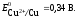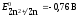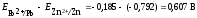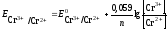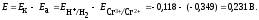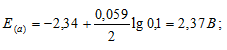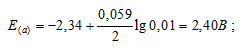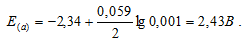Гальванический элемент. Схема гальванического элемента. Токообразующая реакция. Эдс гальванического элемента
Самопроизвольно
идущий окислительно-восстановительный
процесс в определенных условиях может
создавать электрическую энергию.
Процессы превращения химической энергии
в электрическую можно использовать для
создания химических источников тока
(ХИТ), простейший из которых гальванический
элемент.
Гальванический
элемент состоит из двух электродов,
погруженных в электролиты, которые
замыкаются электролитическим ключом.
КЛАССИФИКАЦИЯ ЭЛЕКТРОДОВ
Металлический
электрод — это металл, погруженный в
раствор собственной соли, не является
инертным, а участвует в электродной
реакции. Cхематично
такой электрод записывают в виде Ме|Меn+,
где вертикальная черта обозначает
границу между металлом и раствором.
Уравнение
Нернста для металлических электродов
имеет вид
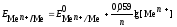
где

моль/л.
Окислительно-восстановительный
(редокс-)
электрод – это инертный металл
(токоподвод), погруженный в электролит,
содержащий одновременно окисленную и
восстановленную формы потенциалопределяющих
частиц. В качестве инертного металла
чаще всего используют платину Pt.
Схематично такой электрод можно записать
в виде Pt│Men+,
Mem+.
На поверхности инертного металла
протекает окислительно-восстановительная
реакция. Например, для
окислительно-восстановительного
электрода Pt│Sn4+,
Sn2+
такими
реакциями могут быть: Sn2+
— 2 ē
→ Sn4+;
Sn4+
+ 2 ē
→ Sn2+
Уравнение Нернста
для редокс- систем включает концентрацию
обоих катионов и имеет вид

где [окисл], [восст]
– концентрации окисленной и восстановленной
форм потенциалопределяющих частиц в
полуреакции.
19
Газовые
электроды состоят из инертного металла,
который находится в одновременном
контакте с газом и раствором, содержащим
ионы этого газа. Представителями газовых
электродов являются водородный,
кислородный, хлорный и другие электроды.
Водородный
электрод
состоит из платиновой пластинки, покрытой
слоем мелкодисперсной платины
(«платиновой черни») и погруженной
в раствор кислоты, содержащий ионы
водорода. Через раствор непрерывно
пропускается поток водорода, водород
адсорбируется на поверхности платины,
и на границе электрод/раствор
устанавливается равновесие:
H+(раствор)
+ ē
↔ ½ H2
(г)
.
При давлении
водорода, равном 101,3 кПа (1 атм), активности
(концентрации) ионов водорода 1 моль/л
и Т=298К
водородный электрод называется
стандартным водородным электродом.
Потенциал такого электрода принимается
за ноль.
Уравнение Нернста
для водородного электрода имеет вид

(6)
где

стандартный электродный потенциал,
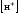
ионов водорода в растворе, моль/л

давление водорода над раствором, атм.
равно 1 атм.
Рассмотрим работу
гальванического элемента на примере
элемента Даниэля-Якоби. Он представляет
собой два сосуда с 1М растворами CuSO4
и ZnSO4,
в которые погружены соответственно
медная и цинковая пластинки, соединенные
проводом. Сосуды соединены между собой
трубкой, которая называется солевым
мостиком, заполненной раствором
электролита (например, KCl). Солевой мостик
является электролитическим ключом.
Электрод с меньшим
значением потенциала заряжается
отрицательно, является анодом. Электрод
с большим значением потенциала заряжается
положительно, является катодом. На
аноде протекает процесс окисления
(отдача электронов),
на катоде – процесс восстановления
(присоединение электронов).
20
Гальванические
элементы принято записывать в виде
схем. Анод со знаком (-) записывают слева,
катод со знаком (+) записывают справа.
Например, схема медно-цинкового
гальванического элемента Даниэля-Якоби
может быть представлена таким образом:
ē
ē
(-) Zn|ZnSO4||CuSO4|Cu
(+) или (-) Zn|Zn2+||Cu2+|Cu
(+)
Одна вертикальная
черта на схеме обозначает границу между
металлом и раствором электролита, две
черты – границу между растворами
(солевой мостик).
При замыкании цепи
электроны по внешней цепи пойдут от
анода к катоду – от цинка к меди. При
этом на электродах протекают следующие
реакции:
(-) Анод: Zn
– 2
ē → Zn2+
реакция окисления
(+) Катод: Cu2+
+ 2
ē →Cu
реакция восстановления
Суммируя процессы
на катоде и аноде, получаем уравнение
окислительно-восстановительной реакции,
за счет которой в гальваническом элементе
возникает электрический ток:
Zn
+ Cu2+
= Zn2+
+ Cu
Такое уравнение
называется уравнением токообразующей
реакции.
ЭДС гальванического
элемента рассчитывают как разность
потенциалов катода и анода: Е
= Ек
– Еа.
Если концентрация
ионов в растворе составляет 1 моль/л,
то ЭДС называется стандартной. Стандартная
ЭДС медно-цинкового элемента при
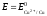
Пример
7. Рассчитайте
ЭДС свинцово-цинкового гальванического
элемента при
Т = 298К, в
котором [Zn2+]=0,1моль/л
и [Pb2+]=0,01моль/л.
Укажите знаки полюсов, напишите уравнения
электродных процессов, составьте схему
гальванического элемента. Укажите
направление движения электронов при
замыкании цепи.
Решение:
ЭДС гальванического элемента
рассчитывают как разность
21
равновесных
потенциалов катода и анода: Е=
Ек
– Еа.
Поскольку
концентрации потенциалопределяющих
ионов отличаются от 1 моль/л, рассчитаем
по уравнению Нернста (ур. 4) значения
электродных потенциалов цинка и свинца:
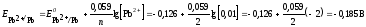
с меньшим значением потенциала является
анодом (цинковый электрод). На нем
протекает реакция окисления:
(-) А: Zn
– 2
ē → Zn2+
Электрод с большим
значением потенциала является катодом
(свинцовый электрод), на нем протекает
реакция восстановления:
(+) К: Pb2+
+ 2
ē → Pb
Уравнение
токообразующей реакции: Zn
+ Pb2+
→ Zn2+
+ Pb.
Схема гальванического
элемента: (-) Zn│Zn2+(0,1M)║Pb2+(0,01M)│Pb
(+).
Рассчитываем ЭДС
гальванического элемента:
Е=
Ек
– Еа
=
При замыкании
цепи, электроны во внешней цепи пойдут
от отрицательно заряженного электрода
к положительно заряженному электроду,
то есть — от цинка к свинцу.
Пример
8. Для
гальванического элемента
Pt│Cr3+
(0,1 моль/л),
Cr2+(0,01
моль/л)║Н+(рН=2)│Н2,
Pt
рассчитать
ЭДС, написать уравнения электродных
процессов, составить уравнение
токообразующей реакции, указать знаки
полюсов. Определить направление движения
электронов во внешней цепи.
Решение:
данный гальванический элемент составлен
из окислительно-
восстановительного
и водородного электродов.
Потенциал
окислительно-восстановительного
электрода рассчитываем по уравнению
Нернста:
22
Стандартный
потенциал пары Сr3+/Cr2+

Подставив данные условия задачи,
рассчитаем потенциал
окислительно-восстановительного
электрода:
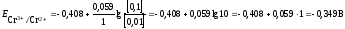
Второй электрод
данного гальванического элемента
является водородным электродом. Потенциал
его, согласно уравнению Нернста:
Определяем
катод и анод. Поскольку
окислительно-восстановительный электрод
имеет меньший потенциал, то в гальваническом
элементе он будет играть роль анода
(отрицательный полюс), а водородный
электрод – катода (положительный полюс).
После замыкания цепи на первом электроде
будет протекать анодный процесс
окисления, на втором – катодный процесс
восстановления:
(-) А : Cr2+
— ē
→ Cr3+
2
(+) К: 2 Н+
+ 2
ē → Н2
Суммарная
токообразующая реакция описывается
уравнением
2 Cr2+
+ 2 Н+
→ 2 Cr3+
+ Н2
Электроны при
замыкании внешней цепи будут двигаться
от отрицательного полюса к положительному:
от хромового окислительно-восстановительного
электрода к водородному.
ЭДС
данного элемента
Пример
9. Какие
процессы протекают на электродах в
концентрационном гальваническом
элементе, имеющем цинковые электроды,
если у одного из электродов концентрация
ионов цинка Zn2+
равна 1 моль/л, а у другого –
0,0001
моль/л? Какова ЭДС этого элемента?
Напишите схему данного ГЭ.
Решение:
Концентрационный гальванический элемент
состоит из одинаковых электродов,
погруженных в растворы своих солей
различной концентрации. Определим
потенциалы обоих электродов. Так как
концентрация ионов цинка
23
у первого электрода
равна 1 моль/л, то потенциал его будет
равен стандартному потенциалу цинкового
электрода:
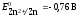
Потенциал второго
электрода рассчитаем по уравнению
Нернста:
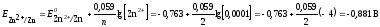
является катодом, на нем после замыкания
цепи протекает реакция восстановления
(+) К: Zn2+
+ 2
ē →Zn
Второй
электрод, имеющий меньший потенциал,
будет анодом, на нем протекает реакция
окисления: (-) А: Zn
— 2
ē →Zn2+
Токообразующая
реакция в гальваническом элементе будет
иметь вид:
Zn
+ Zn2+→
Zn
+ Zn2+
Рассчитываем ЭДС
элемента: Е
= Ек
— Еа
= — 0,763 –(-0,881) = 0,122 В.
Данный
гальванический элемент можно отобразить
схемой:
(-) Zn│Zn2+(0,0001
моль/л)║Zn2+(1
моль/л)│Zn
(+)
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Составление уравнений электродных процессов и суммарной реакции, происходящей при работе гальванического элемента
Задача 652.
Гальванический элемент состоит из серебряного электрода, погруженного в 1 М раствор AgNO3, и стандартного водородного электрода. Написать уравнения электродных процессов и суммарной реакции, происходящей при работе элемента. Чему равна его э.д.с.?
Решение: 


H20 — 2 
Серебро, потенциал которой +0,80 В, — катод, т.е. электрод, на котором протекает восстановительный процесс:
Ag + + 2 
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного и катодного процессов, получим
H20 + 2Ag + = 2H + + 2Ag 0
Для определения ЭДС гальванического элемента необходимо из потенциала катода вычесть потенциал анода, т.е. при вычислении ЭДС элемента меньший электродный потенциал вычитается из большего (в алгебраическом смысле), получим:


Ответ: +0,80В.
Задача 653.
Э. д. с. гальванического элемента, состоящего из стандартного водородного электрода и свинцового электрода, погруженного в 1 М раствор соли свинца, равна 126 мВ. При замыкании элемента электроны во внешней цепи перемещаются от свинцового к водородному электроду. Чему равен потенциал свинцового электрода? Составить схему элемента. Какие процессы протекают на его электродах?
Решение: 
Pb 0 — 2 
А на водородном – восстановительный:
2H + + 2 
Таким образом, свинцовый электрод будет анодом, а водородный – катодом.
Уравнение окислительно-восстановительного процесса, протекающего при работе данного гальванического элемента, можно получить, сложив электронные процессы на электродах:
Pb 0 + 2H + = Pb 2+ + H2 0
Для расчета электродного потенциала свинца, можно использовать уравнение определения ЭДС гальванического элемента:
E = 

Подставив в уравнение данные задачи, получим:
Е = 



Ответ: -0,126В.
Задача 654.
Рассчитать электродные потенциалы магния в растворе его соли при концентрациях иона Mg 2+ 0,1, 0,01 и 0,001 молы/л.
Решение:
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
Е 0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация (при точных измерениях активность) гидратированных ионов металла в растворе. Е 0 для магния равен -2,34 В.
Определим электродные потенциалы магния в растворах при разных значениях концентрации его ионов:
а) Mg 2+ = 0,1 молы/л.
б) Mg 2+ = 0,01 молы/л.
в) Mg 2+ = 0,001 молы/л.
Ответ: а) 2,37 В; б) 2,40 В; в) 2,43 В.
Задачи к разделу Электродные процессы, Гальванический элемент
В настоящем разделе представлены типовые задачи на гальванические элементы: Определение ЭДС гальванического элемента, составление схемы гальванического элемента, определение энергии химической реакции в кДж.
Задача 1. Вычислите значение э.д.с. гальванического элемента:
(-) Mg / MgSO4 // CuSO4 / Cu (+)
Напишите процессы на аноде и катоде, реакцию, генерирующую ток, и определите в кДж энергию химической реакции, превращающуюся в электрическую.
Решение.
Дана схема гальванического элемента, из которой видно, что анодом является магний, а катодом — медь
(-) Mg / MgSO4 // CuSO4 / Cu (+)
А: Mg 0 -2e — = Mg 2+
К : Cu 2+ +2e — = Cu
Mg 0 + Cu 2+ = Mg 2+ + Cu
Вычислим ЭДС гальванического элемента:
ЭДС =0,337 + 2,37 = 2,71 В
ΔG 0 298 = -nFE = -2∙96500∙2,71 = — 523030 Дж = — 523 кДж
Задача 2. Рассчитайте ЭДС гальванического элемента, составленного из стандартного водородного электрода и свинцового электрода, погруженного в 0,01 М раствор PbCl2. На каком электроде идёт процесс окисления, а на каком — восстановление?
Решение.
В данной паре потенциал свинца имеет более отрицательное значение, поэтому анодом является свинец:
А: Pb 0 -2e — = Pb 2+
К: 2 H + +2 e — = H 2
Pb 0 + 2H + = Pb 2+ + H2
Определим электродный потенциал свинца:
E = -0,126 + (0,059/2)∙lg0,01 = -0,185 В
Вычислим ЭДС гальванического элемента:
ЭДС = 0 + 0,185 = 0,185 В
Задача 3. По уравнению токообразующей реакции составьте схему гальванического элемента:
Ni + СuSO4 = NiSO4 + Cu Напишите уравнения анодного и катодного процессов. Рассчитайте стандартную ЭДС.
Решение.
Пользуясь таблицей стандартных электродных потенциалов, найдем E 0 Ni2+/Ni и E 0 Cu2+/Cu
В данной паре потенциал никеля имеет более отрицательное значение, поэтому анодом является никель:
А: Ni 0 -2e — = Ni 2+
К: Cu 2+ +2 e — = Cu 0
Ni 0 + Cu 2+ = Ni 2+ + Cu 0
Ni 0 + CuSO4 = NiSO4 + Cu 0
Составим схему гальванического элемента:
(-) Ni 0 |NiSO4 || CuSO4|Cu 0 (+)
Рассчитаем стандартную ЭДС реакции:
ЭДС = 0,337 – (- 0,250) = 0,587 В
Задача 4. Составьте схему гальванического элемента из магния и свинца, погруженных в растворы их солей с концентрацией ионов:
[Mg 2+ ] = 0,001 моль/л, [Pb 2+ ] = 1 моль/л. Напишите уравнения реакций, протекающих на катоде и аноде. Рассчитайте стандартную ЭДС этого элемента.
Решение.
Пользуясь таблицей стандартных электродных потенциалов, найдем E 0 Mg2+/Mg и E 0 Pb2+/Pb
В данной паре потенциал магния имеет более отрицательное значение и является анодом:
А: Mg 0 -2e — = Mg 2+
К: Pb 2+ +2 e — = Pb 0
Mg 0 + Pb 2+ = Mg 2+ + Pb 0
Составим схему гальванического элемента:
(-) Mg 0 |Mg 2+ || Pb 2+ |Pb 0 (+)
Применяя уравнение Нернста, найдем EPb2+/Pb и EMg2+/Mg заданной концентрации:
Рассчитаем стандартную ЭДС реакции
ЭДС = -0,126 – (-2,46) = 2,334 В
Задача 5. Как изменится (увеличится, уменьшится) или останется постоянной масса пластины из кобальта, погруженной в раствор, содержащий соли Fe (II), Mg, Ag (I). Напишите молекулярные уравнения реакций.
Решение.
Пользуясь таблицей стандартных электродных потенциалов, найдем E 0 Mg2+/Mg, E 0 Co2+/Co, E 0 Fe2+/Fe, E 0 Ag+/Ag
Протекание реакции возможно при условии, когда E 0 восст 0 ок.
В нашем случае восстановителем является кобальт и условие E 0 восст 0 ок соблюдается только для пары
Co 0 + Ag + = Co 2+ + Ag 0
Молекулярное уравнение, например:
В процессе пластина из кобальта будет растворяться, но одновременно на ее поверхности будет осаждаться серебро.
Из уравнения реакции видно, что при взаимодействии 1 моль кобальта, образуется 2 моль серебра.
Мольная масса кобальта M(Co) = 59 г/моль, мольная масса серебра M(Ag) = 108 г/моль.
Найдем массы металлов:
n = m/M, m = n∙M
m(Ag) = 2∙108 = 216 г.
Таким образом, масса осажденного серебра больше, чем масса растворенного кобальта, т.е. масса пластины из кобальта увеличится.
В случаях, когда пластина опущена в раствор соли железа или соли магния ее масса не изменится, т.к. кобальт не вытесняет эти металлы из их солей. Т.е. реакции не происходит и масса пластины остается неизменной.
Задача 6. Составьте схему гальванического элемента, уравнения полуреакций анодного и катодного процессов, молекулярное уравнение реакции, проходящей при работе гальванического элемента, анодом которого является никель. Подберите материал для катода. Рассчитайте стандартную ЭДС этого гальванического элемента.
Решение.
По условию задачи материал анода известен – никель. Электродный потенциал анода всегда имеет более отрицательное значение, т.е. анод состоит из более активного металла, чем катод.
Поэтому нам надо подобрать такой металл, значение потенциала которого, будет иметь большее значение, чем значение электродного потенциала никеля. Например, медь:
Составим уравнения полуреакций анодного и катодного процессов и молекулярное уравнение реакции, проходящей при работе гальванического элемента.
А: Ni 0 -2e — = Ni 2+
К: Cu 2+ +2 e — = Cu 0
Ni 0 + Cu 2+ = Ni 2+ + Cu 0
Ni 0 + CuSO4 = NiSO4 + Cu 0
Составим схему гальванического элемента:
(-) Ni 0 |NiSO4 || CuSO4|Cu 0 (+)
Рассчитаем стандартную ЭДС реакции
Написать уравнения электродных процессов и суммарной реакции процесса коррозии.
По таблице 11.1 находим значение стандартных электродных потенциалов железа и цинка:


Так как 
2Zn + 2H2O + O2 = 2Zn(OH)2 – суммарное молекулярное уравнение процесса коррозии.
б) Коррозия в кислой среде (H2SO4)
Составляем схему коррозионного ГЭ:
А (-) Zn │ H + │ Fe (+) K
Составляем уравнения электродных процессов и суммарной реакции процесса коррозии:


На К(+) 2H + + 2ē = H2 1
Zn + 2H + = Zn 2+ + H2 — суммарное ионно-молекулярное уравнение процесса коррозии;
Zn + H2SO4 = ZnSO4 + H2 – суммарное молекулярное уравнение процесса коррозии.
в) Коррозия в кислой среде в присутствии кислорода (HCl+O2).
Составляем схему коррозионного ГЭ:
А (-) Zn │ HCl + O2 │ Fe (+) K
А (-) Zn │ H + + O2 │ Fe (+) K
Составляем уравнения электродных процессов и суммарной реакции процесса коррозии:


На A (-) Zn – 2ē = Zn 2+ 2

2Zn + 4H + + O2 = 2Zn 2+ + 2H2O – суммарное ионно-молекулярное уравнение процесса коррозии
2Zn + 4HCl + O2 = 2ZnCl2 + 2H2O – суммарное молекулярное уравнение процесса коррозии.
Во всех случаях коррозионному разрушению будет подвергаться более активный металл – цинк.
УРОВЕНЬ В
1. Составить схему гальванического элемента (ГЭ), образованного цинковым электродом, погруженным в 1М раствор хлорида цинка, и хромовым электродом, погруженным в 1·10 -3 М раствор хлорида хрома (III). Рассчитать напряжение ГЭ, написать уравнения электродных процессов и суммарной токообразующей реакции.
 |
РЕШЕНИЕ: Для составления схемы ГЭ необхо-димо знать величины электродных потенциалов металлов – цинка и хрома. По таблице 11.1 определяем стан-дартные электродные потенциалы металлов: |
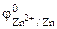
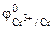
Хлорид цинка диссоциирует по уравнению:

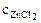

α = 1 (ZnCl2 – сильный электролит), 

Хлорид хрома (III) диссоциирует по уравнению:
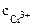
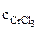
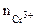
α = 1 (CrCl3 – сильный электролит), 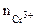
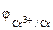
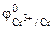
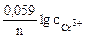

Так как 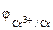
Составляем уравнения электродных процессов и суммарной токообразующей реакции:


На A(-)Cr – 3ē = Cr 3+ 2
На К(+)Zn 2+ + 2ē = Zn 3
2Cr + 3Zn 2+ = 2Cr 3+ + 3Zn — суммарное ионно-молекулярное уравнение токообразующей реакции
2Cr + 3ZnCl2 = 2CrCl3 + 3Zn — суммарное молекулярное уравнение токообразующей реакции.
Рассчитываем напряжение ГЭ:
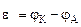


2. Составить схему ГЭ, в котором протекает химическая реакция Fe + Ni 2+ = Fe 2+ + Ni. Написать уравнения электродных процессов. На основании стандартных значений энергий Гиббса образования ионов ∆fG 0 (298К, Me n + ) рассчитать стандартное напряжение ГЭ и константу равновесия реакции при 298К.
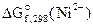



На К(+)Ni 2+ + 2ē = Ni 1 — восстановление
Анодом ГЭ является электрод, на котором происходит процесс окисления. Катодом – электрод, на котором происходит процесс восстановления. Тогда в рассматриваемом ГЭ анодом будет являться железо, катодом – никель.
Составляем схему ГЭ:
А(-) Fe │ Fe 2+ ║ Ni 2+ │ Ni(+)K
Рассчитываем стандартное напряжение ГЭ:
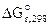
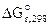

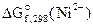
= -84,94-(-64,4) = -20,54 кДж,
ε 0 =
z = 2, F = 96500 Кл/моль.
Рассчитываем константу равновесия токообразующей реакции (Кc).
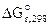
lgKс =
Ответ: ε 0 = 0,106В, Kс = 3981.
3. Составить схему коррозионного ГЭ, возникающего при контакте железной пластинки площадью 20 см 2 с никелевой в растворе соляной кислоты HCl. Написать уравнения электродных процессов и суммарной реакции процесса коррозии.
а) Вычислить объемный и весовой показатели коррозии, если за 40 минут в процессе коррозии выделилось 0,5 см 3 газа (н.у.).
б) Вычислить весовой и глубинный показатели коррозии, если за 120 минут потеря массы железной пластинки составила 3,7∙10 -3 г. Плотность железа равна 7,9 г/см3 .
По таблице 11.1 находим значения стандартных электродных потенциалов железа и никеля:

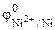
Так как 
Cоставляем уравнения электродных процессов и суммарной реакции процесса коррозии:
На A Fe – 2ē = Fe 2+

Fe + 2H + = Fe 2+ + H2 – суммарное ионно-молекулярное уравнение процесса коррозии.
Fe + 2HCl = FeCl2 + H2 – суммарное молекулярное уравнение процесса коррозии.
Из уравнения суммарной реакции процесса коррозии следует, что при коррозии выделяется водород.
Следовательно, V(газа) = 
Тогда, KV = 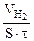
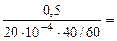
10 -4 – коэффициент пересчета, см 2 в м 2 .
Рассчитываем весовой показатель коррозии Km по формуле:
Km = 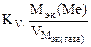
В процессе коррозии разрушению подвергается железо и выделяется водород.
Мэк(Ме) = Мэк(Fe) = 
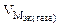

Km = 
Ответ: KV = 375 см 3 /м 2 ∙час, Km = 0,94 г/м 2 ∙час.
При расчете Km принимаем: 
Тогда: Km = 


Рассчитываем глубинный показатель коррозии по формуле:
П = 

Ответ: Km = 0,925 г/м 2 ∙час, П = 1,03 мм/год.
ЭЛЕКТРОЛИЗ РАСТВОРОВ
Таблица 11.1. Процессы протекающие на катоде при электролизе водных растворов
 В В |
Катио-ны в вод- ном рас- творе | Зоны | Процессы на катоде |
| -3,02 -2,99 -2,93 -2,92 -2,90 -2,89 -2,87 -2,71 -2,34 -1,67 | Li + , Rb + , Cs + K + , Ba 2+ , Sr 2+ , Ca 2+ , Na + , Mg 2+ , Al 3+ | I | Катионы этих металлов на катоде не восстанавли-ваются, а концентри-руются в околокатодном пространстве (католите). На катоде восстанавливаются только молекулы воды: 2Н2О + 2ē = 2ОН — + Н2 |
| -1,05 -0,76 -0,74 -0,44 -0,40 -0,28 -0,26 -0,14 -0,13 | Mn 2+ , Zn 2+ , Cr 3+ , Fe 2+ , Cd 2+ , Co 2+ , Ni 2+ , Sn 2+ , Pb 2+ | II |  На катоде параллельно протекают два процесса: Ме n + + nē = Me 2Н2О + 2ē = 2ОН — + Н2 На катоде параллельно протекают два процесса: Ме n + + nē = Me 2Н2О + 2ē = 2ОН — + Н2 |
| 0,00 | Н + | При электролизе кислоты 2Н + + 2ē = Н2 | |
| +0,20 +0,23 +0,34 +0,80 +0,83 +0,85 +1,20 | Sb 3+ , Bi 3+ , Cu 2+ , Ag + , Pd 2+ , Hg 2+ , Pt 2+ | III | Восстанавливаются только ионы этих металлов Ме n + + nē = Me |
Таблица 11.2. Последовательность окисления анионов на инертном аноде в водном растворе.
Примечание. Если анод изготовлен из металлов II или III зоны (растворимый анод), то при электролизе протекает только процесс его растворения Мe 0 – nē = Me n +
УРОВЕНЬ А
1. Составить схемы электролиза и написать уравнения электродных процессов водных растворов (анод инертный): а) хлорида меди (II), б) гидроксида натрия.
Какие продукты выделяются на катоде и аноде?
|
Дано: а)CuCl2, б) NaОН. Анод инертный 1. Схема электролиза-? 2. Продукты электролиза-? |
РЕШЕНИЕ а) CuCl2 = Cu 2+ + 2Cl — , Схему электролиза составляем в соответствии с таблицами 11.1 и 11.2: K(-) A(+) инертный Cu 2+ + 2ē = Cu 2Cl — — 2ē = Cl2 H2O H2O |
На катоде выделяется Cu, на аноде выделяется Cl2.
б) NaОН = Na + + ОН —
Na + 4ОН 
На катоде выделяется Н2, на аноде выделяется О2.
2.Составить схемы электролиза и написать уравнения электродных процессов водного раствора сульфата никеля (II) , если: а) анод инертный, б) анод никелевый. Какие продукты выделяются на катоде и аноде?

Дано: NiSO4 а) анод инертный б) анод никелевый 1. Схема электролиза-? 2. Продукты электролиза-? |
РЕШЕНИЕ а) анод – инертный NiSO4 = Ni 2+ +  Схему электролиза составляем в соответствии с таблицами 11.1. и 11.2: Схему электролиза составляем в соответствии с таблицами 11.1. и 11.2: |
На катоде выделяется Ni и H2 , на аноде выделяется О2.
б) анод – никелевый:
NiSO4 = Ni 2+ +

2H2O+2ē = H2+2OH — Ni — 2ē = Ni 2+
На катоде выделяется Ni и H2, на аноде растворяется Ni.
3.При электролизе растворов а) нитрата кальция, б) нитрата серебра на аноде выделяется 560 мл газа (н.у.). Составить схему электролиза и написать уравнения электродных процессов. Определить какое вещество и в каком количестве выделилось на катоде? Анод инертный.
В соответствии со схемой электролиза:
nэк (О2)(анод) = nэк (Н2)(катод) или 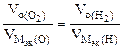


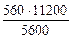
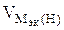
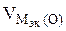
На катоде выделилось 1120 см 3 водорода.
Ответ: 1120 см 3 водорода.
б) AgNO3 = Ag + +
Ag + + ē = Ag
На катоде выделяется Ag, на аноде выделяется О2.
По закону эквивалентов: nэк(Ag)(катод) = nэк(О2)(анод) или 
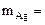


где
На катоде выделилось 10,8 г серебра.
Ответ: 10,8 г серебра.
УРОВЕНЬ В
Составить схему электролиза и написать уравнения электродных процессов водного раствора сульфата калия (анод инертный). Определить какие вещества и в каком количестве выделяются на катоде и аноде, если проводить электролиз в течение четырех часов при силе тока 2А. Температура 298К, давление 99 кПа.


где 
F = 96500 Кл/моль, если τ – cек,
F = 26,8 А∙ч/моль, если τ – час.
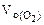

где 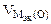

Объем водорода при заданных условиях отличных от нормальных определяем из уравнения:

откуда: 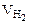

Объем кислорода при заданных условиях:

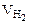
Ответ: 3,73 л водорода, 1,865 л кислорода.
2.Металлическую деталь, площадь поверхности которой равна 100 см 2 , необходимо покрыть слоем электролитически осажденной меди из раствора хлорида меди (II). Составить схему электролиза и написать уравнения электродных процессов, если анод медный. Сколько времени должно длиться осаждение при силе тока 8А и выходе по току 98%, если толщина покрытия 0,15 мм. Плотность меди – 8,9 г/см 3 .
По закону Фарадея с учетом выхода по току (ВТ) масса меди, фактически выделившейся на катоде равна:
mCu(факт) = 
Масса меди, необходимая для получения медного покрытия:
mCu(факт) = S∙h∙ρ (г), где S – см 2 , h – см, ρ – г/см 3 .
S∙h∙ρCu = 
откуда
τ = 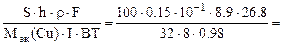
где Mэк(Cu) = 
10 -1 – коэффициент пересчета мм в см.
3.Определить молярную концентрацию эквивалента раствора нитрата серебра, если для выделения всего серебра из 75 см 3 этого раствора потребовалось пропустить ток силой 4А в течение 25 минут. Составить схему электролиза и написать уравнения электродных процессов. Анод инертный. Выход по току серебра 100%.
Молярная концентрация эквивалента раствора AgNO3:

nэк(Ag) = 
где mAg – масса серебра, выделившегося при электролизе с учетом 100 % выхода по току.
mAg = 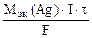

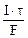
Молярная концентрация эквивалента раствора AgNO3:


где τ – c, F – 96500 Кл/моль, Vр-ра – л.
60 – коэффициент пересчета мин. в сек.
10 -3 – коэффициент пересчета см 3 в л.
Ответ: 
источники:
http://zadachi-po-khimii.ru/obshaya-himiya/zadachi-k-razdelu-elektrodnye-processy-galvanicheskij-element.html
http://lektsii.org/9-43917.html
Катодный и анодный процессы
Написать катодный и анодный процессы, уравнение токообразующей реакции и вычислить ЭДС гальванического элемента. Указать полярность электродов.
Pt| Sn+4 (0,1 моль/л ), Sn+2 (0,1 моль/л ) || Hg+2 (1 моль/л )|Hg
Решение задачи
Гальванический элемент (ГЭ) – это устройство, в котором энергия химической реакции превращается в электрическую. В основе работы гальванического элемента лежит ОВР.
Pt| Sn+4, Sn+2 || Hg+2 |Hg
СSn4+= 0,1 моль/л, СSn2+= 0,1 моль/л, СHg2+= 1 моль/л.
Редокс-электрод представляет собой раствор, состоящий из смеси солей Sn2+ и Sn4+, в который погружен платиновый электрод (инертный электрод). На поверхности электрода устанавливается равновесие Sn4+ + 2e = Sn2+, которое определяет потенциал электрода (в стандартных условиях 0,15 В). Окислительно-восстановительный процесс протекает в растворе и не связан с выделением или растворением простых веществ.
Пользуясь уравнением Нернста, вычисляем значения электродных потенциалов в растворах заданной концентрации:
E (Sn4+, Sn2+/ Pt) < E (Hg2+/Hg0), следовательно, более активный электрод (Sn4+, Sn2+/ Pt), он будет отрицательным электродом – анодом, а ртуть – катодом. Катодный и анодный процессы
Таким образом, (Sn4+, Sn2+/ Pt) – анод (А) и (Sn4+, Sn2+/ Pt), Hg – катод (K).
(-) Pt| Sn+4, Sn+2 || Hg+2 |Hg (+)
Электроны двигаются от анода к катоду (Hg). Катодный и анодный процессы
Запишем электронные уравнения процессов, протекающих на электродах, и составим суммарное уравнение токообразующей реакции. Катодный и анодный процессы
(-) (А) Sn2+ — 2e = Sn4+ процесс окисления;
(+)(K) Hg2+ + 2e = Hg0— процесс восстановления.
Sn2+ + Hg2+ = Sn4+ + Hg0
Рассчитываем ЭДС гальванического элемента:
Ответ:
ЭДС гальванического элемента 0,7 Вольт.
Похожие задачи
Предложите, как улучшить StudyLib
(Для жалоб на нарушения авторских прав, используйте
другую форму
)
Ваш е-мэйл
Заполните, если хотите получить ответ
Оцените наш проект
1
2
3
4
5






Чтобы получить решение, напишите мне в WhatsApp, оплатите, и я Вам вышлю файлы.
Кстати, если эта работа не по вашей теме или не по вашим данным, не расстраивайтесь, напишите мне в WhatsApp и закажите у меня новую работу, я смогу выполнить её в срок 1-3 дня!
Описание и исходные данные задания, 50% решения + фотография:
Составьте электрохимическую схему ГЭ, в котором происходит суммарная токообразующая реакция
Zn+ NiSO4 = ZnSO4 + Ni
Напишите уравнения электродных процессов. Вычислите значение ЭДС ГЭ
Решение:
В соответствии с уравнением реакции схему гальванического элемента можно представить следующим образом: (–)Zn½Zn2+||Ni2+½Ni(+). Уравнения электродных реакций имеют вид:
на аноде: Zn0 – 2ē ® Zn2+
- Имеется ГЭ, состоящий из следующих компонентов: платина (Pt), водород, раствор серной кислоты м рН=5, раствор сульфата марганца II с молярной концентрацией С(MnSO4), равной 0,01М, марганец.
- Напишите уравнения электродных процессов при электролизе водного раствора нитрата кадмия II Cd(NO3)2 (графитовые электроды)
- Составить генетический ряд для элементов (6 баллов). Для перехода «элемент → оксид» напишите уравнения окисления, восстановления; укажите окислитель, восстановитель. Углерод
- При взаимодействии магния массой 1,2 г с раствором серной кислоты получили соль массой 5, 5 г. Определите выход продукта реакции (%). Дано: m(Mg)= 1,2 г m(соли)= 5,5 г Найти: α -?