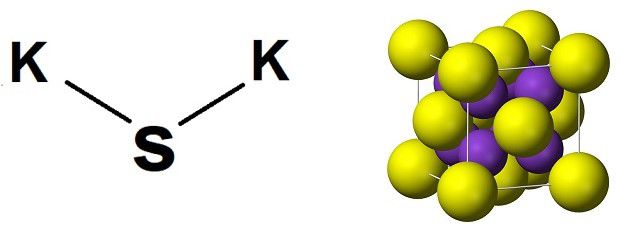
Физические свойства
Сульфид калия K2S — белое вещество, плавится без разложения. Термически устойчивый. Хорошо растворяется в воде.
Относительная молекулярная масса Mr = 110,26; относительная плотность для тв. и ж. состояния d = 1,74; tпл = 912º C.
Способ получения
1. Сульфид калия можно получить путем взаимодействия калия и серы при температуре 100 — 200º C:
2K + S = K2S
2. При взаимодействии с углеродом (коксом) сульфат калия при температуре 900º C образует сульфид калия и угарный газ:
K2SO4 + 4C = K2S + 4CO
3. При температуре 600º C в присутствии оксида железа (III) сульфат калия реагирует с водородом. Взаимодействие сульфата калия с водородом приводит к образованию сульфида калия и воды:
K2SO4 + 4H2 = K2S + 4H2O
Качественная реакция
Качественная реакция на сульфид калия — взаимодействие его с хлоридом меди, в результате реакции происходит образование черного осадка:
1. При взаимодействии с хлоридом меди, сульфид калия образует осадок сульфид меди и хлорид калия:
CuCl2 + K2S = CuS↓ + 2KCl
Химические свойства
1. Сульфид калия может реагировать с простыми веществами:
Твердый сульфид калия реагирует с кислородом при температуре выше 500º C. При этом образуется сульфат калия:
K2S + 2O2 = K2SO4
2. Сульфид калия вступает в реакцию со многими сложными веществами:
2.1. Сульфид калия способен реагировать со многими кислотами:
2.1.1. Сульфид калия реагирует с разбавленной хлороводородной кислотой. Взаимодействие сульфида калия с хлороводородной кислотой приводит к образованию хлорида калия и газа сероводорода:
K2S + 2HCl = 2KCl + H2S↑
2.1.2. Сульфид калия взаимодействует с концентрированной серной кислотой. При этом образуются гидросульфат калия, газ оксид серы, осадок сера и вода:
K2S + 3H2SO4 = 2KHSO4 + SO2↑ + S↓ + H2O
2.1.3. При взаимодействии сульфида калия с концентрированной азотной кислотой выделяются нитрат калия, газ оксид азота, сера и вода:
K2S + 4HNO3 = 2KNO3 + 2NO2↑ +S↓ + H2O
2.1.4. Взаимодействуя с насыщенной сероводородной кислотой холодный сульфид калия образует гидросульфид калия:
K2S + H2S = 2KHS
| Сульфид калия | |
|---|---|
 |
|
| Систематическое наименование |
калия сульфид |
| Традиционные названия | калий сернистый, сульфид калия, калия моносульфид |
| Хим. формула | K2S |
| Состояние | бесцветный порошок с запахом тухлых яиц |
| Молярная масса | 110,262 г/моль |
| Плотность | 1,805 г/см³ |
| Температура | |
| • плавления | 471; 948 °C |
| Мол. теплоёмк. | 76,15 Дж/(моль·К) |
| Энтальпия | |
| • образования | −387,3 кДж/моль |
| Растворимость | |
| • в воде | растворяется с образованием KSH, KOH |
| • в остальных веществах | растворяется в этаноле и глицерине |
| Кристаллическая структура | кубическая сингония |
| Рег. номер CAS | 1312-73-8 |
| PubChem | 14800 |
| Рег. номер EINECS | 215-197-0 |
| SMILES |
[SH-].[K+].[K+] |
| InChI |
1S/2K.H2S/h;;1H2/q2*+1;/p-1 FANSKVBLGRZAQA-UHFFFAOYSA-M |
| RTECS | TT6000000 |
| ChemSpider | 14116 |
| Пиктограммы ECB | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Калия сульфид — бинарное неорганическое химическое соединение калия с серой. Представляет собой соединение с формулой K2S.
Содержание
- 1 Физические свойства
- 2 Получение
- 3 Химические свойства
- 4 Применение
- 4.1 В пиротехническом деле
Физические свойства
Сульфид калия K2S — бесцветные кубические кристаллы (a = 0,739 нм, Z=4; пространственная группа Fm3m). Хорошо растворимы в воде (с гидролизом). Растворим в спирте и глицерине. Гигроскопичен, образует ди- и пентагидраты.
Получение
Прямой синтез из элементов:
- 2K + S →100−200oC K2S
Восстановление сульфата калия водородом:
- K2SO4 + 4H2 →600oC,Fe2O3 K2S + 4H2O
или углеродом (в промышленности — кокс):
- K2SO4 + 4C →900oC K2S + 4CO
Сульфит калия при нагревании диспропорционирует:
- 4K2SO3 →600oC K2S + 3K2SO4
Химические свойства
На воздухе медленно окисляется:
- 2K2S + 2O2 + H2O ⟶ K2S2O3 + 2KOH
в зависимости от условий проведения этой реакции образуются побочные продукты: коллоидная сера, полисульфиды калия.
Сульфид калия при поджигании сгорает:
- 2K2S + 2O2 →>500oC K2SO4
Так как сероводород является слабой кислотой, то сульфид калия разлагается кислотами:
- K2S + 2HCl ⟶ 2KCl + H2S↑
Концентрированные кислоты могут окислять выделяемый сероводород:
- K2S + 3H2SO4 ⟶ 2KHSO4 + SO2↑ + S↓ + 2H2O
При кипячении раствора сульфида калия с серой или сплавления его с серой образуются полисульфиды:
- K2S + (n − 1)S → K2Sn
для калия выделены полисульфиды вплоть до n = 6.
При пропускании через раствор сульфида калия избытка сероводорода образуются гидросульфид калия:
- K2S + H2S ⟶ 2KHS
Реагирует, образовывая соединения с сульфидами Ag, Sn и другими.
Применение
Калия сульфид компонент светочувствительных эмульсий в фотографии, аналитический реагент для разделения сульфидов металлов, является компонентом входящим в состав для удаления наружного слоя шкур.
В пиротехническом деле
Сульфид калия образуется при сжигании пороха.
Сульфид калия – это неорганическое соединение сложного состава, состоящее из атомов калия и серы. Это бескислородная соль, которая применяется в основном в фотографии, кожевенном деле, пиротехнике, а также в химии. В органике и неорганике сульфид калия – предшественник важных веществ и ценный реагент, без которого невозможно разделение сульфидов металлов. Из-за высокой химической активности калиевый сульфид токсичен, поэтому при работе с ним требуется соблюдать осторожность.
Содержание
- Что такое сульфид калия, формула
- Физические свойства, внешний вид
- Химические свойства, реакции
- Производство и получение
- Применение
- Применение калия сульфида в химии и фотографии
- Применение калия сульфида в кожевенном производстве и других сферах
- Где купить и сколько стоит
- Перевозка, хранение, класс опасности
- Заключение
Что такое сульфид калия, формула
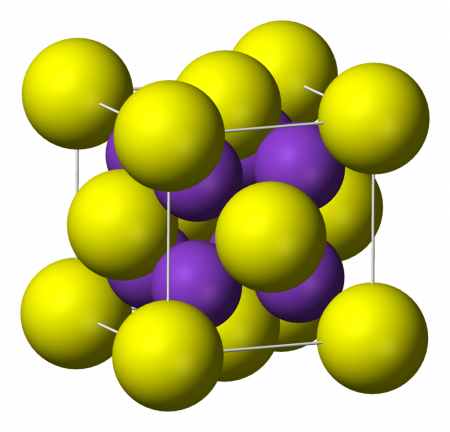
Сульфид калия представляет собой соль, в которой отсутствует кислород, а два атома калия связаны с серой. Химическая формула – K2S, молекула имеет особую форму куба, в которой углы занимает отрицательно заряженная сера (анион), а в центре располагаются положительно заряженные калии (катионы). Это так называемая антифлюоритовая структура – противоположность пространственной организации флюорита, в которой углы составляют катионы, а внутренние позиции – анионы.
Физические свойства, внешний вид
Сульфид калия — это мелкодисперсные кубические кристаллы, не имеющие цвета и вкуса, запах неприятный, напоминающий тухлые яйца (это связано с выделением при достаточной влажности сероводорода). Загрязнённый или технический реагент может иметь жёлто-коричневую окраску. Плотность невысокая и составляет 1,805 г/см3.
Гигроскопичен, быстро впитывает влагу и образует кристаллогидраты: дигидрат – K2S ∙ 2H2O, петагидрат – K2S ∙ 5H2O. Сульфид калия хорошо растворяется в воде, подвергается гидролизу. Растворим в органических растворителях, таких как спирт (метанол, этанол), эфиры, фенолы, глицерин. Раствор сульфида калия даёт щелочную среду (pH более 7).
Химические свойства, реакции
Раствор сульфида калия обладает повышенной реакционной способностью. Так, сульфид калия реагирует с кислородом, отдавая электроны. Результат может быть разным, в том числе выделение сульфата при сгорании (температура порядка 500 °С):
K2S + 2O2 → K2SO4
При медленном окислении возможен иной исход, тогда продуктом реакции выступает полисульфид и гидроксид калия:
K2S + O2 → K2S2O3 + KOH
Сульфид калия реагирует с кислотами. Так, он даёт хлорид калия и сернистый водород при взаимодействии с соляной кислотой:
K2S + 2HCl → 2KCl + H2S↑
Раствор сульфида калия реагирует с концентрированной серной кислотой, образуя коллоидную серу, кислую соль гидроксульфат калия и сернистый ангидрид:
K2S + 3H2SO4 → 2KHSO4 + SO2↑ + S↓ + 2H2O
Расплав сульфида калия подвергается электролизу при прохождении электрического тока. При этом он распадается на составные элементы:
K2S → 2K + S
Раствор сульфида калия пропускает электричество, при этом происходит образование едкого калия:
K2S → S↓ + 2KOH + H2↑
Сульфид калия реагирует с водой, при этом он разлагается, образуя новые соединения. Гидролиз вещества протекает по аниону, поскольку в образуемых им ионах присутствуют частицы слабой кислоты. Реакция обратима и приводит к выделению большого количества гидроксид-анионов, защелачивающих раствор:
K2S + H2O → KHS + K+ + OH–
Реагент подвержен реакции ионного обмена с сульфатом алюминия, которая сопровождается необратимым разложением:
3K2S + Al(SO4)2 + 6H2O → 2Al(OH)3↓ + 3H2S↑ + 3K2SO4
Раствор сульфида калия реагирует с серой в разной концентрации, в итоге образуются полсульфиды с переменной n, где n – любое натуральное число от 2 и выше:
K2S + (n-1)S → K2Sn
Производство и получение
Кристаллы сульфида калия
В лабораторных условиях проводят прямой синтез сульфида калия при 100-200 °С:
2K + S → K2S
В промышленности используют реакцию восстановления углеродом (каменноуглеродный кокс) при 900 °С:
K2SO4 + 4С → K2S + 4CO
Для восстановительной реакции можно брать водород. Взаимодействие протекает при участии катализатора (Fe2O3) и нагреве до 600 °С:
K2SO4 + 4H2 → K2S↓ + 4H2O
В качестве сырья на некоторых производствах предпочтение отдают сульфиту калия, т.к. он подвержен термолизу при 600 °С:
4K2SO3 + K2S + 3K2SO4
Промышленное получение ведётся в несколько этапов:
- Сернокислый калий предварительно высушивают, затем смешивают с жжённой магнезией (MgO) в определённых пропорциях.
- Смесь поступает специализируемую вращающуюся печь, которая разогревается до 950 °С.
- Внутрь подаётся водород, окись углерода. Образующиеся газы проходят через теплообменник, отдают тепло, охлаждаются, и отправляются на выхлоп.
- Образовавшийся в растворе осадок выщелачивают, оксид магния отфильтровывают, высушивают и переводят на повторное использование.
- Сульфид калия попадает в кристаллизатор, где перекристаллизовывается до необходимой чистоты, после подсушивается и расфасовывается в упаковочные ёмкости.
Применение
Основная сфера применения сульфида калия – химия. Он играет большую роль в реакциях синтеза многих значимых для хроматографии и металлургии веществ. Сульфид калия необходим для получения качественных кожматериалов, применение калия сульфида для удаления волос с натуральной кожи обусловлено его относительной дешевизной и доступностью. Реактив вносят в состав фотоэмульсий, пиротехнику, его используют для добычи пестицидов и дифференциации металлов.
Применение калия сульфида в химии и фотографии
Сульфид калия — это ценный реактив, который используется для синтеза сульфатов и промежуточных соединений, среди которых:
- полисульфиды, необходимые для выпуска каучуков, воронения стали, борьбы с насекомыми-вредителями;
- сернистый калий;
- каустический поташ;
- диоксид серы.
Вещество применяют для разделения и анализа сульфатов. В фотографических светоэмульсиях сульфид калия – компонент для сенсибилизации фотоматериалов – увеличения светочувствительности.
Применение калия сульфида в кожевенном производстве и других сферах
Сульфид калия способствует очищению натуральной кожи от мелких волосков, обеспечивает её прочность и долговечность, закрепление окраски, предотвращает выцветания и обветшание с течением времени. Наряду с другими средствами его включат в первичную обработку для улучшения товарного вида и внешних качеств.
Сульфид калия применяют в фейерверках для усиления яркости огня. Применение соединения отмечается в традиционных японских бенгальских огнях под названием «сенко ханаби».
Где купить и сколько стоит
Сульфид калия продаётся заводами-производителями, в интернет-магазинах. Оптовая стоимость от 75 рублей за 1 кг. Розничная цена 100 грамм – 125-170 рублей.
Перевозка, хранение, класс опасности
Сульфид калия относится к 2 классу (выскоопасные отходы), способен разъедать слизистые оболочки, оставлять глубокие ожоги. Химикат следует хранить в оригинальной герметично закрытой упаковки вдали от источников влаги при относительной влажности воздуха не более 50%. Транспортировка осуществляется всеми видами крытого транспорта, за исключением самолётов.
Заключение
Сульфид калия – это соединение, востребованное в аналитике и химической промышленности. Его высокая реактивность обусловила применение в качестве реагента для добычи различных веществ, пиротехническое и фотографическое использование. Он является компонентом составов для обработки кожевенных изделий.
Читайте также:
- Сульфид натрия: описание, реакции, получение, применение
- Оксид азота: свойства, применение, реакции
- Угольная кислота: описание, свойства и реакции, применение
- Сульфат алюминия: свойства, применение
Сайт предоставляет информацию в справочных целях, только для ознакомления. Поставить диагноз и назначить адекватное лечение может только врач! Медикаменты и народные средства должны назначаться специалистом, так как имеют противопоказания и побочные действия! Посещение и консультации квалифицированного специалиста строго обязательны!
Загрузка…
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Сульфид калия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 31 октября 2010;
проверки требуют 12 правок.
Перейти к: навигация,
поиск
| Сульфид калия | |
 |
|
| Общие | |
|---|---|
| Систематическое наименование | калия сульфид |
| Традиционные названия | калий сернистый, сульфид калия, калия моносульфид |
| Химическая формула | K2S |
| Физические свойства | |
| Состояние (ст. усл.) | бесцветный порошок с запахом тухлых яиц |
| Молярная масса | 110.262 г/моль |
| Плотность | 1.8 г/см³ |
| Термические свойства | |
| Температура плавления | 948 °C |
| Молярная теплоёмкость (ст. усл.) | 76,15 Дж/(моль·К) |
| Энтальпия образования (ст. усл.) | −387,3 кДж/моль |
| Химические свойства | |
| Растворимость в воде | растворяется с образованием KSH, KOH г/100 мл |
| Растворимость в остальных веществах | растворяется в этаноле и глицерине г/100 мл |
| Структура | |
| Кристаллическая структура | кубическая сингония |
| Классификация | |
| Рег. номер CAS | 1312-73-8 |
| RTECS | TT6000000 |
| Безопасность | |
| Токсичность |
1 3 0 |
Калия сульфид — бинарное неорганическое химическое соединение калия с серой. Представляет собой соединение с формулой K2S.
Содержание
- 1 Физические свойства
- 2 Получение
- 3 Химические свойства
- 4 Применение
- 4.1 В пиротехническом деле
[править] Физические свойства
Сульфид калия K2S — бесцветные кубические кристаллы (a = 0,739 нм, Z=4; пространственная группа Fm3m). Хорошо растворимы в воде (с гидролизом). Растворим в спирте и глицерине. Гигроскопичен, образует ди- и пентагидраты.
[править] Получение
Прямой синтез из элементов:
Восстановление сульфата калия водородом:
или углеродом (в промышленности — кокс):
Сульфит калия при нагревании диспропорционирует:
[править] Химические свойства
На воздухе медленно окисляется:
в зависимости от условий проведения этой реакции образуются побочные продукты: коллоидная сера, полисульфиды калия.
Сульфид калия при поджигании сгорает:
Так как сероводород является слабой кислотой, то сульфид калия разлагается кислотами:
Концентрированные кислоты могут окислять выделяемый сероводород:
При кипячении раствора сульфида калия с серой или сплавления его с серой образуются полисульфиды:
для калия выделены полисульфиды вплоть до n = 6.
При пропускании через раствор сульфида калия избытка сероводорода образуются гидросульфид калия:
Реагирует, образовывая соединения с сульфидами Ag, Sn и другими.
[править] Применение
Калия сульфид компонент светочувствительных эмульсий в фотографии, аналитический реагент для разделения сульфидов металлов, является компонентом входящим в состав для удаления наружного слоя шкур.
[править] В пиротехническом деле
Сульфид калия образуются при сжигании пороха; является важным промежуточным веществом во многих пиротехнических эффектах.