МИНИСТЕРСТВО ГЕОЛОГИИ СССР
ВСЕСОЮЗНЫЙ НАУЧНО-ИССЛЕДОВАТЕЛЬСКИЙ ИНСТИТУТ МИНЕРАЛЬНОГО СЫРЬЯ (ВИМС)
Научный сооег но аналитическим методам
Химико-аналитические методы
Инструкция N* 2-Х
СЕРА
МОСКВА- 1965 г.
В соответствии с приказом Госгеолкома СССР К 229 от 18 мая 1964 г* инструкция fe 2 — X рассмотрена и рекомендовано Научным Советом по аналитическим методам к применению для анализа рядовых проб.
(Протокол fr I от 25.ХЛ.64 г.)
Председатель НСАМ В.Г.Сочеванов
Ученый секретарь
Председатель секции химико-аналитических методов К.С.Пахомова
Р.С.Фридман
Инструкция t- 2 — X рассмотрена в соответствии с приказом Государственного геологического комитета СССР w 229 от 18 ман 1964 г. Научным Советом но аналитическим методам (протокол *1 от 25.ХП.64 г.) и утверждена ВИМСом с введением в действие с 1/УИ-65 г.
ВЕСОВОЕ ОПРЕДЕЛЕНИЕ СЕРЫ РАСТВОРИМЫХ СУЛШТОВх/
Сущность метода
Метод основан на избирательном растворении некоторых природных сульфатов (гипс, ангидрид и пр.) в 8-10%-ной по весу соляной кислоте. Другие сульфаты (барит, целестин, алунит) при этом не растворяются. Определение растворимой сульфатной серы заканчивается, как обычно, осаждением в виде сульфата бария и взвешиьанием пропаленного остатка (1, 3).
Если в испытуемом материале присутствуют сульфиды, растворимые в 10%-ноИ соляной кислоте (галенит, сфалерит и др.)* то выделяющийся сероводород может частично окисляться до серной кислоты и завымать результаты определения сульфатной серы. Для предотвращения этой ошибки растворение в соляной кислоте следует проводить при пропускании тока углекислого газа.
Железо и другие элементы, которые осаждаются аммиаком в виде гидроокисей, а не основных сульфатов, отделяют предварительно двукратным осаждением из солянокислого раствора 25%-ным аммиаком, прибавляемым с избытком.
При осаждении сульфат-иона из растворов, содержащих аммонийные соли, возникает отрицательная ошибка, связанная с соосаж-дением сульфата аммония, который улетучивается при прокаливании осадка. Захватывание сульфата аммония осадком уменьшается при увеличении скорости осаждения и продолжительности отстаивания рветвора с осадком перед фильтрованием.
Метод позволяет определять от 0,10% серного ангидрида
( so3).
х/ Внесена в HCAU химико-аналитической лабораторией ВИМСа 1964 г.
Допустимые расхождения (2)
Содержание сульфатной серы (so7X* Допустимые расхождения,
_г__ j_°и,2__
Выше 20 10,0 — 20,0 1,0 — 10,0 0,05 — 1,0
1. Кислота азотная, d I,V
2. Кислота соляная, d 1,19 и разбавленная 1:1 (для получения утлекислого газа).
3. Кислота соляная, 10%-аыИ (по весу) раствор. 225 мл. соляной кислоты 4 1,19 разоавлягт до 1 л водой,
4. Аммиак, 25,1-ный раствор.
5. Барий хлористый, 31 — ный раствор.
6. Серебро азотнокислое, 51-ный раствор.
7. Перекись водороде, 301-иый рествор(пергидроль).
8. Метиловый оранжевый, 0,011-ный водный раствор.
9. Мрамор (для получения углекислого газа).
Аппаратура
1. Аппарат Киппа для получения углекислого газа.
2. Склянки Тиденко для промывания углекислого газа — 2вт.. с 51-И1И1 раствррои сернокислой меди (П), подкисленным 1-2 каплями серной кислоты 1:1 и с водой.
Ход анализе
Навеску образца 1-2 г (в вависимости от содержания сульфатной серы) помещают в коническую колбу емкостью 200-250 мл, приливают 50-75 мл 101-ного раствора соляной кислоты* отмечают уровень жидкости в колбе и в течение 15-20 млн. пропускают на холоду ток утлекислого газа, погрузив конец вводной трубки почти до дна колбы. Не прерывая тока газа, содержимое колбы нагревают до кипения и кипятят 30-40 мин., периодически пополняя горячей водой убыль жидкости в колбе. Раствор охлаждают
х/ 4 -относительная плотность. 4.
* 2-Х
под током углекислого газа. Затем содержимое колбы переносят в мерную колбу емкостью 250 мл, доводят объем до метки водой, перемешивают и сразу же фильтруют через сухой фильтр в сухой стакан. Отбирают аликвотную часть раствора 200 мл и переносят в стакан емкостью 300-400 мл.
Окислив закисное железо 1-2 каплями пергидроля, нагревают солянокислый раствор почти до кипения и осаждают гидроокиси 25%-ным аммиаком, прибавляя его до появления слабого запаха, а затем приливают избыток 3-4 мл. Помещают стакан на горячую водяную баню и дают осадку гидроокисей отстояться.
Осадок отфильтровывают и промывают 4-5 раз горячей водой, к которой добивлеко небольшое количество аммиака (9-4 мл на 1 л воды).
Фильтр с осадком переносят в стакан, в котором производилось осаждение, приливают 20-30 мл 10%-ной соляной кислоты, осторожно нагревают до растворения осадка, разрывают фильтр стеклянной палочкой на части, прибавляют 100 мл воды я вторично осаждают гидроокиси аммиаком так же, как и в первый рав.
Осадок гидроокисей промывают водой с несколькими каплями аммиака до отрицотельной реакции на хлор-ион в промывных водах (проба с раствором азотнокислого серебра при слабом подкислении азотной кислотой).
Соединяют оба фильтрата и промывные воды. Полученный pact* вор нейтрализуют соляной кислотой по метиловому оранжевому до перехода окраски индикатора в красный цвет, упаривиют до объема 150-200 мл и прибавляют соляной кислоты d 1,19 из расчета 0,5 мд кислоты на каждые 100 мл раствора. Раствор нагревают до кипения и осаждают сульфат-ион, прибавляя в один прием при энергичном перемешивании 30 мл горячего 3%-ного раствора хлористого бария.
Раствор с осадком кипятят в течение нескольких минут, дают постоять в теплом месте и оставляют до следующего дня. Фильтруют через плотный фильтр и осадок сульфата бария промывают холодной водой до отрицательной реакции ка хлор-ион (проба с раствором азотнокислого серебра). Фильтр с осадком помещают во взвешенный тигель, осторожно озоляют фильтр, прокаливают остаток при умеренно-красном калении (не выше 800°С) и вввеоивают.
5.
* 2 — X
Параллельно проводят глухой опыт с теми же реактивами.
Вычисление результатов анализа
Содержание растворимой сульфатной серы вычисляют по формуле:
% so, = . 100,
* 200 . Н
где: А — вес осадка сульфата бария, г/с поправкой на глухой опыт/*
250 — объем испытуемого раствора, мл*
200 — объем аликвотной части рэствора, взятой для определения, мл;
0,3430- фактор пересчета сульфата баржя на серный ангидрид ( so,);
Н — навеска, г.
Литература
I. Анализ минерального сырья, под редакцией и.Н.Книпо-вич и Ю.В.Морачевского. Л.,Госхимиздат, 1956.
2. Изменения ж дополнения к «Временной инструкции по внут-рмлаборатормому контролю ИГ и 0U СССР», 1962.
3. А.И.Пономарев. Методы химического анализа силикатных и карбонатных горных пород. М., изд.АН СССР, 19Ы.
Подписано к печати 25.IX.65r,
Заказ 175 7ч.-изд.1.0,3 £1036*3 Тираж ЬОО
Ротапринт ВИЛ С а
Выписка из приказа ГГК СССР ► 229 от 18 мая 1964 года
?. Министерству геологии и охраны недр Казахской ССР,глав-ным управлениям и управлениям геологии и охраны недр при Советах Министров соганьа республик» научно-исследовательским институтам, организациям я учреждениям Госгеолкома СССР:
а) обязать лаборатории при выполнении количественных анализов геологических проб применять методы, рекомендованные ГОСТами, а такие Научным советом, по мере утверждения последних ВИМСом.
При отсутствии ГОСТов и методов, утвержденных В/МСом,разрешить временно применение методик, утвержденных в порядке, предусмотренном приказом от I ноября 1954 г. ► 998;
в) выделить лиц, ответственных за выполнение лабораториями установленных настоящим приказом требований к применению наиболее прогрессивных методов анализа.
Кате-! тория) анали{-аа I
I
П
О
лабораторных методов анализа минерального сырья по кх назначение и достигаемой точности
Каименовя- | IТочность по сравнение! i/q-Wim
кие анализа ! Назначение анализа jc допусками внутркла- !,МХ2; 3
«бораторного контроля j
Особо точный Арбитражный анализ,ана-Среднял ошибка вЗ ра-анализ лйз эталонов . за меньше допусков.
Полный анализ Полные анализы горных пород и минералов.
Анализ рядо- Массовый анализ гео-
вих проб логических проб при
разведочных работах и подсчете запасов, а та:пке при контрольных анализах.
Точность анализа должна обеспечивать получение суммы элементов в пределах 99,5-100,5/»
Ошибки анализа должны укладываться в допуски
0,33
I
1У Анализ техно- Текуаий контроль тех-логических нологических процес-
продуктов сов.
Ошибки анализа могут I укладываться в расширенные допуски по особой договоренности с заказчиком»
2
У Особо точный Определение редких я Омибка определения не 0,5 анализ геохи- рассеянных элементов должна превышать ло-
ыичегких проб и «элсмснтов-спутни- ловины допуска; для
ковл при близких к низких содержаний,для Марковым содержаниях, которых допуски отсутствуют,-по договоренности с заказчиком.
У1 Анализ рядовых геохимических проб.
Анализ проб при геохимических и других исследованиях с повышенной чувствительностью и высокой производительностью.
Ошибка определения должна укладываться в удвоенный допуск; для низких содержаний, для которых допуски отсутствуют,- по договоренности с заказчиком.
2
JH
Полуколичест-венный анализ
Качественная характеристика минерального сырья с ориентировочным указанием содержания элементов, применяемая при металлометрической съемке и др.поисковых геологических работах.
При определении содержания элемента допускаются отклонения на 0,5-1 порядок-
•УУ Качественный Качественное определе- Точность определения анализ ние присутствия эле- не нормируется
мевта в минеральном сырье.
12.3.1.
Сущность метода
Метод
основан на разложении навески соляной
кислотой с последующим осаждением серы
в виде сульфата бария и определением
массы последнего.
12.3 2.
Аппаратура, реактивы и растворы
Для
проведения анализа применяют аппаратуру,
реактивы и растворы, указанные в
п.12.2.1.2, при этом используют соляную
кислоту по ГОСТ
3118,
раствор 1:3 (одна объемная часть
концентрированной соляной кислоты и
три объемные части воды).
12.3.3.
Подготовка к испытанию
Навеску
к испытанию готовят по п.12.1.1.3, при этом
массу навески принимают равной 1 г.
12.3.4.
Проведение испытаний
Навеску помещают
в стакан вместимостью 100-150 см,
прикрывают стеклом и добавляют 40-50
см соляной
кислоты. После прекращения выделения
пузырьков газа ставят стакан на плитку
и выдерживают при слабом кипении 10-15
мин. Осаждают полуторные окислы, добавляя
2-3 капли индикатора метилового оранжевого
и доливая раствор аммиака до перехода
окраски индикатора из красной в желтую
и появления запаха аммиака. Через 10 мин
осадок отфильтровывают. Осадок промывают
теплой водой с добавлением нескольких
капель раствора аммиака.
Фильтрат
нейтрализуют соляной кислотой до
перехода окраски раствора в розовую и
доливают еще 2,5 см кислоты.
Раствор нагревают до кипения и доливают
в один прием 10 см горячего
раствора хлорида бария, перемешивают,
кипятят раствор 5-10 мин и оставляют не
менее чем на 2 ч. Осадок отфильтровывают
через плотный фильтр «синяя лента»
и промывают 10 раз небольшими порциями
холодной воды до удаления хлорид-ионов.
Полноту
удаления хлорид-ионов проверяют по
реакции с нитратом серебра: несколько
капель фильтрата помещают на стекло и
добавляют каплю 1%-ного раствора нитрата
серебра. Отсутствие образования белого
осадка свидетельствует о полноте
удаления хлорид-ионов.
В
фарфоровый тигель, предварительно
прокаленный до постоянной массы при
температуре 800-850 °С, помещают осадок с
фильтром, высушивают, озоляют, избегая
воспламенения фильтра, и прокаливают
в открытом тигле до полного выгорания
фильтра, а затем при температуре 800-850
°С в течение 30-40 мин.
После
охлаждения в эксикаторе тигель с осадком
взвешивают. Прокаливание повторяют до
получения постоянной массы.
Параллельно
с анализом проводят «глухой опыт»
(см. примечание к п.12.2.1.4). Количество
сульфата бария ,
найденное «глухим опытом», вычитают
из массы сульфата бария ,
полученной при анализе пробы.
12.3.5.
Обработка результатов
Содержание
сульфатной серы ()
в процентах в пересчете на вычисляют
по формуле (21).
Допустимые
расхождения между результатами двух
параллельных анализов принимают по
п.12.2.1.5.
12.4. Определение содержания сульфидной серы
Содержание
сульфидной серы ()
в процентах в пересчете на вычисляют
по разности между общим содержанием
серы и содержанием сульфатной серы по
формуле
, (27)
где —
общее содержание серы в пересчете на ,
%;
— содержание
сульфатной серы в пересчете на ,
%.
13. Определение морозостойкости песка из отсевов дробления
13.1. Сущность
метода
Морозостойкость
песка определяют по потере массы при
последовательном замораживании и
оттаивании.
13.2. Аппаратура
Камера
морозильная.
Шкаф
сушильный.
Весы
по ГОСТ
29329 или ГОСТ
24104.
Сита
с сетками N 1,25; 016 по ГОСТ
6613 и
с круглыми отверстиями диаметром 5 мм.
Сосуд
для оттаивания проб.
Мешочки
тканевые из плотной ткани с двойными
стенками.
Противни.
13.3. Подготовка
пробы
Лабораторную
пробу сокращают до массы не менее 1000 г,
просеивают на двух ситах: первом с
отверстиями диаметром 5 мм и втором — с
сеткой N 1,25 или 016, в зависимости от
крупности испытуемого материала,
высушивают до постоянной массы, после
чего отбирают две навески массой по 400
г.
13.4. Проведение
испытаний
Каждую
навеску помещают в мешочек, обеспечивающий
сохранность зерен, погружают в сосуд с
водой для насыщения в течение 48 ч. Мешочек
с навеской вынимают из воды и помещают
в морозильную камеру, обеспечивающую
постепенное понижение температуры до
минус (20±5) °С.
Пробы
в камере при установившейся температуре
минус (20±5) °С выдерживают 4 ч, после чего
мешочки с навесками извлекают, погружают
в сосуд с водой, имеющий температуру 20
°С, и выдерживают 2 ч.
После
проведения требуемого числа циклов
замораживания и оттаивания навеску из
мешочка высыпают на контрольное сито
с сеткой N 1,25 или 016, тщательно смывая со
стенок мешочка оставшиеся зерна. Навеску,
находящуюся на контрольном сите,
промывают, а остаток высушивают до
постоянной массы.
13.5. Обработка
результатов
Потерю
массы навески ()
в процентах вычисляют по формуле
, (28)
где — масса
навески до испытания, г;
—
масса зерен навески на контрольном сите
с сеткой N 1,25 или 016 после испытания, г.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Определение содержания сульфатной серы [c.140]
Определение содержания сульфатной серы (метод ЁТИ) [c.36]
ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ СУЛЬФАТНОЙ И МИНЕРАЛЬНОЙ СЕРЫ В КАМЕННЫХ УГЛЯХ [c.139]
Определение серы. В силикатах может присутствовать сульфидная или сульфатная сера. Обычно общее содержание серы в силикатах невелико, и сульфидная сера при сплавлении навески с содой окисляется кислородом воздуха до сульфатной серы. Если предполагают, что силикат содержит много сульфидной серы, то сплавление ведут в присутствии небольшого количества KNO или КСЮ,, которые окисляют двухвалентную серу до шестивалентной. [c.469]
Нитхромазо применен для определения сульфатной серы в экстракционной фосфорной кислоте [49], в лимонной и винной кислотах [175], в котловой воде [51], сточных водах гальванических цехов, в электролитах меднения, хромирования [22] и матового никелирования [237], в теллуристых растворах [483] для определения серы в трехсернистой сурьме [481 ], в полупроводниковых пленках на основе сульфида и селенида кадмия [485], в сульфидах урана [166], в горных породах и минералах [1467], в углеродистых материалах [267] для определения серной кислоты в газах контактных сернокислотных цехов [53] и в башенных газах в присутствии окислов азота [199] для оценки содержания серы в удобрениях [47], овощах [258], биологических материалах 378], расти,-тельных объектах [257] для определения серы в фосфор- и мышьяксодержащих органических соединениях [50, 304]. [c.93]
Описаны методы определения серы, основанные на разрушении лаков тория [57], циркония, тория и церия [58, 59], а также на разрушении сульфат-ионами роданида железа [60], родизоната бария [61], комплексов тория с ксиленоловым оранжевым [62]. Рекомендуются также нефелометрические или турбидиметрические методы определения сульфатов в различных вариантах [2]. Для определения малых количеств сульфатной серы ее восстанавливают до сероводорода с помощью хлорида олова (И) [63], смесью иодида и гипофосфита [64, 65] или другими восстановителями с последующим определением сульфидной серы в виде метиленового голубого. [c.205]
Реакции осаждения сульфат-иона других солей см. в разделе Определение содержания сульфатной серы на стр. 140. [c.142]
Определение серы сульфатной [c.129]
ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ СУЛЬФАТНОЙ КОЛЧЕДАННОЙ И ОРГАНИЧЕСКОЙ СЕРЫ В УГЛЯХ, СЛАНЦАХ И ТОРФАХ [c.136]
Наиболее целесообразным методом определения содержания сульфатной серы в рудах цветных металлов является обработка навески раствором карбоната натрия при нагревании. При этом не только растворимые средние сульфаты металлов (сульфат железа, меди, кальция и др.), но и труднорастворимые основные сульфаты металлов переходят в соответствующие карбонаты. Труднорастворимый сульфат свинца также переходит в карбонат, так как его растворимость в несколько тысяч раз превышает растворимость карбоната свинца (растворимость сульфата свинца равна l,5 10″ а карбоната свинца — 3,9-10 моль/л). В результате обработки пробы раствором карбоната натрия все металлы, содержащиеся в пробе в виде сульфатов, осаждаются в виде карбонатов, а сульфат-ион переходит в раствор в виде натриевой соли. [c.269]
При определении серы в минеральном сырье в зависимости от поставленной задачи может быть необходимо либо определение общего (валового) содержания серы, либо определение сульфатной, сульфидной и элементной серы. [c.190]
В присутствии больших количеств сульфидной и сульфатной серы извлечение последней следовало бы делать в атмосфере двуокиси углерода, но обычно эта предосторожность оказывается излишней. Подробности определения серы см. на стр. 1029. [c.1062]
По методу сжигания в трубке определение проводят в токе воздуха или кислорода. Газообразные продукты сгорания содержат сернистый ангидрид, образующийся при сгорании органической и пиритной серы. Сульфатная сера также переходит, при определенных условиях, в серный ангидрид и, следовательно, присутствует в газообразных продуктах сгорания. Окислы серы вместе с двуокисью углерода поглощают щелочами и затем в полученном растворе определяют серу весовым или объемным методом. [c.51]
При создании полупроводниковых приборов, изготовленных на основе высокочистого селена, необходимо контролировать микропримеси, в частности, серу и галогены, особенно влияющие на физические свойства элементарного селена. Обычно определение микроколичеств серы, содержащейся в селене, проводят окислением образца для перевода серы в окислы. В дальнейшем идут одним из двух путей либо проводят определение сульфит-сульфатно/й серы [1, 2], либо восстанавливают серу до сероводорода [3]. Возможен другой метод анализа — гидрирование непосредственно исходного элементарного селена с последующим определением сероводорода. Элементарные сера и селен легко гидрируются водородсодержащими соединениями [4, 5]. Химическая термодинамика позволяет рассчитать количественный и качественный состав газов, образующихся при гидрировании селена продуктами пиролиза предельных углеводородов. [c.219]
Определение общего содержания серы в сульфидных минералах весовыми методами. Определение серы в сульфидах после сплавления навески минерала с карбонатом и нитратом натрия не дает удовлетворительных результатов, поэтому для разложения таких минералов применяют бром в четыреххлористом углероде и азотную кислоту . При таком разложении удается количественно окислить сульфидную серу до сульфатной. В полученном растворе сульфат-ион определяют весовым методом в виде сульфата бария. [c.308]
II 1.1.2.2. Раздельное определение элементной, сульфатной и сульфидной серы…….113 [c.6]
Можно видоизменить метод работы определить из навески породы валовую серу без предварительного растворения сульфатов путем обработки навески прямо царской водкой, как выше описано. Тогда найденная сера будет, очевидно, отвечать сумме сульфатной и сульфидной вычтя из этой суммы отдельно определенную серу солянокислой вытяжки, получим серу сульфидов. Этот путь проще, но менее надежен, поскольку обычно сульфаты настолько преобладают над сульфидами, что приходится устанавливать содержание сульфидов по разности между двумя большими (относительно) цифрами, что, конечно, нежелательно. [c.118]
При анализе железных руд различают определение общего содержания серы, сульфатной серы и сульфидной серы, которые определяются из отдельных навесок. [c.216]
Ниже приведены методы раздельного определения сульфидной, сульфатной и пиритной серы. Эти методы имеют недостатки и, как будет видно из дальнейшего изложения, область применения методов ограничена присутствием различных мешающих компонентов. Тем не менее фазовый анализ соединений серы во многих случаях дает возможность изучить качество сырья, контролировать обжиг сульфидных руд и другие металлургические процессы. [c.264]
Сплавление с углекислым натрием. При определении серы в силикатных породах, где содержание ее невелико, обычно исследуемое вещество сплавляют в платиновом тигле со смесью углекислого натрия с азотнокислым или хлорноватокислым калием. При этом сульфидная сера окисляется до сульфатной [c.163]
При исследовании реакции концентрированной серной кислоты с белками было найдено, что при этом чрезвычайно легко протекает сульфатирование гидроксильных групп в некоторых условиях эта реакция осуществляется совершенно специфично [72]. Однако в некоторых случаях, как на примере свободного тирозина, так и белков, было установлено, что при более продолжительных периодах реакции и более высоких температурах с сульфатированием начинает все более и более конкурировать реакция сульфирования. Следует отметить, что при сульфировании серусодержащая группа необратимо связывается с белком. Эти наблюдения аналогичны данным, полученным при изучении реакций фенолов с серной кислотой [73]. Реакция тирозина в условиях, обычно применяемых при работе с белками (действие концентрированной серной кислоты при нормальной температуре в течение приблизительно 30 мин), приводит к образованию 25% сульфоэфира и 63% сульфокислоты, как это было установлено путем определения полной и сульфатной серы (сульфатная сера легко отщепляется при гидролизе в сернокислой среде при комнатной температуре [72]). Доказательства сульфирования тиро- [c.360]
В фазовом анализе бокситов, медных руд, марганцевых руд, в исследовании отдельных стадий восстановления металлов из руд и в ряде других случаев также часто применяют ступенчатое растворение отдельных составляющих . Этот же метод применяется для определения свободной извести в цементе, для определения сульфидной серы наряду с сульфатной и т. д. [c.14]
При всех определениях серы в асфальтах следует иметь в виду, что иногда сера может присутствовать в виде сульфатов или сульфидов, также и в свободном состоянии. В последнем случае следует для определения растворимости пользоваться такими растворителями, которые хорошо и легко растворяют серу и битумы одно-времеино. Сульфатная и т. п. сера определяется в минеральном остатке после экстрагирования. [c.360]
Принцип метода. Определение основано на окислении серы до сульфатной спеканием с перманганатом калия и содой. После выщелачивания спека водой сульфат-ионы осаждают хлоридом бария Ва2++50 Ва504. Относительное стандартное отклонение результатов определения серы составляет 0,02 при ее содержании до 0,5% и 0,01 при более высоких содержаниях. [c.235]
Содержание галогенов [17] и серы [18] в растворах определяли в низковольтной искре (сила тока 5 А, емкость 10—60 мкФ ЕАСи КО20 X 1 1 об/мин) с медными (Зыс/сали. Использовали линии в видимой области спектра. Определение серы в сульфатных растворах проводили в области концентраций 0,002—0,02% со средней погрешностью 10%- [c.166]
Зикеев Т. А. и Шифрин М. Г. Растворы хлористого хрома как поглотители кислорода в газовом анализе. Зав. лаб.,, 1947, 13,, № 9, с. 1130—1133. Библ. 8 назв. 3973 Зикеев Т. А. и Шифрин М. Г. Определение содержания сульфатной серы в угле и в лабораторной золе угля. Изв. Всес. теплотехн. ин-та, 1951, № 10, с. 29—30. [c.159]
Для большинства целей определение серы, растворимой в азотной кислоте, можно рассматривать как определение содержания сульфидов силикатных пород. Однако в результаты этого определения входит и сера из сульфатных минералов, растворимых в азотной кислоте, и следы серы из нерастворимых, например барита. Другим способом определения сульфидной серы, которая не содержала бы сульфатной серы, является восстановление сульфидов до сероводорода иодистоводородной кислотой [4]. Выделяющиеся газы пропускают через суспензию гидроокиси кадмия и сульфид кадмия определяют при помощи иода обычным путем. Больщинство сульфидов разлагается, но чтобы полностью разложить пирит и халькопирит, необходимо присутствие ртути [5], [c.393]
Сера и методика ее определения. Сера содержится в каменных углях обычно в виде сульфидов (FeSa и др.), сульфатов (FeS04, aS04 и др.) и сложных органических соединений. Соответственно серу в угле подразделяют на сульфидную (S ), сульфатную (SJ и органическую (S ). [c.316]
Осаждение сульфат-ионов хлоридом бария в присутствии большого количества Ре(П1) нежелательно. Последнее частично со-осаждается в виде сульфата окиеного железа. Таким образом часть сульфатной серы оказывается связанной с более легким, чем барий, металлом. Кроме того, при прокаливании осадка соосажденный сульфат железа разлагается с потерей ЗОз, что приводит к получению несколько заниженного результата определения серы. Устранить влияние железа можно предварительным восстановлением Ре(П1) до Ре (II) аскорбиновой кислотой или гидроксил-амином. Более радикальная мера — удаление железа из раствора осаждением аммиаком (с последующим переосаждением осадка) или еще лучше — электролиз с ртутным катодом. [c.220]
Метод определения сульфатов, основаашый на возникновении флуоресценции дважды шротонизироваиного хинина при подкислении раствора серной кислотой [1—3], мало чувствителен. Определение сульфатной серы по флуоресценции салицилфлуорона [4] или морина [5], вытесняемого сульфатом из его комплекса с торием, мало специфично определению препятствуют миллиграммовые количества соли никеля. Наиболее чувствительный метод — определение серы в виде сульфида. Он основан на гашении сульфидом флуоресценции тетрартутьацетата флуоресцеина [6]. [c.25]
Лабораторная методика фо-тотурбидиметрического определения примеси сульфатной серы по норме 1.10″ % [c.53]
Сера в керосине может иметь двоякое присхождеиие она можег быть, во-первых, первичной, т. е. попадать в виде сернистых соединений, предсуществовавших в нефти и не выделенных недостаточной очисткой. Во-вторых, сера может присутствовать в виде соединений, заключающих окисленную се ру сульфонафтеновых кислот серноэфирных, может быть, и сульфонов И полных эфиров серной кислоты [Гейслер и Деннштедт (142)]. Все эти соединения вторичного характера и главная масса их удаляется хорошей промывкой очищаемого керосина щелочью и водой. Сюда же можно отнести и сульфатную серу в виде минеральных солей, взвешенных В керосине. Эта последняя форма встречается редко, но может иметь некоторое значение в особых случаях. Определение ее производится по Конрадсону (143), но в виду редкости здесь не приводится. [c.207]
Сера широко распространена в природе в чистом виде, в рудах, в нефти, 
Физические и химические свойства реактива
Сера — простое вещество, элемент таблицы Менделеева, типичный неметалл. Чистая сера в нормальных условиях — вещество желтого цвета, без запаха и вкуса, состоящее из мелких хрупких кристаллов. Устойчива в нескольких аллотропных состояниях, которые объясняются способностью вещества к естественной полимеризации.
Сера не растворяется в воде, плохо проводит ток и тепло, растворяется в сероуглероде, бензоле, дихлорэтане и некоторых других органических растворителях. При нагревании активно взаимодействует с большинством металлов и неметаллов. Горюча и взрывоопасна. Производства серы и склады требуют особых мер предосторожностей, включая использование инструментов из неискрящих материалов и специальных ультрафиолетовых датчиков для обнаружения пламени.
Применение серы
Сера и ее соединения чрезвычайно востребованы во многих областях производства.
Чистая сера:
— Необходима для того, чтобы превратить каучук в резину. Этот процесс называют вулканизацией каучука. Резиновая промышленность потребляет до 10% общего объема получаемой серы.
— Входит в состав лекарственных средств против паразитов и заболеваний кожи (чесотка, псориаз и др), средств для ванн против ревматизма и подагры, некоторых лекарств, принимаемых внутрь.
— Применяется в химической промышленности: почти 50% всей производимой в мире серы идет для получения серной кислоты, еще четверть — для получения сульфитов; до 15% используется в производстве инсектицидов для борьбы с вредителями винограда, хлопчатника и некоторых других культур.
Сера требуется для:
— изготовления красок и ультрамарина для лако-красочной промышленности, полимеров и синтетических волокон, диоксида серы, сероуглерода, сульфатов, люминофоров, эбонита, удобрений;
— изготовления многих пиротехнических и взрывчатых смесей, в том числе пороха и состава для спичечных головок;
— изготовления бумаги;
— создания некоторых сталей с особыми свойствами;
— дезинфекции овощехранилищ, птичников, подвалов в сельском хозяйстве;
— виноделия, при хранении овощей и фруктов.
Серосодержащие руды часто являются сырьем 
Серная кислота применяется:
— в электротехнической промышленности для производства аккумуляторов;
— для очистки нефтепродуктов;
— для очистки проволоки и металлического листа от окалины, для травления металлических поверхностей;
— в изготовлении лекарственных средств и красителей;
— в химической промышленности в качестве сырья для производства широкого спектра химических веществ, для осушения газов, для повышения концентрации азотной кислоты.
Оксид серы используется для:
— получения серной и азотной кислоты, олеума, сульфитов, тиосульфатов;
— дезинфекции помещений в сельском хозяйстве, в виноделии, в консервировании плодово-ягодной продукции;
— отбеливания тканей (шерсти, шелка).
Сероводород находит применение в производстве чистой серы и серной кислоты, сульфитов и тиосульфатов.
«ПраймКемикалсГрупп», интернет-магазин химических реактивов в Москве и Московской области, предлагает купить серу, оборудование и посуду для лабораторий и производства. Возможен самовывоз со склада в Мытищах или доставка. Хороший сервис, демократичные цены.
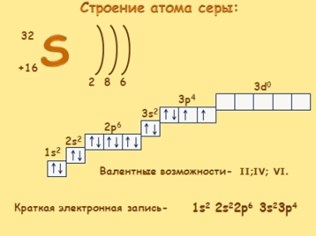
Электронное строение атома.
Сера относится к элементу, находящемуся в VI-й группе главной подгруппы периодической системы Д.И.Менделеева. Его электронная конфигурация атома 1s22s22p63s23p4.
Нахождение в природе.
В обычных условиях сера представляет собой лёгкие, жёлтые кристаллы, нерастворимые в воде, но хорошо растворимые в сероуглероде. Кристаллическая решётка серы – молекулярная, в узлах которой находится циклическая молекула S8. Сера имеет ряд аллотропных модификаций.
Вышеуказанная форма серы называется моноклинной серой, при охлаждении которой переходит в устойчивые кристаллы ромбической серы.
Если расплавленную серу влить в холодную воду, то образуется ещё одна аллотропная модификация – пластическая сера. Температура кипения серы +445оС. В парах расплавленной серы содержатся молекулы S8, S6, S4, S2.
В природе сера встречается в трёх формах:
1) Самородная сера
2) Сульфидная сера:
FeS2 – серный или железный колчедан, пирит.
CuS – медный блеск.
CuFeS2 – халькопирит или медный колчедан.
PbS – свинцовый блеск.
ZnS – цинковая обманка.
HgS – киноварь.
3) Сульфатная сера:
CaSO4x2H2O – гипс.
CaSO4xH2O – алебастр.
Na2SO4x10H2O – глауберова соль.
MgSO4x 7H2O – горькая соль.
Химические свойства.
1. Свойства простого вещества.
Сера может проявлять как окислительные, так и восстановительные свойства. Окислителем сера является в первую очередь по отношению к металлам:
S + 2Na = Na2S
S + Ca = CaS
3S +2Al = Al2S3
В качестве окислителя сера проявляет свои свойства и при взаимодействии с неметаллами:
S + H2 = H2S
3S + 2P = P2S3
2S + C = CS2
Однако с неметаллами, имеющими электроотрицательность бóльшую, чем у серы, она реагирует в качестве восстановителя:
S +3F2 = SF6
S + Cl2 = SCl2
Сера реагирует со сложными веществами, как правило, окислителями. Причём азотная кислота окисляет её до серной кислоты:
S + 6HNO3 = H2SO4 + 6NO2 + 2H2O
Другие окислители окисляют серу до степени окисления (+4):
S + 2H2SO4 = 3SO2 + 2H2O
3S + 2KClO3 = 3SO2 + 2KCl
По механизму реакции ДИСПРОПОРЦИОНИРОВАНИЯ сера реагирует с щелочами. В процессе этой реакции образуются соединения серы (-2) и (+4):
3S + 6KOH = K2SO3 + 2K2S + 3H2O
Непосредственно с водой сера не реагирует, однако при нагревании подвергается дисмутации в атмосфере водяного пара.
Сера может быть получена в процессе реакций:
SO2 + 2CO = S + 2CO2
Na2S2O3 + 2HCl = S + SO2 + 2NaCl + H2O
2. Соединения серы (-2).
У серы в степени окисления (-2) соединения называются сульфидами. Это бинарные соединения, в которых одним из элементов является металл: Na2S, ZnS, Al2S3, PbS2 и др.
Соединение серы (-2) с водородом называется сероводород – H2S. Сероводород – газ без цвета, неприятного запаха, тяжелее воздуха, очень ядовит, мало растворим в воде. Сероводород можно получить различными способами. Oбычно, в лаборатории, сероводород получают, действуя на сульфиды сильными кислотами:
FeS + 2HCl = FeCl2 + H2S
Для сероводорода и его солей характерны восстановительные свойства:
H2S + SO2 = 3S + 2H2O
В указанной реакции сера образуется по механизму конпропорционирования ( из двух атомов серы, имеющих различные степени окисления (-2) и (+4) образуется соединение серы со степенью окисления (0).
SO2 + 2CO = S + 2CO2
Na2S2O3 + 2HCl = S + SO2 + 2NaCl + H2O
В лаборатории сероводород получают:
FeS + 2HCl = FeCl2 + H2S
При сгорании в кислороде он образует различные продукты:
2H2S + O2 = 2H2O + 2S (недостаток кислорода)
2H2S + 3O2 = 2H2O + 2SO2 (избыток кислорода)
Cероводород легко окисляется галогенами, оксидом серы, хлоридом железа (III):
H2S + Cl2 = 2HCl + S
2H2S + SO2 = 2H2O + 3S
H2S + 2FeCl3 = 2FeCl2 + S + 2HCl
На воздухе сероводород окисляет серебро, чем и объясняется почернение серебряных изделий со временем:
2H2S + 4Ag + O2 = 2Ag2S + 2H2O
Водные растворы сероводорода являются слабой кислотой. Диссоциирует в две стадии, образует два типа солей: гидросульфиды и сульфиды:
H2S ↔ HS-1 + H+
HS-1 ↔ H+ + S-2
Сульфиды большинства металлов нерастворимы и имеют различную окраску. Это является фактором, благодаря которому можно распознавать те или иные катионы в растворах:
Чёрные – HgS, Ag2S, PbS, CuS, FeS, NiS;
Коричневые – SnS, Bi2S3;
Оранжевые – Sb2S3, Sb2S5;
Жёлтые – As2S3, As2S5, SnS2, CdS;
Розовые — MnS
Белые – ZnS, Al2S3, BaS, CaS;
Cульфиды в водной среде проявляют восстановительные свойства, обычно окисляясь до серы:
3H2S + 2KMnO4 = 3S + 2MnO2 + 2KOH + 2H2O
H2S + 2HNO3 = S + 2NO2 + 2H2O
3H2S + 2FeCl3 = S + FeS + 6HCl
H2S + J2 = S + 2HJ
При взаимодействии с более сильными окислителями сульфиды окисляются до соединений со степенью окисления (+6):
H2S + 4H2O + Cl2 = H2SO4 + 8HCl
MnS + 3HNO3 = MnSO4 + 8NO2 + 4H2O
PbS + 4H2O2 = PbSO4 + 4H2O
3. Соединение серы (+4).
Из соединений серы со степенью окисления (+4) наиболее характерны оксид серы (SO2) или сернистый газ и сернистая кислота (H2SO3) и её соли. Оксид серы представляет собой газ с резким запахом, бесцветный, тяжелее воздуха, хорошо растворяется в воде. Получают при неполном горении сероводорода или при окислении сульфидов. В лаборатории его получают при взаимодействии меди с концентрированной серной кислотой:
Cu + H2SO4 = CuSO4 + SO2 + H2O
Na2SO3 + 2HCl = 2NaCl + SO2 + H2O
Для оксида серы (+4) характерны как окислительные:
SO2 + H2S = 3S + 2H2O
так и восстановительные свойства:
2SO2 + O2 = 2SO3
2SO2 + 2H2O + Br2 = H2SO4 + 2HBr
SO2 + Cl2 = SO2Cl2
SO2 + 2HNO3 = H2SO4 + 2NO2
Оксид серы (+4) – типичный кислотный оксид, он реагирует с основания-ми с образованием солей, с водой образует сернистую кислоту:
SO2 + 2NaOH = Na2SO4 + H2O
SO2 + H2O = H2SO3
Сернистая кислота – слабая кислота, диссоциирует в две стадии, образует два типа солей: кислые — гидросульфитыи средние —сульфиты :
H2SO3 ↔ HSO3— + H+
HSO3—↔ SO32- + H+
Соли сернистой кислоты неустойчивы, разлагаются при действии более сильных кислот и при нагревании:
Na2SO3 + HNO3 = 2NaNO3 + SO2 + H2O
K2SO3 = K2O + SO2
В растворах сульфит-ионы проявляют чаще всего восстановительные свойства:
Na2SO3 + 2KOH + KMnO4 = Na2SO4 + 2K2MnO4 + H2O
4. Соединения серы (+6)
Из соединений серы в степени окисления (+6) наиболее характерны оксид серы — SO3 или серный ангидрид и H2SO4 — cерная кислота. SO3 — бесцветный газ с характерным резким запахом, тяжелее воздуха, хорошо растворим в воде.
Оксид серы (+6) получают окислением оксида серы (+4) в присутствии катализатора и высоком давлении:
2SO2 + O2 = 2SO3
SO3 + H2O = H2SO4
Оксид серы (+6) является сильным окислителем:
SO3 + 2KJ = J2 + K2SO3
SO3 + H2S = 4SO2 + H2O2
5SO3 + 2P = P2O5 + 5SO2
Кроме того, он проявляет кислотные свойства, так как является кислотным оксидом:
SO3 + ZnO = ZnSO4
SO3 + KOH = KHSO4
SO3 + 2KOH = K2SO4 + H2O
Серная кислота, её соли.
Серная кислота представляет собой бесцветную маслообразную жидкость, максимальная плотность которой 1,84 г/мл. Исходным сырьём для получения серной кислоты является серный колчедан или пирит:
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
Далее, под воздействием катализатора — V2O5 происходит окисление оксида серы (+4) до оксида серы (+6):
2SO2 + O2 = 2SO3
Полученная безводная серная кислота называется олеум, т.к. в действительности, оксид серы (+4) растворяют в 98%-ной серной кислоте.
SO3 + H2O = H2SO4
Концентрированная серная кислота проявляет сильное водоотнимающее действие. Это свойство положено в основу многочисленных химических процессов, особенно в органической химии (получение спиртов, простых и сложных эфиров, альдегидов и т.д.). Концентрированная серная кислота является сильным окислителем. Например, при взаимодействии с просты-ми веществами, она окисляет их до кислот или оксидов:
2P + 5H2SO4 = 2H3PO4 + 5SO2 + 2H2O
C + H2SO4 = 2SO2 + CO2 + 2H2O
При обычной температуре она окисляет галогенводороды и сероводород:
H2SO4 + 8HJ = 4J2 + H2S + 4H2O
H2SO4 + 2HBr = Br2 + SO2 + 2H2O
H2SO4 + H2S = S + SO2 + 2H2O
Серная кислота термически устойчива и не летуча, поэтому способна вытеснять другие кислоты из их солей:
H2SO4 + KClO3 = KHSO4 + HClO4
Cерная кислота диссоциирует в две стадии, образует два типа солей:
кислые – гидросульфатыи средние – сульфаты:
H2SO4 ↔ HSO4— + H+
HSO4— ↔ SO42— + H+
Серная кислота проявляет свойства, характерные для остальных кислот: она реагирует с металлами, оксидами металлов, гидроксидами, солями слабых кислот. Качественной реакцией на сульфат-ионы в растворах является взаимодействие её с ионами бария Ва2+, в результате чего выпадает белый осадок:
Ba2+ + SO42- = BaSO4
При прокаливании сульфаты разлагаются на различные классы соединений в зависимости от металла, входящего в состав соли. Сульфаты щелочных металлов плавятся без разложения. Сульфаты металлов средней активности разлагаются на соответствующие оксиды:
ZnSO4 = ZnO + SO3
Сульфат железа (II) разлагается по механизму внутримолекулярной ОВР:
4FeSO4 = 2Fe2O3 + 4SO2 + O2
Сульфаты наиболее тяжёлых или малоактивных металлов разлагаются с образованием простых веществ – металла и кислорода:
HgSO4 = Hg + SO2 + O2
Некоторые сульфаты, являясь окислителями, реагируют с простыми веществами:
CaSO4 + C = CaO + SO2 + CO
BaSO4 + 4C = BaS + 4CO
Большое значение в промышленности, лабораторных исследованиях имеет взаимодействие серной кислоты с металлами. Эта тема заслуживает особого внимания, т.к. образуются различные продукты реакции в зависимости от положения реагируемого металла в ряду напряжений, степени разбавленности кислоты, температуры, катализаторов.
Разбавленная серная кислота с металлами, стоящими в ряду активности до водорода, при обычной температуре образует соль и водород:
H2SO4 + Zn = ZnSO4 + H2
Разбавленная кислота не реагирует с металлами, стоящими в ряду активности после водорода (медь, серебро, ртуть), но концентрированная кислота образует с ними соль, оксид серы (+4) и воду:
H2SO4 + Cu = CuSO4 + SO2 + H2O
Такие же продукты реакции концентрированная серная кислота образует при взаимодействии с металлами, стоящими в ряду активности до водорода:
2H2SO4 + Zn = ZnSO4 + SO2 + 2H2O
Однако, концентрированная серная кислота реагирует не со всеми металлами. Алюминий, железо, свинец и олово она пассивирует с образованием на их поверхности тонких оксидных плёнок, предотвращающих дальнейшее растворение металла:
H2SO4 + Al = Al2O3 + SO2 + H2O
Активные щелочные и щелочноземельные металлы могут образовывать с разбавленной кислотой не только водород. Например, магний с очень разбавленной серной кислотой на холоду образует соль, серу и воду:
H2SO4 + Mg = MgSO4 + S + H2O
Натрий при обычной температуре с очень разбавленной серной кислотой образует соль, серу и воду:
H2SO4 + Na = Na2SO4 + S + H2O,
а при охлаждении образует сероводород:
H2SO4 + Na = Na2SO4 + Н2S + H2O
Соли серной кислоты находят большое применение в промышленности, сельском хозяйстве, в быту.
Na2SO4x 10H2O – глауберова соль, применяется в медицине в качестве слабительного,
(NH4)2SO4 – азотное удобрение для сельского хозяйства,
CaSO4 – безводный гипс, применяется в строительстве.
CaSO4x 2H2O – водный гипс,
2CaSO4 xH2O – алебастр, продукт получения гипса,
MgSO4 – горькая соль, применяется в медицине как слабительное и гипотензивное средство,
BaSO4 – баритова каша, средство, применяемое как рентгеноконтрастное средство.
CuSO4 x 5H2O – медный купорос, применяется в строительстве,
FeSO4x 7H2O – железный купорос,
ZnSO4 x 7H2O – цинковый купорос,
KАl(SO4)2 x 12H2O – алюмокалиевые квасцы.
© blog.tutoronline.ru,
при полном или частичном копировании материала ссылка на первоисточник обязательна.