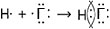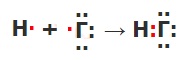- Учебники
- 9 класс
- Химия 👍
- Габриелян
- №4
авторы: Габриелян, Остроумов, Сладков.
издательство: «Просвещение»
Раздел:
- ГЛАВА III. Неметаллы и их соединения
- §12. Соединения галогенов
- Примените свои знания
ГДЗ учебник по химии 9 класс класс Габриелян. §12. Примените свои знания. Номер №4
- Предыдущее
- Следующее
Составьте схему образования химической связи для молекул галогеноводородов. Как меняется полярность связи и прочность молекулы галогеноводородов от HF к HI?
reshalka.com
ГДЗ учебник по химии 9 класс класс Габриелян. §12. Примените свои знания. Номер №4
Решение
Схема образования химической связи для молекул галогеноводородов:
Полярность связи и прочность молекулы от HF к HI уменьшается, потому что электроотрицательность галогенов в этом ряду уменьшается.
- Предыдущее
- Следующее
Нашли ошибку?
Если Вы нашли ошибку, неточность или просто не согласны с ответом, пожалуйста сообщите нам об этом
ГДЗ Химия 9 класc Габриелян О.С. , Остроумов И.Г., Сладков С.А. 2019 §12 СОЕДИНЕНИЯ ГАЛОГЕНОВ
Красным цветом приводится решение, а фиолетовым ― объяснение.
Задание 1
Как получают галогеноводороды в промышленности и лаборатории?
Галогеноводороды в промышленности получают прямым синтезом из простых веществ:
H2 + F2 = 2HF
H2 + Cl2 = 2HCl
Фтороводород и хлороводород в лаборатории обычно получают воздействием концентрированной серной кислотой на их галогениды щелочных металлов:
CaF2 + H2SO4(конц.) = CaSO4 + 2HF↑
2NaCl + H2SO4(конц.) = Na2SO4 + 2HCl↑
Для получения иодоводорода и бромоводорода используют кислоты, не обладающие окислительными свойствами:
КI (тв) + Н3РO4(конц.) = КН2РO4 + HI↑
КВr(тв) + Н3РO4(конц.) = КН2РO4 + HB↑
Как изменяется скорость синтеза галогеноводородов в зависимости от природы галогена? Скорость синтеза галогеноводородов тем больше, чем более электроотрицателен галоген. Так, например, реакция фтора с водородом протекает со взрывом, а реакция иода с водородом — только при нагревании и является обратимой.
Задание 2
Каков состав высших оксидов галогенов и какими свойствами они обладают?
В высших оксидах галогены проявляют степень окисления +7 — общая формула Г2O7(кроме фтора, т.к. это самый электроотрицательный элемент и положительных степеней окисления не проявляет). Высшие оксиды галогенов обладают кислотными свойствами.
Реагируют с водой:
Cl2O7 + H2O = 2HClO4
Реагируют с основными оксидами:
Na2O + Cl2O7 = 2NaClO4
Реагируют с щелочами:
2NaOH + Cl2O7 = 2NaClO4 + H2O
Можно ли получить эти оксиды синтезом? Можно, например, 2HClO4 + P2O5 = Cl2O7 + 2HPO3
Задание 3
С помощью какого реактива можно распознать галогенид-ионы? Реактив качественной реакции — раствор нитрата серебра.
Ag+ + Cl− ⟶ AgCl↓ — осадок белый творожистый
Аg+ + Br− ⟶ AgBr↓ — осадок светло-желтый
Ag+ + Br−⟶ AgBr↓ — осадок желтый
Какой ион является исключением? Фторид-ион
Как его распознают? С помощью растворимой соли кальция: Ca2+ + 2F− ⟶ CaF2↓ — осадок белый
Задание 4
Составьте схему образования химической связи для молекул галогеноводородов.
Как меняется их полярность связи и прочность молекулы от НF к НI? Полярность связи от HF к HI уменьшается, т. к. в этом ряду уменьшается электроотрицательность галогенов. Прочность молекулы уменьшается, т.к. в этом ряду увеличивается длина связи Н—Г (поскольку растёт радиус атома галогена).
Задание 5
Дайте сравнительную характеристику галогеноводородных кислот. Укажите черты сходства и различия. Сравнение химических свойств проиллюстрируйте уравнениями химических реакций.
Сходства химических свойств галогеноводородных кислот:
1) реагируют с металлами:
Zn+ 2HCl = ZnCl2 + H2↑
Zn+ 2HBr = ZnBr2 + H2↑
2) реагируют с основными оксидами:
MgO + 2HСl = MgCl2 + H2O
MgO + 2HF = MgF2 + H2O
3) реагируют с основаниями:
Mg(OH)2 + 2HBr = MgBr2 + 2H2O
Mg(OH)2 + 2HCl = MgCl2 + 2H2O
4) реагируют с солями, если образуется газ или осадок:
2HF + Ca(NO3)2 = 2HNO3 + CaF2↓
HI + AgNO3 = HNO3 + AgI↓
Различия химических свойств галогеноводородных кислот.
В ряду HF—НСl—НВг—HI растёт сила кислот, то есть средней силы плавиковая кислота HF, в отличие от остальных сильных кислот, обладает необычным свойством: она способна реагировать с оксидом кремния (IV):
4HF + SiO2 = SiF4 + 2Н2O
Задание 6
В четырёх пробирках без этикеток находятся растворы фторида, хлорида, бромида и иодида натрия. Как с помощью одного реактива распознать эти вещества? Распознать галогенид-ионы можно с помощью нитрата серебра: в пробирке с раствором хлорида натрия образуется белый творожистый осадок, в пробирке с раствором бромида натрия — светло-желтый осадок, в пробирке с раствором иодида натрия — желтый осадок, а в пробирке с раствором фторида натрия — осадок не образуется, т. к. фторид серебра является растворимым соединением.
Напишите уравнения реакций.
NaCl + AgNO3 ⟶ NaNO3 + AgCl↓ — белый творожистый осадок
Na+ + Cl— + Ag+ + NO3— ⟶ Na+ + NO3— + AgCl↓
Ag+ + Cl— ⟶ AgCl↓
NaBr + AgNO3 ⟶ NaNO3 + AgBr↓ — cветло-желтый осадок
Na+ + Br— + Ag+ + NO3— ⟶ Na+ + NO3— + AgBr↓
Ag+ + Br— ⟶ AgBr↓
NaI + AgNO3 ⟶ NaNO3 + AgI↓ — желтый осадок
Na+ + I— + Ag+ + NO3— ⟶ Na+ + NO3— + AgI↓
Ag+ + I— ⟶ AgI↓
Задание 7
Используя метод электронного баланса, составьте уравнения реакций, соответствующие следующим схемам превращений, укажите окислители и восстановители:
а) Fe2(SO4)3 + KI ⟶ FeSO4 + I2 + K2SO4;
Fe2(SO4)3 + 2KI = 2FeSO4 + I2 + K2SO4
Схема окислительно-восстановительной реакции.
Fe2+3(SO4)3 + KI-1 ⟶ Fe+2SO4 + I20 + K2SO4
2I-1 -2ē ⟶ I20 |2|2|1 ― процесс окисления
Fe+3 +1ē ⟶ Fe+2 |1| |2 ― процесс восстановления
Проводим вертикальную черту и пишем за ней число электронов, которые отдали и присоединили атомы иода и железа. Находим наименьшее общее кратное для чисел 2 и 1. Это число 2, которое записываем за второй вертикальной чертой посередине, и поделив его поочередно на 2 и 1, записываем результат за третьей чертой в строках, касающихся элементов иода и железа. Множители 1 и 2 являются искомыми коэффициентами. Поскольку элементы изменили степень окисления полностью (в правой части схемы эти элементы ни в одном веществе не проявляют такую же степень окисления, как в исходном веществе) и разными являются индексы элементов в формуле исходного вещества и продукта реакции, поэтому ставим коэффициент 1 (который обычно не пишем), поскольку относится к двум атомам иода, перед формулой иода I2 и коэффициент 2, поскольку относится к одному атому железа, перед формулой сульфата железа FeSO4. Подбираем коэффициенты для остальных соединений.
В приведённой реакции иодид калия— восстановитель (за счёт атомов иода в степени окисления -1), а сульфат железа (III) (за счёт атомов железа в степени окисления +2) — окислитель.
б) NaBr + Cl2 ⟶ NaCl + Br2;
2NaBr + Cl2 = 2NaCl + Br2
Схема окислительно-восстановительной реакции.
NaBr-1 + Cl20 ⟶ NaCl-1 + Br20
2Br-1 -2ē ⟶ Br20 |2|2|1 ― процесс окисления
Cl20 + 2ē ⟶ 2Cl-1 |2| |1 ― процесс восстановления
Проводим вертикальную черту и пишем за ней число электронов, которые отдали и присоединили атомы брома и хлора. Находим наименьшее общее кратное для чисел 2 и 2. Это число 2, которое записываем за второй вертикальной чертой посередине, и поделив его поочередно на 2 и 2, записываем результат за третьей чертой в строках, касающихся элементов брома и хлора. Множители 1 и 1 являются искомыми коэффициентами. Поскольку элементы изменили степень окисления полностью (в правой части схемы эти элементы ни в одном веществе не проявляют такую же степень окисления, как в исходном веществе) и разными являются индексы элементов в формуле исходного вещества и продукта реакции, поэтому ставим коэффициент 1 (который обычно не пишем), поскольку относится к двум атомам, перед формулой брома Br2 и хлора Cl2. Подбираем коэффициенты для остальных соединений.
В приведённой реакции бромид натрия — восстановитель (за счёт атомов брома в степени окисления -1), а хлор — окислитель.
в) KBr + MnO2 + H2SO4 ⟶ Br2 + K2SO4 + MnSO4 + H2O
2KBr + MnO2 + 2H2SO4 = Br2 + K2SO4 + MnSO4 + 2H2O
Схема окислительно-восстановительной реакции.
KBr-1 + Mn+4O2 + H2SO4 ⟶ Br20 + K2SO4 + Mn+2SO4 + H2O
2Br-1 -2ē ⟶ Br20 |2|2|1 ― процесс окисления
Mn+4 +2ē ⟶ Mn+2 |2| |1 ― процесс восстановления
Проводим вертикальную черту и пишем за ней число электронов, которые отдали и присоединили атомы брома и марганца. Находим наименьшее общее кратное для чисел 2 и 2. Это число 2, которое записываем за второй вертикальной чертой посередине, и поделив его поочередно на 2 и 2, записываем результат за третьей чертой в строках, касающихся элементов брома и марганца. Множители 1 и 1 являются искомыми коэффициентами. Поскольку элементы изменили степень окисления полностью (в правой части схемы эти элементы ни в одном веществе не проявляют такую же степень окисления, как в исходном веществе) и одинаковыми являются индексы элемента марганца в формуле исходного вещества и продукта реакции, поэтому ставим коэффициент 1 (который обычно не пишем) перед формулой двух соединений марганца (MnO2, MnSO4), а разными являются индексы элемента брома в формуле исходного вещества и продукта реакции, поэтому ставим коэффициент 1, поскольку относится к двум атомам брома, перед формулой брома Br2. Подбираем коэффициенты для остальных соединений.
В приведённой реакции бромид калия (за счёт атомов брома в степени окисления -1) — восстановитель , а оксид марганца (IV) (за счёт атомов марганца в степени окисления +4) — окислитель.
Задание 8
При обработке 5,30 г смеси хлорида натрия и карбоната натрия избытком соляной кислоты выделилось 784 мл газа (н.у.). Рассчитайте массовые доли компонентов в смеси.
Дано: m(смеси)=5,30 г; в смеси соединений только карбонат натрия реагирует из соляной кислотой с образованием углекислого газа, поэтому V(СО2)=784 мл=0,784 л
Найти: w(Na2CO3)-?, w(NaCl)-?
Решение
1 способ
1. Количество вещества углекислого газа объёмом 0,784 л рассчитываем по формуле: n=V/VM, где VM=22,4 л/моль.
n(CO2)=V(CO2)/VM=0,784 л : 22,4 л/моль=0,035 моль
2. Составим химическое уравнение:
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
По уравнению реакции n(Na2CO3):n(CO2)=1:1, количества веществ одинаковые, поэтому:
n(Na2CO3)=n(СО2)=0,035 моль
3. Вычисляем массу карбоната натрия количеством вещества 0,035 моль по формуле: m=n•M, где M — молярная масса.
Mr(Na2CO3)=2•Ar(Na)+Ar(C)+3•Ar(O)=2•23+12+3•16=106, поэтому M(Na2CO3)=106 г/моль
m(Na2CO3)=n(Na2CO3)•M(Na2CO3)=0,035 моль •106 г/моль=3,71 г
4. Вычисляем массовую долю карбоната натрия в смеси:
w(Na2CO3)=(m(Na2CO3):m(смеси))•100%=(3,71 г : 5,30 г)•100%=70%
5. Вычисляем массовую долю хлорида натрия в смеси:
w(Na2CO3)=100%-w(Na2CO3)=100%-70%=30%
2 способ
1. Составим химическое уравнение:
х г 0,784 л
Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O
106 г 22,4 л
Над формулами соединений Na2CO3 и CO2 записываем неизвестную массу cоли (х г) и приведенный в условии задачи объём углекислого газа (0,784 л), а под формулами соединений ― массу и объём соответствующего количества вещества согласно коэффициентам в химическом уравнении. При н.у. 1 моль любого газа занимает объём 22,4 л.
Mr(Na2CO3)=2•Ar(Na)+Ar(C)+3•Ar(O)=2•23+12+3•16=106, поэтому M(Na2CO3)=106 г/моль. Масса 1 моль=106 г
х=m(Na2CO3)=106 г • 0,784 л : 22,4 л=3,71 г
2. Вычисляем массовую долю карбоната натрия в смеси, то есть массу карбоната натрия в 100 г смеси:
в 5,30 г смеси содержится 3,71 г Na2CO3, а
в 100 г смеси ― х г Na2CO3
х=3,71 г • 100 г : 5,30 г=70 г, то есть w(Na2CO3)=70%
4. Вычисляем массовую долю хлорида натрия в смеси:
w(Na2CO3)=100%-w(Na2CO3)=100%-70%=30%
Ответ: w(Na2CO3)=70%, w(NaСl)=30%
Задание 9
Молярная масса бромида одновалентного металла на 31% больше, чем молярная масса хлорида этого металла. Что это за металл?
Допустим, что молярная масса M(MeCl) составляет 100%,
тогда по условию задачи M(MeBr) будет составлять 131%.
M(MeBr) : M(MeCl) = 131% : 100%, отсюда по свойству пропорции имеем
M(MeBr) • 100% = M(MeCl) • 131%, поэтому
M(MeBr)=M(MeCl) • 131% : 100%
M(MeBr)=1,31•M(MeCl), поэтому Mr(MeBr)=1,31•Mr(MeCl) (1).
Примем Ar(Me)=х, тогда
Mr(MeBr)=Ar(Me)+Ar(Br)=х+80
Mr(MeСl)=Ar(Me)+Ar(Cl)=х+35,5
и подставим значения в формулу (1), получим алгебраическое уравнение и решим его:
х+80=1,31•(х+35,5)
х+80=1,31х+46,505
1,31х — х = 80 — 46,505
0,31х=33,495
х=33,495:0,31
х=108, то есть Ar(Me)=108. Такую относительную атомную массу имеет металлический одновалентный элемент — серебро Ag
Ответ: серебро
Дополнительное задание
Объём производства соляной кислоты в России составляет 1 млн т в год. Сравните эти данные с объёмом производства соляной кислоты в трёх-четырёх других странах. Результат представьте в виде диаграммы в координатах: объём производства (млн т) — страна. Самостоятельно.
Галогеноводороды
НХ —
соединения с полярной связью. Электронная
пара, осуществляющая химическую связь
Н-X, сильно сдвинута в сторону более
электроотрицательного элемента —
галогена. Поэтому можно условно принять,
что в галогеноводородах атом галогена
имеет завершенную восьмиэлектронную
конфигурацию.
С
позиций метода МО образование молекулы
галогеноводорода на примере HF в некотором
приближении можно изобразить следующим
образом:
H[1s]
+ F[1s22s22p5]
= HF[KK(1CB)2(2HECB)2(1HECB)4(3РАЗР)0]
Вследствие
большой разницы в энергии ls-орбитали
водорода (-13,6 эВ) и 2р-орбитали
атома фтора (-46,4 эВ) 1CB
МО формируется в основном 2s-орбталью
атома фтора. 1s-орбиталь
водорода и 2рz-орбиталь
фтора образуют 2HECB
и 3РАЗР
МО. Таким образом, основной вклад (~90%)
при формировании 1CB
и 2HECB
МО вносят орбитали атома фтора, т.е. эти
МО в большей степени принадлежат фтору,
чем водороду, а электроны, расположенные
на них, практически локализованы на
атоме фтора. Значит, электронная плотность
в молекуле HF
сильно смещена
к атому фтора, а связь Н-F
оказывается полярной: H+—F—.
Орбитали фтора 2рх
и 2ру
по условиям симметрии способны участвовать
в образовании -связей,
но у атома водорода доступных по энергии
и симметрии орбиталей нет. Поэтому две
1-орбитали
остаются несвязывающими. Электроны
заполняют орбиталь 1CB,
обусловливающую связь между атомами
водорода и фтора, 2HECB
и две 1HECB
(шесть электронов на этих трех МО
ослабляют связь водорода с фтором, так
как участвуют в межэлектронном
отталкивании).
В случае НСl
диаграмма МО несколько изменяется. Это
связано с тем, что значения энергии 3s—
и 3p-AO
хлора больше, чем 2s—
и 2p-АО
фтора, и приближаются к энергии 1s-AO
водорода. Поэтому в образование 1CB-MO
HCl
вклад орбитали водорода становится
значительным, а это уменьшает смещение
электронной плотности к атому хлора и
понижает полярность молекулы по сравнению
с HF.
При переходе к НВr
и HI
значения энергии МО увеличиваются,
смешение электронной плотности к атому
галогенов и полярность молекул НХ
уменьшаются.
Поскольку электронная
структура всех галогеноводородов
однотипна, свойства НХ изменяются в
ряду F
— I
монотонно с ростом радиуса, если не
считать особенностей HF,
обусловленных образованием водородной
связи (табл. 17.7).
Таблица 17.7.
Свойства галогеноводородов
|
НХ |
ТПЛ, |
ТКИП, |
Н0298, |
Раствор в воде |
Длина связи Н-Х, |
Диполь-ный момент, |
||
|
Раствори-мость, |
рКа |
Расчет |
Экспери-мент |
|||||
|
HF |
-83,5 |
19,5 |
-271,12 |
Без огра-ничений |
2,95* |
0,917 |
0,40 |
1,86 |
|
HCl |
-114,2 |
-85,1 |
-92,31 |
-450 |
-7 |
1,274 |
0,22 |
1,11 |
|
HBr |
-86,9 |
-67,1 |
-36,40 |
-600 |
-9 |
1,414 |
0,17 |
0,788 |
|
HI |
-51,0 |
-35,1 |
26,48 |
-425 |
-10 |
1,609 |
0,08 |
0,382 |
* Для равновесия
F¯aq
+ HF
HF2¯aq
K
= 2,610-1.
Аномальные
свойства HF
(например,
высокие ТПЛ
и ТКИП,
низкая степень диссоциации в водном
растворе) объясняются повышенной
склонностью фтороводорода к полимеризации.
Даже при ТКИП
безводный фтороводород в парах полностью
димеризован — (HF)2.
С понижением температуры степень
полимеризации n
в (HF)n
возрастает. По способности полимеризоваться
HF
напоминает воду, которая в конденсированном
фазе существует в виде ассоциатов (Н2О)n
(см. разд. 1.3.1.1).
Полимеризация
HF
происходит
вследствие высокой полярности связи
Н+—F—
(из-за очень высокой электроотрицательности
фтора): атомы фтора образуют с атомами
водорода соседних молекул HF
максимально прочные водородные связи,
которые возникают
главным образом в результате
электростатического взаимодействия
одновременно двух атомов водорода с
каждым атомом F и одновременно двух
атомов F c каждым атомом водорода. При
этом плотность положительного заряда
на атоме водорода и отрицательного
заряда на атоме фтора не имеют себе
равных среди молекул гидридов, образованных
другими элементами ПС.
Электростатическая
гипотеза, объясняющая причины образования
водородной связи в HF, однако, плохо
согласуется с установленной
рентгеноструктурным методом
зигзагообразностью полимеризованных
молекул (HF)n.
Угол
HFH в цепях –H—F—H—F—
равен 1200.
Этот факт можно объяснить, если принять,
что в образование водородной связи
вносят свой вклад не только электростатические
силы, но и донорно-акцепторное
взаимодействие ковалентной природы.
Напомним, что электростатическое
взаимодействие не имеет направленного
характера, это свойство присуще только
ковалентным связям. Можно принять, что
-связь
в (HF)n
носит трехцентровый (двухэлектронный)
характер и обусловливает взаимодействие
каждого протона (HF)n
с двумя атомами фтора.
Образованием
водородных связей объясняется
существование кислых фторидов (или
гидрофторидов), не имеющих аналогов
среди солей, производных других
галогеноводородных кислот. В гидрофторидах,
например в NH4HF2
анион HF2¯
содержит два иона фтора, соединенных
симметричной водородной связью, т.е.
оба расстояния Н-F в группировке FH-F
одинаковы. Это довольно редкое явление:
как правило, водородные связи не
симметричны.
Гидрофториды
имеют относительно низкую температуру
плавления. Так, KHF2
плавится при ~2000С,
а средняя соль KF — при ~7000С.
Низкая температура плавления гидрофторидов
ЩЭ — причина их практической важности
для технологии. Например, при электролизе
расплавов фторидов с целью получения
молекулярного фтора экономически
целесообразно использовать KHF2
или KH2F3,
а не KF (см. разд. 17.2.3).
Высокая
диэлектрическая проницаемость жидкого
фтороводорода (
= 83,6 при 00С),
низкая вязкость и широкий температурный
интервал жидкою состояния делают его
хорошим неводным растворителем для
большого числа соединений. Он диссоциирует
по уравнению
3HF
H2F+
+ HF2¯
Ионное
произведение при 00С
([H2F+][HF¯])
= 810-12)
больше, чем у воды (10-14).
Значения
энтальпии образования галогеноводородов
(см. табл. 17.7) указывают на чрезвычайную
прочность
связи Н-F
по сравнению с другими НХ, при этом вклад
водородной связи в нее для HF несуществен
(20 — 30 кДж/моль). Высокая прочность связи
в HF объясняется наложением сильного
электростатического взаимодействия и
достаточно прочной ковалентной связи.
У других галогеноводородов вклад
электростатического взаимодействия
значительно меньше; преобладает
ковалентный характер связи из-за более
легкой деформируемости электронной
оболочки ионов тяжелых галогенов под
влиянием протона.
Как
видно из табл. 17.7, полярность газообразной
молекулы НF существенно выше, чем
полярность молекул других галогеноводородов.
Поэтому можно было бы ожидать, что HF
будет не только лучше других НХ
растворяться в воде, но и образовывать
наиболее сильную из галогеноводородных
кислот. Действительно, растворимость
HF в воде
очень велика: жидкий фтороводород
смешивается с водой в любых соотношениях,
образуя однофазную систему. Однако
фтороводородная кислота уступает по
силе другим галогеноводородным кислотам.
Сила кислот
НХ
в ряду галогенов увеличивается от F к
I, и водный раствор HI является одной из
самых сильных минеральных кислот
(сопоставима с хлорной кислотой НСlО4).
Причина такого изменения кислотных
свойств в ряду галогеноводородных
кислот -увеличение радиуса атомов от F
к I. Если расстояние между атомным ядром
галогена и водорода в газообразных НХ
оценить как сумму радиусов атомов, то
можно было бы ожидать усиления кислотных
свойств с ростом радиуса галогена.
Измерения показывают, однако, что длина
диполя (расстояние между положительным
и отрицательным электрическими центрами
тяжести) и значение дипольного момента
у газообразных галогеноводородов
изменяются обратно пропорционально
межъядерным расстояниям, рассчитанным
как сумма радиусов атомов (см. табл.
17.7). Полярность
молекул газообразных галогеноводородов
максимальна для HF минимальна для HI.
Такой ход изменения величины диполя
связан с резким увеличением деформируемости
электронных оболочек у тяжелых галогенов.
Именно в случае иодоводорода частично
заряженный атом водорода максимально
внедряется в электронную оболочку
галогена (более рыхлую по сравнению с
электронной оболочкой F, Cl,
Вr)
и действительное расстояние между
ядрами водорода и галогена здесь
вследствие сильной поляризации больше
всего отличается от рассчитанного для
ионной модели. С этой точки зрения
иодоводородная кислота должна быть
самой слабой среди НХ.
Однако,
когда
газообразный НХ попадает в полярный
растворитель,
в частности в воду, положение коренным
образом меняется. Диполи воды гидратируют
атом водорода, превращая его в ион
гидроксония [Н3О+]
(или Н3О+nН2О),
и таким образом изолируют протон от
образующегося аниона X¯. При этом протон
и анион галогена уже не поляризуют друг
друга в сколько-нибудь значительной
степени. Взаимодействие катиона Н3О+
и аниона X¯ становится теперь
электростатическим. Но поскольку ионный
радиус I¯ больше, чем у Сl¯
и Вr¯,
то кулоновское взаимодействие между
ионом гидроксония и анионом X¯ оказывается
самым слабым как раз у HI (наибольшее
расстояние между центрами положительно
и отрицательно заряженных ионов). Итак,
несмотря
на наиболее ковалентный характер связи
в газообразном HI, его раствор в воде
представляет собой самую сильную
галогеноводородную кислоту (см.
табл. 17.7).
Кажущаяся
степень электролитической диссоциации
НХ в 0,1 М растворе при 180С
изменяется в ряду галогенов следующим
образом:
|
HX |
HF |
HCl |
HBr |
HI |
|
, |
10 |
92,6 |
93,5 |
95 |
Таким
обратом, относительно мало диссоциирует
только (HF)n,
остальные галогеноводороды — очень
сильные кислоты, и самая сильная —
иодоводородная. Это тем более удивительно,
что молекулярный иод сильнее, чем его
легкие аналоги, проявляет металлические
свойства. Прогнозируя, можно ожидать,
что астат, у которого атомный радиус
больше, чем у иода, будет обладать еще
более ярко выраженными металлическими
свойствами, и ему будет отвечать еще
более сильная, чем HI, бескислородная
кислота HAt. При низких температурах
можно выделить соединения галогеноводородов
с водой НХnН2О,
имеющие вполне определенный состав:
|
НХnН2О |
НFnН2О |
НClnН2О |
|||||
|
n |
1 |
0,5 |
0,25 |
1 |
2 |
3 |
4 |
|
ТПЛ, |
-35,5 |
-75,5 |
-100,4 |
-15,4 |
-17,7 |
-24,9 |
-70 |
|
НХnН2О |
НBrnН2О |
НInН2О |
||||||
|
n |
1 |
2 |
3 |
4 |
6 |
2 |
3 |
4 |
|
ТПЛ, |
— |
—11,3 |
—47,9 (разл.) |
—55,8 |
-88,2 (разл.) |
-43 |
-48 |
-36,5 |
Все
эти гидраты — твердые кристаллические
бесцветные вещества. Их существование
доказывает, что галогеноводороды,
растворяясь в воде, взаимодействуют с
ней химически.
Интересной
особенностью галогеноводородов является
способность к образованию с водой
азеотропных
смесей
(состав
пара и жидкости одинаков),
которые при постоянном давлении кипят
без изменения состава при постоянной
температуре:
|
НХ |
HF |
HCl |
HBr |
HI |
|
ТКИП |
112 |
108,6 |
124,3 |
126,7 |
|
Концентрация |
38 |
20,22 |
47,63 |
56,7 |
Если
перегонке подвергать более разбавленный,
чем азеотроп, раствор НХ, например. 10%-ю
соляную кислоту, то вначале отгоняется
пар, обогащенный водой (концентрация
НСl в жидкости при этом возрастает).
Температура кипения раствора повышается
до тех пор, пока не будет достигнут
азеотропный состав (20,22% HCl). То же
происходит, если перегонке подвергают
более концентрированный, чем азеотроп,
раствор HCl, который можно получить
насыщением воды газообразным HCl при
достаточно низкой температуре (при 00С
концентрация HCl в воде достигает 45,15%).
В этом случае сначала отгоняется пар,
обогащенный HCl (концентрация HCl в жидкости
понижается), а потом (по достижении
содержания HCl, равного 20,22%) — азеотроп.
Перегонку
смесей постоянного состава пытались
объяснять образованием в растворе и
переходом затем в пар химических
соединений, например гидратов
галогеноводородов. Потом, однако,
установили, что в зависимости от давления,
при котором происходит перегонка, состав
азеотропных смесей меняется. Тик,
например, HCl
при 700 мм рт. ст. и 106,420С
перегоняется в виде 20,36%-го раствора;
при 50 мм рт. ст. перегонка происходит
при 48,720С,
а состав азеотропа отвечает содержанию
23,42% HCl.
Этот факт не согласуется с предположением
о перегонке химических соединений как
целого.
Термическая
устойчивость
(реакция 2НХ = Х2
+ Н2)
газообразных галогеноводородов находится
в хорошем соответствии с величинами их
диполей. Хлороводород, в молекулах
которого водород в наименьшей степени
(в ряду HCl
– НВr
— HI) поляризует электронную оболочку X¯
(соединение наиболее ионное среди
перечисленных НХ), при 10000С
диссоциирует только на 0,014%. При тех же
условиях НВr
распадается на 0,5%, a HI — на 33%. Фтороводород
отличается максимальной энергетической
устойчивостью — при 10000С
степень его диссоциации установить не
удалось, настолько она мала.
Можно
показать опытным путем, что HI
действительно мало устойчив к действию
повышенной температуры. Если опустить
в колбу, заполненную газообразным HI,
раскаленную спираль (700 – 8000С),
будет видно, что газ бурно разлагается
— в колбе появляются пары иода. Протекает
реакция 2HI
Н2
+ I2.
Неодинаковые
термическая устойчивость и восстановительная
активность
НХ (уменьшающаяся с падением размера
атома и ростом электроотрицательности)
обусловливают специфику способов
получения галогеноводородов.
Газообразный
HCl
в
лаборатории
обычно получают обработкой NaClКРИСТ
концентрированной H2SO4.
При контакте реагентов содержимое
сосуда вспенивается. Над сосудом
появляется белый дым — это НСl
образует c
парами воды капельки соляной кислоты:
NaCl
+ H2SO4
= NaHSO4
+ HCl.
Если
попробовать таким же способом получить
НВr
и для этого обработать NaBrКРИСТ
концентрированной серном кислотой, то
в первый момент реакция идет так же, как
в предыдущем случае: выделяется бесцветный
бромоводород. Но через несколько секунд
содержимое сосуда становится темно-бурым
— наряду с НВr
здесь получается бром:
2NaBr
+ 3H2SO4
= Br2
+ 2NaHSO4
+ SO2
+ 2H2O.
При
действии H2SO4
на KI сразу образуется продукт, окрашенный
молекулярным иодом в темно-бурый цвет:
4KI
+ 5H2SO4
= 4KHSO4
+ H2S
+ 2H2O.
Таким
образом, серная кислота, окисляя атомы
I-1
и Вr-1,
сама восстанавливается до соединений
серы со степенью окисления соответственно
-2 (в H2S)
и +4 (в SO2).
Интересно, что такому воздействию
подвергаются не сами галогенид-ионы в
солях NaBr, NaI
и т.д., а именно галогеноводороды,
образующиеся из них на первой стадии.
Следствием
высокой термической устойчивости HCl
и HF
является возможность синтезировать
их
в
промышленности
из соответствующих простых веществ
(механизм — цепная реакция, см. разд.
17.2.2).
Менее
термически устойчивые НВr
и HI
непосредственным синтезом (из-за
сопутствующей ему повышенной температуры)
в чистом виде получить нельзя (см. выше).
Их, как и в лаборатории, получают обычно
путем гидролиза галогенидов фосфора
или действием на бромиды и иодиды ЩЭ
неокисляющих кислот, например
ортофосфорной. Так, для получения
газообразного НВr
используют следующие реакции:
2Р
+ 3Вr2
+ 6Н2О
= 6НВr
+ 2Н3РО3,
КВr
+ Н3РО4
= НВr
+ КН2РО4.
Иодоводород
синтезируют также взаимодействуем иода
с восстановителями — сероводородом или
гидразином:
2I2
+ N2H4
= 4HI + N2.
Галогеноводороды,
будучи кислотами, образуют соли —
галогениды.
В зависимости от величины ионных
радиусов, поляризационной способности
катионов элементов-металлов и
поляризуемости анионов тип связи в
кристаллических галогенидах может
заметно отклоняться от чисто ионного.
В этих случаях наблюдается понижение
температуры плавления по сравнению ТПЛ
прогнозируемой на основании расчета
по ионной модели.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #