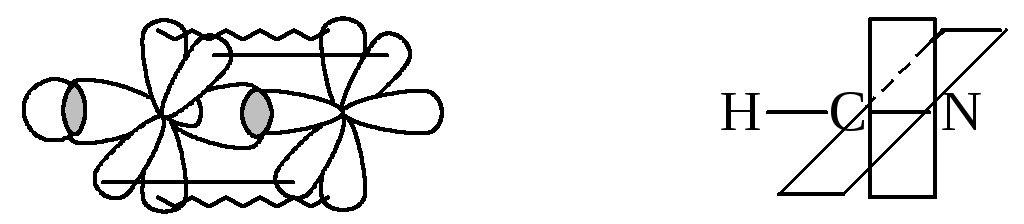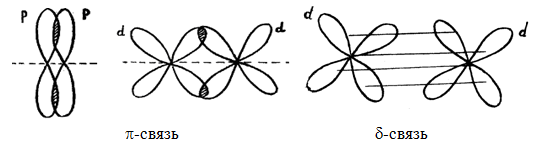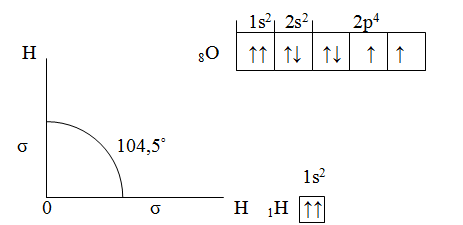Классический метод
ВС не способен объяснить дробный характер
связи, а многие частицы характеризуются
именно такими связями. Был предложен
оригинальный подход к решению этой
проблемы. Реальное распределение связей
в частице представляется как результат
наложения так называемых валентных
схем с различной кратностью связей.
Например, полуторная связь является
результатом наложения двух схем, где в
одной – однократная связь, а в другой
– двойная. Приведём ряд примеров.
В молекуле N2Oхарактеристики связи между атомами
азота соответствуют кратности 2,5; а
связь между атомами азота и кислорода
примерно полуторная. Подобного
распределения связей можно добиться
наложением двух валентных схем:
что приводит к
следующему распределению связей:
Валентные схемы
для нитратного аниона:
В результате
приходим к выводу, что все связи
одинаковые, анион имеет форму правильного
треугольника, кратность связи
азот–кислород равна
:
Именно процедура
наложения валентных схем позволяет
правильно описать строение молекулы
озона:
Изображение
“уголком” призвано отразить наличие
у центрального атома кислорода
неподелённой электронной пары.
Задачи и упражнения
Пример 11.В
следующих молекулах и ионах указать,
сколько связей образовано по
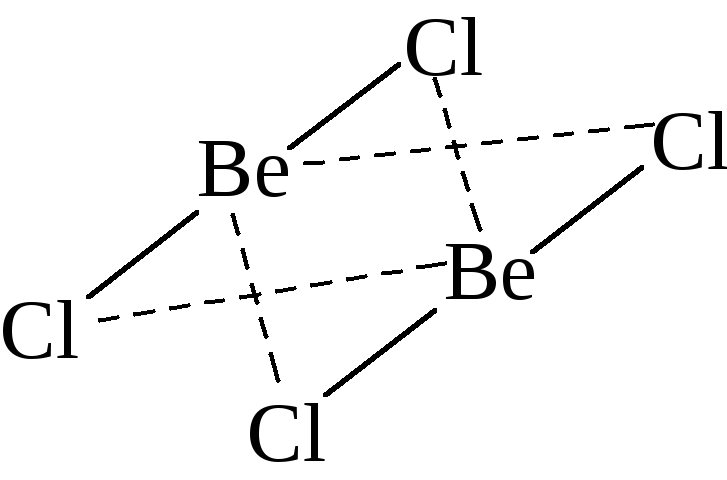
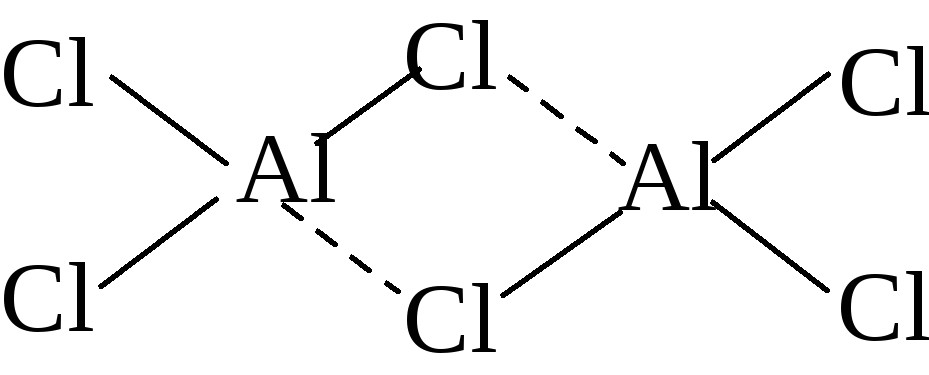
донорно-акцепторному механизму:Be2Cl4;Al2Cl6;NH4+;BF4–;SiF62–.
Решение.Как уже говорилось, представления о
донорно-акцеп-торном взаимодействии
привлекаются для описания химических
связей в тех случаях, когда их число
превышает валентные возможности атомов.
Молекула хлорида
бериллия – линейна, химическая связь
в ней описывается исходя из представлений
об sp-гибридизации орбиталей
центрального атома. В парах это соединение
димеризовано, энергия Гиббса процесса
2 BeCl2(г)Be2Cl4(г)
отрицательна.
Внешний электронный слой атома бериллия
в хлориде заполнен лишь наполовину и
может принять еще две пары электронов
от двух атомов хлора второй молекулы
BeCl2за счет
донорно-акцепторного взаимодействия.
Сказанное справедливо и для второй
молекулыBeCl2:
В результате
суммарное количество связей, образованных
по донорно-акцепторному механизму,
составляет в молекуле Be2Cl4четыре.
Сходная ситуация
наблюдается и в хлориде алюминия: внешний
слой содержит (после образования трех
связей с атомами хлора) шесть электронов
и может принять еще пару электронов по
донорно-акцепторному механизму от атома
хлора второй молекулы хлорида алюминия:
Более того, поскольку
атом алюминия имеет пустые d-орбитали,
можно их заполнить электронными парами
от других атомов хлора:
В результате
приходим к выводу, что при образовании
молекулы Al2Cl6число связей, образованных по
донорно-акцепторному механизму, не
менее двух и не более шести. Первый
вариант объяснения соответствуетsp3-гибридному
состоянию орбиталей атома алюминия
(этот же вариант гибридизации орбиталей
атома бериллия используется для описания
химической связи вBe2Cl4).
Второй –sp3d2-гибридному
состоянию орбиталей атома алюминия.
В ионе аммония
NH4+имеется
одна связь, образованная по
донорно-акцепторному механизму за счёт
свободной электронной пары молекулы
аммиака и пустой 1s-орбитали
протона.
Также одна связь
образована по обсуждаемому механизму
в ионе BF4–, в
этом случае донором электронной пары
является фторидный анион, свободная
электронная пара которого поставляется
на пустую орбиталь атома бора.
В ионе SiF62–две связи образованы по донорно-акцепторному
механизму.
Пример 12.Изобразить схемы перекрывания орбиталей
при образовании связей в молекулахCH3OH;C2H6;C2H4;C2H2;HCN.
Решение.
Для описания химических связей атома
углерода (элемент второго периода) во
всех предлагаемых молекулах используем
гибридные представления.
Для метильной
группы метанола используем представление
об sp3–гибридизации
(четыре партнера по химической связи и
нет свободных пар). ОН-группа, входящая
в состав молекул спиртов и карбоновых
кислот, является “осколком” молекулы
воды, для описания химической связи
которой привлекаются представления оsp3-гибридизации
(рис. 3.6). Отсюда получаем:
Для описания связи
в молекуле этана (два метила), естественно,
используем представления о sp3-гибридизации
орбиталей атомов углерода. В результате
схема перекрывания орбиталей при
образовании связей в этой молекуле
представится двумя тетраэдрами,
соединенными вершинами:
В молекуле этилена
каждый атом углерода связан с тремя
партнерами по химической связи, свободных
электронных пар у них нет; негибридная
р-орбиталь используется для образования
π-связи:
В молекуле ацетилена
у каждого атома углерода два партнёра
по химической связи, свободных электронных
пар нет; две негибридные орбитали
используются для образования двух
π-связей:
Такой же вариант
гибридизации орбиталей атома углерода
используем и для описания связи в
молекуле циановодорода, негибридные
орбитали атома углерода вместе с
р-орбиталями атома азота образуют две
π-связи:
Пример 13.На
основе метода Гиллеспи предскажите
геометрию следующих молекул и ионов:SO2;SO3;PCl3;PCl5;XeF4;O3;BF4–;PF6–.
Решение.SO2;
n=2; ;
AB2E1.
Исходная модель для рассмотрения
молекулыSO2–
правильный треугольник.
Сама молекула
уголковая с углом около 120о.
У атома серы в
молекуле SO3нет
свободных электронных пар:;AB3E0.
Молекула имеет форму правильного
треугольника, в вершинах которого стоят
атомы кислорода, а в центре – атом серы.
У фосфора на внешнем
слое пять электронов, поэтому для PCl3запишемAB3E1;.
Исходной моделью для рассмотрения
геометрии этой молекулы является
тетраэдр, а молекула представляет собой
треугольную пирамиду, в одной из вершин
которой находится атом фосфора:
А вот молекула
PCl5будет симметричной
в силу отсутствия у атома фосфора
свободных (неподелённых) электронных
пар:.
Для неё запишем АВ5E0и сделаем вывод, что указанная молекула
представляет собой тригональную
бипирамиду, в которой расстояния от
атома фосфора до атомов хлора одинаковы:
На внешнем
электронном слое атома ксенона находится
восемь электронов, поэтому для XeF4запишем АВ4E2;.
Таким образом, исходная модель –
октаэдр, возможны два варианта:
III
Первая модель по
энергетическим соображениям представляется
более выгодной, поэтому приходим к
выводу, что молекула XeF4имеет форму квадрата с центром в виде
атома ксенона.
При рассмотрении
молекулы озона следует не забывать, что
у центрального атома кислорода есть
свободная электронная пара, тогда
относительно него запишем: АВ2E1,.
Исходная модель – правильный треугольник,
а молекула озона – уголковая с углом
около 120о.
У атома бора в
анионе BF4–нет свободных электронных пар,n=4;m=0. Ион имеет форму
тетраэдра. Аналогично и у атома фосфора
в анионеPF6–нет свободных электронных пар,n=6;m=0. Анион имеет форму
октаэдра. В этих анионах по одной связи
образовано по донорно-акцепторному
механизму: анионF–поставляет свободную электронную пару
на пустую орбиталь атома бора или фосфора
соответственно.
Пример 14.Какие
из перечисленных молекул являются
полярными:CO2;H2O;SnCl2;CHCl3;PF5;BF3?
Решение.
Молекулы полярны, если их дипольные
моменты не равны нулю. В свою очередь
дипольный момент молекулы представляет
собой векторную сумму дипольных моментов
связей, при этом необходимо учитывать
вклад неподеленных электронных пар.
Таким образом, дипольный момент молекулы
определяется не только полярностью
отдельных связей, но и их расположением
в пространстве, т. е. геометрией молекулы.
Симметричные молекулы, имеющие одинаковые
связи, неполярны и имеют μ=0.
Для ответа на
поставленный вопрос воспользуемся
методом Гиллеспи и определим геометрию
молекул (геометрию связей).
Молекула CO2;n=2;;
линейная молекула. Два вектора дипольных
моментов связей углерод–кислород
одинаковы и противоположно направлены
Следовательно,
μ=0 и молекула неполярна.
Молекула Н2O;n=2;;
исходная модель для рассмотрения
геометрии – тетраэдр; сама же молекула
– уголковая:
Результат сложения
векторов дает положительный дипольный
момент молекулы, кроме того в эту величину
вносят вклад и свободные электронные
пары атома кислорода. В результате
приходим к выводу, что дипольный момент
молекулы воды не равен нулю μ≠0.
Молекула SnCl2;n=2;;
исходная модель для рассмотрения
геометрии – правильный треугольник;
сама же молекула – уголковая. Она будет
полярной.
Молекула хлороформа;
n=4;m=0;
тетраэдрическая молекула с разными
связями, имеющими различные дипольные
моменты, результатом сложения которых
будет ненулевой дипольный момент
молекулы СНCl3.
Молекулы PF5иBF3 симметричны,
в силу симметрии и одинаковости связей
они не будут полярными:
PF5;n=5;m=0;
тригональная бипирамида; μ=0:
BF3;n=3;m=0;
правильный треугольник; μ=0:
Пример 15.На
основе следующих данных определить
стандартную энтальпию связи С–С в
молекуле этана:
1) ΔНообрС2Н6(г) = ΔНо1=
–84,7 кДж/моль,
2) Н2(г) =
2Н (г); ΔНо2= 436,0 кДж,
3) С(к, графит) = С
(г); ΔНо3= 715,1 кДж/моль,
4) ΔНоС–Н= ΔНо4= 415,6 кДж/моль
Решение.Запишем исходные данные в виде
соответствующих термохимических
уравнений.
1) 2С(к, графит) + 3Н2
(г)= С2Н6
(г); ΔНо1,
2) Н2
(г) = 2Н (г); ΔНо2,
3) С(к, графит) = С
(г); ΔНо3
Основой для
нахождения искомой величиныΔНоС–C
является уравнение процесса диссоциации
1 моль газообразного этана на атомы:
5) С2Н6
(г) = 2С (г) + 6Н (г);ΔНо5,
При осуществлении
этого процесса разрывается связь С–С
и шесть связей С–Н. Таким образом,
ΔНо5
=ΔНоС–С
+ 6ΔНоС–Н
Термохимическое
уравнение 5) получается сложением
утроенного второго уравнения с удвоенным
третьим и вычитанием из полученной
суммы первого термохимического уравнения:
ΔНо5
= 3ΔНо2
+ 2ΔНо3
– ΔНо1
= 2822,9 кДж
Тот же результат
можно получить, воспользовавшись первым
следствием из закона Гесса и обратив
внимание на то, что ΔНо2
есть удвоенная стандартная энтальпия
образования атомарного водорода, а ΔНо3
– стандартная
энтальпия образования газообразного
углерода:
ΔНо5
= 6ΔНообрН(г)
+2ΔНообрС(г)
–ΔНообрС2Н6(г)
= 3ΔНо2+2ΔНо3–ΔНо1
Найдя ΔНо5
и зная стандартную энтальпию связи С–Н,
находим стандартную энтальпию связи
С–С в этане:
ΔНоС–С
= ΔНо5
– 6ΔНоС–Н
= 329,3 кДж/моль связи
Пример 16.По
справочным данным вычислить среднюю
стандартную энтальпию связиC–ClвCCl4и связи С=О в
СО2.
Решение.Термохимические уравнения изучаемых
процессов:
СCl4(г) = С (г) + 4Cl (г); ΔНо1,
СO2(г) = С (г) + 2O (г); ΔНо2
По следствию из
закона Гесса находим:
ΔНо1= 4ΔНообрCl(г)
+ ΔНообрС(г) – ΔНообрСCl4(г)
= 1302,6 кДж;
ΔНо2= 2ΔНообрO(г)
+ ΔНообрС(г) – ΔНообрСO2(г)
= 1607,0 кДж
Находим искомые
величины:
ΔНоср
С–Сl= ΔНо1/ 4 = 325,7 кДж/моль связи;
ΔНоср
С=O= ΔНо2/ 2 = 803,5 кДж/моль
связи
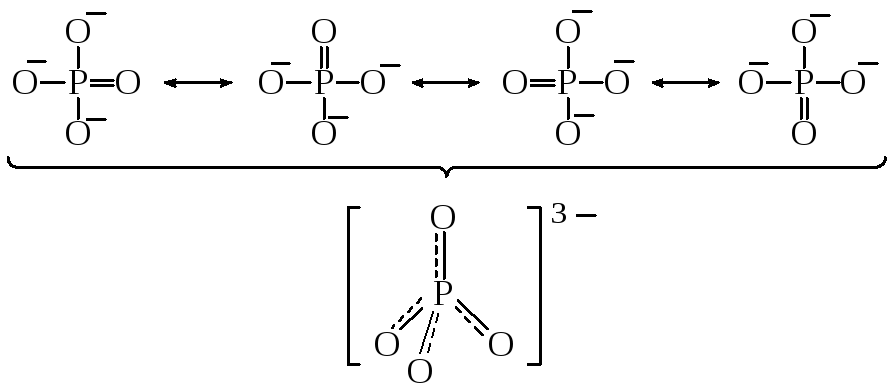
Пример 17.Изобразить валентные схемы для следующих
молекул и ионов, позволяющие объяснить
дробную кратность связей:SO3;O3;PO43–;ClO4–.
Решение.Характеристики связи сера–кислород в
молекулеSO3указывают
на кратность связи ниже двух. Этот факт
может быть объяснён привлечением к
рассмотрению валентных схем с однократной
связью, например:
Результатом
наложения будет молекула, имеющая форму
правильного треугольника с кратностью
связи
:
Если же необходимо
объяснять ещё меньшую кратность связи,
то следует включить в рассмотрение
валентные схемы с двумя однократными
связями сера–кислород и т.д.
Строение молекулы
озона можно представить как результат
наложения двух валентных схем:
Уголковая геометрия
молекулы связана с тем, что у центрального
атома кислорода есть одна свободная
электронная пара.
Очевидно, строение
иона PO43–можно описать результатом наложения
четырёх валентных схем:
Фосфат-ион имеет
форму тетраэдра, кратность связи
фосфор–кислород составляет
.
Аналогичное
тетраэдрическое строение имеет и анион
ClO4–, описываемый
также как результат наложения четырёх
валентных схем:
Кратность связи
хлор–кислород составляет
.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
…
Метод валентных связей
Метод валентных связей (локализованных электронных пар) предполагает, что каждая пара атомов в молекуле удерживается вместе при помощи одной или нескольких общих электронных пар.
Поэтому химическая связь представляется двухэлектронной и двухцентровой, т.е. локализована между двумя атомами. В структурных формулах соединений обозначается черточкой:
H-Cl, H-H, H-O-H
Рассмотрим в свете Метода ВС, такие особенности связи, как насыщаемость, направленность и поляризуемость.
Образование сигма-, пи- и дельта-связей
Валентность атома — определяется числом неспаренных (валентных) электронов, способных принять участие в образовании химической связи.
Валентность выражается небольшими целыми числами и равна числу ковалентных связей. Валентность элементов, проявляющуюся в ковалентных соединениях, часто называют ковалентностью.
Некоторые атомы имеют переменную валентность, например углерод в основном состоянии имеет 2 неспаренных электрона и будет двух валентен. При возбуждении атома, возможно распарить другие два спаренных электрона и тогда атом углерода станет четырех валентен:
Возбуждение атома до нового валентного состояния требует затраты энергии, которая компенсируется выделяемой при образовании связей энергией.
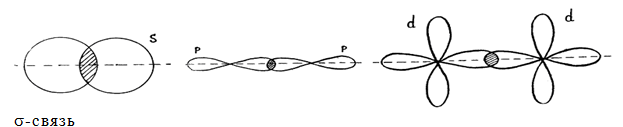
Взаимное перекрывание облаков, т.е. образование связи может происходить разными способами, ввиду их различной формы. Различают σ-, π- и δ-связи.
Как различить сигма-, пи- и дельта-связи?
Сигма – связи образуются при перекрывании облаков вдоль линии, проходящей через ядра атомов.
Пи – связи возникают при перекрывании облаков по обе стороны от линии, соединяющей ядра атомов.
Дельта – связи осуществляются при перекрывании всех четырех лопастей d – электронных облаков, расположенных в параллельных плоскостях.
σ– связь может возникнуть при перекрывании вдоль линии, соединяющей ядра атомов в следующих орбиталей:
s — s -, s — р-, р – р-, d — d -орбиталей , а также d — s-, d — р– орбиталей.
σ– связь обладает свойствами локализованной двухцентровой связи, каковой она и является.
π– связь может образовываться при перекрывании по обе стороны от линии, соединяющей ядра атомов следующих орбиталей:
р — р-, р — d-, d — d-, f — p-, f — d— и f — f— орбиталей.
Итак, s— элементы способны к образованию только σ– связи,
р— элементы — σ– и π– связи,
d— элементы — σ–, π– и δ‑ связи,
f— элементы — σ– , π– , δ-связи.
При совместном образовании π– и σ- связей получается двойная связь.
Если же одновременно возникают две π–и σ- связь, то образуется тройная связь.
Количество возникших связей между атомами, называется кратностью связи.
Между двумя атомами может возникнуть только одна сигма-связь.
Направленность ковалентной связи
- При образовании связи с помощью s — орбиталей, ввиду их сферической формы, не возникает какого-либо преимущественного направления в пространстве, для наиболее выгодного образования ковалентных связей.
- В случае же р – орбиталей, электронная плотность распределена неравномерно, поэтому возникает определенное направление, по которому образование ковалентной связи наиболее вероятно.
Гибридизация атомных орбиталей
Рассмотрим пример. Представим, что четыре атома водорода соединились с атомом углерода и образовалась молекула метана CH4.
Рисунок показывает что происходит, но не объясняет, как ведут себя s- и р— орбитали, при образовании таких соединений.
Хотя р— орбиталь имеет две части, развернутые друг относительно друга, но она может образовывать только одну связь. В итоге, можно предположить, что в молекуле метана один атом водорода присоединяется к 2s- орбитали углерода, остальные – к 2р— орбитали.
Тогда, каждый атом водорода будет находиться по отношению к другому под углом 90°, но это не так. Электроны отталкиваются друг от друга и расходятся на большее расстояние.
Что же на самом деле происходит?
Происходит гибридизация атомных орбиталей, в результате которой все орбитали объединяются, перестраиваются и образуют 4 эквивалентные гибридные орбитали, которые направлены к вершинам тетраэдра.
Гибридизация — это смешение различных атомных орбиталей (например, s и p) и образование одинаковых по форме и энергии гибридных орбиталей (например, sp, sp2, sp3).
Типы гибридизации атомных орбиталей
sp3-гибридизация
В нашем примере, каждая из гибридных орбиталей содержит некий вклад 2s- орбитали и некоторые вклады 2р— орбиталей.
Поскольку 4 гибридные орбитали образованы одной 2s— и тремя 2р— орбиталями, то такой способ гибридизации называют sp3-гибридизацией.
Как видно из рисунка, конфигурация гибридных орбиталей позволяет четырем атомам вдорода образовать ковалентные связи с атомом углерода, при этом орбитали будут располагаться относительно друг друга под углом 109,5°.
Такой же тип гибридизации присутствует в таких молекулах, как , например, NH3, H2O.
На одной из sp3-гибридных орбиталей, в молекуле NH3, находится неподеленная электронная пара, а три остальные орбитали используются для соединения с атомами водорода.
В молекуле H2O неподеленными электронными парами заняты две гибридные орбитали атома кислорода, а две другие используются для связывания с атомами водорода.
sp2-гибридизация
Число гибридных орбиталей определяется числом одинарных связей, а также количеством неподеленных электронных пар в молекуле. Эти электроны находятся на гибридных орбиталях. Когда же происходит перекрывание негибридных орбиталей двух атомов, то образуется кратная связь. Например, в молекуле этилена связь реализуется следующим образом:
Плоское расположение трех связей вокруг каждого атома углерода дает основание предположить, что в данном случае имеет место sp2-гибридизация ( гибридные орбитали образованы одной 2s- и двумя 2р— орбиталями). При этом одна 2р— орбиталь остается неиспользованной (негибридной).
Орбитали будут располагаться относительно друг друга под углом 120°.
sp-гибридизация
Таким же образом, в молекуле ацетилена образуется тройная связь. В данном случае происходит sp-гибридизация атомов, т.е. гибридные орбитали образованы одной 2s- и одной 2р— орбиталями, а другие две 2р— орбитали являются негибридными.
Орбитали располагаются относительно друг друга под углом 180°
Ниже в таблице приведены примеры гибридных орбиталей, их геометрическое расположение .
| Набор атомных орбиталей | Набор гибридных орбиталей | Геометрическое расположение гибридных орбиталей |
Примеры |
| s,p | sp | Линейное (угол 180°) |
Be(CH3)2, HgCl2 MgBr2, СаН2, ВаF2, C2H2 |
| s,p,p | sp2 | Плоское тригональное (угол 120°) |
BF3,GaCl3, InBr3,TeI3, C2H4 |
| s,p,p,p | sp3 | Тетраэдрическое (угол 109,5°) |
CH4, AsCl4—, TiCl4, SiCl4, GeF4 |
| s,p,p,d | sp2d | Плоскоквадратнoe (угол 90°) |
Ni(CO)4, [PdCl4]2— |
| s,p,p,p,d | sp3d | Тригонально-бипирамдальное (углы 120° и 90°) |
PF5, PCl5, AsF5 |
| s,p,p,p,d,d | sp3d2 | Октаэдрическое (угол 90°) |
SF6, Fe(CN)63-, CoF63- |
Гибридные орбитали в пространстве располагаются различным образом:
МЕТОД ВАЛЕНТНЫХ СВЯЗЕЙ
Эволюция метода валентных связей
Впервые приближенное решение уравнения Шредингера для одной из простейших молекул — молекулы водорода было произведено в 1927 г. В. Гейтлером и Ф. Лондоном. Эти авторы сначала
рассмотрели систему из двух атомов водорода, находящихся на большом расстоянии друг от друга. При этом условии можно учитывать только взаимодействие каждого электрона со «своим» ядром, а всеми остальными
взаимодействиями (взаимное отталкивание ядер, притяжение каждого электрона к «чужому» ядру, взаимодействие между электронами) можно пренебречь. Тогда оказывается возможным выразить зависимость волновой
функции рассматриваемой системы от координат и тем самым определить плотность общего электронного облака (электронную плотность) в любой точке пространства.
Далее Гейтлер и Лондон предположили, что найденная ими зависимость волновой функции от координат сохраняется и при сближении атомов водорода. При этом, однако, необходимо уже учитывать
и те взаимодействия (между ядрами, между электронами и т. д.), которыми при значительном удалении атомов друг от друга можно было пренебрегать. Эти дополнительные взаимодействия рассматриваются как некоторые
поправки («возмущения») к исходному состоянию электронов в свободных атомах водорода.
В результате были получены уравнения, позволяющие найти зависимость потенциальной энергии Е системы, состоящей из двух атомов водорода, от расстояния r между ядрами этих атомов. При этом
оказалось, что результаты расчета зависят от того, одинаковы или противоположны по знаку спины взаимодействующих электронов. При совпадающем направлении спинов сближение атомов приводит к непрерывному
возрастанию энергии системы. В последнем случае для сближения атомов требуется затрата энергии, так что такой процесс оказывается энергетически невыгодным и химическая связь между атомами не возникает. При
противоположно направленных спинах сближение атомов до некоторого расстояния го сопровождается уменьшением энергии системы. При r = r0 система обладает наименьшей потенциальной энергией,
т.е. находится в наиболее устойчивом состоянии; дальнейшее сближение атомов вновь приводит к возрастанию энергии. Но это и означает, что в случае противоположно направленных спинов электронов образуется
молекула Н2 — устойчивая система из двух атомов водорода, находящихся на определенном расстоянии друг от друга.
Образование химической связи между атомами водорода является результатом взаимопроникновения («перекрывания») электронных облаков, происходящего при сближении взаимодействующих атомов. Вследствие такого
взаимопроникновения плотность отрицательного электрического заряда в межъядерном пространстве возрастает. Положительно заряженные ядра атомов притягиваются к области перекрывания электронных облаков. Это
притяжение преобладает над взаимным отталкиванием одноименно заряженных электронов, так что в результате образуется устойчивая молекула.
Таким образом, проведенное исследование позволило сделать вывод, что химическая связь в молекуле водорода осуществляется путем образования пары электронов с противоположно направленными спинами,
принадлежащей обоим атомам. Разработанная на этой основе теория химической связи и для более сложных молекул получила название метода валентных связей. Важным положением является то, что всякий
раз, когда химическая связь образуется, спины пары электронов должны быть антипараллельными. Это находится в соответствии с принципом Паули и подчеркивает, что при образовании химической связи
электроны переходят в новое квантовое состояние.
Наличие спаренных электронов является «индикатором» наличия химической связи, но не причиной ее образования. Изучение причины образования химической связи к настоящему времени показало, что энергия
системы из двух атомов понижается тогда, когда электроны с большей вероятностью находятся в межъядерном пространстве (как бы «задерживаются» в этой области). Такая задержка приводит к понижению их
кинетической энергии, в результате отрицательная составляющая полной энергии молекулы преобладает, молекула становится устойчивой или, как говорят, образуется химическая связь.
Метод валентных связей дал теоретическое объяснение важнейших свойств ковалентной связи, позволил понять строение большого числа молекул. Хотя этот метод не оказался универсальным и в ряде случаев не в
состоянии правильно описать структуру и свойства молекул, все же он сыграл большую роль в разработке квантово-механической теории химической связи и не потерял своего значения до настоящего времени в
качественном понимании природы химической связи.
Основные положения метода валентных связей
Метод валентных связей описывает механизм возникновения ковалентной связи и базируется на следующих основных принципах:
- Химическая связь между двумя атомами осуществляется за счет одной или нескольких общих электронных пар.
Оба электрона общей электронной пары удерживаются одновременно двумя ядрами, что энергетически более выгодно, чем нахождение каждого электрона в поле «своего» ядра.
Такая химическая связь является двухцентровой.
- При образовании общей электронной пары электронные облака перекрываются; область повышенной электронной плотности между ядрами способствует их притяжению. Чем сильнее перекрывание электронных
облаков (соотношение R1 и R2), тем прочнее химическая связь. - При образовании общей электронной пары спины взаимодействующих электронов должны быть антипараллельны (т.к. электроны с параллельными спинами отталкиваются, и связь не образуется).
- В образовании общих электронных пар по вышеописанному механизму могут участвовать только неспаренные электроны атомов (иначе говоря — только одноэлектронные облака).
Например, изобразим образование молекулы F2 с помощью квантовых ячеек внешнего энергетического уровня (электронная формула атома F:
1s22s22p5):
Спаренные электроны внешнего уровня атома для образования химических связей с другими атомами должны разъединяться (распариваться). Атом перейдет в новое валентное состояние. Затрата энергии на такой
процесс возбуждения атома компенсируется энергией, выделяющейся при образовании химической связи (следует помнить, что возможности возбуждения атомов ограничены числом свободных орбиталей в соответствующих
энергетических подуровнях).
- Ковалентная связь обладает свойством насыщаемости, вследствие чего молекулы имеют вполне определенный состав.
Например, при образовании молекулы метана СН4 каждый из четырех неспаренных электронов возбужденного атома углерода соединился с электроном атома водорода,
образовались 4 ковалентные связи; больше электронных пар в данном случае образоваться не может, молекулы СН5, СН6 и т.д. не существуют.
(Примечание: взаимодействие валентнонасыщенных соединений между собой возможно с образованием одной или нескольких дополнительных донорно-акцепторных связей по особому механизму).
- Ковалентная связь направлена в пространстве, что обусловливает пространственную структуру молекул (свойство направленности).
В зависимости от того, какими электронами осуществляются связи — s-, р-, d- или f-электронами, существенно различны энергии связей, длины связей, а также их направление в пространстве.
Электронные облака имеют различную форму, поэтому их взаимное перекрывание осуществляется несколькими способами: различают σ- (сигма), π- (пи) и δ (дельта)-связи.
Если перекрывание электронных облаков происходит вдоль линии, соединяющей ядра — это σ-связь; если облака перекрываются вне этой линии, возникают π- и δ-связи.
Если между атомами возникла одна общая электронная пара (обычно σ-связь), такая связь называется одинарной, если две и более, то кратной: двойной, тройной.
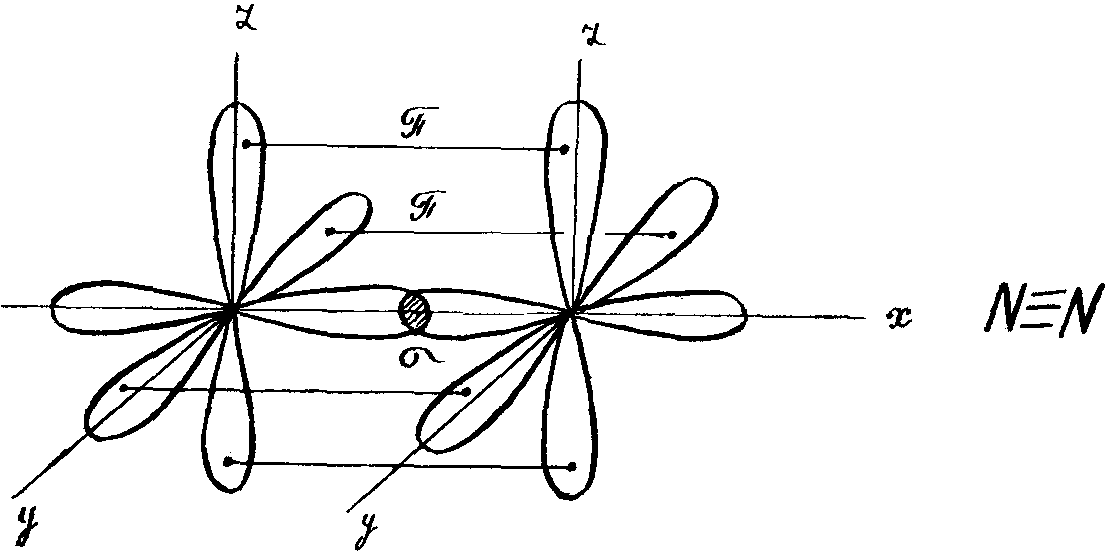
Например, образование молекулы азота N2 осуществляется тремя общими электронными парами. У каждого атома азота в образовании связей участвует 3 неспаренных
р-электрона, направленных в трехмерном пространстве под углом 900 друг к другу и ориентированных соответственно по осям х, у, z (таковы свойства р-подуровня и
р-орбиталей, диктуемые магнитным квантовым числом).
Два атома азота, соединяясь в молекулу N2, могут образовать одну σ-связь (перекрываются облака, ориентированные вдоль оси х) и две π-связи (перекрываются
облака, ориентированные вдоль осей у и z).
Гибридизация атомных орбиталей
Cтруктура молекул зависит прежде всего от вида и свойств тех орбиталей, которые атомы предоставляют для образования химических связей. Но, помимо этого фактора, на пространственное строение молекул
влияет явление гибридизации орбиталей.
Гибридизацией называется образование новых равноценных по форме и энергии орбиталей из орбиталей разного типа. Смешанные, гибридные орбитали на схемах изображают условно:
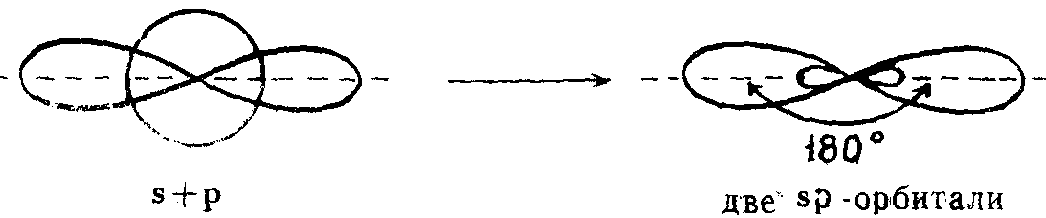
sp-гибридизация
Из одной s-орбитали и одной р-орбитали образуются две гибридные, смешанные орбитали sp-типа, направленные по отношению друг к другу на 180°.
Например: линейную форму имеют молекулы ВеН2 и SnCl2 с sp-гибридизацией атома бериллия и олова соответсвенно.
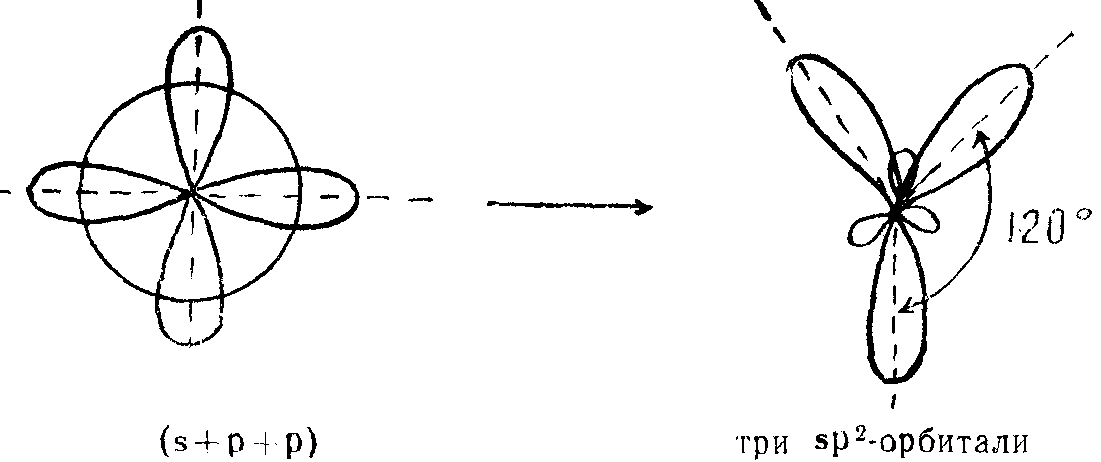
sp2-гибридизация
Из одной s-орбитали и двух р-орбиталей образуются три sp2-гибридные орбитали, расположенные в одной плоскости под углом 120° друг к другу.
Взаимная ориентация трех sp2-гибридных орбиталей — тригональная. Концепцию sp2-гибридизации применяют для описания плоских молекул тригональной формы.
Например: молекула фторида алюминия A1F3. Возбуждение атома алюминия сопровождается распариванием s2-электронов внешнего уровня на p-подуровень.
Следовательно, электронная конфигурация внешнего уровня атома алюминия в возбужденном состоянии — 3s13p2. Заселенные электронами орбитали атома алюминия гибридизируются и
ориентируются в одной плоскости под углом 120° друг к другу. Каждое из трех электронных облаков гибридных sp2-орбиталей перекрывается с электронными облаками p-орбиталей трех
атомов фтора.
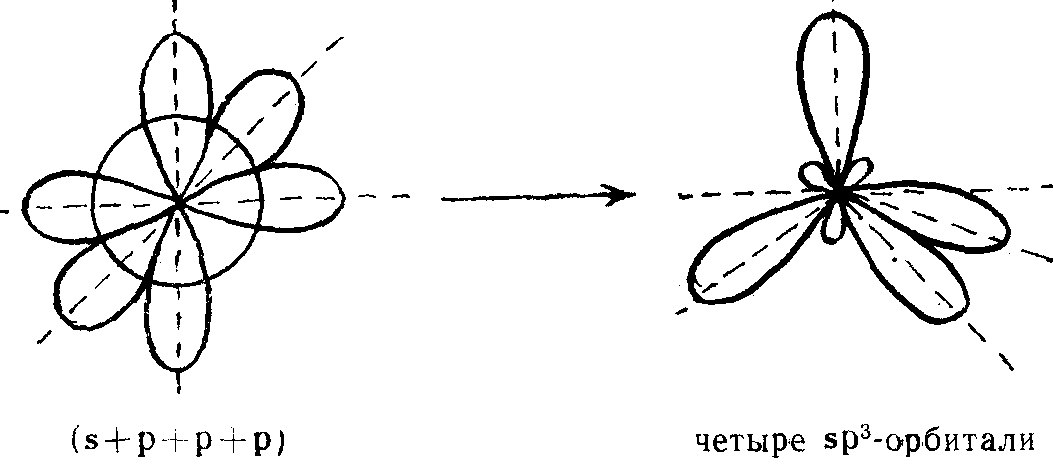
sp3-гибридизация
sp3-гибридизация имеет место, если объединяются одна s-орбиталь и три р-орбитали; образуются четыре sp3-гибридные орбитали, ориентированные уже не в
одной плоскости, а в объеме тетраэдра и направленные от центра тетраэдра к его 4 вершинам; валентный угол между двумя химическими связями составляет 109°28′.
Например: строение молекулы метана СН4. Атом углерода в возбужденном состоянии имеет четыре неспаренных электрона: один s- и три р-электрона. Казалось
бы, четыре химические связи, образованные ими с s-электронами четырех атомов водорода, должны быть неравноценными. Однако экспериментально установлено, что все 4 связи в молекуле СН4
совершенно идентичны по длине и энергии, а углы между связями составляют 109°28′. Следовательно, в молекуле СН4 имеет место sp3-гибридизация.
Возможны более сложные случаи гибридизации с участием d-электронов, (например, sp3d2 — гибридизация).
Явление гибридизации, т.е. смешения, выравнивания электронной плотности, энергетически выгодно для атома, поскольку у гибридных орбиталей происходит более глубокое перекрывание и образуются более
прочные химические связи. Небольшие затраты энергии на возбуждение атома и гибридизацию орбиталей с избытком компенсируются энергией, выделяющейся при возникновении химических связей. Валентные углы
диктуются соображениями максимальной симметрии и устойчивости.
На гибридных орбиталях, как и на обычных орбиталях, может располагаться не только по одному электрону, но и по два. Например, четыре sp3-гибридные орбитали атома кислорода О
таковы, что две из них содержат по паре электронов, а две — одному неспаренному электрону. С современных позиций строение молекулы воды рассматривается с учетом гибридизации орбиталей атома О и
тетраэдрической структуры молекулы Н2O в целом.
Валентность по обменному механизму метода
Способность атома присоединять или замещать определенное число других атомов с образованием химических связей называется валентностью. Согласно обменному механизму метода
валентных связей каждый атом отдает на образование общей электронной пары (ковалентной связи) по одному неспаренному электрону. Количественной мерой валентности в обменном механизме метода валентных связей
считают число неспаренных электронов у атома в основном или возбужденном состоянии атома. Это неспаренные электроны внешних оболочек у s- и p-элементов, внешних и предвнешних оболочек у
d-элементов, внешних, предвнешних и предпредвнешних оболочек у f-элементов.
При образовании химической связи атом может переходить в возбужденное состояние в результате разъединения пары (или пар) электронов и переходе одного электрона (или нескольких электронов, равных числу
разъединенных пар) в свободную орбиталь той же оболочки.
Например: электронная конфигурация кальция в основном состоянии записывается как:
1s22s22p63s23p64s2
В соответствии с обменным механизмом метода валентных связей валентность его равна нулю В=0. У атома кальция в четвертой оболочке (n=4) имеются вакантные р-орбитали. При возбуждении
атома происходит распаривание электронов и один из 4s-электронов переходит в свободную 4р-орбиталь. Валентность кальция в возбужденном состоянии равна двум, т.е. при распаривании валентность
увеличивается на две единицы:
В отличие от кислорода и фтора, электронные пары которых не могут разъединяться, так как во второй оболочке нет вакантных орбиталей, электронные пары атомов серы и хлора могут распариваться в вакантные
орбитали 3d-подоболочки, соответственно сера кроме валентности основного состояния 1 и 2 , имеет еще валентности 4 и 6 в возбужденном состоянии, а хлор кроме валентности 1 в основном состоянии,
имеет валентности 3, 5 и 7 в возбужденном состоянии.
Электронные конфигурации атомов некоторых злементов в основном и возбужденном состояниях
| Элемент | Основное состояние | Возбужденное состояние | ||||||||
| Электронная конфигурация |
Заполнение орбиталей | Валентность | Электронная конфигурация |
Заполнение орбиталей | Валентность | |||||
| s | p | d | s | p | d | |||||
| Водород | 1s1 |  |
1 | |||||||
| Гелий | 1s2 |  |
0 | |||||||
| Бериллий | 2s2 |  |
 |
0 | 2s12p1 |  |
 |
2 | ||
| Углерод | 2s22p2 |  |
 |
1,2 | 2s12p3 |  |
 |
1,2,4 | ||
| Кислород | 2s22p4 |  |
 |
1,2 | ||||||
| Фтор | 2s22p5 |  |
 |
1 | ||||||
| Сера | 3s23p4 |  |
 |
 |
1,2 | 3s13p33d2 |  |
 |
 |
1,2,4,6 |
| Хлор | 3s23p5 |  |
 |
 |
1 | 3s13p33d3 |  |
 |
 |
1,3,5,7 |
У атомов большинства d- и f-элементов на внешних оболочках в основном состоянии нет неспаренных электронов, поэтому их валентность в основном состоянии равна нулю, несмотря на то, что на
предвнешних d- и f-подоболочках имеются неспаренные электроны. Последние не могут образовывать электронные пары с электронами других атомов, так как закрыты электронами внешней оболочки. При
возбуждении атома распаренные электроны внешней оболочки вступают в химическую связь и открывают внутренние электронные оболочки.
Например: валентность железа в основном состоянии равна нулю:
В возбужденном состоянии происходит разъединение 4s-пары электронов:
Валентность железа в возбужденном состоянии определяется не только 4s-, 4p-, но и 3d-неспаренными электронами. Однако пара 3d-электронов не может разъединиться, потому что в
третьей оболочке нет вакантных орбиталей, поэтому максимальная валентность железа равна шести.
У осмия при возбуждении могут разъединяться не только внешние 6s-электроны, но и предвнешние 5d-электроны, поскольку в пятой оболочке имеется еще 5f-подоболочка со свободными
орбиталями, поэтому максимальная валентность осмия равна восьми:
МЕТОД ВАЛЕНТНЫХ СВЯЗЕЙ
Метод валентных связей (МВС, ВС).
Глава 4. Химическая связь и строение молекул
Для глубокого понимания сущности ковалентной связи, характера распределения электронной плотности в молекуле, принципов построения молекул простых и сложных веществ необходим метод валентных связей (ВС, МВС).
Метод валентных связей описывает механизм возникновения ковалентной связи и базируется на следующих основных принципах:
1. Химическая связь между двумя атомами осуществляется за счет одной или нескольких общих электронных пар.
Оба электрона общей электронной пары удерживаются одновременно двумя ядрами, что энергетически более выгодно, чем нахождение каждого электрона в поле «своего» ядра.
Такая химическая связь является двухцентровой.
2. При образовании общей электронной пары электронные облака перекрываются; область повышенной электронной плотности между ядрами способствует их притяжению. Чем сильнее перекрывание электронных облаков (соотношение R1 и R2), тем прочнее химическая связь (рис. 11).
3. При образовании общей электронной пары спины взаимодействующих электронов должны быть антипараллельны (т.к. электроны с параллельными спинами отталкиваются, и связь не образуется).
Рис. 11. Перекрывание электронных облаков
4. В образовании общих электронных пар по вышеописанному механизму могут участвовать только неспаренные электроны атомов (иначе говоря – только одноэлектронные облака). Например, изобразим образование молекулы F2 с помощью квантовых ячеек внешнего энергетического уровня (электронная формула атома F: 1s22s22p5):
Спаренные электроны внешнего уровня атома для образования химических связей с другими атомами должны разъединяться (распариваться). Атом перейдет в новое валентное состояние. Затрата энергии на такой процесс возбуждения атома компенсируется энергией, выделяющейся при образовании химической связи (следует помнить, что возможности возбуждения атомов ограничены числом свободных орбиталей в соответствующих энергетических подуровнях).
5. Ковалентная связь обладает свойством насыщаемости, вследствие чего молекулы имеют вполне определенный состав.
Например, при образовании молекулы метана СН4 каждый из четырех неспаренных электронов возбужденного атома углерода соединился с электроном атома водорода, образовались 4 ковалентные связи; больше электронных пар в данном случае образоваться не может, молекулы СН5, СН6 и т. д. не существуют.
(Примечание: взаимодействие валентнонасыщенных соединений между собой возможно с образованием одной или нескольких дополнительных донорно-акцепторных связей по особому механизму).
6. Ковалентная связь направлена в пространстве, что обусловливает пространственную структуру молекул (свойство направленности).
В зависимости от того, какими электронами осуществляются связи – s-, р-, d- или f- электронами, существенно различны энергии связей, длины связей, а также их направление в пространстве.
Электронные облака имеют различную форму, поэтому их взаимное перекрывание осуществляется несколькими способами: различают — (сигма), — (пи) и (дельта)-связи.
Если перекрывание электронных облаков происходит вдоль линии, соединяющей ядра – это -связь; если облака перекрываются вне этой линии, возникают — и -связи. Разновидности связи при комбинировании s-, р- и d-орбиталей показаны на рисунках:
Если между атомами возникла одна общая электронная пара (обычно -связь), такая связь называется одинарной, если две и более, то кратной: двойной, тройной.
Например, образование молекулы азота N2 осуществляется тремя общими электронными парами. У каждого атома азота в образовании связей участвует 3 неспаренных р-электрона, направленных в трехмерном пространстве под углом 900 друг к другу и ориентированных соответственно по осям х, у, z (таковы свойства р-подуровня и р-орбиталей, диктуемые магнитным квантовым числом).
Два атома азота, соединяясь в молекулу N2, могут образовать одну -связь (перекрываются облака, ориентированные вдоль оси х) и две -связи (перекрываются облака, ориентированные вдоль осей у и z).
Угловая конфигурация молекулы воды Н2O, определяющая ее высокую полярность и особенности свойств, связана с направлением в пространстве двух химических -связей, в образовании которых участвовали два неспаренных р-электрона атома кислорода и по одному s-электрону атомов водорода.
Исходный угол в 90° между двумя р-орбиталями атома О увеличивается за счет взаимного отталкивания атомов Н, несущих избыток положительного заряда (вследствие смещения электронной плотности от Н к О).
Итак, структура молекул зависит прежде всего от вида и свойств тех орбиталей, которые атомы предоставляют для образования химических связей. Но, помимо этого фактора, на пространственное строение молекул влияет явление гибридизации орбиталей.
Гибридизацией называется образование новых равноценных по форме и энергии орбиталей из орбиталей разного типа. Смешанные, гибридные орбитали на схемах изображают условно:
Из одной s-орбитали и одной р-орбитали образуются две гибридные, смешанные орбитали sp-типа, направленные по отношению друг к другу на 180°
Из одной s-орбитали и двух р-орбиталей образуются три sp2-гибридные орбитали, расположенные в одной плоскости под углом 120° друг к другу:
sp3-гибридизация имеет место, если объединяются одна s-орбиталь и три р-орбитали; образуются четыре sp3-гибридные орбитали, ориентированные уже не в одной плоскости, а в объеме тетраэдра и направленные от центра тетраэдра к его 4 вершинам; валентный угол между двумя химическими связями составляет 109° 28
Возможны более сложные случаи гибридизации с участием d-электронов, (например, sp3d 2 — гибридизация).
Явление гибридизации, т.е. смешения, выравнивания электронной плотности, энергетически выгодно для атома, поскольку у гибридных орбиталей происходит более глубокое перекрывание и образуются более прочные химические связи. Небольшие затраты энергии на возбуждение атома и гибридизацию орбиталей с избытком компенсируются энергией, выделяющейся при возникновении химических связей. Валентные углы диктуются соображениями максимальной симметрии и устойчивости.
Примером sp3-типа гибридизации служит строение молекулы метана СН4. Атом углерода в возбужденном состоянии имеет четыре неспаренных электрона: один s- и три р-электрона. Казалось бы, четыре химические связи, образованные ими с s-электронами четырех атомов водорода, должны быть неравноценными. Однако экспериментально установлено, что все 4 связи в молекуле СН4 совершенно идентичны по длине и энергии, а углы между связями составляют 109°28. Следовательно, в молекуле СН4 имеет место sp3-гибридизация.
Другие примеры гибридизации: BeH2(sp-), BF3 (sp-2), РСl5(sp3d-) и др.
На гибридных орбиталях, как и на обычных орбиталях, может располагаться не только по одному электрону, но и по два. Например, четыре sp3-гибридные орбитали атома кислорода О таковы, что две из них содержат по паре электронов, а две – одному неспаренному электрону. С современных позиций строение молекулы воды рассматривается с учетом гибридизации орбиталей атома О и тетраэдрической структуры молекулы Н2O в целом.