Химическими источниками тока называют
устройства, в которых химическая энергия
пространственно разделенных
окислительно-восстановительных реакций
преобразовывается в электрическую.
Электрическая энергия возникает при
замыкании электродов ХИТ
на внешнее сопротивление (нагрузку),
благодаря превращению активных веществ,
определенный запас которых создается
в электродах, при изготовлении ХИТ.
По характеру работы ХИТ различают: 1)
первичные источники тока, активные
вещества которых используют однократно;
2) вторичные ХИТ, или аккумуляторы, у
которых израсходованные при разряде
активные вещества могут быть регенерированы
путем заряда от внешнего источника
постоянного тока; 3) топливные элементы,
или электрохимические генераторы, для
непрерывной работы которых необходимо
обеспечить подвод соответствующих
веществ к электродам ХИТ.
Как всякая электрохимическая система,
ХИТ характеризуется электродвижущей
силой (ЭДС), определяемой
разностью равновесных потенциалов,
соответствующих реакциям, протекающим
на электродах данного источника тока.
Так, при работе серебряно-цинкового
гальванического элемента
Zn|KOH|Ag2O
(рис. 3.1) токообразующие процессы и
соответствующие равновесные потенциалы
для положительного цинкового
и отрицательного серебряного
электродов
могут быть записаны уравнениями:
Ag2O
+ H2O
+ 2
= 2Ag +
2OH—, (3.а)
Zn + 2OH—
= ZnO
+ H2O
+ 2, (3.б)
После сложения частных
электродных реакций получаем суммарную
токообразующую реакцию:
Ag2O
+ Zn = ZnO
+ 2Ag. (3.в)
Рис. 3.1 Схема
серебряно – цинкового гальванического
элемента
ЭДС ХИТ зависит от природы и активности
участников токообразующего процесса
и от температуры и не зависит от
межэлектродных расстояний, размеров
электродов и других конструкционных
параметров ХИТ.
Для характеристики ХИТ обычно применяют
близкое к ЭДС напряжение разомкнутой
цепи Uрц,
представляющее собой разность между
стационарными потенциалами электродов
неработающего ХИТ, которая зависит
также от степени разряженности ХИТ к
моменту измерения Upц.
Ниже будут рассмотрены основные
характеристики ХИТ на примере работы
вторичных источников тока (аккумуляторов).
Напряжение на клеммах работающего ХИТ
зависит от проходящего через
электрохимическую систему электрического
тока, что иллюстрируется так называемыми
вольтамперными кривыми (рис. 3.2). Напряжение
при разряде всегда меньше, а при заряде
(аккумулятора) U3
– больше Uраз
на падение напряжения за счет омических
потерь IR
и поляризации положительного (η+)
и отрицательного (η—) электродов
при работе ХИТ в неравновесных условиях.
Упрощенно это может быть выражено
линейными уравнениями:
Uр = Uрц
— [IрRом
+ (η+ + η—)], (3.1)
U3
= Uрц
+ [IзRом
+ (η+
+ η—)]. (3.2)
Сумма (η+ + η—),
обозначаемая условно как Еп
(напряжение поляризации), пропорциональна
току разряда, либо заряда: Еп
= RпI.
Рис. 3.2 Вольтамперная
характеристика ХИТ
Коэффициент пропорциональности,
называемый сопротивлением поляризации
Rп, имеет
размерность омического сопротивления,
однако в широком интервале изменения
тока Rп не
подчиняется закону Ома. После подстановки
значений Еп в уравнения (3.1) и
(3.2) получим:
Uр = Uрц
— Iр(Rом
+ Rп)
= Uрц
— IpRвн, (3.3)
Uз = Uрц
+ Iз(Rом
+ Rп)
= Uрц
+ IзRвн, (3.4)
где Rвн = Rом
+ Rп — полное
внутреннее сопротивление ХИТ. Таким
образом, при разряде
,
а при заряде
.
На основании рис. 3.2 для данного интервала
нагрузки
,
либо Rвн =
tg, (3.5)
где – угол наклона
касательной к вольтамперной кривой при
силе тока I.
Полное внутреннее сопротивление
возрастает с увеличением степени
разряженности ХИТ (при этом увеличиваются
обе составляющие Rом
и Rп) и
уменьшается с ростом температуры.
Большую роль в формировании требуемых
параметров ХИТ играет поляризация
электродов. Основными причинами ее
возникновения являются:
-
концентрационные изменения в растворе
вблизи поверхности электрода (либо в
твердой фазе) при прохождении тока,
которые вызывают затруднения доставки
активного вещества (диффузионное
перенапряжение или концентрационная
поляризация); -
замедленность собственно электрохимической
реакции, связанная с переходом заряда
через фазовую границу, что требует
повышения разности потенциалов для
активации процесса (электрохимическое
перенапряжение, или активационная
поляризация); -
образование первых зародышей кристаллов
при восстановлении оксидных электродов
до металлов (кристаллизационная
поляризация). -
Пассивация электродов (чаще всего
наблюдаемая при анодном растворении
металлических электродов), связанная
с изменением структуры активной массы
при работе ХИТ, образованием на
поверхности металлов плотных оксидных
слоев, экранирующих и изолирующих ее,
либо с адсорбцией на поверхности
электрода кислорода или других веществ.
При этом электрохимические свойства
электрода могут измениться таким
образом, что скорость реакции (ток)
резко уменьшится, хотя запас активного
вещества еще не исчерпан. Склонность
к пассивации особенно возрастает при
понижении температуры.
В некоторых случаях вследствие увеличения
поляризации электрода (если при помощи
внешних устройств силу разрядного тока
поддерживать постоянной) на запассивированном
электроде может начаться другая реакция,
например, выделение кислорода вместо
анодного растворения металла.
Соответственно уменьшается и разрядное
напряжение ХИТ.
График изменения Uр
за время разряда ХИТ р
и изменения Uз
за время его заряда з
при постоянной силе тока называют
разрядно-зарядной характеристикой
аккумулятора (рис. 3.3). Сняв зарядно-разрядные
кривые, можно определить соответствующие
значения емкости, энергии,
коэффициента полезного действия ХИТ
при его эксплуатации в данном режиме.
Так как перепад значений начального
Uрн и Uрк
напряжений разряда, которые определяются
электрохимической системой ХИТ и
потребителем, может быть достаточно
большим (рис. 3.3), для расчетов используют
средние напряжения разряда Uср.р.
Эту величину определяют либо интегрированием
разрядной кривой (рис. 3.3) от 0 до ,
либо как среднее арифметическое
из n напряжений,
измеренных через равные промежутки
времени.
Рис. 3.3 Зарядно
– разрядная характеристика ХИТ
Напряжение разряда ХИТ зависит от
конструкции, режима разряда, температуры,
технологических особенностей и других
факторов.
Разрядной емкостью Qр
(А·ч) называют количество электричества,
отдаваемое ХИТ во внешнюю цепь при
данных режимах разряда, а зарядной
емкостью Qз –
количество электричества, которое
необходимо сообщить разряженному
аккумулятору для восстановления запаса
активных веществ.
В общем случае
. (3.6)
При конечных значениях времени и
напряжения разряда при Iр
= const
Qр = Iрр, (3.7)
а при R = const
(если разряд ХИТ вести на постоянное
внешнее сопротивление)
или
(3.8)
Емкость, гарантируемая заводом-изготовителем
при нормальном режиме работы ХИТ,
называется номинальной емкостью Qн.
В связи с необходимостью учета саморазряда
ХИТ его фактическая емкость Qср
превышает Qн на
10 – 20%.
Теоретическая емкость Qт
– емкость, которую данный ХИТ мог бы
отдать, если бы коэффициент используемых
активных веществ, участвующих в
токообразующем процессе Киав
был равен 100%. Его рассчитывают по закону
Фарадея: при участии в электрохимической
реакции 1/n молей
вещества может быть получена емкость,
равная 26,8 А·ч (объединенный закон
Фарадея):
Коэффициент использования активных
веществ может быть определен отношением:
Киав = gr
/g, (3.9)
где gr
— количество активного вещества,
принимающего участие в токообразующей
реакции в соответствии с законом Фарадея,
г
gr
= CQ, (3.10)
g – фактически израсходованное
при разряде до Uрк
количество активного вещества, г; C
– электрохимический эквивалент, (г/А·ч):
Значение g превышает
значение gт, что
обусловлено протеканием на электродах
ХИТ побочных процессов, а также тем, что
Uрк ≠ 0. В силу
этих же причин количество электричества,
полученное при разряде заложенной в
ХИТ активной массы, меньше теоретической
емкости, и Киав, который может
быть также рассчитан по уравнению
Киав = Q/Qr (3.11)
как правило, меньше единицы.
Возможность полного использования
активных веществ ограничивается рядом
причин, например, образованием не
проводящих ток продуктов реакции,
закупоркой пор пластин нерастворимыми
соединениями, неравномерным использованием
активных веществ по глубине пластины,
увеличением электросопротивления
электролита и т.п. Также как и емкость,
Киав ХИТ определяется его
конструкцией, режимами эксплуатации и
хранения.
Саморазряд ХИТ – самопроизвольная
потеря емкости при его хранении –
обусловлен протеканием побочных
химических реакций с участием активных
веществ электродов и электролита.
Саморазряд выражают в процентах (долях)
относительного снижения емкости за
время хранения ХИТ τ по уравнению
S =
Q — Qф
/ Q, (2.12)
где Qф – емкость
после хранения ХИТ в течение времени τ
(сутки, месяцы, годы).
Энергия W (Дж или
Вт·ч), отдаваемая ХИТ потребителю при
определенных режимах разряда (либо
потребляемая аккумулятором при его
заряде), может быть рассчитана по
уравнениям:
при Iр(з) =
const Wр(з)
= Qр(з)Uср.р(з)
= Iр(з) р(з)
Uср.р(з), (3.13)
при R =
const Wр
=
(3.14)
Для сравнения энергетических характеристик
различных систем ХИТ используют величины
теоретической удельной энергии
–
энергии, отнесенной к единице массы,
либо объема активных веществ при
коэффициенте их использования, равном
единице. Величина
постоянна для данной электрохимической
системы. Практически получаемая удельная
энергия всегда меньше теоретической и
зависит от конструкции и режима
эксплуатации ХИТ.
Мощность ХИТ Р(Вт) – работа,
производимая за единицу времени, —
определяется уравнением Рр
= IрUср.р,
а теоретическая мощность – уравнением
Рт = IUрц.
Мощность тратится на преодоление
сопротивления внешней цепи (полезная
мощность Рпол) и на преодоление
полного внутреннего сопротивления
самого источника тока. Следовательно,
полезная мощность Рпол = IUрц.
— I2Rвн.
Зависимости Rпол
от R и
Rпол от I
проходят через максимум. Для нахождения
максимальной полезной мощности
следует продифференцировать
Рпол по току (либо по
сопротивлению) и приравнять производную
нулю.
во внешней цепи можно получить при
условии равенства сопротивления внешней
цепи полному внутреннему сопротивлению
ХИТ.
В момент отдачи максимальной полезной
мощности напряжение ХИТ Uрц
= Uрц/2,
а сила тока I =
Uрц /2Rвн.
Удельные характеристики ХИТ
(емкость, энергия или мощность на единицу
массы или объема данного источника
тока) используют для сопоставления
различных ХИТ.
Весьма важными для характеристики ХИТ
являются такие показатели как сохранность
(максимальный срок хранения, после
которого ХИТ еще отдает обусловленную
техническими условиями емкость) и срок
службы (ресурс). Для аккумуляторов
ресурс определяется количеством циклов
заряд — разряд, после которых емкость
снижается не больше, чем на 20 — 25% Qp.
При последовательном соединении ХИТ
в батарею разрядное напряжение батареи
равно сумме Uр
отдельных ее элементов, в то время как
ток разряда (и емкость) батареи определяются
соответствующими величинами отдельного
элемента. При параллельном соединении
ХИТ напряжение на клеммах батареи равно
Uр отдельного
элемента, а Iр
и Qp
соответственно суммируются. Количество
энергии, отдаваемой батареей ХИТ, Wp
= Qp
Uр не зависит
от способа их включения.
Пользуйтесь нашим приложением
Мы используем файлы cookie. Пользуясь сайтом, вы принимаете условия нашего соглашения. Принять Детальнее
Источники тока химические (сокращенно ХИТ) — приспособления, в которых энергия окислительно-восстановительной реакции преобразуется в электрическую. Другие их названия — электрохимический элемент, гальванический элемент, электрохимическая ячейка. Принцип их действия заключается в следующем: в результате взаимодействия двух реагентов происходит химическая реакция с выделением энергии постоянного электрического тока. В прочих источниках тока процесс получения электроэнергии происходит по многоступенчатой схеме. Сначала выделяется тепловая энергия, затем она превращается в механическую и лишь после этого в электрическую. Преимущество ХИТ — одноступенчатость процесса, то есть электричество получается сразу, минуя стадии получения тепловой и механической энергий.
История
Как появились первые источники тока? Химические источники получили название гальванических элементов в честь итальянского ученого восемнадцатого века — Луиджи Гальвани. Он был врачом, анатомом, физиологом и физиком. Одним из направлений его исследований было изучение реакций животных на различные внешние воздействия. Химический способ получения электроэнергии был открыт Гальвани случайно, во время одного из опытов над лягушками. Он подсоединил к оголенному нерву на лягушачьей лапке две металлические пластины. При этом произошло мускульное сокращение. Собственное объяснение этого явления Гальвани было неверным. Но результаты его опытов и наблюдений помогли его соотечественнику Алессандро Вольта в последующих исследованиях.
Вольта изложил в своих трудах теорию возникновения электрического тока в результате химической реакции между двумя металлами при контакте с мускульной тканью лягушки. Первый химический источник тока выглядел как емкость с соляным раствором, с погруженными в него пластинами из цинка и меди.
В промышленных масштабах ХИТ начали производиться еще во второй половине девятнадцатого века, благодаря французу Лекланше, который изобрел первичный марганцево-цинковый элемент с солевым электролитом, названный его именем. Через несколько лет эта электрохимическая ячейка была усовершенствована другим ученым и являлась единственным первичным химическим источником тока до 1940 года.
Устройство и принцип работы ХИТ
Устройство химических источников тока включает в себя два электрода (проводники первого рода) и находящийся между ними электролит (проводник второго рода, или ионный проводник). На границе между ними возникает электронный потенциал. Электрод, на котором происходит окисление восстановителя называют анодом, а тот, на котором происходит восстановление окислителя, — катодом. Вместе с электролитом они составляют электрохимическую систему.
Побочным результатом окислительно-восстановительной реакции между электродами является возникновение электрического тока. Во время такой реакции восстановитель окисляется и отдает электроны окислителю, который их принимает и за счет этого восстанавливается. Присутствие между катодом и анодом электролита является необходимым условием реакции. Если просто смешать между собой порошки из двух разных металлов, никакого выделения электроэнергии не произойдет, вся энергия выделится в виде тепла. Электролит нужен, чтобы упорядочить процесс перехода электронов. Чаще всего в его качестве выступает солевой раствор или расплав.
Электроды выглядят как металлические пластины или решетки. При их погружении в электролит возникает разность электрических потенциалов между ними — напряжение разомкнутой цепи. Анод имеет тенденцию к отдаче электронов, а катод — к их принятию. На их поверхности начинаются химические реакции. Они прекращаются при размыкании цепи, а также когда израсходован один из реагентов. Размыкание цепи происходит при удалении одного из электродов или электролита.
Состав электрохимических систем
Источники тока химические в качестве окислителей используют кислородсодержащие кислоты и соли, кислород, галоиды, высшие оксиды металлов, нитроорганические соединения и т. д. Восстановителями в них являются металлы и их низшие оксиды, водород и углеводородные соединения. Как электролиты используются:
- Водные растворы кислот, щелочей, солевые и т. д.
- Неводные растворы с ионной проводимостью, полученные при растворении солей в органических или неорганических растворителях.
- Расплавы солей.
- Твердые соединения с ионной решеткой, в которой один из ионов подвижен.
- Матричные электролиты. Это жидкие растворы или расплавы, находящиеся в порах твердого непроводящего тела — электроносителя.
- Ионообменные электролиты. Это твердые соединения с фиксированными ионогенными группами одного знака. Ионы другого знака при этом подвижны. Это свойство делает проводимость такого электролита униполярной.
Гальванические батареи
Источники тока химические состоят из гальванических элементов — ячеек. Напряжение в одной из таких ячеек невелико — от 0,5 до 4В. В зависимости от потребности, в ХИТ используют гальваническую батарею, состоящую из нескольких последовательно соединенных элементов. Иногда применяется параллельное или последовательно-параллельное соединение нескольких элементов. В последовательную цепь всегда включают исключительно одинаковые первичные ячейки или аккумуляторы. Они должны иметь одни и те же параметры: электрохимическую систему, конструкцию, технологический вариант и типоразмер. Для параллельного соединения допустимо использование элементов разного типоразмера.
Классификация ХИТ
Химические источники тока отличаются по:
- размеру;
- конструкции;
- реагентам;
- природе энергообразующей реакции.
Эти параметры определяют эксплуатационные свойства ХИТ, подходящие для конкретной области применения.
Классификация электрохимических элементов основана на различии в принципе работы устройства. В зависимости от этих характеристик, различают:
- Первичные химические источники тока — элементы одноразового действия. В них имеется определенный запас реагентов, который расходуется при реакции. После полного разряда такая ячейка теряет работоспособность. По-другому первичные ХИТ называют гальваническими элементами. Верным будет и называть их просто — элемент. Самые простые примеры первичного источника питания — «батарейка» А-А.
- Перезаряжаемые химические источники тока — аккумуляторы (их также называют вторичными, обратимыми ХИТ) являются многоразовыми элементами. Путем пропускания тока от внешней цепи в обратном направлении через аккумулятор после полного разряда израсходованные реагенты регенерируются, вновь накапливая химическую энергию (заряжаясь). Благодаря возможности подзарядки от внешнего постоянного источника тока это устройство используется в течение долгого времени, с перерывами на подзарядку. Процесс выработки электрической энергии называется разрядом аккумулятора. К таким ХИТ можно отнести элементы питания многих электронных устройств (ноутбуки, мобильные телефоны и т. п.).
- Тепловые химические источники тока — приборы непрерывного действия. В процессе их работы происходит непрерывное поступление новых порций реагентов и удаление продуктов реакции.
- В комбинированных (полутопливных) гальванических элементах имеется запас одного из реагентов. Второй подается в устройство извне. Срок работы устройства зависит от запаса первого реагента. Комбинированные химические источники электрического тока используются как аккумуляторы, если есть возможность восстановления их заряда путем пропускания тока от внешнего источника.
- ХИТ возобновляемые перезаряжаются механическим или химическим путем. Для них существует возможность замены после полного разряда израсходованных реагентов на новые порции. То есть они не являются устройствами непрерывного действия, а, подобно аккумуляторам, периодически подзаряжаются.
Характеристики ХИТ
К основным характеристикам химических источников тока относятся:
- Напряжение разомкнутой цепи (НРЦ или разрядное напряжение). Этот показатель, прежде всего, зависит от выбранной электрохимической системы (сочетание восстановителя, окислителя и электролита). Также на НРЦ влияют концентрация электролита, степень разряженности, температура и другое. НРЦ зависит от значения проходящего через ХИТ тока.
- Мощность.
- Ток разряда — зависит от сопротивления внешней цепи.
- Емкость — максимальной количество электричества, которое ХИТ отдает при полном его разряде.
- Энергозапас — максимальная энергия, получаемая при полном разряде устройства.
- Энергетические характеристики. Для аккумуляторов, это, прежде всего, гарантированное количество зарядно-разрядных циклов без снижения емкости или напряжения заряда (ресурс).
- Температурный диапазон работоспособности.
- Срок сохраняемости — максимально допустимый промежуток времени между изготовлением и первым разрядом устройства.
- Срок службы — максимально допустимый общий срок хранения и работы. Для топливных элементов значение имеют сроки службы при непрерывной и прерывистой работе.
- Общая энергия, отдаваемая за весь срок службы.
- Механическая прочность по отношению к вибрации, ударам и т. п.
- Возможность работы в любом положении.
- Надежность.
- Простота в обслуживании.
Требования к ХИТ
Конструкция электрохимических элементов должна обеспечивать условия, способствующие наиболее эффективному протеканию реакции. К этим условиям относятся:
- предотвращение утечек тока;
- равномерная работа;
- механическая прочность (в том числе герметичность);
- разделение реагентов;
- хороший контакт между электродами и электролитом;
- отвод тока от зоны реакции до внешнего вывода с минимальными потерями.
Источники тока химические должны отвечать следующим общим требованиям:
- самые высокие значения удельных параметров;
- максимальный температурный интервал работоспособности;
- самое большое напряжение;
- минимальная стоимость единицы энергии;
- стабильность напряжения;
- сохранность заряда;
- безопасность;
- простота обслуживания, а в идеале отсутствие необходимости в нем;
- длительный срок службы.
Эксплуатация ХИТ
Главное преимущество первичных гальванических элементов — отсутствие необходимости какого-либо обслуживания. Перед началом их использования достаточно провести проверку внешнего вида, срока годности. При подключении важно соблюсти полярность и проверить целостность контактов прибора. Более сложные химические источники тока — аккумуляторы, требуют уже более серьезного ухода. Цель их обслуживания — максимальное продление срока службы. Уход за аккумуляторной батареей заключается в:
- поддержании чистоты;
- контроле напряжения разомкнутой цепи;
- поддержании уровня электролита (для доливки можно использовать только дистиллированную воду);
- контроле концентрации электролита (с помощью ареометра — простого прибора для измерения плотности жидкостей).
При эксплуатации гальванических элементов необходимо соблюдать все требования, относящиеся к безопасному использованию электроприборов.
Классификация ХИТ по электрохимическим системам
Виды химических источников тока, в зависимости от системы:
- свинцовые (кислотные);
- никель-кадмиевые, никель-железные, никель-цинковые;
- марганцево-цинковые, медно-цинковые, ртутно-цинковые, хлорно-цинковые;
- серебряно-цинковые, серебряно-кадмиевые;
- воздушно-металлические;
- никель-водородные и серебряно-водородные;
- марганцево-магниевые;
- литиевые и т. д.
Современное применение ХИТ
Источники тока химические в настоящее время применяются в:
- транспортных средствах;
- переносных приборах;
- военной и космической технике;
- научном оборудовании;
- медицине (электрокардиостимуляторы).
Привычные примеры ХИТ в быту:
- батарейки (сухие батареи);
- аккумуляторные батареи переносных бытовых приборов и электроники;
- источники бесперебойного питания;
- автомобильные аккумуляторы.
Особенно широкое применение получили литиевые химические источники тока. Это связано с тем, что литий (Li) обладает самой высокой удельной энергией. Дело в том, что он отличается самым отрицательным электродным потенциалом среди всех прочих металлов. Литий-ионные аккумуляторы (ЛИА) опережают все прочие ХИТ по величинам удельной энергии и рабочего напряжения. Сейчас они постепенно осваивают новую сферу — автомобильный транспорт. В дальнейшем разработки ученых, связанные с усовершенствованием литиевых элементов питания, будут двигаться в направлении сверхтонких конструкций и крупных сверхмощных аккумуляторных батарей.
Любая батарейка или аккумулятор дает ток за счет протекающих внутри них химических реакций
Химические источники тока (сокращенно ХИТ) – это источники электродвижущей силы (ЭДС), в которых в электрическую энергию превращается энергия протекающих внутри химических реакций. Используют их сегодня повсеместно – это и современные электромобили и портативная радиоэлектроника, и медицинское оборудование, и портативные компьютеры.
Все это делает источники тока электрохимические очень важным изобретением, которым пользуются вот уже 2-ю сотню лет. Именно про ХИТ мы подробно и поговорим в сегодняшней статье.
Содержание
- Классификация химических источников тока
- Характеристики гальванических источников тока
- Более подробное строение элементов
- Литий-ионные аккумуляторные батареи
- Строение
- Принцип работы
- Характеристики аккумуляторов
- Советы по эксплуатации аккумуляторов
Классификация химических источников тока
Классификация ХИТ
Все ХИТ принято подразделять на три основные категории:
Как устроены гальванические батареи
- Первичные гальванические элементы – внутри таких источников происходят химические окислительно-восстановительные реакции, энергия которых и переходит в электрическую. Данные реакции являются необратимыми, поэтому элементы невозможно перезарядить.
- Состоят такие батареи из двух электродов, которые имеют разный электродный потенциал, металлического проводника, по которому могут перемещаться электроны, и электролита, который помогает перемещению ионов между электродами.
Интересно знать! Напомним, что именно поток электронов и приводит к возникновению электрического тока.
Вторичный химический источник тока
- Вторичные ХИТ, они же электрические аккумуляторы – тоже являются гальваническими элементами, однако их особенность заключается в том, что возможна перезарядка.
- В отличие от батарей, которые исчерпывают свою работоспособность при разряде, аккумуляторы могут регенерироваться, то есть повторно накапливать энергию и перезапускать цикл химических реакций.
- Возобновление заряда происходит при пропускании через элемент электрического тока, для чего нужна внешняя цепь. Все мы ежедневно заряжаем свои телефоны и смартфоны, ноутбуки и планшеты. Аккумуляторы применяются практически везде, и это не удивительно – их ресурс намного выше, чем у любой первичной батареи в сотни раз, при том, что цена больше до 10-ти раз.
- Прообраз первой аккумуляторной батареи был создан в далеком 1803 году немецким физиком-химиком И. Риттером. Его устройство имело в составе пятьдесят медных кружков, между которыми было проложено влажное сукно. Когда через него проходил ток от Вольтова столба, изделие само становилось источником электрического тока.
Топливный источник тока химический
- Последним типом химических источников тока являются топливные элементы, или электрохимические генераторы. Основное отличие их от гальванических элементов это то, что вещества необходимые для электрохимической реакции подаются внутрь извне, а продукты от реакций, наоборот, удаляются.
- Подобный подход позволяет организовать долгую непрерывную работу без фактической перезарядки.
- Впервые применять топливные источники тока стали во второй половине 20-го века, несмотря на то, что основные принципы функционирования были открыты в далеком 1839 году. В 1965 году их впервые задействовали в космической технике – это был элемент КК «Джемини». Его изначальное расчетное время работы составляло от суток, до 2-х месяцев. Эти элементы имели достаточное преимущество перед солнечными батареями с буферными химическими батареями в плане массы и габаритов, а также удельной мощности.
- Первая топливная батарея КК «Джемини» состояла из 3 блоков по 32 элемента, каждый из которых выдавал напряжение в 0,8В, и работала на газообразном топливе (кислород и водород).
Характеристики гальванических источников тока
Щелочные аккумуляторы и их свойства
Характеристика химических источников тока включает в себя следующие параметры:
Уравнение Нернста для электродного потенциала
- Электродвижущая сила – этот параметр гальванического элемента зависит от состава используемого электролита и типов металлов, из которых изготовлены электроды. Описывают ЭДС термодинамические функции (уравнение Нернста), приложенные к протекающим электрохимическим процессам.
Измеряется емкость обычно в миллиамперах в час
- Емкость элемента питания – тут все просто, имеется в виду количество энергии, которое элемент может отдать при разряде. Данный параметр напрямую зависит от массы запасенного в батарее реагентов и скорости их превращения. Емкость элемента будет снижаться, если элемент будет охлажден, либо вырастет ток разряда.
- Энергия гальванического элемента. Этот параметр высчитывается путем перемножения емкости на выдаваемое напряжение. Энергия будет уменьшаться по мере роста разрядного тока. Обратный эффект будет достигнут при росте температуры (до определенного уровня) и увеличении используемых реагентов.
Прототип гальванической батареи
- Сохраняемость – по сути, срок годности элемента, в течение которого он способен не менять своих основных характеристик в допустимых пределах.
Совет! Чем выше температура, тем быстрее сокращается срок хранения.
- Плотность энергии – количество запасенной энергии в расчете на единицу массы аккумулятора или его объема.
- Саморазряд первичного химического источника тока – очень важный параметр, указывающий на потерю емкости батареей без подключенной к ней нагрузки. То есть параметр фактически сопоставим со сроком службы элемента.
- Саморазряд химических источников тока вторичных, по сути, то же самое, однако этот параметр меняется во времени. Особенно высоко его значение после полной подзарядки аккумулятора, но по мере разрядки он ослабевает.
Интересно знать! Для никель-кадмиевых аккумуляторов, функционирующих исправно, не допускается потеря более 10% от максимального заряда за 1 сутки. Никель-металлгидридные имеют меньший показатель, а у литий-ионных этот эффект практически отсутствует, растягиваясь на месяцы. Герметичные кислотные аккумуляторы потеряют за год всего 40% своего заряда, однако, если температура воздуха будет выше 20 градусов, процесс потечет куда быстрее, и наоборот, приближаясь к нулю – будет замедляться.
Более подробное строение элементов
Гальваническая батарейка в разрезе
Мы уже дали определение химических источников тока и назвали их основные типы. Теперь давайте рассмотрим немного глубже, как они устроены, и какие химические реакции внутри протекают.
Элемент Даниэля-Якоби
- Итак, начнем с первичных гальванических элементов. В их состав входят реагенты (окислители и восстановители), которые участвуют в прямом преобразовании энергии. Выработка тока прекращается после того, как реагенты полностью израсходуются.
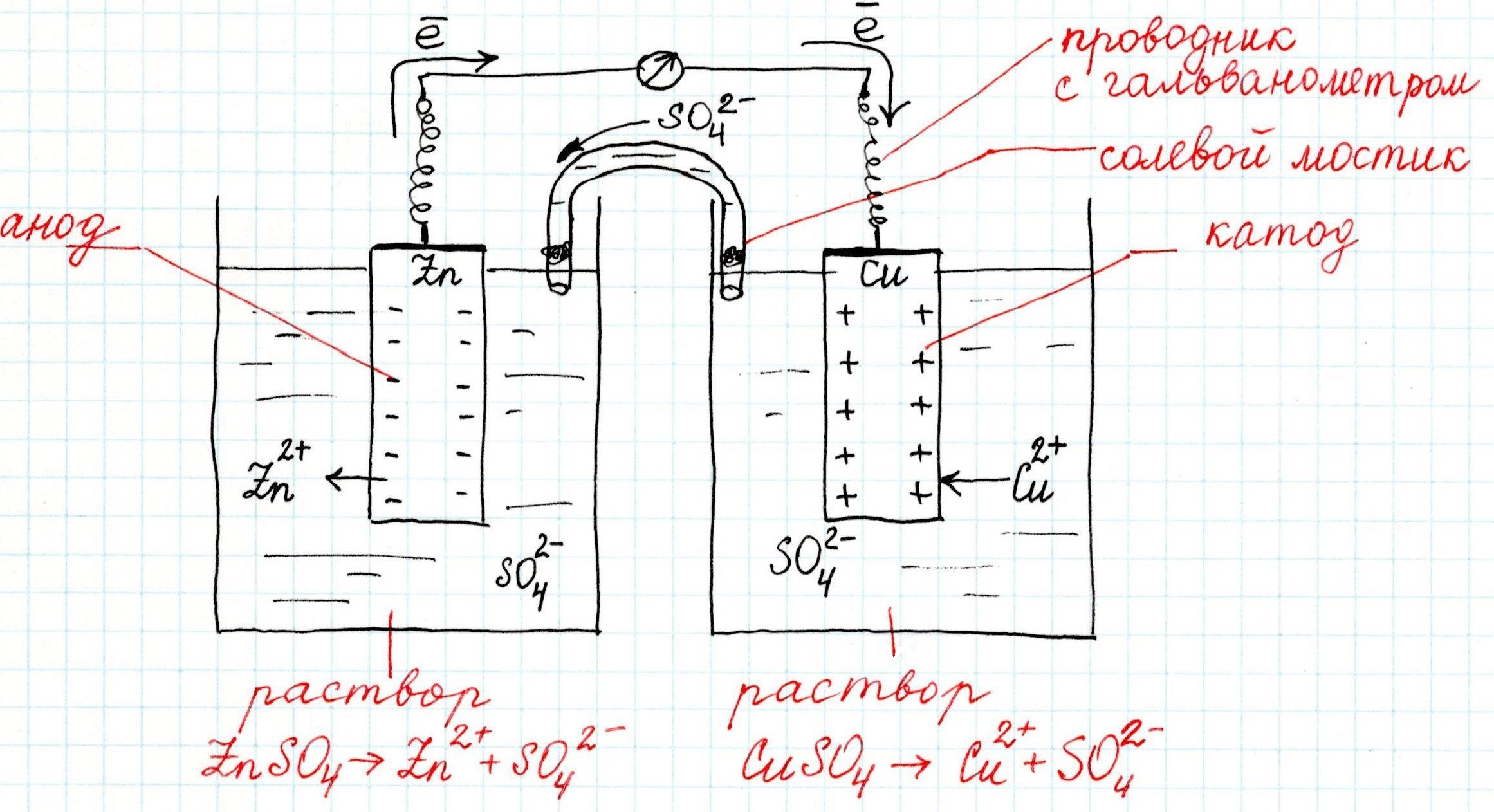
- В качестве примера того, как функционирует элемент, давайте опишем давно известное устройство Даниэля-Якоби. Выше представлена его схема.
- Итак, два электрода (цинковый и медный) опущены в колбы наполненные растворами сульфатов цинка и меди, соответственно.
- Растворы разъединены внутренней цепью (полупроницаемой перегородкой), а электроды соединяются внешней цепью (металлический проводник) через гальванометр, обозначенный на схеме как 2.
Элемент Даниэля
- Когда цепь замкнута, на обоих электродах протекают процессы гидратации ионов металлов. Между самим металлом и его ионами в растворе устанавливается химическое равновесие.
- В связи с тем, что цинк и медь имеют разную активность электродных потенциалов, электроды приобретают разный заряд по величине, то есть концентрация свободных электронов на них будет значительно отличаться.
- Как только будет замкнута внешняя цепь, концентрация электронов придет в равновесие и они по внешнему проводнику начнут перемещаться от цинкового электрода к медному.
- По этой причине концентрация электронов на цинковом электроде начинает уменьшаться, из-за чего происходит смещение равновесия на границе Zn|ZnSO4 в сторону катионов цинка (их образования). Другими словами цинк начинает растворяться.
- С медным электродом происходит обратный процесс – равновесие смещается в другую сторону и начинает образовываться металлическая медь, или другими словами – медь начинает восстанавливаться.
- Если говорить более конкретно, то на цинковом электроде происходит процесс окисления, который в электрохимии называется анодным процессом, а сам электрод – анодом. На медном электроде (катоде) – процесс восстановления, называемый еще катодным.
Классическая солевая батарейка
- Наиболее широко распространились элементы питания, состоящие из марганца и цинка. Они не содержат раствора электролита, поэтому называются сухими.
- Эти элементы при всем конструкционном многообразии делят всего лишь на два типа, в зависимости от рН электролита и состава: солевые и щелочные. Для солевых марганцево-цинковых элементов (МЦ) используется электрохимическая схема Лекланше (Zn|NH4Cl|MnO2) – в качестве катода выступает цинковый электрод, в качестве анода – электрод их диоксида марганца и графита, а электролитом является паста из муки или крахмала с раствором хлорида аммония.
- В щелочных элементах питания применяется другая схема (Zn|KOH|MnO2). При этом электроды делаются из тех же материалов, а в качестве электролита применяется паста из гидроксида калия.
- Такие элементы обладают большей емкостью, лучше переносят низкие температуры и высокие разрядные токи. Однако они намного сложнее солевых источников, почему и имеют значительно большую цену.
- Данные элементы имеют многоцелевое назначение и применяются в быту повсеместно. Они могут выступать источниками автономного питания для любой радиоаппаратуры, фотоаппаратов, калькуляторов, различных тестовых приборов, часов, фонариков, для запитки схем Биоса материнских плат персональных компьютеров и прочего.
Процесс зарядки аккумуляторных батарей
- Аккумуляторы, или вторичные химические источники тока – отличает эти элементы то, что благодаря воздействию внешнего тока, электрическая энергия может переходить в химическую, а при подключении внешней цепи происходит обратный процесс.
- Одним из часто встречающихся типов таких устройств являются свинцовые аккумуляторы, которые также называют и кислотными.
- В качестве электролита выступает 25-30%-ый раствор серной кислоты, а материалом для электродов служат свинцовые решетки. При взаимодействии этих веществ свинец превращается в следующее соединение — PbSO
- Процессы, протекающие на аккумуляторных электродах, до сих пор до конца не изучены, что говорит об их высокой сложности. Допускается, что одновременно происходят изменения в твердой фазе и в растворе, с зависимостью скоростей этих реакций от условий поляризации.
- Применяются такие элементы в основном в качестве источников питания в автомобилях.
- Помимо кислотных существуют и щелочные аккумуляторы, среди которых больше остальных распространились никель-металлгидридные и никель-кадмиевые устройства, электролитом в которых является гидроксид калия (КОН).
- Для переносной электроники, например, ноутбуков, планшетов, смартфонов используются в основном литий-ионные аккумуляторы, а также литий-полимерные, обладающие приличной емкостью и отсутствием эффекта памяти.
Про литий-ионные аккумуляторы мы поговорим в отдельной главе, так как эти устройства на сегодня в быту самые часто встречающиеся.
Строение электрохимического генератора тока
- Топливные элементы питания, по сути, тоже являются гальваническими, только восстановитель и окислитель находятся вне самого элемента. Они подаются во время работы к электродам раздельно и непрерывно.
- При работе такого элемента сами электроды не расходуются, как в обычных батарейках.
- В качестве окислителя обычно применяется кислород (чистый или из воздуха), а в качестве восстановителя – водород, метан и метанол, которые могут быть как в жидком, так и в газообразном состоянии.
- Электролитом при этом является щелочь.
Литий-ионные аккумуляторные батареи
Теперь, как и обещали, давайте подробно обсудим, что такое литий-ионные аккумуляторы, как они устроены и как ими правильно пользоваться. Тема очень интересная, и поможет не только увеличить объем теоретических знаний, но и практических, которые, к примеру, помогут продлить срок службы вашего телефонного или любого другого аккумулятора.
Строение
На фото — литий-ионный аккумулятор от сотового телефона
- В качестве катода (отрицательного электрода) используется алюминий, а в качестве анода (положительного электрода) – медь. Выполняются они обычно в виде фольги, в форме цилиндра или продолговатого пакета.
- Разделяются электроды пористым сепаратором, который пропитал электролитом.
Схематическое строение литий-ионного аккумулятора
- Все электроды устанавливаются в прочный корпус и подсоединяются к токосъемным клеммам.
- Попутно внутри корпуса могут устанавливаться и отдельные устройства, которые призваны продлить срок службы аккумулятора и сделать эксплуатацию безопасной. К таковым относятся:
- Устройства, реагирующие на изменения температурного коэффициента изменением сопротивления.
- Устройство разрыва контакта между катодом и клеммой, в случае превышения допустимого давления газов внутри.
- Предохранительные клапаны, способные сбрасывать аварийное давление.
- Также используются и внешние устройства электронной защиты, которые также предупреждают аварийный перегрев, перезаряд и короткое замыкание.
- Конструктивно аккумуляторы изготавливают цилиндрического типа (как обычные батарейки) либо призматического (как в телефонах). В первом случае электроды с сепаратором сворачиваются рулоном, а во втором они накладываются друг на друга.
- Литий-ионные аккумуляторы абсолютно герметичные устройства, что продиктовано необходимостью защиты от утечки электролита, а также защитой от попадания внутрь паров воды и кислорода, что приводит к выходу элемента из строя.
Принцип работы
Как работает аккумулятор
Разберем сначала разряд.
- При подключении во внешнюю цепь заряженного аккумулятора, начинает протекать химическая реакция, благодаря которой образуются свободные электроны, которые, как мы помним, «хотят» попасть на катод. Через электролит им не пройти, поэтому они «отправляются в путь» через внешнюю цепь – так образуется ток, который питает подключенные к источнику устройства.
- «Улетевшие» электроны оставляют ионы лития (положительно заряженные), которые через электролит направляются к катоду.
- После полного перемещения электронов, аккумулятор остается разряженным.
Чтобы восполнить запас энергии, процесс нужно обратить вспять. К аккумулятору подключается зарядное устройство, из-за чего электроны устремляются обратно к аноду, пока тот не соберет прежнее количество электронов. Далее цикл может повторяться большое количество раз.
Емкость литий-ионной батареи – это ни что иное, как количество ионов лития, которые могут «прилипнуть» к электродам. Попадают они в кратеры (микроскопические поры на аноде и катоде).
При выходе аккумулятора из строя требуется его замена на новый
- Со временем материал электродов начинает деградировать. По этой причине они уже не могут удерживать прежнее количество ионов лития, то есть происходит потеря емкости. Данный процесс будет продолжаться до тех пор, пока элемент полностью не утратит свою работоспособность.
- Строение литий-ионных аккумуляторов таково, что постоянно требуется контроль за уровнем заряда. С этой целью в симбиозе с ними применяют контроллеры заряда. Эти устройства полностью ведут процесс зарядки, выставляя необходимое напряжение в зависимости от стадии.
Зарядное устройство
- Процесс зарядки через контроллер протекает обычно в следующей последовательности. Вначале подается ток, составляющий 10% от номинального. Напряжение при этом составляет 2,8 Вольт. Далее происходит увеличение тока при достижении напряжением отметки в 4,2 Вольта. Приближаясь к финалу, ток постепенно ослабевает, но напряжение так и остается на достигнутом уровне.
- Описанный процесс, в принципе, универсален, но может отличаться в зависимости от типов аккумулятора и применяемого контроллера.
Характеристики аккумуляторов
Именно такие аккумуляторы установлены в батареи для ноутбуков
Изготавливаемые сегодня литий-ионные аккумуляторы бывают двух видов: таблеточные и цилиндрические.
Все они могут иметь следующие рабочие параметры и характеристики:
- Минимальное рабочее напряжение составляет 2,2-2,5 В;
- Максимальное напряжение обычно не превышает 4,35 В, тогда как маркировка указывает 5 В.
- Время зарядки зависит от мощности зарядного устройства и емкости самого аккумулятора, поэтому обобщить данные достаточно сложно. Обычно этот параметр составляет 2-4 часа.
- Саморазряд при комнатной температуре не превышает 7% в год, что как понимаете, очень мало.
- Работать аккумуляторы могут при температурах от -20 до +60 градусов, естественно, меняя свои рабочие характеристики.
- Аккумуляторы теряют около 20% своей емкости по истечении от 500 до 1000 циклов зарядаразряда.
Для таких аккумуляторов характерны следующие плюсы:
- Высокая плотность энергии, по сравнению с никель-кадмиевыми и никель-металлгидридными аккумуляторами.
- Высокое напряжение одного элемента. Для сравнения один никель-металлгидридный аккумулятор выдает всего лишь 1,2 В, поэтому их используют в количестве 4-х штук, чтобы получить то же рабочее напряжение.
- «Эффект памяти» у них отсутствует, что намного упрощает процесс эксплуатации.
«Эффект памяти» требует особого подхода к заряду аккумулятора
Интересно знать! Эффект памяти – это изменение полезной емкости аккумулятора, из-за нарушения режима зарядки. То есть, если постоянно заряжать не до конца севший аккумулятор, он «запомнит» нижний порог и будет «считать» его нулевым.
- Большое число циклов перезарядки.
- Достаточно длительная эксплуатация.
- Высокий диапазон рабочих температур, что позволяет использовать такие устройства в разных погодных условиях.
- Литий-ионные аккумуляторы более безопасны в плане экологии.
Советы по эксплуатации аккумуляторов
А теперь самые простые советы, которые помогут прослужить вашим аккумуляторам максимально долго.
- Берегите элементы питания от огня и воды – оба фактора чреваты выходом из строя.
- Чрезмерное охлаждение и нагревание, а также резкая смена температур тоже губительны.
- Применяйте соответствующий вашему аккумулятору тип зарядки, коих есть аж 4 штуки.
- Первый – это медленный заряд низким постоянным током. Происходит он в течение довольно длительного времени – до 18 часов. Такой метод подходит почти для всех аккумуляторов и является самым безопасным.
- Второй – быстрый заряд. Происходит в течение 3-5 часов при постоянном токе в 1/3С.
- Третий – дельта V заряд (ускоренный) — начальные ток равен номинальной емкости элемента, напряжение постоянно меняется. Заряд происходит за 1-1,5 часа. При этом возможен перегрев и разрушение устройства.
- Четвертый тип называется реверсивным. При нем длинные импульсы заряда сменяются короткими импульсами разряда. Такой метод наиболее полезен для аккумуляторов с «эффектом памяти».
Совет! Прилагаемая к аккумуляторным батареям инструкция обычно содержит рекомендации по режиму зарядки.
На этом закончим наш обзор. Мы разобрали электрохимические источники тока и получили простейшее представление об их работе. Если вы хотите изучить тему глубже, то уже не обойтись без учебных пособий и видео, которые можно легко отыскать в сети.
Фундаментальные законы физики и химии, и в том числе, закон сохранения массы и энергии вещества, находят свое подтверждение на уровне перемещения мельчайших частиц – электронов, массами которых в химии обычно пренебрегают.
Речь идет об окислительно-восстановительных процессах, сопровождающихся переходом электронов от одних веществ (восстановителей) к другим (окислителям). Причем вещества могут обмениваться электронами, непосредственно соприкасаясь друг с другом.
Однако существует множество случаев, когда прямого контакта веществ не происходит, а процесс окисления-восстановления все равно идет. А если он идет самопроизвольно, то при этом еще и энергия выделяется. Ее человек с успехом использует для выполнения электрической работы.
Реализуется такая возможность в гальваническом элементе, схема работы которого, а также расчеты, связанные с ним, рассматриваются в данной статье.
Содержание:
1) Простейший гальванический элемент: схема работы.
2) Как устроен гальванический элемент Даниэля-Якоби, или Так где же все-таки электрический ток?
3) Типовые задачи на схему гальванического элемента: примеры решения.
Простейший гальванический элемент: схема работы
Гальванический элемент – это прибор, позволяющий при посредстве химической реакции получить электрическую энергию.
Пластинка металла и вода: простые взаимоотношения
Давайте сначала разберемся, что происходит с пластинкой металла, если опустить ее в воду?
Процесс схож с диссоциацией соли: диполи воды ориентируются к ионам металла и извлекают их из пластины. Но почему же тогда не происходит растворения самой пластины в воде? Все дело в строении кристаллической решетки.
Кристаллы соли состоят из катионов и анионов, поэтому диполями воды извлекаются из решетки и те, и другие.
У металла же кристаллическая решетка представлена атомами-ионами. Внутри нее всегда происходит превращение атомов в катионы за счет отщепления валентных электронов и обратный процесс: катионы снова превращаются в атомы, присоединяя электроны. Электроны являются общими для всех ионов и атомов, присутствующих в кристаллической решетке металла.
Процессы внутри металлической кристаллической решетки в обобщенном виде можно показать так:
В итоге, вода, окружающая пластинку – это уже не собственно вода, а раствор, составленный из молекул воды и перешедших в нее из пластины ионов металла. На пластине же возникает избыток электронов, которые скапливаются у ее поверхности, так как сюда притягиваются гидратированные катионы металла.
Возникает так называемый двойной электрический слой.
Бесконечно катионы металла с пластины в раствор уходить не будут, поскольку существует и обратный процесс: переход катионов из раствора на пластину. И он будет идти до тех пор, пока не наступит динамическое равновесие:
На границе раздела «металлическая пластина – раствор» возникает разность потенциала, которая называется равновесным электродным потенциалом металла.
Пластинка металла и раствор его соли: к чему приводит такое соседство
А что произойдет, если металлическую пластинку поместить не в воду, а в раствор соли этого же металла, например, цинковую пластинку Zn в раствор сульфата цинка ZnSO4?
В растворе сульфата цинка уже присутствуют катионы цинка Zn2+. Таким образом, при погружении в него цинковой пластины возникнет избыточное количество этих катионов, и уже известное нам равновесие (см. выше) сместится влево. Все это приведет к тому, что отрицательный заряд на пластинке будет иметь меньшее значение, так как меньшее количество катионов с нее будет переходить в раствор. Как результат – более быстрое наступление равновесия и менее значительный скачок потенциала.
Потенциал металла в растворе его же соли в момент равновесия записывают так:
Металл, погруженный в раствор электролита, называют электродом, обратимым относительно катиона.
Цинк – достаточно активный металл. А если речь будет идти о медной пластинке Cu, погруженной в раствор, например, сульфата меди (II) CuSO4?
Медь – металл малоактивный. Двойной электрический слой, конечно же, появится и в этом случае. Но! Катионы из пластинки в раствор переходить не будут. Наоборот, катионы меди (II) Cu2+из раствора соли начнут встраиваться в кристаллическую решетку пластинки и создавать положительный заряд на ее поверхности. Сюда же подойдут сульфат-анионы SO42-и создадут вокруг нее отрицательный заряд. То есть распределение зарядов в данном случае будет совершенно противоположным, чем на цинковой пластинке.
Это общая закономерность: пластинки из малоактивных металлов при погружении в раствор их солей всегда заряжаются положительно.
Как устроен гальванический элемент Даниэля-Якоби, или Так где же все-таки электрический ток?
Известно, что электрический ток – это направленное движение заряженных частиц (электронов).
На активном металле скапливаются электроны, а поверхность малоактивного металла, заряжается положительно. Если соединить проводником (например, металлической проволокой) оба металла, то электроны с одного перейдут на другой, а двойной электрический слой перестанет существовать. Это будет означать возникновение электрического тока.
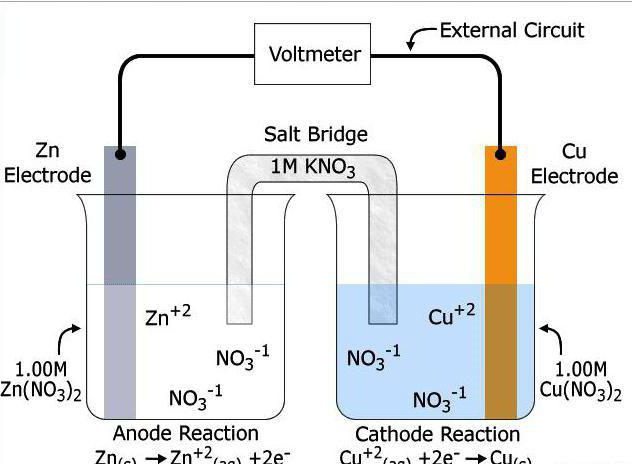
Причем, ток возникает за счет окислительно-восстановительного процесса: активный металл окисляется (так как отдает электроны малоактивному), а малоактивный металл восстанавливается (так как принимает электроны от активного). Металлы друг с другом не соприкасаются, а взаимодействуют через посредника: внешнего проводника. Данная схема и есть схема гальванического элемента. Именно так устроен и работает гальванический элемент Даниэля-Якоби:
В схеме элемента показан «солевой мостик». Он представляет собой трубку, в которой присутствует электролит, не способный взаимодействовать ни с электродами (катодом или анодом), ни с электролитами в пространствах у электродов. Например, это может быть раствор сульфата натрия Na2SO4. Подобный мостик нужен для того, чтобы уравновешивать (нейтрализовать) заряды, образующиеся в растворах гальванического элемента.
Таким образом, возникшая электрическая цепь замыкается: анод → проводник с гальванометром → катод → раствор в катодном пространстве → «солевой мостик» → раствор в анодном пространстве → анод.
Анод – электрод, на котором происходит окисление (цинковая пластинка):
Электроны цинка Zn отправляются по внешней цепи (то есть по проводнику) на катод.
Катод – электрод, на котором происходит восстановление (медная пластинка):
Катионы меди Cu2+, пришедшие на пластинку из раствора сульфата меди (II), получают электроны цинкового анода.
В общем виде весь процесс окисления-восстановления в гальваническом элементе выглядит так:
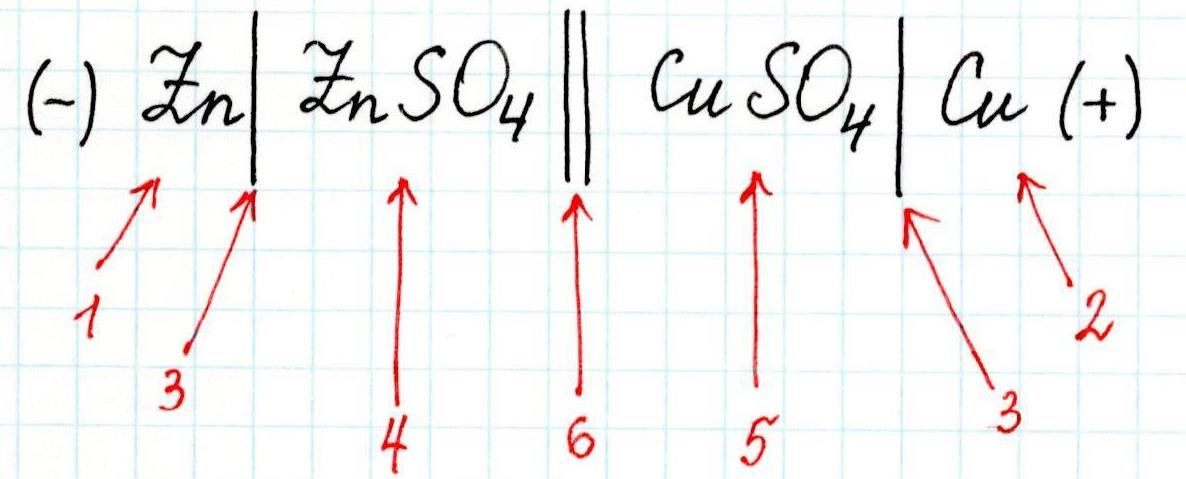
Для любого гальванического элемента можно составить запись в виде схемы. Например, для приведенного элемента Даниэля-Якоби она будет выглядеть так:
Здесь:
1 – анод;
2 – катод;
3 – скачок потенциала (граница раздела фаз);
4 – электролит в анодном пространстве;
5 – электролит в катодном пространстве;
6 – граница между растворами (солевой мостик).
Или сокращенно:
Типовые задачи на схему гальванического элемента: примеры решения
По вопросу, рассмотренному в данной статье, возможны два основных вида задач.
Задача 1. Составьте схему гальванического элемента, в котором протекает реакция:

Задача 2. Напишите электродные и суммарные уравнения реакций, протекающих в гальваническом элементе:

Итак, разобрав принцип работы гальванического элемента, мы научились записывать схему его работы и определять основные процессы на электродах.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.