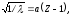В зависимости от того, какой подуровень
последним заполняется электронами, все
элементы делятся на четыре типа –
электронные семейства:
-
s
– элементы;
заполняется электронами s
– подуровень внешнего уровня. К ним
относятся первые два элемента каждого
периода. Валентными1являютсяs-электроны
внешнего уровня. -
p
– элементы;
заполняется электронами р – подуровень
внешнего уровня. Это последние шесть
элементов каждого периода (кроме I
и VII).
Валентными
являются s—
и p—
электроны внешнего уровня. -
d
– элементы; заполняется
электронами d
– подуровень второго снаружи уровня,
а на внешнем уровне – один или два
электрона (y
46Pd
– нуль). К ним относятся элементы
вставных декад больших периодов,
расположенных между s
– и p
– элементами (их также называют
переходными элементами). Валентными
являются s
– электроны внешнего уровня и d
– электроны предвнешнего уровня
(второго
снаружи). -
f
– элементы;
заполняется электронами f
– подуровень третьего снаружи уровня,
а на внешнем уровне остается два
электрона. Они расположены в 6 – м (4f
– элементы) и 7 – м (5f
– элементы) периодах периодической
системы. 4f
– элементы объединяют в семейство
лантаноидов, а 5f
– элементы – семейство актиноидов.
В периодической системе s – элементов
14, p – элементов 30, d – элементов 38, f –
элементов 28.
2.9. Понятие об электронных аналогах
Атомы элементов с одинаковым заполнением
внешнего энергетического уровня носят
название электронных аналогов.Например:
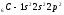
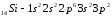
Элементы с одинаковым строением
внешнего и предвнешнего энергетических
уровней называют полными электронными
аналогами.Например:
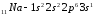
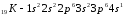
2.10. Периодический закон и периодическая система элементов д.И. Менделеева
Важнейшим событием химии в 19 веке было
открытие периодического закона, сделанное
в 1869 г. гениальным русским ученым Д.
И. Менделеевым. Периодический закон
в формулировке Д. И. Менделеева гласит:
“ свойства элементов, а потому и свойства
образуемых ими простых и сложных тел,
стоят в периодической зависимости от
их атомного веса”.
Графическим выражением этого закона
стала созданная им периодическая система
элементов.
В настоящее время известно несколько
сотен вариантов периодической системы
элементов, но все они в своей основе
содержат предложенные Менделеевым
принципы её построения. Наибольшее
распространение получили короткая
(восьмиклеточная) и длинная
(тридцатидвухклеточная) формы периодической
система элементов.
Развитие учения о строении атома вскрыло
глубокий физической смысл периодического
закона. Как было доказано, свойства
элементов зависят, прежде всего, от
заряда атомных ядер, который в свою
очередь определяет распределение
электронов на электронных оболочках
атомов. Основной характеристикой атома
является положительный заряд ядра,
численно равный порядковому номеру
элемента. В нейтральном атоме заряд
ядра и общее число электронов равны.
Распределением электронов на электронных
оболочках атомов определяются свойства
элементов и их соединений, положение
элемента в периодической системе.
Периодичность изменения свойств
химических элементов и их соединений
зависит от периодически повторяющейся
сходной структуры электронных оболочек
атомов.
В 1913 г. ученик Резерфорда английский
ученый Мозли, исследуя спектры лучей
Рентгена для различных элементов,
установил простое соотношение между
длиной волны рентгеновских лучей и
порядковым номером элемента (закон
Мозли):
Корень квадратный из величины, обратной
длине волны рентгеновских лучей,
испускаемых атомами различных элементов,
находится в линейной зависимости от
порядкового номера элемента, т. е.
где
– длина волны; Z
– порядковый номер элемента;
– постоянная, одинаковая для всех
элементов.
Из
уравнения следует, что, зная
и измерив ,
можно вычислить порядковый номер
элемента. Это экспериментальный метод
проверки правильности распределения
элементов в периодической системе по
возрастанию заряда ядра. Закон Мозли
показал, что Д.И. Менделеев правильно
расположил элементы в периодической
системе, позволил установить общее
число элементов в каждом периоде, а
главное, направил усилия ученых на
открытие предсказанных им элементов.
Вскоре несколько элементов было открыто
с помощью анализа рентгеновских спектров
(гафний, Z=72;
рений, Z=75
и др.).
Вместе с тем из закона
Мозли следует, что порядковый номер –
это не простая нумерация элементов, а
выражение конкретного внутреннего
свойства атома – величины элементарных
положительных зарядов ядра. Именно
положительный заряд ядра (а не атомная
масса) является главной характеристикой
атома.
В
свете современных представлений о
строении атома изменилась и формулировка
периодического закона: свойства
химических элементов, а также формы и
свойства их соединений находятся в
периодической зависимости от величины
заряда атомных ядер.
На данном уроке дана подробная историческая справка о попытках классификации химических элементов учеными-химиками, формируется представление о структуре периодического закона химических элементов Д.И. Менделеева, подчеркивается значение этого закона для химической науки.
Попытки классификации химических элементов начались задолго до открытия Д.И.Менделеевым периодического закона. Естествоиспытатели в начале XIX сталкивались с большими трудностями в этом направлении, потому что химических элементов было известно всего 63, а атомные массы были определены для них неточно.
В 1829 году немецкий химик И.В.Дёберейнер заметил, что некоторые сходные по своим свойствам элементы можно объединить по три в группы. Он назвал их триадами.
Сущность данной классификации заключается в следующем: в каждой триаде есть средний элемент, масса атома которого будет равна средней арифметической массе двух крайних элементов.
Например, рассмотрим первую триаду: Li, Na, K.
Их атомные массы соответственно равны 7, 23, 39.
Система классификации И.В.Дёберейнера оказалась несовершенной. Некоторые триады не содержали тех элементов, которые были бы похожи с ними по химическим свойствам.
Так, например, триада, содержащая S, Se, Te , не содержала кислорода O.
Ошибка И.В.Дёберейнера заключалась в том, что он ограничил себя поиском тройственных союзов, т.е. триад.
Но И.В.Дёберейнер был первым из естествоиспытателей, который связал свойства химических элементов с их атомными массами. Все дальнейшие попытки классификации химических элементов основывались на связи масс атомов с их химическими свойствами.
2. Спираль Шанкурту
В середине XIX века появилось много работ ученых, которые пытались классифицировать химические элементы. Французский геолог и химик А.Э. Шанкуртуа в 1862 году предложил свою классификацию химических элементов.

Рис. 1. Спираль Шанкуртуа
Он расположил все известные к тому времени химические элементы в порядке возрастания их атомных масс, а полученный ряд нанес на поверхность цилиндра, по линии исходя из его основания под углом 45
После развертывания этого цилиндра оказалось, что на вертикальных линиях, параллельных оси цилиндра, находятся химические элементы со сходными химическими свойствами. Так на одну вертикаль попадали Li, Na, K; а также Be, Mg, Ca. Кислород, сера, теллур. Недостатком спирали Шанкуртуа было то, что в вертикальную группу химических элементов попадали не имеющие ничего сходного с ними химические элементы. Так в группу щелочных металлов, попадал марганец. А в группу кислорода и серы, попадал титан.
3. Октавы Ньюлендса
В 1865 году 18 августа английский ученый Дж.А.Ньюлендс расположил химические элементы в порядке возрастания их атомных масс. В результате он заметил, что каждый восьмой элемент напоминает по свойствам первый элемент. Найденную закономерность, он назвал законом октав по аналогии с семью интервалами музыкальной гаммы.Рис.2.Закон октав он сформулировал следующим образом:
Рис. 2. Октавы Ньюлендса
«Номера аналогичных элементов, как правило, отличаются или на целое число семь или на кратное семи; другими словами члены одной и той же группы соотносятся друг с другом в том же отношении, как и крайние точки одной или больше октав в музыке».
Он расположил элементы по семь в группы. Таким образом, он заметил, что вертикальные ряды, полученные после такого расположения, включают в себя элементы, схожие по своим химическим свойствам. Дж.А. Ньюлендс был первым, кто соотнес атомные массы химических элементов и их химические свойства и присвоил каждому элементу порядковый номер. Но все же в его таблице не было свободных мест. Он ограничил себя семью клетками в каждом периоде ,и некоторые клетки ему пришлось поместить по несколько элементов. Поэтому научный мир отнесся скептически к его открытию.
В 1864 году английский химик У. Одлинг опубликовал таблицу, в которой элементы были размещены, согласно их атомным весам и сходствам химических свойств. Но он не дал никаких комментариев к своей работе, и она не была замечена.
4. Таблица химических элементов Мейера

Рис. 3. Таблица химических элементов Мейера
В 1870 году появилась первая таблица немецкого химика Ю.Л. Мейера под названием « Природа элемента, как функция их атомного веса». В неё были включены 28 элементов, размещенные в 6 столбцов, согласно их валентности. Ю.Л. Мейер намеренно ограничил число элементов в таблице, чтобы подчеркнуть закономерные изменения атомной массы в рядах сходных элементов. Рис. 3.Сходные элементы располагаются в вертикальных рядах таблицы. Некоторые ячейки Ю.Л. Мейер оставил незаполненными.
5. Открытие периодического закона Д.И.Менделеевым
В марте 1869 года русский химик Д. И. Менделеев представил русскому химическому обществу сообщение об открытии им периодического закона химических элементов. В том же году вышло первое издание Менделеевского учебника «Основы химии», в котором была приведена его периодическая таблица.
В конце 1870 года Д. И. Менделеев делает доклад русскому химическому обществу под названием «Естественные системы химических элементов и применение её к указанию свойств еще неизвестных элементов». В этом докладе Д. И. Менделеев предсказывает существование трех еще неизвестных элементов: экасилиций, экабор и экаалюминий. Он утверждает, что свойства химических элементов, стоящих в одной группе, будут нечто средним между свойствами элементов, стоящих сверху и снизу данного элемента. Если рассматривать этот элемент в периоде, то он будет обладать средними свойствами элементов, стоящими слева и справа от него.

Рис. 4. Таблица химических элементов Менделеева
Еще алхимики пытались найти закон природы, на основе которого можно было бы систематизировать химические элементы. Но им недоставало надежных и подробных сведений об элементах. К середине XIX в. знаний о химических элементах стало достаточно, а число элементов возросло настолько, что в науке возникла естественная потребность в их классификации. Первые попытки классификации элементов на металлы и неметаллы оказались несостоятельными. Предшественники Д.И.Менделеева (И. В. Деберейнер, Дж. А. Ньюлендс, Л. Ю. Мейер) многое сделали для подготовки открытия периодического закона, но не смогли постичь истину. Дмитрий Иванович установил связь между массой элементов и их свойствами.
Дмитрий Иванович родился в г. Тобольске. Он был семнадцатым ребенком в семье. Закончив в родном городе гимназию, Дмитрий Иванович поступил в Санкт-Петербурге в Главный педагогический институт, после окончания которого с золотой медалью уехал на два года в научную командировку за границу. После возвращения его пригласили в Петербургский университет. Приступая к чтению лекций по химии, Менделеев не нашел ничего, что можно было бы рекомендовать студентам в качестве учебного пособия. И он решил написать новую книгу – «Основы химии».
Открытию периодического закона предшествовало 15 лет напряженной работы. 1 марта 1869 г. Дмитрий Иванович предполагал выехать из Петербурга в губернии по делам.
Видео-фильм о Д.И. Менделееве
II. Открытие Периодического закона
Периодический закон был открыт на основе характеристики атома – относительной атомной массы.
Менделеев расположил химические элементы в порядке возрастания их атомных масс и заметил, что свойства элементов повторяются через определенный промежуток – период, Дмитрий Иванович расположил периоды друг под другом., так, чтобы сходные элементы располагались друг под другом – на одной вертикали, так была построена периодическая система элементов.
1 марта 1869г. Формулировка периодического закона Д.И. Менделеева.
Свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов.
К сожалению, сторонников периодического закона сначала было очень мало, даже среди русских ученых. Противников – много, особенно в Германии и Англии.
Открытие периодического закона – это блестящий образец научного предвидения: в 1870 г. Дмитрий Иванович предсказал существование трех еще неизвестных тогда элементов, которые назвал экасилицием, экаалюминием и экабором. Он сумел правильно предсказать и важнейшие свойства новых элементов. И вот через 5 лет, в 1875 г., французский ученый П.Э. Лекок де Буабодран, ничего не знавший о работах Дмитрия Ивановича, открыл новый металл, назвав его галлием. По ряду свойств и способу открытия галлий совпадал с экаалюминием, предсказанным Менделеевым. Но его вес оказался меньше предсказанного. Несмотря на это, Дмитрий Иванович послал во Францию письмо, настаивая на своем предсказании.
Ученый мир был ошеломлен тем, что предсказание Менделеевым свойств экаалюминияоказалось таким точным. С этого момента периодический закон начинает утверждаться в химии.
В 1879 г. Л. Нильсон в Швеции открыл скандий, в котором воплотился предсказанный Дмитрием Ивановичем экабор.
В 1886 г. К. Винклер в Германии открыл германий, который оказался экасилицием.
Но гениальность Дмитрия Ивановича Менделеева и его открытия — не только эти предсказания!
В четырёх местах периодической системы Д. И. Менделеев расположил элементы не в порядке возрастания атомных масс:
Ar – K, Co – Ni, Te – I, Th — Pa
Ещё в конце 19 века Д.И. Менделеев писал, что, по-видимому, атом состоит из других более мелких частиц. После его смерти в 1907 г. было доказано, что атом состоит из элементарных частиц. Теория строения атома подтвердила правоту Менделеева, перестановки данных элементов не в соответствии с ростом атомных масс полностью оправданы.
Современная формулировка периодического закона.
Свойства химических элементов и их соединений находятся в периодической зависимости от величины заряда ядер их атомов, выражающейся в периодической повторяемости структуры внешней валентной электронной оболочки.
И вот спустя более 130 лет после открытия периодического закона мы можем вернуться к словам Дмитрия Ивановича, взятым в качестве девиза нашего урока: «Периодическому закону будущее не грозит разрушением, а только надстройка и развитие обещаются». Сколько химических элементов открыто на данный момент? И это далеко не предел.
III. Периодическая система химических элементов
Графическим изображением периодического закона является периодическая система химических элементов. Это краткий конспект всей химии элементов и их соединений.
Изменения свойств в периодической системе с ростом величины атомных весов в периоде (слева направо):
1. Металлические свойства уменьшаются
2. Неметаллические свойства возрастают
3. Валентность элементов в формулах высших оксидов возрастает от I до VII, а в формулах летучих водородных соединений уменьшается от IV до I.
Основные принципы построения периодической системы
|
Признак сравнения |
Д.И.Менделеев |
|
Как устанавливается последовательность элементов по номерам? (что положено в основу п.с.?) |
Элементы расставлены в порядке увеличения их относительных атомных масс. При этом есть исключения. Ar – K, Co – Ni, Te – I, Th — Pa |
|
Принцип объединения элементов в группы. |
Качественный признак. Сходство свойств простых веществ и однотипных сложных. |
|
Принцип объединения элементов в периоды. |
Совокупность элементов по мере роста относительной атомной массы от одного щелочного металла до другого. |
На сегодняшний день открыто 118 химических элементов, каждый из которых занял свою ячейку в Периодической системе. Новые открываемые элементы имеют большую относительную атомную массу, чем уже известные и попадают в конец таблицы. В настоящее время используются длинная и короткая формы периодических таблиц.
В ячейке таблицы записывается символ химического элемента, его название и порядковый номер, значение относительной атомной массы.
Рис. Информация о химическом элементе кислороде
При изучении школьного курса химии, как правило, пользуются короткой формой Периодической таблицы. Она содержит 8 вертикальных столбцов (групп), которые нумеруются римскими цифрами. Каждая группа включает в себя главную (А) и побочную (В) подгруппы.
У элементов главных подгрупп высшая валентность, как правило, равна номеру группы. Одними из исключений этого правила являются кислород (его валентность всегда равна II) и фтор (высшая валентность которого – I).
С помощью Периодической таблицы можно определить и низшую валентность элемента. Для этого из 8 (максимального числа групп) надо вычесть номер группы, в которой находится элемент. Например, высшая валентность фосфора равна V (т. к. фосфор находится в V группе), а низшая равна III. Только это правило применимо для элементов главных подгрупп V–VII групп.
Горизонтальные ряды химических элементов в Периодической таблице называются периодами. Пока их 7. Первые три периода называют малыми (первый период содержит всего 2 хим. элемента, а 2 и 3 – по 8 элементов). Периоды 4, 5, 6, 7 называются большими.
По положению элемента в Периодической системе можно определить его принадлежность к металлам или неметаллам. Для этого в короткой форме таблицы нужно провести диагональ от бериллия к астату. Элементы главных подгрупп, находящиеся выше этой диагонали (плюс водород), относятся к неметаллам. Все остальные элементы – металлы. Инертные газы He, Ne, Ar, Kr, Xe, Rn не относят ни к металлам, ни к неметаллам.
В длинной форме таблицы можно провести диагональ от бора к астату. Все элементы, которые находятся ниже этой диагонали, образуют простые вещества металлы.
Рис. Длинная форма периодической системы химических элементов
По положению элемента в периодической системе можно получить информацию о его высшем оксиде и гидроксиде. У неметаллов высший оксид и гидроксид имеют кислотный характер, у металлов – основный, у переходных металлов оксид и гидроксид, как правило, амфотерные (см. рис.).
Рис. Связь свойств элементов и образованных ими соединений
Открытие новых химических элементов
В 1875 году П.Л. Буабодран открыл галлий. В 1879 году Л.Ф. Нильсон открыл скандий, а в 1886 году К.Винклер откывает германий. Это соответственно были экабор , экаалюминий, экасилиций, предсказанные Д. И. Менделеевым.
С этого момента периодический закон и периодическая система Д. И. Менделеева становится общепризнанной всем мировым химическим сообществом. Особая заслуга Д. И. Менделеева заключается в том, что он не только расположил химические элементы в определенной последовательности, но и дал описательную характеристику своей периодической системы. При помощи её можно было предсказывать химические свойства различных химических элементов.
По этому поводу Д. И. Менделеев писал: « Утверждение закона возможно только при помощи вывода из него следствий, без него невозможных и неожидаемых, и оправдание тех следствий в опытной проверке. Потому-то, увидев периодический закон, я со своей стороны вывел из него такие логические следствия, которые могли показать — верен ли он или нет. Без такого способа испытания не может утвердиться ни один закон природы».
Д. И. Менделеев взял на себя смелость оставить пустые клетки в своей таблице и исправить некоторые значения атомных масс химических элементов, предсказать свойства еще неоткрытых целых групп соединений. Таким образом, Д. И. Менделеев является первооткрывателем одного из главных законов природы.
Значение периодического закона
«Будут появляться, и умирать новые теории, блестящие сообщения будут сменять наши понятия, величайшие открытия будут сводить на нет прошлые и открывать невиданные по новизне и широте горизонты – все это будет приходить, и уходить, Периодический закон Д.И. Менделеева будет всегда жить, развиваться и совершенствоваться» (А.Е. Ферсман)
2. Структура ПСХЭ
Графическим изображением периодического закона является периодическая таблица. Она содержит 7 периодов и 8 групп.
Короткая форма таблицы Д.И. Менделеева (полудлинный вариант таблицы Д.И. Менделеева)
Существует ещё и длинный вариант таблицы, он похож на полудлинный, но только лантаноиды и актиноиды не вынесены за пределы таблицы.
Оригинал таблицы Д. И. Менделеева
1. Период – химические элементы, расположенные в строчку (1 – 7)
Малые (1, 2, 3) – состоят из одного ряда элементов
Большие (4, 5, 6, 7) – состоят из двух рядов – чётного и нечётного
Периоды могут состоять из 2 (первый), 8 (второй и третий), 18 (четвертый и пятый) или 32 (шестой) элементов. Последний, седьмой период незавершен.
Все периоды (кроме первого) начинаются щелочным металлом, а заканчиваются благородным газом.
Во всех периодах с увеличением относительных атомных масс элементов наблюдается усиление неметаллических и ослабление металлических свойств. В больших периодах переход свойств от активного металла к благородному газу происходит более медленно (через 18 и 32 элемента), чем в малых периодах (через 8 элементов). Кроме того, в малых периодах слева направо валентность в соединениях с кислородом возрастает от 1 до 7 (например, от Na до Cl). В больших периодах вначале валентность возрастает от 1 до 8 (например, в пятом периоде от рубидия к рутению), затем происходит резкий скачок, и валентность уменьшается до 1 у серебра, потом снова возрастает.
2. Группы — вертикальные столбцы элементов с одинаковым числом валентных электронов, равным номеру группы. Различают главные (А) и побочные подгруппы (Б).
Главные подгруппы состоят из элементов малых и больших периодов.
Побочные подгруппы состоят из элементов только больших периодов.
В главных подгруппах сверху вниз металлические свойства усиливаются, а неметаллические ослабевают. Элементы главных и побочных групп сильно отличаются по свойствам.
Номер группы показывает высшую валентность элемента (кроме N, O, F).
Общими для элементов главных и побочных подгрупп являются формулы высших оксидов (и их гидратов). У высших оксидов и их гидратов элементов I — III групп (кроме бора) преобладают основные свойства, с IV по VIII — кислотные.
|
Группа |
I |
II |
III |
IV |
V |
VI |
VII |
VIII (кроме инертных газов) |
|
Высший оксид |
Э2О |
ЭО |
Э2О3 |
ЭО2 |
Э2О5 |
ЭО3 |
Э2О7 |
ЭО4 |
|
Гидрат высшего оксида |
ЭОН |
Э(ОН)2 |
Э(ОН)3 |
Н2ЭО3 |
Н3ЭО4 |
Н2ЭО4 |
НЭО4 |
Н4ЭО4 |
Для элементов главных подгрупп общими являются формулы водородных соединений. Элементы главных подгрупп I — III групп образуют твердые вещества — гидриды (водород в степени окисления — 1), а IV — VII групп — газообразные. Водородные соединения элементов главных подгрупп IV группы (ЭН4) — нейтральны, V группы (ЭН3) — основания, VI и VIIгрупп (Н2Э и НЭ) — кислоты.
ЦОРы
Видео урок: “ПСХЭ”
Вероятно речь идёт о s-, p-, d- и f-элементах. Определить это очень просто. У s- элементов заполняются электронами s- орбитали, y p- элементов — p-орбитали и т.д. Посмотрите в Периодическую таблицу. Скажем, второй период. У элемента Li конфигурация внешнего электронного слоя 2s1, то есть на s-орбитали имеется один электрон. Значит, Li — это s-элемент. Далее стоит Be. У него s-орбиталь содержит на один электрон больше, чем у Li, то есть конфигурация Be — 2s2. Это тоже s-элемент. Следующие 6-элементов (от B до Ne) — это p-элементы. У них электроны заполняют уже не s-орбиталь как у Li и Be, а p-орбиталь. Каждый следующий атом, начиная с Be, имеет на p-орбитали на один электрон больше, чем предыдущий.
Третий период совершенно аналогичен второму. Сначала идут два s-элемента: Na и Mg, затем идут 6 p-элементов: Al — Ar.
Четвертый период начинается снова с двух s-элементов (K, Ca). Но в третьем периоде существует «вставка» из 10-ти d-элементов (от Sc до Zn). У них заполняются d-орбитали. А после цинка идут 6 p-элементов (Ga-Kr).
Пятый период аналогичен четвертому. А вот в шестом периоде возникает еще одна «вставка» из 14-ти f-элементов. Их называют Лантаноиды и обычно выносят за пределы таблицы. У лантаноидов заполняются электронами f-орбитали. Итак, шестой период, как и все предыдущие периоды начинается с двух s-элементов (Cs, Ba), затем идёт один d-элемент La, затем идёт вставка f-элементов (Лантаноиды), затем с Hf до Hg происходит заполнение d-орбиталей (это d-элементы) и заканчивается период шестью p-элементами (Tl — Rh).
Седьмой период был бы аналогичен шестому, если бы был закончен.
Если Вы заметили, количество элементов каждого семейства в одном периоде равно максимальному количеству электронов на соответствующих орбиталях. Например, s-электронов два, s-элементов в одном периоде два, p-электронов шесть, p-элементов тоже шесть в одном периоде, d-электронов 10, а f-электронов 14, такое же количество d- и f- элементов в каждом периоде.
План урока:
Классификация химических элементов
Строение периодической системы
Периодический закон Д. И. Менделеева
Характеристика элемента по его положению в периодической системе
Классификация химических элементов
Начнём с истории создания ПСХЭ. В определённый момент XIX века, когда наука значительно шагнула вперёд и достаточно быстрыми темпами открывались новые химические элементы, возникла необходимость рассортировать их. Несмотря на то, чтои все они отличались по своим свойствам, в процессе изучения можно было выделить общие их свойства.
Год открытия периодической системы считается 1869. Она была колоссальным успехом того времени, а так же не теряет актуальность и на данный момент.
Но давайте всё рассмотрим по порядку, ведь над проблемой систематизации на протяжении многих лет работало много учёных, которые внесли большой вклад в развитие науки. В силу разных причин, они не смогли в полной мере классифицировать элементы.
Так, самая первая попытка была разделить на металлы и неметаллы, автором которой был шведский учёный Йёнс Якоб Берцелиус.
Что характерно для металлов?
Представим перед собой, предметы с железа, золота, алюминия. Что первое мы можем сказать о свойствах этих металлов? Все они имеют металлический блеск.
(Источник)
Также они (за исключением ртути) при нормальных условиях находятся в твёрдом виде. Имеют хорошую электропроводность и теплопроводность, высокую плотность. Эти признаки объединяют группу металлов.
Как мы можем описать неметаллические вещества?
Какие они будут иметь общие характеристики? В простых соединениях неметаллы могут быть как газы (кислород О2, хлор Cl2, азот N2), жидкости (бром Br2), так и твёрдые вещества (алмаз – самоё твёрдое вещество, образован Углеродом С, также сера S, кремний Si, фосфор Р, йод I2).Они могут быть не только разного агрегатного состояния, но и иметь разнообразную окраску.
Но, не смотря на такие резкие отличия между ними, возможно выделить общие черты: они диэлектрики и не пластичны. Большинство неметаллов имеют молекулярное строение. Данная классификация актуальна и в наше время.
Над классификацией элементов трудилось много учёных разных стран. Работая независимо друг от друга, они обнаружили интересный факт, что свойства элементов зависят от их атомной массы.
Немецкий химик И.В. Деберейнер отметил, что некоторые элементы сходны свойствами, и их можно объединить в группы, название которым дал – триады. Масса одного из элементов является средним арифметическим элементов с максимальной и минимальной массой в группе.

Недостатком данной систематизации является то, что данным способом удалось получить всего 5 триад. Не трудно подсчитать, что систематизировано было всего 15 элементов, а остальные 56 элементов не вписывались в его классификацию. Однако Деберейнер один из немногих заметил связь между свойствами и атомной массой элемента.
Ещё один необычный способ предложил французский химик А.Э. Шанкартуа. За основу он взял спираль и на её витках разместил элементы в порядке возрастания их атомных масс. Другое название она получила «Теллуровый винт», потому что заканчивалась Теллуром. Заслугой «спирали-винта» было обращение внимания на подобные свойства Водорода и галогенов (Cl, Br, I). Таким образом удалось систематизировать 50 элементов.
Как совершенству нет предела, так и фантазиям учёных. Так английский учёный Джон Ньюлендс связал элементы с музыкой, он предоставил их в виде нот и заострил своё внимание на том, что каждый восьмой повторяет свойства первого.
(Источник)
Как оказалось, и эта классификация имеет недочёты, во-первых, она не располагала местом для новых элементов, а, во-вторых, в одно семейство попадали элементы с разными свойствами, которые не имели ничего общего: Cl и Pt, S, Fe и Au. Однако данная систематизация имела и положительные моменты, учёные заметили, что периодичность возникает на 8 элементе по счёту, также появилось понятие порядковый номер.
Отдельно хочется выделить немецкого учёного Лотара Мейера. Он разместил 28 элементов в виде таблицы. В принцип создания таблицы он заложил атомную массу, её увеличение, а также выделил столбцы элементов с одинаковой валентностью.
Ему понадобилось почти шесть лет, чтобы усовершенствовать свою таблицу и расположить остальные элементы, которые он не учёл в версии таблицы, выданной в 1864 году. Ошибка Мейера заключалась в том, что не было никаких обобщений и выводов, но как видно, он был близок к открытию не только периодической системы, но и закона.
Схема показывает, что учёные не одно десятилетие работали над созданием упорядоченной таблицы для элементов. Необходим был фундаментальный закон, который будет применим в естествознании.
(Источник)
В 1869 году русский учёный Дмитрий Менделеев создаёт периодическую систему. Об истории написания таблицы существует множество легенд, как и самом учёном. Менделеев был достаточно многогранной личностью, он трудился в разных сферах науки. Открыл секрет изготовления бездымного пороха, придумал способ передачи нефти, используя трубопровод. К нефти он особенно относился, считая сжигание нефти кощунством, так как она служит источником для получения множества вещества. «Человек-чемодан» можно также услышать о нём, потому что любимым его делом было изготавливать чемоданы. Но самой значимой его заслугой было создание периодической системы, которую, поговаривают, создал он во сне.
Строение периодической системы
Для начала рассмотрим понятия таблица и система. Вы не один раз видели таблицу, она состоит из строк и столбцов. Но почему творение Менделеева имеет названия как таблица, так система да еще и с добавлением периодическая.
В таблице содержится упорядоченная информация в определённом порядке. Система указывает, что сведения связаны между собой. Периодичность означает, что через какой-то промежуток или отрезок происходит повторение свойств.
Как уже известно, в периодической системе находятся элементы. Принцип их расположения — это увеличение их атомной массы.
В таблице имеются строки – это периоды, и столбцы – группы.
Существует несколько вариантов ПСХЭ, так называемый короткий и длинный вариант.
Короткий вариант имеет 8 групп, номера которых указаны римскими цифрами I, II…VIII, содержит главную (А) и побочную (В) группы. Длинный формат вмещает 18 групп, нумерация осуществляется арабскими цифрами I, II…XVIII,
Если посмотреть на таблицу, то видим закономерность, так как абсолютно каждый период будет начинаться активным металлом и заканчиваться инертным газом. Такая периодичность сохраняется 7 раз.
Как видно из таблицы, I период включает 2 элемента, II и III состоят из 8, IV и V содержат 18, самые большие – это VI и VII вмещают 32 элемента (VII период незаконченный).
В периоде с ростом атомной массы металлические свойства уменьшаются, неметаллические – увеличиваются.
Вертикальные столбцы образуют группы. Это условно компании, где собираются единомышленники. Точнее, располагаются элементы, подобные по своим свойствам.
Обратите внимание, что подобие характерно только в пределах подгруппы. Так, натрий и медь принадлежат одной I группе, но располагаются в разных подгруппах. Натрий – элемент главной подгруппы, медь – побочной. Именно по этой причине они будут иметь разные физические и химические свойства.
В пределах группы с ростом атомной массы металлические свойства увеличиваются, неметаллические – уменьшаются.
Таким образом, периодическую систему можно условно назвать домом химических элементов, где каждый из них занимает своё определённое место (порядковый номер) согласно его свойствам.
Рассмотрим подробнее на примере 2 и 3 периода. Что показывает сравнение: оба периода начинаются с активных металлов Li и Na, для которых характерно существование в виде соединений, в свободном виде могут находиться только под слоем керосина. Они относятся к группе щелочных металлов. Анализируя схему, мы видим, что первые три группы образованны металлами. С IV – VII находятся неметаллы. «Закрывают период» инертные газы.
Особое внимание располагают к себе элементы VI и VII периоды, которые образуют «семейство» лантаноидов (Лантан № 57) и актиноидов (Актиний 89), они формально близки к скандию. Но из-за их количества они вынесены за пределы системы.
Периодический закон Д. И. Менделеева
Проанализировав изменения свойств элементов II и III периода, можно сделать выводы, которые Д. И. Менделеев записал в виде периодического закона.
Благодаря периодическому закону, зная расположение элемента в периодической системе, мы можем прогнозировать свойства веществ. Элементы входят в состав как простых, так и сложных веществ, влияя при этом на их свойства. Обобщить данные тезисы можно в виде таблицы.

Рассмотрим на примере I группы. Li, Na, K, Cs, Fr собрались в компанию одновалентных металлов, которые образуют основные оксиды состава Ме2О. При взаимодействии с водой образуют щёлочь. Эти характеристики их объединяют. Теперь рассмотрим отличия. Вам уже известно, что в пределах группы с ростом атомной массы металлические свойства увеличиваются.
Как это сказывается на реакционной способности данных металлов?
Интенсивность и скорость реакции калия и лития с водой будет отличаться. Реакция калия будет сопровождаться бурным выделением водорода, в то время как литий будет спокойно реагировать с водой.
Зная формулу и состав высшего оксида, можем предположить его характер. Например, марганец образует оксиды MnO, MnO2, Mn2O7. Таблица поможет нам предположить их свойства.
MnO – будет основным оксидом (ищем аналогию со II группой), ему будет отвечать основание Mn(OH)2. Не трудно догадаться, что MnO2 и Mn2O7 будут кислотными (подобно IV и VII группе), они образуют кислоты H2MnO3 и HMnO4.
Свинец образует два оксида PbO и PbO2. Оксид свинца (II) PbO будет основной, оксид свинца (IV)PbO2– кислотный.
Характеристика элемента по его положению в периодической системе
Зная «прописку» элементов в таблице, мы можем прогнозировать их свойства. Составим план, согласно которому сможем описать свойства элементов, рассматривать будем на примере серы.
Первое, что нам необходимо знать — это какой символ имеет сера, чтобы по нему найти её в ПСХЭ. Обозначение S занимает ячейку 16. (порядковый номер).
Уточняем «прописку». III период, VI группа, главная подгруппа. Зная эти элементарные сведения, мы предполагаем, что это неметалл (принадлежность к VI группе и нахождение в малом ряду даёт нам основание для предположения).
Формула высшего оксида и его свойства. Поскольку сера элемент VI группы, высшая валентность будет равна VI. Формула оксида SO3. Пользуясь таблицей-шпаргалкой, определяем характер – кислотный. С курса физики известно, что противоположности притягиваются. Как плюс притягивает минус, так и кислотные оксиды взаимодействуют с основными, которые образованы элементами-металлами с валентностью I или II. Возьмём, например, барий, который образует оксид и гидроксид, соответственно ВаO и Вa(OH)2.
ВаO + SO3 → ВаSO4
Ва(ОН)2 + SO3 → ВаSO4 + H2O
Формула высшего гидроксида и его свойства. Снова обратимся к нашей шпаргалке, высшие гидроксиды VI группы имеют формулу H2ЭO4, а именно H2SO4. Образованный гидроксид имеет кислотные свойства, для которого свойственны реакции с основными оксидами и основаниями. К примеру, возьмём двухвалентный стронций, формула оксида и гидроксида соответственно SrO и Sr(OH)2.
SrO + H2SO4→ SrSO4 + H2O
Sr(OH)2 + H2SO4 → SrSO4 + 2H2O
Как элемент-неметалл образует летучее водородное соединение состава H2S.
На данном примере убеждаемся, что зная расположение элемента в ПСХЭ, можно прогнозировать его свойства, а также свойства веществ, в состав которых он входит.
Elements are grouped into families in the periodic table.
Digital Art / Getty Images
Updated on October 27, 2019
Elements may be categorized according to element families. Knowing how to identify families, which elements are included, and their properties helps predict behavior of unknown elements and their chemical reactions.
Element Families
Element families are indicated by numbers located at the top of the periodic table.
Todd Helmenstine
An element family is a set of elements sharing common properties. Elements are classified into families because the three main categories of elements (metals, nonmetals, and semimetals) are very broad. The characteristics of the elements in these families are determined primarily by the number of electrons in the outer energy shell. Element groups, on the other hand, are collections of elements categorized according to similar properties. Because element properties are largely determined by the behavior of valence electrons, families and groups may be the same. However, there are different ways of categorizing elements into families. Many chemists and chemistry textbooks recognize five main families:
5 Element Families
- Alkali metals
- Alkaline earth metals
- Transition metals
- Halogens
- Noble gases
9 Element Families
Another common method of categorization recognizes nine element families:
- Alkali Metals: Group 1 (IA) — 1 valence electron
- Alkaline Earth Metals: Group 2 (IIA) — 2 valence electrons
- Transition Metals: Groups 3-12 — d and f block metals have 2 valence electrons
- Boron Group or Earth Metals: Group 13 (IIIA) — 3 valence electrons
- Carbon Group or Tetrels: — Group 14 (IVA) — 4 valence electrons
- Nitrogen Group or Pnictogens: — Group 15 (VA) — 5 valence electrons
- Oxygen Group or Chalcogens: — Group 16 (VIA) — 6 valence electrons
- Halogens: — Group 17 (VIIA) — 7 valence electrons
- Noble Gases: — Group 18 (VIIIA) — 8 valence electrons
Recognizing Families on the Periodic Table
Columns of the periodic table typically mark groups or families. Three systems have been used to number families and groups:
- The older IUPAC system used Roman numerals together with letters to distinguish between the left (A) and right (B) side of the periodic table.
- The CAS system used letters to differentiate main group (A) and transition (B) elements.
- The modern IUPAC system uses Arabic numbers 1-18, simply numbering the columns of the periodic table from left to right.
Many periodic tables include both Roman and Arabic numbers. The Arabic numbering system is the most widely accepted today.
Alkali Metals or Group 1 Family of Elements
The highlighted elements of the periodic table belong to the alkali metal element family.
Todd Helmenstine
The alkali metals are recognized as a group and family of elements. These elements are metals. Sodium and potassium are examples of elements in this family. Hydrogen is not considered an alkali metal because the gas does not exhibit the typical properties of the group. However, under the right conditions of temperature and pressure, hydrogen can be an alkali metal.
- Group 1 or IA
- Alkali Metals
- 1 valence electron
- Soft metallic solids
- Shiny, lustrous
- High thermal and electrical conductivity
- Low densities, increasing with atomic mass
- Relatively low melting points, decreasing with atomic mass
- Vigorous exothermic reaction with water to produce hydrogen gas and an alkali metal hydroxide solution
- Ionize to lose their electron, so the ion has a +1 charge
Alkaline Earth Metals or Group 2 Family of Elements
The highlighted elements of this periodic table belong to the alkaline earth element family.
Todd Helmenstine
The alkaline earth metals or simply alkaline earths are recognized as an important group and family of elements. These elements are metals. Examples include calcium and magnesium.
- Group 2 or IIA
- Alkaline Earth Metals (Alkaline Earths)
- 2 valence electrons
- Metallic solids, harder than the alkali metals
- Shiny, lustrous, oxidize easily
- High thermal and electrical conductivity
- More dense than the alkali metals
- Higher melting points than alkali metals
- Exothermic reaction with water, increasing as you move down the group; beryllium does not react with water; magnesium reacts only with steam
- Ionize to lose their valence electrons, so the ion has a +2 charge
Transition Metals Element Family
The highlighted elements of this periodic table belong to the transition metal element family. The lanthanide and actinide series below the body of the periodic table are transition metals, too.
Todd Helmenstine
The largest family of elements consists of transition metals. The center of the periodic table contains the transition metals, plus the two rows below the body of the table (lanthanides and actinides) are special transition metals.
- Groups 3-12
- Transition Metals or Transition Elements
- The d and f block metals have 2 valence electrons
- Hard metallic solids
- Shiny, lustrous
- High thermal and electrical conductivity
- Dense
- High melting points
- Large atoms exhibit a range of oxidation states
Boron Group or Earth Metal Family of Elements
These are the elements belonging to the boron family.
Todd Helmenstine
The boron group or earth metal family is not as well-known as some of the other element families.
- Group 13 or IIIA
- Boron Group or Earth Metals
- 3 valence electrons
- Diverse properties, intermediate between those of metals and nonmetals
- Best-known member: aluminum
Carbon Group or Tetrels Family of Elements
The highlighted elements belong the carbon family of elements. These elements are collectively known as the tetrels.
Todd Helmenstine
The carbon group is made up of elements called tetrels, which refers to their ability to carry a charge of 4.
- Group 14 or IVA
- Carbon Group or Tetrels
- 4 valence electrons
- Diverse properties, intermediate between those of metals and nonmetals
- Best-known member: carbon, which commonly forms 4 bonds
Nitrogen Group or Pnictogens Family of Elements
The highlighted elements belong to the nitrogen family. These elements are collectively known as pnictogens.
Todd Helmenstine
The pnictogens or nitrogen group is a significant element family.
- Group 15 or VA
- Nitrogen Group or Pnictogens
- 5 valence electrons
- Diverse properties, intermediate between those of metals and nonmetals
- Best-known member: nitrogen
Oxygen Group or Chalcogens Family of Elements
The highlighted elements belong to the oxygen family. These elements are called chalcogens.
Todd Helmenstine
The chalcogens family is also known as the oxygen group.
- Group 16 or VIA
- Oxygen Group or Chalcogens
- 6 valence electrons
- Diverse properties, changing from nonmetallic to metallic as you move down the family
- Best-known member: oxygen
Halogen Family of Elements
The highlighted elements of this periodic table belong to the halogen element family.
Todd Helmenstine
The halogen family is a group of reactive nonmetals.
- Group 17 or VIIA
- Halogens
- 7 valence electrons
- Reactive nonmetals
- Melting points and boiling points increase with increasing atomic number
- High electron affinities
- Change state as it moves down the family, with fluorine and chlorine existing as gases at room temperature while bromine is a liquid and iodine is a solid
Noble Gas Element Family
The highlighted elements of this periodic table belong to the noble gas element family.
Todd Helmenstine
The noble gases are a family of nonreactive nonmetals. Examples include helium and argon.
- Group 18 or VIIIA
- Noble Gases or Inert Gases
- 8 valence electrons
- Typically exist as monatomic gases, although these elements do (rarely) form compounds
- Stable electron octet makes nonreactive (inert) under ordinary circumstances
Sources
- Fluck, E. «New Notations in the Periodic Table.» Pure Appl. Chem. IUPAC. 60 (3): 431–436. 1988. doi:10.1351/pac198860030431
- Leigh, G. J. Nomenclature of Inorganic Chemistry: Recommendations. Blackwell Science, 1990, Hoboken, N.J.
- Scerri, E. R. The periodic table, its story and its significance. Oxford University Press, 2007, Oxford.