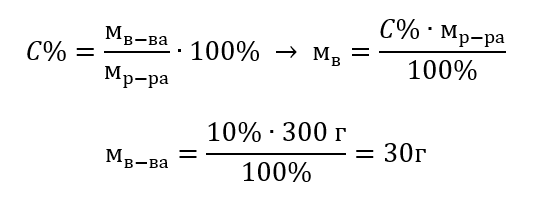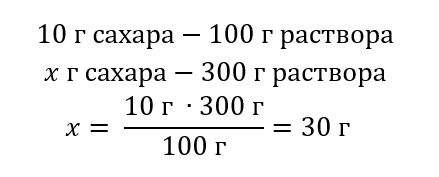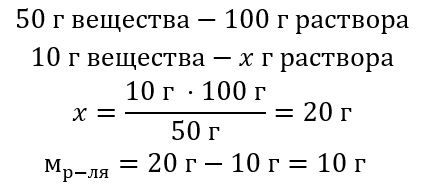Смесь, состоящая из частиц растворителя, растворяемого вещества и продуктов их взаимодействия, называется раствором. Это гомогенные структуры однородной консистенции, состоящие из двух либо нескольких компонентов. Решение задач на растворы – определение их концентрации, степени растворимости веществ, условий протекания растворообразующих процессов.
Задачи на растворы по химии
Чистое вещество либо смесь нескольких компонентов, попадая в растворитель, могут проявлять свойства:
- хорошей растворимости;
- малой растворимости;
- быть нерастворимыми.
При растворении в воде образуются многочисленные атомно-молекулярные связи. Их количество зависит от коэффициента растворимости – химической величины, которая рассчитывается путем деления массы растворяемого вещества на массу растворителя.
Кроме этого, в задачах могут присутствовать массовая доля вещества, растворенного в соответствующем растворителе.
Как решать задачи с процентными растворами
Растворы с выраженной концентрацией активного (растворенного) вещества носят название процентных. В задачах по химии ставятся цели определить содержание массы растворенного вещества, массы образовавшегося либо первоначального раствора, процентного содержания вещества до или после растворения.
Растворы, о которых идет речь в задачах по химии, обладают общими свойствами:
- они однородны;
- смешивание компонентов происходит за малый отрезок времени, как и изменение их концентрации;
- в результате смешивания двух (или более) растворов с различной концентрацией, происходит не только увеличение общей массы и объема раствора, но и усреднение процентного содержания растворенного вещества.
Поэтому существуют общие принципы их решения. Так, увеличение концентрации происходит в результате упаривания (испарения растворителя), а уменьшение – разбавления. В результате смешения может наблюдаться как увеличение, так и уменьшение, в зависимости от конкретных условий задачи.
В любом случае характеристики начального и конечного продуктов будут различаться, поэтому важно, данные в условии сведения не перепутать. Для этого применяется их нумерация.
Чтобы грамотно составить алгоритм решения, часто бывает полезно использовать уравнение химической реакции относительно активного вещества либо кислоты.
Концентрация растворов и способы ее выражения
На бытовом уровне понятие концентрации раствора выражается в отношении массы растворенного вещества к массе раствора, выраженном в процентах. Однако правомерно более широкое определение, охватывающее различные способы выражения концентрации.
Концентрация раствора – количественный показатель состава активного вещества в растворе, выраженное в определенных единицах и заключенное в единице массы или объема. Выражается в долях, процентах, массовых долях, молярности, мольных долях, титрах. Из них чаще применяются молярность и мольная доля.
1. О массовой доле ((omega)) идет речь в задачах, когда можно составить соотношение масс растворенного компонента и всего раствора. Для ее выражения существует формула:
(omega=M_{в-ва}div M_{р-ра})
Выражается она в процентах либо долевых частях единицы.
2. Молярность (по-другому – молярная концентрация) или (С) показывает сколько молей растворяемого компонента содержится в литре раствора. Ее формула имеет вид:
(С=ndiv V)
где (n) – это растворенное вещество в молях. Исходя из его значения, раствор может быть одномолярным (содержит 1 моль в 1 литре), децимолярным (0,1 моля в 1 л), сантимолярным (0,01 моль) и т.д.
3. Концентрация моляльная (обозначается (С_х)) – моляльность – показатель количества (n) молей растворенного компонента в 1 кг растворителя ((M_{р-ля})).
(C_x=ndiv M_{р-ля})
4. Для определения содержания (в граммах) вещества в 1 л раствора применяется понятие «титр» ((Т)).
(T=M_{в-ва}div V_{р-ра})
5. Под растворимостью ((S)) понимают максимальную массу растворяемого вещества, способного раствориться в 100 г растворителя:
(S=(M_{в-ва}div M_{р-ля})times100 {})
6. Коэффициент растворимости ((K_s)) – показатель, который определяется отношением массы вещества к массе растворителя при условии получения насыщенного раствора при обозначенной температуре:
(K_s=M_{в-ва}div M_{р-ля})
Решение задач на упаривание растворов
Выпаривание раствора происходит в результате испарения воды, что ведет за собой уменьшение общего объема и массы. В то же время масса растворенного вещества остается без изменений. Существуют случаи, когда, кроме растворителя, испаряется растворенное вещество, если оно обладает повышенной летучестью.
Пример. Водный раствор аммиака
Рассмотрим пример решения задачи на упаривание.
Условие: В наличии 800 г раствора с 15%-ной концентрацией определенного вещества. Нужно увеличить его массовую долю на 5%. Сколько г воды должно испариться?
Этапы решения:
- Какова масса вещества в первичном растворе?
(M_в=omega_вtimes M_р=0,15×800=120)г, где (M_в) — масса вещества, (M_р) — масса раствора
Найденное значение останется постоянным, поскольку при выпаривании изменения массы растворенного вещества не происходит. Значит M’=120г
2. (M_р=M_вdivomega_в= 120÷0.2=600)г
3. Теперь можно найти массу испаренной воды:
(M{исп;в}=M_р-M’=800-600=200)г
Решение задач на разбавление растворов
В результате процесса разбавления масса того вещества, которое растворено, не меняется в отличие от массы всего раствора и растворителя.
Задача
Масса имеющегося раствора NaCl 200г, его концентрация – 15%. К раствору добавлено 40г воды. Определить массовую долю NaCl в конце реакции.
Решение
1. Определение массы раствора в конце процесса:
(M’=M_{р-ра}+M_{добH2O}=240)г
2. Определение массы NaCl в начале процесса:
(M_{NaCl}=(omega_{NaCl}times M_р)div100%=15%times200гdiv100%=30 {})г
В конечном растворе (M’_ {NaCl}=M_{NaCl})
3. Определение массовой доли NaCl в конце процесса:
(omega’_{NaCl}=M_{NaCl}div M’_рtimes100%=12,5%)
Решение задач на концентрирование растворов
Повышение концентрации происходит при добавлении вещества в раствор. При этом конечная масса растворенного вещества равна сумме первоначального содержимого и того, который добавлен.
Задача. Имеется 180 г раствора с 8%-ной концентрацией соли (формула NaCl). В этот раствор всыпали еще 20 г поваренной соли. Какая массовая доля NaCl получилась в конце реакции?
Решение
1. Определение окончательной массы раствора:
(M’_р=M_р+M_{доб}=200)г
2. Определение конечной массы NaCl:
M’=M+Mдоб
Следовательно, нужно найти (M) – массу в начале процесса.
(M=(omega_{NaCl}times M_р)÷100%=14,4)г
Тогда (M’=14,4г+20г=34,4)г
3. Определение массовой доли NaCl в конечном продукте:
(omega’=M’_{NaCl}div M’_рtimes100%=17,2%)
Решение задач на смешение растворов
Смешение растворов с различной концентрацией растворенного вещества происходит с соблюдением «конверта Пирсона». Это – диагональная модель, при которой нельзя складывать массовые доли, а можно – лишь массы растворенных компонентов и растворов.
Задача
Дано два раствора с массами (M) и (M_1). Массовые доли растворенного вещества обозначим соответственно (ω) и (ω_1). В конечном продукте аналогичная величина – (ω_3). Необходимо приготовить третий раствор с отличной от имеющихся концентраций.
Решение
1. Определение общей массы растворенного вещества:
(M_1omega_1+M_2omega_2=omega_3(M_1+M_2))
2. Математические действия:
(M_1(omega_1-omega_3)=M_2=(omega_3-omega_2))
(M_1div M_2=(omega_3-omega_2)div(omega_1-omega_3))
Следовательно, согласно этому математическому выражению, и нужно взять соотношение растворов.
Задачи на определение процентной концентрации раствора
Задача 1
Какая процентная концентрация раствора (KNO_3), если нормальная равна (0,2) моль/л. Плотность равна (1) г/мл.
Решение:
1. Определение массы раствора объемом (1000) мл:
(M=rhotimes V=1times1000=1000)г
2. Составление и решение следующей пропорции:
(20,0)г (KNO_3) — (1000) г раствора
(Х_г) — (100) г раствора
(Х=2,02) г или (ω=2,02%)
Задача 2
Нужно приготовить (300) г 25%-ного раствора соли, имея 60%-ный и 10%-ный. Сколько нужно взять таких компонентов (m1 и m2)?
Для решения применим правило Креста:
1. Определение веса одной из 50-ти частей образуемого раствора:
(300div5=6)
2. Определение массы каждой части (m_1) и (m_2):
(m_1=6times15=90)
(m_2=6times35=210)
Задача 3
Используя 250г 45%-ного раствора соли, нужно понизить его концентрацию до 10%. Сколько воды необходимо использовать?
Концентрация соли в воде, используемой в качестве добавки, равна 0.
По методу креста образуется 45 частей раствора:
Решение
1. Масса одной части первичного раствора равна: (250div10=25)г
2. Определение массы воды, что необходима: (25times35=875)г
С целью проверки можно выполнить следующие действия:
1. Определение массы конечного продукта-раствора:
(875+25=1125г)
2. Для исходного раствора действует пропорция:
В 250г 40%-ного р-ра содержится Хг соли
в 100 г – 45г
Отсюда Х=112,5 г соли
3. Определение конечной концентрации раствора:
1125 г раствора – 112,5 соли
100г – Х
Х=10г или 10%
Следовательно, нужно взять 875 г воды.
Решать задачи на растворы – интересное занятие! Знание основных закономерностей будет полезно с теоретической и практической точек зрения. Однако бывают случаи, когда нужно быстро сдать контрольную либо перепроверить собственные решения. Тогда можно обратиться на сайт ФениксХелп.
В химии мы часто используем такие термины, как «концентрированный раствор», «разбавленный раствор» и «насыщенный раствор», но они дают нам лишь приблизительное представление о том, много или мало вещества в растворе. Однако есть несколько способов точно определить, каков его количественный состав. Об одном из них Вы прочтете в следующей статье.

Определение процентной концентрации
Понятие концентрации означает величину количества вещества, находящегося в данном растворе. Концентрация может быть указана в единицах в зависимости от размера, который мы используем, например, в молях, граммах или процентах. Процентная концентрация говорит нам, сколько массовых частей растворенного вещества содержится в 100 массовых частях раствора. Другими словами, это количество граммов растворенного вещества в 100 г раствора. Например, если мы покупаем молоко 3,2%, это означает, что в 100 г молока содержится 3,2 г жира. Процентная концентрация обозначается символом «C%».
Общая формула для процентной концентрации
Чтобы вывести формулу процентной концентрации, следует помнить, что масса раствора (мр-ра) — это не только масса растворителя (мр-ля), но и растворенного в нем вещества (мв-ва):
мр-ра = мр-ля + мв-ва
Взяв в качестве примера 4-процентный раствор массой 100 г, мы знаем, что C% = 4%, значит масса вещества равна 4 г. Из определения процентной концентрации следует, что, поскольку масса раствора составляет 100 г, масса растворителя составляет 96 г.
Процентная концентрация может быть рассчитана по формуле:
C% = (мв-ва/мр-ра) · 100%
Из формулы следует, что, зная массу раствора и массу вещества, мы можем легко вычислить процентную концентрацию. Например, зная, что раствор имеет массу 450 г, а растворенного вещества в нем 15 г, подставив в формулу, получим:
C% = (15/450) · 100% = 3,3%
Расчет массы отдельных компонентов раствора
Любая формула, в том числе формула процентной концентрации, может быть преобразована. Зная процентную концентрацию раствора и его массу, можно рассчитать массу растворенного в нем вещества. Аналогично, зная процентную концентрацию и массу вещества, можно рассчитать массу раствора. В дополнение к преобразованиям формулы можно также использовать соответствующие пропорции.
Пример 1. Сколько граммов сахара потребуется для приготовления 300 г 10%-го раствора?
Из содержания задания мы знаем, что масса раствора 300 г и его процентная концентрация 10 %. Определение массы растворенного вещества возможно двумя способами.
Способ 1. Преобразование формулы
Способ 2. Использование пропорции, зная, что 10%-ый раствор содержит 10 г сахара в 100 г раствора
Результатом обоих способов решения является то, что для приготовления 300 г 10%-ого раствора необходимо использовать 30 г сахара.
Пример 2. В скольких граммах воды надо растворить 10 г вещества, чтобы получить 50%-ый раствор?
Из содержания задания мы знаем, что масса вещества 10 г, а процентная концентрация раствора 50 %. Это означает, что в 100 г раствора содержится 50 г вещества. Определение массы раствора возможно двумя способами. Следует помнить, что масса раствора не равна массе растворителя. Для расчета массы растворителя из массы раствора следует вычесть массу вещества.
Способ 1. Преобразование формулы
Способ 2. Использование пропорции, зная, что в 100 г раствора содержится 50 г вещества.
Решение задания двумя способами заключается в том, что для получения 50%-ого раствора необходимо растворить 10 г вещества в 10 г воды.
Приготовление растворов
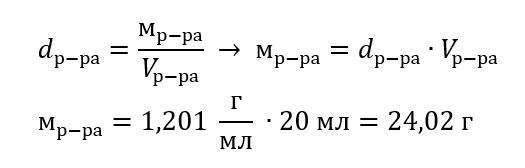
Ключевым элементом лабораторной работы является способность готовить растворы с заданными концентрациями. Для этого необходимо знать массы его компонентов. Рассчитанную ранее массу вещества следует растворить в точно отмеренном объеме растворителя. Необходимый объем можно рассчитать, зная массу и плотность жидкости. Плотность раствора – физическая величина, характерная для данной жидкости, определяющая ее массу для конкретной единицы объема. Значение сильно зависит от температуры. Зная, что плотность раствора равна 2,03 г/мл, мы знаем, что 1 мл данного раствора имеет массу 2,03 г. Наиболее распространенными единицами плотности являются: г/мл = г/см3, г/л = г/дм3, но могут встречаться и другие единицы, например кг/м3. Плотность раствора определяется по формуле: dр-ра=мр-ра/vр-ра, где mр-ра означает массу раствора, а Vр-ра – его объем. Зная объем данного раствора и его плотность, можно вычислить его массу.
Пример 3. Какую массу имеет 20 мл раствора, плотность которого составляет 1,201 г/мл?
Способ 1. Преобразование формулы
Способ 2. Использование пропорции, зная, что 1,201 г раствора занимает объем 1 мл
Оба способа показали, что раствор с плотностью 1,201 г/мл, занимающий 20 мл, имеет массу, равную 24,02 г.
Знание понятия плотности позволяет нам проводить еще больше расчетов по процентной концентрации.
Пример 4. Сколько граммов соли содержится в 10 мл раствора с концентрацией 15%, если его плотность составляет 1,035 г/мл?
Способ 1. Преобразование формул
Способ 2. Использование пропорции
Оба способа показали, что для приготовления 10 мл раствора с C% = 15%, плотностью 1,035 г/мл необходимо взвесить 1,553 г соли.
Пример 5. Какова процентная концентрация раствора, полученного при растворении 40 г вещества в 200 мл этанола плотностью 0,78 г/мл?
Для расчета задания можно использовать преобразование формулы в процентную концентрацию. Мы можем рассчитать массу раствора, сложив массу растворенного вещества и массу растворителя. В связи с тем, что в содержании задания не указана масса растворителя, а даны его плотность и объем, то путем преобразования формулы в плотность можно вычислить недостающие данные.
Большинство реактивов продаётся в сухом виде: это или порошок, или мелкие гранулы. Однако используются реактивы чаще всего в виде растворов. Поэтому один из самых частых вопросов от наших покупателей – как из сухого вещества сделать раствор нужной концентрации.
Напоминаем, что все работы с химическими веществами следует проводить с соблюдением необходимых мер безопасности! Используйте средства индивидуальной защиты органов дыхания, глаз и кожных покровов!
В зависимости от способа и методики приготовления растворы можно разделить на приблизительные и точные. Вторые можно приготовить только в лабораторных условиях с использованием дорогостоящего оборудования и посуды.
С другой стороны, “точности” приблизительных растворов вполне достаточно для проведения домашних опытов, удаления ржавчины или загрязнения, очистки или обеззараживания воды в аквариуме или в бассейне, для таких хобби, как химическая металлизация, печать фотографий, выращивание кристаллов, изготовления мыла и свечей и многих других целей.
Растворение химических веществ может производится в разных средах – воде, спирте, кислотах и т.д. В этой статье мы будем говорить только о растворении в воде.
Что такое концентрация раствора?
Концентрацию раствора выражают в процентах, например 10% раствор или 0,5% раствор. Эта цифра показывает, сколько частей вещества приходится на 100 частей раствора.
Так, в 100 граммах 10%-го раствора поваренной соли находится 10 грамм соли и 90 грамм воды. А в 500 граммах 30%-го раствора гидроксида натрия содержится 150 грамм NaOH и 350 грамм воды. Один килограмм 0,2%-го раствора нитрата серебра состоит из 2 грамм нитрата серебра и 998 грамм воды.
Отметим, что существует разница между массовой концентрацией и объемной концентрацией растворов, и эта разница тем больше, чем больше концентрация растворенного вещества и плотность раствора.
Например, чтобы приготовить 1 килограмм 15%-го раствора NaCl нужно смешать 150 грамм соли и 850 грамм воды. Для приготовления же 1 литра 15%-го раствора NaCl понадобится уже 166,2 грамм NaCl и 941,8 грамм воды (при растворении соли в воде объём раствора несколько увеличится), и плотность увеличится с 1,000 (на самом деле 0,998) до 1,108.
Объясняется такая разница тем, что плотность солевого раствора выше, чем плотность чистой воды.
В этой статье, для упрощения, речь всегда будет идти о массовой концентрации раствора, то есть вес раствора будем измерять в граммах, а не в миллилитрах.
Приготовление водного раствора из сухого безводного реактива
Прежде всего, определитесь – какой вес раствора вам понадобится. Если раствор этого вещества нестабилен или он вам нужен для какой-то разовой работы – готовьте столько раствора, сколько нужно сейчас. Если же раствор хорошо хранится и используется время от времени, можно приготовить его с запасом.
Теперь рассчитаем количество вещества, которое нужно взять для приготовления определенной массы раствора определённой концентрации:
Масса вещества в граммах = (концентрация раствора в процентах) * (масса раствора в граммах/100)
Соответственно, масса воды вычисляется как разница между общей массой раствора и массой сухого вещества.
Пример 1: приготовим 5%-й раствор гидроксида натрия (NaOH) массой 500 грамм.
Масса NaOH = (5) * (500 гр/100) = 25 грамм.
Масса воды = 475 грамм.
Пример 2: приготовим 37%-й раствор аммония фосфорнокислого (NH4H2PO4) массой 750 грамм.
Масса (NH4H2PO4) = (37) * (750 гр/100) = 277,5 грмм.
Масса воды = 472,5 грамм.
Остаётся растворить навеску сухого реактива в рассчитанном объёме воды.
Приготовление раствора из водных солей (кристаллогидратов)
Откуда взялась вода в сухом реактиве и что такое “водность” вещества – можно прочитать здесь…
Если вам нужно приготовить раствор из вещества, содержащего кристаллизационную воду (например, медный купорос CuSO4*5H2O, хромокалиевые квасцы KCr(SO4)2*12H2O и тому подобные вещества), то методика расчетов меняется, чтобы учесть уже имеющуюся в веществе воду.
Опять же, начинаем с определения массы раствора, который мы хотим приготовить. Затем вычисляем, сколько вещества должно содержаться в растворе такой массы нужной нам концентрации – формула та же, что и при использовании безводных реактивов.
Масса вещества в граммах = (концентрация раствора в процентах) * (масса раствора в граммах/100)
Далее, пересчитываем массу вещества на кристаллогидрат. Для этого в справочниках (Яндекс или Google – наше всё) находим молярные массы безводной формы этого вещества и кристаллогидрата и вычисляем соотношение – сколько вещества в безводной форме содержится в кристаллогидрате. Так, если молярная масса кристаллогидрата 150 грамм/моль, а безводная форма этого вещества имеет молярную массу 70 грамм/моль, это значит, что в 150 грамм кристаллогидрата содержатся 70 грамм безводной формы вещества.
Определив, какое количество кристаллогидрата вещества нам нужно растворить, вычисляем необходимую массу воды.
Пример 1. Приготовим 500 грамм 15%-го раствора карбоната натрия 10-водного Na2CO3∙ 10H2O
Определяем массу карбоната натрия в 500 граммах 15%-го раствора:
Na2CO3 = (15) * (500 гр/100) = 75 грамм
Делаем пересчет массы на кристаллогидрат. Молярная масса Na2CO3 = 106 грамм/моль, молярная масса Na2CO3∙ 10H2O = 286 грамм/моль. Таким образом, 286 грамм карбоната натрия 10-водного содержат 106 грамм карбоната натрия безводного.
Нам нужно, чтобы в растворе оказалось 75 грамм карбоната натрия безводного. Составляем пропорцию и получаем, что нужно взять 202 грамма карбоната натрия 10-водного.
Последний шаг – посчитать нужное количество воды. 500 грамм минус 202 грамма = 298 грамм воды.
Пример 2. Приготовим 1000 грамм 3%-го раствора сульфата магния 7-водного MgSO4∙ 7H2O
Определяем массу сульфата магния в 1000 граммах 3%-го раствора:
MgSO4 = (3) * (1000 гр/100) = 30 грамм
Делаем пересчет массы на кристаллогидрат. Молярная масса (MgSO4) = 120 грамм/моль, молярная масса (MgSO4∙ 7H2O) = 246 грамм/моль.
Вычисляем, что для того, чтобы получить в растворе 30 грамм сульфата магния нужно взять 62 грамма сульфата магния 7-водного.
Смешиваем 938 грамм воды и 62 грамма сульфата магния 7-водного, получаем нужный результат.
Как вычислить процентную концентрацию раствора
Задания на вычисление процентной концентрации растворов приходится выполнять не только при изучении раздела химии. Умение проводить соответствующие расчеты могут сослужить хорошую службу в повседневной жизни, например, при перерасчете концентрации раствора уксусной кислоты в период консервирования овощей.

Вам понадобится
- — калькулятор.
Инструкция
Любой раствор состоит из растворенного вещества и растворителя. В большинстве случаев растворителем выступает вода. Чтобы вычислить процентную концентрацию (или массовую долю растворенного вещества) необходимо воспользоваться формулой:W = m (растворенного вещества) / m (раствора) х 100 %W – массовая доля растворенного вещества (или процентная концентрация), %Из этой же формулы можно вывести и массу растворенного вещества, если известны масса раствора и процентная концентрация раствора.
Пример № 1. Вычислите массовую долю (в процентах) поваренной соли (NaCl), если масса (NaCl) 5 г, а масса раствора (NaCl) 100 г.В данной задаче остается только подставить в формулу предложенные в условии параметры:W = m (р. в-ва) / m (р-ра) х 100 %W (NaCl) = m (NaCl) / m (раствора NaCl) х 100 %W (NaCl) = 5 г / 100 г х 100 % = 5 %Ответ: W (NaCl) = 5 %
Пример № 2. Вычислите массовую долю (в процентах) бромида калия (KBr), если масса соли (KBr) 10 г, а масса воды 190 г.Прежде чем работать с формулой на вычисление процентной концентрации, рассчитайте массу раствора, который состоит из воды и растворенного вещества:m (раствора) = m (растворенного вещества) + m (воды) Следовательно:m (р-ра KBr) = 10 г + 190 г = 200 гПодставьте в основную формулу найденные и указанные в условии параметры:W = m (р. в-ва) / m (р-ра) х 100 %W (KBr) = m (KBr) / m (раствора KBr) х 100 %W (KBr) = 10 г / 200 г х 100 % = 5 %Ответ: W (KBr) = 5 %
Пример № 3. Вычислите процентную концентрацию уксусной кислоты (СН3СООН), если масса кислоты (СН3СООН) 30 г, а масса воды 170 г.Рассчитайте массу раствора, который состоит из воды и уксусной кислоты:m (раствора) = m (растворенного вещества) + m (воды) Следовательно:m (р-ра СН3СООН) = 30 г + 170 г = 200 гПодставьте в формулу необходимые параметры:W = m (р. в-ва) / m (р-ра) х 100 %W (СН3СООН) = m (СН3СООН) / m (раствора СН3СООН) х 100 %W (СН3СООН) = 30 г / 200 г х 100 % = 15 %Ответ: W (СН3СООН) = 15 %
Источники:
- процентная доля раствора
- Решение задач на понятия «процентное содержание
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Загрузить PDF
Загрузить PDF
Простые химические растворы можно легко приготовить различными способами в домашних условиях или на работе. Независимо от того, получаете ли вы раствор из порошкового материала или разбавляете жидкость, можно легко определить правильное количество каждого компонента. При приготовлении химических растворов не забывайте использовать персональные средства защиты, чтобы избежать повреждений.
-
1
Определите процентное содержание по весу/объему раствора. Проценты показывают, сколько частей вещества приходится на сто частей раствора. В применении к химическим растворам это означает, что если концентрация составляет 1 процент, значит, в 100 миллилитрах раствора содержится 1 грамм вещества, то есть 1 мл/100 мл.[1]
- Например, по весу: 10-процентный раствор по весу содержит 10 граммов вещества, растворенные в 100 миллилитрах раствора.
- Например, по объему: 23-процентный раствор по объему содержит 23 миллилитра жидкого соединения в каждых 100 миллилитрах раствора.
-
2
Определите объем раствора, который вы хотите приготовить. Чтобы выяснить требующуюся массу вещества, сначала следует определить конечный объем необходимого вам раствора. Этот объем зависит от того, какое количество раствора вам понадобится, как часто вы его будете использовать, и от стабильности готового раствора.
- Если каждый раз необходимо использовать свежий раствор, приготовьте лишь такое количество, которое необходимо для одного раза.
- Если раствор сохраняет свои свойства в течение длительного времени, можно приготовить большее количество, чтобы использовать его в дальнейшем.
- Пример: необходимо приготовить 5-процентный раствор NaCl объемом 500 миллилитров.
-
3
Рассчитайте количество граммов вещества, которое требуется для приготовления раствора. Чтобы вычислить необходимое число граммов, используйте следующую формулу: число граммов = (необходимые проценты)(требуемый объем/100 мл). При этом необходимые проценты выражаются в граммах, а требуемый объем — в миллилитрах.[2]
- Пример: необходимо приготовить 5-процентный раствор NaCl объемом 500 миллилитров.
- число граммов = (5г)(500мл/100мл) = 25 граммов.
- Если NaCl дан в виде раствора, просто возьмите 25 миллилитров NaCl вместо количества граммов порошка и вычтите этот объем из конечного объема: 25 миллилитров NaCl на 475 миллилитров воды.
-
4
Взвесьте вещество. После того как вы посчитаете необходимую массу вещества, следует отмерить это количество. Возьмите откалиброванные весы, поместите на них чашу и выставьте ноль. Взвесьте необходимое количество вещества в граммах и отсыпьте его.
- Прежде чем продолжать готовить раствор, обязательно очистите чашу весов от остатков порошка.
- В приведенном выше примере необходимо взвесить 25 граммов NaCl.
-
5
Растворите вещество в необходимом количестве жидкости. Если не указано другого, то в качестве растворителя используется вода. Возьмите мерную мензурку и отмерьте необходимое количество жидкости. После этого растворите в жидкости порошковый материал.[3]
- Подпишите емкость, в которой вы будете хранить раствор. Отчетливо укажите на ней вещество и его концентрацию.
- Пример: растворите в 500 миллилитрах воды 25 граммов NaCl, чтобы получить 5-процентный раствор.
- Помните, что если вы разбавляете жидкое вещество, для получения необходимого количества воды следует вычесть объем добавляемого вещества из конечного объема раствора: 500 мл – 25 мл = 475 мл воды.
Реклама
-
1
Определите молекулярный вес используемого вещества по формуле. Молекулярный вес по формуле (или просто молекулярный вес) соединения записывается в граммах на моль (г/моль) на стенке бутылки. Если вы не можете найти на бутылке молекулярный вес, поищите его в интернете.[4]
- Молекулярный вес вещества представляет собой массу (в граммах) одного моля этого вещества.
- Пример: молекулярный вес хлорида натрия (NaCl) составляет 58,44 г/моль.
-
2
Определите объем необходимого раствора в литрах. Очень просто приготовить один литр раствора, так как его молярность выражается в молях/литр, однако может потребоваться сделать больше или меньше литра, в зависимости от назначения раствора. Используйте конечный объем, чтобы рассчитать необходимое число граммов.[5]
- Пример: необходимо приготовить 50 миллилитров раствора с мольной долей NaCl 0,75.
- Чтобы перевести миллилитры в литры, поделим их на 1000 и получим 0,05 литра.
-
3
Рассчитайте число граммов, необходимое для приготовления требуемого молекулярного раствора. Для этого следует использовать следующую формулу: число граммов = (необходимый объем)(необходимая молярность)(молекулярный вес по формуле). Помните, что необходимый объем выражается в литрах, молярность — в молях на литр, а молекулярный вес по формуле — в граммах на моль.[6]
- Пример: если вы хотите приготовить 50 миллилитров раствора с мольной долей NaCl 0,75 (молекулярный вес по формуле: 58,44 г/моль), следует рассчитать количество граммов NaCl.
- число граммов = 0,05 л * 0,75 моль/л * 58,44 г/моль = 2,19 грамма NaCl.
- Сократив единицы измерения, вы получите граммы вещества.
-
4
Взвесьте вещество. С помощью правильно откалиброванных весов отвесьте необходимое количество вещества. Разместите на весах чашу и выставьте ноль перед взвешиванием. Добавляйте в чашу вещество до тех пор, пока не получите необходимую массу.
- После использования очистите чашу весов.
- Пример: взвесьте 2,19 грамма NaCl.
-
5
Растворите порошок в необходимом количестве жидкости. Если не указано другого, для приготовления большинства растворов используется вода. При этом берется такой же объем жидкости, который использовался при расчете массы вещества. Добавьте вещество в воду и перемешайте ее до полного растворения.
- Подпишите емкость с раствором. Отчетливо обозначьте растворенное вещество и молярность, чтобы можно было использовать раствор в дальнейшем.
- Пример: с помощью мензурки (инструмент для измерения объема) отмерьте 50 миллилитров воды и растворите в ней 2,19 грамма NaCl.
- Перемешивайте раствор до тех пор, пока порошок не растворится полностью.
Реклама
-
1
Определите концентрацию каждого раствора. При разбавлении растворов необходимо знать концентрацию исходного раствора и того раствора, который вы хотите получить. Данный метод подходит для разбавления концентрированных растворов.[7]
- Пример: необходимо приготовить 75 миллилитров раствора NaCl концентрации 1,5 M из раствора концентрации 5 M. Исходный раствор имеет концентрацию 5 M, и необходимо разбавить его до концентрации 1,5 M.
-
2
Определите объем конечного раствора. Необходимо найти объем того раствора, который вы хотите получить. Вам придется рассчитать количество раствора, который потребуется, чтобы разбавить данный раствор до получения необходимых концентрации и объема.[8]
- Пример: необходимо приготовить 75 миллилитров раствора NaCl концентрации 1,5 M из начального раствора концентрации 5 M. В этом примере конечный объем раствора составляет 75 миллилитров.
-
3
Рассчитайте объем раствора, который понадобится для разведения начального раствора. Для этого вам понадобится следующая формула: V1C1=V2C2, где V1 — объем необходимого раствора, C1 — его концентрация, V2 — объем конечного раствора, C2 — его концентрация.[9]
- Чтобы рассчитать объем требуемой жидкости, необходимо переписать равенство относительно V1: V1 = (V2C2)/C1.
- Пример: необходимо приготовить 75 миллилитров раствор NaCl концентрацией 1,5 M из раствора концентрации 5 M.
- V1 = (V2C2)/C1 = (0,075 л * 1,5 M)/5M = 0,0225 л.
- Переведем литры обратно в миллилитры путем умножения на 1000 и получим 22,5 миллилитра.
-
4
Вычтем объем исходного раствора из планируемого конечного объема. В результате разведения раствора необходимо получить фиксированный конечный объем. Чтобы определить объем разбавляющего раствора, вычтите из конечного объема объем исходного раствора.
- Пример: конечный объем составляет 75 миллилитров, а исходный объем равен 22,5 миллилитра. Таким образом, получаем 75 – 22,5 = 52,5 миллилитра. Именно такой объем жидкости понадобится для разбавления раствора.
-
5
Смешайте рассчитанное количество исходного раствора с разбавляющей жидкостью. С помощью мензурки (инструмент для измерения объема жидкости) отмерьте необходимое количество исходного раствора и смешайте его с требуемым объемом разбавляющей жидкости.
- Пример: отмерьте 22,5 миллилитра исходного раствора NaCl концентрации 5 M и разбавьте его 52,5 миллилитрами воды. Перемешайте раствор.
- Напишите на емкости с разбавленным раствором его концентрацию и состав: 1,5 M NaCl.
- Помните: если вы разбавляете кислоту водой, следует добавлять кислоту в воду, но ни в коем случае не наоборот.
Реклама
-
1
Используйте средства индивидуальной защиты. При работе с агрессивными химическими веществами и растворами следует защититься от их воздействия. Обязательно наденьте лабораторный халат, закрытую обувь, защитные очки и перчатки.
- Используйте лабораторный халат из негорючего материала.
- Защитные очки должны иметь боковые щитки, которые прикрывают глаза сбоку.
-
2
Работайте в хорошо проветриваемом месте. При смешивании растворов могут выделяться летучие газы. С некоторыми веществами следует работать лишь под лабораторной вытяжкой. Если вы смешиваете растворы дома, откройте окна и включите вентилятор, чтобы обеспечить достаточную циркуляцию воздуха.
-
3
Добавляйте кислоту в воду. При разведении концентрированных кислот всегда добавляйте кислоту в воду. При смешивании воды и кислоты происходит экзотермическая (с выделением теплоты) реакция, что может привести к взрыву в том случае, если добавлять воду в кислоту, а не наоборот.[10]
- Вспоминайте меры безопасности каждый раз, когда вам предстоит работать с кислотами.
Реклама
Советы
- Прежде чем приступить к работе, ознакомьтесь с предметом. Знание — сила!
- Попробуйте использовать обычные бытовые вещества. Не пытайтесь сделать что-нибудь экстраординарное. Если вы подозреваете, что может возникнуть опасность, откажитесь от задуманного.
Реклама
Предупреждения
- Не смешивайте отбеливатель и аммиак.
- При необходимости используйте средства безопасности, защитные очки, пластиковый фартук и неопреновые перчатки.
Реклама
Что вам понадобится
- Точные механические или электронные весы, чтобы определить массу. К примеру, можно использовать кухонные весы.
- Проградуированная стеклянная посуда. Такую посуду можно найти в магазине кухонной утвари или заказать через интернет. Измерительная посуда отличается разнообразием форм и размеров. Подойдет пластиковая посуда, хотя она не выдерживает высоких температур.
Об этой статье
Эту страницу просматривали 30 128 раз.