Строение атома
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: планетарная модель атома.
Атомы каждого химического элемента имеют строго индивидуальный линейчатый спектр, присущий только данному элементу и не меняющийся от опыта к опыту. Как это можно объяснить? Как вывести формулу, дающую весь набор частот атомного спектра? Чтобы сделать это, нужно узнать, как устроен атом.
Модель Томсона
Первую модель строения атома придумал английский физик Джозеф Джон Томсон (удостоенный Нобелевской премии за открытие электрона). В конечном счёте она оказалась неверной, но сыграла важную роль, будучи стимулом последующих экспериментальных исследований Резерфорда. Физики называли модель Томсона «пудинг с изюмом».
Согласно Томсону атом представляет собой шар размером порядка см. По этому шару некоторым образом распределён положительный заряд, а внутри шара, подобно изюминкам, находятся электроны (рис. 1).
Рис. 1. Модель атома Томсона
Суммарный заряд электронов в точности равен положительному заряду шара, поэтому атом в целом электрически нейтрален.
Излучение атомов объясняется колебаниями электронов около положений равновесия (как вы помните, любой ускоренно движущийся заряд излучает электромагнитные волны). Однако вся совокупность экспериментальных данных по атомным спектрам не укладывалась в модель Томсона. Например, для некоторых химических элементов были подобраны формулы, хорошо описывающие их спектры, но эти формулы из модели Томсона никак не следовали.
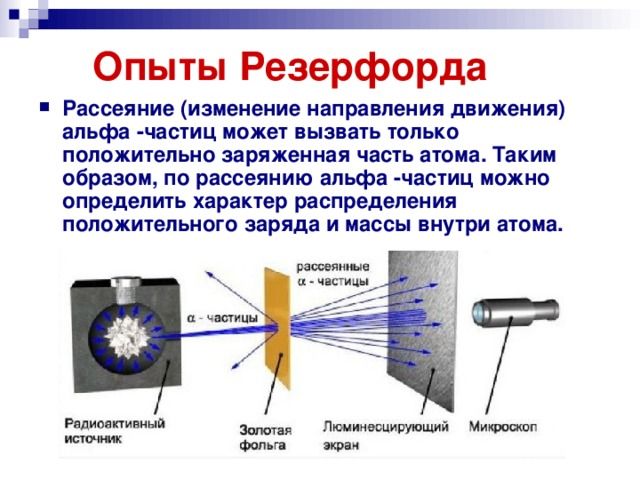
Опыты Резерфорда
Верна ли модель Томсона? Как в действительности распределены положительные и отрицательные заряды внутри атома? Чтобы ответить на эти вопросы, нужен был эксперимент, позволяющий проникнуть внутрь атома. Ученик Томсона, знаменитый английский физик Эрнест Резерфорд предложил с этой целью бомбардировать атом высокоэнергетичными ?-частицами и смотреть, как они будут отклоняться положительным зарядом атома.
Что такое -частицы? Потоки этих частиц — так называемые «альфа-лучи» — были обнаружены при радиоактивном распаде некоторых элементов (например, радия). В результате тщательных исследований, проведённых опять-таки Резерфордом, было установлено, что каждая
-частица имеет положительный заряд, равный по модулю удвоенному заряду электрона, и массу, превышающую массу электрона примерно в
раз. То есть,
-частица оказалась полностью ионизованным (лишённым электронов) атомом гелия.
Резерфорд говорил об -частицах как об ионах гелия; сейчас мы знаем, что это ядра гелия.
Но в те времена об атомных ядрах ещё ничего не знали — о них Резерфорду лишь предстояло догадаться, глядя на результаты своих знаменитых опытов!
Энергия -частиц очень велика — достаточно сказать, что скорость их вылета из радиоактивного образца составляет примерно
скорости света. Поэтому интересно было выяснить, на какие углы будут отклоняться столь мощные «снаряды» при рассеянии на отдельных атомах, а точнее — на их положительных зарядах.
Пучок -частиц направлялся на тончайшую золотую фольгу. Как гласит история, Резерфорд не сомневался в том, что углы отклонения должны быть весьма малы: имея столь огромную энергию,
-частицы должны проходить сквозь фольгу как нож сквозь масло. Только «для очистки совести», на всякий случай, он попросил учеников посмотреть, не возникает ли рассеяния
-частиц на большие углы.
Каково же было всеобщее удивление, когда такие частицы обнаружились! Да, как и следовало ожидать, подавляющая доля -частиц отклонялась несущественно. Но совсем небольшая их часть (примерно одна частица из нескольких тысяч) отклонялась на угол, больший
(рис. 2).
Рис. 2. Рассеяние -частиц на атомах
Эти отклонения казались совершенно невероятными. По словам Резерфорда, дело выглядело так, словно артиллерийский снаряд налетел на кусок бумаги и от удара повернул назад.
А «бумагой» в образном сравнении Резерфорда служил атом, устроенный согласно модели Томсона. Действительно, допустим, что положительный заряд атома «размазан» по всему атому, то есть шару радиусом
см. Этот положительный заряд создаёт электрическое поле, тормозящее и отклоняющее
-частицы. Вблизи атома потенциал данного поля:
Расчёты, однако, показывают, что такое поле оказывается слишком слабым — его тормозящего действия никак не хватит для того, чтобы остановить -частицу и отбросить её назад!
Таким образом, наличие -частиц, отброшенных фольгой, опровергло модель Томсона. Что же было предложено взамен?
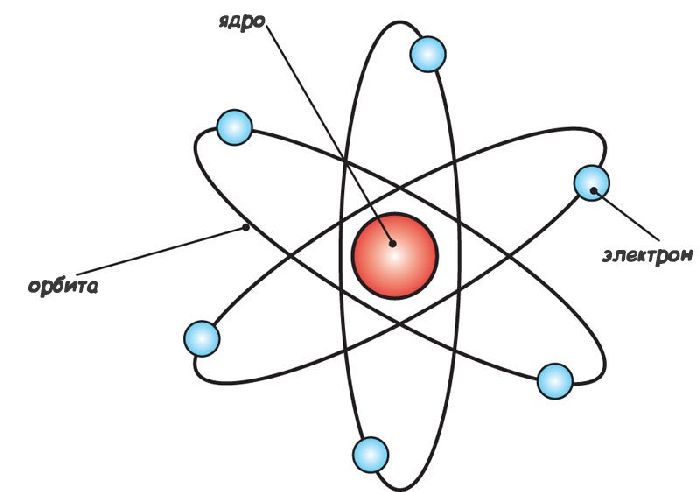
Планетарная модель атома
Чтобы отбросить -частицу, положительный заряд атома должен создавать куда более сильное электрическое поле, чем то, которое получается в модели Томсона. А чтобы создать такое поле, положительный заряд должен быть сосредоточен в области, гораздо меньшей размера атома.
Размер этой области можно вычислить. Если положительный заряд занимает область размером
, то вблизи заряда создаётся электрическое поле с потенциалом
Зная кинетическую энергию -частицы, можно найти величину тормозящего потенциала
, а затем и размер
положительно заряженной области. Вычисления, проведённые Резерфордом, дали следующий результат:
см.
Эта величина на пять порядков (в сто тысяч раз!) меньше размера атома. Так на смену модели Томсона пришла планетарная модель атома (рис. 3).
Рис. 3. Планетарная модель атома
В центре атома находится крошечное положительно заряженное ядро, вокруг которого, словно планеты вокруг Солнца, движутся электроны. Между ядром и электронами действуют силы кулоновского притяжения, но упасть на ядро электроны не могут за счёт своего движения — точно так же, как и планеты не падают на Солнце, хоть и притягиваются к нему.
Заряд ядра по модулю равен суммарному заряду электронов, так что атом в целом электрически нейтрален. Однако электроны могут быть выбиты из своих орбит и покинуть атом — тогда атом превращается в положительно заряженный ион.
Масса электронов составляет очень малую часть общей массы атома. Например, в атоме водорода всего один электрон, и его масса в раз меньше массы ядра. Следовательно, почти вся масса атома сосредоточена в ядре — и это при том, что ядро в сто тысяч раз меньше самого атома.
Чтобы лучше почувствовать соотношение масштабов атома и ядра, представьте себе, что атом стал размером с Останкинскую телебашню ( м). Тогда ядро окажется горошиной размером
мм, лежащей у вас на ладони. И тем не менее, почти вся масса атома заключена в этой горошине!
Разберем задачи ЕГЭ по темам: «Строение атома», «Энергетические уровни», «Ядро атома», «Электронные оболочки», «Протоны и нейтроны».
Задача 1.
Ядро элемента претерпевает альфа-распад. Как изменятся следующие физические величины: зарядовое число, массовое число у образовавшегося (дочернего) ядра по отношению к исходному?
Для каждой величины определите соответствующий характер изменения:
1) увеличится;
2) уменьшится;
3) не изменится.
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
| Зарядовое число | Массовое число |
| 1 | 1 |
Решение:
При решении подобных задач выделяют следующие виды радиоактивных распадов:
1) α-распад (альфа-распад) – распад ядер, сопровождающийся выбросом α-частицы, которая является ядром атома гелия ;
2) β-распад (бета-распад) – распад ядер, сопровождающийся выбросом β-частицы, которая является электроном ;
3) γ-распад (гамма-распад) – распад ядер, сопровождающийся выбросом γ-квантов, не имеющих заряда и массы.
Составление ядерных реакций основывается на законах сохранения заряда и массы. Таким образом, суммарное зарядовое число в левой части уравнения должно быть равно суммарному зарядовому числу в правой части уравнения. То же самое относится и к массовому числу.
Запишем ядерную реакцию для данной задачи.
.
Уменьшение зарядового числа Z произошло на 2 единицы, а массового числа на 4 единицы.
| Зарядовое число | Массовое число |
| 2 | 2 |
Ответ: 22
Задача 2.
Как изменяются с уменьшением массового числа изотопов одного и того же элемента число нейтронов в ядре и число электронов в электронной оболочке соответствующего нейтрального атома?
Для каждой величины определите соответствующий характер изменения:
1) увеличивается;
2) уменьшается;
3) не изменяется.
Запишите в ответ выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
| Число нейтронов в ядре | Число электронов в электронной оболочке нейтрального атома |
| 1 | 1 |
Решение:
Изотопы – это атомы одного и того же химического элемента, отличающиеся количеством нейтронов в атомном ядре. Количество протонов у всех изотопов данного химического элемента одинаковое.
Массовое число определяется суммой масс протонов и нейтронов. Масса электронов не влияет на массу атома, при этом считается, что вся масса атома сосредоточена в ядре.
При уменьшении массового числа изотопов одного и того же элемента число нейтронов в ядре, соответственно, уменьшается. Число электронов в электронной оболочке нейтрального атома остается неизменным. Так как атом нейтральный, то количество протонов и количество электронов будут равны между собой.
| Число нейтронов в ядре | Число электронов в электронной оболочке нейтрального атома |
| 2 | 3 |
Ответ: 23
Задача 3.
Для некоторых атомов характерной особенностью является возможность захвата атомным ядром одного из ближайших к нему электронов. Как при захвате электрона изменяются массовое число атомного ядра и число нейтронов в ядре?
Для каждой величины определите соответствующий характер изменения:
1) увеличивается;
2) уменьшается;
3) не изменяется.
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
| Массовое число ядра | Число нейтронов в ядре |
| 1 | 1 |
Решение:
При захвате ядром одного из электронов происходит превращение протона в нейтрон. Так как массовое число ядра определяется количеством протонов и нейтронов, то увеличение числа нейтронов на единицу и уменьшение числа протонов на единицу, не изменит конечного результата. Поэтому массовое число ядра не изменится.
Превращение протона в нейтрон увеличит общее количество нейтронов в ядре.
| Массовое число ядра | Число нейтронов в ядре |
| 3 | 1 |
Ответ: 31
Задача 4.
В первом эксперименте атомы водорода облучают потоком фотонов такой частоты, что электроны в атомах переходят с энергетического уровня с номером n > 1 на энергетический уровень с номером n + 1. При постановке второго эксперимента частоту фотонов подбирают такой, что электроны в атомах переходят с энергетического уровня с номером n − 1 на энергетический уровень с номером n. Определите, как изменяются во втором эксперименте по сравнению с первым длина волны падающего на атом фотона и приращение энергии атома в результате поглощения фотона.
Для каждой величины определите соответствующий характер изменения:
1) увеличивается;
2) уменьшается;
3) не изменяется.
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
| Длина волны падающего на атом фотона |
Приращение энергии атома в результате поглощения фотона |
| 1 | 1 |
Решение:
Рассчитаем энергию поглощенного фотона при переходе с уровня n на уровень n+1. Для этого воспользуемся формулой энергетических уровней атома водорода.
Для второго перехода с уровня n-1 на уровень n этот переход можно представить в виде:
Найдем разность этих энергий:
Преобразовав это выражение, получим:
Разность этих энергий отрицательная, так как числитель (по условию n > 1). Поэтому энергия фотона во втором переходе больше, чем в первом.
Согласно формуле Планка, увеличение энергии соответствует уменьшению длины волны.
| Длина волны падающего на атом фотона |
Приращение энергии атома в результате поглощения фотона |
| 2 | 1 |
Ответ: 21
Вот таким удивительным объектом оказался атом. Однако планетарная модель атома, объяснив результаты опытов Резерфорда по рассеянию -частиц, оказалась лишь первым шагом на пути к пониманию внутриатомных процессов. А именно, планетарная модель приводила к одному серьёзному противоречию, и преодоление этого противоречия Нильсом Бором положило начало физике атома. Читаем следующий листок!
Спасибо за то, что пользуйтесь нашими статьями.
Информация на странице «Строение атома» подготовлена нашими авторами специально, чтобы помочь вам в освоении предмета и подготовке к ЕГЭ и ОГЭ.
Чтобы успешно сдать нужные и поступить в ВУЗ или колледж нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими материалами из разделов нашего сайта.
Публикация обновлена:
07.05.2023
Планетарная модель атома

3.9
Средняя оценка: 3.9
Всего получено оценок: 157.
3.9
Средняя оценка: 3.9
Всего получено оценок: 157.
На пути познания сложной структуры атомов вещества наукой пройден непростой путь. Одним из шагов на этом пути явилась планетарная модель атома. Рассмотрим эту модель подробнее.
Электроны и состав атома
Мысль о том, что все вещества в Природе состоят из мельчайших неделимых частиц – атомов, высказывалась еще в античные времена. По мере развития научных представлений, стало ясно, что это не совсем так. Минимальная частица вещества, сохраняющая свойства вещества – это молекула. Молекула же чаще всего состоит из нескольких атомов одного или разных элементов (но иногда молекула состоит из одного атома).
Атомы же элементов долгое время считались неделимыми.
Однако, в самом конце XIXв были открыты электроны – их испускал нагретый электрод в колбе с вакуумом. Стало ясно, что даже атомы простого вещества имеют структуру. Согласно первой атомной теории Дж.Томсона атом представляет собой положительно заряженный шар, внутри которого заключены один или несколько электронов.
Опыты Э. Резерфорда
Для зондирования состава атома Э. Резерфорд использовал поток альфа-частиц, испускаемых радиоактивным препаратом на тонкую металлическую фольгу, а после прохождения фольги частицы попадали на экран, вызывая его свечение. По размеру зоны отклонения можно было судить о том, как воздействовал атом вещества фольги на альфа-частицу.
Альфа-частица (фактически, представляющая собой ядро атома гелия) имеет гораздо больший вес, чем электрон, таким образом, электроны не могут сколь-нибудь заметно повлиять на ее движение. Отклонение альфа-частицы может происходить только из-за взаимодействия с положительно заряженным атомом. При этом, чем равномернее распределен заряд по атому, тем меньше он будет отклонять альфа-частицу, влияя только на ее скорость (в результате кулоновского взаимодействия).
Опыт дал неожиданный результат. Большинство альфа-частиц, как и следовало ожидать, отклонялись очень слабо. Однако, небольшой их процент отклонялся на большие углы, иногда частицы полностью меняли направление движения. Модель Томсона никак не могла объяснить этого явления.
Планетарная модель атома
Из опыта Резерфорда следовало, что хотя атом имеет размер порядка $10^{-10}$ м, весь положительный заряд и вся масса атома сосредоточена в очень малой его части, порядка $10^{-14}-10^{-15}$ м !
Поэтому была предложена планетарная модель строения атома, согласно которой внутри атома имеется маленькое положительно заряженное ядро, вокруг которого обращаются отрицательно заряженные электроны.
В целом атом получается нейтральным. Электроны не падают на ядро потому, что они вращаются вокруг него по круговым орбитам. Таким образом, атом подобен Солнечной системе, ядро подобно Солнцу, а электроны – планетам.
На самом деле атом заметно более «пуст», чем Солнечная система. Если атом увеличить так, чтобы ядро увеличилось до размера Солнца, орбиты электронов будут в сто раз дальше от Солнца, чем Земля.
Проблемы планетарной модели
Планетарная модель атома Резерфорда объяснила опыт по рассеянию альфа-частиц, однако, она противоречила электродинамике Максвелла, согласно которой заряд, движущийся с ускорением, должен излучать электромагнитные волны. Электрон, двигаясь по круговой орбите, имеет постоянное центростремительное ускорение, а значит, должен излучать, теряя энергию, и в конце концов, должен упасть на ядро. Расчеты показывали, что это должно происходить очень быстро. Однако, в реальности атомы устойчивы. Данное затруднение было преодолено только с развитием квантовой физики.
Что мы узнали?
Открытие электрона показало, что атом имеет сложную структуру. В результате опытов Э.Резерфорда была предложена планетарная модель строения атома, где весь положительный заряд и почти вся масса сосредоточена в ядре малых размеров, а электроны вращаются вокруг ядра на некотором расстоянии.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
Пока никого нет. Будьте первым!
Оценка доклада
3.9
Средняя оценка: 3.9
Всего получено оценок: 157.
А какая ваша оценка?
Как изобразить планетарную модель атома
Для того чтобы правильно изобразить планетарную модель атома необходима Периодическая система химических элементов и несложный алгоритм, который записан ниже.
1.
Обозначить атом и заряд его ядра.
В
центре находится ядро. Его заряд равен порядковому номеру элемента в
периодической системе.
2.
Указать число энергетических уровней.
Энергетические
уровни, по которым движутся электроны, изображаются дугами. Число
энергетических уровней равно номеру периода.
3.
Записать число электронов на внешнем
уровне.
Количество
электронов обозначается на схеме числом. Общее число электронов равно числу
протонов и равно порядковому номеру элемента.
Число
электронов на внешнем уровне определяется следующим образом:
—
для элементов главных (А) подгрупп –
число электронов на внешнем уровне равно номеру группы
—
для элементов побочных (В) подгрупп –
число электронов на внешнем уровне равно 2.
—
для элементов-исключений – число
электронов на внешнем уровне равно 1.
—
(Исключения: Cu, Ag, Au, Cr, Mo)
4.
Записать оставшиеся электроны по
энергетическим уровням.
Для
этого надо знать какое количество электронов может помещаться на том или ином
уровне. Это определяется по формуле 2n2, где n – это номер уровня.
На
1 уровне – максимум 2 электрона
На
2 уровне – максимум 8 электронов
На
3 уровне – максимум 18 электронов
На
4 уровне – максимум 32 электрона
В данном сообщении (тексте или рисунках) содержится ошибка. Бонусные баллы тому, кто первым в комментариях укажет, в чём эта ошибка заключается.
Физика, 11 класс
Урок №24. Строение атома. Опыты Резерфорда
На уроке рассматриваются: понятия атомное ядро, опыты Резерфорда, планетарная модель строения атома; сравниваются модели атома Томсона и Резерфорда, даны некоторые сведения о фактах, подтверждающих сложное строение атома, о работах учёных по созданию модели строения атома.
Атомное ядро — тело малых размеров, в котором сконцентрирована почти вся масса и весь положительный заряд атома.
Размеры ядра: диаметр порядка 10-12—10-13 см (у разных ядер диаметры различны).
Размер атома: примерно 10-8 см, т. е. от 10 до 100 тысяч раз превышает размеры ядра.
Планетарная модель атома Резерфорда: в целом атом нейтрален, в центре атома расположено положительно заряжённое ядро, в котором сосредоточена почти вся масса атома, электроны движутся по орбитам вокруг ядра, заряд ядра, как и число электронов в атоме, равен порядковому номеру элемента в периодической системе Д.И.Менделеева.
Ядро атома водорода названо протоном и рассматривается как элементарная частица.
Ядро атома водорода имеет положительный заряд, равный по модулю заряду электрона, и массу, примерно в 1836,1 раза больше массы электрона.
Частота излучений атома водорода составляет ряд серий: серия Бальмера, серия Лаймана, серия Пашена и другие, каждая из которых образуется в процессе перехода атома в одно из энергетических состояний.
Обязательная литература по теме урока:
- Мякишев Г.Я., Буховцев Б.Б., Сотский Н.Н. Физика.11 класс. Учебник для общеобразовательных организаций М.: Просвещение, 2017. – С. 279 – 283.
- Степанова Г.Н. (сост.) Сборник задач по физике для 10-11 классов общеобразовательных учреждений.5-е изд., доп. — М.: «Просвещение», 1999 — С. 221-222
- Анциферов Л.И., Физика: электродинамика и квантовая физика. 11кл. Учебник для общеобразовательных учреждений. – М.: Мнемозина, 2001. – С. 270-274.
- Рымкевич А.П. Физика. Задачник. 10-11 классы. – М.: Дрофа, 2013. — С. 155 – 156.
- Кикоин А. К. За пределы таблицы //Квант. — 1991. — № 1. — С. 38,39,42-44
Основное содержание урока
Долгое время, физика накапливала факты о свойстве вещества для полного представления о строении атома. И только в XIX веке изучение атомического строения вещества существенно сдвинулось с точки покоя.
Большую роль в развитии атомистической теории сыграл выдающийся русский химик Дмитрий Иванович Менделеев, разработавший в 1869 году периодическую систему элементов, в которой впервые был поставлен вопрос о единой природе атомов.
Важным свидетельством сложной структуры атомов явились исследования спектров, излучаемые веществом, которые привели к открытию линейчатых спектров атомов. В начале XIX века в излучении атома водорода были открыты спектральные линии в видимой части спектра.
Идеи электронной структуры атома теоретически и гипотетически формулировались учёными. В 1896 году Хендрик Лоренц создал электронную теорию о том, что электроны являются частью атома. Эту гипотезу в 1897 году подтвердили эксперименты Джозефа Джона Томсона. Им был сформулирован вывод о том, что существуют частицы с наименьшим отрицательным зарядом — электроны и они являются частью атомов.
По мысли Томсона, положительный заряд занимает весь объём атома и распределён он в этом сферическом объёме равномерно. У более сложных атомов в положительно заряжённом шаре есть несколько электронов, так что атом подобен кексу, в котором роль изюма играют электроны. Распространённый термин этой модели — «Пудинг с изюмом» или «Булочка с изюмом».
Таким образом, к началу XX века учёные сделали вывод о том, что атомы материи имеют сложную внутреннюю структуру. Они являются электрически нейтральными системами, а носителями отрицательного заряда атомов являются лёгкие электроны, масса которых составляет лишь малую долю массы атомов. Однако модель атома Томсона находилась в полном противоречии с экспериментами по изучению распределения положительных зарядов.
Электрон – наименьшая электроотрицательная заряжённая элементарная частица
Масса покоя электрона me = 9,1·10-31кг;

Немецкий физик Филипп фон Ленард в 1903 году проводил опыты, в которых пучок быстрых электронов легко проходил через тонкую металлическую фольгу. На основании этого Ленард предположил, что атом состоит из нейтральных частиц или нейтральных дуплетов с совмещённым положительным и отрицательным зарядами, рассредоточенными в атоме, где большая площадь представляет собой пустоту.
В 1904 году японский физик Хентаро Нагаока выдвинул гипотезу о том, что атом состоит из тяжелого положительно заряженного ядра, окруженного кольцами из большого числа электронов, колебания которых и являются причиной испускания атомных спектров, по аналогии с теорией устойчивости колец Сатурна.
Но в физике уже более 200 лет существует главное правило: окончательный выбор между гипотезами может быть сделан только на основе опыта. Эксперименты, проведенные в первый раз Эрнестом Резерфордом, сыграли решающую роль в понимании структуры атома.
30.08.1871 г. – 19.10.1937 г.
Эрнест Резерфорд
Британский физик новозеландского происхождения
Лауреат Нобелевской премии по химии 1908 года
Для экспериментального изучения распределения положительного заряда, а значит, и массы внутри атома Эрнест Резерфорд в 1906 г. предложил применить зондирование атома α-частицами, скорость которых составляет 1/15 скорости света.
Эти частицы возникают при распаде, например, радия и некоторых других радиоактивных элементов. Сами же α-частицы – это ионизированные атомы гелия, положительный заряд гелия в два раза больше заряда электрона +2He. Этими частицами Резерфорд бомбардировал атомы тяжёлых элементов (золото, медь и др.). Если бы электроны были равномерно распределены по всему объёму атома (по модели атома Томсона), электроны не могли бы заметно изменять траекторию α –частиц, так как размеры и масса электронов в 8000 раз меньше массы α-частиц. Точно так же камушек в несколько десятков граммов при столкновении с автомобилем не может изменить его скорость.
Изменение направления движения α-частиц может вызвать только массивная часть атома, при этом положительно заряжённая. Весь прибор размещался в сосуде, из которого был откачан воздух. Радиоактивный препарат, помещался внутри свинцового цилиндра, вдоль которого был высверлен узкий канал. Пучок α -частиц из канала падал на тонкую фольгу из тяжёлого металла. После рассеяния α-частицы попадали на полупрозрачный экран, покрытый сульфидом цинка. Столкновение каждой частицы с экраном сопровождалось сцинтилляцией (вспышкой света), которую можно было наблюдать в микроскоп.
Чтобы обнаружить отклонение α-частиц на большие углы Резерфорд окружил фольгу экранами. Сотрудники Резерфорда вели счёт α-частиц, попадающих в регистрирующее устройство при отклонении их на от первоначального направления на определённый угол φ (фи). Данные из серии опытов, за определённый период времени, приведены в таблице:
|
Угол отклонения α-частиц φ, ° |
15 |
60 |
105 |
150 |
180 |
|
Число частиц N |
132000 |
477 |
70 |
33 |
1-3 |
Отсюда можно сделать вывод: такое поведение α-частиц возможно только в том случае, если они упруго взаимодействуют с массивным положительно заряжённым телом малых по сравнению с атомом размеров.
Позднее Резерфорд признался, что, предложив своим ученикам провести эксперимент по наблюдению за рассеянием α-частиц, он сам не верил в положительный результат. Он сравнил такой эффект с 15-дюймовым снарядом, как если бы его выстрелили в кусок тонкой бумаги, а снаряд возвратился бы и нанёс обратный удар.
Резерфорд понял, что α-частица могла быть отброшена назад лишь в том случае, если положительный заряд атома и его масса сконцентрированы в очень малой области пространства. Так Резерфорд пришел к мысли о существовании атомного ядра.
Подсчитывая число α-частиц, рассеянных на различные углы, Резерфорд смог оценить размеры ядра. Оказалось, что ядро имеет диаметр порядка 10-12—10-13 см (у разных ядер диаметры различны). Размер же самого атома 10-8 см, то есть от 10 до 100 тысяч раз превышает размеры ядра. Впоследствии удалось определить и заряд ядра.
Планетарная модель атома Резерфорда: в целом атом нейтрален, в центре атома расположено положительно заряженное ядро, в котором сосредоточена почти вся масса атома. Число внутриатомных электронов, как и заряд ядра, равны порядковому номеру элемента в периодической системе Д. И. Менделеева.
Электроны движутся вокруг ядра, подобно тому как планеты обращаются вокруг Солнца.
Такой характер движения электронов определяется действием кулоновских сил притяжения со стороны ядра.
Закон Кулона:
qα — заряд α-частицы;
q — положительный заряд атома;
r — его радиус;

Ядро атома водорода имеет положительный заряд, который по модулю равен заряду электрона, и массу, примерно в 1836,1 раза больше массы электрона.
Размер атома водорода — это радиус орбиты его электрона
Простая и наглядная планетарная модель атома имеет прямое экспериментальное обоснование. Она кажется совершенно необходимой для объяснения опытов по рассеиванию α-частиц. Но на основе этой модели нельзя объяснить факт существования атома, его устойчивость. Ведь движение электронов по орбитам происходит с ускорением. Ускоренно движущийся заряд должен излучать электромагнитные волны с частотой, равной частоте его обращения вокруг ядра. Электроны должны приближаться к ядру, подобно тому как спутник приближается к Земле при торможении в верхних слоях атмосферы. Атом должен прекратить свое существование. В действительности ничего подобного не происходит. Атомы устойчивы и в невозбужденном состоянии могут существовать неограниченно долго, совершенно не излучая электромагнитные волны
В начале XX века было уже известно, что вещество излучает свет конкретных длин волн в определенных, очень узких спектральных интервалах — спектральных линиях, все линии имеют конечную длину.
Линейчатые спектры дают все вещества в газообразном атомарном (но не молекулярном состоянии). Классическим примером линейчатого спектра является спектр атома водорода.
Швейцарский физик и математикИоганн Якоб Бальмер определил, что в видимой части спектра атома водорода имеются четыре линии, соответствующие длинам волн: λ1 = 434 нм; λ2 = 486 нм; λ3 = 410 нм; λ4 = 656 нм
Частота излучений атома водорода составляет ряд серий, каждая из которых образуется в процессе перехода атома в одно из энергетических состояний, переходов электрона с верхних энергетических уровней на нижние уровни.
На рисунке можно увидеть переходы электрона на другой энергетический уровень, частоты излучения которого находятся в видимой области спектра.
Серию уровней назвали в честь швейцарского учителя Иоганна Бальмера, который ещё в 1885 году основываясь на результатах экспериментов вывел формулу для определения частот видимой части спектра водорода:


где Z – число протонов в атоме или порядковый номер в периодической таблице Менделеева;
n и m (целое число – 1, 2, 3, 4, 5, и так далее) — энергетические уровни, где m > n.
В этой формуле v — не частота, которая измеряется в с-1, а волновое число, которое равно обратному значению длины волны 1/λ и которое измеряется в м-1.
R — это постоянная Ридберга (для данного вещества), которая определена из спектральных данных, учитывая, что скорость распространения видимого излучения составляет:
Не согласующийся с опытом вывод о неизбежной гибели атома вследствие потери энергии на излучение — это результат применения законов классической физики к явлениям, происходящим внутри атома. Отсюда следует, что к таким явлениям законы классической физики неприменимы. Все выводы об устойчивости атома и спектре, которые излучает атом будут подтверждены Нильсом Бором в 1913 году.
Рассмотрим задачи тренировочного блока урока.
1. Формула Бальмера – Ридберга для водорода приводится в виде:
Коэффициент RH носит название постоянной Ридберга для водорода и его можно вычислить из данной формулы. Полученный результат равен _______·107 м-1, если известно, что при переходе атома водорода из четвёртого энергетического состояния во второе происходит излучение с длиной волны 486,13 нм.
Дано:
m = 4
n = 2
RH — ?
Решение:
Постоянная Ридберга для водорода:
Выведем постоянную Ридберга RH из формулы Бальмера – Ридберга:
Подставим известные значения в формулу:
Ответ:
2. Рассчитайте на какое наименьшее расстояние α-частица может приблизиться к ядру атома золота, двигаясь по прямой, проходящей через центр ядра. Масса α-частицы, её заряд, скорость движения и заряд ядра золота приведены в таблице:
|
Масса α-частицы, кг |
Заряд α-частицы, Кл |
Скорость движения α-частицы, м/с |
Заряд ядра золота, Кл |
Расстояние сближения, м |
|
6,6·10-27 |
3,2·10-19 |
1,9·107 |
1,3·10-17 |
? |
По закону сохранения энергии максимальная кинетическая энергия α-частицы будет равна максимальной потенциальной энергии взаимодействия частицы с ядром атома золота:
Потенциальная энергия кулоновского взаимодействия зарядов.
Для определения наименьшего расстояния между α-частицей и ядра атома золота используем формулу взаимодействия заряжённых частиц — закон Кулона:

Чтобы определить силу взаимодействия зарядов на кратчайшем расстоянии, запишем II закон Ньютона, устанавливающий зависимость силы от ускорения, для движения тела движущегося по окружности с центростремительным ускорением:
Приравняем выражения для силы взаимодействия двух точечных зарядов:
Отсюда выразим расстояние сближения двух зарядов, считая его радиусом от центра ядра золота до точки сближения с α-частицей:
Подставим числовые значения в полученную формулу:
Ответ:
|
Масса α-частицы, кг |
Заряд α-частицы, Кл |
Скорость движения α-частицы, м/с |
Заряд ядра золота, Кл |
Расстояние сближения, м |
|
6,6·10-27 |
3,2·10-19 |
1,9·107 |
1,3·10-17 |
3,1·10-14 |
Вам уже известно, что исследования спектров излучения
разрежённых газов (то есть спектров излучения отдельных атомов) показали, что
каждому газу присущ вполне определенный линейчатый спектр, состоящий из
отдельных спектральных линий или групп близко расположенных линий. Эти линии
являются своеобразным ключом к пониманию внутреннего строения атома, так как
излучение и поглощение света атомами есть результат внутриатомных процессов, то
есть процессов, в которых могут принимать участие только частицы, входящие в
состав атома. Но вот что такое атом?
Мы знаем, что атомы представляют собой достаточно прочные
системы, несоизмеримо более устойчивые, чем составленные из них молекулы. А
такие внешние воздействия, как нагрев, изменение давления, мощные электрические
разряды приводят лишь к незначительным изменениям атомов: они могут
ионизоваться. Поэтому до конца XIX века атомы считали простейшими неделимыми
частицами вещества. Однако, как вы уже знаете, открытия, совершённые в конце
XIX — начале ХХ века, перевернули в физике всё с ног на голову. В частности,
французским физиком Антуаном Анри Беккерелем было открыто явление естественной
радиоактивности некоторых веществ. А в 1896 году англичанин Джозеф Томсоном
открыл электрон.
Явление радиоактивности, то есть самопроизвольное излучение
веществом альфа-, бета- и гамма-излучений, наряду с другими экспериментальными
фактами, послужило основанием для предположения о том, что атомы вещества имеют
сложный состав.
А опыты Эрнеста Резерфорда по исследованию радиоактивного
излучения показали, что в его состав входят положительно и отрицательно
заряженные частицы. Поэтому естественно было предположить, что эти частицы
входят в состав атомов.
На основании этих данных Томсон для попытки объяснения
открытых к тому моменту новых экспериментальных фактов предложил одну из первых
моделей атома. В статье, опубликованной в марте 1904 года, Томсон
рассмотрел три правдоподобные (по его мнению) варианта возможного строения
атома, объясняющие его электрическую нейтральность и другие свойства. Однако
тут же в статье учёный говорит о том, что наиболее вероятно строение атома по
третьей модели. Томсон писал: «…атомы элементов состоят из нескольких
отрицательно заряженных корпускул, заключённых в сферу, имеющую однородно
распределённый положительный электрический заряд…».
То есть по Томсону, атом состоит из электронов, помещённых в
положительно заряженный «суп», компенсирующий электрически отрицательные заряды
электронов, образно — подобно отрицательно заряженным «изюминкам» в
положительно заряженном «пудинге». Именно поэтому модель атома Томсона была
названа «Пудинговой».
В модели Томсона электроны могли свободно вращаться по
кольцевым орбитам, которые стабилизировались взаимодействиями между
электронами. А линейчатые спектры объясняли разницей энергий при движении
электронов по разным кольцевым орбитам.
Используя модель атома Томсона, можно было объяснить ряд
известных к тому времени физических явлений, таких как электризация,
электрическая проводимость твёрдых тел, жидкостей и газов. Но в то же время она
имела ряд существенных недостатков. Во-первых, она не могла объяснить наличие
большого числа линий в спектрах атомов. Во-вторых, модель не позволяла
объяснить спектральные закономерности в спектре атома водорода. Но самый
главный фактор, заставившим отказаться от модели Томсона, состоял в том, что
«Пудинговая модель» оказалась в полном противоречии с опытами Ганса Гейгера и
Эрнеста Марсдена под руководством Эрнеста Резерфорда, проведёнными в тысяча
1909 году.
Суть опыта была достаточно проста. Резерфорд с помощниками
брали свинцовый сосуд, внутри которого находился радиоактивный элемент,
испускающий через узкое отверстие в сосуде альфа-частицы (ионизированные атомы
гелия, масса которых примерно в 8000 раз больше массы электрона).
Скорость вылетающей альфа-частицы была очень велика — порядка
1/15 скорости света. Для регистрации этих самых частиц учёный использовал
сцинтилляционный экран с микроскопом. Микроскоп вместе с экраном мог вращаться
вокруг вертикальной оси, проходящей через центр камеры. Чтобы устранить
рассеяние альфа-частиц на молекулах воздуха, установка помещалась внутрь
герметичной камеры, в которой создавался высокий вакуум.
Если на пути частиц нет никаких препятствий, то они попадали
на экран узким пучком. А возникающие вспышки сливались в одно небольшое
световое пятно. Однако когда учёные поместили на пути
альфа-частиц тонкую золотую фольгу, то при взаимодействии с ней, площадь пятна
увеличилась. Это свидетельствовало о рассеянии альфа-частиц на атомах золота.
Однако самое удивительное произошло тогда, когда экран был
поставлен с обратной стороны (говорят, что в результате ошибки лаборанта). Даже
в этом случае на экране наблюдались вспышки, то есть альфа-частицы рассеивались
на углы больше 90°. Такой результат предвидеть было очень сложно, поскольку
расчёты говорили о том, что электрическое поле положительного заряда,
распределённого по всему атому, не может быть достаточно сильным, чтобы
отбросить альфа-частицу назад. А так как масса электрона почти в 8000 раз
меньше массы альфа-частицы, то и они не могли существенно поменять траекторию
движения последней. При этом резкие отклонения наблюдались весьма редко
(примерно одна из 20 000 альфа-частиц испытывала отклонение на угол больше
90°; одна из 40 000 — на угол больше 120°, и одна из 70 000 — на угол
больше 150°).
Легенда гласит, что Резерфорд выбежал из лаборатории с
криком: «Теперь я знаю, как устроен атом!»
Из результатов экспериментов следовало то, что внутри атома
имеется очень сильное электрическое поле, которое создаётся положительным
зарядом, сконцентрированным в очень малом объёме. Название «ядро» для этого
заряда было предложено Резерфордом. Размер ядра мал, но в нём сосредоточена
практически вся масса атома — около 99,96 %. При сближении альфа-частицы и ядра
в соответствии с законом Кулона между ними возникают большие силы отталкивания,
которые существенно изменяют траекторию альфа-частиц.
На основании своих опытов Резерфорд смог оценить размеры
атома и его ядра. Выяснилось, что диаметр ядра составляет порядка 10–14
— 10–15 м. В то время как диаметр атома составляет порядка 10–10
м. В 1911 году все эти данные привели Резерфорда к созданию ядерной модели
атома.
Согласно этой модели в центре атома
расположено положительно заряженное ядро, диаметром около 10–15 м, в
котором сосредоточена основная масса атома. Заряд ядра равен произведению
порядкового номера элемента в таблице Менделеева и модулю заряда электрона:
Ядро атома окружают электроны, образуя электронную оболочку
атома. Причём число электронов равно порядковому номеру элемента в таблице
Менделеева, а их суммарный заряд равен заряду ядра. Именно поэтому атом в целом
электрически нейтрален.
Внутри атома электроны не могут покоиться, так как под
действием кулоновских сил они упали бы на ядро, и атом прекратил бы своё
существование. Поэтому они вращаются вокруг ядра по определенным орбитам.
Такую модель атома называют также планетарной,
поскольку она напоминает нашу Солнечную систему, где планеты вращаются вокруг
массивного центра — Солнца, масса которого составляет около 99,87 % массы
всей Солнечной системы.
При всей своей убедительности модель атома Резерфорда
оказалась внутренне противоречивой. По законам электродинамики движущийся
ускоренно заряд излучает электромагнитные волны. Следовательно, атом должен
непрерывно излучать электромагнитные волны. Излучение же связано с уменьшением
энергии электрона в поле ядра. Следствием этого должно явиться уменьшение
скорости движения и частоты вращения электронов вокруг ядра. Если частота
непрерывно изменяется, то спектр излучения атома должен быть сплошным.
Уменьшение скорости электрона должно привести к тому, что электрон будет
двигаться по спирали к ядру и в течение короткого времени упадёт на него. То
есть в этой модели атом должен быть неустойчивым.
Это находится в полном противоречии с экспериментальными
фактами, которые свидетельствуют о том, что:
атом является достаточно устойчивой системой;
атом излучает электромагнитные волны лишь при определенных
условиях, а не непрерывно;
а спектры излучения атомов являются линейчатыми.
Эти противоречия возникли потому, что к электронам в атомах
применяли законы классической физики, а, как мы уже с вами знаем, в микромире
действуют свои законы, отличные от законов макромира.
В 1903 году Эрнест Резерфорд и его помощник, английский химик
Фредерик Содди, обнаружили, что в результате альфа-распада радиоактивный радий
превращается в новый химический элемент — радон. При этом оба химических
элемента не имеют ничего общего друг с другом: радий — это металл, который при
нормальных условиях находится в твёрдом состоянии, а радон — это инертный газ.
Помимо этого, атомы обоих элементов имеют разную массу, заряд ядра и количество
электронов в электронной оболочке. Плюс ко всему, они по-разному вступают в
химические реакции.
Вскоре опыты, проведённые с другими радиоактивными
элементами, показали, что не только при альфа-излучении, но и при бета-распаде
происходит превращение одного химического элемента в другой. Однако механизм
обоих превращений не был понятен. Лишь после того, как Резерфордом была
предложена ядерная модель атома, стало понятно, что именно ядро претерпевает
изменения при радиоактивных превращениях.