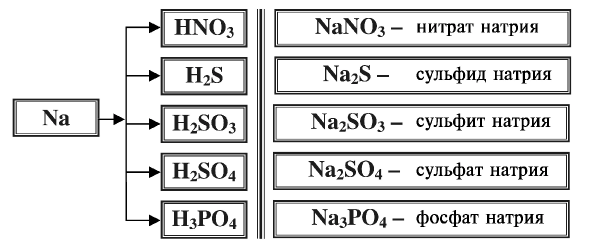
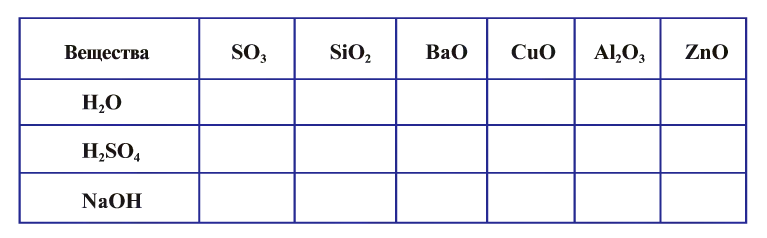
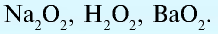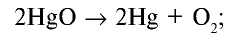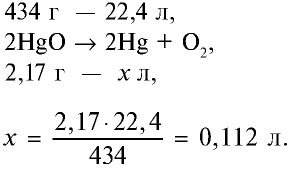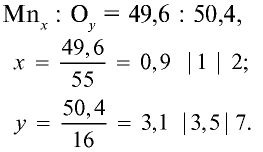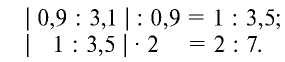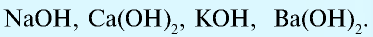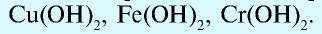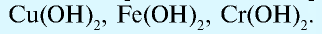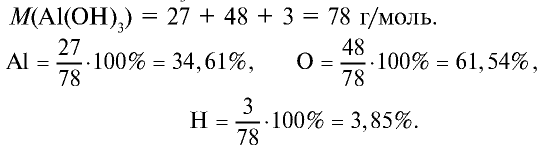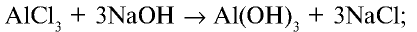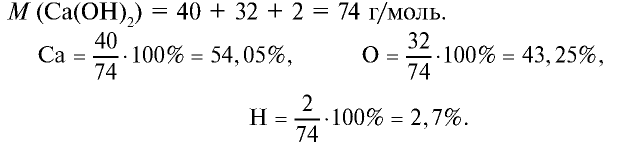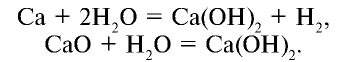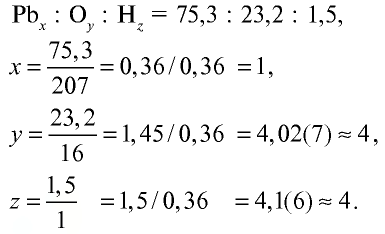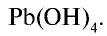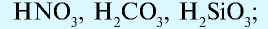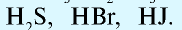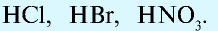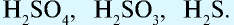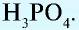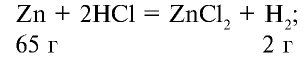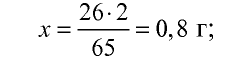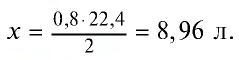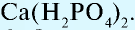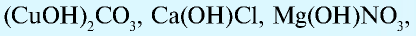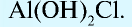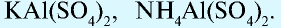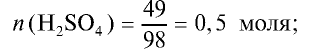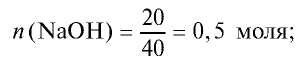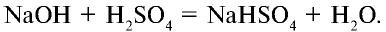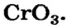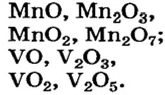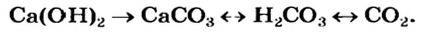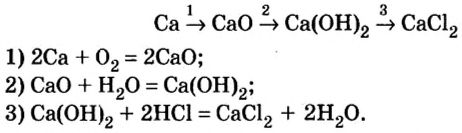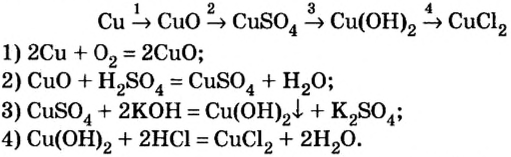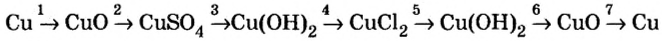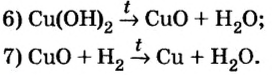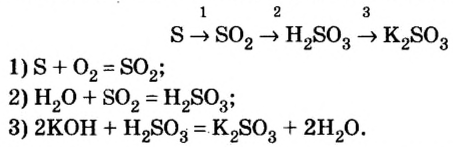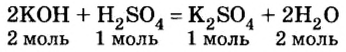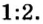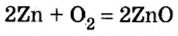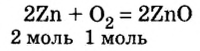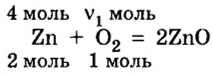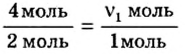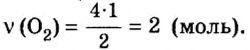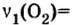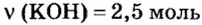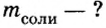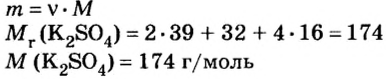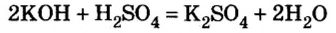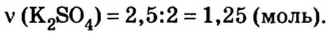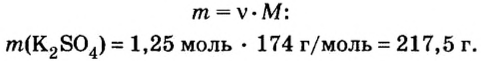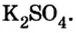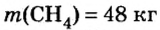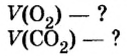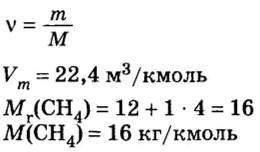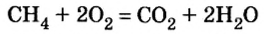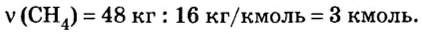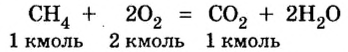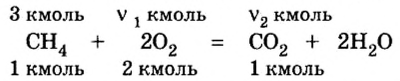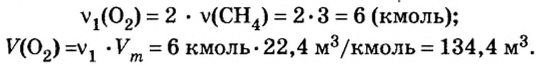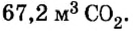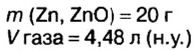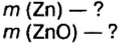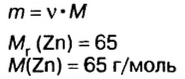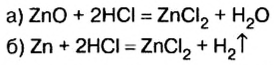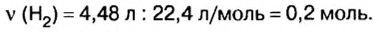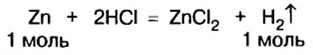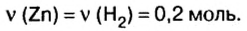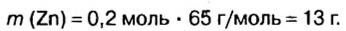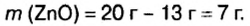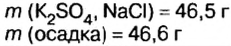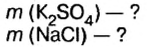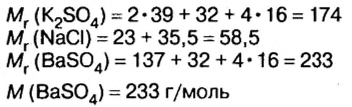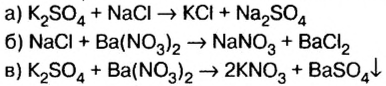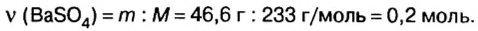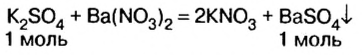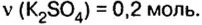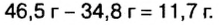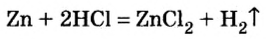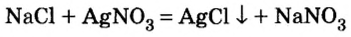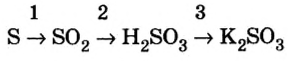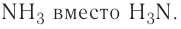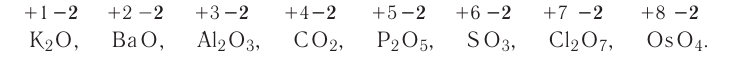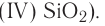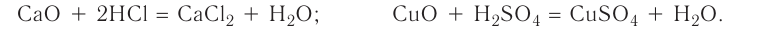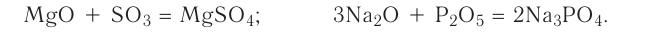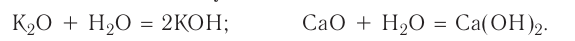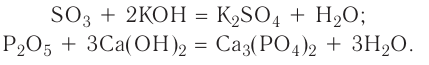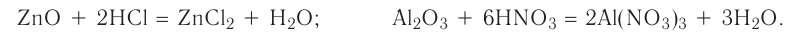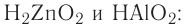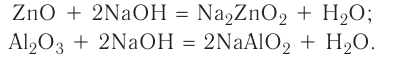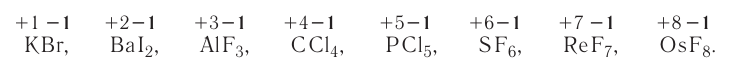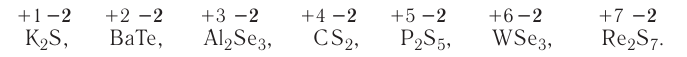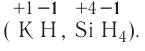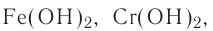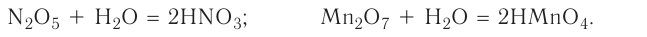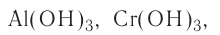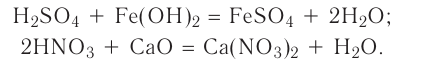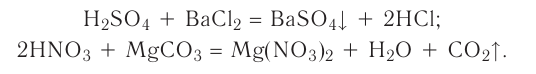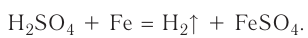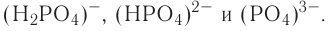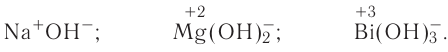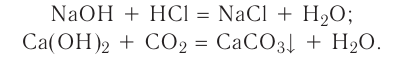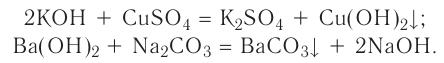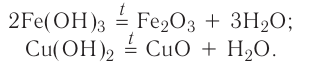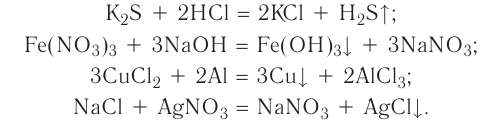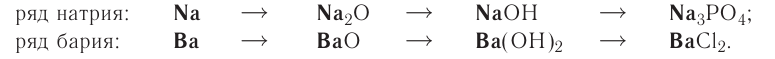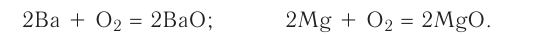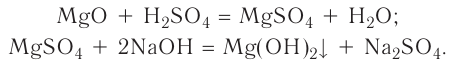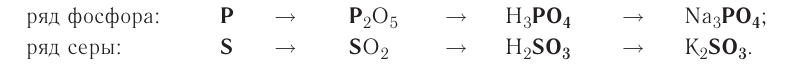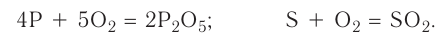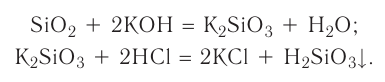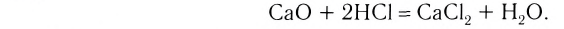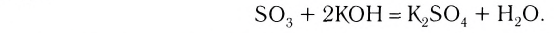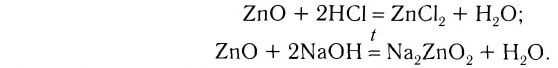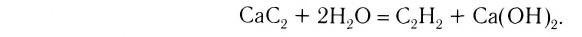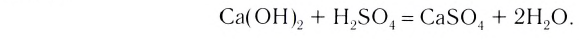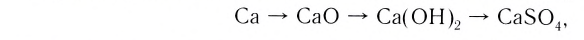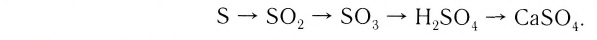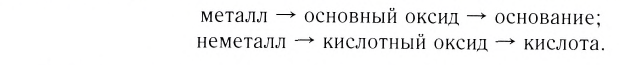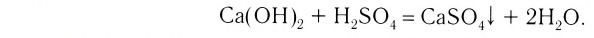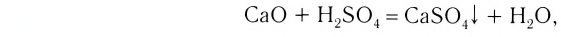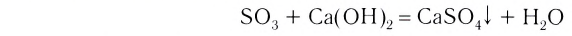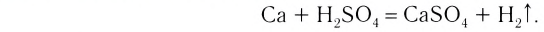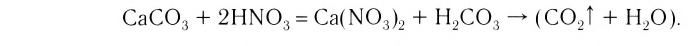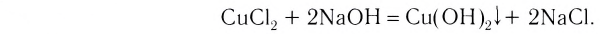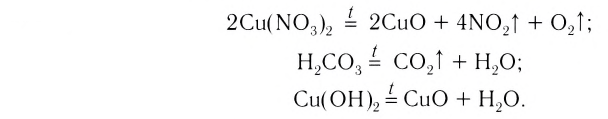2.1. Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная).
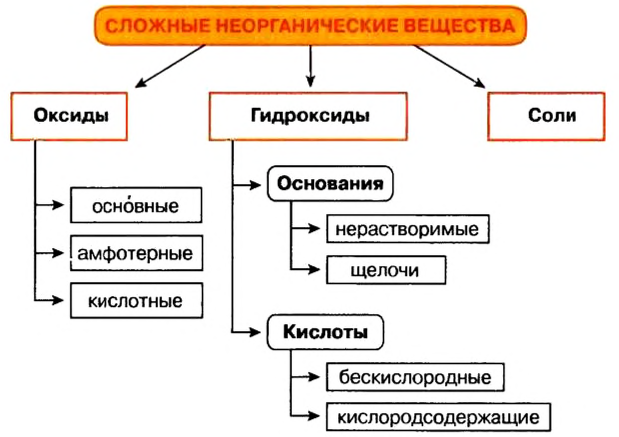
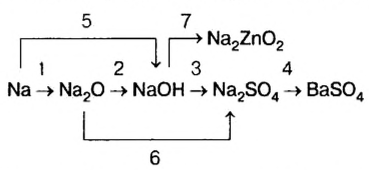
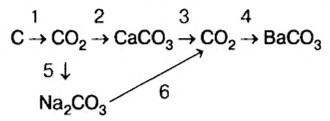
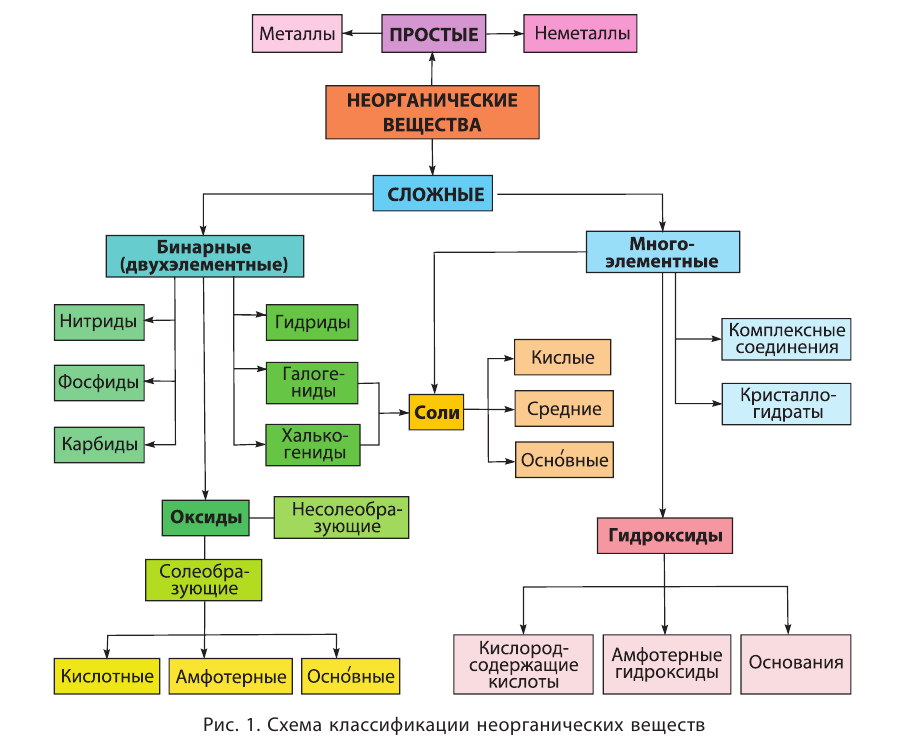
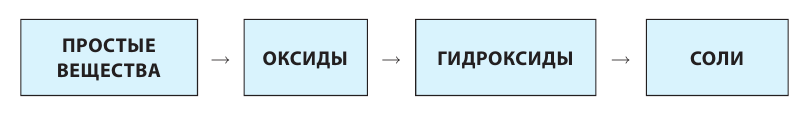
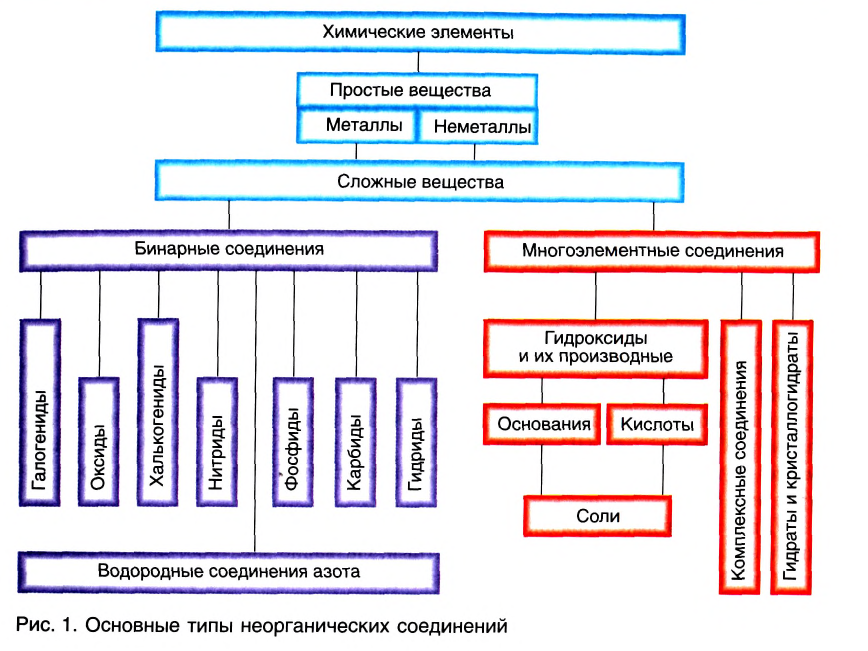
Классификация неорганических веществ с примерами соединений
Теперь проанализируем представленную выше классификационную схему более детально.
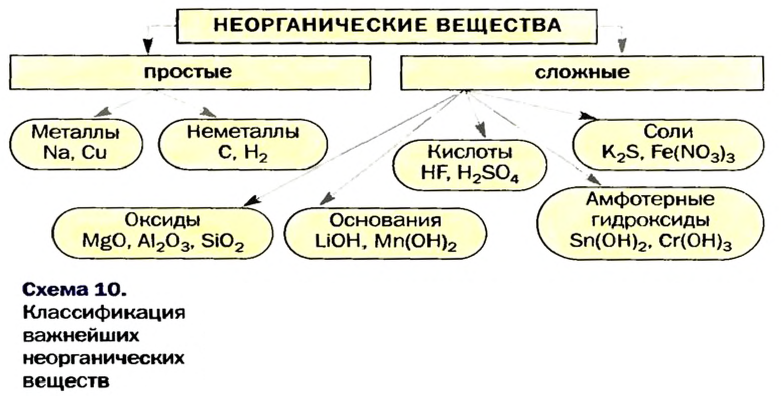
Как мы видим, прежде всего все неорганические вещества делятся на простые и сложные:
Простыми веществами называют такие вещества, которые образованы атомами только одного химического элемента. Например, простыми веществами являются водород H2, кислород O2, железо Fe, углерод С и т.д.
Среди простых веществ различают металлы, неметаллы и благородные газы:
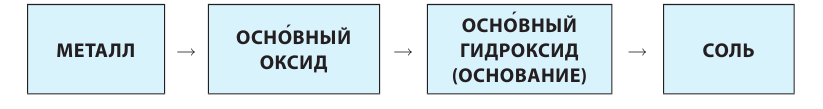
Металлы образованы химическими элементами, расположенными ниже диагонали бор-астат, а также всеми элементами, находящимися в побочных группах.
Благородные газы образованы химическими элементами VIIIA группы.
Неметаллы образованы соответственно химическими элементами, расположенными выше диагонали бор-астат, за исключением всех элементов побочных подгрупп и благородных газов, расположенных в VIIIA группе:
Названия простых веществ чаще всего совпадают с названиями химических элементов, атомами которых они образованы. Однако для многих химических элементов широко распространено такое явление, как аллотропия. Аллотропией называют явление, когда один химический элемент способен образовывать несколько простых веществ. Например, в случае химического элемента кислорода возможно существование молекулярных соединений с формулами O2 и O3. Первое вещество принято называть кислородом так же, как и химический элемент, атомами которого оно образовано, а второе вещество (O3) принято называть озоном. Под простым веществом углеродом может подразумеваться любая из его аллотропных модификаций, например, алмаз, графит или фуллерены. Под простым веществом фосфором могут пониматься такие его аллотропные модификации, как белый фосфор, красный фосфор, черный фосфор.
Сложные вещества
Сложными веществами называют вещества, образованные атомами двух или более химических элементов.
Так, например, сложными веществами являются аммиак NH3, серная кислота H2SO4, гашеная известь Ca(OH)2 и бесчисленное множество других.
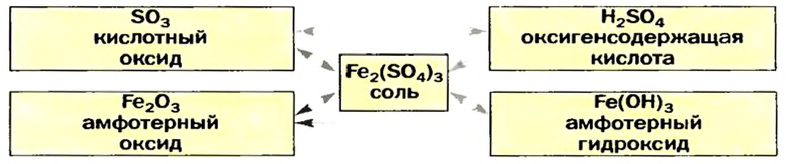
Среди сложных неорганических веществ выделяют 5 основных классов, а именно оксиды, основания, амфотерные гидроксиды, кислоты и соли:
Оксиды — сложные вещества, образованные двумя химическими элементами, один из которых кислород в степени окисления -2.
Общая формула оксидов может быть записана как ЭxOy, где Э — символ какого-либо химического элемента.
Номенклатура оксидов
Название оксида химического элемента строится по принципу:
Например:
Fe2O3 — оксид железа (III); CuO — оксид меди (II); N2O5 — оксид азота (V)
Нередко можно встретить информацию о том, что в скобках указывается валентность элемента, однако же это не так. Так, например, степень окисления азота N2O5 равна +5, а валентность, как это ни странно, равна четырем.
В случае, если химический элемент имеет единственную положительную степень окисления в соединениях, в таком случае степень окисления не указывается. Например:
Na2O — оксид натрия; H2O — оксид водорода; ZnO — оксид цинка.
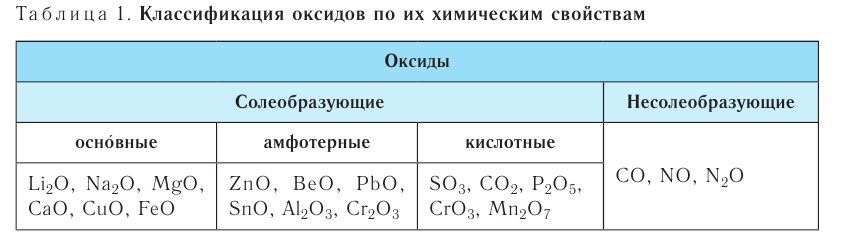
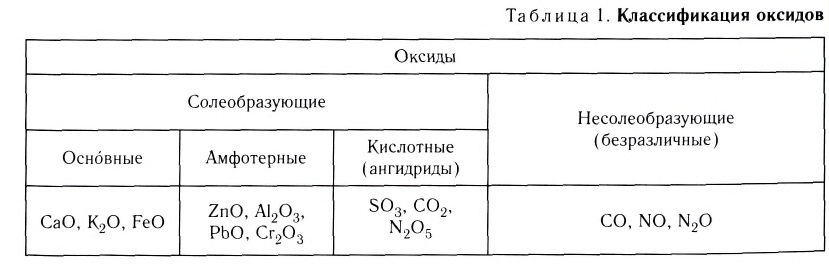
Классификация оксидов
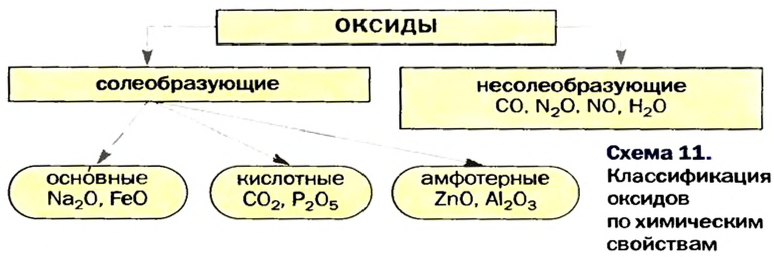
Оксиды по их способности образовывать соли при взаимодействии с кислотами или основаниями подразделяют соответственно на солеобразующие и несолеобразующие.
Несолеобразующих оксидов немного, все они образованы неметаллами в степени окисления +1 и +2. Список несолеобразующих оксидов следует запомнить: CO, SiO, N2O, NO.
Солеобразующие оксиды в свою очередь подразделяются на основные, кислотные и амфотерные.
Основными оксидами называют такие оксиды, которые при взаимодействии с кислотами (или кислотными оксидами) образуют соли. К основным оксидам относят оксиды металлов в степени окисления +1 и +2, за исключением оксидов BeO, ZnO, SnO, PbO.
Кислотными оксидами называют такие оксиды, которые при взаимодействии с основаниями (или основными оксидами) образуют соли. Кислотными оксидами являются практически все оксиды неметаллов за исключением несолеобразующих CO, NO, N2O, SiO, а также все оксиды металлов в высоких степенях окисления (+5, +6 и +7).
Амфотерными оксидами называют оксиды, которые могут реагировать как с кислотами, так и основаниями, и в результате этих реакций образуют соли. Такие оксиды проявляют двойственную кислотно-основную природу, то есть могут проявлять свойства как кислотных, так и основных оксидов. К амфотерным оксидам относятся оксиды металлов в степенях окисления +3, +4, а также в качестве исключений оксиды BeO, ZnO, SnO, PbO.
Некоторые металлы могут образовывать все три вида солеобразующих оксидов. Например, хром образует основный оксид CrO, амфотерный оксид Cr2O3 и кислотный оксид CrO3.
Как можно видеть, кислотно-основные свойства оксидов металлов напрямую зависят от степени окисления металла в оксиде: чем больше степень окисления, тем сильнее выражены кислотные свойства.
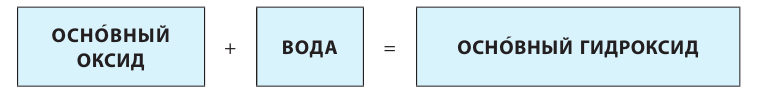
Основания
Основания — соединения с формулой вида Me(OH)x, где x чаще всего равен 1 или 2.
Исключения: Be(OH)2, Zn(OH)2, Sn(OH)2 и Pb(OH)2 не относятся к основаниям, несмотря на степень окисления металла +2. Данные соединения являются амфотерными гидроксидами, которые еще будут рассмотрены в этой главе более подробно.
Классификация оснований
Основания классифицируют по количеству гидроксогрупп в одной структурной единице.
Основания с одной гидроксогруппой, т.е. вида MeOH, называют однокислотными основаниями, с двумя гидроксогруппами, т.е. вида Me(OH)2, соответственно, двухкислотными и т.д.
Также основания подразделяют на растворимые (щелочи) и нерастворимые.
К щелочам относятся исключительно гидроксиды щелочных и щелочно-земельных металлов, а также гидроксид таллия TlOH.
Номенклатура оснований
Название основания строится по нижеследующему принципу:
Например:
Fe(OH)2 — гидроксид железа (II),
Cu(OH)2 — гидроксид меди (II).
В тех случаях, когда металл в сложных веществах имеет постоянную степень окисления, указывать её не требуется. Например:
NaOH — гидроксид натрия,
Ca(OH)2 — гидроксид кальция и т.д.
Кислоты
Кислоты — сложные вещества, молекулы которых содержат атомы водорода, способные замещаться на металл.
Общая формула кислот может быть записана как HxA, где H — атомы водорода, способные замещаться на металл, а A — кислотный остаток.
Например, к кислотам относятся такие соединения, как H2SO4, HCl, HNO3, HNO2 и т.д.
Классификация кислот
По количеству атомов водорода, способных замещаться на металл, кислоты делятся на:
— одноосновные кислоты: HF, HCl, HBr, HI, HNO3;
— двухосновные кислоты: H2SO4, H2SO3, H2CO3;
— трехосновные кислоты: H3PO4, H3AsO4.
Следует отметить, что количество атомов водорода в случае органических кислот чаще всего не отражает их основность. Например, уксусная кислота с формулой CH3COOH, несмотря на наличие 4-х атомов водорода в молекуле, является не четырех-, а одноосновной. Основность органических кислот определяется количеством карбоксильных групп (-COOH) в молекуле.
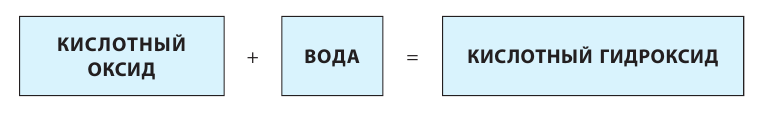
Также по наличию кислорода в молекулах кислоты подразделяют на бескислородные (HF, HCl, HBr и т.д.) и кислородсодержащие (H2SO4, HNO3, H3PO4 и т.д.). Кислородсодержащие кислоты называют также оксокислотами.
Более детально про классификацию кислот можно почитать здесь.
Номенклатура кислот и кислотных остатков
Нижеследующий список названий и формул кислот и кислотных остатков обязательно следует выучить.
В некоторых случаях облегчить запоминание может ряд следующих правил.
Как можно видеть из таблицы выше, построение систематических названий бескислородных кислот выглядит следующим образом:
Например:
HF — фтороводородная кислота;
HCl — хлороводородная кислота;
H2S — сероводородная кислота.
Названия кислотных остатков бескислородных кислот строятся по принципу:
Например, Cl— — хлорид, Br— — бромид.
Названия кислородсодержащих кислот получают добавлением к названию кислотообразующего элемента различных суффиксов и окончаний. Например, если кислотообразующий элемент в кислородсодержащей кислоте имеет высшую степень окисления, то название такой кислоты строится следующим образом:
Например, серная кислота H2S+6O4, хромовая кислота H2Cr+6O4.
Все кислородсодержащие кислоты могут быть также классифицированы как кислотные гидроксиды, поскольку в их молекулах обнаруживаются гидроксогруппы (OH). Например, это видно из нижеследующих графических формул некоторых кислородсодержащих кислот:
Таким образом, серная кислота иначе может быть названа как гидроксид серы (VI), азотная кислота — гидроксид азота (V), фосфорная кислота — гидроксид фосфора (V) и т.д. При этом число в скобках характеризует степень окисления кислотообразующего элемента. Такой вариант названий кислородсодержащих кислот многим может показаться крайне непривычным, однако же изредка такие названия можно встретить в реальных КИМах ЕГЭ по химии в заданиях на классификацию неорганических веществ.
Амфотерные гидроксиды
Амфотерные гидроксиды — гидроксиды металлов, проявляющие двойственную природу, т.е. способные проявлять как свойства кислот, так и свойства оснований.
Амфотерными являются гидроксиды металлов в степенях окисления +3 и +4 (как и оксиды).
Также в качестве исключений к амфотерным гидроксидам относят соединения Be(OH)2, Zn(OH)2, Sn(OH)2 и Pb(OH)2, несмотря на степень окисления металла в них +2.
Для амфотерных гидроксидов трех- и четырехвалентных металлов возможно существование орто- и мета-форм, отличающихся друг от друга на одну молекулу воды. Например, гидроксид алюминия (III) может существовать в орто-форме Al(OH)3 или мета-форме AlO(OH) (метагидроксид).
Поскольку, как уже было сказано, амфотерные гидроксиды проявляют как свойства кислот, так и свойства оснований, их формула и название также могут быть записаны по-разному: либо как у основания, либо как у кислоты. Например:
| Амфотерный гидроксид в форме основания | Амфотерный гидроксид в форме кислоты | «Кислотный» остаток |
| Zn(OH)2 гидроксид цинка | H2ZnO2 цинковая кислота | ZnO22- цинкат |
| Al(OH)3 (орто)гидроксид алюминия | H3AlO3 ортоалюминиевая кислота | AlO33- ортоалюминат |
| AlO(OH) метагидроксид алюминия | HAlO2 метаалюминиевая кислота | AlO2— метаалюминат |
Соли
Соли — это сложные вещества, в состав которых входят катионы металлов и анионы кислотных остатков.
Так, например, к солям относятся такие соединения как KCl, Ca(NO3)2, NaHCO3 и т.д.
Представленное выше определение описывает состав большинства солей, однако же существуют соли, не попадающие под него. Например, вместо катионов металлов в состав соли могут входить катионы аммония или его органические производные. Т.е. к солям относятся такие соединения, как, например, (NH4)2SO4 (сульфат аммония), [CH3NH3]+Cl— (хлорид метиламмония) и т.д.
Также противоречат определению солей выше класс так называемых комплексных солей, которые будут рассмотрены в конце данной темы.
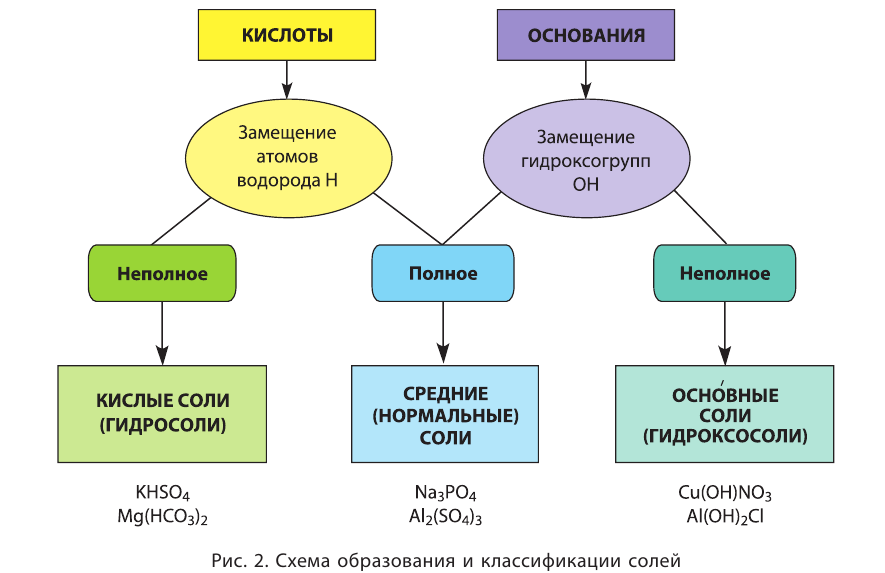
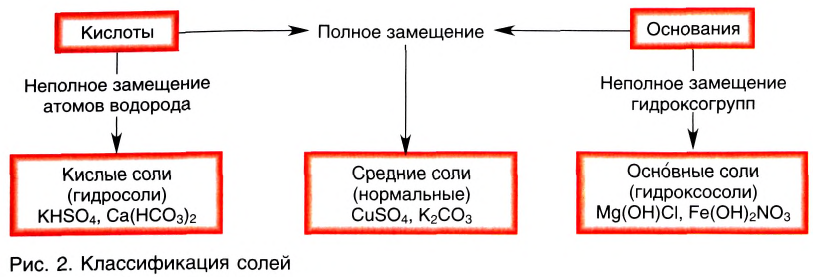
Классификация солей
С другой стороны, соли можно рассматривать как продукты замещения катионов водорода H+ в кислоте на другие катионы или же как продукты замещения гидроксид-ионов в основаниях (или амфотерных гидроксидах) на другие анионы.
При полном замещении образуются так называемые средние или нормальные соли. Например, при полном замещении катионов водорода в серной кислоте на катионы натрия образуется средняя (нормальная) соль Na2SO4, а при полном замещении гидроксид-ионов в основании Ca(OH)2 на кислотные остатки нитрат-ионы образуется средняя (нормальная) соль Ca(NO3)2.
Соли, получаемые неполным замещением катионов водорода в двухосновной (или более) кислоте на катионы металла, называют кислыми. Так, при неполном замещении катионов водорода в серной кислоте на катионы натрия образуется кислая соль NaHSO4.
Соли, которые образуются при неполном замещении гидроксид-ионов в двухкислотных (или более) основаниях, называют основными солями. Например, при неполном замещении гидроксид-ионов в основании Ca(OH)2 на нитрат-ионы образуется основная соль Ca(OH)NO3.
Соли, состоящие из катионов двух разных металлов и анионов кислотных остатков только одной кислоты, называют двойными солями. Так, например, двойными солями являются KNaCO3, KMgCl3 и т.д.
Если соль образована одним типом катионов и двумя типами кислотных остатков, такие соли называют смешанными. Например, смешанными солями являются соединения Ca(OCl)Cl, CuBrCl и т.д.
Существуют соли, которые не попадают под определение солей как продуктов замещения катионов водорода в кислотах на катионы металлов или продуктов замещения гидроксид-ионов в основаниях на анионы кислотных остатков. Это — комплексные соли. Так, например, комплексными солями являются тетрагидроксоцинкат- и тетрагидроксоалюминат натрия с формулами Na2[Zn(OH)4] и Na[Al(OH)4] соответственно. Распознать комплексные соли среди прочих чаще всего можно по наличию квадратных скобок в формуле. Однако нужно понимать, что, чтобы вещество можно было отнести к классу солей, в его состав должны входить какие-либо катионы, кроме (или вместо) H+, а из анионов должны быть какие-либо анионы помимо (или вместо) OH—. Так, например, соединение H2[SiF6] не относится к классу комплексных солей, поскольку при его диссоциации из катионов в растворе присутствуют только катионы водорода H+. По типу диссоциации данное вещество следует скорее классифицировать как бескислородную комплексную кислоту. Аналогично, к солям не относится соединение [Ag(NH3)2]OH, т.к. данное соединение состоит из катионов [Ag(NH3)2]+ и гидроксид-ионов OH—, т.е. его следует считать комплексным основанием.
Номенклатура солей
Номенклатура средних и кислых солей
Название средних и кислых солей строится по принципу:
Если степень окисления металла в сложных веществах постоянная, то ее не указывают.
Названия кислотных остатков были даны выше при рассмотрении номенклатуры кислот.
Например,
Na2SO4 — сульфат натрия;
NaHSO4 — гидросульфат натрия;
CaCO3 — карбонат кальция;
Ca(HCO3)2 — гидрокарбонат кальция и т.д.
Номенклатура основных солей
Названия основных солей строятся по принципу:
Например:
(CuOH)2CO3 — гидроксокарбонат меди (II);
Fe(OH)2NO3 — дигидроксонитрат железа (III).
Номенклатура комплексных солей
Номенклатура комплексных соединений значительно сложнее, и для сдачи ЕГЭ многого знать из номенклатуры комплексных солей не нужно.
Следует уметь называть комплексные соли, получаемые взаимодействием растворов щелочей с амфотерными гидроксидами. Например:
*Одинаковыми цветами в формуле и названии обозначены соответствующие друг другу элементы формулы и названия.
Тривиальные названия неорганических веществ
Под тривиальными названиями понимают названия веществ не связанные, либо слабо связанные с их составом и строением. Тривиальные названия обусловлены, как правило, либо историческими причинами либо физическими или химическими свойствами данных соединений.
Список тривиальных названий неорганических веществ, которые необходимо знать:
| Na3[AlF6] | криолит |
| SiO2 | кварц, кремнезем |
| FeS2 | пирит, железный колчедан |
| CaSO4∙2H2O | гипс |
| CaC2 | карбид кальция |
| Al4C3 | карбид алюминия |
| KOH | едкое кали |
| NaOH | едкий натр, каустическая сода |
| H2O2 | перекись водорода |
| CuSO4∙5H2O | медный купорос |
| NH4Cl | нашатырь |
| CaCO3 | мел, мрамор, известняк |
| N2O | веселящий газ |
| NO2 | бурый газ |
| NaHCO3 | пищевая (питьевая) сода |
| Fe3O4 | железная окалина |
| NH3∙H2O (NH4OH) | нашатырный спирт |
| CO | угарный газ |
| CO2 | углекислый газ |
| SiC | карборунд (карбид кремния) |
| PH3 | фосфин |
| NH3 | аммиак |
| KClO3 | бертолетова соль (хлорат калия) |
| (CuOH)2CO3 | малахит |
| CaO | негашеная известь |
| Ca(OH)2 | гашеная известь |
| прозрачный водный раствор Ca(OH)2 | известковая вода |
| взвесь твердого Ca(OH)2 в его водном растворе | известковое молоко |
| K2CO3 | поташ |
| Na2CO3 | кальцинированная сода |
| Na2CO3∙10H2O | кристаллическая сода |
| MgO | жженая магнезия |
Номенклатура оксидов
В соответствии с номенклатурой ИЮПАК любое бинарное соединение, в котором присутствует кислород со степенью окисления -2, называют словом «оксид», затем указывают название элемента в родительном падеже. Если для элемента характерна постоянная валентность, то больше ничего указывать не нужно. Если для элемента характерна переменная валентность, то после названия необходимо указать в скобках его валентность в данном оксиде; валентность указывают римскими цифрами.
Например: WO3 — оксид вольфрама (VI); Li2O — оксид лития.
Если вы не знаете, что такое валентность, и как ее определять, то необходимо изучить соответствующую статью.
Номенклатура оснований и амфотерных гидроксидов
Названия оснований и амфотерных гидроксидов строятся аналогично, только вместо слова «оксид» используют слово «гидроксид«, затем указывают название металла в родительном падеже. Если для металла (или металлоподобного иона) характерна постоянная валентность, то больше ничего указывать не нужно. Если для металла характерна переменная валентность, то после названия необходимо указать в скобках его валентность в данном гидроксиде; валентность указывают римскими цифрами.
Например: KOH – гидроксид калия; Fe(OH)3 – гидроксид железа (III).
Номенклатура кислот и солей
Название кислот строятся так: к корню названия центрального элемента на русском языке добавляют постфиксы -ная, -нистая или -водородная, в зависимости от степени окисления центрального элемента.
Если вы не помните, что такое степень окисления, и как ее определять, то сначала необходимо изучить соответствующую статью.
Названия солей строятся так: к корню названия центрального элемента на латинском языке добавляют постфиксы -ат, -ит или -ид, в зависимости от степени окисления центрального элемента. Затем указывают название металла в родительном падеже. Если для металла (или металлоподобного иона) характерна постоянная валентность, то больше ничего указывать не нужно. Если для металла характерна переменная валентность, то после названия необходимо указать в скобках его валентность в данной соли; валентность указывают римскими цифрами.
Корни латинского названия у большинства элементов совпадают с корнями русского названия. Для некоторых элементов они отличаются. Их следует запомнить:
C – карб, S – сульф, N – нитр и др.
Рассмотрим основные случаи.
1. Если центральный элемент в кислоте имеет высшую степень окисления, т.е. в кислотном остатке этой кислоты содержится максимальное количество атомов кислорода, то к названию кислоты добавляют постфикс -ная или -вая.
Например: H2S+6O4 – серная кислота, H3P+5O4 – фосфорная кислота.
При этом в названии соли используют постфикс -ат.
Например: Na2S+6O4 – сульфат натрия, K2C+4O3 – карбонат калия.
2. Если центральный элемент в кислоте имеет промежуточную степень окисления, т.е. в кислотном остатке этой кислоты содержится не максимальное количество атомов кислорода, то к названию кислоты добавляют постфикс -нистая.
Например: H2S+4O3 – сернистая кислота, H3P+3O3 – фосфористая кислота.
При этом в названии соли используют постфикс —ит.
Например, Na2S+4O3 – сульфит натрия, KN+3O2 – нитрит калия.
3. Если центральный элемент в кислоте имеет низшую степень окисления, т.е. в кислотном остатке этой кислоты не содержатся атомы кислорода, то к названию кислоты добавляют постфикс -водородная.
Например: H2S-2 – сероводородная кислота, HCl— – хлороводородная кислота.
При этом в названии соли используем постфикс -ид.
Например, Na2S-2 – сульфид натрия, KCl— – хлорид калия.
Номенклатура кислых солей.
Если в кислой соли на один кислотный остаток приходится один атом водорода, то к названию кислотного остатка добавляют префикс гидро-. Если на один кислотный остаток приходится два атома водорода, то добавляют префикс дигидро-.
Например, K2HPO4 – гидрофосфат калия, KH2PO4 – дигидрофосфат калия. Но: Ca(HCO3)2 – гидрокарбонат кальция.
Номенклатура основных солей.
Если в основной соли на один катион металла приходится одна гидроксо-группа, то к названию кислотного остатка добавляют префикс гидроксо-. Если на один катион металла приходится две гидроксо-группы, то добавляют префикс дигидроксо-.
Например, AlOHCl2 – гидроксохлорид алюминия, Al(OH)2Cl – дигидроксохлорид алюминия. Но: (CuOH)2CO3 – гидроксокарбонат меди (II).
В названии двойной соли катионы металлов перечисляют через дефис. В названии смешанных солей анионы кислотных остатков перечисляются через дефис.
Например, KAl(SO4)2 – сульфат алюминия-калия, CaClBr – бромид-хлорид кальция.
Также применяется тривиальная номенклатура. Тривиальные названия неорганических необходимо выучить наизусть.
Номенклатура комплексных солей*
Комплексное соединение может состоять из комплексного катиона, комплексного аниона или может быть нейтральным.
Комплексные соединения состоят из внутренней и внешней сферы. Центральная частица, вокруг которой расположены окружающие ее лиганды, называется комплексообразователем. Число лигандов комплексообразователя называется координационным числом. Как правило (но не обязательно!), число лигандов в 2 раза больше, чем степень окисления центральной частицы.
Соединения с комплексными катионами. Вначале называют анион внешней сферы, затем перечисляют лиганды, затем называют комплексообразователь в родительном падеже (ему дается русское название данного элемента). После названия комплексообразователя в скобках римской цифрой указывается его степень окисления.
К латинскому названию анионного лиганда добавляется окончание “о” (F— — фторо, Cl— -хлоро, ОН— — гидроксо, CN— — циано и т.д). Аммиак обозначают термином “аммин”, СО – карбонил, NO – нитрозил, H2O – аква.
Число одинаковых лигандов называют греческим числительным: 2 –ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса, 7 – гепта и т.д.
Например:
[Cu(NH3)4]SO4 – сульфат тетраамминмеди (II),
[Ni(H2O)6]Cl2 – хлорид гексаакваникеля (II).
Вначале перечисляют лиганды анионные, затем нейтральные, затем катионные.
Например:
[Pt(NH3)5Cl]Cl3 – хлорид хлоропентаамминплатины (IV) .
Если в комплексе имеются несколько лигандов одинакового знака заряда, то они называются в алфавитном порядке:
[CoCl2(H2O)(NH3)3]Cl – хлорид дихлороакватриамминкобальта (III).
Соединения с комплексными анионами. Вначале называют комплексный анион в именительном падеже: перечисляют лиганды, затем комплексообразователь (ему дается латинское название и к названию добавляется окончание “ат”). После названия комплексообразователя указывается его степень окисления. Затем в родительном падеже называется внешнесферный катион.
Например:
Na2[Zn(OH)4] – тетрагидроксоцинкат (II) натрия;
K4[Fe(CN)6] – гексацианоферрат (II) калия;
K2[СuCl4] – тетрахлорокупрат (II) калия.
Соединения без внешней сферы. Вначале называют лиганды, затем комплексообразователь в именительном падеже с указанием его степени окисления. Все название пишется слитно.
[Ni(CО)4] – тетракарбонилникель (0);
[Pt(NH3)2Cl4] – тетрахлородиамминплатина (IV).
* материалы с портала onx.distant.ru
Номенклатура неорганических веществ
Формулы большинства неорганических веществ записывают в последовательности от катиона к аниону, от металла к неметаллу, от менее активного неметалла к более электроотрицательному.
В летучих водородных соединениях элементов на первое место ставится этот элемент, а затем водород: СН4, NH3.
В России названия оксидов, оснований, солей часто составляют от аниона к катиону, называя справа налево входящие в это соединение атомы или группы атомов.
-
Оксиды
Название оксидов строится по принципу: «оксид» + «название элемента в родительном падеже» + «валентность элемента, если она переменная».
Cr2O3 – оксид хрома (III), Р2О5 – оксид фосфора (V)
-
Гидроксиды
Название гидроксидов строится по принципу: «гидроксид» + «название элемента в родительном падеже» + «валентность элемента, если она переменная».
Fe(OH)2 – гидроксид железа (II), LiOH – гидроксид лития
-
Кислоты
Кислородсодержащие кислоты, имеющие в своем составе атом неметалла или металла в высшей степени окисления, имеют суффикс –НАЯ или –ВАЯ (кислота), в предыдущей степени – ИСТАЯ (кислота).
HNO3 – азотНАЯ кислота, HNO2 – азотИСТАЯ кислота, HMnO4 – марганцеВАЯ кислота, H2MnO4 – марганцовИСТАЯ кислота
Следующий список кислот и названий кислот и кислотных остатков рекомендуется выучить наизусть.
| Название | Формула | Остаток |
|---|---|---|
|
плавиковая фтороводородная |
HF | фторид |
|
соляная хлороводородная |
HCl | хлорид |
| бромоводородная | HBr | бромид |
| иодоводородная | HI | иодид |
| хлорноватистая | HClO | гипохлорит |
| хлористая | HClO2 | хлорит |
| хлорноватая | HClO3 | хлорат |
| хлорная | HClO4 | перхлорат |
| азотистая | HNO2 | нитрит |
| азотная | HNO3 | нитрат |
| сероводородная | H2S | сульфид |
| сернистая | H2SO3 | сульфит |
| серная | H2SO4 | сульфат |
| ортофосфорная | H3PO4 | фосфат |
| фосфористая | H3PO3 | фосфит |
| метафосфорная | HPO3 | метафосфат |
| кремниевая | H2SiO3 | силикат |
| угольная | H2CO3 | карбонат |
| марганцовистая | H2MnO4 | манганат |
| марганцевая | HMnO4 | перманганат |
| хромовая | H2CrO4 | хромат |
| дихромовая | H2Cr2O7 | дихромат |
-
Соли
Названия средних солей строятся по принципу: «название кислотного остатка» + «название катиона» + «валентность металла, если она переменная».
K2SO3 – сульфит калия, NaMnO4 – перманганат натрия
Названия кислых солей строятся следующим образом: «название кислотного остатка с приставкой ГИДРО» + «название катиона» + «валентность металла, если она переменная».
NaHS – гидросульфид натрия, NH4H2PO4 – дигидрофосфат аммония
Названия основных солей строятся так: «название кислотного остатка с приставкой ГИДРОКСО» + «название катиона» + «валентность металла, если она переменная».
MgOHCl – гидроксохлорид магния, (CuOH)2CO3 – гидроксокарбонат меди (II)
Номенклатура комплексных солей несколько сложнее, но для сдачи ЕГЭ многого знать не нужно. Следует уметь называть комплексные соли, образованные щелочами и амфотерными соединениями.
Na2[Zn(OH)4]
4 – тетра
ОН – гидроксо
Zn – цинкат
Na – натрия
=тетрагидроксоцинкат натрия
Под тривиальной номенклатурой понимают названия, связанные либо с применением вещества в быту, либо с физико-химическими свойствами.
В ЕГЭ могут встретиться следующие тривиальные названия веществ:
| Формула | Название |
|---|---|
| SiO2 | кварц, кремнезем |
| FeS2 | пирит |
| NaOH |
едкий натр каустическая сода |
| CaCO3 | мел, мрамор |
| Fe3O4 | железная окалина |
| CO | угарный газ |
| SiC | карборунд |
| KClO3 | бертолетова соль |
| СаО | негашеная известь |
| Ca(OH)2 | гашеная известь |
| K2CO3 | поташ |
| NaHCO3 | пищевая сода |
| Na2CO3 | сода |
Содержание:
Вам известно, что все вещества делят на органические (соединения Карбона) и неорганические (соединения других элементов, а также простые вещества).
Область химической науки, которая изучает неорганические вещества, называют неорганической химией.
Известны сотни тысяч неорганических веществ. Чтобы разобраться в их многообразии, ученые распределили эти вещества по группам, которые назвали классами.
В этом разделе речь пойдет о таких важнейших классах неорганических соединений:
Напомним: буква Е — общий символ химического элемента. Буквой М в общих формулах соединений обозначен металлический элемент, а буквой А — неметаллический элемент (он может находиться в VI или VII группе периодической системы Д. И. Менделеева).
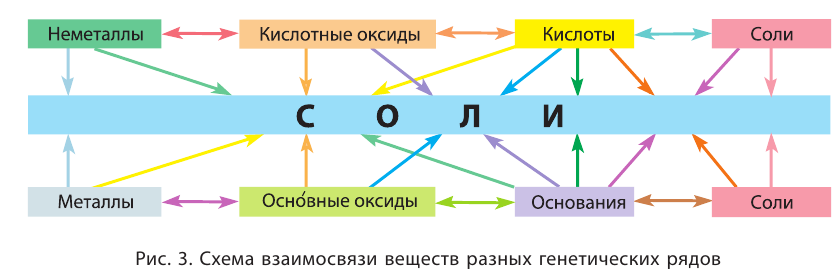
Вещества, принадлежащие к одному классу, похожи по составу, а основания, кислоты и соли — еще и по свойствам и строению.
Металлы и неметаллы
Неорганические вещества по своему составу бывают сложными и простыми (рис. 37). Первоначальные сведения об этих веществах были изложены при изучении темы «Простые и сложные вещества».
Рис. 37. Образцы простых и сложных веществ: 1— бихромат калия; 2 — хлорид калия; 3 — оксид меди (II); 4 — известняк; 5 — цинк; 6 — уголь; 7 — медный купорос; 8 — сера
Вещество, не разлагающееся на составные элементы, называется простым веществом, например, натрий, хлор, водород, кислород.
Рис. 38. Образец природной меди
Простые вещества по своим свойствам подразделяются на металлы и неметаллы.
Металлы состоят из атомов металлов, например, медь (Си) (рис. 38), натрий (Na), калий (К), железо (Fe), магний (Mg), серебро (Ag) и др.
Неметаллы состоят из атомов неметаллов, например, хлор 
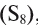
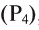
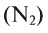
Металлы и неметаллы в большинстве своем обладают противоположными химическими и физическими свойствами (это объясняется различиями в электронном строении их атомов) (табл. 8).
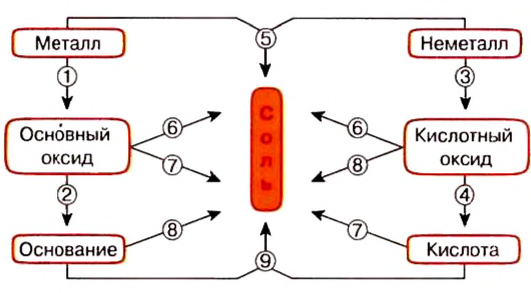
Целесообразно для классификации неорганических веществ воспользоваться следующей схемой:
Классификация сложных веществ
Вещества, состоящие из атомов различных элементов, называются сложными, например: вода состоит из атомов водорода и кислорода, а пищевая соль — из атомов натрия и хлора.
Сложные вещества обычно подразделяются на органические и неорганические: органическими веществами являются углеродсодержащие соединения (за исключением 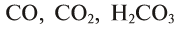
Сложные вещества по составу (состоящие из двух элементов, т. е. бинарные и состоящие из нескольких элементов) и по химическим свойствам (классифицируются по функциональным признакам и группам) подразделяются на оксиды, основания, кислоты и соли.
Сложные вещества коренным образом отличаются от простых тем, что их можно разложить до простых веществ. Между сложными веществами существует тесная взаимосвязь. Классификация сложных веществ отдельно представлена на приведенной выше схеме.
Сложные вещества состоят из атомов различных элементов. В частности, оксиды являются сложными веществами, состоящими из атомов двух видов элементов (бинарные соединения); основания — из атомов трех элементов; кислоты — из атомов двух или трех элементов; соли могут иметь в своем составе атомы двух, трех или четырех элементов.
Оксиды — состав, строение и номенклатура
Оксидами называют сложные вещества, состоящие из двух элементов, один из которых — кислород. Оксиды — бинарные соединения.
Общая формула оксидов: 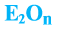
В оксидах атомы кислорода связаны не друг с другом, а с другим элементом. Эмпирические и структурные формулы оксидов изображаются так:
Номенклатура
Название оксида элемента, имеющего постоянную валентность, образуется путем прибавления к слову «оксид» названия элемента в родительном падеже, например, оксид магния, оксид алюминия.
Если элемент имеет переменную валентность и образует несколько оксидов, после слова «оксид» пишется название элемента в родительном падеже, а в скобках римскими цифрами указывается его валентность. Например, 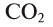
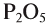
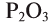
Оксиды иногда обозначаются прибавлением к химическому знаку кислорода греческого названия цифры, указывающей число атомов кислорода в оксиде: например, 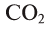
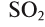
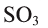
При назывании оксидов иногда используются их бытовые и исторические названия: негашеная известь — СаО; вода —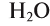
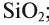
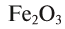
Рис. 39. 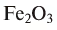
Классификация оксидов
Оксиды по своим химическим свойствам бывают солеобразующими и несолеобразующими.
Оксиды, образующие при химических реакциях соли, делятся на основные

Амфотерность — это проявление двойственных свойств — основности и кислотности. Более подробно амфотерные оксиды будут изучаться в курсе химии 8 класса.
Оксиды, которые не образуют солей при химических реакциях, называются несолеобразующими 
Основные и кислотные оксиды обладают противоположными свойствами, а амфотерные в зависимости от условий могут проявлять как основные, так и кислотные свойства (табл. 9).
Свойства и получение оксидов
Получение оксидов
1. В результате взаимодействия простого вещества с кислородом (горение):
2. В результате взаимодействия сложного вещества с кислородом (горение):
3. В результате разложения сложных веществ (оснований, кислот и солей):
4. В результате некоторых других реакций:
Химические свойства
1. При взаимодействии оксидов щелочных и щелочноземельных металлов с водой образуются гидраты — растворимые в воде основания (щелочи):
2. Оксиды некоторых неметаллов, взаимодействуя с водой, образуют кислоты:
3. Оксиды металлов, взаимодействуя с кислотами, образуют соль и воду:
4. Оксиды неметаллов, взаимодействуя с основаниями, образуют соль и воду:
5. Оксиды металлов, взаимодействуя с оксидами неметаллов, образуют соли:
4. Сколько граммов меди образуется при взаимодействии 16 г оксида меди (И) с водородом, измеренным при нормальных условиях?
Применение важнейших оксидов
Углекислый газ —
Данный оксид является постоянной составной частью воздуха, его массовая доля в нем — 0,03%. Он — основная пища растений. Все зеленые растения, поглощая листьями из воздуха углекислый газ, а корнями — воду, превращают их, под действием солнечного света, в органические питательные вещества — сахара, выделяя при этом в воздух кислород. Этот процесс называется фотосинтезом.
Углекислый газ широко используется при газировании прохладительных напитков. В качестве охлаждающего средства применяется «сухой лед» — углекислый газ в твердом состоянии. Он также является сырьем для производства стирачьной, питьевой соды и многих других веществ (рис. 40).
Рис. 40. «Сухой лсд» и его взаимодействие с раствором щелочи, содержащим фенолфталеин, в результате которого происходят его нейтрализация и исчезновение окраски индикатора
Оксид кремния (IV)-
Оксид кремния (IV) широко распространен в природе и встречается главным образом в виде песка. Песок считается одним из важнейших строительных материалов. Одним из видов этого оксида кремния является кварц, который имеет кристаллическое строение. Из-за того, что он обладает способностью полностью пропускать ультрафиолетовые лучи, он широко используется в медицине в приборах с ультрафиолетовым излучением. Благодаря слишком затрудненной плавкости его используют для изготовления стеклянной химической посуды. Различные природные видоизменения кварца: аметист, сапфир, халцедон, рубин — используются в качестве драгоценных и полудрагоценных ювелирных камней. Помимо этого кремний считается одним из основных материапов при изготовлении полупроводников.
Оксид кальция — СаО
Этот оксид — негашеная известь, жженая известь или просто известь. Его получают термическим разложением широко распространенного в природе известняка. Он считается важным сырьем в производстве строительных материалов. Из него изготавливают различные растворы, цемент. В определенном количестве он также используется для нейтрализации повышенной кислотности почв. Применение его водных растворов дает хорошие результаты при уничтожении вредителей деревьев и других растений. Он также имеет огромное значение в производстве химических веществ.
Оксид серы (VI) —
Этот оксид называют также серным ангидридом. Он не встречается в природе в свободном виде. Его получают окислением сернистого ангидрида (оксид серы (IV) — 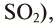
Оксид азота (IV) —
Этот оксид в природе на встречается (рис. 41).
Он получается в основном синтетическим путем и расходуется на получение азотной кислоты. Азотная же кислота является основным сырьем в производстве минеральных азотных удобрений, нитросоохлажденном виде
Рис. 41. 
Основания — состав, строение и номенклатура
Основаниями называются сложные вещества, состоящие из атома металла и одной или нескольких гидроксильных групп (гидроксид аммония 
Количество гидроксильных групп в составе оснований соответствует валентности атомов металлов, потому что гидроксильная группа условно одновалентна.
Основания принадлежат к веществам функциональных групп.
Общая формула оснований выражается в виде
Атом кислорода в основании расположен между атомами водорода и металла, образуя с каждым из них связь.
Эмпирические и структурные формулы оснований можно представить следующим образом
Номенклатура
Название оснований, в состав которых входит металл с постоянной валентностью, образуется следующим образом: «гидроксид + название атома металла в родительном падеже»: гидроксид калия — КОН, гидроксид бария — 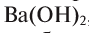
Если металл обладает переменной валентностью и образует соответственно несколько гидроксидов, то название такого основания образуется аналогично приведенному выше с указанием в скобках римскими цифрами валентности металла, например, гидроксид висмута (III) — 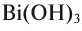
Гидроксиды также можно называть по числу гидроксильных групп, используя греческие названия цифр: 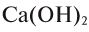
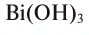
Классификация оснований
В зависимости от физических свойств оснований, т.е. растворимости или нерастворимости в воде, они классифицируются на щелочи и не растворимые в воде основания, а по химическим свойствам — еще и на амфотерные.
Растворимые в воде основания называются щелочами (NaOH, КОН).
К не растворимым в воде основаниям относятся все остальные гидроксиды
Амфотерные основания — это основания, проявляющие свойства как кислот, так и оснований
Растворимые в воде основания способны разъедать кожу и ткани и поэтому называются едкими щелочами, например: КОН — едкий калий, NaOH — едкий натрий. При работе с щелочами необходима осторожность.
Рис.42. Взаимодействие Na c
Получение и свойства оснований
Получение. Основания получают следующими способами.
1. Взаимодействием щелочных и щелочноземельных металлов с водой (рис. 42):
2. Взаимодействием оксидов щелочных и щелочноземельных металлов с водой:
3. Взаимодействием растворов солей с щелочью — нерастворимые основания:
Физические свойства оснований
Основания — твердые вещества различного цвета: КОН, NaOH, 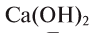
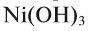
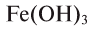
Гидроксиды щелочных и щелочноземельных металлов (кроме бериллия и магния) растворимы в воде. Другие основания малорастворимы или вообще не растворимы в воде. В узлах кристаллических решеток твердых оснований находятся ионы металлов и гидроксид-ионы.
Химические свойства оснований
1. Растворимые в воде основания изменяют окраску многих индикаторов. Например, водно-спиртовый раствор фенолфталеина под влиянием щелочи приобретает малиновую окраску.
2. Основания, взаимодействуя с кислотами, образуют соли и воду (эта реакция носит название реакции нейтрализации):
3. Основания взаимодействуют и с кислотными оксидами, образуя соли и воду (эта реакция также может послужить примером реакции нейтрализации):
4. Щелочи взаимодействуют с солями, образуя новые основания и соли (среднюю или основную — в зависимости от условий):
а) среднюю соль:
б) основную соль:
5. При нагревании основания разлагаются на оксид металла и воду (за исключением КОН и NaOH):
Применение важнейших оснований
Гидроксид натрия (едкий натрий) — NaOH
NaOH — вещество белого цвета, хорошо растворимое в воде, плавится при поглощении водяных паров на воздухе (сильно гигроскопично). Слабый водный раствор гидроксида натрия мыльный на ощупь и разъедает кожу, поэтому он имеет еще техническое название «едкий натр» или «каустическая сода».
Гидроксид натрия производится в промышленных масштабах. В промышленности его получают путем электролиза (разложения под действием электрического тока) раствора поваренной соли (хлорида натрия).
Гидроксид натрия — один из важнейших видов сырья для химической промышленности. Он используется при очистке продуктов нефтепереработки, в производстве мыла, бумаги, искусственных волокон и в других отраслях и ро м ы ш л е н н ости.
Гидроксид калия (едкий калий) — КОН
КОН — твердое вещество белого цвета, хорошо растворимое в воде. По свойствам очень похож на едкий натр. В промышленности, как и едкий натр, получается электролизом раствора хлорида калия. Но из-за того, что его себестоимость дороже, он применяется в меньшей степени, чем NaOH.
Гидроксид кальция (гашеная известь) —
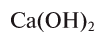
Гашеная известь используется в основном в строительстве при изготовлении цементных, песочных и других растворов (в частности, его раствор с водой и песком называется «известковым раствором», который применяется при укладке кирпичей), для нейтрализации почв с повышенной кислотностью, как средство борьбы с сельскохозяйственными вредителями.
Кислоты — состав, строение и номенклатура
Кислотами называются сложные вещества, состоящие из атомов водорода, способных замещаться на атомы металла, и кислотного остатка.
Число атомов водорода в составе кислот соответствует валентности кислотного остатка, так как водород одновалентен.
Кислоты принадлежат к веществам функциональных групп.
Общая формула кислот выражается в виде 
Водород в кислотах соединяется с кислотным остатком, образуя прямую связь. Эмпирические и структурные формулы кислот можно представить следующим образом:
Номенклатура
Названия кислот образуются от латинского названия центрального элемента с изменением суффикса или префикса по мере изменения валентности этого элемента.
Эти названия необходимо запомнить (черточками указана валентность кислотного остатка) (табл. 10).
Классификация кислот
Кислоты в зависимости от присутствия или отсутствия в их составе кислородных атомов делятся на бескислородные и кислородсодержащие.
Основность кислот
Кислоты в зависимости от числа атомов водорода в их составе, способных замещаться атомами металлов, подразделяются на одно-, двух-, трех- и многоосновные (табл. 11).
Получение кислот
Кислоты получают следующими способами:
1. Кислородсодержащие кислоты можно получить взаимодействием кислотных оксидов с водой:
2. Бескислородные кислоты можно получить растворением в воде продуктов взаимодействия неметаллов с водородом:
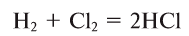
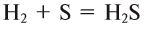
3. Кислоты можно получить взаимодействием их солей с другими кислотами:
Физические свойства кислот
Кислоты могут быть твердыми (борная, ортофос-форная) и жидкими (серная, азотная). Большинство из них хорошо растворимы в воде. Водные растворы некоторых газов (хлористый водород — НС1, бромистый водород — НВг, сероводород — H2S) также являются кислотами. В молекулах кислот водород образует прямую связь с кислотным остатком.
Химические свойства кислот
Химические свойства кислот доказывают их довольно высокую активность:
1. Кислоты изменяют окраску многих индикаторов. В приведенной ниже таблице указано изменение окраски индикаторов под воздействием кислот.
2. Кислоты, взаимодействуя с основаниями, образуют соль и воду (эта реакция называется реакцией нейтрализации) (рис. 43):
Рис. 43. Исчезновение окраски индикатора при нейтрализации щелочного раствора, содержащего фенолфталеин, раствором кислоты
3. Кислоты, взаимодействуя с основными оксидами, образуют также соль и воду (эта реакция также может послужить примером реакции нейтрализации):
4. Кислоты взаимодействуют с металлами, образуя соль и выделяя водород или другие продукты в зависимости от условий (рис. 44):
Металлы, стоящие в ряду активности слева от водорода, вытесняют его из кислот, стоящие же справа — не вытесняют или дают другие продукты (рис. 45):
Рис. 44. Растворение цинка в серной кислоте и выделение водорода
5. Кислоты, взаимодействуя с солями, образуют новые соль и кислоту’ (среднюю или кислую соль в зависимости от условий):
а) средняя соль и новая кислота:
б) кислая соль и новая кислота:
в) только кислая соль:
6. При нагревании кислоты разлагаются на кислотный оксид и воду:
Применение важнейших кислот
Серная кислота —
Маслянистая жидкость без цвета и запаха, почти в два раза тяжелее воды. Очень хорошо растворима в воде.
Серная кислота используется для осушки воздуха и других газов, а также других веществ (рис. 46).
Концентрированная серная кислота, попадая на кожу, вызывает сильные ожоги. Поэтому в работе с ней необходима осторожность. Нужно оберегать кожу и одежду от соприкосновения с этой кислотой.
При смешивании серной кислоты с водой выделяется большое количество тепла, поэтому для приготовления ее раствора необходимо приливать кислоту к воде постепенно по стенкам сосуда или по стеклянной палочке (рис. 47). Если же приливать воду к кислоте, раствор плохо смешивается и сильно нагревается. Это может привести к растрескиванию стеклянного сосуда и разбрызгиванию кислоты, которая может попасть на одежду, кожу, в глаза.
Рис. 46. Влияние серной кислоты на древесину .
Для приготовления раствора кислоты необходимо приливать кислоту к воде.
Серная кислота применяется во многих областях народного хозяйства, в частности в:
- производстве минеральных удобрений,
- очистке нефтепродуктов,
Рис. 47. Приготовление раствора серной кислоты
Рис. 48. Сернокислотные аккумуляторные батареи
- производстве хлора, производстве различных солей, кислот и лекарственных препаратов, приготовлении взрывчатых веществ, производстве красителей,
- производстве целлюлозы,
- травлении черных металлов,
- приготовлении кислотных аккумуляторов (рис. 48).
Соляная кислота — НС1
Получаемая растворением хлористого водорода в воде, эта бесцветная жидкость немного тяжелее ее, обладает резким запахом (рис. 49), потому что молекулы хлористого водорода постоянно выделяются из раствора. Концентрированную соляную кислоту называют также «дымящей» кислотой. Причиной тому являются выделяющиеся молекулы хлористого водорода, которые образуют с водяными парами воздуха туман.
Соляная кислота является составной частью желудочного сока и имеет важное значение в процессе пищеварения.
Рис. 49. Растворение газообразного НС1 в воде и образование раствора соляной
Соляная кислота применяется во многих областях народного хозяйства, в частности в:
- травлении металлов,
- производстве хлоридов,
- производстве медицинских препаратов,
- производстве красителей,
- производстве пластмасс.
Азотная кислота —
Азотная кислота — бесцветная жидкость, в 1,5 раза тяжелее воды, подобно соляной кислоте, «дымит» на воздухе. При высоких концентрациях кислоты раствор приобретает желтовату ю окраску, так как находясь на свету, азотная кислота разлагается, образуя бурый газ N02, что приводит к ошибочному выводу о цветности кислоты. Это неверно. Чистая кислота бесцветна. Поскольку холодная концентрированная азотная кислота пассивирует железо, хром и алюминий, ее можно хранить в сосудах, изготовленных из этих металлов. Эта кислота взаимодействует со всеми металлами, кроме золота, платины, тантала, родия и иридия.
Азотная кислота используется во многих областях народного хозяйства, в частности в производстве:
- азотных удобрений,
- азотсодержащих органических соединений,
- лекарственных препаратов,
- красителей,
- взрывчатых веществ,
- серной кислоты нитрозным способом.
Соли — состав, строение и номенклатура
Солями называются сложные вещества, состоящие из атомов металла (или ионов аммония 
Соли образуются при замещении водорода кислоты на атом металла или гидроксида основания на кислотный остаток.
Соли принадлежат к веществам функциональных групп.
Общая формула солей выражается в виде 

В случае, когда валентность атома металла в составе солей равна валентности кислотного остатка (п = m), индексы не ставятся.
Атомы металлов в солях соединяются с кислотными остатками, образуя прямую связь.
Эмпирические и структурные формулы солей можно представить следующим образом:
Номенклатура
Названия солей образуются от названий атомов металла и кислотного остатка (табл. 12).
Соли подразделяются на средние, основные и кислые и называются соответствующим образом.
1. Рассмотрим способы наименования средних солей.
Название солей, содержащих металл с постоянной валентностью, образуется по схеме: «название кислотного остатка + название атома металла в родительном падеже».
Если мы имеем дело с металлом, обладающим переменной валентностью и образующим несколько типов солей, то название такой соли образуется аналогично с той лишь разницей, что в конце названия римскими цифрами в скобках указывается валентность металла.
2. Рассмотрим способы наименования кислых солей.
Название таких солей, содержащих металл с постоянной валентностью, образуется так: «гидро + название кислотного остатка + название атома металла в родительном падеже».
В случае с металлами с переменной валентностью ее указывают римскими цифрами в скобках в конце названия.
3. Рассмотрим способы наименования основных солей.
Название таких солей, содержащих металл с постоянной валентностью, образуется так: «гидроксо + название кислотного остатка + название атома металла в родительном падеже».
Аналогично образуются названия солей, содержащих металл с переменной валентностью, которая указывается римскими цифрами в скобках в конце названия.
Составление формул солей
Можно считать, что соли состоят из остатков кислот и оснований (атомов металлов или 
Произведение индекса кислотного остатка на его валентность равно произведению индекса остатка основания (атома металла или NH+4 и др.) на его валентность.
Если А — остаток основания, К — кислотный остаток; m — валентность остатка основания, n— валентность кислотного остатка; х — индекс остатка основания, а у — индекс кислотного остатка, то формула соли будет иметь следующий вид:
В качестве примера составим формулу сульфата алюминия
Алюминий — остаток основания, и его валентность равна 3. Сульфат — остаток серной кислоты, и его валентность — 2. Найдем наименьшее общее кратное чисел 3 и 2, выражающих соответственно валентность алюминия и кислотного остатка. Это значение равно 6. Число атомов алюминия в молекуле соли равно: х = 6 : 3 = 2; а кислотного остатка: у = 6:2 = 3. Следовательно, формула соли
Таким способом можно составить формулу любой соли.
Классификация солей
Соли в зависимости от способа образования и строения делятся на средние, кислые и основные.
Средние соли — сложные вещества, состоящие из кислотного остатка и атомов металла, которые заместили все атомы водорода в составе исходной кислоты (фосфат алюминия — 



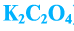
Кислые соли — сложные вещества, состоящие из кислотного остатка и атомов металла, которые частично заместили атомы водорода в составе исходной кислоты (гидрокарбонат натрия — 

Основные соли — сложные вещества, в состав которых наряду с атомами металла и кислотным остатком входит и гидроксогруппа. Такие соли образуются при неполной нейтрализации оснований кислотой (гидроксо-бромид магния — Mg(OH)Br, гидроксосульфат алюминия —
Известны также соли, в которых содержатся атомы двух разных металлов, соединенные друг с другом и встречающиеся вместе, которые называются двойными (смешанными) солями. Они могут записываться как в виде одной формулы, так и соединенных двух: например, сульфат калия-алюминия (квасцы) 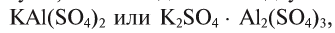
Представителями комплексных солей являются красная — 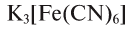
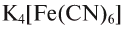
Получение солей
Существует множество способов получения солей, которые приведены в табл. 13 (цифрами обозначен порядковый номер способа):
1. Взаимодействием металла и неметалла:
2. Взаимодействием металла с кислотой:
3. Взаимодействием металла с солью:
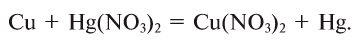
4. Взаимодействием металлов, образующих амфотерные оксиды, с щелочами:
5. Взаимодействием основных оксидов с кислотами:
6. Взаимодействием основных оксидов с кислотными:
7. Взаимодействием оснований с кислотами:
8. Взаимодействием оснований с кислотными оксидами:
9. Взаимодействием щелочей с солями:
10. Взаимодействием щелочей с неметаллами:
11. Взаимодействием солей с кислотами:
12. Взаимодействием солей с кислотными оксидами:
13. Взаимодействием солей с солями:
14. Взаимодействием солей с неметаллами:
Физические свойства солей
Соли — твердые различного цвета вещества кристаллическою строения с различной растворимостью в воде. В составе солей может содержаться кристаллизационная вода (рис. 50).
Рис. 50. Образцы солей: сульфат меди 
Химические свойства. Соли, являясь химически активными веществами, подвергаются различным превращениям.
1. Соли взаимодействуют со щелочами — при этом образуются новая соль и новое основание или основная соль:
2. Соли взаимодействуют с кислотами, образуя новую кислоту и соль — среднюю или кислую:
3.Образуется только кислая соль:
3. Соли взаимодействуют между собой, образуя новые соли. Если один из продуктов плохо растворим, то обменная реакция идет до конца (рис. 51)
Рис.51. Образование осадка AgI при взаимодействии
4. Соли взаимодействуют с металлами, образуя новую соль и металл. Металлы, стоящие в ряду активности левее, вытесняют из солей те, которые находятся правее от них. Металлы, стоящие слева от магния (Li, К, Ва, Са, Na и др.), не используются для вытеснения правостоящих металлов из водных растворов или солей, так как вступают в реакцию с водой:
5. Некоторые соли при нагревании разлагаются:
Применение важнейших солей
Самыми распространенными неорганическими веществами, широко используемыми в народном хозяйстве, являются соли. Их значение для нормального протекания жизненных процессов на Земле очень велико.
Человеческий организм нуждается в постоянном сохранении солевого баланса, и эту функцию выполняют различные соли, составляющие 5,5% общей массы организма.
Например, при уменьшении содержания солей кальция в организме появляется желание употреблять в пищу продукты, содержащие кальций, чтобы восстановить его баланс. При быстрой потере жидкости, с которой выходят и соли, организм должен пополняться ими за счет физиологических растворов различных солей.
Соли, содержащие кальций, железо, калий, натрий и другие металлы, используются в медицине в качестве лекарственных средств от различных заболеваний.
Соли, содержащие азот, фосфор, калий, серу, кальций, натрий и так называемые микроэлементы, широко используются в сельском хозяйстве в качестве удобрений, как средства борьбы против некоторых вредителей, как регуляторы роста, повышающие всхожесть и урожайность.
Карбонаты и силикаты используются в строительных целях.
Хлорид натрия — NaCI
Мы все хорошо знаем, для каких целей используется в повседневной жизни поваренная соль.
В промышленности поваренная соль используется для получения хлора, щелочи, металлического натрия, в медицине — для приготовления физиологического раствора.
Карбонат кальция — СаСО
Эта соль применяется в строительстве в виде мрамора и известняка. Мрамор широко используется для украшения зданий. Им украшены станции Ташкентского метрополитена.
Нитрат аммония —
Широко используется в сельском хозяйстве под названием аммонийная селитра. Производится на Ферганском заводе азотных удобрений.
Соли широко применяют в промышленности для получения металлов и других солей. Например, сульфидные соли железа используют в производстве чугуна и стали.
На территории нашей республики обнаружены природные запасы различных солей, применяемых в народном хозяйстве:
Мрамор 
Поваренную соль (NaCI) и сильвинит (NaCI-KCI) добывают в Ходжаиканском, Тубокатском, Барсакельмесском, Байбичаканском и Аккалин-ском месторождениях.
Фосфориты 
Сульфиды ряда цветных металлов добывают в Алмалыкском месторождении. Их используют для производства металлов, серы и различных химических соединений.
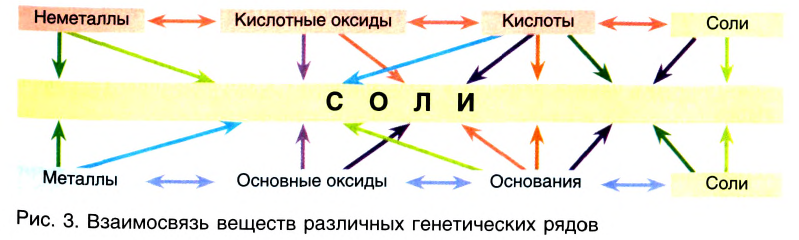
Генетическая связь оксидов, оснований, кислот и солей
Между химическими соединениями существует генетическая связь.
Из простых веществ можно получать сложные
Из сложных веществ можно получать простые:
Из веществ, относящихся к одному классу, можно получать вещества, относящиеся к другому классу. Например, фосфор при горении образует оксид фосфора (V), который, взаимодействуя с водой, дает кислоту, а из нее можно получить соль. Из этой соли можно получить другую соль:
Магний, сгорая, образует оксид, который вода помогает перевести в гидроксид, а из него можно получить соль:
При взаимодействии кальция с водой можно получить его гидроксид, который, вступая в реакцию с 
Как видно, между простыми веществами и классами неорганических соединений существует генетическая связь. С ее помощью из одних веществ можно получить другие и снова возвращаться к исходным.
Генетическую связь между основными классами неорганических веществ можно выразить в виде схемы:
1. Из оксидов можно получить основания, кислоты и соли. И наоборот, из оснований, кислот и солей можно получить оксиды:
2. Из оснований можно получить оксиды и соли, и наоборот, из оксидов и солей можно получить основания:
3. Из кислот можно получить оксиды и соли, и наоборот:
Связь между соединениями и их превращениями доказывает единство элементного состава вещества.
Основные классы неорганических соединении
Сложные вещества обычно делят на классы: оксиды, кислоты, основания, амфотерные гидроксиды и соли.
Оксиды
— Сложные вещества, состоящие из двух элементов, одним из которых является кислород, называются оксидами, то есть 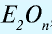
— В зависимости от того, с какими веществами вступают в реакцию оксиды (вода, основания, кислоты), их выделяют в несколько групп:
- Основные оксиды:
и др.
- Кислотные оксиды:
и др.
- Амфотерные оксиды:
и др.
- Индифферентные оксиды (или не образующие соли): СО, N0,
и др.
- Пероксиды у которых степень окисления кислорода равна — 1, а валентность — 2):
Пример №1
Какой объем кислорода (л,н.у) образуется при разложении 2,17 г оксида ртути (II)?
Решение:
1) запишем уравнение реакции разложения HgO:
2) вычислим объем кислорода, образующегося из 2,17 г HgO, с помощью пропорции:
Ответ: образуется 0,112 л 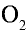
Пример №2
В составе руды, перерабатываемой на Алмалыкском горно металлургическом комбинате, содержится оксид с 49,6% марганца и 50,4% кислорода. Выведите формулу этого оксида.
Решение:
1) качественный состав оксида: Мп и О;
2) количественный состав оксида: 49,6 : 50,4;
3) используя приведенные данные, найдем формулу оксида:
Следовательно, формула оксида:
Результаты вычислений показывают, что атомные соотношения марганца и кислорода составляют 0,9:3,1. Однако в химических соединениях атомные соотношения выражаются целыми числами. Поэтому выразим соотношение 0,9:3,1 целыми числами:
Ответ: 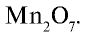
Основания
— Сложные вещества, содержащие атом металла и один или несколько гидроксильных групп (ОН), называются основаниями,
— Основания подразделяются на две группы: растворимые и нерастворимые в воде:
- Водорастворимые основания:
- Нерастворимые в воде основания:
— Основания, вступающие в реакции и с кислотами, и с щелочами и образующие соль, называются амфотерными основаниями:
Пример №3
Рассчитайте состав (%) гидроксидов металлов, имеющих формулы 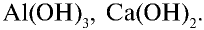
Решение:
1) состав 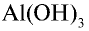
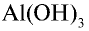
2) состав 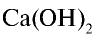
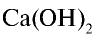
Пример №4
Запишите формулу гидроксида, имеющего следующий состав: 75,3% Рb , 23,2% О, 1,5% Н.
Решение.
Поскольку качественный (Рb, О, Н) и количественный состав вещества известны, для нахождения его формулы выполним следующие действия:
Ответ:
Kислоты
Сложные вещества, в молекуле которых содержатся атомы водорода, способные замещаться атомами металлов, и кислотный остаток, называются кислотами.
В зависимости от того, имеются или не имеются в их молекуле атомы кислорода, кислоты делятся на две группы:
а) кислородные кислоты:
б) бескислородные кислоты:
По числу атомов водорода в молекуле, способных замещаться атомами металлов, кислоты подразделяются на следующие группы:
- Одноосновные кислоты:
- Двуосновные кислоты:
- Трехосновные кислоты:
Пример №5
Какую массу (г) и какой объем (л,ну) водорода можно получить путем воздействия избыточным количеством соляной кислоты на 26 г цинка?
Решение:
1) при растворении цинка в соляной кислоте образуются хлорид цинка и водород:
2) сколько граммов водорода образуется? Составим пропорцию:
65 г цинка вытесняют 2 г водорода,
26 г цинка вытесняют х г водорода,
3) масса водорода, образовавшегося в результате реакции, уже известна (0,8 г). Объем водорода можно определить с помощью уравнения реакции или массы образовавшегося водорода. Составим пропорцию:
2 г (1 моль) водорода занимают объем 22,4 л, 0,8 г водорода — л: л объема,
Ответ: 0,8 г — 8,96 л.
Соли
— Сложные вещества, молекула которых состоит из атомов металла и кислотного остатка, называются солями (вместо атомов металла может быть и ион 
— Соли делятся на следующие группы:
- Средние, или нормальные соли:
- Кислые соли — соли, образованные двух- или трехосновными (многоосновными) кислотами:
- Основные, или гидроксисоли:
- Двойные соли — соли, состоящие из двух металлов и одного кислотного остатка. Среди них практическое значение имеют квасцы:
- Смешанные соли — соли, образованные из двух металлов и двух кислотных остатков:
Пример №6
Запишите формулы солей, образованных из металла натрия и следующих кислот: азотная, сероводородная, сернистая, серная, фосфорная. Назовите эти соли.
Решение.
Пример №7
На раствор, содержащий 49 г серной кислоты, воздействовали 20 г гидроксида натрия. Определите образовавшуюся соль и ее массу.
Решение:
1) сколько молей в 49 г 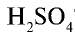
2) сколько молей в 20 г NaOH?
3) в реакцию взято 0,5 моля серной кислоты и 0,5 моля гидроксида натрия:
Из уравнения реакции видно, что при равных молярных соотношениях NaOH и 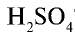
4) найдем массу (г) 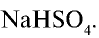
При взаимодействии 1 моля NaOH и 1 моля 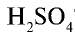
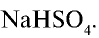
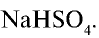
Ответ: 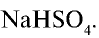
Генетическая связь между основными классами неорганических соединений
В настоящее время известно более 200 тысяч неорганических веществ, образованных из 118 химических элементов периодической таблицы. Эти вещества подразделяются в основном на четыре класса.
Обобщение знаний о важнейших классах неорганических соединений
В этом параграфе подведены итоги всего того, о чем вы узнали, изучая оксиды, основания, кислоты, амфотерные соединения, соли, их химические свойства и взаимопревращения. Прочитав его, найдете и новые сведения о названных классах соединений, лучше поймете связи, существующие между ними.
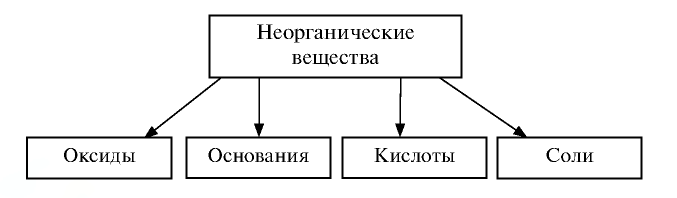
Классификация неорганических веществ
Вам известно, что к неорганическим веществам относят многие сложные вещества (кроме соединений Карбона), а также простые — металлы и неметаллы (схема 10).
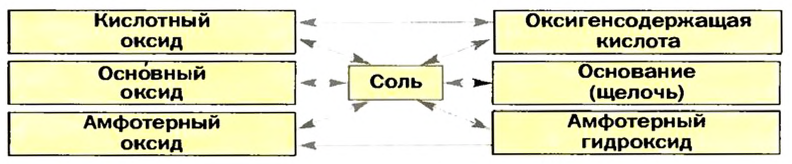
Оксиды — соединения элементов с Оксигеном. Будучи сходными по составу, они отличаются по химическим свойствам. Существуют основные, кислотные и амфотерные оксиды (схема 11). Их называют солеобразующими оксидами, так как эти соединения образуют соли в реакциях с кислотами или основаниями (амфотерные оксиды реагируют и с кислотами, и с основаниями). Известны и несколько несолеобразующих оксидов. Они не вступают в упомянутые реакции.
Существует соответствие между типом и валентностью элемента и типом его оксида.
Металлические элементы могут образовывать не только основные и амфотерные оксиды, но и кислотные. Среди соединений с общей формулой 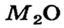
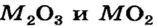
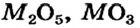
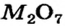
Некоторые металлические элементы образуют оксиды всех трех типов. Так, для Хрома известны основный оксид 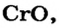
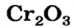
Неметаллические элементы образуют кислотные и несолеобразующие оксиды.
Основные и амфотерные оксиды состоят из ионов, а кислотные — из молекул.
Основания являются соединениями, каждое из которых образовано тремя элементами — металлическим элементом, Оксигеном и Гидрогеном. В их состав входят ионы 
Кислоты — соединения, в состав молекул которых входят один или несколько атомов Гидрогена, способных замещаться в химических реакциях на атомы металлических элементов. Часть молекулы кислоты — атом или группу атомов, которые соединены с атомом (атомами) Гидрогена, — называют кислотным остатком. Кислоты имеют различный состав, неодинаковую химическую активность. Каждый из этих признаков используют для классификации кислот.
Это интересно. Для Мангана и Ванадия известно по 4 оксида:
Различать щелочи и кислоты в растворах помогают вещества-индикаторы (рис. 44).
Амфотерные гидроксиды — соединения с двойственным химическим характером (как и амфотерные оксиды). Они взаимодействуют с кислотами как основания, а со щелочами — как кислоты.
Соли — соединения, состоящие из катионов металлических элементов и анионов кислотных остатков. Соль является продуктом реакции между веществом с основными свойствами и веществом с кислотными свойствами. Запомните такие важные закономерности:
- • если два соединения имеют аналогичные свойства (например, два основных оксида, основный оксид и основание), то они не взаимодействуют друг с другом*;
- • реакции между соединениями с противоположными свойствами происходят почти всегда;
- • амфотерные соединения реагируют с соединениями как основного, так и кислотного характера.
Взаимосвязи между неорганическими веществами
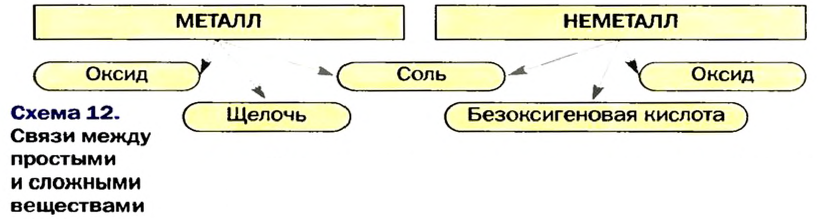
Многие простые вещества — металлы и неметаллы — вступают в реакции с образованием оксидов, щелочей, безоксигеновых кислот, солей (схема 12).
* — Исключение — соли.
Почти все кислотные и некоторые основные оксиды взаимодействуют с водой. Продуктом реакции в первом случае является оксигенсодержащая кислота, а во втором — щелочь. Реакции между амфотерными оксидами и водой не происходят.
Каждое соединение — оксид, основание, амфотерный гидроксид, кислота — в результате определенных реакций превращается в соответствующую соль. А нагреванием оксигенсодержащей кислоты, нерастворимого основания, амфотерного гидроксида, некоторых оксигенсодержащих солей можно получить соответствующий оксид.
Взаимосвязи между веществами, которые основываются на происхождении веществ и их химических свойствах, называют генетическими* связями.
Изложенное обобщает схема 13.
Схема 13. Генетические связи между важнейшими классами неорганических соединений
Стрелки в схеме указывают на соответствие соединений друг другу и на возможности их взаимопревращений.
Схема 13 является упрощенной. В ней, например, отсутствуют безоксигеновые кислоты, а также несолеобразующие оксиды.
* — Термин происходит от греческого слова genos — род, рождение.
Пример генетических связей между соединениями двух элементов приведен на схеме 14.
На основании схемы 13 можно составлять различные генетические «цепочки». Приводим запись, которая иллюстрирует взаимосвязи между основанием, солью, кислотой и кислотным оксидом:
(Первая стрелка направлена только вправо, поскольку из нерастворимой соли не удается непосредственно получить основание.)
Знание и понимание генетических связей между классами неорганических соединений помогают выбирать способы получения оксидов, оснований, кислот, амфотерных гидроксидов и солей.
ВЫВОДЫ
К неорганическим веществам относят простые вещества (металлы, неметаллы), а также много сложных веществ, которые делят на классы. Важнейшими классами неорганических соединений являются оксиды, основания, кислоты, амфотерные гидроксиды, соли.
По химическим свойствам оксиды делят на солеобразующие и несолеобразующие, а солеобразующие оксиды — на основные, кислотные и амфотерные.
Взаимосвязи между веществами, которые основываются на происхождении веществ и их химических свойствах, называют генетическими связями.
Генетическая связь между классами неорганических соединений
Генетические ряды. Отныне вам известны разные классы неорганических соединений, которые можно представить такой схемой:
При изучении свойств веществ вы выяснили, что с помощью соответствующих химических реакций из веществ одного класса можно получать вещества других классов. Такие взаимопревращения получили название генетических рядов. В переводе с греческого генетический означает — такой, который касается происхождения, изучает развитие чего-либо.
Рассматривая химические свойства неорганических соединений разных классов, можно проследить родственную связь между ними, то есть составить генетические ряды.
Генетическая связь — это связь между веществами разных классов, которая основывается на взаимопревращении веществ и показывает происхождение одних веществ от других.
Знание генетических связей объясняет разнообразие классов неорганических соединений и веществ в природе, открывает перед учеными перспективы создания новых веществ.
Было давно замечено, что вещества, которые берут свое начало от металлов, существенно отличаются по свойствам от веществ, которые берут начало от неметаллов. Поэтому различают два генетических ряда: генетический ряд металлов и генетический ряд неметаллов.
Генетический ряд металлов:
Генетический ряд металлов имеет такой вид:
металл 
Металл, который начинает генетический ряд, присутствует во всех его сложных веществах, например:
Однако, как вам известно, нерастворимое основание нельзя получить из оксида, подвергнув его взаимодействию с водой. Поэтому генетическая связь усложняется на одно звено:
металл 
Для меди и соединений меди он имеет вид:
Однако необязательно, чтобы генетический ряд завершался образованием соли. Его можно продолжить и, в частности, в обратном направлении:
В этом генетическом ряду первые пять действий аналогичны рассмотренным выше, а остальные являются новыми:
Действие 7 указывает на то, что существуют реакции, с помощью которых можно вывести кислород из оксида металла и таким способом получить простое вещество.
Генетический ряд неметаллов:
Генетический ряд неметаллов выстраивается по тому же принципу, что и металлов, лишь гидроксид в нем не основание, а кислота:
неметалл 
Рассмотрим генетический ряд неметаллов на примере серы:
Итак, вы ознакомились с генетическими рядами металлов и неметаллов.
Взаимосвязи между генетическими рядами неорганических соединений:
Взаимосвязи прослеживаются не только в пределах генетического ряда, но и между генетическими рядами металлов и неметаллов, о чем свидетельствует такая обобщающая схема:
Итоги:
Разнообразие веществ и их свойств дает возможность строить разветвленные генетические ряды. Рассмотрим это на конкретных примерах.
Пример №8
Генетический ряд металла разветвленного строения:
Пример №9
Генетический ряд неметалла разветвленного строения:
Расчеты по химическим уравнениям массы, объема, количества вещества реагентов и продуктов реакций
Каждый раз, записывая химическое уравнение той или другой реакции, вы принимали во внимание состав веществ — и тех, которые реагируют, и тех, которые образуются. То есть, считались с качественной характеристикой химического явления. Коэффициенты перед формулами обеспечивали соответствие ваших записей закону сохранения массы веществ. Однако роль коэффициентов этим не исчерпывается — в уравнениях реакций они показывают соотношение количества вещества реагентов и продуктов реакции. Рассмотрим это на примере реакции нейтрализации гидроксида калия серной кислотой:
Согласно уравнению этой реакции 2 моль гидроксида калия взаимодействуют с 1 моль серной кислоты, в результате чего образуются 1 моль сульфата калия и 2 моль воды. Если же для реакции будет взято больше, чем 2 моль гидроксида калия, то и кислоты понадобится больше, и количество вещества соли будет больше, чем 1 моль. Но сколько бы молей обоих реагентов мы не взяли для проведения этой реакции, они будут взаимодействовать в соотношении 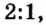
Соотношением количества вещества реагентов и количества вещества продуктов реакции пользуются для расчетов по химическим уравнениям количества вещества, массы и объема веществ, которые вступают в химическую реакцию, и веществ, которые образуются.
Расчеты по химическим уравнениям количества вещества, если известно количество другого вещества
Для того чтобы вычислить по уравнению реакции количество вещества любого реагента или любого продукта реакции, достаточно иметь сведения об одном из веществ.
Пример №10
Какое количество вещества кислорода нужно для окисления цинка количеством вещества 4 моль?
Дано:
Решение
1. Запишем уравнение химической реакции:
2. Рассмотрим в уравнении реакции количественные отношения веществ, указанных в условии задачи:
3. Над формулами указанных в условии задачи веществ обозначим данные условия задачи. То есть, над цинком — 4 моль, а над кислородом — 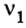
4. Составим пропорцию
Отсюда,
Ответ: для окисления 4 моль цинка необходимо 2 моль кислорода.
Можно было бы обойтись и без пропорции, воспользовавшись таким логическим рассуждением. Поскольку соотношение количества вещества цинка и кислорода составляет 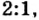
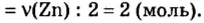
Рассуждая логически, вычислите устно, какое количество вещества цинка прореагировало, если на его окисление пошло 3 моль кислорода.
Расчеты по химическим уравнениям массы вещества
Пример №11
Вычислить массу соли, которая образуется в результате полной нейтрализации 2,5 моль гидроксида калия серной кислотой.
Дано:
Решение
1. Запишем химическое уравнение и вычислим количество вещества соли, которая образовалась в результате реакции:
Согласно уравнению реакции соотношение количества вещества реагента гидроксида калия 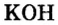
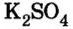
2. Вычислим массу образовавшейся соли по формуле
Ответ: образуется 217,5 г соли
Задачу можно решить, составив пропорцию. Однако, поскольку количество вещества 
При расчетах по уравнениям реакций важно не допускать ошибок в применении физических величин. Следует помнить, что с количеством вещества 1 моль соразмерны: масса — в граммах; молярная масса — в г/моль; объем в л, и, соответственно, единицей молярного объема является л/моль.
Этими единицами измерения мы будем пользоваться чаще всего. Количество вещества можно измерять и в кмоль (кило-молях). Тогда масса будет измеряться в кг, молярная масса — в кг/кмоль (килограмм на киломоль), объем — в 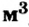
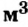
(Подумайте, какие единицы массы, молярной массы, молярного объема и объема соразмерны с количеством вещества 1 ммоль (миллимоль).
Расчеты по химическим уравнениям объема вещества
Пример №12
Какой объем кислорода (н.у.) необходим для сжигания метана массой 48 кг и какой объем углекислого газа выделится в результате этой реакции?
Дано:
Решение
1. Запишем уравнение реакции:
2. Вычислим количество вещества метана массой 48 кг:
3. Рассмотрим количественные отношения данных в условии задачи веществ по уравнению реакции. Поскольку масса вещества выражена в килограммах, изберем размерную единицу количества вещества — кмоль:
4. Над формулами веществ укажем данные по условию задачи:
5. Вычислим количество вещества и объем кислорода.
Из уравнения реакции видно, что количество вещества кислорода в 2 раза больше количества вещества метана. Следовательно:
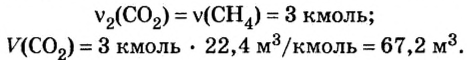
6. Вычислим количество вещества и объем углекислого газа.
Из уравнения реакции видно, что количество вещества углекислого газа равно количеству вещества метана. Поэтому:
Ответ: необходимо 134,4 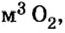
Рассмотренные примеры подтверждают, что, зная количественные соотношения веществ в реакции, можно вычислять количество вещества, массу и объем любого реагента или продукта реакции, используя известное количество вещества, массу и объем одного из веществ. Такие расчеты имеют большое практическое значение. На химических заводах, прежде чем приступать к изготовлению продукции, проводят аналогичные вычисления, чтобы определить, какого сырья и сколько необходимо взять и каким будет выход продукции.
Итоги:
- По уравнениям химических реакций можно вычислять количество вещества, массу или объем любого реагента или продукта реакции, если в условии задачи одна величина известна.
- Расчеты по химическим уравнениям количества вещества, массы и объема реагентов и продуктов реакций проводят на основе закона сохранения массы веществ.
- Для расчетов по химическим уравнениям важно, чтобы коэффициенты были расставлены правильно.
- Наиболее используемой единицей количества вещества является моль, а соразмерными с ней единицами измерения физических величин являются грамм (г), литр (л), литр на моль (л/моль).
- Алгоритм расчетов по химическим уравнениям такой:
1) записать уравнение реакции;
2) уравнять левую и правую части уравнения (расставить коэффициенты);
3) рассмотреть количественные отношения данных в условии задачи веществ по уравнению реакции и под их формулами записать количество вещества, равное коэффициентам;
4) рассмотреть количественные отношения данных в условии задачи веществ и над их формулами записать количество вещества, исходя из условия задачи;
5) вычислить количество вещества, объем или его массу;
6) записать ответ.
Вам известно, что в составе смеси вещества сохраняют свои свойства. Зная это, можно проводить расчеты количества вещества, массы или объема компонентов смеси.
Пример №13
Смесь цинка и оксида цинка массой 20 г обработали избытком соляной кислоты. Объем газа, который выделился при этом, равен 4,48 л (н.у.). Определите массу каждого компонента смеси.
Дано:
Решение
1. Рассмотрим химические явления, которые происходят между соляной кислотой и смесью цинка с оксидом цинка, запишем уравнения реакций:
Как видим, оба компонента смеси взаимодействуют с соляной кислотой, однако газ выделяется лишь при взаимодействии цинка и кислоты. Поэтому для выполнения последующих расчетов выбираем уравнение б).
2. Вычислим количество вещества водорода:
3. По известному количеству вещества водорода найдем количество вещества цинка:
Из уравнения реакции видно, что количество вещества цинка равно количеству вещества водорода. Поэтому:
4. По формуле 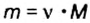
5. Вычислим массу оксида цинка в составе смеси. Если мы знаем массу цинка, а масса смеси известна из условия задачи, это сделать легко:
Ответ: смесь состояла из 13 г цинка и 7 г оксида цинка.
Пример №14
смесь сульфата калия и хлорида натрия массой 46,5 г растворили в воде, а к образовавшемуся раствору добавили избыток раствора нитрата бария. Образовался осадок массой 46,6 г. Определите массу каждой соли в исходной смеси.
Дано:
Решение
Оба компонента смеси и добавленный к ним реагент относятся к классу солей. Как известно, соли взаимодействуют в растворе между собой, если один из продуктов реакции — осадок или газообразное вещество.
1. Запишем схемы возможных вариантов взаимодействия веществ и, если реакция происходит, запишем химические уравнения:
Из рассмотренных схем реакций взаимодействие происходит лишь по схеме в), поскольку один из продуктов — сульфат бария — выпадает в осадок. Следовательно, осадок, о котором идет речь в условии задачи,— сульфат бария.
Для последующих расчетов необходимо знать количество вещества этого соединения.
2. Вычислим количество вещества сульфата бария, который выпал в осадок:
По схеме в) запишем уравнение реакции и рассмотрим количественные отношения сульфата калия и сульфата бария :
Как видно из уравнения реакции, 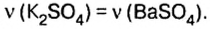
3. Вычислим массу сульфата калия :
4. Для определения массы хлорида натрия из общей массы смеси сульфата калия и хлорида натрия вычтем массу сульфата калия :
Ответ: исходная смесь солей содержала 34,8 г 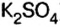
Значение экспериментального метода исследования в химии
Вам известны различные методы исследования веществ и явлений, в том числе и эксперимент.
Экспериментом называют научный опыт изучения явлений и свойств веществ.
Этот метод исследования применим для многих наук и наиболее распространен в области естественных наук — биологии, физики, химии. Используя эксперимент как метод исследований, ученые-химики всесторонне изучают химические свойства веществ, создают новые вещества с заранее заданными свойствами, в том числе и жизненно необходимые организму человека, например витамины. Благодаря экспериментальному методу стремительно развиваются фармацевтическая промышленность (синтез лекарственных препаратов), производство синтетических моющих средств (стиральные порошки, шампуни, средства ухода за вещами, бытовыми приборами и др.).
Изучая классы неорганических соединений, вы наблюдали за проведением химического эксперимента учителем, а также самостоятельно выполняли лабораторные опыты в классе и проводили домашние эксперименты по заданиям рубрики Страница естествоиспытателя. Это дало вам возможность убедиться в достоверности информации о свойствах классов неорганических соединений, сформировать экспериментальные умения. Теперь вы можете самостоятельно исследовать некоторые свойства веществ, выполнять задания, не детализированные в учебнике. Для этого вам необходимо самостоятельно составлять планы проведения исследований, прогнозировать результаты и подтверждать их достоверность экспериментальным путем. Успешное выполнение таких заданий станет убедительным доказательством ваших знаний, усовершенствует экспериментальные умения: собирать несложные приборы, пользоваться химической посудой и лабораторным оборудованием и т. п.
Без химического эксперимента было бы невозможно создавать новые вещества, а тем более вещества с заранее заданными свойствами. Проиллюстрируем это на примере инсулина — вещества, которое вырабатывается поджелудочной железой в организме всех позвоночных, в том числе и человека. Основное его назначение — регулировать содержание глюкозы в составе крови. Именно благодаря инсулину уровень глюкозы в крови остается постоянным, независимо от того, сколько сладостей мы съели. Если же инсулина в организме человека вырабатывается недостаточно, это вызывает серьезное нарушение обмена веществ, которое получило название сахарного диабета. Больным сахарным диабетом необходимы ежедневные инъекции инсулина. Длительное время его получали в специальных лабораториях при мясокомбинатах из поджелудочных желез животных — свиней и крупного рогатого скота.
Ученые издавна исследовали строение инсулина и искали методы его синтеза, то есть получения в химической лаборатории. В конце XX ст. их усилия увенчались успехом — строение органического вещества инсулина было установлено. Начался следующий этап работы — поиск возможности создания искусственного инсулина. После его завершения инсулин стали изготовлять массово. В 2003 году Киевский завод по производству инсулина выпустил свою первую продукцию. Так, благодаря экспериментальному методу исследований, химиками, биологами, медиками была решена проблема обеспечения жизненно необходимым препаратом людей, больных сахарным диабетом.
Решение экспериментальных задач
Химические задачи разделяют на две больших группы — расчетные и экспериментальные.
Решение первых предусматривает проведение математических вычислений, например расчеты по химическим уравнениям массы или объема вещества.
Экспериментальные задачи решают опытным путем.
Экспериментальными называют задачи, для решения которых необходимо проведение химического эксперимента.
Это могут быть задачи, по условию которых необходимо:
а) распознать вещества;
б) установить качественный состав веществ;
в) получить вещество разными способами или придерживаясь заданной схемы преобразований и др.
Для успешного решения экспериментальных задач необходимо знать физические и химические свойства веществ, способы их получения.
Прежде чем приступать к решению экспериментальной задачи, следует провести воображаемый эксперимент. Для задач на распознавание веществ он заключается в том, что на основе знаний о свойствах классов соединений составляют план экспериментального распознавания данных для опыта веществ и устанавливают последовательность выполнения опытов. Поупражняйтесь в этом, решая примеры 1—3 лабораторного опыта 10 (с. 169).
Пример №15
Определить, в каких пронумерованных, но без этикеток, пробирках содержатся: соляная кислота, растворы серной кислоты, хлорида натрия, гидроксида натрия.
Решение
Рассуждаем так: жидкости во всех пробирках внешне одинаковы, значит, по агрегатному состоянию и цвету провести распознавание хотя бы одного из веществ не удастся. Поэтому следует распознавать вещества, используя их химические свойства. Достаточно часто два, а то и больше веществ, которые нужно распознать, одинаково взаимодействуют с веществом, с помощью которого осуществляют распознавание. Это создает определенные трудности во время решения экспериментальных задач. Их можно избежать, оформив воображаемый эксперимент в виде таблицы:
Из таблицы следует, что для решения задачи вещества, с помощью которых необходимо провести распознавание, используют в такой последовательности: хлорид бария, цинк, фенолфталеин, нитрат серебра.
Помните! Из пробирок следует отливать (отбирать) для распознавания небольшие порции веществ или их растворов. Это правило нужно обязательно соблюдать, поскольку неизвестно, с какого по счету раза удастся распознать вещество.
Итак, сначала отольем в чистые пробирки немного (около 1 мл) каждого вещества и по очереди добавим к ним хлорид бария. Только в одной из пробирок появится осадок — в той, которая содержит серную кислоту:
Номер этой пробирки запишем в ответе.
Обратите внимание, что взаимодействие с цинком определено как второй опыт. Если бы его проводили первым, то одновременно в двух пробирках (с соляной и серной кислотами) наблюдали бы выделение водорода и распознать кислоты не удалось бы.
Следующее исследование проводим, изъяв из опытов пробирку с серной кислотой. Из трех пробирок, которые содержат нераспознанные вещества, отливаем в чистые пробирки по 1 мл растворов и осторожно кладем в каждую гранулы цинка. Лишь в одной пробирке наблюдается выделение водорода:
Записываем в ответе номер этой пробирки напротив ярлычка с формулой 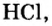
Осталось распознать хлорид натрия и гидроксид натрия. Воспользуемся фенолфталеином. В пробирке с гидроксидом натрия раствор индикатора приобретет малиновую окраску.
Остается убедиться, что в последней пробирке находится хлорид натрия. Добавим к раствору нитрат серебра:
Получили осадок хлорида серебра.
Может ли быть другая последовательность? Да. Например, можно распознавание начинать с использования фенолфталеина. Так мы сразу определим и изымем из последующих исследований гидроксид натрия, ведь в других растворах фенолфталеин не изменит окраску.
Пример №16
Получить хлорид магния разными способами.
Решение
Хлорид магния 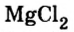
1) магний + хлор 
2) магний +соляная кислота 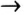
3) оксид магния + соляная кислота 
4) гидроксид магния + соляная кислота 
5) сульфат магния + хлорид бария 
Запишите самостоятельно уравнения реакций по указанным схемам, проделайте опыты.
Пример 3. Проделайте эксперимент по схеме таких превращений:
и запишите уравнения реакций.
Решение
1. Сжигание серы.
2. Растворение полученного кислотного оксида в воде с получением раствора кислоты.
3.Нейтрализация кислоты щелочью.
Запишите самостоятельно уравнения реакций по указанным схемам, проделайте опыты.
Классы и номенклатура неорганических веществ
В настоящее время известно около 400 тысяч различных неорганических веществ, среди которых есть знакомые вам соединения четырёх важнейших классов — оксиды, кислоты, основания и соли. Их современные названия составляются в соответствии с правилами, предложенными Международным союзом чистой (теоретической) и прикладной химии 
Международные (систематические) названия оксидов, кислот, оснований и солей составляются из названий их составных частей в именительном падеже, соединённых дефисом. ШРАС рекомендует при этом вначале указывать название электроположительной, а затем электроотрицательной составляющей, читая формулу в направлении слева направо, например: СuО — медь(II)-оксид, NaCl — натрий-хлорид, 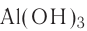
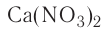
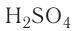
В русском языке традиционно используется обратный порядок составления названий сложных веществ — формулы читаются в направлении справа налево. Вначале даётся название электроотрицательной части в именительном падеже, а затем без дефиса указывается название электроположительной части в родительном падеже: СuО — оксид меди(II), NaCl — хлорид натрия, 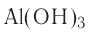
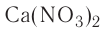
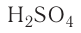
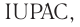
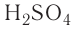
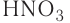
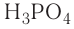
Кроме того, для ряда веществ, находящих широкое практическое применение, нормами 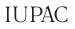
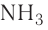
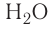
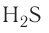
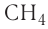
В практической деятельности наряду с международными, традиционными и специальными названиями химики иногда используют и устаревшие тривиальные (т. е. «нехимические») названия веществ. Это, например, чилийская селитра, олеум, угарный газ, сусальное золото. К тривиальным относятся названия минералов, например 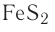
Теперь рассмотрим классификацию неорганических веществ, кратко охарактеризуем их состав и важнейшие свойства, приведём примеры названий.
Как вы уже знаете, все неорганические вещества делятся на простые (состоят из атомов одного элемента) и сложные (состоят из атомов двух и более элементов). Простые вещества, в свою очередь, подразделяются на металлы и неметаллы. Названия простых веществ, как правило, совпадают с названиями соответствующих химических элементов, например железо, кремний, натрий, кислород, хлор. Исключение составляют названия аллотропных модификаций углерода (алмаз, графит, карбин, фуллерен) и аллотропной модификации кислорода (озон).
Сложные неорганические вещества подразделяются на бинарные, в состав которых входят атомы двух элементов, и многоэлементные, образованные атомами трёх или большего числа элементов. Все такие вещества классифицируются на основе их состава и свойств (рис. 1).
Бинарные соединения (от лат. 
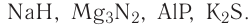
В, Si, С, As, Р, Н, Те, Se, S, I, Вг, Cl, N, О, F.
Примеры формул: 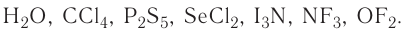
В русскоязычной химической литературе международные названия сложных веществ, в том числе и бинарных, составляются по их химическим формулам в направлении справа налево и включают в себя два слова. Первое из них состоит из корня латинского названия «правого» элемента и суффикса —ид-. Второе слово — название «левого» элемента на русском языке в родительном падеже. Примеры названий: NaCI — хлорид натрия, 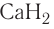
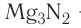
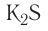
К важнейшим бинарным неорганическим соединениям относятся оксиды, галогениды (фториды, хлориды, бромиды, иодиды), халькогениды (сульфиды, селениды, теллуриды), нитриды, фосфиды, карбиды, гидриды. Из них в природе наиболее распространены оксиды, галогениды и халькогениды. Они находят широкое практическое применение.
Оксиды:
В Оксиды — бинарные соединения атомов различных элементов с атомами кислорода.
Напомним, что степень окисления атомов кислорода в оксидах равна —2:
Оксиды разнообразны по строению и физическим свойствам. Оксиды молекулярного строения при обычных условиях — газы (оксид углерода(IV) 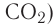
В основе классификации оксидов лежат их важнейшие химические свойства (табл. 1).
Деление оксидов на солеобразующие и несолеобразующие основано на их способности или неспособности образовывать соли в реакциях с кислотами или щелочами. К солеобразующим относятся основные, амфотерные и кислотные оксиды.
Общее свойство всех основных оксидов — способность реагировать с кислотами с образованием солей и воды:
Практически все основные оксиды реагируют с кислотными оксидами, образуя средние соли. Например:
Основные оксиды щелочных и щёлочно-земельных металлов реагируют с водой с образованием соответствующих оснований:
Общее свойство всех кислотных оксидов — взаимодействие со щелочами с образованием соли и воды:
Практически все кислотные оксиды реагируют с основными оксидами с образованием средних солей. За исключением 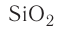
Амфотерные оксиды вступают в реакции как с кислотами, так и со щелочами. В реакциях с кислотами они проявляют свойства основных оксидов:
В реакциях со щелочами ZnO и 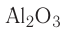
Несолеобразующие оксиды с кислотами и щелочами не реагируют.
Галогениды:
В Галогениды — бинарные соединения атомов различных элементов с атомами галогенов (F, Cl, Вг, I) — элементов группы VIIA.
Степень окисления атомов галогенов в галогенидах равна —1:
Галогениды разнообразны по строению и физическим свойствам. Галогениды неметаллов являются соединениями молекулярного строения. При обычных условиях — это газы (фторид серы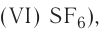
или легкоплавкие твёрдые вещества (хлорид фосфора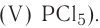
Галогениды большинства металлов — твёрдые тугоплавкие вещества немолекулярного строения. Они являются солями вышеуказанных кислот: 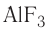
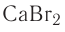
Халькогениды:
В Халькогениды — бинарные соединения атомов различных элементов с атомами халькогёнов (S, Se, Те) — элементов группы VIA.
Степень окисления атомов халькогенов в халькогенидах равна —2:
Халькогениды разнообразны по строению и физическим свойствам. Халь-когенидов молекулярного строения немного. При комнатной температуре они существуют в виде газов 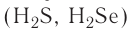
Водородные соединения халькогенов имеют общее название — халькогено-водороды. Их водные растворы называются соответственно сероводородной и селеноводородной кислотами. Соли этих кислот — сульфиды, селениды.
Большинство халькогенидов относятся к веществам немолекулярного строения. При обычных условиях это твёрдые тугоплавкие вещества. Среди них преобладают халькогениды металлов, являющиеся солями вышеперечисленных халькогеноводород-ных кислот. Например: 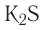
Менее распространёнными, чем оксиды, галогениды и халькогениды, являются соединения атомов различных элементов с атомами азота — нитриды 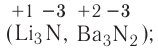
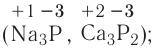
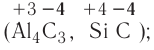
Сложные неорганические вещества подразделяются на две большие группы — бинарные и многоэлементные соединения. К бинарным веществам относятся оксиды, галогениды, халькогениды, нитриды, фосфиды, карбиды, гидриды.
Многоэлементные соединения
В отличие от бинарных многоэлементные соединения состоят из атомов трёх или большего числа химических элементов. К ним относятся гидроксиды (кислородсодержащие кислоты и основания), большинство солей, кристаллогидраты, комплексные соединения.
Термин гидроксиды (гидраты оксидов) в современной неорганической химии используется как обобщающее название двух классов веществ — оснований и кислородсодержащих кислот. К основаниям относятся основные гидроксиды, а к кислородсодержащим кислотам — кислотные гидроксиды. Вы уже знаете, что некоторые из этих веществ образуются при взаимодействии соответствующих оксидов с водой:
Несмотря на то что не все оксиды реагируют с водой, каждому из них соответствует гидроксид. Поскольку оксиды делятся на основные, кислотные и амфотерные, то и соответствующие им гидроксиды также подразделяются на основные, кислотные и амфотерные.
Из большой группы основных гидроксидов лишь некоторые образуются при гидратации основных оксидов:
Это, например, гидроксиды щелочных (Li, Na, К, Rb, Cs) и щёлочноземельных (Са, Sr, Ва) металлов, относящиеся к щелочам:
Основные гидроксиды других металлов, например 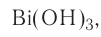
Практически все кислотные гидроксиды (кислородсодержащие кислоты), кроме H2Si03, образуются при гидратации соответствующих кислотных оксидов:
Так можно получить кислотные гидроксиды неметаллов и некоторых металлов, например:
Амфотерные гидроксиды, к примеру такие, как 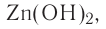
Таким образом, основные, кислотные и амфотерные гидроксиды являются гидратами соответствующих оксидов:
NaOH — гидроксид натрия — гидрат оксида натрия;
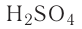
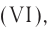
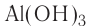
К названию «гидроксид натрия» вы уже привыкли, а вот название «гидроксид серы(VI)», скорее всего, кажется вам необычным, ведь вещество с формулой 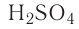
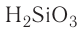
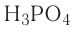
кислотой.
Кислоты (кислотные гидроксиды):
В Кислоты — сложные вещества, в состав которых входят атомы водорода, способные замещаться атомами металлов, и кислотные остатки.
Традиционные русские названия кислот состоят из двух слов. Первое из них — прилагательное, образованное корнем русского названия кислотообразующего элемента, суффиксом -н- или -ист- и окончанием -ая. Второе слово — «кислота». Если степень окисления атомов кислотообразующего элемента максимальна (т. е. равна номеру группы А), то в названиях кислот присутствует суффикс -н-, —ов- или -ев-: 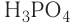
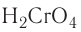
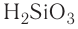
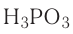
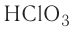
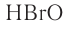
Число атомов водорода в формулах кислот называется их основностью. В соответствии с этим 
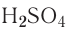
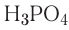
Все кислоты — вещества молекулярного строения. Некоторые из них, например угольная и сернистая кислоты 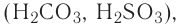
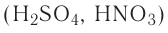
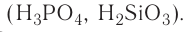
Важнейшее химическое свойство всех кислородсодержащих кислот — способность образовывать соли при взаимодействии с основаниями и с основными оксидами. Например:
Многие кислородсодержащие кислоты вступают в реакции с солями:
Кроме того, указанные кислоты (кроме 
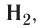
При отщеплении ионов водорода от молекул кислот образуются отрицательно заряженные кислотные остатки. Их общее число совпадает с основностью кислоты. Например, трёхосновной фосфорной кислоте соответствуют три кислотных остатка —
Основания:
В Основания — сложные вещества, состоящие из атомов металлов и ги-дроксогрупп ОН.
Напомним, что заряд группы ОН равен 1 — :
Названия оснований состоят из двух слов, первое из которых — «гидроксид», а второе — русское название металла в родительном падеже. Например:
NaOH — гидроксид натрия; Mg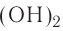
Число групп ОН в формулах оснований называется их кислотностью. В соответствии с этим КОН — однокислотное, 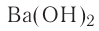
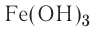
Все основания — твёрдые вещества немолекулярного строения. Некоторые из них, например 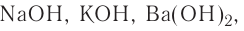
Важнейшее химическое свойство оснований — способность образовывать соли при взаимодействии с кислотами и кислотными оксидами. Например:
Кроме того, растворимые основания (щёлочи) реагируют с солями. Например:
Нерастворимые основания при нагревании разлагаются с образованием соответствующих оксидов металлов и воды:
Соли:
Соли можно рассматривать как продукты замещения атомов водорода в кислотах металлами или групп ОН в основаниях кислотными остатками. В зависимости от степени замещения атомов водорода в молекулах кислот или гидроксогрупп ОН в формульных единицах оснований соли классифицируются следующим образом (см. рис. 2).
Название любой соли на русском языке состоит из двух слов, первое из которых — систематическое название кислотного остатка в именительном падеже, а второе — русское название основного остатка в родительном падеже.
Примеры названий:
Все соли — твёрдые кристаллические вещества немолекулярного строения, большинство из них хорошо растворимы в воде.
Важнейшие химические свойства солей — их взаимодействие с кислотами, щелочами, металлами, другими солями. Например:
Комплексные соединения:
Некоторые сложные вещества разных классов, соединяясь друг с другом, образуют особые, ещё более сложные соединения, называемые комплексными (от лат. complexus — сочетание). Они принадлежат к отдельному классу веществ, обладают рядом общих свойств и имеют сходные черты в строении. В любом таком соединении содержатся комплексные частицы, образующиеся чаще всего в результате присоединения к атому металла двух, четырёх или шести молекул воды, аммиака, гидроксид-ионов или кислотных остатков. Заряженные или электронейтральные комплексные частицы устойчивы и существуют в растворах самостоятельно. В формулах комплексных соединений они выделяются квадратными скобками. Например:
Многоэлементные соединения состоят из атомов трёх или большего числа элементов. К многоэлементным относятся гидроксиды — основания и кислородсодержащие кислоты, соли, комплексные соединения.
Взаимосвязь между классами неорганических соединений
Изучая ранее способы получения и химические свойства простых веществ, различных оксидов, кислот, оснований и солей, вы неоднократно сталкивались с примерами последовательного превращения веществ. В результате различных химических реакций одни вещества превращаются в другие, из которых затем образуются всё новые и новые соединения. Ряды таких последовательных переходов уже знакомы вам под названием «цепочки превращений» и вы, конечно же, составляли уравнения реакций для их осуществления. Вспомним, в чём заключается суть этих превращений.
Начнём с простых веществ — металлов и неметаллов. Многие из них, соединяясь с кислородом, образуют основные и кислотные оксиды. Например, металл барий при этом окисляется до основного оксида ВаО, а неметалл фосфор — до кислотного оксида 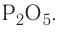
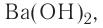
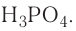
Из данной схемы видно, что вещества разных классов — простые вещества, оксиды, гидроксиды и соли, последовательно «порождая» друг друга, образуют так называемые генетические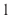
Каждый такой ряд включает в себя металл, его основный оксид, соответствующее основание и соль, в состав которой входит данный металл:
Приведём примеры таких рядов:
Переход от металлов к основным оксидам во всех этих рядах осуществляется в результате реакций соединения с кислородом. Например:
Основные оксиды натрия и бария превращаются в основания в результате известной вам реакции гидратации:
В отличие от указанных оксидов, оксиды магния и железа с водой не реагируют. Поэтому для получения соответствующих оснований эти оксиды сначала превращают в соли, а их — в основания. Например, для осуществления перехода от оксида MgO к гидроксиду 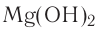
Переходы от оснований к солям осуществляются уже известными вам реакциями. Так, растворимые основания (щёлочи) — NaOH и 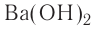
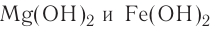
Генетические ряды неметаллов и их соединений
Каждый такой ряд состоит из неметалла, образованного им кислотного оксида, соответствующей кислоты и соли, в состав которой входят остатки этой кислоты:
Приведём примеры таких рядов:
Во всех этих рядах переходы от неметаллов к кислотным оксидам осуществляются в результате реакций соединения с кислородом. Например:
Для превращения кислотных оксидов в соответствующие кислоты используются известные вам реакции гидратации. Например:
В отличие от указанных оксидов, оксид кремния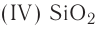
Переходы от кислот к солям могут осуществляться известными вам реакциями с основными оксидами, основаниями или с солями.
Вещества одного и того же генетического ряда, как правило, друг с другом не реагируют. Вещества из генетических рядов разных типов реагируют друг с другом, образуя соли в соответствии с общей схемой (рис. 3).
Как видно из этой схемы, отражённые в ней взаимосвязи между простыми веществами, оксидами, соответствующими гидроксидами и солями не являются односторонними. Двунаправленные стрелки на схеме показывают, что вещества разных классов могут взаимопревращаться. В такой взаимосвязи находятся, например, основные оксиды и основания, основания и соли, соли и кислоты.
Взаимосвязи веществ лежат в основе многих химических превращений, происходящих в природе и используемых в практической деятельности.
Простые вещества, оксиды, гидроксиды и соли связаны между собой совокупностью превращений в следующих рядах:
• металл 


• неметалл 


Справочный материал по классам и номенклатуре неорганических веществ
Число официально зарегистрированных химических веществ в настоящее время превышает 30 млн. Понятно, что их описание и классификация возможны только в рамках единой системы номенклатуры.
В соответствии с официальной номенклатурой Международного союза теоретической и прикладной химии (ИЮПАК), часто называемой также Международной, при наименовании сложных веществ сначала называется условно электроположительная часть (катион), затем электроотрицательная часть (анион). Например, СuО — медь(II)-оксид, Na2S04 — натрий-сульфат, А1(ОН)3 — алюминий-гидроксид, HN03 — водород-триоксонитрат(V), или просто водород-ни-трат, и т. п.
В русском языке порядок употребления названий составных частей сложных химических веществ традиционно обратный. Название электроотрицательной части (аниона) дается в именительном падеже, а название электроположительной части (катиона) — в родительном падеже: СuО — оксид меди(II), Na2S04 — сульфат натрия, А1(ОН)3 — гидроксид алюминия, HN03 — нитрат водорода и т. п. Поскольку почти вся учебная литература по химии на русском языке основана именно на таком подходе к составлению названий неорганических соединений, он используется и в нашем учебном пособии.
Для некоторых соединений (наиболее распространенные кислоты, их соли) допускается употребление традиционных названий: H2S04 — серная кислота, HN03 — азотная кислота. Кроме того, допустимо применение специальных названий: аммиак NH3, вода Н20, ион аммония 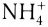
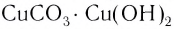
Рассмотрим принципы классификации, характеристики различных типов неорганических веществ, приведем примеры их названий.
Все вещества делятся на простые (состоят из атомов одного элемента) и сложные (состоят из атомов двух и более элементов). Простые вещества, в свою очередь, подразделяются на металлы и неметаллы. Названия простых веществ, как правило, совпадают с названиями соответствующих химических элементов (железо, платина, сера, кислород). Исключение составляют названия аллотропных модификаций углерода (алмаз, графит, фуллерен, карбин) и кислорода (кислород и озон).
Сложные неорганические вещества подразделяются по числу химических элементов, из которых они состоят, на бинарные и многоэлементные, которые классифицируются дальше на основе их состава, строения и свойств (рис. 1).
Бинарные соединения (от греч. ди (би) — два) состоят из атомов двух различных химических элементов. Если в соединении есть металл, то его химический символ в формуле записывается первым: NaH, Mg3N2, AIP, K2S. В формулах веществ, содержащих кислород, его химический символ записывается на втором месте: S03, Р205. Название условного аниона бинарного соединения обычно имеет суффикс -ид. Рассмотрим некоторые бинарные соединения подробнее.
К галогенидам относят соединения атомов различных элементов с галогенами — атомами элементов VIIА-группы (F, CI, Br, I).
Водородные соединения галогенов — газы, их растворы в воде называют бескислородными кислотами: HF — фтороводородная (плавиковая), HCI — хлороводородная (соляная), НВr — бромоводородная, HI — иодоводородная.
Галогениды металлов относят к солям этих кислот: AlF3 — фторид алюминия, NaCl — хлорид натрия (поваренная соль), КВr — бромид калия, СаI2 — иодид кальция.
Галогениды неметаллов чаще всего жидкие или газообразные соединения: ССI4 — хлорид углерода (IV), или четыреххлористый углерод, SF6 — фторид cepы(VI), или гексафторид серы, — один из самых тяжелых газов при н. у. В то же время РСI5 — хлорид фосфора (V), или пентахлорид фосфора, — твердое вещество.
Оксиды — бинарные соединения атомов различных элементов с кислородом. Оксиды разнообразны по своим физическим свойствам — от газов до твердых кристаллических веществ с высокими температурами плавления.
Оксиды, содержащие группу атомов кислорода (—О—О—), называют пероксидами: Na202 — пероксид натрия.
Химические свойства оксидов отражаются в их классификации (табл. 1).
Основные оксиды взаимодействуют с кислотами с образованием солей и воды:
Кислотные оксиды взаимодействуют со щелочами с образованием солей и воды:
Амфотерные оксиды вступают в реакции и с кислотами, и со щелочами. В обоих случаях образуются соли и вода:
Несолеобразующие оксиды обычно легко окисляются:
К халькогенидам принадлежат бинарные соединения элементов группы VIA (сера, селен, теллур) с менее элетроотрицательными элементами. Эти соединения разнообразны по агрегатному состоянию: от газообразного (H2S)ao твердого (K2Se).
Водные растворы водородных соединений серы, селена и теллура являются бескислородными кислотами: H2S — сероводородная, H2Se — селеноводородная, Н2Те — теллуроводородная.
Соединения металлов с халькогенами рассматриваются как соли этих кислот: Na2S — сульфид натрия, K2Se — селенид калия, CdTe — теллурид кадмия.
К нитридам относятся бинарные соединения азота с менее электроотрицательными элементами. С металлами азот образует твердые нитриды: Na3N — нитрид натрия, Mg3N2 — нитрид магния.
Особое место среди нитридов занимают водородные соединения азота. Они часто имеют специальные названия: NH3 — аммиак, N2H4 — гидразин. Аммиак и гидразин — газообразные вещества. Водный раствор аммиака рассматривается как основание — NH3 • Н20, его производные — соли аммония: NH4C1 —хлорид аммония.
Фосфидами являются бинарные соединения фосфора с металлами и менее электроотрицательными неметаллами. Фосфиды неметаллов немногочисленны, некоторые из них — газообразные вещества: Н3Р(или РН3) — фосфид водорода (фосфин), ядовитый газ. Фосфиды металлов — твердые вещества (К3Р фосфид калия), легко взаимодействуют с водой.
К карбидам относятся соединения углерода с металлами и неметаллами. Карбиды некоторых неметаллов (В4С — карбид бора) очень твердые и тугоплавкие вещества. Карбиды металлов IA- и IIА-групп также твердые вещества, легко разлагаются водой:
Гидриды — соединения водорода с металлами и некоторыми неметаллами. Гидриды неметаллов (SiH4 — силан, AsH3 — арсин) — газообразные вещества. Гидриды металлов — твердые вещества, легко взаимодействуют с водой:
Интерметаллиды — химические соединения двух или нескольких металлов. При обычных условиях это твердые, хрупкие вещества со смешанным типом химической (металлической, ковалентной и ионной) связи; отличаются широким разнообразием физических и химических свойств. Систематические названия интерметаллидов составляются из названий элементов с соответствующими числовыми приставками в именительном падеже: CuZn3 — трицинк-медь, KNa2 — динатрий-калий.
К многоэлементным веществам относятся гидроксиды (кислородсодержащие кислоты и основания), соли, гидраты, комплексные соединения.
Термин гидроксид в современной неорганической химии используется в качестве сборного (т. е. общего) понятия оснований и кислородсодержащих кислот В общем виде формулу гидроксида можно представить как R(OH)n, где R — атом гидроксидобразующего элемента (металл или неметалл) или сложная группировка, включающая, кроме гидроксидобразующего элемента, атомы кислорода, водорода и некоторых других элементов. Например: КОН; Mg(OH)2; N02(0H) или HNO3; СО(ОН)2, или Н2С03; РО(ОН)3, или Н3Р04; РНО(ОН)2, или Н3Р03 РН20(0Н), или Н3Р02.
Кислоты — вещества, содержащие атомы водорода, соединенные с кислотными остатками: H2S04, HN03, Н3Р04 и др. Большинство кислот хороня растворимы в воде. Их важнейшее химическое свойство — способность образовывать соли при взаимодействии с основаниями и основными оксидами:
Число атомов водорода в молекуле кислоты, способных замещаться на атомы металла, называется основностью кислоты: HN03 — одноосновная кислота H2S04 — двухосновная, Н3Р04 — трехосновная.
Названия кислот состоят из двух слов — прилагательного, производного от корня названия кислотообразующего элемента, и слова «кислота»: азотная кислота, фосфорная кислота.
Если элемент образует несколько кислот, то различие между ними устанавливается с помощью суффиксов, присоединяемых к корню названия: серная кислота — H2S04, сернистая кислота — H2S03.
Основания — соединения, содержащие одну или несколько групп ОН, соединенных с атомами металлов. Основания — твердые кристаллические вещества. В зависимости от способности растворяться в воде их делят на щелочи (NaOH, КОН, Ва(ОН)2) и нерастворимые гидроксиды (Fe(OH)3, Cu(OH)2). Систематические названия оснований состоят из слова «гидроксид» и названия элемента в родительном падеже: гидроксид железа(III), гидроксид меди(II).
Основное свойство оснований — их способность взаимодействовать с кислотами и кислотными оксидами с образованием солей:
Соли можно рассматривать как продукты замещения атомов водорода в кислотах на атомы металлов или групп ОН в основаниях на кислотные остатки. В зависимости от степени замещения атомов водорода или гидроксо-групп соли классифицируются, как показано на рисунке 2.
Согласно принципам систематической номенклатуры название каждой соли происходит от латинского названия кислотного остатка (он называется первым) в именительном падеже и названия металла в родительном падеже: нитрат натрия — NaN03, сульфат железа(II) — FeS04, карбонат кальция — СаС03. В соответствии с официальной номенклатурой ИЮПАК сначала называется металл, а затем кислотный остаток в именительном падеже: натрий-нитрат, железо(II)-сульфат, кальций-карбонат.
Кислые соли называют, добавляя к названию кислотного остатка слово гидро-: гидрокарбонат натрия — NaHC03, дигидрофосфат кальция — Са(Н2Р04)2. В названиях основных солей добавляется слово гидроксо-: хлорид гидроксомагния — Mg(OH)Cl, нитрат дигидроксоалюминия — AI(OH)2NO3.
К основным химическим свойствам солей относится их взаимодействие с кислотами, щелочами, металлами, другими солями.
Гидраты — соединения, содержащие в своем составе молекулы воды. Как правило, гидраты нестойкие и существуют только в растворе. Но наиболее прочные гидраты могут быть выделены из раствора в виде кристаллогидратов: CuS04 • 5Н20 — пентагидрат сульфата меди(II) (медный купорос), Na2C03 • 10Н2О — декагидрат карбоната натрия (кристаллическая сода). При повышенных температурах кристаллогидраты теряют воду.
- Атомы химических элементов, взаимодействуя между собой, образуют простые и сложные химические вещества.
- Сложные вещества классифицируют по составу и по функциональному признаку.
Взаимосвязь между классами неорганических соединений
При помощи химических реакций, которые вы уже изучили, можно осуществить переход от простых веществ к сложным и от одних сложных веществ к другим. Подтвердим это на примере. Возьмем в качестве простого вещества металл кальций. При его взаимодействии с кислородом образуется оксид кальция:
Растворение оксида кальция в воде приводит к образованию гидроксида кальция:
Это основание под действием серной кислоты переходит в соль сульфат кальция:
Проведя указанные реакции, мы осуществили цепочку превращений:
которая показывает, что простое вещество кальций является родоначальником цепочки сложных веществ, между которыми существует генетическая связь.
Если взять неметалл, например серу, то можно установить другую линию генетической связи, последовательно осуществляя такие превращения:
Запишите самостоятельно соответствующие уравнения реакций.
На примере других известных металлов и неметаллов можно показать подобные переходы от простых веществ к сложным. Металлы и неметаллы при окислении образуют оксиды. Основные оксиды прямо или косвенно могут быть превращены в основания, а кислотные оксиды — в кислоты. Таким образом, металлы и неметаллы выступают родоначальниками двух рядов генетически связанных веществ:
Напомним, что вещества одного генетического ряда друг с другом не взаимодействуют. Взаимосвязь между веществами различных генетических рядов показана на рисунке 3.
При взаимодействии веществ, относящихся к разным генетическим рядам, всегда образуются соли. В приведенном выше примере соль получалась в реакции гидроксида кальция с серной кислотой:
Эту же соль можно получить при взаимодействии основного оксида кальция с кислотным оксидом серы(VI):
этого же оксида с серной кислотой:
кислотного оксида серы(VI) с гидроксидом кальция:
или кальция с серной кислотой:
Необходимо подчеркнуть, что показанные генетические связи между простыми и сложными веществами не являются односторонними. Из солей можно получать кислоты и основания. Например, действуя на карбонат кальция азотной кислотой, мы получим нитрат кальция и угольную кислоту, которая распадается на оксид углерода(IV) и воду:
Действуя щелочью на хлорид меди(II), мы получим гидроксид меди(II) и новую соль:
Соли, кислоты и основания при разложении могут образовывать оксиды, например:
Некоторые оксиды, в свою очередь, способны разлагаться на простые вещества, например:
Рассмотренные примеры, хотя и не охватывают всего многообразия химических веществ, свидетельствуют о разнообразии взаимосвязей между различными классами неорганических соединений. Эти взаимосвязи лежат в основе многочисленных химических превращений, происходящих в природе и использующихся в практической деятельности человека.
Химические формулы веществ с молекулярным и немолекулярным строением
Каждое химическое вещество, независимо от типа химической связи, характеризуется формулой, которая показывает его качественный и количественный состав. Однако лишь в случае веществ с молекулярным строением формула отражает качественный и количественный состав реально существующих частиц, из которых построено данное вещество, — молекул. Именно молекула является элементарной структурной единицей вещества такого строения. Поэтому, как правило, в молекулярных формулах всегда указывают общее число атомов всех элементов в молекуле: Не, I2, СН4, H2S04, С6Н6. Лишь в некоторых случаях в формулах простых веществ молекулярного строения с большим числом атомов в молекуле (Р4, S8) опускают числовые индексы, особенно при составлении химических уравнений с участием таких простых веществ.
В случае простых веществ немолекулярного строения, существующих обычно в форме металлических и атомных кристаллов, формула показывает лишь, из атомов какого химического элемента состоит данное вещество. Например, формулы простых веществ металлов: натрия — Na, магния — Mg, серебра — Ag, а простых веществ неметаллов: углерода — С, кремния — Si.
Состав сложного вещества немолекулярного строения выражают с помощью формулы, которая показывает простейшее численное соотношение между атомами разных химических элементов, входящих в состав вещества. Такие группы атомов, как известно, носят название формульных единиц (ФЕ). Например, формула вещества ионного строения СаСl2 означает, что на каждый атом кальция приходится два атома хлора (точнее, на один ион Са2+ приходится два иона С1—). Формула вещества атомного строения Si02 показывает, что в кристалле этого оксида на каждый атом кремния приходится два атома кислорода. Точно так же и формулы химических соединений двух или нескольких металлов между собой (их называют интерметаллиды) отражают лишь простейшее численное соотношение между атомами металлов: CuZn3, Na3Pb7.
Существует взаимосвязь между простыми и сложными неорганическими веществами.
Вещества, принадлежащие к генетическим рядам металлов и неметаллов, взаимодействуют между собой с образованием солей. Химическая формула вещества молекулярного строения отражает полный качественный и количественный состав элементарной структурной единицы таких веществ — молекулы.
Формула вещества немолекулярного строения показывает простейшее соотношение между числом атомов химических элементов, входящих в состав этого вещества. Такие формулы называются формульными единицами.
- Вещества и их свойства в химии
- Чистые вещества и смеси в химии
- Состав и строение веществ в химии
- Простые и сложные вещества в химии
- Азот в химии
- Фосфор в химии
- Углерод в химии
- Кремний в химии
В настоящее
время для составления названий
неоргани-ческих
соединений применяют тривиальную
и
рациональную
но-менклатуры,
причем в последней выделяют три
разновидности: русская,
международная (полусистематическая)
и систематичес—кая
номенклатуры.
Химическая
номенклатура
Международная
(полусистематическая)
Тривиальная
номенклатура. Исторически
сложившаяся сис-тема
названий неорганических веществ,
специальных, часто техни-ческих названий,
которые, как правило, не отражают или
отражают в
незначительной степени состав химических
соединений. Тривиаль-ная
номенклатура хотя и считается устаревшей,
широко приме-няется во многих областях
техники, химического производства, в
8
9
учебной и научной
литературе по химии. Эти названия требуют
за-поминания.
Например: Na2CO3—
сода, K2CO3—
поташ, HCI-
соля-ная
кислота, KOH—
едкое кали, NaCI—
поваренная соль, CaO-негашеная
известь, NH4OH-
нашатырный спирт и другие.
Русская номенклатура.
В основу
русской номенклатуры положено
использование русских названий химических
элемен-тов. При этом часто используются
корни слов или усеченные корни слов.
Например: NaCI-
хлористый натрий, NO2—
дву-окись азота, Ca(NO3)2—
азотнокислый кальций. В настоящее вре-мя
широко используются названия кислот
по русской номенк-латуре, номенклатура
других соединений считается устаревшей
и не рекомендуется к употреблению (см.
табл. 1).
Международная
номенклатура (полусистематическая).
Си-стема
составления названий химических
соединений, в основу которой положено
использование слов иноязычного
происхож-дения; чаще всего корни слов
латинских названий химических элементов.
При записи названий оксидов, оснований
и солей после слов оксид,
гидроксид или
названия
кислотного остатка обычно
указывают римскими цифрами значение
степени окисле—ния
атома химического
элемента, если она переменная.
Например:
NO2—
оксид азота (IV),
N2O5—
оксид азота (V),
но Na2O-
оксид натрия. Fe(OH)3—
гидроксид
железа (III),
Cu(OH)2—–
гидроксид меди (II),
но KOH—
гидроксид калия. NiSO4—
сульфат никеля (II),
Mn(NO3)2—
нитрат марганца (II),
но CaCI2—
хлорид кальция.
Несмотря на то, что
Международным союзом теорети-ческой и
прикладной химии ИЮПАК в настоящее
время реко-мендовано предпочтительное
использование систематической
номенклатуры, международная
номенклатура широко применя-ется в
учебной, научной и технической литературе.
Названия солей
наиболее употребляемых кислот по
меж-дународной номенклатуре представлены
в табл. 1.
Систематическая
номенклатура. Универсальная
система пра-вил
составления названий неорганических
соединений, рекомен-дованных ИЮПАК для
использования в учебной, научной и
тех-нической литературе.
По систематической
номенклатуре при записи формулы вещества
вначале записывают электроположительную
составля-ющую (условные или реальные
катионы). При этом согласно
10
правилам ИЮПАК,
называть составляющие следует слева
направо в соответствии с порядком
записи. Электроположительную состав-ляющую
пишут в именительном падеже. При
необходимости скло-няют обе части
названия.
Примеры систематических
названий:
Оксиды.
Систематическое
название оксида состоит из на—звания
элемента в
именительном падеже и слова оксид.
Число ато-мов
элемента и кислорода указывают числовыми
приставками. NO2—
азот диоксид,
N2O4—
диазот тетраоксид, Cr2O3—
Дихром триоксвд.
Анионы.
Систематические
названия одноатомных анионов состоят
из корня латинского
названия элемента, суффикса
-ид и
слова ион. Для
многоатомных анионов, состоящих из
атомов од-ного элемента, добавляется
числовая приставка.
H- гидрид-ион, F-
фторид-ион, S2—
сульфид-ион, S22—
дисульфид-ион.
Названия анионов
кислородсодержащих кислот состоят из
названия кислорода -оксо
с указанием
числа атомов и латинского
названия центрального атома с
суффиксом —am,
при этом в
скоб-ках римскими цифрами обозначают
значение степени окисления.
NO –—
триоксонитрат (V)
-ион,
NO –—
диоксонитрат (III)
-ион,
SO42—
тетраоксосульфат (VI)
-ион,
SO32—
триоксосульфат (IV)
-ион.
Существует группа
анионов, для которых допускается
сохранение их специальных названий,
имеющих суффикс -ид:
CN-
— цианид-ион, ОН—
— гидроксид-ион.
Кислоты.
Систематическое
название кислоты состоит из двух частей:
слова водород
и названия
аниона.
H2SO4
— водород тетраоксосульфат (VI),
H2SO3
— водород триоксосульфат (IV),
HNO
— водород триоксонитрат (V),
HF
— водород фторид.
Катионы.
Систематические
названия одноатомных кати-онов состоят
из названия
элемента в
именительном падеже с ука-занием
численного значения степени окисления
римской циф-рой в скобках и слова катион.
Для многоатомных
катионов, состоящих из атомов одного
элемента, добавляется числовая приставка,
а в скобках указывается общий заряд
катиона арабской цифрой со знаком после
цифры.
11
Fe2+—
железо (II)-
катион, Cu+—
медь (I)-
катион, Hg2+—
диртуть (2+)—
катИон.
Если атом, образующий
катион, имеет постоянную сте-пень
окисления, ее можно не указывать: К+—
калий-катион, Ва2+—
барий-катион.
Названия катионов,
состоящих из атомов различных элементов,
состоят из названия
атомов-лигандов и
русского
названия центрального атома в именительном
падеже. Атомы
водорода и кислорода называют
соответственно -гидро
и оксо-.
Количество
атомов указывают числовой приставкой.
NH+-
тетрагидроазот (III)
-катион,
CrO22+—
диоксохром (VI)
-катион.
Таблица 1
Название наиболее
употребительных кислот и их кислотных
остатков
|
Кислота |
Кислотный |
||
|
Формула |
Название |
Формула |
Название |
|
HF |
Фтороводородная |
F |
Фторид |
|
HCl |
Хлороводородная |
Cl– |
Хлорид |
|
HBr |
Бромоводородная |
Br– |
Бромид |
|
HI |
Иодоводородная |
I– |
Иодид |
|
h2s |
Сероводородная |
HS |
Гидросульфид |
|
S |
Сульфид |
||
|
h2so4 |
Серная |
hso4– |
Гидросульфат |
|
SO42— |
Сульфат |
||
|
H |
Сернистая |
hso3 |
Гидросульфит |
|
SO32— |
Сульфит |
||
|
HNO3 |
Азотная |
no3– |
Нитрат |
|
HNO |
Азотистая |
NO2 |
Нитрит |
|
hpo3 |
Метафосфорная |
po |
Метафосфат |
Продолжение табл.
1
|
Кислота |
Кислотный |
||
|
Формула |
Название |
Формула |
Название |
|
(Орто)фосфорная |
H |
Дигидрофосфат |
|
|
H3PO4 |
HPO |
Гидрофосфат |
|
|
PO43– |
Ортофосфат |
||
|
Двуфосфорная (пирофос- форная) |
H3P2O7 |
Тригидродифосфат |
|
|
H |
H2P2O72 |
Дигидродифосфат |
|
|
HP2O73 |
Гидродифосфат |
||
|
PO4- |
Дифосфат |
||
|
H2CO3 |
Угольная |
HCO3 |
Гидрокарбонат |
|
CO32 |
Карбонат |
||
|
H |
Кремниевая |
hsio3 |
Гидросиликат |
|
SiO |
Силикат |
||
|
H2CrO4 |
Хромовая |
HCrO |
Гидрохромат |
|
CrO42– |
Хромат |
||
|
H2Cr2O7 |
Двухромовая |
HCr2O7 |
Гидродихромат |
|
Cr2O72– |
Дихромат |
||
|
HClO |
Хлорная |
ClO |
Перхлорат |
|
HClO3 |
Хлорноватая |
ClO3— |
Хлорат |
|
HClO2 |
Хлористая |
ClO2— |
Хлорит |
|
HClO |
Хлорноватистая |
ClO- |
Гипохлорит |
|
HMnO4 |
Марганцевая |
MnO4— |
Перманганат |
|
CH3COOH |
Уксусная |
CH3COO |
Ацетат |
|
Борная |
H2BO3 |
Дигидроборат |
|
|
H3BO3 |
HBO32 |
Гидроборат |
|
|
BO33 |
Борат |
||
|
HCN |
Циановодородная |
CN- |
Цианид |
12
13
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
07.11.2018329.22 Кб21A.doc
- #
- #
- #
- #
- #










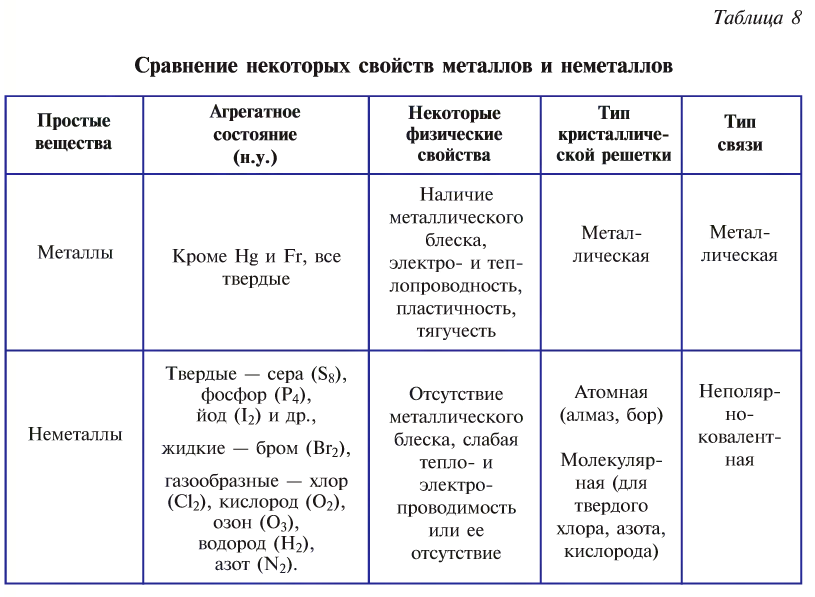
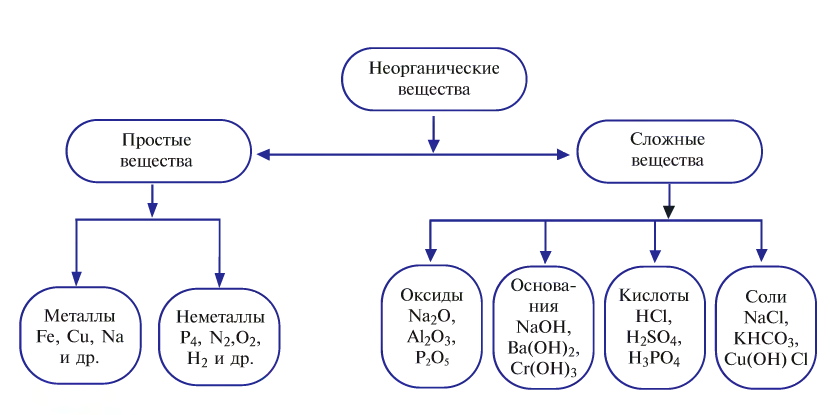
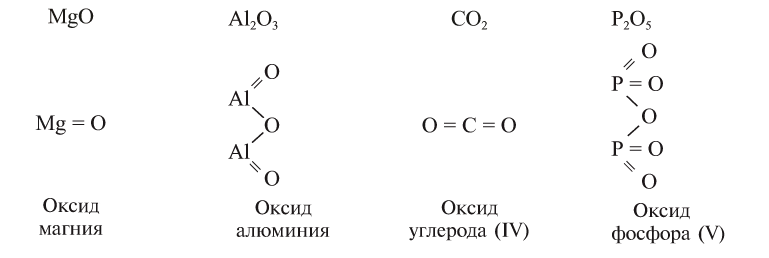

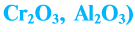
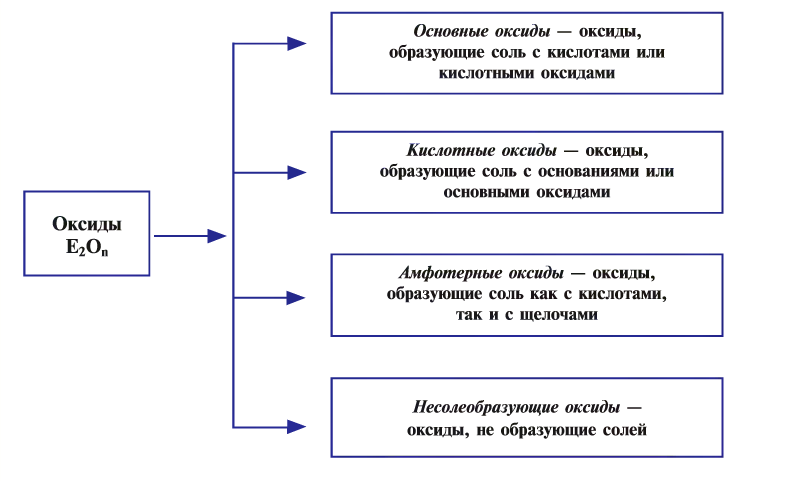
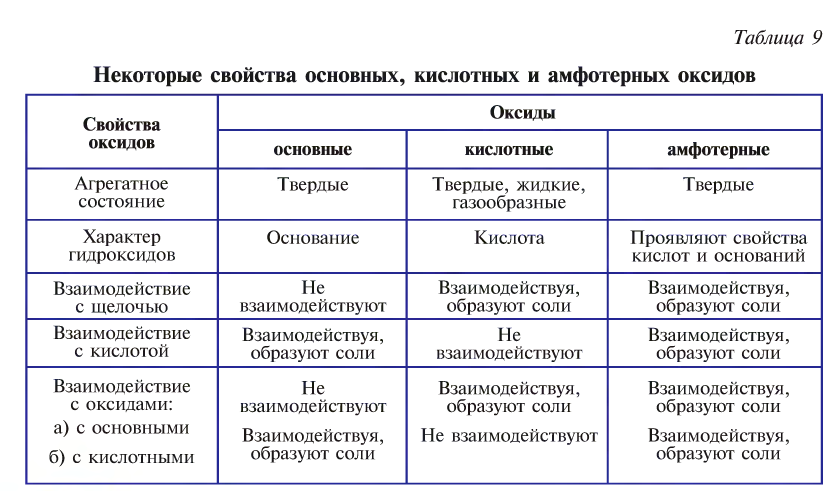
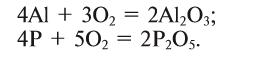
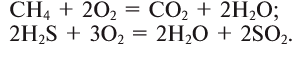
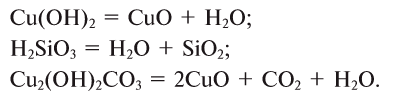
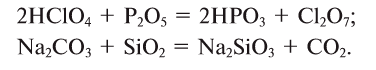
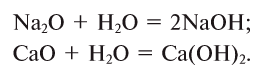
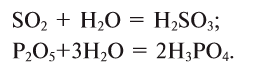
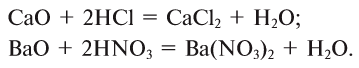
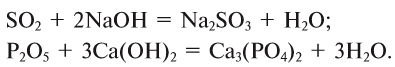
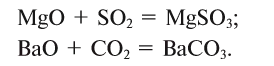
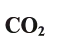

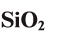
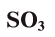


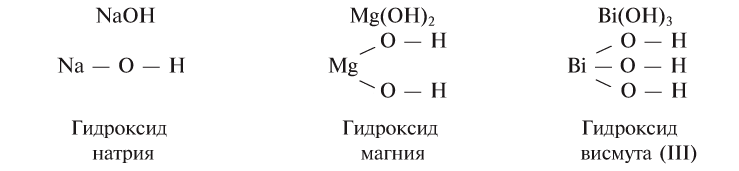
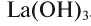
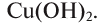
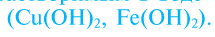

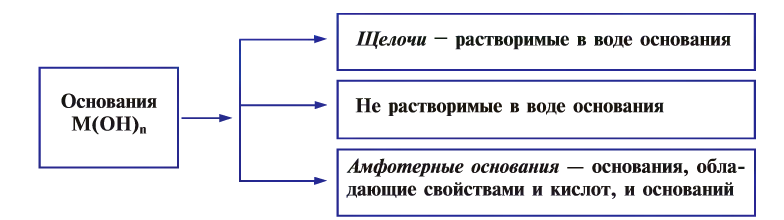

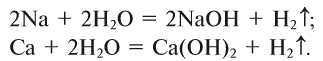
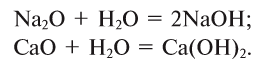
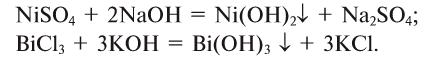

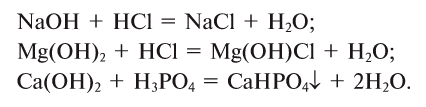
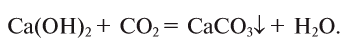
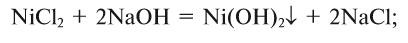
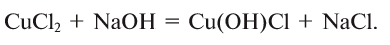
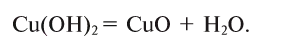
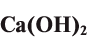
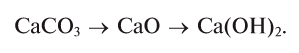
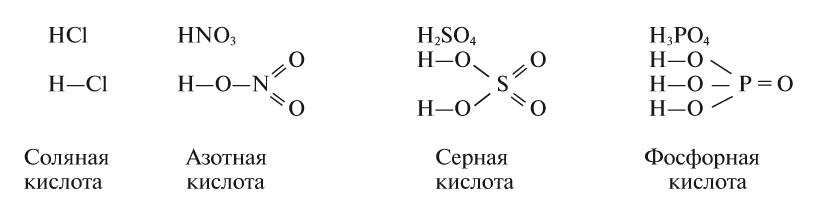
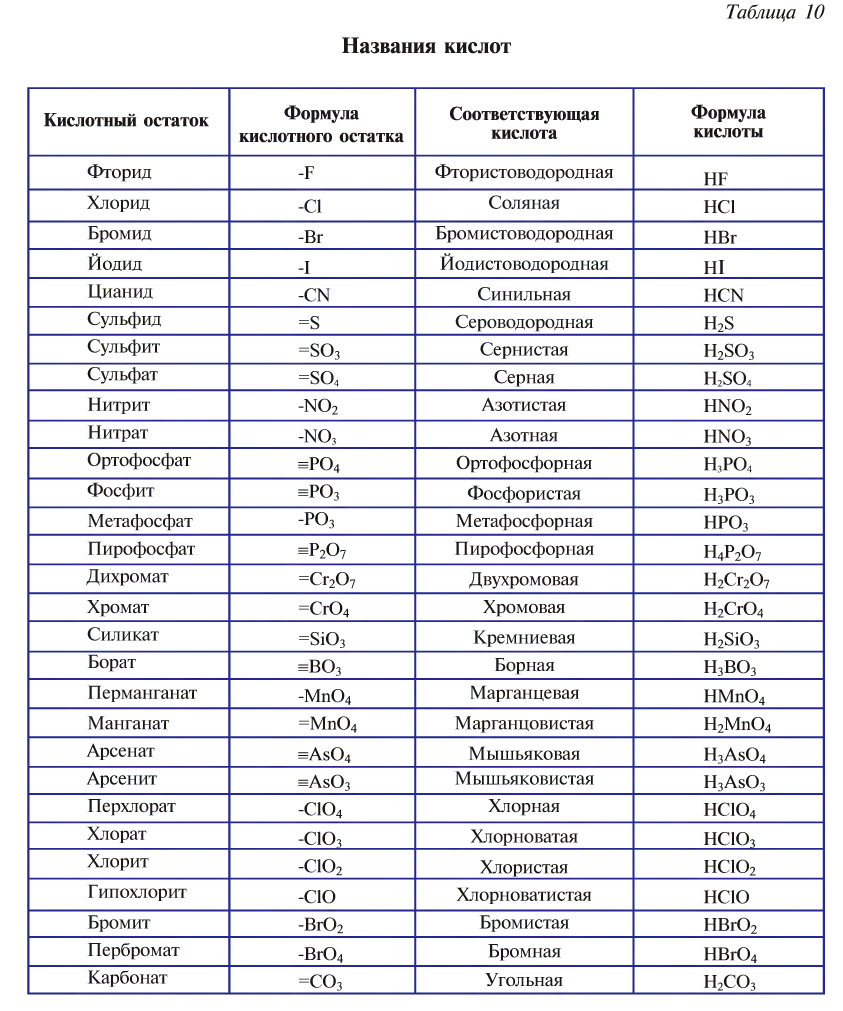
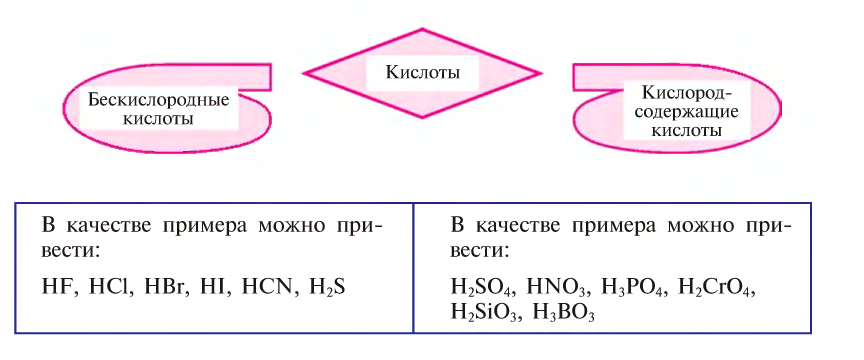
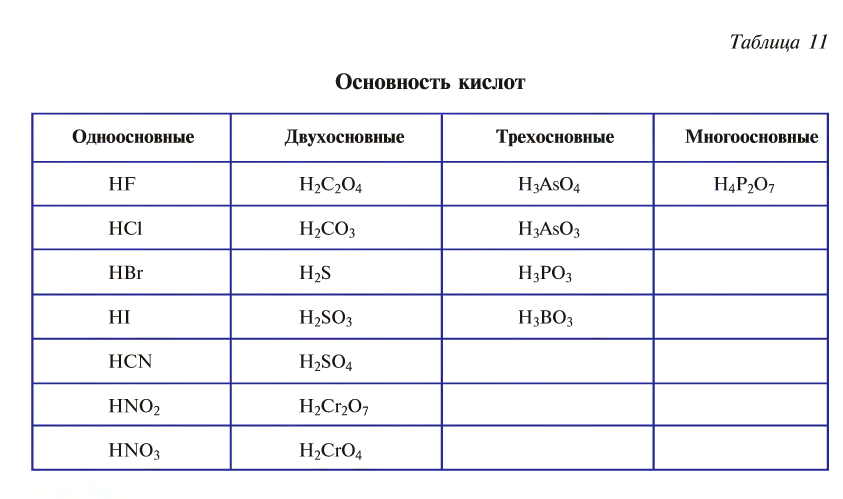
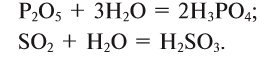
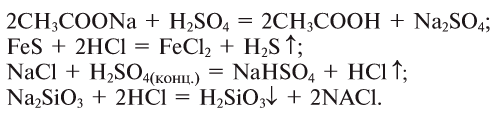


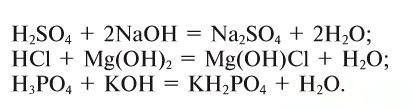
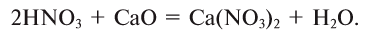
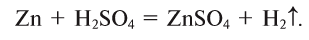
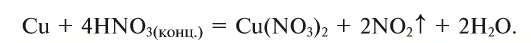



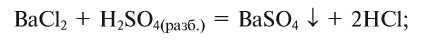
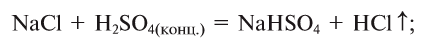
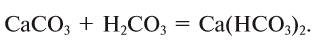
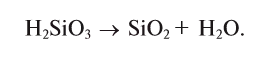
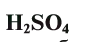

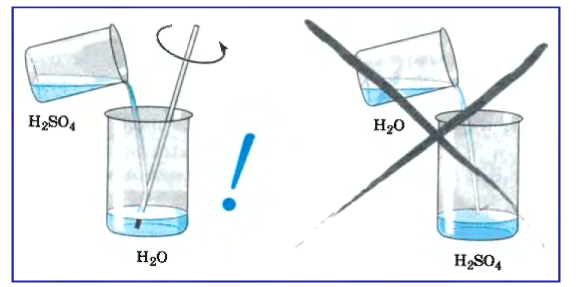



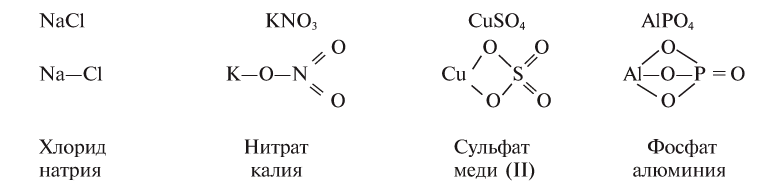
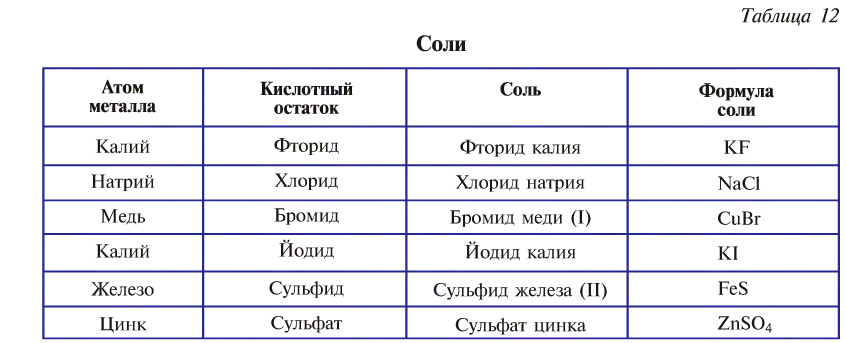
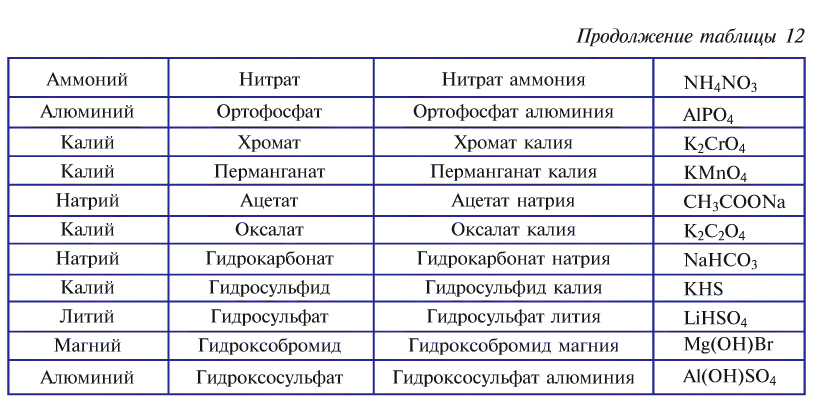
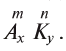

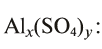
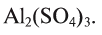
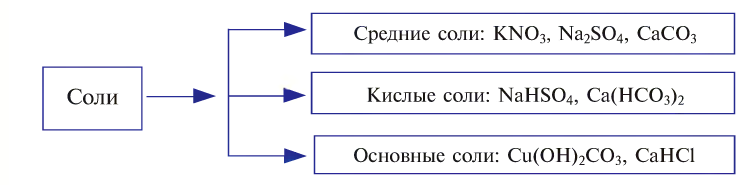

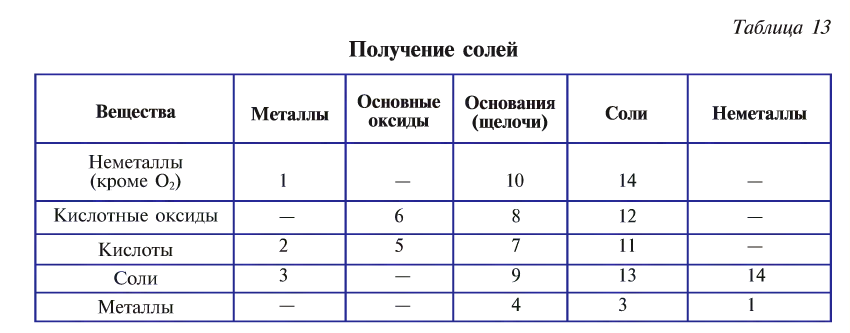
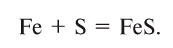
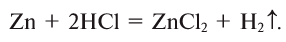
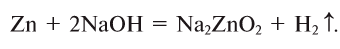
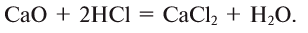
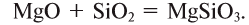
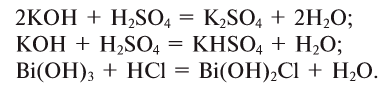
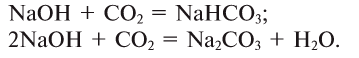
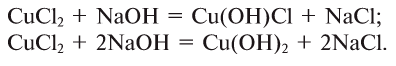
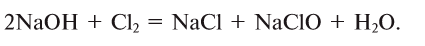
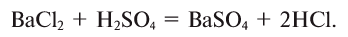
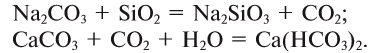
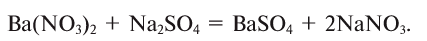
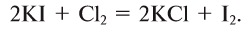

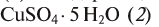
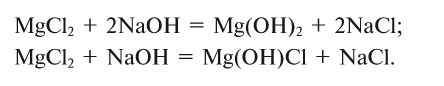
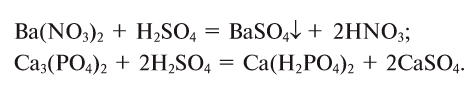
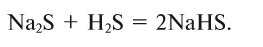
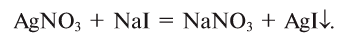

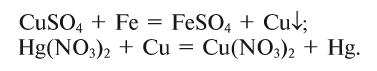
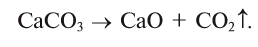

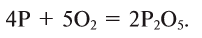
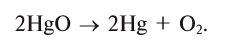
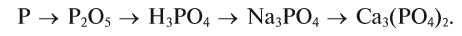
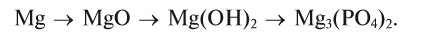
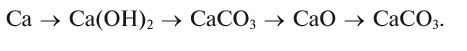
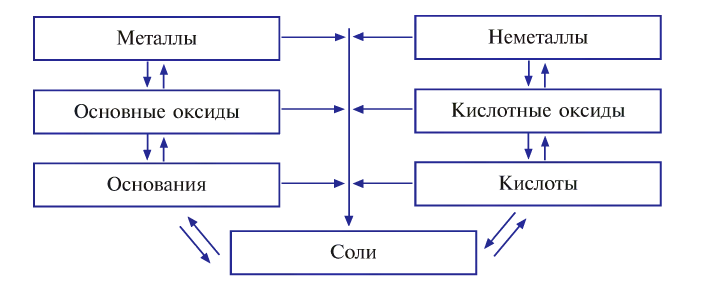

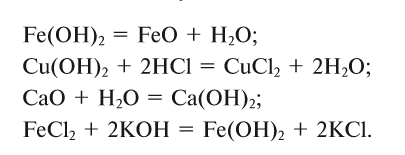
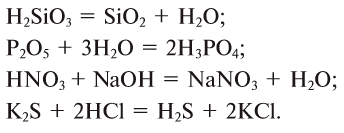
 и др.
и др. и др.
и др.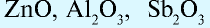 и др.
и др.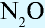 и др.
и др.