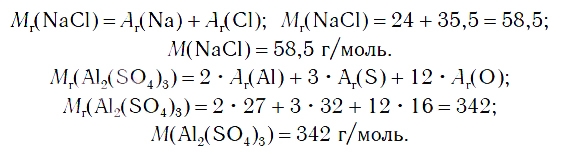В уроке 25 «Соли» из курса «Химия для чайников» узнаем, как правильно называть соли, их состав и научимся составлять химические формулы солей.
Как отмечалось в предыдущем уроке, в реакциях кислот с металлами выделяется простое вещество водород Н2. Кроме водорода, образуются и сложные вещества: ZnCl2, MgSO4 и др. Это представители класса широко распространенных в химии соединений — солей (рис. 102).
Здесь же мы рассмотрим состав солей, научимся составлять их формулы, узнаем, как называть соли.
Cостав солей
Сравним формулы кислот HCl и H2SO4 c формулами солей ZnCl2 и FeSO4. Мы видим, что в этих формулах одинаковые кислотные остатки Cl(I) и SO4(II). Но в молекулах кислот они соединены с атомами водорода Н, а в формульных единицах солей — с атомами цинка Zn и железа Fe. Значит, эти и другие соли можно рассматривать как продукты замещения атомов водорода в молекулах кислот на атомы металлов. Вещества, подобные ZnCl2 и FeSO4, относят к классу солей.
Соли — это сложные вещества, состоящие из атомов металлов и кислотных остатков.
В солях кислотные остатки соединяются с атомами металлов в соответствии с их валентностью. Для составления химической формулы соли необходимо знать валентность атома металла и валентность кислотного остатка. При этом пользуются тем же правилом, что и при составлении формул бинарных соединений. Для солей это правило следующее: сумма единиц валентности всех атомов металла должна быть равна сумме единиц валентности всех кислотных остатков.
Для примера составим формулу соли, в которую входят атомы кальция и кислотный остаток фосфорной кислоты PO4(III). Кальций проявляет постоянную валентность II, а валентность кислотного остатка PO4 равна III.
Названия солей
Соли образованы атомами разных металлов и различными кислотными остатками. Поэтому состав солей самый разнообразный. Давайте научимся давать им правильные названия.
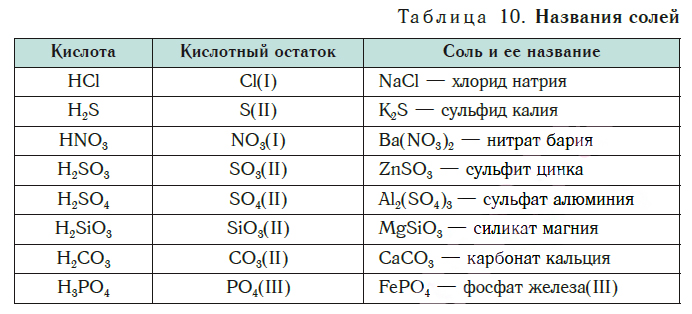
Название соли состоит из названия кислотного остатка и названия металла в родительном падеже. Например, соль состава NaCl называют «хлорид натрия».
Если входящий в формульную единицу соли атом металла имеет переменную валентность, то она указывается римской цифрой в круглых скобках после его названия. Так, соль FeCl3 называют «хлорид железа(III)», а cоль FeCl2 — «хлорид железа(II)».
В таблице 10 приведены названия некоторых солей.
Соли — это вещества немолекулярного строения. Поэтому их состав выражают с помощью формульных единиц. В них отражено соотношение атомов металлов и кислотных остатков. Например, в формульной единице NaCl на один атом Na приходится один кислотный остаток Cl.
По химической формуле соли можно вычислить ее относительную формульную массу Mr, а также молярную массу M, например:
К солям относится не только поваренная соль (NaCl), но и мел, мрамор (СаСО3), сода (Na2CO3), марганцовка (KMnO4) и др.
Краткие выводы урока:
- Соли — сложные вещества, которые состоят из атомов металлов и кислотных остатков.
- Соли образуются при замещении атомов водорода в молекулах кислот на атомы металлов.
- Соли — вещества немолекулярного строения.
Надеюсь урок 25 «Соли» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Методическая
разработка:
«Алгоритм
составления названий и формул солей».
При изучении химии в 8
классе учащиеся сталкиваются с затруднениями в названии химических веществ и
составления формул химических соединений. Для лучшего усвоения данного
материала им помогут «Алгоритмы» — краткая запись последовательности действий.
При составлении
названий и формул солей необходимо знать состав и название кислот, и
соответственно название кислотных остатков, входящих в эти кислоты. Для
удобства, они указаны в данной разработке.
Названия
кислот и кислотных остатков этих кислот, образующих соли.
—
HCl соляная
кислота Cl хлорид
—
HF фтороводородная
кислота F фторид
—
HBr бромоводородная
кислота Br бромид
—
HI иодоводородная
кислота I иодид
2-
H2S
сероводородная кислота S сульфид
2-
H2SO3
сернистая кислота SO3
сульфит
2-
H2SO4
серная
кислота SO4
сульфат
—
HNO3
азотная кислота NO3 нитрат
—
HNO2
азотистая кислота NO2
нитрит
2-
H2CO3
угольная
кислота CO3
карбонат
2-
H2SiO3
кремниевая
кислота SiO3 силикат
3-
H3PO4
фосфорная кислота PO4
фосфат
АЛГОРИТМ
СОСТАВЛЕНИЯ НАЗВАНИЙ СОЛЕЙ.
Соли – сложные
химические соединения, состоящие из ионов металла, связанного с ионами
кислотного остатка.
При составлении
названия соли, совершаются поочередно следующие шаги:
1. Называется
кислотный остаток, который стоит в формуле соли в конце.
2. Называется
металл ( в родительном падеже). Он записан перед кислотным остатком.
3. Если
заряд металла переменный, в скобках указывается валентность металла.
ПРИМЕР:
CuSO4
сульфат меди (II) NaCl хлорид
натрия
АЛГОРИТМ
СОСТАВЛЕНИЯ ФОРМУЛ СОЛЕЙ.
1. Записываем
химические символы металла и кислотного остатка, образующих соль. Металл
записываем перед кислотным остатком.
2. Над
хим. элементами указываем заряды ионов металла и кислотного остатка.
3. Находим
Наименьшее Общее Кратное между зарядами ионов.
4. НОК
делим поочередно: на заряд металла и заряд кислотного остатка.
5. Ставим
полученные при расчете индексы справа, внизу возле химических элементов. Если
кислотных остатков несколько, заключаем его в скобки. Индекс ставиться за
скобками.
ПРИМЕР:
Нитрат железа (III)
1. Fe
NO3
2.
3+
_
Fe NO3
3.
3
3+
—
Fe NO3
4. 3
: 3 = 1 , 3 :1 = 3
5. Fe(NO3)3
Сульфат
алюминия
1. Al
SO4
2. 3+
2-
Al
SO4
3.
6
3+
2-
Al SO4
4. 6
:3 = 2 , 6 :2 = 3
5. Al2(SO4)3
План урока:
Оксиды
Кислоты
Основания
Соли
Оксиды
В состав оксидов ВСЕГДА входит ТОЛЬКО два элемента, один из которых будет кислород. В этом классе соединений срабатывает правило, третий элемент лишний, он не запасной, его просто не должно быть. Второе правило, степень окисления кислорода равна -2. Из выше сказанного, определение оксидов будет звучать в следующем виде.
Оксиды в природе нас окружают повсюду, честно говоря, сложно представить нашу планету без двух веществ – это вода Н2О и песок SiO2.
Вы можете задаться вопросом, а что бывают другие бинарные соединения с кислородом, которые не будут относиться к оксидам.
Поранившись, Вы обрабатываете рану перекисью водорода Н2О2. Или для примера соединение с фтором OF2. Данные вещества вписываются в определение, так как состоят из 2 элементов и присутствует кислород. Но давайте определим степени окисления элементов.
Данные соединения не относятся к оксидам, так как степень окисления кислорода не равна -2.
Кислород, реагируя с простыми, а также сложными веществами образует оксиды. При составлении уравнения реакции, важно помнить, что элементу О свойственна валентность II (степень окисления -2), а также не забываем о коэффициентах. Если не помните, какую высшую валентность имеет элемент, советуем Вам воспользоваться периодической системой, где можете найти формулу высшего оксида.
Рассмотрим на примере следующих веществ кальций Са, мышьяк As и алюминий Al.
Подобно простым веществам реагируют с кислородом сложные, только в продукте будет два оксида. Помните детский стишок, а синички взяли спички, море синее зажгли, а «зажечь» можно Чёрное море, в котором содержится большое количество сероводорода H2S. Очевидцы землетрясения, которое произошло в 1927 году, утверждают, что море горело.
Чтобы дать название оксиду вспомним падежи, а именно родительный, который отвечает на вопросы: Кого? Чего? Если элемент имеет переменную валентность в скобках её необходимо указать.
Классификация оксидов строится на основе степени окисления элемента, входящего в его состав.
Реакции оксидов с водой определяют их характер. Но как составить уравнение реакции, а тем более определить состав веществ, строение которых Вам ещё не известно. Здесь приходит очень простое правило, необходимо учитывать, что эта реакция относиться к типу соединения, при которой степень окисления элементов не меняется.
Возьмём основный оксид, степень окисления входящего элемента +1, +2(т.е. элемент одно- или двухвалентен). Этими элементами будут металлы. Если к этим веществам прибавить воду, то образуется новый класс соединений – основания, состава Ме(ОН)n, где n равно 1, 2 или 3, что численно отвечает степени окисления металла, гидроксильная группа ОН- имеет заряд –(минус), что отвечает валентности I.При составлении уравнений не забываем о расстановке коэффициентов.
Аналогично реагируют с водой и кислотные оксиды, только продуктом будет кислота, состава НхЭОу. Как и в предыдущем случае, степень окисления не меняется, тип реакции — соединение. Чтобы составить продукт реакции, ставим водород на первое место, затем элемент и кислород.
Особо следует выделить оксиды неметаллов в степени окисления +1 или +2, их относят к несолеобразующим. Это означает, что они не реагируют с водой, и не образуют кислоты либо основания. К ним относят CO, N2O, NO.
Чтобы определить будет ли оксид реагировать с водой или нет, необходимо обратиться в таблицу растворимости. Если полученное вещество растворимо в воде, то реакция происходит.
Золотую середину занимают амфотерные оксиды. Им могут соответствовать как основания, так и кислоты, но с водой они не реагируют. Они образованные металлами в степени окисления +2 или +3, иногда +4. Формулы этих веществ необходимо запомнить.
Кислоты
Если в состав оксидов обязательно входит кислород, то следующий класс узнаваем будет по наличию атомов водорода, которые будут стоять на первом месте, а за ними следовать, словно нитка за иголкой, кислотные остатки.
В природе существует большое количество неорганических кислот. Но в школьном курсе химии рассматривается только их часть. В таблице 1 приведены названия кислот.
Валентность кислотного остатка определяется количеством атомов водорода. В зависимости от числа атомов Н выделяют одно- и многоосновные кислоты.
Если в состав кислоты входит кислород, то они называются кислородсодержащими, к ним относится серная кислота, угольная и другие. Получают их путём взаимодействия воды с кислотными оксидами. Бескислородные кислоты образуются при взаимодействии неметаллов с водородом.
Только одну кислоту невозможно получить подобным способом – это кремниевую. Отвечающий ей оксид SiO2 не растворим в воде, хотя честно говоря, мы не представляем нашу планету без песка.
Основания
Для этого класса соединений характерно отличительное свойство, их ещё называют вещества гидроксильной группы — ОН.
Чтобы дать название, изначально указываем класс – гидроксиды, потом добавляем чего, какого металла.
Классификация оснований базируется на их растворимости в воде и по числу ОН-групп.
Следует отметить, что гидроксильная группа, также как и кислотный остаток, это часть целого. Невозможно получить кислоты путём присоединения водорода к кислотному остатку, аналогично, чтобы получить основание нельзя писать уравнение в таком виде.
Na + OH →NaOH или H2 + SO4→ H2SO4
В природе не существуют отдельно руки или ноги, эта часть тела. Варианты получения кислот были описаны выше, рассмотрим, как получаются основания. Если к основному оксиду прибавить воду, то результатом этой реакции должно получиться основание. Однако не все основные оксиды реагируют с водой. Если в продукте образуется щёлочь, значит, реакция происходит, в противном случае реакция не идёт.
Данным способом можно получить только растворимые основания. Подтверждением этому служат реакции, которые вы можете наблюдать. На вашей кухне наверняка есть алюминиевая посуда, это могут быть кастрюли или ложки. Эта кухонная утварь покрыта прочным оксидом алюминия, который не растворяется в воде, даже при нагревании. Также весной можно наблюдать, как массово на субботниках белят деревья и бордюры. Берут белый порошок СаО и высыпают в воду, получая гашеную известь, при этом происходит выделение тепла, а это как вы помните, признак химического процесса.
Раствор щёлочи можно получить ещё одним методом, путём взаимодействия воды с активными металлами. Давайте вспомним, где они размещаются в периодической системе – I, II группа. Реакция будет относиться к типу замещения.
Напрашивается вопрос, а каким же образом получаются нерастворимые основания. Здесь на помощь придёт реакция обмена между щёлочью и растворимой солью.
Соли
С представителями веществ этого класса вы встречаетесь ежедневно на кухне, в быту, на улице, в школе, сельском хозяйстве.
Объединяет все эти вещества, что они содержат атомы металла и кислотный остаток. Исходя из этого, дадим определение этому классу.
Средние соли – это продукт полного обмена между веществами, в которых содержатся атомы металла и кислотный остаток (КО) (мы помним, что это часть чего-то, которая не имеет возможности существовать отдельно).
Выше было рассмотрено 3 класса соединений, давайте попробуем подобрать комбинации, чтобы получить соли, типом реакции обмена.
Чтобы составить название солей, необходимо указать название кислотного остатка, и в родительном падеже добавить название металла.
Ca(NO3)2– нитрат (чего) кальция, CuSO4– сульфат (чего) меди (II).
Наверняка многие из вас что-то коллекционировали, машинки, куклы, фантики, чтобы получить недостающую модель, вы менялись с кем-то своей. Применим этот принцип и для получения солей. К примеру, чтобы получить сульфат натрия необходимо 2 моль щёлочи и 1 моль кислоты. Допустим, что в наличии имеется только 1 моль NaOH, как будет происходить реакция? На место одного атома водорода станет натрий, а второму Н не хватило Na. Т.е в результате не полного обмена между кислотой и основанием получаются кислые соли. Название их не отличается от средних, только необходимо прибавить приставку гидро.
Однако бывают случаи, с точностью наоборот, не достаточно атомов водорода, чтобы связать ОН-группы. Результатом этой недостачи являются основные соли. Допустим реакция происходит между Ва(ОН)2 и HCl. Чтобы связать две гидроксильные группы, требуется два водорода, но предположим, что они в недостаче, а именно в количестве 1. Реакция пойдёт по схеме.
Особый интерес и некоторые затруднения вызывают комплексные соли, своим внешним, казалось,громоздким и непонятным видом, а именно квадратными скобками:K3[Fe(CN)6] или [Ag(NH3)2]Cl. Но не страшен волк, как его рисуют, гласит поговорка. Соли состоят из катионов (+) и анионов (-). Аналогично и с комплексными солями.
Образует комплексный ион элемент-комплексообразователь, обычно это атом металла, которого, как свита, окружают лиганды.
Источник
Теперь необходимо справиться с задачей дать название этому типу солей.
Попробуем дать название K3[Fe(CN)6]. Существует главный принцип, чтение происходит справа налево. Смотрим, количество лигандов, а их роль выполняют циано-группы CN−, равно 6 – приставка гекса. В комплексообразователем будут ионы железа. Значит, вещество будет иметь название гексацианоферрат(III) (чего) калия.
Образование комплексных солей происходит путём взаимодействия, к примеру, амфотерных оснований с растворами щелочей. Амфотерность проявляется способностью оснований реагировать как с кислотами, так и щелочами. Так возьмём гидроксид алюминия или цинка и подействуем на них кислотой и щёлочью.
В природе встречаются соли, где на один кислотный остаток приходится два разных металла. Примером таких соединений служат алюминиевые квасцы, формула которых имеет вид KAl(SO4)2. Это пример двойных солей.
Из всего вышесказанного можно составить обобщающую схему, в которой указаны все классы неорганических соединений.
|
Составьте формулы солей натрия, кальция и алюминия азотной, серной и фосфорной кислот. Какие из этих солей растворимы в воде? (Габриелян. Химия. 8 класс. Параграф 17, № 2) NaNO3- растворима Ca(NO3)2-растворима Al(NO3)3-растворима Na2SO4-растворима CaSO4-малорастворима Al2(SO4)3-растворима Na3PO4-растворима Ca3(PO4)2-растворима AlPO4-нерастворима Знаете ответ? |
Смотрите также: ВПР по химии 8 класс 2020, задания, ответы, демоверсии, где найти? Химия 8 класс учебник Аббасов, где читать онлайн, краткое содержание? Химия 8 класс учебник Усманова, Сакарьянова, где читать онлайн? Химия 8 класс учебник Григорович, где читать онлайн, краткое содержание? Химия 8 класс учебник Еремин, Кузьменко, Дроздов, Лунин, где читать онлайн? Химия 8 класс учебник Габриелян, где читать онлайн, краткое содержание? Химия 8 класс учебник Кузнецова, Титова, Гара, где читать онлайн? ВПР 2022, химия, 8 класс, все варианты с ответами — где найти, скачать? ВПР по химии 8 класс 2021, задания, ответы, демоверсии, где найти? ВПР по химии 8 класс с ответами 2019 год все варианты — где найти/скачать? |
Основы деления солей на отдельные группы были заложены в трудах французского химика и аптекаря Г. Руэля ((1703)–(1770)). Именно он в (1754) г. предложил разделить известные к тому времени соли на кислые, основные и средние (нейтральные). В настоящее время выделяют и другие группы этого чрезвычайно важного класса соединений.
Средними называют соли, в состав которых входят металлический химический элемент и кислотный остаток.
В состав солей аммония вместо металлического химического элемента входит одновалентная группа аммония
NH4I
.
Примеры средних солей:
— хлорид натрия;
Al2IIISO4II3
— сульфат алюминия;
NHI4NO3I
— нитрат аммония.
Кислыми называют соли, в состав которых, кроме металлического химического элемента и кислотного остатка, входят атомы водорода.
Кислые соли можно считать продуктом неполной нейтрализации многоосновной кислоты.
Обрати внимание!
Составляя формулы кислых солей, следует иметь в виду, что валентность остатка от кислоты численно равна количеству атомов водорода, входивших в состав молекулы кислоты и замещённых металлом.
При составлении названия такого соединения к названию соли добавляется приставка «гидро», если в остатке от кислоты имеется один атом водорода, и «дигидро», если в остатке от кислоты содержатся два атома водорода.
— гидрокарбонат кальция;
Na2IHPO4⏞II
— гидрофосфат натрия;
NaIH2PO4⏞I
— дигидрофосфат натрия.
Простейшим примером кислых солей может служить пищевая сода, т. е. гидрокарбонат натрия (NaHCO_3).
Основными называют соли, в состав которых, кроме металлического химического элемента и кислотного остатка, входят гидроксогруппы.
Основные соли можно рассматривать как продукт неполной нейтрализации многокислотного основания.
Обрати внимание!
Составляя формулы таких веществ, следует иметь в виду, что валентность остатка от основания численно равна количеству гидроксогрупп, «ушедших» из состава основания.
При составлении названия основной соли к названию соли добавляется приставка «гидроксо», если в остатке от основания имеется одна гидроксогруппа, и «дигидроксо», если в остатке от основания содержатся две гидроксогруппы.
— гидроксохлорид магния;
FeOH⏞IINO32I
— гидроксонитрат железа((III));
FeOH2⏞INO3I
— дигидроксонитрат железа((III)).
Известным примером основных солей может служить налёт зелёного цвета гидроксокарбоната меди((II)) ((CuOH)_2CO_3), образующийся с течением времени на медных предметах и предметах, изготовленных из сплавов меди, если они контактируют с влажным воздухом. Такой же состав имеет и минерал малахит.
Комплексные соединения — разнообразный класс веществ. Заслуга в создании теории, объясняющей их состав и строение, принадлежит лауреату Нобелевской премии по химии (1913) г. швейцарскому учёному А. Вернеру ((1866)–(1919)). Правда, термин «комплексные соединения» в (1889) г. был введён другим выдающимся химиком, лауреатом Нобелевской премии (1909) г. В. Оствальдом ((1853)–(1932)).
В составе катиона или аниона комплексных солей имеется элемент-комплексообразователь, связанный с так называемыми лигандами. Число лигандов, которое присоединяет комплексообразователь, называется координационным числом. Например, координационное число двухвалентной меди, а также бериллия, цинка, равно (4). Координационное число алюминия, железа, трёхвалентного хрома равно (6).
В названии комплексного соединения число лигандов, соединённое с комплексообразователем, отображается греческими числительными: (2) — «ди», (3) — «три», (4) — «тетра», (5) — «пента», (6) — «гекса». В качестве лигандов могут выступать как электрически нейтральные молекулы, так и ионы.
Название комплексного аниона начинается с указания состава внутренней сферы.
Если в качестве лигандов выступают анионы, к их названию добавляется окончание «–о»:
(–Cl) — хлоро-, (–OH) — гидроксо-, (–CN) — циано-.
Если лигандами являются электрически нейтральные молекулы воды, используется название «аква», а если аммиака — название «аммин».
Затем называют комплексообразователь, используя его латинское название и окончание «–ат», после чего без пробела римскими цифрами в скобках указывают степень окисления (если комплексообразователь может иметь несколько степеней окисления).
После обозначения состава внутренней сферы указывают название катиона внешней сферы — той, что в химической формуле вещества находится вне квадратных скобок.
Пример:
— тетрагидроксоцинкат калия,
K3AlOH6
— гексагидроксоалюминат калия,
K4FeCN6
— гексацианоферрат((II)) калия.
В школьных учебниках формулы комплексных солей более сложного состава, как правило, упрощаются. Например, формулу тетрагидроксодиакваалюмината калия
KAlH2O2OH4
принято записывать как формулу тетрагидроксоалюмината.
Если комплексообразователь входит в состав катиона, то название внутренней сферы составляют так же, как в случае комплексного аниона, но используют русское название комплексообразователя и в скобках указывают степень его окисления.
Пример:
— хлорид диамминсеребра,
CuH2O4SO4
— сульфат тетрааквамеди((II)).
Гидратами называют продукты присоединения воды к частичкам вещества (термин образован от греческого hydor — «вода»).
Многие соли выпадают в осадок из растворов в виде кристаллогидратов — кристаллов, содержащих молекулы воды. В кристаллогидратах молекулы воды прочно связаны с катионами или анионами, образующими кристаллическую решётку. Многие соли такого вида по сути являются комплексными соединениями. Хотя многие из кристаллогидратов известны с незапамятных времён, начало систематическому изучению их состава положил голландский химик Б. Розебом ((1857)–(1907)).
В химических формулах кристаллогидратов принято указывать соотношение количества вещества соли и количество вещества воды.
Обрати внимание!
Точка, которая делит химическую формулу кристаллогидрата на две части, в отличие от математических выражений не обозначает действие умножения и читается как предлог «с».
Например, химическая формула
Na2SO4⋅10H2O
читается так:
«натрий-два-эс-о-четыре-с-десятью-аш-два-о».
В названии при помощи греческого числительного (а для числа (9) — латинского) указывается количество вещества воды в моле кристаллогидрата, затем слитно следует слово «гидрат», а за ним (раздельно) — систематическое, т. е. международное, название соли.
Пример:
— дигидрат сульфата кальция;
CuSO4⋅5H2O
— пентагидрат сульфата меди((II)).
Для названия целого ряда кристаллогидратов, кроме систематического, используют и исторические (тривиальные) названия. Например, гемигидрат сульфата кальция
CaSO4⋅0.5H2O
называют жжёным гипсом, пентагидрат сульфата меди((II))
CuSO4⋅5H2O
называют медным купоросом, а декагидрат карбоната натрия
Na2CO3⋅10H2O
— кристаллической содой.