Определение и формула
Неорганическое химическое соединение, являющееся солью гидроксида аммония и угольной кислоты.
Альтернативное название – углекислый аммоний.
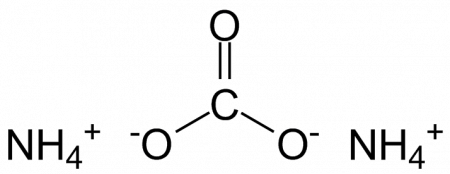
Формула
(NH4)2CO3.
Получение
Соединение синтезируют преимущественно химическим путем. Получение из натуральных ингредиентов утратило актуальность.
Естественные источники получения
До расцвета химической промышленности для получения углекислого аммония использовались вещества натурального происхождения, содержащие в составе азот, – ногтевые платины, волосы, костные выросты, рога. Они подвергались высокотемпературной дистилляции. В настоящее время способ устарел.
Искусственные источники получения
В лабораторных условиях и промышленности карбонат аммония получают тремя способами:
- Путем разложения хлористого аммония.
- При пропускании углекислого газа через водный раствор аммиака.
- При смешивании газообразного аммиака, водяных паров и углекислого газа.
Свойства карбоната аммония
Физические свойства соединения
Углекислый аммоний – это белое кристаллическое вещество, отлично растворимое в воде. И твердая форма, и водные растворы на воздухе не устойчивы. Они быстро разлагаются на составляющие компоненты. В ходе реакции улетучивается аммиак и остается кислая соль – гидрокарбонат аммония NH4HCO3.
| Свойство | Описание |
|---|---|
| плотность | 1,6 г/см³ |
| молярная масса | 96 г/моль |
| температура разложения | 60°C |
| растворимость в воде | 100,1 (15°C) |
Химические свойства
Карбонат аммония демонстрирует свойства, характерные для своего класса соединений.
- Подвергается гидролизу по катиону и аниону как соль, образованная слабым основанием и слабой кислотой.
(NH4)2CO3+ HOH ↔ NH4CO3 + NH4OH
Диссоциация на ионы:
(NH4)2CO3↔ 2NH4+ + CO32-
Гидролиз по катиону:
NH4+ + HOH↔NH4OH + H+
Гидролиз по аниону:
CO32- + HOH ↔ HCO3— + OH—
Ионное уравнение:
2NH4+ + CO32- + HOH ↔ HCO3— + NH4OH
- Разлагается при термическом воздействии.
(NH4)2CO3 → CO2↑ + 2NH3↑ + H2O↑
- Вступает в реакции с кислотами (любыми, так как угольная кислота самая слабая среди неорганических).
(NH4)2CO3+ H2SO4 → (NH4)2SO4 + CO2↑ + H2O
- Взаимодействует с основаниями.
(NH4)2CO3+ NaOH → Na2CO3 + 2NH3↑ + 2H2O
- Вступает во взаимодействие с другими солями.
(NH4)2CO3+СaCl2 → CaCO3↓ + 2NH4Cl
Практическое применение карбоната аммония
Углекислый аммоний используется в разных сферах:
• в пищевой промышленности как заменитель дрожжей (за счет выделения углекислого газа);
• в качестве сырья для получения сульфата аммония;
• для осаждения солей магния при добыче калия из морской воды;
• в производстве косметики в качестве красящего соединения;
• в фармацевтической промышленности при производстве лекарств от кашля и нашатыря;
• для ускорения процесса ферментации при производстве вина;
• в качестве одного из компонентов составов для тушения огня.
Тест по теме «Карбонат аммония»
| Карбонат аммония | |
|---|---|
 |
|
 |
|
| Традиционные названия | углекислый аммоний |
| Хим. формула | (NH4)2CO3 |
| Плотность | 1,6 г/см³ |
| Температура | |
| • разложения | 60 °C |
| Растворимость | |
| • в воде | растворим (0 °C) 100,1 (15 °C) Разл. (100 °C) |
| ГОСТ | ГОСТ 3770-75 ГОСТ 9325-79 |
| Рег. номер CAS | 506-87-6 |
| PubChem | 10480 |
| Рег. номер EINECS | 208-058-0 |
| SMILES |
C(=O)(O)O.N.N |
| InChI |
1S/CH2O3.2H3N/c2-1(3)4;;/h(H2,2,3,4);2*1H3 PRKQVKDSMLBJBJ-UHFFFAOYSA-N |
| Кодекс Алиментариус | E503i |
| ChEBI | 10048 |
| ChemSpider | 10048 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Карбонат аммония, углекислый аммоний, (NH4)2CO3 — аммониевая соль угольной кислоты.
Содержание
- 1 Свойства
- 2 Применение
Свойства
Бесцветные кристаллы соединения хорошо растворимы в воде. Карбонат аммония очень неустойчив как на воздухе, так и в растворе, так как уже при комнатной температуре выделяет аммиак, превращаясь в гидрокарбонат аммония NH4HCO3. При температуре 60 °C быстро распадается на NH3, CO2 и H2O.
Подвергается гидролизу:
-
- (NH4)2CO3 + H2O ⇄ NH4HCO3 + NH4OH
Применение
На процессе разложения, связанном с выделением газов, основано применение карбоната аммония вместо дрожжей в хлебопечении и кондитерской промышленности (пищевая добавка E503). Получают карбонат аммония взаимодействием газообразных NH3, CO2 и H2O при быстром охлаждении продуктов реакции. Технический продукт содержит наряду с (NH4)2CO3 соединение гидрокарбоната аммония с карбаминатом аммония NH4HCO3 ⋅ NH4COONH2.
Карбонат аммония применяется для получения сульфата аммония из гипса по реакции
-
- (NH4)2CO3 + CaSO4 → (NH4)2SO4 + CaCO3
При этом карбонат аммония можно вводить в виде раствора (жидкостный процесс конверсии), вместо карбоната аммония можно вводить газообразные NH3 и CO2 (газовый процесс конверсии), а также можно вводить газообразные NH3 и CO2 дополнительно к раствору (NH 4)2CO3 в количестве 10—15 % стехиометрического количества в расчёте на CaSO4 (газожидкостный процесс конверсии). В последнем случае при растворении газов выделяется дополнительная теплота, необходимая для протекания реакции. Карбонат аммония может рассматриваться как источник карбонат-ионов и в перспективе может применяться, например, для осаждения солей магния для отделения его от солей калия. При добыче калия из морской воды соли калия выделяются вместе с солями магния и не могут быть очищены от него перекристаллизацией. При добавлении карбоната аммония магний выпадает в осадок в виде карбоната, в растворе остаются в основном хлорид калия и хлорид аммония, которые впоследствии могут быть разделены (рекристаллизацией или возгонкой), либо не разделяться, а использоваться как азотно-калийное удобрение. Также карбонат аммония применяется:
- в лекарственных препаратах (сиропы от кашля, нашатырь и др.);
- в качестве ускорителя ферментации при производстве вина;
- в качестве компонента огнетушащих составов
- в косметике в качестве красителей
- в качестве компонента раствора чистки стволов огнестрельного оружия (РЧС)
|
Соединения аммония |
|---|
|
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
From Wikipedia, the free encyclopedia

|
|

|
|

|
|
| Names | |
|---|---|
| IUPAC name
Ammonium carbonate |
|
Other names
|
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChemSpider |
|
| ECHA InfoCard | 100.007.326 |
| EC Number |
|
| E number | E503(i) (acidity regulators, …) |
|
IUPHAR/BPS |
|
|
PubChem CID |
|
| UNII |
|
| UN number | 3077 |
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
(NH4)2CO3 |
| Molar mass | 96.09 g/mol |
| Appearance | White powder |
| Density | 1.50 g/cm3 |
| Melting point | 58 °C (136 °F; 331 K) (decomposes) |
|
Solubility in water |
100 g/100 ml (15°C)[1] 25 g/100 ml (20°C) |
|
Magnetic susceptibility (χ) |
-42.50·10−6 cm3/mol |
| Hazards | |
| Occupational safety and health (OHS/OSH): | |
|
Main hazards |
Irritant |
| GHS labelling: | |
|
Pictograms |

|
|
Signal word |
Warning |
|
Hazard statements |
H302, H319 |
| Safety data sheet (SDS) | External MSDS |
| Related compounds | |
|
Other anions |
Ammonium bicarbonate Ammonium carbamate |
|
Other cations |
Sodium carbonate Potassium carbonate |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Ammonium carbonate is a salt with the chemical formula (NH4)2CO3. Since it readily degrades to gaseous ammonia and carbon dioxide upon heating, it is used as a leavening agent and also as smelling salt. It is also known as baker’s ammonia and is a predecessor to the more modern leavening agents baking soda and baking powder. It is a component of what was formerly known as sal volatile and salt of hartshorn,[2] and produces a pungent smell when baked.
Production[edit]
Ammonium carbonate is produced by combining carbon dioxide and aqueous ammonia. About 80,000 tons/year were produced as of 1997. 2NH3 + H2O + CO2 → (NH4)2CO3[2]
An orthorhombic monohydrate is known. It crystallizes in an ammonia solution exposed in a carbon dioxide-rich atmosphere.[3]
Decomposition[edit]
Ammonium carbonate slowly decomposes at standard temperature and pressure through two pathways. Thus any initially pure sample of ammonium carbonate will soon become a mixture including various byproducts.
Ammonium carbonate can spontaneously decompose into ammonium bicarbonate and ammonia:
- (NH4)2CO3 → NH4HCO3 + NH3
Which further decomposes to carbon dioxide, water and another molecule of ammonia:
- NH4HCO3 → H2O + CO2 + NH3
Uses[edit]
Leavening agent[edit]
Ammonium carbonate may be used as a leavening agent in traditional recipes, particularly those from northern Europe and Scandinavia (e.g. Amerikaner, Speculoos, Tunnbröd or Lebkuchen). It was the precursor to today’s more commonly used baking powder.
Originally made from ground deer horn and called hartshorn, today it is called baker’s ammonia. It is prepared by the sublimation of a mixture of ammonium sulfate and calcium carbonate and occurs as a white powder or a hard, white or translucent mass.[4] It acts as a heat activated leavening agent and breaks down into carbon dioxide (leavening), ammonia (which needs to dissipate) and water. It is sometimes combined with sodium bicarbonate to mimic as a double acting baking powder and to help mask any ammonia smell not baked out.
It also serves as an acidity regulator and has the E number E503. It can be replaced with baking powder, but this may affect both the taste and texture of the finished product. Baker’s ammonia should be used to create thin dry baked goods like crackers and cookies. This allows the strong ammonia smell to bake out. It should not be used to make moist baked items like cake since ammonia is hydrophilic and will leave a strong bitter taste.
Its use as a leavening agent, with associated controversy, goes back centuries:
In the third kind of bread, a vesicular appearance is given to it by the addition to the dough of some ammoniacal salt, (usually the sub-carbonate,) which becomes wholly converted into a gaseous substance during the process of baking, causing the dough to swell out into little air vessels, which finally bursting, allow the gas to escape, and leave the bread exceedingly porous. Mr. Accum, in his Treatise on Culinary Poisons, has stigmatized this process as «fraudulent,» but, in our opinion, most unjustly. The bakers would never adopt it but from necessity: when good yeast cannot be procured, it forms an admirable and perfectly harmless substitute; costing the baker more, it diminishes his profit, while the consumer is benefited by the bread retaining the solid matter, which by the process of fermentation is dissipated in the form of alcohol and carbonic acid gas.[5]
Other uses[edit]
Ammonium carbonate is the main component of smelling salts, although the commercial scale of their production is small. Buckley’s cough syrup from Canada today uses ammonium carbonate as an active ingredient intended to help relieve symptoms of bronchitis. It is also used as an emetic. It is also found in smokeless tobacco products, such as Skoal, and it is used in aqueous solution as a photographic lens cleaning agent, such as Eastman Kodak’s «Kodak Lens Cleaner.»
It is also used for luring of apple maggots in Washington State, to monitor the spread of the infestation and adjust the borders of the Apple Maggot Quarantine Area.[6]
See also[edit]
- Ammonium bicarbonate
- Ammonium nitrate
- Sal ammoniac, the mineralogical form of ammonium chloride
References[edit]
- ^ John Rumble (June 18, 2018). CRC Handbook of Chemistry and Physics (99th ed.). CRC Press. pp. 4–40. ISBN 978-1138561632.
- ^ a b Karl-Heinz Zapp (2012). «Ammonium Compounds». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a02_243. ISBN 978-3527306732.
- ^ Fortes, A.D.; Wood, I.G.; Alfè, D.; Hernàndez, E.R.; Gutmann, M.J.; Sparkes, H.A. (2014-12-01). «Structure, hydrogen bonding and thermal expansion of ammonium carbonate monohydrate». Acta Crystallographica Section B. 70 (6): 948–962. doi:10.1107/S205252061402126X. ISSN 2052-5206. PMC 4468514. PMID 25449618. Retrieved 2021-08-20.
- ^ «CFR — Code of Federal Regulations Title 21». www.accessdata.fda.gov. Retrieved 2018-02-07.
- ^ «Bread». The Engineer’s and Mechanic’s Encyclopedia. Vol. 1. Luke Hebert. 1849. p. 239.
- ^ Yee, Wee L.; Nash, Meralee J.; Goughnour, Robert B.; Cha, Dong H.; Linn, Charles E.; Feder, Jeffrey L. (2014). «Ammonium Carbonate is More Attractive Than Apple and Hawthorn Fruit Volatile Lures to Rhagoletis pomonella(Diptera: Tephritidae) in Washington State». Environmental Entomology. 43 (4): 957–968. doi:10.1603/en14038. PMID 24915519. S2CID 31174719.
Поиск химических веществ по названиям или формулам.
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Языки:
По умолчанию |
Все возможные |
Из списка
|
Применить к найденному
Карбонат аммония
Брутто-формула:
CH8N2O3
CAS# 506-87-6
Категории:
Неорганические соли
PubChem CID: 10480
| ChemSpider ID: 10048
| CB9393644
| CHEMBL2105849
| MolPort-006-111-520
Названия
Русский:
- Карбонат аммония(IUPAC) [Wiki]
- аммония карбонат
- углекислый аммоний
English:
- Ammonium carbonate(IUPAC) [Wiki]
- Carbonic acid diammoniate(IUPAC)
- Carbonic acid, ammonium salt(CAS)
- E503
- EINECS:233-786-0
Варианты формулы:
(NH4)2CO3
$slope(30)N`H4^+-0O`^-/C`|O|O^-# -0NH4^+
HN^+<_q4H><_p4H>HO`^-/C`|O|O^-/0H/N`^+<_q4H><_p4H>/H
Вещества, имеющие отношение…
Анион:
Карбонаты
Катион:
Аммоний
Химический состав
Реакции, в которых участвует Карбонат аммония
-
(NH4)2CO3 + 2HI -> 2NH4I + CO2″|^» + H2O
-
(NH4)2CO3 «30^oC»—> NH4HCO3 + NH3
-
(NH4)2CO3 + CO2 + H2O -> 2NH4HCO3
-
NH4HCO3 + NH3 -> (NH4)2CO3
-
(NH4)2CO3 + CaSO4 -> (NH4)2SO4 + CaCO3
И ещё 13 реакций…


