- Справочник
- Справочник структурных формул
- д
- Дигидрофосфат алюминия
Дигидрофосфат алюминия
Al(H2PO4)3
Al(+3)(H(+1)2P(+5)O(-2)4)3
HO-P<`||O><-OH>|O^-|0Al^3+<`/0O^-`/P<_p4HO>`/O/_p4OH>O`^-P<_q4OH>O`_q4HO
Брутто-формула: H6AlO12P3
From Wikipedia, the free encyclopedia

|
|

|
|
| Identifiers | |
|---|---|
|
CAS Number |
|
|
3D model (JSmol) |
|
| EC Number |
|
|
PubChem CID |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
AlH6O12P3 |
| Molar mass | 317.939 g·mol−1 |
| Appearance | white solid |
| Density | 2.37 g/cm3 |
| Hazards | |
| GHS labelling: | |
|
Pictograms |
 [1] [1]
|
|
Hazard statements |
H318 |
|
Precautionary statements |
P280, P305+P351+P338, P310 |
| Safety data sheet (SDS) | External SDS |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa). Infobox references |
Aluminium dihydrogenphosphate describes inorganic compounds with the formula Al(H2PO4)3.xH2O where x = 0 or 3. They are white solids. Upon heating these materials convert sequentially to a family of related polyphosphate salts including aluminium triphosphate (AlH2P3O10.2H2O), aluminium hexametaphosphate (Al2P6O18), and aluminium tetrametaphosphate (Al4(P4O12)3). Some of these materials are used for fireproofing and as ingredients in specialized glasses.[2]
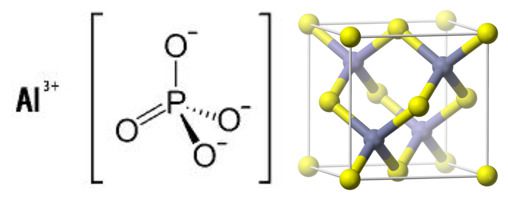
According to analysis by X-ray crystallography, the structure consists of a coordination polymer featuring octahedral Al3+ centers bridged by tetrahedral dihydrogen phosphate ligands. The dihydrogen phosphate ligands are bound to Al3+ as monodentate ligands.[3]
References[edit]
- ^ «Aluminum Phosphate Monobasic». American Elements. Retrieved January 21, 2019.
- ^ Klaus Schrödter; Gerhard Bettermann; Thomas Staffel; Friedrich Wahl; Thomas Klein; Thomas Hofmann (2008). «Phosphoric Acid and Phosphates». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a19_465.pub3. ISBN 978-3527306732.
- ^ Brodalla, D.; Kniep, R.; Mootz, D. (1981). «Eine neue Form von Al(H2PO4)3 mit dreidimensionaler Al-O-P Vernetzung» [A new form of Al(H2PO4)3 with three-dimensional Al-O-P crosslinking]. Zeitschrift für Naturforschung B. 36: 907–909. doi:10.1515/znb-1981-0803.
Поиск химических веществ по названиям или формулам.
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Языки:
По умолчанию |
Все возможные |
Из списка
|
Применить к найденному
Дигидрофосфат алюминия
Брутто-формула:
H6AlO12P3
CAS# 13530-50-2
Категории:
Неорганические соли
, Кислые соли
PubChem CID: 9818426
Названия
Русский:
- Дигидрофосфат алюминия
English:
- 100L (phosphate)
- Aluminum dihydrogen phosphate
- Aluminum dihydrogen phosphate(Al(H2PO4)3)
- Aluminum dihydrophosphate
- Aluminum phosphate (1:3)
- Aluminum phosphate monobasic
- Aluminum phosphate monobasic solution
- Aluminum triorthophosphate
- Aluminum tris(dihydrogen phosphate)
- Aluminum trisphosphate
- Aluminumtris(orthophosphate)
- Dihydrogen aluminum phosphate
- Monophix A
- Phosphoric acid, aluminum salt (3:1)
- Phosphoric acid,aluminum salt (3:1)(CAS)
- Primary aluminumphosphate
- aluminum;dihydrogen phosphate(IUPAC)
- prim-Aluminum phosphate
Варианты формулы:
Al(H2PO4)3
Al(+3)(H(+1)2P(+5)O(-2)4)3
HO-P<`||O><-OH>|O^-|0Al^3+<`/0O^-`/P<_p4HO>`/O/_p4OH>O`^-P<_q4OH>O`_q4HO
Вещества, имеющие отношение…
Анион:
Дигидрофосфаты
Химический состав
Вася Иванов
Мореплаватель — имя существительное, употребляется в мужском роде. К нему может быть несколько синонимов.
1. Моряк. Старый моряк смотрел вдаль, думая о предстоящем опасном путешествии;
2. Аргонавт. На аргонавте были старые потертые штаны, а его рубашка пропиталась запахом моря и соли;
3. Мореход. Опытный мореход знал, что на этом месте погибло уже много кораблей, ведь под водой скрывались острые скалы;
4. Морской волк. Старый морской волк был рад, ведь ему предстояло отчалить в долгое плавание.
Фосфат алюминия – это неорганическое вещество, широко применяемое в медицине, тяжёлой промышленности, отрасли производства продуктов питания, а также химии. Фосфат алюминия проявляет каталитическую активность, обладает выраженными фармацевтическими свойствами, за счёт чего активно используется для выпуска лекарственных препаратов. Особая формула алюминия фосфорнокислого позволяет использовать его в органическом синтезе и как улучшитель разрыхлителей в хлебопечении.
Содержание
- Что такое фосфат алюминия, виды, формула
- Физические свойства, внешний вид
- Химические свойства, уравнение, реакции
- Производство и получение
- Применение
- Применение алюминия фосфата в медицине
- Применение алюминия фосфата в химпроме и других сферах
- Инструкция по применению
- Показания
- Противопоказания, побочные эффекты, передозировка
- Способ применения и дозы
- Опасность, токсичность, меры предосторожности
- Где купить и сколько стоит
- Заключение
Что такое фосфат алюминия, виды, формула
Фосфат алюминия представляет собой алюминиевую соль фосфорной кислоты. Она состоит из атомов фосфора, который находится в степени окисления +5, алюминия, заряженного как +3 и кислорода с отрицательным зарядом -2. Химическая формула алюминия фосфата – AlPO4. По расположению составляющих компонентов выделяют два варианта вещества:
- альфа- AlPO4 – менее устойчив к температурным воздействиям, шестиугольный;
- бета- AlPO4 – высокая термоустойчивость, элементарная ячейка – куб.
По количеству атомов водорода, входящих в состав соединения, различают кислые и основные соли фосфатов алюминия. Они отличаются по свойствам и описываются разными формулами:
- формула алюминия трифосфата Al2(PO4)(OH)3;
- формула алюминия дигидрофосфата Al(H2PO4)3;
- формула алюминия монофостфата AlH3(PO4)2.
В природе фосфат алюминия чрезвычайно распространён. Он входит в состав более чем 15 минералов, месторождения которых расположены по всему миру. Один из них – лазулит – железно-алюминиевый фосфат представлен пирамидальными кристаллами небесно-синего цвета (формула – (Mg, Fe)Al2(OH,PO4)2). Иногда яркая окраска может отсутствовать, что обусловлено примесью магния. Характеризуется стеклянным блеском, излом неровный, черта надлома – белая. Лазулит не отличается крепкостью, его твёрдость по шкале Мооса составляет 5,5-6,5.
Химическая формула и структура фосфата алюминия
Фосфат алюминия находят в амблигонитах, которые формируют массивные агрегаты и зернистые высокоплотные массы (формула – (Li, Na)AlPO4(F,OH)). Для них характерна небольшая желтоватая люминесценция, цвет образований золотисто-жёлтый, иногда они не окрашены. Прозрачность крайне высокая, иногда минерал просвечивает, блестит. Внешне амблигонит можно перепутать с полевым шпатом, он довольно хрупкий. Его находят зачастую в литиевых рудах, в обогащённых фосфором пегматитовых жилах. Редко его подвергают огранке, такие экземпляры добывают в Бразилии, Намибии, США, Франции.
Физические свойства, внешний вид
Фосфат алюминия — это белый мелкокристаллический порошок без вкуса и запаха плотностью 2,566 г/см3. Свойство алюминия фосфата растворяться в воде выражено слабо, практически не растворим в ней и спиртах (этанол, метанол), показатель может меняться в зависимости от кислотности среды (хуже всего при pH – 4-6). Растворимость повышается в органических растворителях, таких как эфиры, фенол и бензол.
Фосфат алюминия формирует кристаллогидраты при выпаривании из водного раствора. Их общая формула – AlPO4 ∙ хH2O, где х = 2, 3, 5. При нагревании до 1800 °С вещество плавится, при достижении температурного режима 1300 °С происходит обезвоживание. Термолиз протекает при температуре 2000 °С.
Химические свойства, уравнение, реакции
Фосфат алюминия реагирует с ограниченным количеством веществ, по своим свойствам он довольно устойчив и малореактивен. При разогревании протекает реакция термического разложения:
2AlPO4 → Al2O3 + P2O5
Фосфат алюминия реагирует с хлоридом водорода, при этом образуется трёххлористый алюминий и фосфорная кислота:
AlPO4 + 3HCl → AlCl3 + H3PO4
По схожему механизму фосфат алюминия реагирует с азотной кислотой:
AlPO4 + 3HNO3 → Al(NO3)3 + H3PO4
При взаимодействии фосфата алюминия с хлористым магнием выделяется магниевый фосфат:
AlPO4 + 3MgCl2 → Mg3(PO4)2 + 2AlCl3
Производство и получение
В лабораторных условиях получение фосфата алюминия ведётся путём реакции ионного обмена, происходит замена алюминия натрием:
AlCl3 + Na3PO4 → AlPO4↓ + 3NaCl
Синтез ведётся и посредством прямой реакции воздействия на алюминий кислоты:
2Al + 2H3PO4 → 2AlPO4↓ + 3H2↑
Фосфат алюминия синтезируют в ходе реакции нейтрализации:
Al(OH)3 + H3PO4 → AlPO4↓ + 3H2O
В промышленности сырьём для добычи фосфата алюминия служит алюминат натрия либо сульфат алюминия, выделение происходит в процессе реакции обмена:
NaAlO2 + H3PO4 → AlPO4↓ + NaOH + H2O
2Na3PO4 + Al2(SO4)3 → 2AlPO4↓ + 3Na2SO4
Применение
Фосфат алюминия используется в производстве керамических изделий и выступает важной добавкой для затвердевания готовой смеси. Кроме того, он важен для выпуска строительных материалов, смесей для кондитерского дела, лекарств.
Применение алюминия фосфата в медицине
Фосфат алюминия обладает собственной фармакологической активностью. Благодаря специфическим свойствам алюминий фосфат способен впитывать в себя аллергены, тяжёлые металлы, токсины и патогены. Он проявляет комплексное действие и характеризуется следующими действиями:
- Адсорбирующее: способность поглощать инородные для организма частицы, понижая негативный эффект интоксикации и уменьшая проявление симптомов отравления.
- Антацидное: попадая в желудок, фосфат алюминия связывается с желудочным соком, основным компонентом которого является соляная кислота. При этом он понижает общее значение pH, инактивируя хлористый водород через формирование трихлорида алюминия. В результате реакция среды повышается до 3,5-5. Кроме того, применение алюминия фосфата позволяет затормозить пепсин, расщепляющий белки.
- Противоязвенное: понижает кровоточивость язв, способствует заживлению ранок через адсорбцию патогенных вирусов и бактерий, а также газов и эндо-, экзотоксинов, раздражающих слизистую оболочку, которая легко травмируется при язвенной болезни.
- Обволакивающее: покрывает стенки желудка защитной плёнкой, предохраняя от повреждения ткани, которые находятся также под защитой слоя естественно секретируемой слизи.
Применение алюминия фосфата в химпроме и других сферах
Большое значение имеет фосфат алюминия для изготовления керамических вещей. Он является флюсом – вспомогательным веществом, необходимым для стеклообразования после перемешивания с глиной. Без добавления фосфата алюминия керамика становится менее привлекательной и более хрупкой.
Фосфат алюминия – пластификатор для цементных смесей. Он улучшает замешивание цемента, повышает его морозостойкость, воздухопроницаемость и твёрдость. При замешивании его в состав продлевается срок службы стройматериала, его устойчивость к плесневым грибкам и разрушению.
В органическом синтезе реагент ценят за его низкий реакционный потенциал, он может ускорять реакции других соединений, сам при этом не вступая в взаимосвязь с ними и не расходуясь. Он выступает как составной компонент разрыхлителей при выпекании сдоб и хлеба (кроме алюминия – натрий, либо другие фосфаты металлов), усиливая выработку углекислого газа в процессе подъёма теста, делая его более мягким и воздушным с сохранением хрустящей корочки.
Инструкция по применению
Показания
Фосфат алюминия назначают при наличии таких заболеваний, как:
- язвы желудка и двенадцатиперстной кишки;
- гастрит;
- рефлюкс-эзофагит;
- грыжа диафрагмы;
- диарея;
- диспепсия;
- интоксикация, сопровождающаяся выраженными желудочно-кишечными расстройствами.
Противопоказания, побочные эффекты, передозировка
Главное противопоказание фосфата алюминия – это индивидуальная непереносимость вещества. Она выражается в аллергии, кашле, тошноте, боли в животе. Приём лекарства противопоказан при тяжёлой печеночной недостаточности, с осторожностью его принимают люди пожилого возраста, при беременности и в период лактации.
Способ применения и дозы
Фосфат алюминия применяют в форме суспензии, геля внутрь сразу либо после предварительного размешивания в стакане воды. Взрослым и детям после 6 лет нужно употреблять 16-32 г средства 2-3 раза в день при возникновении неприятных ощущений для устранения дискомфорта. Детям до 6 месяцев назначают по 4 мг препарата после каждого из кормлений.
Опасность, токсичность, меры предосторожности
Фосфат алюминия относится к 4 классу опасности – малоопасные вещества. Тем не менее, при попадании на кожу порошка он может вызывать раздражение, покраснение и зуд. При работе с солью нужно надевать защитную одежду (перчатки), соблюдать основные гигиенические правила.
Где купить и сколько стоит
Фосфат алюминия продают заводы-производители по оптовым ценам, стоимость 1 кг – 116 рублей. Медикамент продают в аптеках по цене от 225 рублей. Реагент можно приобрести в специализированных интернет-магазинах от 400 рублей за 100 грамм.
Заключение
Фосфат алюминия – это неорганическое вещество, востребованное во многих сферах деятельности Основная масса производимого фосфата уходит на нужды фармацевтики, где он применяется как антацид и адсорбент.
Читайте также:
- Фосфат натрия: описание, реакции, вред, применение
- Фосфат калия: получение, свойства, реакции, польза и вред, применение
- Хлорид алюминия: свойства, применение
- Нитрат алюминия: свойства, реакции, применение
Сайт предоставляет информацию в справочных целях, только для ознакомления. Поставить диагноз и назначить адекватное лечение может только врач! Медикаменты и народные средства должны назначаться специалистом, так как имеют противопоказания и побочные действия! Посещение и консультации квалифицированного специалиста строго обязательны!
Загрузка…