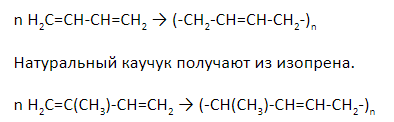Алкадиены – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствуют две двойные связи между атомами углерода С=С.
Общая формула алкадиенов CnH2n-2 (как у алкинов, а также циклоалкенов), где n ≥ 3.
Наличие двух двойных связей между атомами углерода очень сильно влияет на свойства углеводородов. В этой статье мы подробно остановимся на свойствах, способах получения и особенностях строения алкадиенов.
Строение, изомерия и гомологический ряд алкадиенов
Химические свойства алкадиенов
Получение алкадиенов
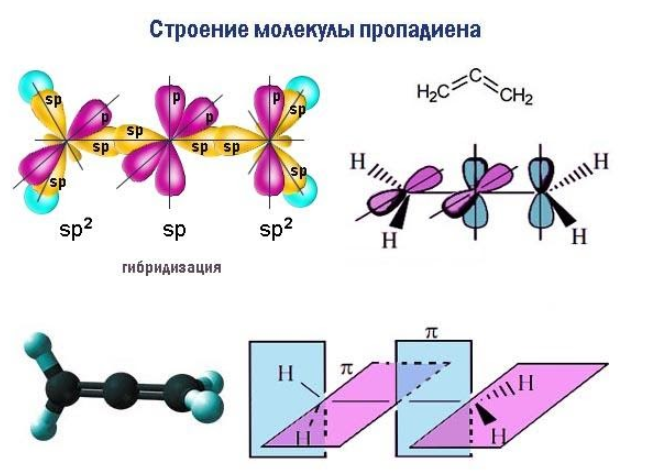
Строение алкадиенов
Свойства алкадиенов определяются их строением и взаимных расположением двойных связей в молекуле.
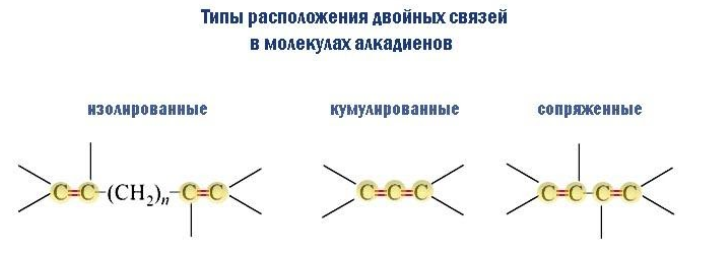
Изолированные двойные связи разделены в углеродной цепи двумя или более σ-связями С–С. Например, в пентадиене-1,4:
CH2=CH–CH2–CH=CH2
Изолированные алкадиены проявляют свойства алкенов.
Кумулированные двойные связи расположены в углеродной цепи у одного атома углерода.
Например, пропадиен:
CH2=C=CH2
Кумулированные алкадиены неустойчивы.
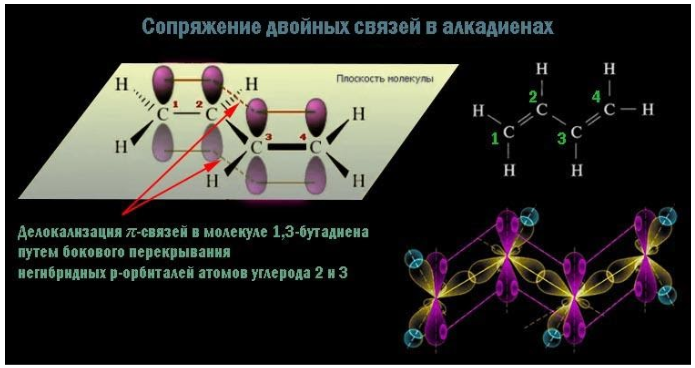
Сопряженные двойные связи разделены одной σ-связью С-С.
Например, бутадиен-1,3:
CH2=CH–CH=CH2
Сопряженные алкадиены обладают характерными свойствами, которые отличаются от свойств алкенов.
Строение сопряженных алкадиенов
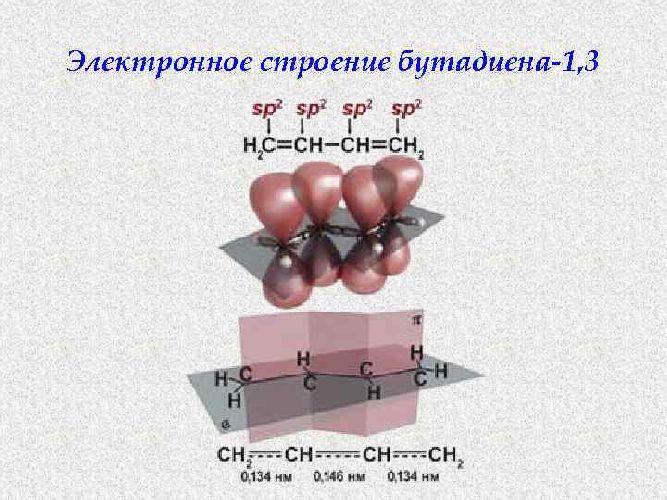
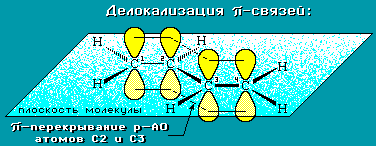
Молекула бутадиена-1,3 содержит четыре атома углерода в sp2—гибридизованном состоянии.
π-Электроны двойных связей образуют единое π-электронное облако (сопряженную систему) и делокализованы (равномерно распределены) между всеми атомами углерода.
Это соответствует плоскому строению молекулы бутадиена-1,3.
Образуется единая сопряженная π-система, которая может вступать во взаимодействие целиком, используя все четыре р-орбитали π-связей.
Реальное строение бутадиена более точно отражает формула с делокализованными «полуторными» связями.
Аналогичное устроены и другие сопряженные алкадиены.
Например, 2-метилбутадиен-1,3:
Сопряжение в молекуле алкадиенов можно также схематично изобразить так:
Изображение с сайта orgchem.ru
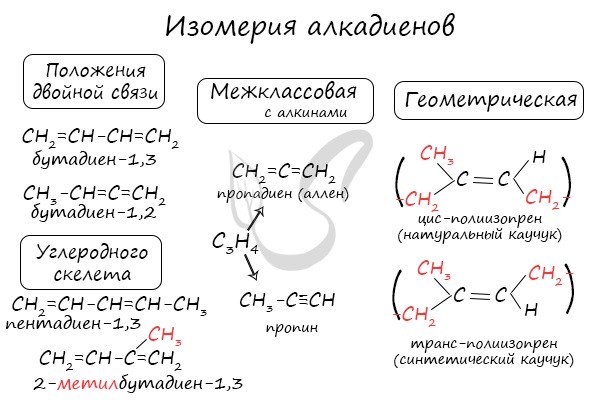
Изомерия алкадиенов
Для алкадиенов характерна структурная и пространственная изомерия.
Структурная изомерия
Для алкенов характерна структурная изомерия – изомерия углеродного скелета, изомерия положения кратных связей и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры положения двойных связей отличаются положением двойных связей.
Изомеры положения двойных связей с формулой С6Н10 — гексадиен-1,3 и гексадиен-2,4
| Гексадиен-1,3 |
Гексадиен-2,4 |
 |
 |
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Алкадиены являются межклассовыми изомерами с алкинами и циклоалкенами с общей формулой — CnH2n-2.
Межклассовые изомеры с общей формулой С4Н6 — бутадиен-1,3, бутин-1, циклобутен
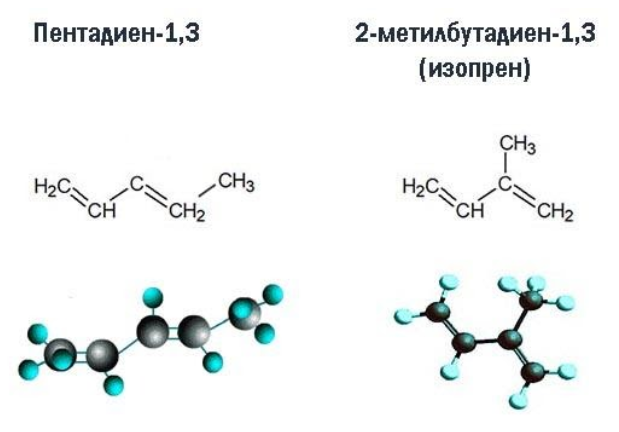
Изомеры углеродного скелета отличаются строением углеродного скелета.
Изомеры углеродного скелета, которые соответствуют формуле С5Н8 — пентадиен-1,3 и 2-метилбутадиен-1,3 (изопрен)
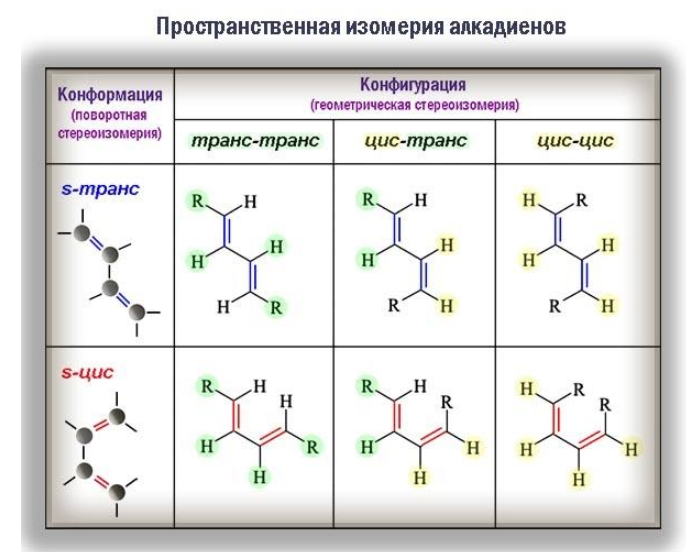
Пространственная изомерия
Для некоторых алкадиенов характерна пространственная изомерия: цис-транс-изомерия и оптическая.
Алкадиены, которые обладают достаточно большим углеродным скелетом, могут существовать в виде оптических изомеров. В молекуле алкадиена должен присутствовать асимметрический атом углерода (атом углерода, связанный с четырьмя различными заместителями).
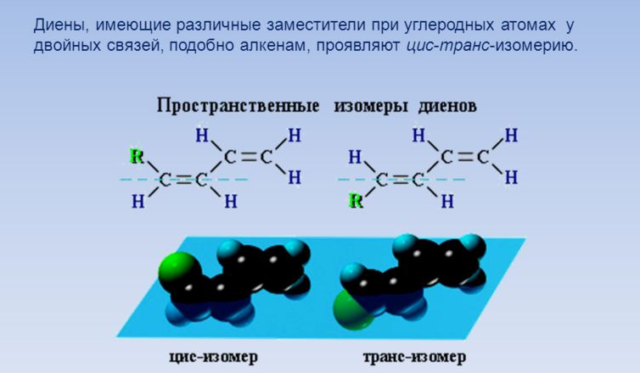
Цис-транс-изомерия обусловлена отсутствием вращения по двойной связи у некоторых алкадиенов.
Алкадиены, имеющие у каждого из двух атомов углерода при двойной связи различные заместители, могут существовать в виде двух изомеров, отличающихся расположением заместителей относительно плоскости π-связи.
Алкадиены, в которых одинаковые заместители располагаются по одну сторону от плоскости двойной связи, это цис-изомеры. Алкадиены, в которых одинаковые заместители располагаются по разные стороны от плоскости двойной связи, это транс-изомеры.
| цис-Алкадиен |
транс-Алкадиен |
 |
 |
Цис-транс-изомерия не характерна для тех алкадиенов, у которых хотя бы один из атомов углерода при двойной связи имеет два одинаковых соседних атома.
Для бутадиена-1,3 цис-транс-изомерия не характерна, так как у одного из атомов углерода при двойной связи есть два одинаковых заместителя (два атома водорода)
CH2=CH–CH=CH2
Номенклатура алкадиенов
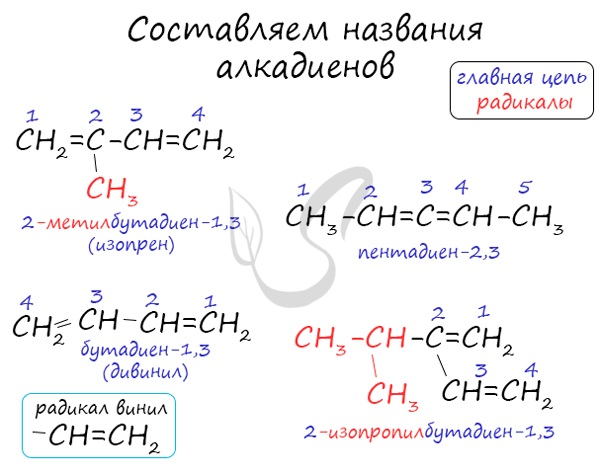
В названиях алкадиенов для обозначения двух двойных связей используется суффикс -ДИЕН.
Например, алкадиен имеет название бутадиен-1,3.
При этом правила составления названий (номенклатура) для алкадиенов в целом такие же, как и для алканов.
Для простейших алкадиенов применяются также исторически сложившиеся (тривиальные) названия:
Химические свойства сопряженных алкадиенов
Сопряженные алкадиены – непредельные нециклические углеводороды, в молекулах которых две двойные связи образуют сопряженную систему.
Химические свойства алкадиенов похожи на свойства алкенов. Алкадиены также легко вступают в реакции присоединения и окисления.
Химические свойства сопряженных алкадиенов отличаются от алкенов некоторыми особенностями, которые обусловлены делокализацией электронной плотности π-связей.
1. Реакции присоединения
Для алкадиенов характерны реакции присоединения по одной из двойных связей С=С, либо по обоим связям. Реакции с водой, галогенами и галогеноводородами протекают по механизму электрофильного присоединения. При присоединении одной молекулы реагента к алкадиену рвется только одна двойная связь. При присоединении двух молекул реагента к алкадиену разрываются обе двойные связи.
Помимо присоединения по одной из двух двойных связей (1,2-присоединение), для сопряженных диенов характерно так называемое 1,4-присоединение, когда в реакции участвует вся делокализованная система из двух двойных связей, реагент присоединяется к 1 и 4 атому углерода сопряженной системы, а двойная связь образуется между 2 и 3 атомами углерода.
1.1. Гидрирование алкадиенов
Гидрирование алкадиенов протекает в присутствии металлических катализаторов, при нагревании и под давлением.
При присоединении одной молекулы водорода к дивинилу образуется смесь продуктов (бутен-1 и бутен-2):
Соотношение продуктов 1,2- и 1,4- присоединения зависит от условий реакции.
При комнатной и повышенной температуре основным продуктом реакции является 1,4-продукт (бутен-2).
При полном гидрировании дивинила образуется бутан:
1.2. Галогенирование алкадиенов
Присоединение галогенов к алкадиенам происходит даже при комнатной температуре в растворе (растворители — вода, CCl4).
При взаимодействии с алкадиенами красно-бурый раствор брома в воде (бромная вода) обесцвечивается. Это качественная реакция на двойную связь.
Например, при взаимодействии бутадиена-1,3 с бромной водой преимущественно протекает 1,4 присоединение и образуется 1,4-дибромбутен-2:
Побочным продуктом бромирования дивинила является 3,4-дибромбутен-1:
При полном бромировании дивинила образуется 1,2,3,4-тетрабромбутан:
1.3. Гидрогалогенирование алкадиенов
Алкадиены взаимодействуют с галогеноводородами. При присоединении хлороводорода к бутадиену-1,3 преимущественно образуется 1-хлорбутен-2:
.
3-Хлорбутен-1 образуется в небольшом количестве.
При присоединении полярных молекул к алкадиенам образуется смесь изомеров. При этом выполняется правило Марковникова.
Правило Марковникова: при присоединении полярных молекул типа НХ к алкадиенам водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода при двойной связи.
1.4. Полимеризация
Полимеризация — это процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера).
nM → Mn (M – это молекула мономера)
Полимеризация алкадиенов протекает преимущественно по 1,4-механизму, при этом образуется полимер с кратными связями, называемый каучуком.
Продукт полимеризации дивинила (бутадиена) называется искусственным каучуком:
При полимеризации изопрена образуется природный (натуральный) каучук:
2. Окисление алкадиенов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на мягкое и жесткое.
2.1. Мягкое окисление алкадиенов
Мягкое окисление алкадиенов протекает при низкой температуре в присутствии перманганата калия. При этом раствор перманганата обесцвечивается.
В молекуле алкадиена разрываются только π-связи и окисляются атомы углерода при двойных связях. При этом образуются четырехатомные спирты.
Обесцвечивание алкадиенами водного раствора перманганата калия, как и в случае алкенов – качественная реакция на двойную связь.
2.2. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) происходит полный разрыв двойных связей С=С и связей С-Н у атомов углерода при двойных связях. При этом у окисляемых атомов углерода образуются связи с атомами кислорода.
Так, если у атома углерода окисляется одна связь, то образуется группа С-О-Н (спирт). При окислении двух связей образуется двойная связь с атомом углерода: С=О, при окислении трех связей — карбоксильная группа СООН, четырех — углекислый газ СО2.
Можно составить таблицу соответствия окисляемого фрагмента молекулы и продукта:
| Окисляемый фрагмент | KMnO4, кислая среда | KMnO4, H2O, t |
| >C= | >C=O | >C=O |
| -CH= | -COOH | -COOK |
| CH2= | CO2 | K2CO3 |
При окислении бутадиена-1,3 перманганатом калия в среде серной кислоты возможно образование щавелевой кислоты и углекислого газа:
2.3. Горение алкадиенов
Алкадиены, как и прочие углеводороды, горят в присутствии кислорода с образованием углекислого газа и воды.
В общем виде уравнение сгорания алкадиенов выглядит так:
CnH2n-2 + (3n-1)/2O2 → nCO2 + (n-1)H2O + Q
Например, уравнение сгорания бутадиена:
2C4H6 + 11O2 → 8CO2 + 6H2O
Получение алкадиенов
1. Дегидрирование алканов
Отщепление водорода от бутана — это промышленный способ получения дивинила. Реакция протекает при нагревании в присутствии оксида хрома (III):
Изопрен получают каталитическим дегидрированием изопентана (2-метилбутана):
2. Синтез Лебедева
Нагревание этанола в присутствии катализатора (смесь оксидов Al2O3, MgO, ZnO) – это промышленный способ получения дивинила из этанола (синтез Лебедева).
При этом образуются бутадиен-1,3, вода и водород:
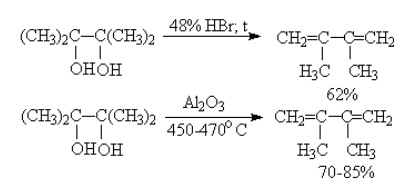
3. Дегидратация двухатомных спиртов
Под действием серной кислоты вода отщепляется от бутандиола-1,3. При этом образуется дивинил и вода:
4. Дегидрогалогенирование дигалогеналканов
Под действием спиртовых растворов щелочей протекает отщепление атомов галогена и водорода и образуются вода, соль и алкадиен.
При этом атомы галогенов в дигалогеналкане должны располагаться не у одного и не у соседних атомов углерода.
1,3-Дихлорбутан реагирует со спиртовым раствором гидроксида калия с образованием бутадиена-1,3:
Алкадиены

3.9
Средняя оценка: 3.9
Всего получено оценок: 800.
3.9
Средняя оценка: 3.9
Всего получено оценок: 800.
Ненасыщенные углеводороды, содержащие две двойные связи, называются алкадиенами или диеновыми углеводородами («ди» означает «два»). Общая формула алкадиенов – CnH2n-2.
Гомологи
Диены образуют гомологический ряд пропандиена. Это простейший представитель алкадиенов. Названия гомологов согласно номенклатуре ИЮПАК составляются из греческого числительного и суффикса «диен». Например, пентадиен, бутадиен, гексадиен.
Ряд гомологов С3-С10:
- пропадиен (С3Н4);
- бутадиен (С4Н6);
- пентадиен (С5Н8);
- гексадиен (С6Н10);
- гептадиен (С7Н12);
- октадиен (С8Н14);
- нонадиен (С9Н16);
- декадиен (С10Н18).
Для диенов, начиная с пентадиена, характерна пространственная и структурная изомерия. Например, пентадиен-1,3 с переносом метильной группы ко второму атому углерода превращается в 2-метилбутадиен-1,3 или изопрен.
Виды
В зависимости от расположения двойных связей друг к другу в углеродном скелете выделяют три вида диеновых углеводородов.
|
Вид |
Описание |
Пример |
|
Кумулированные |
Двойные связи располагаются у одного атома углерода. Такие соединения называются алленами. Простейший аллен – пропадиен, содержащий три атома углерода |
СН2=С=СН2 |
|
Сопряжённые |
Двойные связи разделены одной одинарной связью. Простейший представитель – бутадиен |
CH2=CH-CH=CH2 |
|
Изолированные |
Двойные связи разделены несколькими простыми связями. Простейший представитель – пентадиен |
CH2=CH-CH2-CH=CH2 |
Сопряжённые диены отличаются электронным строением. Атомы углерода в таких соединениях находятся в состоянии sp2-гибридизации и образуют единое р-облако за счёт сопряжения двух двойных связей. Такой тип сопряжения называется π,π-сопряжение.
Получение
Диеновые углеводороды получают несколькими способами:
- методом Лебедева из этанола (получение бутадиена):
2СН3-СН2-ОН → СН2=СН-СН=СН2 + 2H2O + Н2;
- дегидрированием из нефтепродуктов:
СН3-СН2-СН2-СН3 → CH2=CH-СН=СН2 + 2Н2;
- дегидрогалогенированием галогеналканов:
CH2Br-CH2-CH2-CH2Br + 2KOH → CH2=CH-CH=CH2 + 2KBr + 2H2O.
Физические свойства
При обычных условиях алкадиены имеют аналогичные с алкенами физические свойства. Простейшие представители ряда алкадиенов – пропадиен и бутадиен – бесцветные легко сжижаемые газы с неприятным запахом. Алкадиены, содержащие от пяти до 17 атомов углерода, а также их изомеры, являются жидкостями. Высшие диены с 18 и более атомами углерода – твёрдые вещества.
Температуры плавления и кипения, а также плотность увеличиваются с увеличением молекулярной массы. При этом разветвлённые изомеры плавятся и кипят при более низких температурах, чем линейные аналоги.
Диены распространены в природе в виде растительных пигментов, гуттаперчи, каучука, холестерина.
Химические свойства
Реакционная способность обусловлена определением положения двойной связи в молекуле диена. Атомы присоединяются в местах разрыва двойных связей, образуя 1,4-, 1,2-, 1,3-присоединение и т.д. В результате одних и тех же реакций образуются разные структурные соединения. Основные свойства диеновых углеводородов представлены в таблице.
|
Реакция |
Описание |
Уравнение |
|
Гидрирование |
Реакция протекает в присутствии катализатора – никеля |
CH2=CH-CH=CH2 + 2H2 → CH3-CH2-CH2-CH3 |
|
Галогенирование |
Присоединение галогенов с образованием тетрагалогеноалканов |
CH2=CH-CH=CH2 + Br2 → CH2(Br)-CH(Br)-CH=CH2 или CH2(Br)-CH=CH-CH2-Br |
|
Гидрогалогенирование |
Присоединение галогеноводородов аналогично реакции с алканами. Реакция протекает в водной или спиртовой среде в присутствии хлорида лития |
CH2=CH-CH=CH2 +HBr → CH3-CH(Br)-CH=CH2 или CH3-CH=CH-CH2-Br |
|
Полимеризация |
Реакция используется для получения искусственного каучука |
nCH2=CH-CH=CH2 → (-CH2-CH=CH-CH2-)n |
Что мы узнали?
Из урока химии 10 класса узнали, что такое алкадиены или диеновые углеводороды. Диены отличаются от других классов ненасыщенных углеводородов наличием двух двойных связей, которые могут располагаться у одного атома углерода, через одинарную связь или через несколько простых связей. Гомологический ряд образует пропадиен. Простейшие диены – пропадиен и бутадиен – газы, диены С5-С17 – жидкости, высшие диены – твёрдые соединения. Начиная с пентадиена, диеновые углеводороды имеют изомеры. Соединения реагируют с галогенами, водородом, галогеноводородами, а также образуют полимеры.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Александра Викторова
10/10
-
Albina Wolf
10/10
Оценка доклада
3.9
Средняя оценка: 3.9
Всего получено оценок: 800.
А какая ваша оценка?
Содержание
- 1 Строение молекул и классификация диенов
- 1.1 Типология диенов по взаимному положению двойных связей
- 2 Изомерия алкадиенов с сопряженной связью
- 2.1 Структурная изомерия
- 2.2 Пространственная изомерия
- 3 Гомологи диенов и их номенклатура
- 4 Классификация диенов
- 5 Особенности сопряженных диенов
- 6 Физические свойства алкадиенов
- 7 Получение алкадиенов
- 7.1 Дегидрирование алканов
- 7.2 Синтез Лебедева
- 7.3 Дегидратация двухатомных спиртов
- 7.4 Дегидрогалогенирование дигалогеналканов
- 8 Химические свойства алкадиенов
- 9 Реакция Дильса-Альдера
- 10 Полимеризация диенов
- 11 Применение алкадиенов
Углеводороды гомологического ряда диенов, или алкадиенов, отличаются высокой химической активностью, обусловленной особенностями строения молекул. Алкадиенам присуще разнообразие строения, поэтому в гомологическом ряду существует внутренняя классификация. Свойства алкадиенов, принадлежащих к разным типам, заметно отличаются.
Строение молекул и классификация диенов
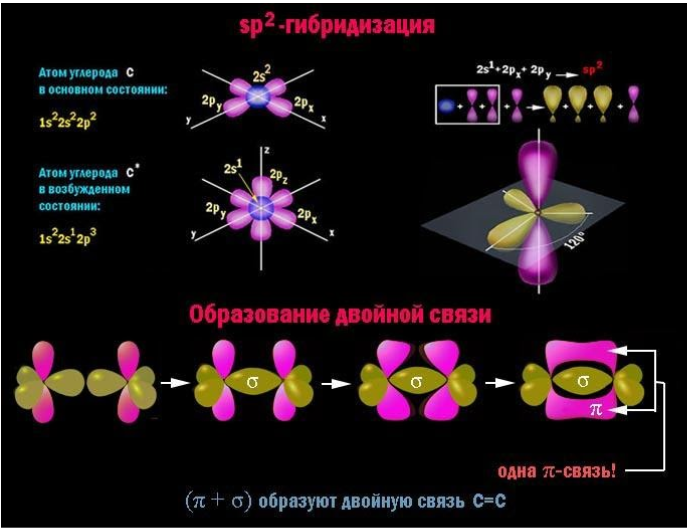
Главный признак алкадиенов – две двойные связи в углеродном скелете. Молекула содержит две пары атомов углерода с sp2-гибридизованными внешними электронными облаками. Для данного состояния атома характерно наличие одной негибридной p-орбитали, располагающейся перпендикулярно плоскости, проходящей через центры взаимодействующих атомов.
В каждой паре таких атомов помимо прочно соединяющей их по кратчайшему расстоянию σ-связи, за счет перекрывающихся p-облаков возникает менее устойчивая π-связь. Сочетание (σ+π) и есть двойная связь C=C. При внешнем воздействии ее π-компонент легче поддается разрыву и освобождает у пары углеродных атомов по одной валентности для химического взаимодействия.
Поскольку у диеновых углеводородов на формирование двойных связей затрачивается по две валентности для каждой углеродной пары, до полного насыщения молекуле не хватает четырех водородных атомов. Химическая формула алкадиенов имеет вид .
Типология диенов по взаимному положению двойных связей
Различают три типа расположения, при которых различаются степень и характер влияния связей C=C друг на друга:
- Изолированные связи разделены двумя и более простыми связями C–C. По химическим свойствам такие соединения аналогичны алкенам, так как связи C=C не взаимодействуют между собой. Пример – гексадиен-1,4: CH2=CH–CH2–CH=CH–CH3.
- Кумулированные (алленовые) связи формируются тремя находящимися рядом углеродными атомами, как в молекуле пропадиена (аллена): CH2=C=CH2. Здесь плоскости, в которых функционируют -связи, взаимно перпендикулярны, что влечет за собой неустойчивость алленовой системы.
- Сопряженные системы возникают, когда связи C=C и C–C чередуются. В этом случае благодаря одинаковой ориентации осей всех перекрывающихся p-облаков их электроны образуют единую систему с равномерно распределенной плотностью, что приводит к укорочению
-связи и стабилизации молекулы.
Соединения этого типа представляют наибольший интерес в плане практического использования.
Изомерия алкадиенов с сопряженной связью
Диены образуют как структурные, так и пространственные изомеры.
Структурная изомерия
Диеновые молекулы могут различаться по следующим признакам:
- Позиция сопряженной связи:
гексадиен-1,3 гексадиен-2,4 .
- Строение углеродного скелета:
- наличие соединений других классов, имеющих тот же атомный состав, – межклассовых изомеров. К их числу относятся алкины и циклоалкены.
Пространственная изомерия
Стереоизомерия (геометрические различия) возникает вследствие того, что фрагменты молекулы не могут вращаться вокруг кратной связи. Одинаковые заместители при этом оказываются либо по одну сторону от плоскости π-связи (цис-изомеры), либо по разные (транс-изомеры) и оказать влияние на реакционную способность.
Большое значение имеет и конформация молекул. Так, при вращении молекулы вокруг -связи, объединяющей сопряженную систему –C=C–C=C–, возникают поворотные (конформационные) изомеры:
- цисоиды, или заслоненные конформеры, в которых радикалы одного типа в торцевой проекции налагаются друг на друга;
- трансоиды, или заторможенные конформеры, одинаковые радикалы которых разведены на максимальное расстояние.
В то время как геометрическая изомерия связана с неизменной конфигурацией углеводородной молекулы, поворотные изомеры способны переходить из одного состояния в другое.
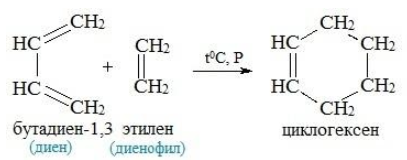
В трансоидной конформации молекула диена обладает минимальной энергией и вследствие этого менее реакционноспособна. Определенные химические превращения, например реакции диенового синтеза, протекают избирательно только с участием s-цис-конформера.
Реакция Дильса-Адлера бутадиен-1,3 этен циклогексен дивинил этилен .
Гомологи диенов и их номенклатура
Поскольку в формуле алкадиенов две кратные связи, гомологический ряд должен начинаться с соединения, в котором три углеродных атома. Название соединения образуется из корня, суффикса –диен– и номеров атомов с кратными связями. Например, H2C=CH-CH2-CH=CH-CH2-CH2-CH3 – октадиен-1,4.
Гомологи алкадиенов приведены в таблице ниже:
| Формула | Наименование |
| C3H4 | пропадиен |
| C4H6 | бутадиен |
| C5H8 | пентадиен |
| C6H10 | гексадиен |
| C7H12 | гептадиен |
| C8H14 | октадиен |
| C9H16 | нонадиен |
Классификация диенов
Кратные связи в диенах могут стоять в разных местах. Алкадиены бывают:
- кумулированные (аллены) – молекулы, кратные связи которых располагаются при одном углеродном атоме (H2C=C=CH2);
- сопряженные – молекулы, кратные связи которых находятся на расстоянии одинарной (H2C=CH-CH=CH2);
- изолированные – молекулы, кратные связи которых отделены двумя и более одинарными (H2C=CH-CH2-CH2-CH2-CH2-CH=CH2).
Особенности сопряженных диенов
Сопряженные диены имеют атомы углерода в sp2-гибридизации. π – электроны создают единую систему и располагаются равномерно по всей молекуле. Все атомы образуют p-облако. Такой тип называется π,π-сопряжение.
Настоящее строение таких алкадиенов отражает наличие делокализованных «полуторных» связей.
Физические свойства алкадиенов
В нормальных условиях алкадиены схожи с алкенами. Первые два представителя гомологического ряда диеновых углеводородов – газы, не имеющие цвет, но со специфическим запахом. Алкадиены, имеющие до семнадцати углеродных атомов в цепи, — жидкости. Диены, находящиеся ниже по гомологическому ряду, – твердые вещества. Температуры плавления и кипения поднимаются по мере роста молекулярной массы.
Это интересно:
Окисление алкенов перманганатом калия
Применение алкенов
Циклические углеводороды
Получение алкадиенов
Существует несколько способов получения диенов.
Дегидрирование алканов
В промышленных условиях бутадиен-1,3 получают из 2-метилбутана под действием катализатора Al2O3 и повышенных температур.
Синтез Лебедева
Бутадиен-1,3 также получают из этанола под действием катализаторов Al2O3, ZnO и повышенных температур.
Дегидратация двухатомных спиртов
Реакция проходит под действием бромоводорода HBr (выход диенов – 62%) или оксида алюминия Al2O3 (выход диенов – 70-85 %).
Дегидрогалогенирование дигалогеналканов
Отщепление подчиняется правилу Зайцева и идет под действием спирта.
Химические свойства алкадиенов
Свойства алкадиенов обуславливают возможность вступления в реакции присоединения. Кратная связь увеличивает реакционную способность и обуславливает необычные механизмы некоторых реакций.
Реакция Дильса-Альдера
Эта реакция заключается во взаимодействии диенов и диенофилов с образованием шестичленных гидроароматических колец. Реакция обратима и проходит при нормальных условиях или слабом нагревании.
Полимеризация диенов
Полимеризация – это реакция последовательного соединения мономеров с целью получения полимера. У алкадиенов полимеризация протекает по 1,4-механизму.
Синтетический каучук получают из дивинила.
Применение алкадиенов
Диены – это ненасыщенные алифатические соединения с двумя двойными связями. Особенности строения алкадиенов указывают на то, что им доступны лишь реакции присоединения. У сопряженных диенов есть единое π – облако, которое позволяет вступать в различные реакции. Алкадиены имеют большое промышленное значение.
Диенами часто используются в промышленности при получении каучуков. Их них изготавливают автомобильные и велосипедные шины.
Органические соединения, имеющие две и более двойные связи, — терпены. Они есть в составе организма, а также их синтезируют и применяют в производстве парфюма.
Формула алкадиенов
Определение и формула алкадиенов
Химическая формула алкадиенов
Общая химическая формула алкадиенов CnH2n-2, например C3H4–пропадиен, C4H6 –бутадиен, C5H8 – пентадиен и т.д. Химическая формула показывает качественные и количественный состав молекулы (сколько и каких атомов присутствует в ней). По химической формуле можно вычислить молекулярную массу вещества:
Mr(C3H4) = 3×Ar(C) + 4×Ar(H);
Mr(C3H4) = 3×12 + 4×1 = 36 + 4 = 40
Mr(C4H6) = 4×Ar(C) +6×Ar(H);
Mr(C4H6) = 4×12 + 6×1 = 48 + 6 = 54
Mr(C5H8) = 5×Ar(C) +8×Ar(H);
Mr(C5H8) = 5×12 + 8×1 = 60 + 8 = 68
Графическая (структурная) формула алкадиенов
Структурная (графическая) формула алкадиенов является более наглядной. Она показывает то, как связаны атомы между собой внутри молекулы.
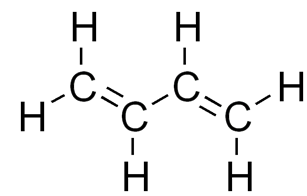
Рассмотрим, как выглядит графическая формула алкадиенов на примере простейшего представителя сопряженных диенов — бутадиена – 1, 3:
Рис. 1. Структурная формула бутадиена – 1,3.
Все четыре атома углерода в бутадиене – 1, 3 находятся в состоянии sp2— гибридизации. Они лежат в одной плоскости и составляют σ-скелет молекулы (рис. 2). Негибридизованные p-орбитали каждого атома углерода перпендикулярны плоскости σ-скелета и параллельны друг другу, что создает условия для их взаимного перекрывания. Перекрывание происходит не только между атомами С-1 – С-2 и С-3 – С-4, но и частично между атомами С-2 – С 3. При перекрывании четырех p-орбиталей происходит образование единого π — электронного облака, т.е. сопряжение двух двойных связей. Этот тип сопряжения называется π, π – сопряжением, так как взаимодействуют орбитали π-связей.
Рис. 1. Строение молекулы бутадиена – 1, 3.
В сопряженной системе π-электроны уже не принадлежат определенным связям, они делокализованы, т.е. электронная плотность распределена по всей сопряженной системе, по всем связям и атомам.
Примеры решения задач
Алкадиены — непредельные (ненасыщенные) углеводороды, имеющие в молекуле две двойных связи С=С.
Каждая такая связь содержит одну сигма-связь (σ-связь) и одну пи-связь (π-связь).
Алкадиены также называют диеновыми углеводородами. Первый член гомологического ряда — пропадиен — CH2=C=CH2.
Общая формула их гомологического ряда — CnH2n-2.
Номенклатура и изомерия алкадиенов
Названия алкадиенов формируются путем добавления суффикса «диен» к названию алкана с соответствующим числом:
пропадиен, бутадиен, пентадиен и т.д.
При составления названия алкадиена важно учесть, что главная цепь атомов углерода должна обязательно содержать двойные связи. Нумерация
атомов углерода в ней начинается с того края, к которому ближе двойная связь. В конце названия указывают атомы углерода, у которых
начинается двойная связь.
Атомы углерода, прилежащие к двойной связи находятся в sp2 гибридизации.
Для алкадиенов характерна изомерия углеродного скелета, положения двойных связей, межклассовая изомерия с алкинами и пространственная геометрическая
изомерия в виде существования цис- и транс-изомеров.
Также к синтетическим каучукам относится бутадиен-1,3 (дивинил).
Классификация по положению двойных связей
В зависимости от того, как чередуются двойные связи в молекуле алкадиена, они подразделяются на следующие типы:
- Кумулированные двойные связи
- Сопряженные двойные связи
- Изолированные двойные связи
В случае, если две двойные связи прилежат к одному и тому же атому углерода.
Пример — пропадиен-1,2 (аллен) — CH2=C=CH2
В молекуле аллена крайние атомы углерода находятся в состоянии sp2-гибридизации, а центральный атом — sp-гибридизации.
В случае, если две двойные связи разделены одной одинарной связью. В результате такого взаиморасположения в
молекулах возникает сопряжение: формируется единое π-электронное облако.
Помните, что сигма-связи (σ-связи) перекрываются вдоль линии плоскости, а пи-связи (π-связи) над и под линией
плоскости (линией, соединяющей центры атомов).
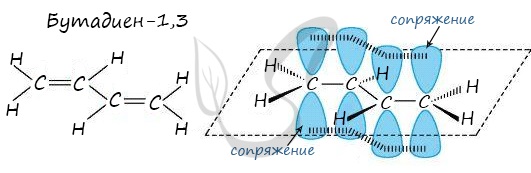
Пример — бутадиен-1,3 — CH2=CH-CH=CH2
В случае, если две двойные связи разделены двумя и более одинарными связями.
Пример — пентадиен-1,4 — CH2=CH-CH2-CH=CH2
Получение алкадиенов
Алкадиены получают несколькими способами:
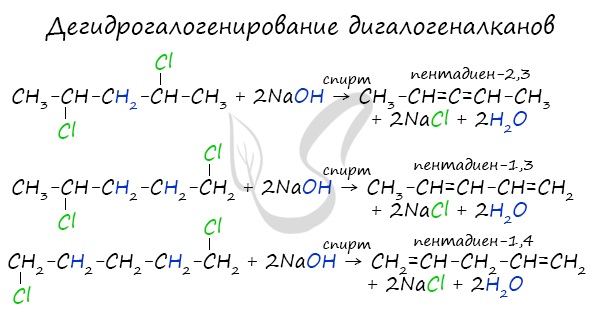
- Дегидрогалогенирование дигалогеналканов
- Синтез С.В. Лебедева
- Дегидрирование алканов
В результате реакции молекулы алкана, содержащей два атома галогена, со спиртовым (!) раствором щелочи
получается алкадиен. В зависимости от положения галогенов возможны разные варианты.
Отщепление идет по правилу Зайцева: атом водорода отщепляется от соседнего, наименее гидрированного атома углерода.
Сергей Васильевич Лебедев в 1927 году разработал первый промышленный способ получения синтетического каучука из
этилового спирта.
2CH3-CH2-OH → (450 °C, кат. ZnO) CH2=CH-CH=CH2 + 2H2O
+ H2
Каучук занимает важное место в промышленности благодаря своим свойствам: водонепроницаемости, эластичности и
способности к электроизоляции. Путем вулканизации из каучука получают резину, используемую повсеместно.

В результате отщепления водорода от молекулы алкана образуются двойные связи. Дегидрирование происходит
при повышенной температуре и в присутствии катализатора.

Химические свойства алкадиенов
Алкадиены — ненасыщенные углеводороды, легко вступающие в реакции присоединения. Реакции замещения для них не характерны.
Наличие сопряженных двойных связей увеличивает реакционную способность молекулы и обуславливает необычный механизм некоторых реакций.
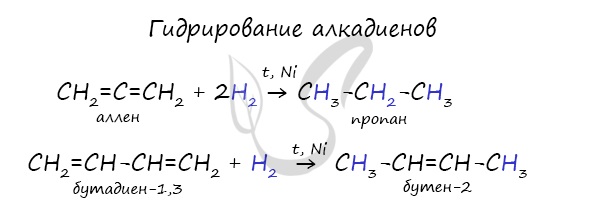
- Гидрирование
- Галогенирование
- Гидрогалогенирование
- Окисление
- Полимеризация
Водород присоединяется к атомам углерода, образующим двойную связь. Пи-связь (π-связь) рвется, остается единичная сигма-связь (σ-связь).
Реакция с бромной водой является качественной для непредельных соединений, содержащих двойные (и тройные) связи. В ходе такой реакции бромная
вода обесцвечивается, что указывает на присоединение брома по кратным связям к органическому веществу.
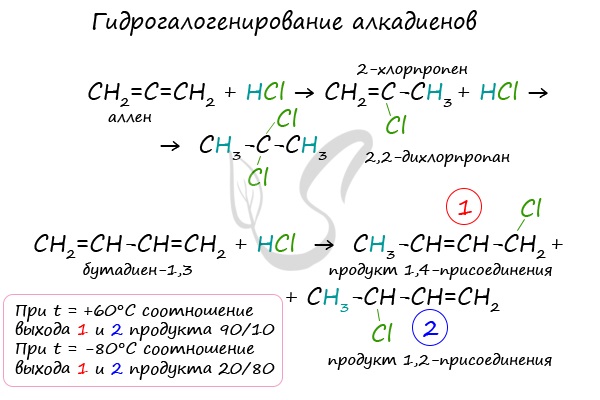
В случае, если двойные связи находятся в сопряжении, выход продуктов во многом зависит от температуры. Например, в ходе галогенирования бутадиена-1,3
при -80°C преимущественно получается продукт 1,2-присоединения, а при +60°C — продукт 1,4-присоединения.

Алкадиены вступают в реакции гидрогалогенирования, протекающие по типу присоединения.
Гидрогалогенирование протекает по правилу Марковникова, в соответствии с которым атом водорода присоединяется к наиболее гидрированному, а
атом галогена — к наименее гидрированному атому углерода.
При горении алкадиены, как и все органические соединения, сгорают с образованием углекислого газа и воды — полное окисление.
2CH2=CH-CH=CH2 + 11O2 → 8CO2 + 6H2O
Полимеризация — цепная реакция синтеза полимеров, при котором молекула полимера образуется путем последовательного соединения
молекул мономеров.
Индекс «n», степень полимеризации, обозначает число мономерных звеньев, которые входят в состав полимера.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.