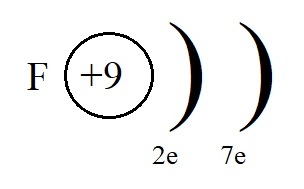Электронные формулы катионов (примеры)
Катионы — положительно заряженные
частицы. Содержат электронов меньше,
чем электронейтральный атом. Заряд
катиона определяет число удаляемых
электронов. Удаляются электроны
валентного уровня. Так, заряд катиона
цезия Cs+ равен
+1. Электронная формула этого катиона
1s22s22p63s23p63d104s24p64d105s25p66s0.
Заряд катиона бария Ba2+
равен +2. Электронная формула Ba2+
1s22s22p63s23p63d104s24p64d105s25p66s0.
Таблица 1.1
|
Катионы |
Электронные формулы |
Число неспаренных электронов |
|
Cr3+ |
1s22s22p63s23p63d34s0 |
три |
|
Mn2+ |
1s22s22p63s23p63d54s0 |
пять |
|
Co2+ |
1s22s22p63s23p63d74s0 |
три |
|
Co3+ |
1s22s22p63s23p63d64s0 |
четыре |
|
Ni2+ |
1s22s22p63s23p63d84s0 |
два |
|
Zn2+ |
1s22s22p63s23p63d104s0 |
ноль (их нет) |
|
Pd2+ |
1s22s22p63s23p63d104s24p64d85s0 |
два |
|
Pd4+ |
1s22s22p63s23p63d104s24p64d65s0 |
четыре |
|
Zr2+ |
1s22s22p63s23p63d104s24p64d25s0 |
два |
|
Zr4+ |
1s22s22p63s23p63d104s24p64d05s0 |
ноль (их нет) |
|
Ce4+ |
1s22s22p63s23p63d104s24p64d104f05s25p66s0 |
ноль (их нет) |
Молекулярные катионы
образуются путем присоединения к
молекуле одного или нескольких катионов
водорода. Пример:
катион аммония, образуется по схеме NH3
+ H+
→ NH4
+.
Электронные формулы атомов элементов и их анионов (примеры)
Анионы – отрицательно заряженные
частицы. Содержат электронов больше,
чем электронейтральный атом. Заряд
аниона определяет число дополнительных
(принятых) электронов.
Таблица 1.2
|
Элемент |
Электронные формулы |
Анионы |
Электронные формулы |
|
N |
1s22s22p3 |
N3- |
1s22s22p6 |
|
P |
1s22s22p63s23p3 |
P3- |
1s22s22p63s23p6 |
|
O |
1s22s22p4 |
O2- |
1s22s22p6 |
|
S |
1s22s22p63s23p4 |
S2- |
1s22s22p63s23p6 |
|
Cl |
1s22s22p63s23p5 |
Cl— |
1s22s22p63s23p6 |
|
I |
1s22s22p63s23p63d104s24p64d105s25p5 |
I— |
1s22s22p63s23p63d104s24p64d105s25p6 |
Потенциал ионизации (в Bольтах)
– численно равен энергии ионизации
(кДж/моль или эВ/атом). Энергией ионизации
(In)
называется количество энергии, необходимое
для отрыва “n”-ого
электрона от невозбужденного атома.
Отрыв каждого последующего электрона
требует бóльших затрат энергии, т.е.
I1
< I2
< I3
. В периоде при переходе слева направо
потенциал ионизации I1
в целом увеличивается. В главных
подгруппах при движении сверху вниз
– I1
уменьшается, в побочных подгруппах
(подгруппах d-элементов)
I1 при
этом увеличивается.
Сродство к электрону – энергетический
эффект процесса присоединения электрона
к нейтральному атому Э с превращением
его в отрицательный ион Э—.
Наибольшим сродством к электрону
обладают p-
элементы VII группы.
Наименьшее и даже отрицательное сродство
к электрону имеют атомы с электронной
конфигурацией s2
(Be, Mg,
Zn) и s2p6
(Ne, Ar,
Kr), а также с
наполовину заполненным p-подуровнем
(N, P,
As).
Сложные анионы – устойчивые
группировки атомов, имеющие отрицательный
заряд, обычно входят в состав кислот
или солей в качестве «кислотного остатка»
(SO42-,
NO3—,
SiF62-).
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Темы кодификатора ЕГЭ: Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы. Электронная конфигурация атомов и ионов. Основное и возбужденное состояние атомов.
Тренировочные тесты в формате ЕГЭ по теме «Строение атома» (задание 1 ЕГЭ по химии) ( с ответами)
Одну из первых моделей строения атома — «пудинговую модель» — разработал Д.Д. Томсон в 1904 году. Томсон открыл существование электронов, за что и получил Нобелевскую премию. Однако наука на тот момент не могла объяснить существование этих самых электронов в пространстве. Томсон предположил, что атом состоит из отрицательных электронов, помещенных в равномерно заряженный положительно «суп», который компенсирует заряд электронов (еще одна аналогия — изюм в пудинге). Модель, конечно, оригинальная, но неверная. Зато модель Томсона стала отличным стартом для дальнейших работ в этой области.
И дальнейшая работа оказалась эффективной. Ученик Томсона, Эрнест Резерфорд, на основании опытов по рассеянию альфа-частиц на золотой фольге предложил новую, планетарную модель строения атома.
Согласно модели Резерфорда, атом состоит из массивного, положительно заряженного ядра и частиц с небольшой массой — электронов, которые, как планеты вокруг Солнца, летают вокруг ядра, и на него не падают.
Модель Резерфорда оказалась следующим шагом в изучении строения атома. Однако современная наука использует более совершенную модель, предложенную Нильсом Бором в 1913 году. На ней мы и остановимся подробнее.
Атом — это мельчайшая, электронейтральная, химически неделимая частица вещества, состоящая из положительно заряженного ядра и отрицательно заряженной электронной оболочки.
При этом электроны двигаются не по определенной орбите, как предполагал Резерфорд, а довольно хаотично. Совокупность электронов, которые двигаются вокруг ядра, называется электронной оболочкой.
Атомное ядро, как доказал Резерфорд — массивное и положительно заряженное, расположено в центральной части атома. Структура ядра довольно сложна, и изучается в ядерной физике. Основные частицы, из которых оно состоит — протоны и нейтроны. Они связаны ядерными силами (сильное взаимодействие).
Рассмотрим основные характеристики протонов, нейтронов и электронов:
| Протон | Нейтрон | Электрон | |
| Масса | 1,00728 а.е.м. | 1,00867 а.е.м. | 1/1960 а.е.м. |
| Заряд | + 1 элементарный заряд | 0 | — 1 элементарный заряд |
1 а.е.м. (атомная единица массы) = 1,66054·10-27 кг
1 элементарный заряд = 1,60219·10-19 Кл
И — самое главное. Периодическая система химических элементов, структурированная Дмитрием Ивановичем Менделеевым, подчиняется простой и понятной логике: номер атома — это число протонов в ядре этого атома. Причем ни о каких протонах Дмитрий Иванович в XIX веке не слышал. Тем гениальнее его открытие и способности, и научное чутье, которое позволило перешагнуть на полтора столетия вперёд в науке.
Следовательно, заряд ядра Z равен числу протонов Np, т.е. номеру атома в Периодической системе химических элементов.
Атом — это электронейтральная частица, следовательно, число протонов Np равно числу электронов Ne:
Ne = Np = Z.
Масса атома (массовое число A) примерно равна суммарной массе крупных частиц, которые входят в состав атома — протонов и нейтронов. Поскольку масса протона и нейтрона примерно равна 1 атомной единице массы, можно использовать формулу, связывающую массовое число М число протонов Np и число нейтронов Nn:
M = Np + Nn
Массовое число указано в Периодической системе химических элементов в ячейке каждого элемента.
Обратите внимание! При решении задач ЕГЭ массовое число всех атомов, кроме хлора, округляется до целого по правилам математики. Массовое число атома хлора в ЕГЭ принято считать равным 35,5.
Таким образом, рассчитать число нейтронов в атоме можно, вычтя из массового числа номер атома: Nn = M – Z.
В Периодической системе собраны химические элементы — атомы с одинаковым зарядом ядра. Однако, может ли меняться у этих атомов число остальных частиц? Вполне. Например, атомы с разным числом нейтронов называют изотопами данного химического элемента. У одного и того же элемента может быть несколько изотопов.
Попробуйте ответить на вопросы. Ответы на них — в конце статьи:
- У изотопов одного элемента массовое число одинаковое или разное?
- У изотопов одно элемента число протонов одинаковое или разное?
Химические свойства атомов определяются строением электронной оболочки и зарядом ядра. Таким образом, химические свойства изотопов одного элемента практически не отличаются.
Поскольку атомы одного элемента могут существовать в форме разных изотопов, в названии часто указывается массовое число, например, хлор-35, и принята такая форма записи атомов:
Еще немного вопросов:
3. Определите количество нейтронов, протонов и электронов в изотопе брома-81.
4. Определите число нейтронов в изотопе хлора-37.
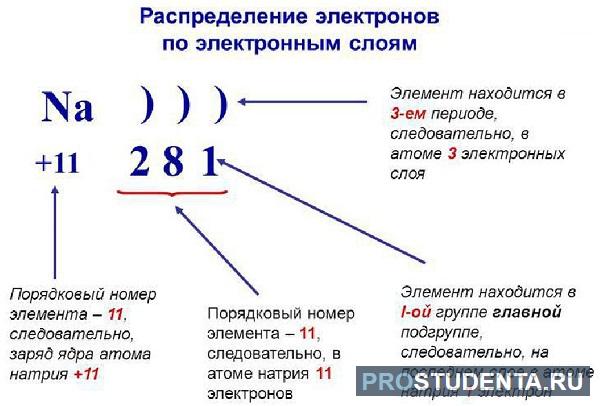
Строение электронной оболочки
Согласно квантовой модели строение атома Нильса Бора, электроны в атоме могут двигаться только по определенным (стационарным) орбитам, удаленным от ядра на определенное расстояние и характеризующиеся определенной энергией. Другое название стационарны орбит — электронные слои или энергетические уровни.
Электронные уровни можно обозначать цифрами — 1, 2, 3, …, n. Номер слоя увеличивается мере удаления его от ядра. Номер уровня соответствует главному квантовому числу n.
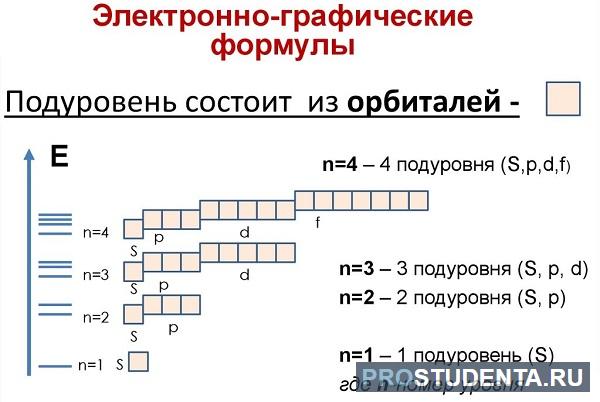
В одном слое электроны могут двигаться по разным траекториям. Траекторию орбиты характеризует электронный подуровень. Тип подуровня характеризует орбитальное квантовое число l = 0,1, 2, 3 …, либо соответствующие буквы — s, p, d, g и др.
В рамках одного подуровня (электронных орбиталей одного типа) возможны варианты расположения орбиталей в пространстве. Чем сложнее геометрия орбиталей данного подуровня, тем больше вариантов их расположения в пространстве. Общее число орбиталей подуровня данного типа l можно определить по формуле: 2l+1. На каждой орбитали может находиться не более двух электронов.
| Тип орбитали | s | p | d | f | g |
| Значение орбитального квантового числа l | 0 | 1 | 2 | 3 | 4 |
| Число атомных орбиталей данного типа 2l+1 | 1 | 3 | 5 | 7 | 9 |
| Максимальное количество электронов на орбиталях данного типа | 2 | 6 | 10 | 14 | 18 |
Получаем сводную таблицу:
|
Номер уровня, n |
Подуровень | Число
АО |
Максимальное количество электронов |
| 1 | 1s | 1 | |
| 2 | 2s | 1 | |
| 2p | 3 | ||
|
3 |
3s | 1 | |
| 3p | 3 | ||
| 3d | 5 | ||
|
4 |
4s | 1 | |
| 4p | 3 | ||
| 4d | 5 | ||
| 4f | 7 |
|
Заполнение электронами энергетических орбиталей происходит согласно некоторым основным правилам. Давайте остановимся на них подробно.
Принцип Паули (запрет Паули): на одной атомной орбитали могут находиться не более двух электронов с противоположными спинами (спин — это квантовомеханическая характеристика движения электрона).
Правило Хунда. На атомных орбиталях с одинаковой энергией электроны располагаются по одному с параллельными спинами. Т.е. орбитали одного подуровня заполняются так: сначала на каждую орбиталь распределяется по одному электрону. Только когда во всех орбиталях данного подуровня распределено по одному электрону, занимаем орбитали вторыми электронами, с противоположными спинами.
Таким образом, сумма спиновых квантовых чисел таких электронов на одном энергетическом подуровне (оболочке) будет максимальной.
Например, заполнение 2р-орбитали тремя электронами будет происходить так: , а не так:
Принцип минимума энергии. Электроны заполняют сначала орбитали с наименьшей энергией. Энергия атомной орбитали эквивалентна сумме главного и орбитального квантовых чисел: n + l. Если сумма одинаковая, то заполняется первой та орбиталь, у которой меньше главное квантовое число n.
| АО | 1s | 2s | 2p | 3s | 3p | 3d | 4s | 4p | 4d | 4f | 5s | 5p | 5d | 5f | 5g |
| n | 1 | 2 | 2 | 3 | 3 | 3 | 4 | 4 | 4 | 4 | 5 | 5 | 5 | 5 | 5 |
| l | 0 | 0 | 1 | 0 | 1 | 2 | 0 | 1 | 2 | 3 | 0 | 1 | 2 | 3 | 4 |
| n + l | 1 | 2 | 3 | 3 | 4 | 5 | 4 | 5 | 6 | 7 | 5 | 6 | 7 | 8 | 9 |
Таким образом, энергетический ряд орбиталей выглядит так:
1s < 2s < 2 p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f~5d < 6p < 7s <5f~6d …
Электронную структуру атома можно представлять в разных формах — энергетическая диаграмма, электронная формула и др. Разберем основные.
Энергетическая диаграмма атома — это схематическое изображение орбиталей с учетом их энергии. Диаграмма показывает расположение электронов на энергетических уровнях и подуровнях. Заполнение орбиталей происходит согласно квантовым принципам.
Например, энергетическая диаграмма для атома углерода:
Электронная формула — это запись распределения электронов по орбиталям атома или иона. Сначала указывается номер уровня, затем тип орбитали. Верхний индекс справа от буквы показывает число электронов на орбитали. Орбитали указываются в порядке заполнения. Запись 1s2 означает, что на 1 уровне s-подуровне расположено 2 электрона.
Например, электронная формула углерода выглядит так: 1s22s22p2.
Для краткости записи, вместо энергетических орбиталей, полностью заполненных электронами, иногда используют символ ближайшего благородного газа (элемента VIIIА группы), имеющего соответствующую электронную конфигурацию.
Например, электронную формулу азота можно записать так: 1s22s22p3 или так: [He]2s22p3.
1s2 = [He]
1s22s22p6 = [Ne]
1s22s22p63s23p6 = [Ar] и так далее.
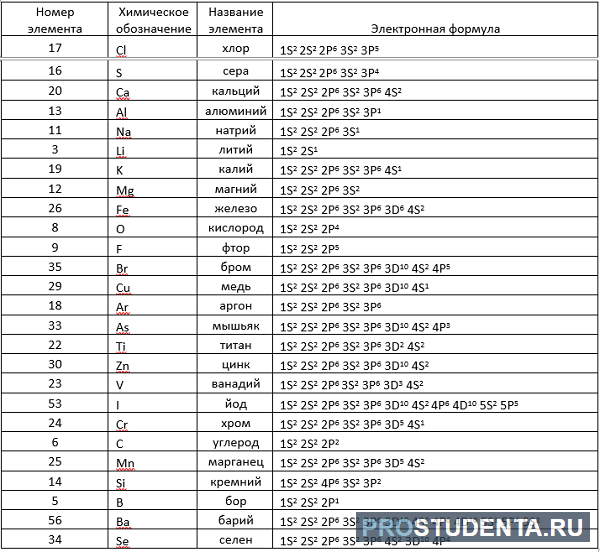
Электронные формулы элементов первых четырех периодов
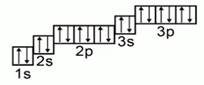
Рассмотрим заполнение электронами оболочки элементов первых четырех периодов. У водорода заполняется самый первый энергетический уровень, s-подуровень, на нем расположен 1 электрон:
+1H 1s1 1s
У гелия 1s-орбиталь полностью заполнена:
+2He 1s2 1s
Поскольку первый энергетический уровень вмещает максимально 2 электрона, у лития начинается заполнение второго энергетического уровня, начиная с орбитали с минимальной энергией — 2s. При этом сначала заполняется первый энергетический уровень:
+3Li 1s22s1 1s 2s
У бериллия 2s-подуровень заполнен:
+4Be 1s22s2 1s 2s
Далее, у бора заполняется p-подуровень второго уровня:
+5B 1s22s22p1 1s 2s
2p
У следующего элемента, углерода, очередной электрон, согласно правилу Хунда, заполняет вакантную орбиталь, а не заполняет частично занятую:
+6C 1s22s22p2 1s 2s
2p
Попробуйте составить электронную и электронно-графическую формулы для следующих элементов, а затем можете проверить себя по ответам конце статьи:
5. Азот
6. Кислород
7. Фтор
У неона завершено заполнение второго энергетического уровня:
+10Ne 1s22s22p6 1s 2s
2p
У натрия начинается заполнение третьего энергетического уровня:
+11Na 1s22s22p63s1 1s 2s
2p
3s
От натрия до аргона заполнение 3-го уровня происходит в том же порядке, что и заполнение 2-го энергетического уровня. Предлагаю составить электронные формулы элементов от магния до аргона самостоятельно, проверить по ответам.
8. Магний
9. Алюминий
10. Кремний
11. Фосфор
12. Сера
13. Хлор
14. Аргон
А вот начиная с 19-го элемента, калия, иногда начинается путаница — заполняется не 3d-орбиталь, а 4s. Ранее мы упоминали в этой статье, что заполнение энергетических уровней и подуровней электронами происходит по энергетическому ряду орбиталей, а не по порядку. Рекомендую повторить его еще раз. Таким образом, формула калия:
+19K 1s22s22p63s23p64s11s 2s
2p
3s
3p
4s
Для записи дальнейших электронных формул в статье будем использовать сокращенную форму:
+19K [Ar]4s1 [Ar] 4s
У кальция 4s-подуровень заполнен:
+20Ca [Ar]4s2 [Ar] 4s
У элемента 21, скандия, согласно энергетическому ряду орбиталей, начинается заполнение 3d-подуровня:
+21Sc [Ar]3d14s2 [Ar] 4s 3d
Дальнейшее заполнение 3d-подуровня происходит согласно квантовым правилам, от титана до ванадия:
+22Ti [Ar]3d24s2 [Ar] 4s 3d
+23V [Ar]3d34s2 [Ar] 4s 3d
Однако, у следующего элемента порядок заполнения орбиталей нарушается. Электронная конфигурация хрома такая:
+24Cr [Ar]3d54s1 [Ar] 4s 3d
В чём же дело? А дело в том, что при «традиционном» порядке заполнения орбиталей (соответственно, неверном в данном случае — 3d44s2) ровно одна ячейка в d-подуровне оставалась бы незаполненной. Оказалось, что такое заполнение энергетически менее выгодно. А более выгодно, когда d-орбиталь заполнена полностью, хотя бы единичными электронами. Этот лишний электрон переходит с 4s-подуровня. И небольшие затраты энергии на перескок электрона с 4s-подуровня с лихвой покрывает энергетический эффект от заполнения всех 3d-орбиталей. Этот эффект так и называется — «провал» или «проскок» электрона. И наблюдается он, когда d-орбиталь недозаполнена на 1 электрон (по одному электрону в ячейке или по два).
У следующих элементов «традиционный» порядок заполнения орбиталей снова возвращается. Конфигурация марганца:
+25Mn [Ar]3d54s2
Аналогично у кобальта и никеля. А вот у меди мы снова наблюдаем провал (проскок) электрона — электрон опять проскакивает с 4s-подуровня на 3d-подуровень:
+29Cu [Ar]3d104s1
На цинке завершается заполнение 3d-подуровня:
+30Zn [Ar]3d104s2
У следующих элементов, от галлия до криптона, происходит заполнение 4p-подуровня по квантовым правилам. Например, электронная формула галлия:
+31Ga [Ar]3d104s24p1
Формулы остальных элементов мы приводить не будем, можете составить их самостоятельно.
Некоторые важные понятия:
Внешний энергетический уровень — это энергетический уровень в атоме с максимальным номером, на котором есть электроны.
Например, у меди ([Ar]3d104s1) внешний энергетический уровень — четвёртый.
Валентные электроны — электроны в атоме, которые могут участвовать в образовании химической связи. Например, у хрома (+24Cr [Ar]3d54s1) валентными являются не только электроны внешнего энергетического уровня (4s1), но и неспаренные электроны на 3d-подуровне, т.к. они могут образовывать химические связи.
Основное и возбужденное состояние атома
Электронные формулы, которые мы составляли до этого, соответствуют основному энергетическому состоянию атома. Это наиболее выгодное энергетически состояние атома.
Однако, чтобы образовывать химические связи, атому в большинстве ситуаций необходимо наличие неспаренных (одиночных) электронов. А химические связи энергетически очень для атома выгодны. Следовательно, чем больше в атоме неспаренных электронов — тем больше связей он может образовать, и, как следствие, перейдёт в более выгодное энергетическое состояние.
Поэтому при наличии свободных энергетических орбиталей на данном уровне спаренные пары электронов могут распариваться, и один из электронов спаренной пары может переходить на вакантную орбиталь. Таким образом число неспаренных электронов увеличивается, и атом может образовать больше химических связей, что очень выгодно с точки зрения энергии. Такое состояние атома называют возбуждённым и обозначают звёздочкой.
Например, в основном состоянии бор имеет следующую конфигурацию энергетического уровня:
+5B 1s22s22p1 1s 2s
2p
На втором уровне (внешнем) одна спаренная электронная пара, один одиночный электрон и пара свободных (вакантных) орбиталей. Следовательно, есть возможность для перехода электрона из пары на вакантную орбиталь, получаем возбуждённое состояние атома бора (обозначается звёздочкой):
+5B* 1s22s12p2 1s 2s
2p
Попробуйте самостоятельно составить электронную формулу, соответствующую возбуждённому состоянию атомов. Не забываем проверять себя по ответам!
15. Углерода
16. Бериллия
17. Кислорода
Электронные формулы ионов
Атомы могут отдавать и принимать электроны. Отдавая или принимая электроны, они превращаются в ионы.
Ионы — это заряженные частицы. Избыточный заряд обозначается индексом в правом верхнем углу.
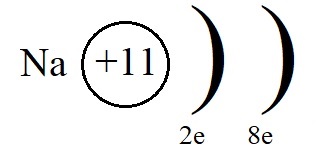
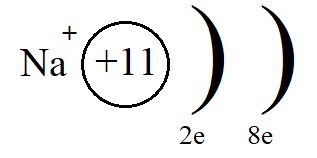
Если атом отдаёт электроны, то общий заряд образовавшейся частицы будет положительный (вспомним, что число протонов в атоме равно числу электронов, а при отдаче электронов число протонов будет больше числа электронов). Положительно заряженные ионы — это катионы. Например: катион натрия образуется так:
+11Na 1s22s22p63s1 -1е = +11Na+ 1s22s22p63s0
Если атом принимает электроны, то приобретает отрицательный заряд. Отрицательно заряженные частицы — это анионы. Например, анион хлора образуется так:
+17Cl 1s22s22p63s23p5 +1e = +17Cl— 1s22s22p63s23p6
Таким образом, электронные формулы ионов можно получить добавив или отняв электроны у атома. Обратите внимание, при образовании катионов электроны уходят с внешнего энергетического уровня. При образовании анионов электроны приходят на внешний энергетический уровень.
Попробуйте составить самостоятельно электронный формулы ионов. Не забывайте проверять себя по ключам!
18. Ион Са2+
19. Ион S2-
20. Ион Ni2+
В некоторых случаях совершенно разные атомы образуют ионы с одинаковой электронной конфигурацией. Частицы с одинаковой электронной конфигурацией и одинаковым числом электронов называют изоэлектронными частицами.
Например, ионы Na+ и F—.
Электронная формула катиона натрия: Na+ 1s22s22p6, всего 10 электронов.
Электронная формула аниона фтора: F— 1s22s22p6, всего 10 электронов.
Таким образом, ионы Na+ и F— — изоэлектронные. Также они изоэлектронны атому неона.
Тренажер по теме «Строение атома» — 10 вопросов, при каждом прохождении новые.
546
Создан на
03 января, 2022 От Admin
Тренировочный тест «Строение атома»
Тренировочный тест по теме «Строение атома»
1 / 10
1) O 2) Se 3) F 4) S 5) Na
Определите, атомы каких из указанных в ряду элементов образуют устойчивый отрицательный ион, содержащий 10 электронов.
2 / 10
1) B 2) Al 3) F 4) Fe 5) N
Определите, атомы каких из указанных в ряду элементов в возбужденном состоянии имеют электронную формулу внешнего энергетического уровня ns1np2.
3 / 10
1) Mn 2) Cr 3) Al 4) F 5) Ba
Определите, атомы каких из указанных в ряду элементов в основном энергетическом состоянии содержат одинаковое количество электронов на внешнем энергетическом уровне.
4 / 10
1) S 2) V 3) Mg 4) Al 5) H
Определите элементы, у атомов которых в основном состоянии все валентные электроны находятся только на s-подуровнях.
5 / 10
1) Mn 2) Fe 3) Al 4) Si 5) P
Определите элементы, атомы которых в основном состоянии не содержат неспаренных электронов на внешнем энергетическом уровне.
6 / 10
1) Na 2) Al 3) Br 4) Cu 5) Se
Определите элементы, катионы которых имеют электронную формулу внешнего энергетического уровня 2s22p6.
7 / 10
1) S 2) P 3) Ar 4) Si 5) Mg
Определите элементы, атомы которых в основном состоянии не содержат неспаренных электронов.
8 / 10
1) Al 2) Si 3) Mg 4) C 5) N
Определите, атомы каких из указанных в ряду элементов в возбужденном состоянии имеют электронную формулу внешнего энергетического уровня ns1np3.
9 / 10
1) Cr 2) O 3) Mg 4) Se 5) C
Определите элементы, атомы которых в основном состоянии имеют сходную конфигурацию внешнего энергетического уровня
10 / 10
1) Ga 2) Cr 3) O 4) Br 5) Mn
Определите, атомы каких из указанных в ряду элементов в основном состоянии содержат только пять d-электронов.
Ваша оценка
The average score is 37%
Ответы на вопросы:
1. У изотопов одного химического элемента массовое число всегда разное, т.к. массовое число складывается из числа протонов и нейтронов. А у изотопов различается число нейтронов.
2. У изотопов одного элемента число протонов всегда одинаковое, т.к. число протонов характеризует химический элемент.
3. Массовое число изотопа брома-81 равно 81. Атомный номер = заряд ядра брома = число протонов в ядре = 35. Вычитаем из массового числа число протонов, получаем 81-35=46 нейтронов.
4. Массовое число изотопа хлора равно 37. Атомный номер, заряд ядра и число протонов в ядре равно 17. Получаем число нейтронов = 37-17 =20.
5. Электронная формула азота:
+7N 1s22s22p3 1s 2s
2p
6. Электронная формула кислорода:
+8О 1s22s22p4 1s 2s
2p
7. Электронная формула фтора:
8. Электронная формула магния:
+12Mg 1s22s22p63s2 1s 2s
2p
3s
9. Электронная формула алюминия:
+13Al 1s22s22p63s23p1 1s 2s
2p
3s
3p
10. Электронная формула кремния:
+14Si 1s22s22p63s23p2 1s 2s
2p
3s
3p
11. Электронная формула фосфора:
+15P 1s22s22p63s23p3 1s 2s
2p
3s
3p
12. Электронная формула серы:
+16S 1s22s22p63s23p4 1s 2s
2p
3s
3p
13. Электронная формула хлора:
14. Электронная формула аргона:
+18Ar 1s22s22p63s23p6 1s 2s
2p
3s
3p
15. Электронная формула углерода в возбуждённом состоянии:
+6C* 1s22s12p3 1s 2s
2p
16. Электронная формула бериллия в возбуждённом состоянии:
+4Be 1s22s12p1 1s 2s
2p
17. Электронная формула кислорода в возбуждённом энергетическом состоянии соответствует формуле кислорода в основном энергетическом состоянии, т.к. нет условий для перехода электрона — отсутствуют вакантные энергетические орбитали.
18. Электронная формула иона кальция Са2+: +20Ca2+ 1s22s22p63s23p6
19. Электронная формула аниона серы S2-: +16S2- 1s22s22p63s23p6
20. Электронная формула катиона никеля Ni2+: +28Ni2+ 1s22s22p63s23p63d84s0. Обратите внимание! Атомы отдают электроны всегда сначала с внешнего энергетического уровня. Поэтому никель отдаёт электроны сначала с внешнего 4s-подуровня.
Тренировочные тесты в формате ЕГЭ по теме «Строение атома» (задание 1 ЕГЭ по химии) ( с ответами)
Конфигурация благородного газа. Образование ионной связи.
Материал по химии
Есть в таблице Д. И. Менделеева группа элементов, именуемая благородным или инертными газами. Названы они так не спроста, хоть они и проявляют окислительно-восстановительные свойства и вступают в химическую связь, их соединений мы знаем не так много, как соединений многих других элементов. Их низкую химическую активность объясняет то, что у этих элементов «идеальное» количество электронов – восемь (исключение – гелий, однако у него внешний энергетический уровень так же является завершенным, так как на первом уровне может разместиться только два электрона, а не восемь). Атомы с таким количеством электронов на внешнем энергетическом уровне устойчивы и не стремятся к химическому взаимодействию. Максимальное количество электронов на внешнем уровне равно восьми, легко запомнить, так как групп в классической периодической системе восемь, а именно группа определяет количество электронов на внешнем энергетическом уровне.
Остальные элементы стремятся принять конфигурацию благородного газа, превращаясь при этом в ионы.
Рассмотрим данный процесс на примере некоторых элементов.
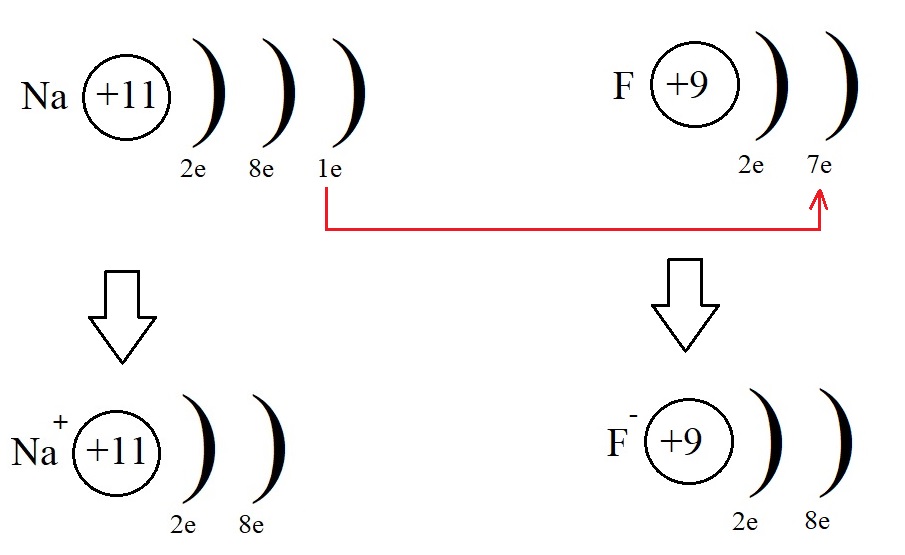
Конфигурация благородного газа. Образование ионной связи.
Строение атома натрия
Атому натрия, для завершения внешнего энергетического уровня не хватает семь электронов, притянуть такое количество, имея большой радиус и небольшое количество протонов оказывается невозможным. Поэтому натрию легче отдать электрон внешнего уровня, тогда второй уровень станет внешним, на нём как раз расположено восемь электронов.
Однако, при этом количество протонов в ядре остаётся равным одиннадцати, а электронов теперь всего десять. Элементарные вычисления (+11-10 = +1) дают нам понять, что теперь это не атом, а положительно заряженная частица – ион:
Ионы, несущие положительный заряд, называются катионами.
Если же мы рассмотрим строение внешнего энергетического уровня фтора, то обнаружим, что этому элементу до завершенного внешнего уровня не хватает всего одного электрона:
Этот электрон фтор может получить от натрия, превратившись при этом в отрицательно заряженную частицу – анион:
Оба атома при таком взаимодействии приняли конфигурацию благородного газа (8 электронов на внешнем уровне), превратились в ионы, после чего притянулись друг к другу из-за противоположных знаков и образовали фторид натрия NaF. Так образуется ионная связь.
Элементы, которые с наибольшей вероятностью отдают электроны, называют металлами, у них хорошо выражены восстановительные свойства (способность отдавать свои электроны, восстанавливая электронную оболочку другого атома до восьмиэлектронной).
Элементы, с наибольшей вероятностью «отнимающие» чужие электроны, называют неметаллами, они проявляют окислительные свойства.
Элементы, отдающие электроны (восстановители) повышают свою степень окисления, тогда как элементы, принимающие электроны (окислители) – понижают степень окисления за счет того, что принятые электроны несут отрицательный заряд.
|
Исходная частица |
Структура внешнего энергетического уровня |
процесс |
Полученная частица |
Структура внешнего энергетического уровня |
|
F0 |
2s22p5 |
+1ē |
F‒ |
2s22p6 |
|
Na0 |
3s1 |
‒1ē |
Na+ |
3s0 Или 2s22p6, так как предвнешний уровень становится внешним |
Решение типовых заданий №1 ЕГЭ по химии.
Пример 1.
Для выполнения заданий 1 – 3 используйте следующий ряд химических элементов:
|
|
|
|
|
Ответом в заданиях 1 – 3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
Определите, однозарядные катионы каких из указанных элементов имеют конфигурацию благородного газа.
Решение: хром и кальций не образуют однозарядных катионов, однако, если это еще не известно, лучше построить электронные конфигурации всех предложенных элементов, предположив, что они все могут образовывать однозарядный катион. Однозарядный катион имеет заряд +1, значит, от исходного атома нужно отнять один электрон, получив восемь электронов на внешнем (скорее предвнешнем уровне, поэтому укажем и его):
|
Исходная частица |
Структура внешнего энергетического уровня |
процесс |
Полученная частица |
Структура внешнего энергетического уровня |
|
Cr |
3d54s1 |
‒1ē |
Cr+ |
3d5 |
|
Ca |
3s23p64s2 |
‒1ē |
Ca+ |
3s23p64s1 |
|
K |
3s23p6 |
‒1ē |
K+ |
3s23p6 |
|
Cu |
3d104s1 |
‒1ē |
Cu+ |
3d10 |
|
Li |
1s22s1 |
‒1ē |
Li+ |
1s2 |
Из всех полученных ионов восьмиэлектронный внешний энергетический уровень имеет лишь катион калия. Но это задание типовое, в нём обязательно должно быть два ответа. Вторым верным ответом будет литий, так как он принимает конфигурацию гелия, у которого на внешнем уровне всего два электрона. Знание того, что хром и кальций не образуют однозарядных катионов, просто сэкономит Вам время.
Ответ: 35
Пример 2.
Для выполнения заданий 1 – 3 используйте следующий ряд химических элементов:
|
|
|
|
|
Ответом в заданиях 1 – 3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
Определите, трехзарядные анионы каких из указанных элементов имеют конфигурацию благородного газа.
Решение: попробуем решить данное задание методом исключения:
Натрий – металл, не проявляет окислительных свойств, не может стать анионом.
Водород может принять только один электрон, так как у него всего один энергетический уровень (водород стоит в первом периоде), на первом уровне может уместиться всего два электрона. Поэтому приняв к уже имеющемуся единственному электрону еще один, водород становится однозарядным анионом.
У хлора на внешнем уровне уже имеется семь электронов, есть место только для одного дополнительного, приняв его, хлор станет однозарядным анионом.
Остаётся азот и мышьяк. У обоих есть три неспаренных p-электрона, которые можно дополнить тремя чужими электронами, образуя трехзарядный анион.
Ответ: 24
В химии есть очень увлекательный, но сложный раздел – электронная конфигурация атомов и ионов.
Оглавление:
- Строение «электронных» оболочек атомов
- Распределение электронных зарядов по уровням
- Электронные формулы химических элементов
- Заключение
Молекулу любого из элементов таблицы Менделеева можно изучить с точки зрения как физики, так и химии.
Дивный молекулярный мир на атомном уровне отличается от привычного. Разберем подробно, как образуется электронная формула элементов.
Строение «электронных» оболочек атомов
Для лучшего понимания электронных окружающих ядро оболочек, нужно знать об ионе – частице, в основе которой, кроме электронов, присутствуют так называемые протоны.
Если число протонов больше числа электронов, то такой атом называется катионом (положительный заряд). В противном случае атом называется анионом (заряд отрицательный).
Каждый из электронов занимает свой собственный уровень относительно ядра.
Конфигурация электронов для отдельно взятого атома может строиться в порядке атомных чисел. В качестве первоначального элемента выбирается водород, а далее продолжается добавление одного протона к ядру согласно с подсхемой и местом в периодической таблице, пока не опишутся все химические элементы.
Такая процедура называется принципом Aufbau (Ауфбау). Название принципа происходит от немецкого слова и переводится «построить».
Можно сделать вывод, что появление ионов связано с моментом, когда атомы получают или теряют заряды. Катион (положительно заряженный ион) образуется, когда один или несколько зарядов удаляются из «родительского атома».
Распределение электронных зарядов по уровням
Как уже говорилось выше, молекула любого элемента периодической таблицы – это своеобразный микрокосмос, где в разные стороны (спины) двигаются заряженные частицы (лептон). По-английски spin означает «вращение». Их полуцелые «спины» были описаны Вольфгангом Паули в 1925 году.
Всего принципов построения графических распределительных схем существует три:
- Принцип ограничений, который сформирован швейцарским физиком В. Паули. На одном электронном уровне ядра может быть два лептона с разным направлением вращения (если один вращается против часов стрелки, то другой — по часовой). Опыты в адронном коллайдере доказали этот факт.
- Второй строительный принцип говорит, что лептоны стремятся занять уровни по мере возрастания энергетического запаса.
- Третий гласит, что любой электрон «любит» только себя и плохо переносит «соседей» по орбитали. Иными словами, сначала электроны занимают свободные клетки (в графическом исполнении формулы), а уже по второму кругу занимают свободные места.
Теперь рассмотрим состав «квартир» для лептонов. В зависимости от уровня и энергии, орбитальные места можно разделить на четыре формы:
- Эс (s) имеет форму круга и способен на одном уровне вместить только два заряда ядра.
- Пи (p) готов предоставить три «места» для шести лептонов.
- Де (d) предоставляет пять «мест» – 10 заряженных частиц.
- Эф (f) самый щедрый на «места», их число равно семи – соответственно 14 парных частиц.
Электронные формулы химических элементов
Здесь приводится таблица-подсказка для некоторых химических элементов.
Теперь, руководствуясь данными таблицы, разберем электронные записи элементов на примере «аргона» (Ar).
В таблице Менделеева его номер — восемнадцать. Руководствуясь описанным выше, высчитываем количество частиц (всего их 18).
Ещё до построения электронно-графической формулы Аргона, вспомним, как формируются орбитали и строятся ячейки:
Начинаем распределять электроны Ar:
- a) поскольку аргон находится в третьем периоде, то у него три подуровня. Смотрим в учебник химии и находим, что это p-элемент;
- b) запишем формулу: 1 s, 2 s, 2 p, 3 s, 3 p;
- c) теперь рисуем орбитальные ячейки и заполняем их.
[advice]Важно знать: непарные заряды во внешних орбиталях, называемые валентными зарядами, отвечают за большинство химических и физических проявлений элементов.[/advice]
Заключение
Чтобы немного отстранится от научных теорий, стоит пофантазировать. Представьте атомное ядро и окружающие его заряды вселенной. Ядро – это солнце, а заряды — планеты. Формула наглядно описывает положение подобных «планет» в космосе (атомного вещества). Чтобы перейти с одного уровня на другой, потребуется большая энергия.
В квантовой физике некоторые специалисты выдвинули теорию о том, что при вмешательстве в структуру атома можно сделать объект невидимым. Ведь если подумать, то фотон (мельчайшая частица света) может не вступать в связь с электронами атома и, не встречая сопротивления, преодолевать объект.
Впечатляет? Химическая формула элемента очень важна для физики. Благодаря труду Менделееву и его таблице, нам стали доступны современные технологии. Химические формулы и эксперименты скучны и сложны, хочется верить, что эта статья сделала их более понятными.

Ион
Ион — это заряженная частица, образованная из молекулы или атома путём потери или приобретения одного электрона.
Отсюда следует, что в ионе количество протонов не равно количеству электронов.
После изучения статьи Вы узнаете, какими бывают заряженные частицы, что такое ионы, катионы и анионы, также
Вы сможете по номеру элемента узнать, каким зарядом он может обладать.
Число электронов в ионе
Количество электронов в нейтральном атоме равно количеству протонов в ядре, например, у хрома (24Cr)
24 протона, соответствено, вокруг ядра вращается 24 электрона. Как было рассказано в статье
«электронная конфигурация атома», каждый
электрон двигается по некой орбитали, то есть обладает заданным количеством энергии.
Если ион образован из-за потери электрона, то заряд иона становится положительным (электрон имеет отрицательный
заряд), схема для запоминания:
24Cr — e— = 24Cr + e+ = 24Cr+
24Cr — 3e— = 24Cr + 3e+ = 24Cr3+
Аналогично при присоединении электрона:
24Cr + e— = 24Cr — e+ = 24Cr—
24Cr + 3e— = 24Cr — 3e+ = 24Cr3-
Энергия ионизации
Если электрону сообщить достаточное количество энергии, то электрон «оторвётся» от атома. Чем ближе электрон
к ядру — тем сложнее его отрывать, а значит, больше энергии необходимо передать. Энергия, необходимая для отрыва
электрона, называется энергией ионизации или ионизационный потенциал (I). Значения I затабулированы и могут быть
найдены в различных справочниках.
| # | Элемент | Название | кДж/моль |
|---|---|---|---|
| 1 | H | Водород | 1312 |
| 2 | He | Гелий | 2373 |
| 3 | Li | Литий | 520 |
| 4 | Be | Бериллий | 899.5 |
| 5 | B | Бор | 801 |
| 6 | C | Углерод | 1086 |
| 7 | N | Азот | 1402 |
| 8 | O | Кислород | 1314 |
| 9 | F | Фтор | 1681 |
| 10 | Ne | Неон | 2080.7 |
| 11 | Na | Натрий | 495 |
| 12 | Mg | Магний | 738 |
| 13 | Al | Алюминий | 578 |
| 14 | Si | Кремний | 787 |
| 15 | P | Фосфор | 1012 |
| 16 | S | Сера | 1000 |
| 17 | Cl | Хлор | 1251 |
| 18 | Ar | Аргон | 1520.6 |
| 19 | K | Калий | 418.8 |
| 20 | Ca | Кальций | 590 |
| 21 | Sc | Скандий | 633.1 |
| 22 | Ti | Титан | 658.8 |
| 23 | V | Ванадий | 650.9 |
| 24 | Cr | Хром | 652.9 |
| 25 | Mn | Марганец | 717.3 |
| 26 | Fe | Железо | 762.5 |
| 27 | Co | Кобальт | 760.4 |
| 28 | Ni | Никель | 737.1 |
| 29 | Cu | Медь | 745.5 |
| 30 | Zn | Цинк | 906.4 |
| 31 | Ga | Галлий | 578.8 |
| 32 | Ge | Германий | 762 |
| 33 | As | Мышьяк | 947 |
| 34 | Se | Селен | 941 |
| 35 | Br | Бром | 1142 |
| 36 | Kr | Криптон | 1350.8 |
| 37 | Rb | Рубидий | 403 |
| 38 | Sr | Стронций | 549 |
| 39 | Y | Иттрий | 600 |
| 40 | Zr | Цирконий | 640.1 |
| 41 | Nb | Ниобий | 652.1 |
| 42 | Mo | Молибден | 684.3 |
| 43 | Tc | Технеций | 702 |
| 44 | Ru | Рутений | 710.2 |
| 45 | Rh | Родий | 719.7 |
| 46 | Pd | Палладий | 804.4 |
| 47 | Ag | Серебро | 731 |
| 48 | Cd | Кадмий | 867.8 |
| 49 | In | Индий | 558.3 |
| 50 | Sn | Олово | 709 |
| 51 | Sb | Сурьма | 834 |
| 52 | Te | Теллур | 869 |
| 53 | I | Иод | 1008 |
| 54 | Xe | Ксенон | 1170.4 |
| 55 | Cs | Цезий | 375.7 |
| 56 | Ba | Барий | 503 |
| 57 | La | Лантан | 538.1 |
| 58 | Ce | Церий | 534.4 |
| 59 | Pr | Празеодим | 527 |
| 60 | Nd | Неодим | 533.1 |
| 61 | Pm | Прометий | 540 |
| 62 | Sm | Самарий | 544.5 |
| 63 | Eu | Европий | 547.1 |
| 64 | Gd | Гадолиний | 593.4 |
| 65 | Tb | Тербий | 565.8 |
| 66 | Dy | Диспрозий | 573 |
| 67 | Ho | Гольмий | 581 |
| 68 | Er | Эрбий | 589.3 |
| 69 | Tm | Тулий | 596.7 |
| 70 | Yb | Иттербий | 603.4 |
| 71 | Lu | Лютеций | 523.5 |
| 72 | Hf | Гафний | 658.5 |
| 73 | Ta | Тантал | 761 |
| 74 | W | Вольфрам | 770 |
| 75 | Re | Рений | 760 |
| 76 | Os | Осмий | 840 |
| 77 | Ir | Иридий | 880 |
| 78 | Pt | Платина | 870 |
| 79 | Au | Золото | 890.1 |
| 80 | Hg | Ртуть | 1007.1 |
| 81 | Tl | Таллий | 589.4 |
| 82 | Pb | Свинец | 715.6 |
| 83 | Bi | Висмут | 703 |
| 84 | Po | Полоний | 812.1 |
| 85 | At | Астат | 890 |
| 86 | Rn | Радон | 1037 |
| 87 | Fr | Франций | 380 |
| 88 | Ra | Радий | 509.3 |
| 89 | Ac | Актиний | 499 |
| 90 | Th | Торий | 587 |
| 91 | Pa | Протактиний | 568 |
| 92 | U | Уран | 597.6 |
| 93 | Np | Нептуний | 604.5 |
| 94 | Pu | Плутоний | 584.7 |
| 95 | Am | Америций | 578 |
| 96 | Cm | Кюрий | 581 |
| 97 | Bk | Берклий | 601 |
| 98 | Cf | Калифорний | 608 |
| 99 | Es | Эйнштейний | 619 |
| 100 | Fm | Фермий | 627 |
| 101 | Md | Менделевий | 635 |
| 102 | No | Нобелий | 642 |
| 103 | Lr | Лоуренсий | 470 |
| 104 | Rf | Резерфордий | 580 |
| Таблица 1. Энергия ионизации, справочные данные |
Энергия сродства электрону
Также электроны могут присоединяться к атому, в процессе присоединения электрон выделяет энергию, такая энергия
называется энергией сродства электрону, для каждого электрона конкретного атома энергия сродства численно равна
и противоположна по знаку энергии ионизации, например, 17Cl, что бы оторвать 17й электрон у атома
хлора, необходимо сообщить ему 13 эВ, любой другой электрон, который присоединится на место 17го электрона
также выделит 13 эВ.
Катионы и анионы
Атомы, в которых количество протонов не равно количеству электронов называются ионами, поскольку электрон имеет
отрицательный заряд, то если электронов больше протонов, то суммарный заряд отрицательный: S2-
означает, что в данном атоме серы количество электронов больше чем протонов на два электрона. Соответственно,
если электронов меньше чем протонов, то суммарный заряд положительный и обозначается H+.
Отрицательно заряженные атомы называются анионами, положительно заряженные атомы — катионами.
Какой заряд будет у атома?
Теоретически возможно отобрать все электроны у атома, но это возможно только в лабораторных условиях и за
пределами лаборатории атомы в таком состоянии находиться не будут, почему?
Вернёмся к устройству электронной оболочки. Вокруг атома электроны сгруппированы по энергетическим уровням,
каждый заполненный уровень экранирует ядро и является более стабильным, нежели не до конца заполненный
уровень. То есть электронная конфигурация стремиться к состоянию заполненного подуровня: если на p-оболочке
находится 5 электронов, то вероятнее атом примет один электрон, нежели отдаст пять. Так, например, у атома
хлора, пять электронов на 3p-подуровне, энергия сродства хлора — 3.61 эВ, энергия ионизации — 13 эВ. У натрия
на последнем подуровне один электрон, энергия сродства — 0,78 эВ, потенциал ионизации — 0,49 эВ, поэтому
вероятнее натрий отдаст один электрон, нежели примет его.
Зная потенциал ионизации и энергию сродства мы можем сделать предположение о взаимодействии веществ. Если
смешать натрий и хлор, и сообщить им энергию, то вероятнее всего Na будет отдавать один электрон Cl и
в результате получится смесь ионов Na+ и Cl—.
Пример
Так можно по номеру элемента предположить, какой заряд он будет иметь, например, 19й элемент, электронная
конфигурация — 1s 22s 22p 63s 23p64s 1,
вероятнее всего, такой элемент может либо отдать, либо принять один электрон.
У 27го элемента электронная конфигурация выглядит так:
1s 22s 22p 63s 23p64s 23d7,
у d-подуровня всего может быть 10 атомов, т.е. либо атом примет 1,2 или 3 электрона, либо отдаст
1,2,3…7 электронов, так, вероятнее, он примет 3, т.е. возможные состояния — это +1, +2 и +3,
Теперь Вы знаете, что такое ионы, осталось изучить химическую связи и Вы сможете составлять
окислительно-восстановительные реакции!
Вам понравилась статья?
/
Просмотров: 12 925