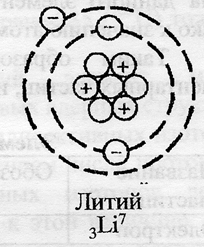
Li (литий) — элемент с прядковым номером 3 в периодической системе.
Находится во II периоде. Температура плавления: 180.5 ℃. Плотность: 0.53 г/см3.
Электронная формула атома лития:
1s2 2s1
Сокращенная электронная конфигурация Li:
[He] 2s1
Ниже приведена электронно-графическая схема атома лития
Распределение электронов по энергетическим уровням в атоме Li
1-й уровень (K): 2
2-й уровень (L): 1
Валентные электроны лития
Количество валентных электронов в атоме лития — 1.
Ниже приведены их квантовые числа (N — главное, L — орбитальное, M — магнитное, S — спин)
| Орбиталь | N | L | M | S |
|---|---|---|---|---|
| s | 2 | 0 | 0 | +1/2 |
Степени окисления, которые может проявлять литий: +1
Литий в таблице менделеева занимает 3 место, в 2 периоде.
| Символ | Li |
| Номер | 3 |
| Атомный вес | 6.9380000 |
| Латинское название | Lithium |
| Русское название | Литий |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема лития
Li: 1s2 2s1
Короткая запись:
Li: [He]2s1
Одинаковую электронную конфигурацию имеют
атом лития и
B+2, C+3, N+4
Порядок заполнения оболочек атома лития (Li) электронами:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d →
5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на
‘d’ — до 10 и на ‘f’ до 14
Литий имеет 3 электрона,
заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
1 электрон на 2s-подуровне
Степень окисления лития
Атомы лития в соединениях имеют степени окисления 1, -1.
Степень окисления — это условный заряд атома в соединении: связь в молекуле
между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается
заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается,
то степень окисления положительная.
Ионы лития
Валентность Li
Атомы лития в соединениях проявляют валентность I.
Валентность лития характеризует способность атома Li к образованию хмических связей.
Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании
химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Li
Квантовые числа определяются последним электроном в конфигурации,
для атома Li эти числа имеют значение N = 2, L = 0, Ml = 0, Ms = +½
Видео заполнения электронной конфигурации (gif):
Результат:
Соединения лития
| Тип | Формула | Название |
|---|---|---|
| Оксид | Li2O | Оксид лития |
| Пероксид | Li2O2 | Пероксид лития |
| Основание | LiOH | Гидроксид лития |
| Соль | Li2CO3 | Карбонат лития |
Энергия ионизации
Чем ближе электрон к центру атома — тем больше энергии необходимо, что бы его оторвать.
Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo.
Если не указано иное, то энергия ионизации — это энергия отрыва первого электрона, также существуют энергии
ионизации для каждого последующего электрона.
Энергия ионизации Li:
Eo = 520 кДж/моль
— Что такое ион читайте в статье.
Перейти к другим элементам таблицы менделеева
Где Li в таблице менделеева?
Таблица Менделеева
Скачать таблицу менделеева в хорошем качестве
Литий представляет собой щелочной металл с атомным номером 3 и принадлежит к группе 1 под s-блоком периодической таблицы. Давайте разберемся с электронными конфигурациями лития.
Электронная конфигурация лития (Li) равна 1s.2 2s1. Ли серебристо-белый металл. Его атомный вес составляет 6.941 ед. Li легко окисляется до оксида лития на воздухе. Он является самым легким среди металлов и обладает высокой удельной теплоемкостью. Литий в основном используется для изготовления литий-ионных аккумуляторов.
Эта статья направлена на объяснение электронной конфигурации лития и орбитальной диаграммы лития в основном состоянии.
Как написать литий-электронную конфигурацию
Атом лития состоит из 3 электронов. Следующий принцип Ауфбау, электроны будут заполняться в порядке возрастания их энергии. После этого согласно Правило Хунда, спаривание электронов происходит в противоположных направлениях в соответствии с Принцип исключения Паули.
Схема конфигурации литиевых электронов
Атом лития содержит 13 электронов. Электронная конфигурация лития выражается в виде диаграммы, приведенной ниже:
- Сначала заполняется 1s-орбиталь, имеющая минимальную энергию, с максимальной емкостью в два электрона.
- После орбитали 1s орбиталь 2s заполнена только одним электроном.
Итак, схема будет-
Обозначение конфигурации литий-электронов
Обозначение электронной конфигурации лития: [He] 2s.1.
Литий. Расшифрованная электронная конфигурация.
Полная электронная конфигурация лития равна 1s.2 2s1 . Li состоит в общей сложности из 3 электронов, которые заполнены следующим образом:
- На 1s-орбитали находятся два электрона.
- Один электрон находится на 2s-орбитали.
Литий-электронная конфигурация в основном состоянии
Электронная конфигурация основного состояния лития 1s2 2s1.
Возбужденное состояние электронной конфигурации лития
Компания возбужденное состояние электронная конфигурация лития 1s2 2p1. В возбужденном состоянии электрон с 2s-орбитали Li перескакивает на вакантную 2p-орбиталь с более высокой энергией.
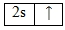
Орбитальная диаграмма лития в основном состоянии
Орбитальная диаграмма основного состояния лития показывает заполнение электронами оболочек вокруг ядра лития. Орбитальная диаграмма лития —
Электронная конфигурация оксида лития
Оксид лития ( Li2О) электронная конфигурация следующая:
- Электронная конфигурация Li1+ составляет 1 с2.
- Электронная конфигурация O2- составляет 1 с22s22p6.
Li с одним валентным электроном легко его теряет, образуя стабильный Li+ ион. Кислород с 6 валентными электронами легко получает 2 электрона, образуя стабильный O2- ион.
Заключение
Литий имеет диагональные отношения с щелочноземельным металлом магнием. Имеет ОЦК кристаллическую структуру. Среди нейтрального Li и Li-ion последний более стабилен из-за полностью заполненной внешней оболочки.
Подробнее о следующих конфигурациях:
Электронное строение атома лития
Электронное строение нейтрального атома лития в основном состоянии.
Схема строения электронных оболочек
Распределение электронов по энергетическим уровням (или по электронным слоям) в атоме лития.
Li
+3
2
1
Электронно-графическая схема
Распределение электронов по атомным орбиталям в атоме лития.
| 2 | ↑ | |
| 1 | ↑↓ | |
| s |
Валентные орбитали атома лития выделены фиолетовым цветом.
Электронная конфигурация
Полная электронная конфигурация атома лития.
3Li 1s2 2s1
Сокращённая электронная конфигурация атома лития.
3Li [He] 2s1
Квантовые числа валентных электронов
Главное (n), орбитальное (l), магнитное (m) и спиновое (s) квантовые числа валентных электронов атома лития.
| Орбиталь | Квантовое число | |||
|---|---|---|---|---|
| n | l | m | s | |
| 2s | 2 | 0 | 0 | +½ |
Содержание
- Строение атома лития
- Общие сведения о строении атома лития
- Электронное строение атома лития
- Примеры решения задач
- Литий Li
- Электронная схема лития
- Степень окисления лития
- Ионы лития
- Валентность Li
- Квантовые числа Li
- Соединения лития
- Энергия ионизации
- Литий Li
- Электронная схема лития
- Степень окисления лития
- Ионы лития
- Валентность Li
- Квантовые числа Li
- Соединения лития
- Энергия ионизации
Строение атома лития
Общие сведения о строении атома лития
Порядковый номер равен 3. Заряд ядра равен +3. Атомный вес – 6,941а.е.м.
Электронное строение атома лития
Поскольку литий расположен во втором периоде, он имеет две оболочки, одна из которых носит название внешней. Электроны, расположенные на внешней оболочке, называются валентными и участвуют в образовании химических связей. Атом лития имеет положительно заряженное ядро (+3), в котором имеется 3 протона и 4 нейтрона (разница между атомным весом и порядковым номером). По орбитам вокруг ядра движутся 3 электрона.
Рис. 1. Схематичное изображение строения атома лития.
Электронную конфигурацию атома лития можно записать двояко:
Литий, так же, как и водород и гелий относится к семейству s-элементов. Энергетическая диаграмма атома лития (на ней изображаются только валентные электроны) имеет вид:
В результате химического взаимодействия литий теряет свой валентный электрон, т.е. является его донором, и превращается в положительно заряженный ион (Li + ):
В соединениях литий проявляет степень окисления +1.
Примеры решения задач
| Задание | Запишите электронные конфигурации атомов элементов с атомными номерами 7, 16, 21. |
| Ответ | Химический элемент с атомным номером 7 – это азот. Он находится во втором периоде, следовательно, имеет две орбитали. Расположение азота в V группе Периодической таблицы свидетельствует о наличии на внешнем энергетическом уровне 5-ти валентных электронов: |
Химический элемент с атомным номером 16 – это сера. Она находится в третьем периоде, следовательно, имеет три орбитали. Расположение серы в VI группе Периодической таблицы свидетельствует о наличии на внешнем энергетическом уровне 6-ти валентных электронов:
Химический элемент с атомным номером 21 – это скандий. Он находится в четвертом периоде, следовательно, имеет четыре орбитали. Расположение скандия в III группе Периодической таблицы свидетельствует о наличии на внешнем энергетическом уровне 3-х валентных электронов:
1s 2 2s 2 2p 6 3s 2 3p 6 3d 2 4s 2 .
| Задание | Укажите номер периода и номер группы (главная или побочная подгруппа) для элементов с электронными конфигурациями атомов: |
а) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 2 ;
б) ls 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 5 ;
в) ls 2 2s 2 2р 6 3s 2 3р 6 3d 10 4s 2 4р 6 4d 10 5s 1 ;
Ответ Чтобы определить порядковый номер химического элемента по его электронной конфигурации, записанной в виде а)-в), нужно сложить все электроны. Если же конфигурация записана, как в случае г), надо прибавить к порядковому номеру элемента, указанного в квадратных скобках число электронов, «привязанных» к орбиталям.
а) 15 – это фосфор. Расположен в третьем периоде VA (главная подгруппа) группе;
б) 35 – это бром. Расположен в четвертом периоде VIIA(главная подгруппа) группе;
в) 47 – это серебро. Элемент расположен в пятом периоде IB (побочная подгруппа) группе;
г) 88 – это радий. Расположен в седьмом периоде IIA(главная подгруппа) группе.
Источник
Литий Li
Литий в таблице менделеева занимает 3 место, в 2 периоде.
| Символ | Li |
| Номер | 3 |
| Атомный вес | 6.9380000 |
| Латинское название | Lithium |
| Русское название | Литий |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема лития
Одинаковую электронную конфигурацию имеют атом лития и B +2 , C +3 , N +4
Порядок заполнения оболочек атома лития (Li) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на ‘d’ — до 10 и на ‘f’ до 14
Литий имеет 3 электрона, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
1 электрон на 2s-подуровне
Степень окисления лития
Атомы лития в соединениях имеют степени окисления 1, -1.
Степень окисления — это условный заряд атома в соединении: связь в молекуле между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается, то степень окисления положительная.
Ионы лития
Валентность Li
Атомы лития в соединениях проявляют валентность I.
Валентность лития характеризует способность атома Li к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Li
Квантовые числа определяются последним электроном в конфигурации, для атома Li эти числа имеют значение N = 2, L = 0, Ml = 0, Ms = ½
Видео заполнения электронной конфигурации (gif):
Результат:
Соединения лития
| Тип | Формула | Название |
|---|---|---|
| Оксид | Li2O | Оксид лития |
| Пероксид | Li2O2 | Пероксид лития |
| Основание | LiOH | Гидроксид лития |
| Соль | Li2CO3 | Карбонат лития |
Энергия ионизации
Чем ближе электрон к центру атома — тем больше энергии необходимо, что бы его оторвать. Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo. Если не указано иное, то энергия ионизации — это энергия отрыва первого электрона, также существуют энергии ионизации для каждого последующего электрона.
Перейти к другим элементам таблицы менделеева
Источник
Литий Li
Литий в таблице менделеева занимает 3 место, в 2 периоде.
| Символ | Li |
| Номер | 3 |
| Атомный вес | 6.9380000 |
| Латинское название | Lithium |
| Русское название | Литий |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема лития
Одинаковую электронную конфигурацию имеют атом лития и B +2 , C +3 , N +4
Порядок заполнения оболочек атома лития (Li) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на ‘d’ — до 10 и на ‘f’ до 14
Литий имеет 3 электрона, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
1 электрон на 2s-подуровне
Степень окисления лития
Атомы лития в соединениях имеют степени окисления 1, -1.
Степень окисления — это условный заряд атома в соединении: связь в молекуле между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается, то степень окисления положительная.
Ионы лития
Валентность Li
Атомы лития в соединениях проявляют валентность I.
Валентность лития характеризует способность атома Li к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Li
Квантовые числа определяются последним электроном в конфигурации, для атома Li эти числа имеют значение N = 2, L = 0, Ml = 0, Ms = ½
Видео заполнения электронной конфигурации (gif):
Результат:
Соединения лития
| Тип | Формула | Название |
|---|---|---|
| Оксид | Li2O | Оксид лития |
| Пероксид | Li2O2 | Пероксид лития |
| Основание | LiOH | Гидроксид лития |
| Соль | Li2CO3 | Карбонат лития |
Энергия ионизации
Чем ближе электрон к центру атома — тем больше энергии необходимо, что бы его оторвать. Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo. Если не указано иное, то энергия ионизации — это энергия отрыва первого электрона, также существуют энергии ионизации для каждого последующего электрона.
Перейти к другим элементам таблицы менделеева
Источник