Расчет вязкости жидких неоднородных смесей (суспензий, коллоидных растворов, эмульсий).
Расчет вязкости жидких неоднородных смесей (суспензий, коллоидных растворов, эмульсий).Эйнштейн [84]впервые сформулировал зависимость вязкости системы, состоящей из сферических частиц полностью твердого вещества, взвешенных в жидкости, от объемной концентрацииp твердой фазы. Математически он угадал зависимость: (VII1-64) ИСМ = МФ о-б 2.5 <п) Г^еРж-вязкость чистой жидкости. Формула была проверена экспериментально, и в этом случае оказалось, что коэффициентp равен не 2,5, а 2,9.
В более поздних исследованиях отмечено множество сложных побочных эффектов (образование адсорбционных слоев на поверхности частиц в дисперсной фазе, заряд частиц и др.) привели к выводу, что результаты расчетов по уравнению Эйнштейна часто не согласуются с экспериментальными данными.
Людмила Фирмаль
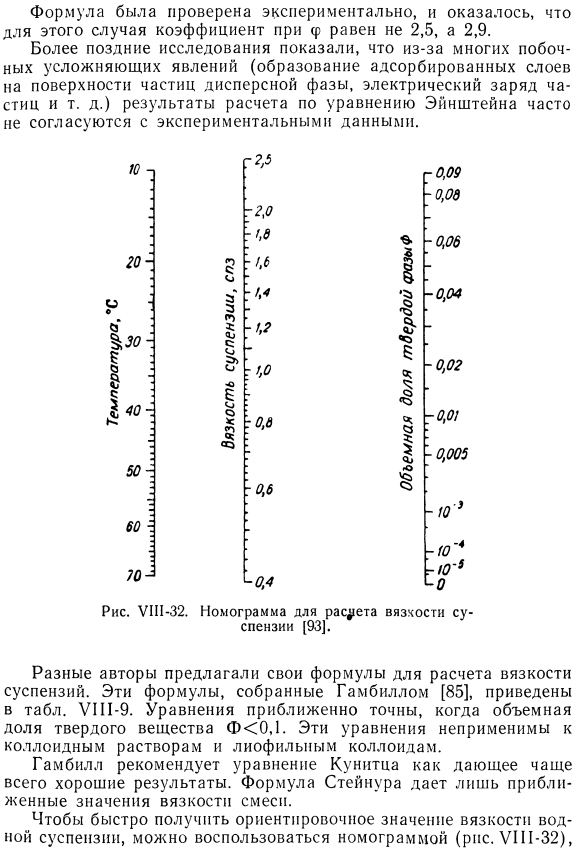
- Рисунок U1N-32.Номограмма для расчета вязкости суспензии[93]. Различные авторы предложили собственную формулу для расчета вязкости суспензии. Эти выражения собраны по Gambill [85]приведены в таблице. УП1-9.Уравнение является приблизительно точным, если объемная доля твердого тела составляет<0,1.Эти уравнения не применимы к коллоидным растворам и Лиофильным коллоидам. Гумвилл рекомендует использовать уравнение кница для достижения хороших результатов в большинстве случаев.
- Формула Штейнура дает только приблизительные значения вязкости смеси. Для быстрого получения приблизительного значения вязкости водной суспензии можно использовать номограмму (рисунок U1P-32). УШ-ТАБЛИЦА Формула для расчета вязкости суспензии(85) Разработано Дэвисом [93].Используйте эту номограмму для быстрого решения уравнения Гутчека[88] см. Вешалка. VI11-9.Точка, соответствующая температуре суспензии, отмечена на левой оси, а точка, соответствующая объемной доле F твердых веществ в суспензии, отмечена на правой оси. Прямая линия, соединяющая эти точки, пересекает центральную ось в точках, соответствующих вязкости твердой суспензии в воде. Кургаев [94]предложил уравнение для расчета вязкости суспензии. (VI11-65) Где rcm-вязкость суспензии. hr-вязкость чистой жидкости; c-концентрация твердой фазы с = п » 2 ^ 1(КС-()б) N-число частиц на единицу длины пространства, заполненного жидкостью. D-размер частиц.
Формула Уш-65 дает очень хороший результат при концентрации с <0,25(таблица УПО).
Людмила Фирмаль
- Стол Сравнение расчетных и экспериментальных значений Ism / Mf Для расчета вязкости смеси из 2 несмешивающихся жидкостей Гамбилл [85]рекомендует применять формулу Тейлора* [95]. ^ −1 + 2 «(t7Tgg) (VII,<7、 Где М-см-вязкость смеси(эмульсии). cs-вязкость жидкой непрерывной фазы. rd-вязкость жидкой дисперсной фазы. Ф-объемная доля дисперсной фазы. Neogi и Chosh [96]исследовали водные ксилоловые эмульсии, стабилизированные различными emulsifiers. In в этом примере мы проверили уравнения, предложенные разными авторами. Они обнаружили, что модифицированное уравнение Ричардсона наиболее согласуется с результатами экспериментов. Рэм__ _ если + ы Где<Р-объемное соотношение фаз. Погрешность расчета-5%.Величина константы с зависит от природы эмульгатора.
Смотрите также:
Методические указания по гидравлике
Возможно эти страницы вам будут полезны:
- Вязкость растворов электролитов и твердых неэлектролитов.
- Вязкость смеси двух жидкостей.
- Выбор метода расчета вязкости смеси жидкостей.
- Теплопроводность по кинетической теории газов
Рассмотрим три наиболее распространенных метода измерения вязкости:
-
Капиллярный
метод (вискозиметр Оствальда).
В
специальный капилляр заливают определенный
объем жидкости V
(см3)
и она вытекает под давлением Р (дин/см2)
в течение времени (сек),
высота l
и радиус r.
Пуазейль показал:
,
где
— коэффициент вязкости.
Чаще
проводят сравнительное определение
вязкости. Для этого измеряют время
истечения
и 1
одинаковых объемов испытуемой и
стандартной жидкости, тогда
,
где
— плотность.
-
Метод
падающего шарика.
Измеряется
скорость v,
с которой шарик из известного материала
падает в вязкой среде. Стокс вывел
уравнение:
,
где
r
– радиус
шарика;
1
– плотность шарика;
2
– плотность среды.
Можно
проводить и относительные измерения:
.
-
Метод
вращающегося цилиндра.
Внешний
цилиндр вращается с постоянной скоростью.
От него начинает вращаться жидкость в
сосуде, а затем и сам внутренний цилиндр,
подвешенный внутри на нити. По углу
закручивания внутреннего цилиндра
и постоянной угловой скоростью
в двух различных жидкостях, для одной
из них
известна.
.
|
Раздел |
СТАБИЛИЗАЦИЯ СОСТОЯНИЕМ |
Глава 6.1 суспензии
Суспензии
— это дисперсные системы, в которых
дисперсной фазой являются частицы
твердого вещества размером, более 10 -5
см.,
дисперсной
средой – жидкость.
Формально
суспензии от лиозолей (коллоидных
растворов) отличаются только размерами
частиц дисперсной фазы. Размеры твердых
частиц в суспензиях (более 10-5
см.)
могут быть на несколько порядков больше,
чем в лиозолях (10-7-10-5
см). Это количественное различие
обусловливает чрезвычайно важную
особенность суспензий: в большинстве
суспензий частички твердой фазы не
участвуют в броуновском движении.
Поэтому свойства суспензий существенно
отличаются от свойств коллоидных
растворов; их рассматривают как
самостоятельный вид дисперсных систем.
Суспензии
классифицируются по нескольким признакам:
1.
По природе дисперсионной среды:
органосуспензии (дисперсионная среда
— органическая жидкость) и водные
суспензии.
2.
По размерам частиц дисперсной фазы:
грубые суспензии (d
> 10-2
см), тонкие суспензии (-510-5<
d
< 10-2
см), мути (110-5<
d
< 510-5
см).
3. По концентрации
частиц дисперсной фазы: разбавленные
суспензии (взвеси) и концентрированные
суспензии (пасты).
В
разбавленных суспензиях частицы свободно
перемещаются в жидкости, сцепление
между частицами отсутствует и каждая
частица кинетически независима.
Разбавленные суспензии — это
свободнодисперсные бесструктурные
системы. В концентрированных суспензиях
(пастах) между частицами действуют силы,
приводящие к образованию определенной
структуры (пространственной сетки).
Таким образом, концентрированные
суспензии — это связнодисперсные
структурированные
системы.
Конкретные
значения концентрационного интервала,
в котором начинается структурообразование,
индивидуальны и зависят, в первую очередь
от природы фаз, формы частиц; дисперсной
фазы, температуры, механических
воздействий. Механические свойства
разбавленных суспензий определяются,
главным образом, свойствами дисперсионной
среды, а механические свойства
связнодисперсных систем определяются,
кроме того, свойствами дисперсной фазы
и числом контактов между частицами.
Суспензии,
так же как и любую другую дисперсную
систему, можно получить двумя группами
методов: со стороны грубодисперсных
систем — диспергационными
методами,
со стороны истинных растворов —
конденсационными
методами.
Наиболее
простым и широко распространенным как
в промышленности, и в быту методом
получения разбавленных суспензий
является взбалтывание соответствующего
порошка в подходящей жидкости с
использованием различных перемешивающих
устройств (мешалок, миксеров и т. д.). Для
получения концентрированных суспензий
(паст) соответствующие порошки растирают
с небольшим количеством жидкости.
Так
как суспензии отличаются от лиозолей
только тем, что частицы в них на несколько
порядков больше, все методы, которые
используются для получения золей, можно
применять и для получения суспензий.
При этом необходимо, чтобы степень
измельчания диспергациониыми методами
была меньше, чем при получении лиозолей.
При конденсационных методах конденсацию
необходимо проводить так, чтобы
образовывались частицы, имеющие размеры
10-5
– 10-2
см. Размер образующихся частиц зависит
от соотношения скоростей образования
зародышей кристаллов и их роста. При
небольших степенях пресыщения обычно
образуются крупные частицы, при больших
— мелкие. Предварительное введение в
систему зародышей кристаллизации
приводит к образованию практически
монодисперсных суспензий. Уменьшение
дисперсности может быть достигнуто в
результате изотермической перегонки
при нагревании, когда мелкие кристаллы
растворяются, а за их счет растут крупные.
При
этом должны соблюдаться условия,
ограничивающие возможности значительного
разрастания и сцепления частиц дисперсной
фазы. Дисперсность образующихся суспензий
можно регулировать также введением
ПАВ.
Суспензии
очищают от примесей растворенных веществ
диализом, электродиализом, фильтрованием,
центрифугированием.
Суспензии образуются
также в результате коагуляции лиозолей.
Следовательно, способы осуществления
коагуляции — это одновременно и методы
получения суспензий. Отсутствие структуры
в разбавленных суспензиях и наличие ее
в концентрированных обусловливает
резкое различие в свойствах этих систем.
Оптические
свойства разбавленных суспензий:
длины волн видимой части спектра лежат
в пределах от 410-5
см (фиолетовый свет) до 710-5
см (красный свет). Световая волна, проходя
через суспензию, может поглощаться
(тогда суспензия окрашена), отражаться
от поверхности частиц дисперсной фазы
по законам геометрической оптики (тогда
суспензия выглядит как мутная) и только
в высокодисперсных суспензиях — мутях
(510-5)
может наблюдаться светорассеяние,
отклоняющееся от закона Рэлея.
В
оптический микроскоп видны частицы,
размер которых не менее 510-5
см, что соответствует большинству
разбавленных суспензий.
Электрокинетические
свойства суспензий
подобны аналогичным свойствам гидрозолей
и обусловлены образованием на поверхности
частиц ДЭС и возникновение потенциала.
В
суспензиях проявляются все 4 вида
электрокинетических явлений. Наиболее
широкое применение нашел электрофоретический
метод нанесения покрытий на разные
поверхности.
Молекулярно-кинетические
свойства суспензий
отличаются в зависимости от размеров
частиц суспензий. Для частиц 10-4
– 10-5
см наблюдается седиментационно-диффузионное
равновесие. Описываемое соответствующем
уравнением (см. седимент. устойчивость)
Для
частиц 10-4
– 10-2
броуновское движение практически
отсутствует и для них характерна быстрая
седиментация (см. седимент. устойчивость).
т.е. для них применим седиментационный
анализ.
Седиментационная
устойчивость суспензии
— это способность её сохранять неизменным
во времени распределение частиц по
объему системы, т. е. способность системы
противостоять действию силы тяжести.
Так
как большинство суспензий оказываются
полидисперсными системами, содержащими
и относительно крупные частицы, то они
являются седиментационно
(кинетически)
неустойчивыми системами.
Изучение
седиментации суспензий связано с
получением кривых накопления осадка
(кривых седиментации) m=f(t).
Кривыe
накопления могут быть двух видов: с
перегибом или без перегиба. Установлено,
что вид кривых седиментации зависит от
того, является ли седиментирующая
суспензия агрегативно устойчивой или
нет. Если седиментация сопровождается
укрупнением частиц, а следовательно,
увеличением скорости их оседания, то
на кривых седиментации появляется точка
перегиба. Если же суспензия агрегативно
устойчива (нет коагуляций), то на кривой
седиментации перегиб отсутствует.
Характер осадков, полученных в том и
другом случаях, также различен.
В
агрегативно устойчивых суспензиях
оседание частиц происходит медленно и
формируется очень плотный осадок.
Объясняется это тем, что поверхностные
слои препятствуют агрегированию частиц;
скользя друг по другу, частицы могут
перейти в положение с минимальной
потенциальной энергией, т.е. с образованием
упаковки, близкой к плотнейшей. В этом
случае расстояние между частицами и
координационное число (число соседних
частиц) в осадке такой седиментирующей,
но предельно стабилизированной суспензии,
определяется соотношением между:
-
силой тяжести;
-
межмолекулярным
притяжением частиц; -
силами
отталкивания между частицами,
обеспечивающими агрегативную устойчивость
суспензии.
В
агрегативно
неустойчивых суспензиях
оседание частиц происходит значительно
быстрее вследствие образования агрегатов.
Однако выделяющийся осадок занимает
гораздо больший объем, так как частицы
сохраняют, то случайное взаимное
расположение, в котором они оказались
при первом же контакте, силы сцепления
между ними соизмеримы с их силой тяжести
или больше ее. Наблюдается анизометрия
(т. е. преобладание одного из размеров
частицы над двумя другими) образующихся
агрегатов или флокул. Исследования
показывают, что наиболее вероятны
цепочечные и спиральные первоначальные
агрегаты, из которых затем получаются
осадки большого седиментационного
объема.
Различие
седиментационных объемов агрегативно
устойчивых и неустойчивых систем
наиболее, четко проявляется, если частицы
имеют средние размеры. Если частицы
крупные, то, несмотря на то, что суспензия
агрегативно неустойчивая, осадок
получается более плотным из-за значительной
силы тяжести, зачастую преобладающей
над силами сцепления между частицами.
Если же частицы очень мелкие, то и в
агрегативно устойчивой системе из-за
малой силы тяжести образуется чрезвычайно
подвижный осадок.
Агрегативная
устойчивость суспензии
— это способность сохранять неизменной
во времени степень дисперсности т. е.
размеры частиц и их индивидуальность.
Агрегативная
устойчивость разбавленных суспензий
весьма сходна с агрегативной устойчивостью
лиофобных золей. Но суспензии являются
более агрегативно устойчивыми системами,
так как содержат более крупные частицы
и следовательно, имеют меньшую свободную
поверхностную энергию.
При
нарушении агрегативной устойчивости
суспензии происходит коагуляция
— слипание частиц дисперсной фазы.
Для
достижения агрегативной устойчивости
суспензии необходимо выполнение по
крайней мере одного из двух условий:
-
смачиваемость
поверхности частиц дисперсной фазы
дисперсионной средой; -
наличие стабилизатора.
Первое
условие.
Если частицы суспензии хорошо смачиваются
дисперсионной средой, то на их поверхности
образуется сольватная оболочка,
обладающая упругими свойствами и
препятствующая соединению частиц в
крупные агрегаты. Хорошая смачиваемость
частиц наблюдается в суспензиях полярных
частиц в полярных жидкостях и неполярных
частиц в неполярных жидкостях.
Второе
условие.
Если частицы суспензии не смачиваются
или плохо смачиваются дисперсионной
средой, то используют стабилизатор.
Стабилизатор
— это вещество, добавление которого в
дисперсную систему повышает ее
агрегативную устойчивость, т. е.препятствует
слипанию частиц.
В
качестве стабилизаторов суспензий
применяют:
-
низкомолекулярные
электролиты; -
коллоидные ПАВ;
-
ВМС.
Механизм
их стабилизирующего действие различен,
в зависимости от природы стабилизатора
реализуется один, а чаще несколько
факторов устойчивости, аналогично тому,
как это происходит в лиофобных золях.
Возможные факторы устойчивости:
адсорбционно-сольватный, электростатический,
структурно-механический, энтропийный,
гидродинамический.
Если
стабилизатор является ионогенным
веществом, то обязательно действует
электрический фактор устойчивости: на
поверхности частиц образуется двойной
электрический слой, возникает
электрокинетический потенциал и
соответствующие электростатические
силы отталкивания, препятствующие
слипанию частиц. Электростатическое
отталкивание частиц описано теорией
ДЛФО. Если его ионогенное вещество —
низкомолекулярный неорганический
электролит, то его стабилизирующее
действие ограничивается только этим
фактором. Если же ионогенное вещество
– коллоидное — ПАВ или полиэлектролит,
то реализуются и другие факторы
устойчивости, рассмотрим их подробнее.
Стабилизирующее
действие
коллоидных ПАВ определяется их
способностью адсорбироваться на
межфазной поверхности, образуя
адсорбционные пленки. Строение
адсорбционного слоя зависит от:
-
природы ПАВ; .
-
природы
межфазной поверхности (границы: «твердая
частица — жидкая среда»); -
степени заполнения
поверхности; -
наличия в
дисперсионной среде различных добавок.
Изменение
строения адсорбционного слоя отражается
на его защитных свойствах.
Коллоидное
ПАВ, имея дифильное строение, способно
адсорбироваться как на полярных, так и
на неполярных поверхностях, лиофилизируя
их.
В
соответствии с правилом уравнивания
полярностей Ребиндера стабилизирующее
действие ПАВ проявляется тем заметнее,
чем больше первоначальная разница в
полярностях твердой частицы и жидкой
дисперсионной среды.
Но
лучший стабилизирующий эффект достигается
при более специфическом выборе ПАВ.
Подбор ПАВ для стабилизации суспензий
различного типа сходен с подбором ПАВ
для стабилизации и прямых, обратных
эмульсий.
В пищевой
промышленности для этих целей используются
липоиды (лецитин), ланолин и т.д.
Максимум
стабилизирующих свойств наблюдается
у ПАВ с 14-16 атомами углерода (так называемый
максимум Доннана). В пищевой промышленности
для этих целей используют пропиловый
спирт, соли высших карбоновых кислот и
т.д.
В
качестве стабилизаторов дисперсных
систем, в том числе и суспензий, можно
использовать только такие ВМС, которые
являются поверхностно-активными
веществами. Эти вещества отличаются от
коллоидных ПАВ тем, что для них характерно
возникновение структурно-механического
фактора устойчивости.
Таким
образом, если в качестве стабилизатора
применяются ВМС, то механизм их действия
аналогичен механизму коллоидной защиты
лиофобных золей.
В
этих условиях существенно возрастает
роль энтропийного фактора устойчивости.
Если в качестве ВМС используют
полиэлектролиты, то к этим двум факторам
добавляется третий – электростатический.
Полиэлектролиты
применяют для водных суспензий, т.е. для
стабилизации гидрофобных частиц в
жидкости. Наиболее распространены –
альгинаты, карбоксиметил целлюлозы,
алкилполиамин.
Механические
методы разрушения суспензий основаны
на отделении вещества дисперсной фазы
от дисперсионной среды. Для этого
используют различные устройства:
отстойники, фильтры центрифуги. Они
используются на завершающей стадии
разрушения, когда агрегативная
устойчивость суспензий уже минимальна
или отсутствует.
Термические
методы разрушения суспензий основаны
на изменении температуры суспензии.
Осуществляются двумя способами:
1)
Замораживание с последующим оттаиванием;
2)
Высушивание (т.е. концентрирование).
Они
требуют больших энергозатрат и в
промышленности не используются.
Химические
методы разрушения суспензий основаны
на использовании химических реагентов.
Поэтому часто их часто называют
реагентными.
Цель
применения
– понизить агрегативную устойчивость,
т.е. снизить потенциальный барьер
коагуляции. В зависимости от факторов
устойчивости, которые преимущественно
реализовывались в данной суспензии, и
стабилизаторов, которые присутствуют,
выбирают соответствующие реагенты.
Из
хлорсодержащих соединений алюминия
наибольшее распространение получили
хлорид алюминия и гидроксохлориды
алюминия. Гидроксохлориды алюминия –
это соединения переменного состава,
которые выражаются общей формулой
[А1(ОН)3
– xСlx]n,
где х
меняется от 0 до 3.
В
настоящее время преимущественно
использует пентагидроксохлорид алюминия
А12(ОН)5С1,
так он имеет меньшую кислотность,
интенсифицирует хлопьеобразование,
дает малое остаточное содержание
алюминия, его растворы не требуют
использования нержавеющих сталей и
противокоррозийной защиты аппаратов
и оборудования.
Эффективным
методом понижения агрегативной
устойчивости суспензий является
сенсибилизация. Для этого обычно
используются флокулянты – линейные
полимеры с длиной цепочки до 1 мк, несущие
полярные группы на обоих концах цепи.
Длинная молекула полимера присоединяется
двумя концами к двум разным частицам
дисперсной фазы, скрепляя их углеводородным
мостиком. Образуются флокулы — рыхлый
хлопьевидный осадок.
Частицы
различного происхождения имеют различное
распределение зарядов, гидрофильных и
гидрофобных областей на поверхности.
Вследствие этого не представляется
возможным применение некоего универсального
полимерного флокулянта, необходим набор
флокулянтов.
Полиакриламид,
ПВО, ПДМДА являются наиболее широко
применяемыми флокулянтами, выпускаемыми
отечественной промышленностью. Из
зарубежных флокулянтов, имеющих доступ
на российский рынок, высокими флокулирующими
свойствами обладают японские санфлоки
N-520p,
AH-70p, AS-310p, Al-310p, Al-110p, CH-799p
Необходимая
концентрация флокулянта в суспензии
зависит от концентрации в ней взвешенных
частиц. Количество флокулянта должно
составлять 0,01 — 2% от 1 массы твердой фазы.
В противном случае может быть достигнут
обратный эффект — произойдет коллоидная
защита взвешенных частиц.
Способ
внесения полимера существенно сказывается
на результатах коагуляции суспензии.
Установлено, что лучше всего флокулянт
добавлять дробно в виде двойной добавки,
т.е. вся доза флокулянта первоначально
добавляется к половине объема суспензии,
а через некоторое время этот раствор
сливают со второй половиной исходной
суспензии.
Электрические
методы разрушения суспензий используются
в тех случаях, когда частицы в суспензиях
имеют заряд, т. е. стабилизированы
ионогенными веществами. В разрушаемой
суспензии создается разность потенциалов,
приводящая к направленному движению
заряженных частиц и осаждению их на
соответствующем электроде. Эти методы
требуют больших энергетических затрат
и специального оборудования и обычно
не используются для разрушения больших
объёмов суспензий.
Свойства
суспензии в значительной степени
определяются размерами частиц дисперсной
фазы. Дисперсионный
анализ –
это совокупность методов измерения
размеров частиц. При дисперсионном
анализе определяют также дисперсность
D
и удельную поверхность Sуд.
Методы дисперсионного
анализа можно разделить на три группы.
1)
Методы измерения
параметров отдельных частиц
(размеров, массы и т. д.) с последующей
статистической обработкой результатов
большого числа измерений:
• методы,
в которых линейные
размеры частиц измеряют с помощью
оптического микроскопа,
который обеспечивает предел измерений
от 1 мкм до нескольких миллиметров, и
электронного микроскопа, позволяющего
измерять размеры частиц от 1 нм до
нескольких микрон;
• методы,
основанные на
измерении электрического сопротивления
при пропускании суспензии порошка через
тонкий канал с помощью счётчиков
Культера,
позволяющие измерять размеры частиц
от 0,1 до 100 мкм;
• методы,
в которых измеряют изменения
светового потока при пропускании
суспензии через тонкий канал, вызванные
попаданием в этот канал частиц дисперсной
фазы. Позволяют
измерять размеры частиц от 5 до 500 мкм;
• методы,
в которых измеряют интенсивность света,
рассеянного единичной частицей, с
помощью ультрамикроскопа или поточного
ультрамикроскопа Дерягина-Власенко
(размеры частиц от 2 до 500 нм).
2)
Методы, основанные на механическом
разделении дисперсной системы на
несколько классов по крупности частиц:
• ситовый анализ
(размеры частиц от 0,05 до 10 мм);
• разделение
частиц в потоке газа или жидкости
(размеры частиц от 0,1 до нескольких
миллиметров).
3) Методы, основанные
на изучении свойств ансамбля частиц:
• методы
седиментационного
анализа,
основанные на регистрации кинетики
накопления осадка. Седиментационный
анализ
состоит в экспериментальном получении
кривой
седиментации,
т. е. зависимости массы осадка m
дисперсной фазы от времени осаждения
t.
Седиментометр Фигуровского позволяет
определить размеры частиц от 1 до 500 мкм.
Применение центрифуг позволяет снизить
предел измерения до 0,1 мкм, а ультрацентрифуг
– до 1-100 нм (в этом случае можно измерять
даже размеры крупных молекул);
• методы
рассеяния
света малыми
частицами (нефелометрия и турбодиметрия),
методы неупругого рассеяния, а также
рассеяния рентгеновских лучей, нейтронов;
• адсорбционные
методы, используемые для определения
удельной поверхности частиц. Измеряют
количество адсорбированного вещества
в мономолекулярном слое. Наиболее
распространён метод низкотемпературной
газовой адсорбции с использованием
азота (аргона, криптона) в качестве
адсорбата. Удельную поверхность
высокодисперсной твёрдой фазы часто
определяют методом адсорбции из раствора.
Адсорбатом при этом служат красители,
ПАВ или другие вещества, малые изменения
концентрации которых легко определяются
с достаточно высокой точностью. Удельную
поверхность частиц можно находить также
по теплоте адсорбции (или смачивания).
Поточные микрокалориметры позволяют
проводить измерения как в газовой, так
и в жидкой среде. Разнообразные
адсорбционные методы дисперсионного
анализа позволяют определять удельные
поверхности 10-103
м2
/г, что примерно соответствует размерам
частиц от 10 до 1000 нм;
• методы,
основанные
на исследовании газопроницаемости слоя
анализируемого вещества
при фильтровании через него воздуха
при атмосферном давлении или в вакууме.
Эти методы позволяют определять удельную
поверхность;
• в
ряде случаев дисперсность порошков
измеряют по
скорости растворения, теплофизическим,
магнитным и другим характеристикам
системы,
связанным с размером частиц дисперсной
фазы или межфазной поверхности.
Во
всех упомянутых методах дисперсионного
анализа получают, как правило, интегральную
характеристику, позволяющую судить о
некоторых средних параметрах системы.
В некоторых случаях удаётся определить
также дифференциальную функцию
распределения числа частиц (их объёма,
массы) по размерам.
Относительная вязкость суспензии [math]displaystyle{ eta }[/math] (отношение вязкости суспензии к вязкости дисперсионной среды) зависит от многих факторов: температуры T, степени дисперсности, объемной доли [math]displaystyle{ varphi }[/math] дисперсной фазы, скорости сдвига (градиента скорости) [math]displaystyle{ dot{gamma} }[/math] и времени действия сдвигового напряжения (в случае наличия релаксационных эффектов – тиксотропии или реопексии).
Формула Кригера
Зависимость относительной вязкости суспензии [math]displaystyle{ eta }[/math] от объемной доли дисперсной фазы [math]displaystyle{ varphi }[/math] при постоянной скорости сдвига описывается формулой Кригера[1]:
[math]displaystyle{ (1) qquad eta=left ( 1-frac{varphi}{varphi_0} right )^{-varphi_0[eta]} }[/math]
Где [math]displaystyle{ [eta] }[/math]– характеристическая вязкость, [math]displaystyle{ varphi_0 }[/math] – максимальное количество твердой фазы, которое можно ввести в суспензию; при этом вязкость суспензии стремится к бесконечности.
Эта формула выведена из следующих посылок [1]
A) При объемной доле твердой фазы, стремящейся к нулю, относительная вязкость суспензии стремится к единице, а ее производная по объемной доле дисперсной фазы – к характеристической вязкости:
[math]displaystyle{ (2) qquad begin{cases} eta(0)=1\ {deta(0) over dvarphi}=[eta] end{cases} }[/math]
B) [math]displaystyle{ eta(varphi) }[/math]должна удовлетворять функциональному уравнению Кригера [1]:
[math]displaystyle{ (3) qquad etabigl(varphi_1+varphi_2bigr)=eta(varphi_1)etaleft ( frac{varphi_2}{1-varphi_1/varphi_0} right ) }[/math]
Где [math]displaystyle{ varphi_1 }[/math] и [math]displaystyle{ varphi_2 }[/math] – объемные доли одного и того же компонента, вводимые по частям.
Заменяя в уравнении (3) [math]displaystyle{ varphi_1 }[/math] на [math]displaystyle{ varphi }[/math], а [math]displaystyle{ varphi_2 }[/math] на дифференциал [math]displaystyle{ dvarphi }[/math], получим дифференциальное уравнение, решение которого, с учетом начальных условий (2) и есть формула Кригера (1).
Рис.1. Типы кривых течения
Обобщение формулы Кригера на случай многокомпонентной суспензии имеет вид[2]:
[math]displaystyle{ (4) qquad eta=left (1-sum_{i=1}^n frac{varphi_i}{varphi_{0,i}} right)^{-overline{varphi}_0[overline{eta}]} }[/math]
где [math]displaystyle{ [overline{eta}] }[/math] – среднеобъемная характеристическая вязкость [math]displaystyle{ [overline{eta}]=frac{sum[eta_i]varphi_i}{varphi} }[/math],
[math]displaystyle{ overline{varphi_0} }[/math] – среднегармоническая предельная концентрация [math]displaystyle{ overline{varphi_0}=frac{varphi}{sum varphi_i/varphi_{0,i}} }[/math],
[math]displaystyle{ varphi }[/math] – суммарная объемная доля твердой фазы [math]displaystyle{ varphi=sum varphi_i }[/math].
Типы кривых течения
Кривые течения – графики зависимости сдвигового напряжения [math]displaystyle{ tau }[/math] от скорости сдвига [math]displaystyle{ dot{gamma} }[/math].
Рис. 2 Зависимость напряжения сдвига от скорости сдвига для дисперсий окиси хрома по данным [4]. Различные кривые соо тветствуют различным концентрациям дисперсной фазы.
На рис. 1 схематично показаны 4 различные типа кривых течения:
(1) – ньютоновская жидкость,
(2) – бингамовский пластик,
(3) – дилатантная суспензия,
(4) – структурно-вязкая (псевдопластичная) суспензия,
[math]displaystyle{ tau_0 }[/math] – предел текучести.
Обобщенную формулу Кригера (4) можно использовать для количественного описания всех типов кривых течения, если принять следующие предположения:[4]:
- Однокомпонентную суспензию можно рассматривать как систему, состоящую из двух фракций: одиночных зерен суспензии и их димеров, причем одиночным зернам и их димерам соответствуют различные значения параметров [math]displaystyle{ [eta] }[/math] и [math]displaystyle{ varphi_0 }[/math];
- Димеризацию одиночных зерен можно рассматривать как реакцию с константой скорости [math]displaystyle{ k_1 }[/math], распад димеров – как реакцию с константой скорости, линейно зависящей от скорости сдвига [math]displaystyle{ dot{gamma} }[/math]: [math]displaystyle{ k=k_2+k_3dot{gamma} }[/math]
Рис.3. N-образная кривая (псевдопластичное течение сменяется на дилатантное)
Любой скорости сдвига соответствуют свои равновесные концентрации одиночных зерен и димеров, исходя из которых, можно вычислить зависимость напряжения сдвига [math]displaystyle{ tau }[/math] от скорости сдвига [math]displaystyle{ dot{gamma} }[/math].с помощью следующей формулы:
(5) [math]displaystyle{ tau=tau_0+eta_0dot{gamma}left ( 1-frac{varphi_1}{varphi_{01}}-frac{varphi_2}{varphi_{02}} right )^{-tfrac{[eta_1]varphi_1+[eta_2]varphi_2}{varphi_1/varphi_{01}+varphi_2/varphi_{02}}} }[/math],
где [math]displaystyle{ varphi_1=sqrt{varkappa^2+2varkappavarphi}-varkappa }[/math], [math]displaystyle{ varphi_2=varphi-varphi_1 }[/math], при этом [math]displaystyle{ varkappa=varkappa_0+varkappa_1dot{gamma} }[/math] – параметр, связанный с константой равновесия между одиночными зернами и их димерами и линейно зависящий от скорости сдвига.
Формула (5) хорошо согласуется с экспериментальными данными (рис. 2).
Однако существуют суспензии, в которых характер течения меняется с ростом скорости сдвига: псевдопластичное поведение сменяется дилатантным ([5]) или наоборот. Для описания таких систем необходимо учитывать образование не только димеров зерен дисперсной фазы, но и их тримеров. В этом случае кривые течения при определенных значениях параметров приобретают точку перегиба, т.е. принимают S- или N-образную форму (рис. 3 и 4)
Рис. 4. S-образная кривая (дилатантное течение сменяется на псевдопластичное)
Литература
- Krieger I.M. Flow Properties of Latex and Concentrated Solutions. В кн. «Surfaces and Coatings Related to Paaper and Wood». A Symposium, State University College of Forestry at Syracuse University, Syracuse University Press. 1967 P. 25-51.
- Barnes H.A., Hutton J.F., Walters K. An Introduction to Rheology. Rheology series 3, Elsevier. 1988. P. 119-125.
- Левинский А.И. Вязкость суспензий: формула Кригера–Догерти и эффект Фарриса» // Известия вузов. Химия и химическая технология, 2005. т. 48 №12. с. 22-25
- Левинский А.И. Напряжения сдвига при течении структурированных суспензий // Журнал Физической Химии, 2021, т. 95 № 7 – с. 1131-1134.
- Laun H.M. Rheological properties of aqueous polymer dispersions. // Angew. Macromol. Chem, 1984, 123, p. 335–359
Примечания
- ↑ 1,0 1,1 Krieger I.M. В кн. «Surfaces and Coatings Related to Paper and Wood» // Flow Properties of Latex and Concentrated Solutions.. — A Symposium, State University College of Forestry at Syracuse University: Syracuse University Press, 1967. — С. 25-51.
- ↑ Левинский А.И. Вязкость суспензий: формула Кригера–Догерти и эффект Фарриса // Известия вузов. Химия и химическая технология. — 2005. — Т. 48, № 12. — С. 22-25.
ОПРЕДЕЛЕНИЕ ВЯЗКОСТИ ДИСПЕРСИОННОЙ СРЕДЫ МАГНИТНОЙ СУСПЕНЗИИ
Г.1 Вязкость дисперсионной среды суспензии на основе масла и масляно-керосиновых смесей измеряют при их приготовлении и в процессе использования с периодичностью, указанной в НД отрасли или предприятия.
Г.2 Кинематическую вязкость измеряют в соответствии с ГОСТ 33 вискозиметрами типа ВПЖ-1, ВПЖ-2, ВПЖ-4 или ВНЖ — по ГОСТ 10028-81. Допускается применение других вискозиметров, имеющих такие же характеристики. Вязкость измеряют после отстоя суспензии не менее 1 ч или фильтрации.
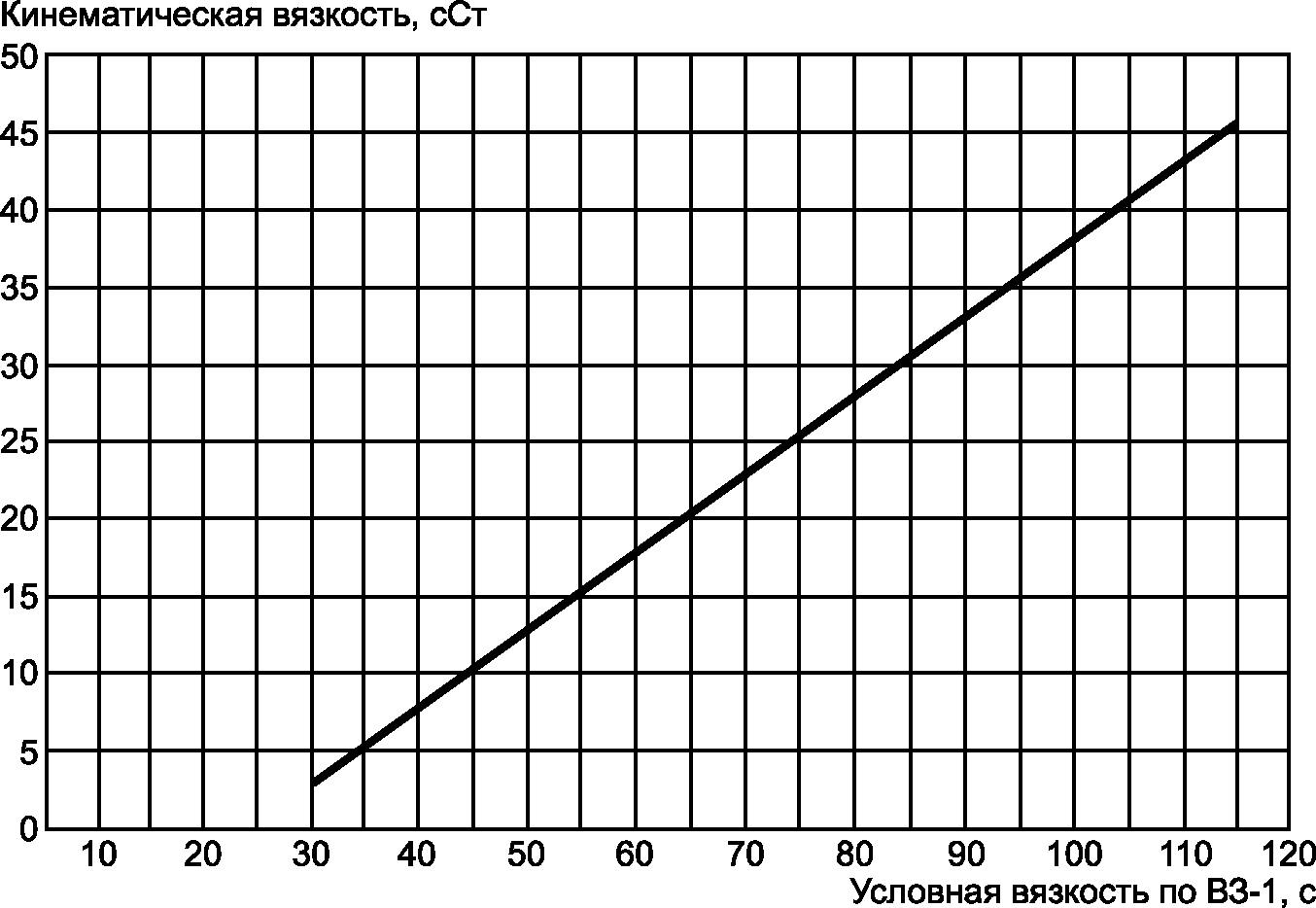
Г.3 На рабочих местах контроля допускается измерять условную вязкость дисперсионной среды суспензии вискозиметром типа ВЗ-246 по ГОСТ 9070-75 с диаметром сопла 2 мм или вискозиметром ВЗ-1 с диаметром сопла 2,5 мм. При этом фильтрация или длительный отстой суспензии не требуются. Магнитную суспензию наливают в резервуар вискозиметра до уровня остриев крючков, имеющихся на внутренней стенке резервуара, что соответствует объему 100 мл. Под сопло вискозиметра ставят чистую и сухую емкость объемом не менее 120 мл. Измеряют время, с, непрерывного истечения жидкости через сопло вискозиметра. Время истечения жидкости умножают на поправочный коэффициент К, указанный на корпусе вискозиметра. Полученный результат принимают за условную вязкость дисперсионной среды магнитной суспензии. При необходимости ее переводят в кинематическую. График перевода условной вязкости в кинематическую при использовании вискозиметра ВЗ-1 приведен на рисунке Г.1. Кинематической вязкости 36·10-6 м2/с (36 сСт), указанной в настоящем стандарте, соответствует условная вязкость 92 с по вискозиметру ВЗ-1, а вязкости 10·10-6 м2/с (10 сСт) — 47 с.
Рисунок Г.1 — График перевода условной вязкости
дисперсионной среды магнитной суспензии, измеряемой
вискозиметром ВЗ-1 с соплом диаметром 2,5 мм,
в кинематическую вязкость
Приложение Д
(справочное)
- ЗНАЧЕНИЯ КОЭРЦИТИВНОЙ СИЛЫ, ОСТАТОЧНОЙ ИНДУКЦИИ И ПОЛЯ НАСЫЩЕНИЯ ДЛЯ ОСНОВНЫХ МАРОК СТАЛЕЙ. ДАННЫЕ ПНАЭ Г-7-015-89
Скачать документ целиком в формате PDF