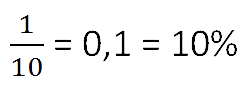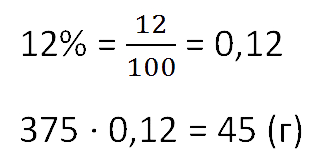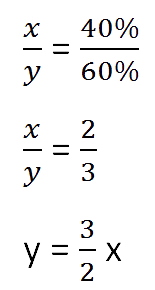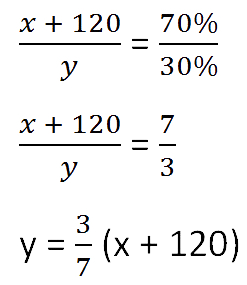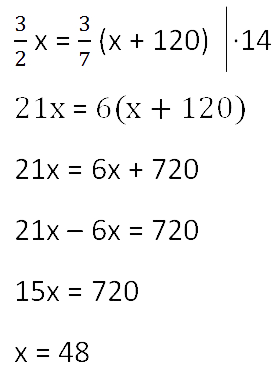Задачи, связанные с изучением растворов, можно условно разделить на следующие группы:
1. вычисление массовой доли растворённого вещества (в процентах) и массы растворенного вещества;
2. вычисление молярной концентрации и массы вещества в растворе определённой молярной концентрации;
3. разбавление растворов с массовой долей растворённого вещества и молярной концентрацией;
4. смещение растворов с массовой долей растворённого вещества и молярной концентрацией;
5. расчёты по химическим уравнениям с применением растворов различной концентрации.
:
вычисление массовой доли растворённого вещества (в процентах) и массы растворенного вещества
Необходимо знать условные обозначения физических величин, которые используются при решение задачи:
· m(р.в.), или m, — масса растворённого вещества в растворе, например, m(CACL2);
· m(р-ра.), или m(р.), — масса раствора;
· w(р.в.), или w, — массовая доля растворённого вещества.
Растворённое вещество является частью целого – раствора. Следовательно, масса раствора представляет собой сумму масс растворённого вещества и растворителя (воды):
w(р.в.) = m(р.в.)/m(р-ра.)*100%
Задача 1: Какова массовая доля растворённого вещества в растворе, полученном растворением хлорида кальция массой 10г в воде 70г?
|
Дано m (CaCL2) =10г m(H2O) = 70г |
Решение w(р.в.) = m(р.в.)/m(р-ра.)*100% w(CaCL2) = m(CaCL2) /m(р—ра.)*100% в данном случае нам из формулы не известна масса раствора. Найдём массу раствора. m(р.в.) –это (CaCL2) его10г m(р-ра) = m(р.в.) + m(H2O) m(р-ра) =10г +70г =80г w(CaCL2) =10г :80г = 0.125*100%=12.5% |
|
Найти : w(CaCL2) — ? |
|
|
Ответ: |
Массовая доля CaCL2 в полученном растворе 12,5% |
2. Приготовление раствора с заданной массовой долей растворённого вещества.
Задача 2
Сколько безводного карбоната натрия и воды надо взять, чтобы приготовить раствор массой 70 г с массовой долей карбоната натрия 10%
|
Дано: m(р-ра) – 70г w(р.в.) – 9% = 0,09 |
Решение w(р.в.) = m(р.в.) / m (р-ра) нам не известно из формулы m(р.в.) следует m(р.в.)=w(р.в.) * m (р-ра) m (р-ра) = m(р.в.) + m(H2O), отсюда, m(H2O) = m (р-ра) — m(р.в.) ; m(р.в.) = 0,09 * 70г = 6.3г m(H2O) = 70г – 6.3г = 63,7г |
|
Найти: m(H2O) -? m(Na2CO3) -? |
|
|
Ответ: |
Для приготовления раствора надо взять 6,3г карбоната натрия (Na2CO3) и 63,7г или 63,7 мл. воды (H2O) |
3. Вычисление молярной концентрации раствора.
Исходные уравнение для вычислений:
с(р.в.) = n(р.в) / V(р-ра) или с(р.в.) = v(р.в.) / V(р-ра)
с(р.в.) – молярная концентрация растворённого вещества,
n(р.в) или v(р.в.) – количество растворенного вещества,
V(р-ра) – объём раствора.
Задача 3
В воде растворили гидроксид натрия массой 21,4г . Объём раствора довели до 300 мл.. Определите молярную концентрацию полеченного раствора.
|
Дано: m(NaOH) = 21.4г V(р-ра) –300мл.= 0.3л |
Решение: с(р.в.) = n(р.в) / V(р-ра) n(р.в) =m / M; M(NaOH) = 40г/моль n(NaOH) =21,2г :40г/моль = 0,53моль c(NaOH) = 0.53моль : 0,3л = 1,77моль/литр или 1,8M |
|
Найти: c(NaOH)-? |
|
|
Ответ: |
Концентрация полученного растворённого 1.8 моль/л |
4, Приготовление раствора заданной молярной концентрации
Растворы молярной концентрации можно готовит из твёрдых, жидких и газообразных веществ. В случае жидкого вещества необходимо знать его плотность; если раствор готовится из газообразного вещества, то применяется молярный объём газов (при н.у.)
Вычисления, связанные с приготовлением молярного раствора, часто являются составным компонентом в расчётах по химическим уравнениям (комбинированные задачи).
Задача 4 Какая масса хлорида цинка потребуется для приготовления раствора этой соли объёмом 500 мл. и с концентрацией 1.15 моль/л
|
Дано: V(р-ра) = 500мл или 0,5 c(ZnCL2) = 1.15моль/л |
Решение: m(ZnCL2) = n(ZnCL2) * M(ZnCL2) M(ZnCL2) =136г/моль c(р.в.) = n(р.в.) / V(р-ра)концентрация хлорида цинка нам дана в задаче, а количество вещества нам не известна n(р.в.) =c(р.в.) * V(р-ра) n(ZnCL2) = 1.15моль/л * 0,5 =0,575моль m(ZnCL2) = n(ZnCL2) * M(ZnCL2) m(ZnCL2) =0,575моль * 136г/моль =78г |
|
Найти: m(ZnCL2) = ? |
|
|
Ответ: |
Для приготовления 500мл 1.15Mраствора потребуется 78г хлорида цинка |
Для того, чтобы решать задачи на растворы и концентрацию, необходимо чётко понимать, что
называется концентрацией раствора.
Запомните!
Концентрация раствора — это часть, которую составляет масса растворённого вещества от
массы всего раствора.
- 9%-я концентрация раствора соли — это 9 грамм соли в
100 граммах раствора.
Разбор примера
Килограмм соли растворили в 9 л воды. Чему равна концентрация полученного раствора?
(Масса 1 л воды составляет 1 кг)
Используя определение концентрации данное выше, решим задачу следующим образом.
- 1 кг — масса растворённого вещества (соли)
- 9 кг — масса воды в растворе (не путать с общей массой раствора)
- 9 + 1 = 10 кг — общая масса раствора.
Ответ: 10% — концентрация раствора.
Разбор примера
Теперь решим обратную задачу.
Сколько соли получится при выпаривании 375 граммов 12%-го раствора?
Чтобы найти массу выпаренной соли из раствора, умножим общую массу раствора на процент концентрации.
Не забудем предварительно перевести процент в десятичную дробь.
Ответ: 45 г соли.
Сложная задача на растворы
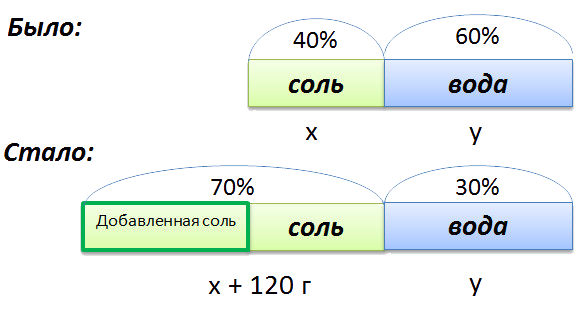
В растворе 40% соли. Если добавить 120 г соли,
то процентное содержание соли станет равным 70.
Сколько грамм соли было первоначально в растворе?
Для составления пропорции обозначим за «x» первоначальную массу соли в растворе, а
за «y» массу
воды в растворе. Так как концентрация соли в исходном растворе 40%, то соответственно вода составляет
100% − 40%= 60%
Изобразим графически условия задачи.
Составим пропорцию, связывающую эти величины до добавления соли.
Для решения задачи нам надо определить какая из неизвестных («x» или «y») остаётся неизменной
после добавления соли.
Этой величиной является масса воды в растворе «y».
Выразим её, учитывая изменения в растворе после добавления соли.
- (x + 120) г — масса соли в новом растворе
- (100% − 70% = 30% — процентное содержание воды в новом растворе.
Составим пропорцию аналогично предыдущей, но с учётом изменений произошедших
после добавления соли.
Так как масса воды осталось неизменной после добавления соли, приравняем её значения до и
после добавления соли и решим уравнение.
Ответ: 48 г — масса соли в первоначальном растворе.
Ваши комментарии
Важно!
Чтобы оставить комментарий, вам нужно войти на наш сайт при помощи
«ВКонтакте».

Оставить комментарий:
31 октября 2016 в 18:30
Роман Роршахов
Профиль
Благодарили: 0
Сообщений: 1
Роман Роршахов
Профиль
Благодарили: 0
Сообщений: 1
Сколько граммов 6%-ного раствора соли можно получить из 300 г жидкости содержащей 40% этой соли?
0
Спасибо
Ответить
5 ноября 2016 в 21:36
Ответ для Роман Роршахов
София Деревянко
Профиль
Благодарили: 0
Сообщений: 2
София Деревянко
Профиль
Благодарили: 0
Сообщений: 2
Если соли 40%, то воды — 60%. проценты характеризуют массовые доли, значит в растворе 120 г соли. Для нахождения массы раствора составляем пропорцию, которую можно прочитать так ЕСЛИ 120 Г СОЛИ СОСТАВЛЯЕТ 6 % ОТ ВСЕГО РАСТВОРА, ТО ВЕСЬ РАСТВОР (100%) БУДЕТ ВЕСИТЬ Х г, 120: 6=Х: 100, отсюда находим Х=120: 6 · 100, вес всего раствора 2 кг. проверяем, 2000 г · 0,06 получается 120г. Количество соли не изменилось))))
0
Спасибо
Ответить
6 сентября 2015 в 12:03
Дарья Сидорова
Профиль
Благодарили: 0
Сообщений: 1
Дарья Сидорова
Профиль
Благодарили: 0
Сообщений: 1
0
Спасибо
Ответить
6 сентября 2015 в 13:43
Ответ для Дарья Сидорова
Настюша Кирпичева
Профиль
Благодарили: 0
Сообщений: 1
Настюша Кирпичева
Профиль
Благодарили: 0
Сообщений: 1
1 3-
0
Спасибо
Ответить
2 сентября 2016 в 15:56
Ответ для Дарья Сидорова
Евгений Колосов
Профиль
Благодарили: 12
Сообщений: 197
Евгений Колосов
Профиль
Благодарили: 12
Сообщений: 197
= ? · = ? = ===8
0
Спасибо
Ответить
22 апреля 2015 в 16:36
Амина Загребельная
Профиль
Благодарили: 0
Сообщений: 1
Амина Загребельная
Профиль
Благодарили: 0
Сообщений: 1
в морской воде содержится 5% соли, какую часть морской воды состовляет соль?
0
Спасибо
Ответить
14 апреля 2016 в 13:37
Ответ для Амина Загребельная
Евгений Колосов
Профиль
Благодарили: 12
Сообщений: 197
Евгений Колосов
Профиль
Благодарили: 12
Сообщений: 197
В статье подробно описано, как это делается: http://math-prosto.ru/index.php?page=pages/percent/percent1.php
А именно: «Чтобы перевести проценты в дробь, нужно убрать знак % и разделить число на 100.»
5: 100=0,05=
0
Спасибо
Ответить
Как найти объем раствора
Существует несколько формул для нахождения объема раствора. В зависимости от того, что дано в условии задачи, можно выбрать одну из них. Порой данных в задаче недостаточно, и приходится применять дополнительные формулы для их нахождения.

Инструкция
Одна из наиболее часто используемых формул выглядит так: V = m/p, где V — объем, m — масса(г), p — плотность(г/мл). Соответственно, если даны эти величины, можно без труда найти объем. Иногда бывает так, что не дана масса вещества, но дано количество вещества (n) и указано, какое это вещество. В этом случае массу находим по формуле: m = n*M, где n — количество вещества (моль), а M — молярная масса(г/моль). Лучше всего рассмотреть это на примере задачи.
Количество вещества раствора сульфата натрия равно 0,2 моль, а плотность — 1,14 г/мл, найти его объем.Сначала пишем основную формулу для нахождения объема: V = m/p. Из этой формулы по условию задачи мы имеем только плотность (1,14 г/мл). Находим массу: m = n*M. Количество вещества дано, осталось определить молярную массу. Молярная масса равна относительной молекулярной массе, которая в свою очередь складывается из относительных атомных масс простых веществ, входящих в состав сложного. На самом деле все просто: в таблице Менделеева под каждым веществом указывается его относительная атомная масса. Формула нашего вещества Na2SO4, считаем. M (Na2SO4) = 23*2+32+16*4=142 г/моль. Подставляем в формулу, получаем: m = n*M = 0,2*142 = 28,4 г. Теперь полученное значение подставляем в общую формулу: V = m/p = 28,4/1,14 = 24,9 мл. Задача решена.
Бывают еще другие типы задач, где присутствует объем раствора – это задачи на концентрации раствора. Формула, необходимая для нахождения объема раствора, выглядит так: V = n/c, где V – объем раствора(л), n – количество растворенного вещества(моль), c – молярная концентрация вещества(моль/л). При необходимости найти количество растворенного вещества, это можно сделать по формуле: n = m/M, где n – количество растворенного вещества(моль), m – масса(г), M – молярная масса(г/моль).
Обратите внимание
Единицы измерения данных величин должны соответствовать друг другу. Например, если масса дана в кг, то соответствующий ей объем измеряется в литрах. А если масса в г, то объем в мл.
Полезный совет
Всегда внимательно читайте условие задачи. Порой из-за неправильно прочитанного условия можно не решить даже самую легкую задачу.
Источники:
- «Сборник задач по химии», Г.П. Хомченко, И.Г. Хомченко, 2002.
- определить объем раствора
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Растворы. Способы выражения концентрации растворов
Способы выражения концентрации растворов
Существуют различные способы выражения концентрации растворов.
Массовая доля ω компонента раствора определяется как отношение массы данного компонента Х, содержащегося в данной массе раствора к массе всего раствора m. Массовая доля – безразмерная величина, её выражают в долях от единицы:
ωр.в. = mр.в./mр-ра (0 < ωр.в. < 1) (1)
Массовый процент представляет собой массовую долю, умноженную на 100:
ω(Х) = m(Х)/m · 100% (0% < ω(Х) < 100%) (2)
где ω(X) – массовая доля компонента раствора X; m(X) – масса компонента раствора X; m – общая масса раствора.
Мольная доля χ компонента раствора равна отношению количества вещества данного компонента X к суммарному количеству вещества всех компонентов в растворе.
Для бинарного раствора, состоящего из растворённого вещества Х и растворителя (например, Н2О), мольная доля растворённого вещества равна:
χ(X) = n(X)/(n(X) + n(H2O)) (3)
Мольный процент представляет мольную долю, умноженную на 100:
χ(X), % = (χ(X)·100)% (4)
Объёмная доля φ компонента раствора определяется как отношение объёма данного компонента Х к общему объёму раствора V. Объёмная доля – безразмерная величина, её выражают в долях от единицы:
φ(Х) = V(Х)/V (0 < φ(Х) < 1) (5)
Объёмный процент представляет собой объёмную долю, умноженную на 100.
φ(X), % = (φ(X)·100)%
Молярность (молярная концентрация) C или Cм определяется как отношение количества растворённого вещества X, моль к объёму раствора V, л:
Cм(Х) = n(Х)/V (6)
Основной единицей молярности является моль/л или М. Пример записи молярной концентрации: Cм(H2SO4) = 0,8 моль/л или 0,8М.
Нормальность Сн определяется как отношение количества эквивалентов растворённого вещества X к объёму раствора V:
Cн(Х) = nэкв.(Х)/V (7)
Основной единицей нормальности является моль-экв/л. Пример записи нормальной концентрации: Сн(H2SO4) = 0,8 моль-экв/л или 0,8н.
Титр Т показывает, сколько граммов растворённого вещества X содержится в 1 мл или в 1 см3 раствора:
T(Х) = m(Х)/V (8)
где m(X) – масса растворённого вещества X, V – объём раствора в мл.
Моляльность раствора μ показывает количество растворённого вещества X в 1 кг растворителя:
μ(Х) = n(Х)/mр-ля (9)
где n(X) – число моль растворённого вещества X, mр-ля – масса растворителя в кг.
Мольное (массовое и объёмное) отношение – это отношение количеств (масс и объёмов соответственно) компонентов в растворе.
Необходимо иметь ввиду, что нормальность Сн всегда больше или равна молярности См. Связь между ними описывается выражением:
См = Сн · f(Х) (10)
Для получения навыков пересчёта молярности в нормальность и наоборот рассмотрим табл. 1. В этой таблице приведены значения молярности См, которые необходимо пересчитать в нормальность Сн и величины нормальности Сн, которые следует пересчитать в молярность См.
Пересчёт осуществляем по уравнению (10). При этом нормальность раствора находим по уравнению:
Сн = См/f(Х) (11)
Результаты расчётов приведены в табл. 2.
Таблица 1. К определению молярности и нормальности растворов
| Тип химического превращения | См | Сн | Сн | См |
| Реакции обмена | 0,2 M Na2SO4 | ? | 6 н FeCl3 | ? |
| 1,5 M Fe2(SO4)3 | ? | 0,1 н Ва(ОН)2 | ? | |
| Реакции окисления-восстановления | 0,05 М KMnO4
в кислой среде |
? | 0,03 М KMnO4
в нейтральной среде |
? |
Таблица 2
Значения молярности и нормальности растворов
| Тип химического превращения | См | Сн | Сн | См |
| Реакции обмена | 0,2M Ma2SO4 | 0,4н | 6н FeCl3 | 2М |
| 1,5M Fe2(SO4)3 | 9н | 0,1н Ва(ОН)2 | 0,05М | |
| Реакции окисления-восстановления | 0,05М KMnO4 в кислой среде | 0,25н | 0,03М KMnO4
в нейтральной среде |
0,01М |
Между объёмами V и нормальностями Сн реагирующих веществ существует соотношение:
V1 Сн,1 =V2 Сн,2 (12)
Примеры решения задач
Задача 1. Рассчитайте молярность, нормальность, моляльность, титр, мольную долю и мольное отношение для 40 мас.% раствора серной кислоты, если плотность этого раствора равна 1,303 г/см3.
Решение.
Масса 1 литра раствора равна М = 1000·1,303 = 1303,0 г.
Масса серной кислоты в этом растворе: m = 1303·0,4 = 521,2 г.
Молярность раствора См = 521,2/98 = 5,32 М.
Нормальность раствора Сн = 5,32/(1/2) = 10,64 н.
Титр раствора Т = 521,2/1000 = 0,5212 г/см3.
Моляльность μ = 5,32/(1,303 – 0,5212) = 6,8 моль/кг воды.
Обратите внимание на то, что в концентрированных растворах моляльность (μ) всегда больше молярности (См). В разбавленных растворах наоборот.
Масса воды в растворе: m = 1303,0 – 521,2 = 781,8 г.
Количество вещества воды: n = 781,8/18 = 43,43 моль.
Мольная доля серной кислоты: χ = 5,32/(5,32+43,43) = 0,109. Мольная доля воды равна 1– 0,109 = 0,891.
Мольное отношение равно 5,32/43,43 = 0,1225.
Задача 2. Определите объём 70 мас.% раствора серной кислоты (r = 1,611 г/см3), который потребуется для приготовления 2 л 0,1 н раствора этой кислоты.
Решение.
2 л 0,1н раствора серной кислоты содержат 0,2 моль-экв, т.е. 0,1 моль или 9,8 г.
Масса 70%-го раствора кислоты m = 9,8/0,7 = 14 г.
Объём раствора кислоты V = 14/1,611 = 8,69 мл.
Задача 3. В 5 л воды растворили 100 л аммиака (н.у.). Рассчитать массовую долю и молярную концентрацию NH3 в полученном растворе, если его плотность равна 0,992 г/см3.
Решение.
Масса 100 л аммиака (н.у.) m = 17·100/22,4 = 75,9 г.
Масса раствора m = 5000 + 75,9 = 5075,9 г.
Массовая доля NH3 равна 75,9/5075,9 = 0,0149 или 1,49 %.
Количество вещества NH3 равно 100/22,4 = 4,46 моль.
Объём раствора V = 5,0759/0,992 = 5,12 л.
Молярность раствора См = 4,46/5,1168 = 0,872 моль/л.
Задача 4. Сколько мл 0,1М раствора ортофосфорной кислоты потребуется для нейтрализации 10 мл 0,3М раствора гидроксида бария?
Решение.
Переводим молярность в нормальность:
0,1 М Н3РО4 0,3 н; 0,3 М Ва(ОН)2 0,6 н.
Используя выражение (12), получаем: V(H3P04)=10·0,6/0,3 = 20 мл.
Задача 5. Какой объем, мл 2 и 14 мас.% растворов NaCl потребуется для приготовления 150 мл 6,2 мас.% раствора хлорида натрия?
Плотности растворов NaCl:
| С, мас.% | 2 | 6 | 7 | 14 |
| ρ, г/см3 | 2,012 | 1,041 | 1,049 | 1,101 |
Решение.
Методом интерполяции рассчитываем плотность 6,2 мас.% раствора NaCl:
6,2% =6% + 0,2(7% —6% )/(7 – 6) = 1,0410 + 0,0016 = 1,0426 г/см3.
Определяем массу раствора: m = 150·1,0426 = 156,39 г.
Находим массу NaCl в этом растворе: m = 156,39·0,062 = 9,70 г.
Для расчёта объёмов 2 мас.% раствора (V1) и 14 мас.% раствора (V2) составляем два уравнения с двумя неизвестными (баланс по массе раствора и по массе хлорида натрия):
156,39 = V1 1,012 + V2 1,101 ,
9,70 = V1·1,012·0,02 + V2·1,101·0,14 .
Решение системы этих двух уравнений дает V1 =100,45 мл и V2 = 49,71 мл.
Задачи для самостоятельного решения
3.1. Рассчитайте нормальность 2 М раствора сульфата железа (III), взаимодействующего со щёлочью в водном растворе.
12 н.
3.2. Определите молярность 0,2 н раствора сульфата магния, взаимодействующего с ортофосфатом натрия в водном растворе.
0,1 M.
3.3. Рассчитайте нормальность 0,02 М раствора KMnO4, взаимодействующего с восстановителем в нейтральной среде.
0,06 н.
3.4. Определите молярность 0,1 н раствора KMnO4, взаимодействующего с восстановителем в кислой среде.
0,02 M.
3.5. Рассчитать нормальность 0,2 М раствора K2Cr2O7, взаимодействующего с восстановителем в кислой среде.
1,2 M.
3.6. 15 г CuSO4·5H2O растворили в 200 г 6 мас.% раствора CuSO4. Чему равна массовая доля сульфата меди, а также молярность, моляльность и титр полученного раствора, если его плотность составляет 1,107 г/мл?
0,1; 0,695М; 0,698 моль/кг; 0,111 г/мл.
3.7. При выпаривании 400 мл 12 мас.% раствора KNO3 (плотность раствора 1,076 г/мл) получили 2М раствор нитрата калия. Определить объём полученного раствора, его нормальную концентрацию и титр.
255 мл; 2 н; 0,203 г/мл.
3.8. В 3 л воды растворили 67,2 л хлороводорода, измеренного при нормальных условиях. Плотность полученного раствора равна 1,016 г/мл. Вычислить массовую, мольную долю растворённого вещества и мольное отношение растворённого вещества и воды в приготовленном растворе.
0,035; 0,0177; 1:55,6.
3.9. Сколько граммов NaCl надо добавить к 250 г 6 мас.% раствору NaCl, чтобы приготовить 500 мл раствора хлорида натрия, содержащего 16 мас.% NaCl? Плотность полученного раствора составляет 1,116 г/мл. Определить молярную концентрацию и титр полученного раствора.
74,28 г; 3,05 М; 0,179 г/мл.
3.10. Определить массу воды, в которой следует растворить 26 г ВaCl2·2H2O для получения 0,55М раствора ВaCl2 (плотность раствора 1,092 г/мл). Вычислить титр и моляльность полученного раствора.
192,4 г; 0,111 г/мл; 0,56 моль/кг.
Как рассчитать процентную концентрацию раствора?
Процентный состав по массе (%) Это масса растворенного вещества, деленная на массу раствора (масса растворенного вещества плюс масса растворителя), умноженная на 100.
Как рассчитать концентрацию вещества?
Поделите массу растворенного вещества на общий объем раствора. Запишите уравнение C = m/V, где m — масса растворенного вещества и V — общий объем раствора. Подставьте величины массы и объема и выполните деление, чтобы определить концентрацию раствора.
Как сделать 5% раствор?
Чтобы приготовить 5% раствор нужно 5 г марганцовки и 100 мл воды. Первым делом наливаем воду в приготовленную ёмкость, следом добавляем кристаллы. Затем все это перемешать до равномерного и насыщенного фиолетового окраса жидкости.
Как определить процентное содержание вещества в растворе?
Если известно процентное содержание вещества, то его концентрация находится по формуле: К=р/100% к — концентрация вещества; р — процентное содержание вещества (в процентах).
Как определить скольки процентный раствор?
Процентная концентрация (С%) вещества в растворе численно равна массовой доле растворенного вещества, выраженной в процентах. Определяется по формуле: С% вещества = (m вещества/ m раствора.) * 100%. Величина процентной концентрации показывает, сколько грамм вещества содержится в 100 г раствора.
Как определить концентрацию солевого раствора?
Солевой раствор. Солевой раствор –это количество соли в 100 г раствора или количество граммов соли на 100 г воды, но при этом концентрация будет разная. Например: если в 100 г солевого раствора содержится 25 г соли и 75 г воды, то концентрация соли равна 25 * 100 / 100 = 25 %;
Как сделать 10% раствор соли?
10—процентный раствор — это девять частей воды и одна часть соли. Например, на 10 граммов соли вам понадобится 90 граммов воды. Воду лучше брать чуть теплую, чтобы соль быстрее растворилась.
Как получить 3% раствор?
Для ранневесеннего опрыскивания (до распускания почек) готовят 3%-й раствор: 300 г медного купороса и 225 г гашеной извести-пушонки на 10 литров воды. Получается пропорция 1:0,75, хотя очень часто берут и 1:1 (300 г медного купороса и 300 г гашеной извести-пушонки на 10 литров воды).
Как определить плотность солевого раствора?
Ареометр общего назначения АОН-1 1360-1420 кг/м³ Ареометр АОН-1 подходит для измерения плотности любой жидкости (в том числе солевых растворов, кислот, солей, нефтепродуктов, химических соединений), а также растворов (например, цемент, бетон, строительные смеси и т. д.).
Как рассчитать количество вещества в растворе?
Количество растворенного вещества : = c•V, где c – молярная концентрация растворенного вещества в моль/л, V – объем раствора в л. где m(р-ра) – масса раствора в г, – массовая доля растворенного вещества.
Как можно найти массу раствора?
Масса раствора определяется по формуле m (раствора)= m (масса растворенного вещества)/ w (массовая доля растворенного вещества). Или m = r (плотность раствора — г/см3) * V (объем раствора). А как найти массу раствора, если изветны только массы воды и растворённого вещества?
Как приготовить раствор с заданной концентрацией?
ПРИГОТОВЛЕНИЕ РАСТВОРА ЗАДАННОЙ КОНЦЕНТРАЦИИ СМЕШИВАНИЕМ РАСТВОРОВ БОЛЕЕ ВЫСОКОЙ И БОЛЕЕ НИЗКОЙ КОНЦЕНТРАЦИИ. Раствор можно готовить, непосредственно вводя рассчитанное количество вещества в растворитель, или путем разбавления более концентрированных растворов до требуемого значения концентрации.
Как сделать 1 процентный раствор?
Как приготовить раствор Если вы хотите получить 1—процентный раствор любого вещества, то растворяете 10 г вещества в литре воды (или 100 г в 10 литрах). Соответственно, 2-процентный раствор содержит 20 г вещества в литре воды (200 г в 10 литрах) и так далее.
Что называют насыщенным раствором?
Насыщенным называют такой раствор, в котором при данной температуре вещество больше не растворяется. Если же при этой температуре в 100 г воды растворить хлорида калия меньше, чем 34,4 г, то раствор будет ненасыщенным.
Что необходимо для приготовления раствора?
Для приготовления раствора с определённой массовой долей растворённого вещества надо:
- вычислить массу растворённого вещества;
- вычислить массу (или объём) растворителя;
- взвесить вещество;
- отмерить растворитель;
- смешать вещества.
Как получить 10% раствор?
10-процентный раствор — это девять частей воды и одна часть соли. Например, на 10 граммов соли вам понадобится 90 граммов воды. Воду лучше брать чуть теплую, чтобы соль быстрее растворилась.
Что понимается под раствором?
Раство́р — однородная (гомогенная) система, в состав которой входят молекулы (атомы, ионы) двух или более типов, причём доля частиц каждого типа может непрерывно меняться в определённых пределах.
Какая система называется раствором?
Растворы – это гомогенные (однофазные) системы переменного состава, состоящие из двух или более веществ (компонентов). По характеру агрегатного состояния растворы могут быть газообразными, жидкими и твердыми.
Как изменяется растворимость веществ с изменением температуры?
При повышении температуры растворимость твердых веществ обычно увеличивается, а газов — уменьшается.
Что такое растворимость какая существует зависимость между изменением температуры?
Растворимость – максимально возможное число граммов вещества, которое может раствориться в 100 г растворителя при данной температуре. С повышением температуры растворимость большинства твердых веществ увеличивается, а растворимость газов снижается.
Что такое растворимость От каких факторов зависит?
Растворимость газов в жидкости зависит от температуры и давления. Растворимость жидких и твёрдых веществ — практически только от температуры. Все вещества в той или иной степени растворимы в растворителях.
Какой фактор увеличивает растворимость?
Растворимость большинства твердых веществ в воде увеличивается с повышением температуры, растворимость газов, наоборот растворимость газов, наоборот уменьшится. На растворимость жидкостей, как смешивающихся, так и не смешивающихся с водой, температура практически не влияет.
Как влияет температура на взаимную растворимость жидких веществ и нерастворимых веществ в воде?
На растворимость жидкостей температура практически не влияет.