поделиться знаниями или
запомнить страничку
- Все категории
-
экономические
43,662 -
гуманитарные
33,654 -
юридические
17,917 -
школьный раздел
611,985 -
разное
16,905
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Законы Фарадея.
http://ru.wikipedia.org/wiki/%D0%97%D0%B0%D0%BA%D0%BE%D0%BD%D1%8B_%D0%A4%D0%B0%D1%80%D0%B0%D0%B4%D0%B5%D1%8F_%28%D1%8D%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%BE%D0%BB%D0%B8%D0%B7%29
F — постоянная Фарадея, I — ток, t — время, M — молярная масса, z — число электронов на один ион (валентное число). Для меди из купороса z = 2.
Эта формула дает массу покрытия. Чтобы получить толщину, надо посчитать объем (поделить на плотность вещества), а потом поделить на площадь покрытой поверхности. Все просто.
На практике в силу разного рода потерь толщина получается меньше. Домножьте на «выход по току», если его знаете, чтобы получить практическую толщину. И еще на самом деле толщина будет немного неравномерной, в зависимости от расстояния до анода, кривизны поверхности и т.п.
Изменено 24 Января, 2012 в 17:35 пользователем Gall
Соотношения между
количеством электричества, прошедшего
через раствор или расплав электролита,
и количеством вещества, выделившегося
при электролизе, были открыты английским
физиком М. Фарадеем в 30-х годах XIX
века и сформулированы в виде законов.
1-й закон Фарадея:
масса вещества,
испытавшего электрохимическое превращение
на электроде, прямо пропорциональна
количеству прошедшего электричества:
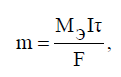
где m – масса
вещества, г; Mэ
– молярная
масса эквивалента вещества, г/моль; I –
сила тока, А; τ – время процесса, с; F –
постоянная Фарадея, равная 96485 Кл/моль.
Единицы количества
электричества: 1 фарадей = 96485 кулонов =
26,8 ампер-часа; 1 ампер-час (а-ч) = 3600 кулонов.
Один фарадей
электричества выделяет один моль
эквивалента вещества. Количество
вещества, выделяемого одним кулоном
электричества, называется электрохимическим
эквивалентом данного вещества.
Произведение силы
тока (I) на время (τ) равняется количеству
электричества (Q), прошедшего через цепь.
Молярную массу
эквивалента вещества (Mэ)
можно рассчитать исходя
из
молярной массы вещества (М) и количества
электронов, участвующих в
электродном
процессе (n):
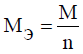
Для расчёта
количества выделяющихся при электролизе
газов удобнее пользоваться эквивалентным
объёмом:
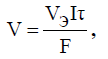
где V – объём
выделяющегося газа, л; Vэ
– объем одного
моля эквивалента газа, л/моль.
Объем одного моля
эквивалента газа рассчитывается путем
деления молярного объема газа на число
электронов, участвующих в полуреакции
получении соответствующего газа на
электроде.
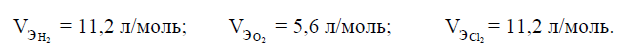
Пример 6. Определите массу и объем
продуктов электролиза раствора хлорида
меди (II) с инертными электродами, если
через раствор пропустили ток силой 2А
в течение 1 часа.
Решение:
Суммарное
уравнение электролиза: CuCl2
Сu +
Сl2
Расчет массы и объема
продуктов электролиза:

Пример 7. Найти объем кислорода
(условия нормальные), который выделится
при пропускании тока силой 6А в течение
30 мин через водный раствор KOH.
Решение: При вычислении объемов
выделившихся газов воспользуемся
уравнением:
,
Поскольку объем одного моля эквивалента
кислорода равен 5,6 л/моль, то получим
2-й закон Фарадея:
массы прореагировавших на электродах
веществ, при постоянном количестве
электричества, относятся друг к другу
как их молярные массы эквивалентов:
При электролизе
во многих случаях выделяется меньше
вещества, чем
должно получиться
по законам Фарадея. Это объясняется
тем, что наряду с основными электродными
процессами окисления и восстановления
практически всегда протекают побочные
реакции (взаимодействие образовавшихся
при электролизе веществ с электролитом,
выделение наряду с металлом на катоде
водорода и др.). Кроме того, часть
электрической энергии тратится на
преодоление сопротивления электролита.
Поэтому для
экономической оценки процесса электролиза
вводят такие понятия, как выход по току
и расход энергии на получение единицы
продукции энергии.
Выход по току –
это выраженное в процентах отношение
количества
фактически
затраченного электричества (Qфакт)
к теоретически необходимому(Qтеор):
Иногда в задачах
используется выход по току, рассчитанный
как степень отклонения массы фактически
прореагировавшего на электроде вещества
(mфакт)
к теоретически рассчитанной по закону
Фарадея (mтеор):
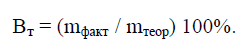
Пример 8. .При электролизе водного
раствора АgNO3 с
нерастворимым анодом в течение 50 мин.
при силе тока в 3,0 А на катоде выделилось
9,6 г серебра. Вычислить выход по току.
Решение:
Выход по току находим как
,
где
Совместим обе формулы и проведем
вычисление:
.
Выход по энергии
– это
количество электрической энергии
(выраженное в кВт·час), затраченное на
весовую единицу полученного продукта:
где
I – сила тока, А; τ – продолжительность
процесса электролиза, ч;
U
– рабочее напряжение, В; m – масса
полученного продукта, г.
Толщину
слоя металлического покрытия
вычисляют по формуле:
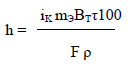
где
h – толщина покрытия, мкм; ρ – плотность
металла, г/см3;
ВТ
– выход металла по току, %; mЭ
– молярная масса эквивалента металла,
г/моль;
F
– постоянная Фарадея, Кл или А-ч; τ –
продолжительность электролиза, с. или
час; iК
– катодная плотность тока, А/см2.
Плотность
некоторых металлов равна:
цинка – 7, 1 г/см3,
олова – 7, 3 г/см3,
меди – 8, 9 г/см3,
никеля – 8, 8 г/см3.
Пример 9. Сколько времени нужно
пропускать ток силой 2,0 А через раствор
сульфата никеля, чтобы покрыть
металлическую пластинку с площадью
поверхности равной 200 см2 слоем
никеля, толщиной 0,01 мм, если плотность
никеля 8,9 г/см3. Выход по току
составляет 90 %.
Решение:
Объем покрытия: V= S×h
= 200 × 0,001 = 0.2 см3
Масса покрытия: mфакт
= V ×
r = 0,2 ×
8,9 = 1,78 г.
Молярная масса эквивалента никеля Mэ
= 29,345 г/моль.
Из уравнения
выразим время:
= 3251 с = 54,19 мин.
Пример 10. Определите толщину
слоя платины (в миллиметрах), нанесенной
на другой металл гальваническим методом.
Исходный электролит H2[PtCl6].
Площадь поверхности металлической
пластинки 250 см2, плотность пластины
21,47 г/см2. Время электролиза 45 мин,
ток силой 0,2 А, выход по току составляет
90%.
Решение:
Зная выход по току, определяем количество
выделенного при электролизе вещества:
Тогда объем покрытия:
и толщина слоя:
.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
2022-05-08
Электрохимическое никелирование (нанесение никелевого покрытия) проводят методом электролиза в подкисленном растворе сульфата никеля (II) с никелевым анодом. Рассчитайте толщину никелевого покрытия, которое можно нанести на изделие с площадью поверхности $0,05 м^{2}$ за 15 мин при токе 800 А и выходе реакции 60%. Плотность никеля равна $8,9 г/см^{3}$. Какие процессы протекают на аноде и катоде?
Решение:
При никелировании изделия на электродах происходят следующие процессы:
Анод: $Ni — 2e rightarrow Ni^{2+}$ (растворение никелевого анода)
Катод: $Ni^{2+} + 2e rightarrow Ni$, $2H^{+} + 2e rightarrow H_{2}$ (осаждение никеля на поверхности изделия и выделение водорода)
Масса осаждённого на катоде никеля:
$m = eta frac{ItM}{zF} = 0,6 frac{800 cdot 15 cdot 60 cdot 59}{2 cdot 96500} = 132 г$.
Объём осаждённого никеля:
$V = frac{m}{ rho } = frac{132}{8,9} = 14,8 см^{3}$.
Толщина никелевого покрытия:
$h = frac{V}{S} = frac{14,8}{500} = 0,03 см = 0,3 мм$.
Условие задачи:
Какой толщины слой серебра образовался на изделии за 3 мин, если плотность тока в растворе азотнокислого серебра AgNO3 2,6 кА/м2?
Задача №7.3.16 из «Сборника задач для подготовки к вступительным экзаменам по физике УГНТУ»
Дано:
(t=3) мин, (j=2,6) кА/м2, (h-?)
Решение задачи:
Запишем объединенный закон Фарадея:
[m = frac{1}{F}frac{M}{n}It;;;;(1)]
Здесь (F) – число Фарадея, равное 96600 Кл/моль; (M) – молярная масса серебра, равная 0,109 кг/моль; (n) – валентность серебра, равная 1.
Если изделие некоторой площадью (S) покрылось серебром толщиной (h), то массу отложившегося серебра очень легко определить по формуле:
[m = rho Sh;;;;(2)]
Здесь (rho) – плотность серебра, равная 10500 кг/м3.
Ток (I) можно выразить как произведение плотности тока (j) на площадь изделия (S), то есть:
[I = jS;;;;(3)]
Подставим выражения (2) и (3) в формулу (1):
[rho Sh = frac{1}{F}frac{M}{n}jSt]
[rho h = frac{1}{F}frac{M}{n}jt]
Откуда искомая толщина слоя серебра (h) равна:
[h = frac{{Mjt}}{{rho Fn}}]
Задача решена в общем виде, теперь посчитаем ответ:
[h = frac{{0,109 cdot 2,6 cdot {{10}^3} cdot 180}}{{10500 cdot 96600 cdot 1}} = 5 cdot {10^{ – 5}};м = 0,05;мм]
Ответ: 0,05 мм.
Если Вы не поняли решение и у Вас есть какой-то вопрос или Вы нашли ошибку, то смело оставляйте ниже комментарий.
Смотрите также задачи:
7.3.15 Две электролитические ванны соединены последовательно. В первой ванне выделилось
7.3.17 Плотность тока при серебрении контактов проводов равна 40 А/м2. Определить толщину
7.3.18 В ряде производств водород получают электролизом воды. При каком токе, пропускаемом

