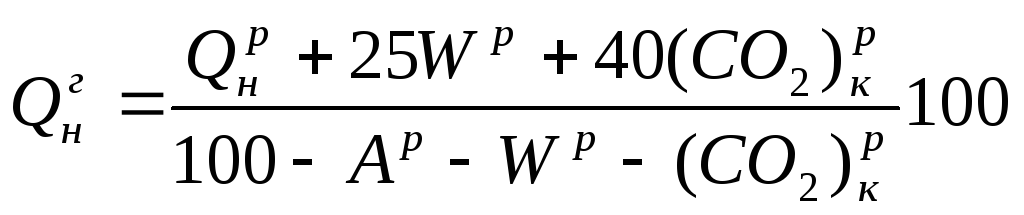Различные виды топлива (твёрдое, жидкое и газообразное) характеризуются общими и специфическими свойствами. К общим свойствам топлива относятся удельная теплота сгорания и влажность, к специфическим — зольность, сернистость (содержание серы), плотность, вязкость и другие свойства.
Удельная теплота сгорания топлива — это количество теплоты, которое выделяется при полном сгорании (1) кг твёрдого или жидкого топлива или (1) м³ газообразного топлива.
Энергетическая ценность топлива в первую очередь определяется его удельной теплотой сгорания.
Удельная теплота сгорания обозначается буквой (q). Единицей удельной теплоты сгорания является (1) Дж/кг для твёрдого и жидкого топлива и (1) Дж/м³ — для газообразного топлива.
Удельную теплоту сгорания на опыте определяют довольно сложными методами.
Таблица (2). Удельная теплота сгорания некоторых видов топлива.
Твёрдое топливо
|
Вещество |
Удельная теплота сгорания, МДж/кг |
| Бурый уголь |
(9,3) |
| Древесный уголь |
(29,7) |
| Дрова сухие |
(8,3) |
| Древесные чурки |
(15,0) |
|
Каменный уголь марки А-(I) |
(20,5) |
|
Каменный уголь марки А-(II) |
(30,3) |
| Кокс |
(30,3) |
| Порох |
(3,0) |
| Торф |
(15,0) |
Жидкое топливо
|
Вещество |
Удельная теплота сгорания, МДж/кг |
| Бензин, нефть |
(46,0) |
| Дизельное топливо |
(42,0) |
| Керосин |
(43,0) |
| Мазут |
(40,0) |
| Спирт этиловый |
(27,0) |
Газообразное топливо
(при нормальных условиях)
|
Вещество |
Удельная теплота сгорания, МДж/м³ |
| Водород |
(120,8) |
| Генераторный газ |
(5,5) |
| Коксовый газ |
(16,4) |
| Природный газ |
(35,5) |
| Светильный газ |
(21,0) |
Из этой таблицы видно, что наибольшей является удельная теплота сгорания водорода, она равна (120,8) МДж/м³. Это значит, что при полном сгорании водорода объёмом (1) м³ выделяется (120,8) МДж (=) (120,8)
⋅106
Дж энергии.
Водород — один из высокоэнергетических видов топлива. Кроме того, продуктом сгорания водорода является обычная вода, в отличие от других видов топлива, где продуктами сгорания являются углекислый и угарный газы, зола и топочные шлаки. Это делает водород экологически наиболее чистым топливом.
Однако газообразный водород взрывоопасен. К тому же он имеет самую малую плотность в сравнении с другими газами при равной температуре и давлении, что создаёт сложности со сжижением водорода и его транспортировкой.
Общее количество теплоты (Q), выделяемое при полном сгорании (m) кг твёрдого или жидкого топлива, вычисляется по формуле:
Общее количество теплоты (Q), выделяемое при полном сгорании (V) м³ газообразного топлива, вычисляется по формуле:
Влажность (содержание влаги) топлива снижает его теплоту сгорания, так как увеличивается расход теплоты на испарение влаги и увеличивается объём продуктов сгорания (из-за наличия водяного пара).
Зольность — это количество золы, образующейся при сгорании минеральных веществ, содержащихся в топливе. Минеральные вещества, содержащиеся в топливе, понижают его теплоту сгорания, так как уменьшается содержание горючих компонентов (основная причина) и увеличивается расход тепла на нагрев и плавление минеральной массы.
Сернистость (содержание серы) относится к отрицательному фактору топлива, так как при его сгорании образуются сернистые газы, загрязняющие атмосферу и разрушающие металл. Кроме того, сера, содержащаяся в топливе, частично переходит в выплавляемый металл, сваренную стекломассу, снижая их качество. Например, для варки хрустальных, оптических и других стёкол нельзя использовать топливо, содержащее серу, так как сера значительно понижает оптические свойства и колер стекла.
Теплота сгорания
топлива.
Теплотой сгорания топлива называют
количество теплоты в кДж, выделяемой
при полном сгорании 1 кг твердого
(жидкого) или 1 м3
газообразного топлива.
Для твердого и
жидкого топлива различают теплоту
сгорания высшую
Qв
(кДж/кг) и
низшую Qн
(кДж/кг).
Величины высшей
и низшей теплоты сгорания рабочей,
горючей и сухой массы твердого
(жидкого) топлива связаны выражениями:
Q=Q
+225Нр+25Wp; (1.9
)
Q=Q
+225Нг; (1.10)
Q=Q
+225Нс. (1.11)
Тепловые расчеты
котлов выполняют, пользуясь низшей
теплотой сгорания рабочей массы
топлива:
низшая теплота
сгорания (кДж/кг) рабочей массы твердого
и жидкого топлива
Q=338Cp+1025Hp-108,5(Op-S
)-25Wp, (1.12)
где Ср,
Нр,
Ор,
S,
Wp
— содержание элементов в рабочей массе
топлива, %;
низшая теплота
сгорания (кДж/м3)
газообразного топлива
Q=108H2
+ 126CO
+ 234H2S
+ 358CH4
+ 591C2H4
+ 638C2H6+860С3Н6
+ 913С3Н8
+
+ 1135С4Н8+1187С4Н10+1461С5Н12+
1403C6H6, (1.13)
где Н2,
СО, H2S,
СН4,
С2Н4
и т. д. — объемное содержание газов,
входящих в состав газообразного топлива,
%.
При пересчете
низшей теплоты сгорания пользуются
следующими формулами:
с горючей массы
на рабочую и обратно
(1.14)
(1.15)
с сухой массы на
рабочую и обратно
(1.16)
(1.17)
для горючих сланцев
— с горючей массы на рабочую и обратно
(1.18)
(1.19)
при изменении
влажности

Для смеси двух
твердых, жидких или газообразных топлив
низшая теплота сгорания определяется
по формуле
, (1.21)
где b1
— массовая
доля одного из топлив в смеси;
— низшая
теплота сгорания первого вида топлива
в смеси, кДж/кг (кДж/м3);
—
низшая теплота сгорания второго вида
топлива, кДж/кг (кДж/м3).
Для сравнения
тепловой ценности различных видов
топлива пользуются понятием условного
топлива. Условным
топливом называют
такое топливо, теплота сгорания которого
равна 29 300 кДж/кг.
Пересчет расхода
натурального топлива на условное
осуществляется по формуле
Ву=ВЭ, (1.22)
где Ву
и
В —
соответственно расход условного и
натурального топлива, кг, кг/с; Э
— тепловой
эквивалент топлива, определяемый по
формуле
Э=/29
300. (1.23)
Зольность,
влажность и
сернистость
топлива. При
рассмотрении условий работы котлов
на различных видах топлива пользуются
приведенными величинами зольности Апр
влажности
Wnp
и сернистости
Sпр,
топлива:
приведенная
зольность топлива, кг·%/МДж,
Апр=Ар/; (1.24)
приведенная
влажность топлива, кг·%/МДж,
Wпр=Wр/; (1.25)
приведенная
сернистость топлива, кг·%/МДж,
Sпр=/
; (1.26)
Задача 1.9.
Определить низшую и высшую теплоту
сгорания рабочей массы челябинского
угля марки БЗ состава: Ср=37,3%;
Нр=2,8%;
=l,0%;
Np=0,9%;
Ор=10,5%;
Ар=29,5%
и Wp=18,0%.
Ответ: =13997
кДж/кг; =15077
кДж/кг.
Задача 1.10.
Определить низшую и высшую теплоту
сгорания рабочей массы кузнецкого угля
марки Д, если состав его горючей массы:
Cг=78,5%;
Нг=5,6%;с
S=0,4%;
Nг=2,5%;
Ог=13,0%.
Зольность сухой массы Ас=15,0%
и влажность рабочая Wр=12,0%.
Решение:
Пользуясь коэффициентами пересчета
(табл. 1.1), определяем зольность рабочей
массы топлива
и состав рабочей
массы:
Низшая теплота
сгорания рабочей массы топлива, по
формуле (1.12),
Q
=
338Cp+1025Hp-108,5(Op-S)-25Wp=338·58,7+1025·4,2-108,5(9,7-0,3)-25·12=
=22
825 кДж/кг.
Высшая теплота
сгорания, по формуле (1.9),
Q=Q
+225Нр+25Wp=22825+225·4,2+25·12,0=24
070 кДж/кг.
Задача 1.11.
Определить
низшую теплоту сгорания рабочей и сухой
массы донецкого угля марки Г, если
известны его низшая теплота сгорания
горючей массы Q=33170
кДж/кг, зольность сухой массы Ас=25,0%
и влажность
рабочая Wp=
8,0%.
Ответ: Q=22024
кДж/кг; Q=24157
кДж/кг.
Задача 1.12.
Определить
низшую теплоту сгорания горючей и сухой
массы кузнецкого угля марки Т, если
известны его низшая теплота сгорания
рабочей массы Q=26180
кДж/кг, зольность сухой массы Аc=
18,0% и влажность
рабочая Wp
= 6,5%.
Ответ:
Q=34345
кДж/кг; Q=28174
кДж/кг.
Задача 1.13.
Определить
высшую теплоту сгорания горючей и сухой
массы кизеловского угля марки Г, если
известны следующие величины: Q=l9680
кДж/кг; Нр=3,6%;
Aр=31,0%;
Wp=6,0%.
Ответ: Q=21
961 кДж/кг; Q=32635кДж/кг.
Задача 1.14.
Определить
низшую и высшую теплоту сгорания рабочей
массы ленинградских сланцев, если
известны следующие величины: Q=36848
кДж/кг; Нр=2,7%;
Aр=46,0%;
Wp=11,5%
и (СО2)=16,4%.
Ответ: Q=
9337 кДж/кг; Q=10
232 кДж/кг.
Задача 1.15.
Определить
низшую и высшую теплоту сгорания горючей
массы высокосернистого мазута, если
известны следующие величины: Q=38772
кДж/кг; Нр=10,4%;
Ар=0,1%
Wp=3,0%.
Решение:
Содержание водорода в горючей массе
определяем, пользуясь коэффициентом
пересчета (табл. 1.1):
Низшая теплота
сгорания горючей массы топлива, по
формуле (1.15),
кДж/кг.
Высшая теплота
сгорания, по формуле (1.10),
Q=Q
+225Нг=40090+225·10,7
= 42497 кДж/кг.
Задача
1.16. Определить
низшую теплоту сгорания сухо природного
газа Саратовского месторождения состава:
СО2=0,8%;
СН4=84,5%;
С2Н6=3,8%;
С3Н8=1,9%;
С4Н10=0,9%;
С5Н12=0,3%;
N2=7,8%.
Ответ: Q=35799
кДж/м3.
Задача 1.17.
Определить низшую теплоту сгорания
рабочей массы челябинского угля марки
БЗ состава: Ср=37,3%;
Нр=2,8%;
S=1,O%;
Np=0,9%;
Ор=10,5%;
Aр=29,5%;
Wp=18%,
— при увеличении его влажности до
Wp=20%.
Ответ:
Q=13542
кДж/кг.
Задача 1.18.
В топке котла сжигается смесь, состоящая
из 3·103
кг кузнецкого угля марки Д и 7·103
кг кузнецкого угля марки Т. Определить
низшую теплоту сгорания смеси, если
известно, что низшая теплота сгорания
угля марки Д составляет Q=22825
кДж/кг, а угля марки Т — Q=26180
кДж/кг. .
Ответ: Q=25174
кДж/кг.
Задача 1.19.
Определить высшую теплоту сгорания
рабочей массы, приведенную влажность,
приведенную зольность, приведенную
сернистость и тепловой эквивалент
подмосковного угля марки Б2 состава:
Ср=28,7%;
Нр=2,2%;
S=2,7%;
Np=0,6%;
Оp=8,6%;
Ap=25,2%;
Wp=32%.
Решение:
Низшая теплота сгорания рабочей массы
топлива, по формуле (1.12),
Q=338Cp+1025Нр-108,5
(Op-S)-25Wp=338·28,7+1025·2,2-108,5(8,6-2,7)-25·32=
=10516
кДж/кг.
Высшая теплота
сгорания рабочей массы топлива, по
формуле (1.9),
Q=Q
+225Hp+25Wp=10516
+ 225·2,2+25·32=11811
кДж/кг.
Приведенная
влажность топлива, по формуле (1.25),
Wnp=Wp/Q=
32/10,516 = 3,04 кг·
%/МДж.
Приведенная
зольность топлива, по формуле (1.24),
Aпр=Aр/Q=25,2/10,516
= 2,39 кг·%/МДж.
Приведенная
сернистость топлива, по формуле (1.26),
Snp=Sp/Q=2,7/10,516
= 0,257 кг·%/МДж.
Тепловой эквивалент
топлива, по формуле (1.23),
Э=Q/29300=10516/29300=0,36.
Задача 1.20.
Определить
высшую теплоту сгорания рабочей массы,
приведенную влажность, приведенную
зольность, приведенную сернистость
и тепловой эквивалент донецкого угля
марки А, если известны следующие величины:
Q=22625
кДж/кг; Нр=1,2%;
S=l,7%;
Ар=22,9%;
Wp=8,5%.
Ответ: Q=23107,5
кДж/кг; Wnp=0,375
кг·%/МДж;
Anp=1,01
кг·%/МДж;
Snp=0,075
кг·%/МДж;
Э
= 0,77.
Задача 1.21.
Определить
приведенную влажность, приведенную
зольность и приведенную сернистость
донецкого угля марки Т состава: Сp=62,7%;
Нр=3,1%;
S=2,8%;
Np=0,9%;
Op=l,7%;
Aр=23,8%;
Wp=5%.
Ответ: Wnp=0,203
кг·%/МДж;
Anp=0,966
кг·%/МДж;
Snp=0,114
кг·%/МДж.
Задача 1.22.
Определить
приведенную влажность, приведенную
зольность и тепловой эквивалент
челябинского угля марки БЗ, если
известен, состав его горючей массы:
Сг=71,1%;
Hг=5,3%;
S=l,9%;
Nг=l,7%;
Ог=20,0%;
зольность сухой массы Ас=36%
и влажность рабочая Wр=18%.
Ответ: Wnр=1,286
кг·%/МДж;
Ар=2,107
кг·%/МДж;
Э=0,48.
Задача 1.23. На
складе котельной имеется 60·103
кг ангренского угля марки Б2, состав
которого по горючей массе: Cг=76,0%;
Hг=3,8%;
S=2,5%;
Nг=0,4%;
Ог=17,3%;
зольность сухой массы Ас=20,0%
и влажность рабочая Wр=34,5%.
Определить запас угля на складе в кг
условного топлива.
Ответ: Ву=28315
кг.
Задача 1.24. Для
котельной, в которой установлены котлы
с различными топками, подвезено 50·103
кг донецкого угля марки Т состава:
Ср=
62,7%; Нр=3,1%;
S=2,8%;
Np=0,9%;
Op=1,7%;
Ар=23,8%;
Wр=5,0%,
и 60·103
кг донецкого угля марки А состава:
Ср=63,8%;
Нр=1,2%;
S=l,7%;
Np=0,6%;
Op=l,3%;
Ар=22,9%;
Wp=8,5%.
Определить время работы топок, если
известно, что топки, работающие на угле
марки Т, расходуют 2·103
кг/ч условного топлива, а топки, работающие
на угле марки А, — 2,3·103
кг/ч условного топлива.
Решение:
Низшая теплота сгорания рабочей массы
донецкого угля марки Т, по формуле
(1.12),
Q=338Cp+1025Hp-108,5(Op-S
)-25Wp=338·62,7+1025·3,1-108,5(1,7-2,8)-25·5,0=
=24365
кДж/кг.
Масса условного
топлива, соответствующая 50·103
кг донецкого угля марки Т, по формуле
(1.22);
By1=B1Э=В1Q/29300=50·103-24365/29300=41,6·103
кг.
Определяем время
работы топок на донецком угле марки Т:
τ1=Ву1/(2·103)=41,6103/(2·103)
=20,8 ч.
Низшая теплота
сгорания рабочей массы донецкого угля
марки А, по формуле (1.12),
Q=338Ср+1025Нр-108,5(Op-S
)-25Wp=338·63,8+1025·1,2-108,5(1,3-1,7)-25·8,5=
=22625
кДж/кг.
Масса условного
топлива, соответствующая 60·103
кг донецкого угля марки А, по формуле
(1.22),
By2=B2Q/29300=60·103-22625/29300=46,3·103
кг.
Находим время
работы топок на донецком угле марки А:
τ2=Bу2/(2,3·103)=46,3·103/(2,3·103)=20,1
ч.
Задача 1.25.
Две котельные установки одинаковой
производительности работают на
различных видах топлива. Первая из них
сжигает 10·103
кг/ч кузнецкого угля марки Т состава:
Ср=68,6%;
Нр=3,1%;
S=0,4%;
Np=l,5%;
Ор=3,1%;
Aр=16,8%;
Wp=6,5%.
Вторая расходует 6·103
кг/ч кузнецкого угля марки Д состава:
Cp=58,7%;
Нр=4,2%;
S=0,3%;
Np=l,9%;
Ор=9,7%;
Ap=13,2%;
Wp=12,0%.
Определить, какому количеству
условного топлива эквивалентен часовой
расход топлива в установках.
Ответ: By1=9000
кг/ч; Ву2=4674
кг/ч.
Задача 1.26.
В котельной за 10 ч сжигается 106
кг донецкого угля марки Г состава:
Сp=55,2%;
Нр=3,8%;
S=3,2%;
Np=1,0%;
Ор=5,8%;
Ар=23,0%;
Wp=8,0%.
Определить часовую потребность котельной
в условном топливе.
Ответ: Ву=15170
кг/ч.
Соседние файлы в папке задачи по турбинам
- #
- #
- #
- #
- #
- #
Download Article
Calculate combustion heat experimentally & with Hess’ Law
Download Article
- Experimentally
- Hess’ Law
- Tips
- Warnings
- Things You’ll Need
|
|
|
|
Calculating the heat of combustion is a useful tool in analyzing fuels in terms of energy. The Heat of Combustion of a substance is defined as the amount of energy in the form of heat is liberated when an amount of the substance undergoes combustion.[1]
Things You Should Know
- Place a candle on a standing rod and secure 3 oz (100 ml) of water in a tin can 2 in (5 cm) above it. Light the candle.
- Measure the water temperature and candle weight. Then, use the formula q = Cp * m * (delta) t to calculate the heat liberated.
- Or, write the equation for combustion: 2NO + O2 = 2NO2. Add the enthalpies for the reactants and product and then subtract them.
-
1
Position the standing rod vertically. To begin setting up your experiment you will first place the rod on your work table.
-
2
Measure 100ml of water into the tin can.
Advertisement
-
3
Put the substance at the base of the standing rod.
-
4
At 5cm above the substance affix the tin can with a clamp to the rod.
-
5
Affix the thermometer so that it is in the tin can but not touching the bottom base.[2]
-
6
Experimentation
- Measure the temperature of the water and note it in degrees celsius.
- Measure the mass of the candle and note it in g.
- Light the substance.
- When the temperature of the water reaches 40 degrees Centigrade, blow out the substance.
- Measure the mass of the candle after burning and note it.
-
7
Calculation
- Use the formula q = Cp * m * (delta) t to calculate the heat liberated which heats the water.[3]
- The specific heat Cp of water is 4.18 J/g C
- Mass of the water is 100g
- Delta t is the difference between the initial starting temperature and 40 degrees centigrade.
- Subtract the initial temperature of the water from 40 C.
- Substitute it into the formula and you will get the answer q in J. Convert into kJ by dividing q by 1000.
- Find the amount of substance burned by subtracting the final mass from the initial mass of the substance in g.
- Divide q in kJ by the mass of the substance burned.
- The answer is the experimental heat of combustion in kJ/g.
- Use the formula q = Cp * m * (delta) t to calculate the heat liberated which heats the water.[3]
Advertisement
-
1
Write the balanced equation of combustion of the substance.[4]
-
2
Find the enthalpies of formation for the reactants and add them.
- Enthalpies of formation are usually found in a table from CRC Handbook of Chemistry and Physics.
-
3
Find the enthalpies of formation of the products and add them. Use the table
-
4
Subtract the enthalpies of the reactants from the product.
-
5
Switch the sign and that is the Heat of Combustion.
Advertisement
Ask a Question
200 characters left
Include your email address to get a message when this question is answered.
Submit
Advertisement
-
You will need to understand why it works..Hess Law states that the enthalpies of the products and the reactants are the same[5]
Thanks for submitting a tip for review!
Advertisement
-
The Experimental heat of combustion is inaccurate because it does not factor in heat loss to surrounding environment. It is only a rough estimate.
Advertisement
Things You’ll Need
- Gathering Materials
- A tin can
- A standing rod
- A thermometer
- Graduated Cylinder
- Ice cold water
- Two clamps
- The substance — which can be preferable burnt with a wick.
References
About This Article
Article SummaryX
The heat of combustion is a useful calculation for analyzing the amount of energy in a given fuel. To calculate the heat of combustion, use Hess’s law, which states that the enthalpies of the products and the reactants are the same. Start by writing the balanced equation of combustion of the substance. Then, add the enthalpies of formation for the reactions. You can find these in a table from the CRC Handbook of Chemistry and Physics. After that, add the enthalpies of formation of the products. Next, subtract the enthalpies of the reactants from the product. Finally, change the sign to kilojoules. For more tips, including how to calculate the heat of combustion with an experiment, read on.
Did this summary help you?
Thanks to all authors for creating a page that has been read 141,511 times.
Did this article help you?
Энергия, которую тело получает или отдает при теплопередаче, называется количеством теплоты. Мы проделали не один опыт, рассмотрели как при теплообмене одни тела отдают энергию, а другие получают. Во многих опытах мы использовали горелку, чтобы сообщить телу какое-то количество теплоты. А как рассчитать это количество теплоты?
С давних времен, чтобы получить энергию, люди используют топливо. Сейчас топливо является источником энергии в промышленности, сельском хозяйстве, на транспорте и, конечно, в повседневном быту. Это нефть, природный газ, торф, уголь, дрова и др.
В данном уроке мы рассмотрим, за счет чего выделяется энергия при сгорании топлива и как ее рассчитать. Также вы узнаете новое определение (удельная теплота сгорания) и научитесь им пользоваться.
Сгорание топлива и энергия
Для начала давайте вспомним строение молекулы воды (рисунок 1). Она состоит из одного атома кислорода и двух атомов водорода.
Между атомами действуют силы притяжения. Если мы захотим разделить атомы, составляющие молекулы, придется преодолеть эти силы. В таком случае будет совершена работа, и затрачена некоторая энергия. При соединение атомов, наоборот, энергия будет выделяться.
Выделение энергии при соединении атомов — явление, на котором основано использование топлива.
В любом топливе содержатся атомы углерода. В процессе горения они соединяются с двумя атомами кислорода (рисунок 2).
В результате:
- Образуется молекула углекислого газа (оксида углерода)
- Выделяется энергия
Удельная теплота сгорания
При сгорании разных видов топлива одинаковой массы выделяется разное количество теплоты. Для того чтобы характеризовать каждый вид топлива используют такую величину, как удельная теплота сгорания. При проектировании двигателей эта величина помогает рассчитать, какое количество теплоты может выделить сжигаемое топливо.
Удельная теплота сгорания топлива — это физическая величина, показывающая, какое количество теплоты выделяется при полном сгорании топлива массой $1 space кг$.
- Обозначается буквой $q$
- Единица измерения — $1 frac{Дж}{кг}$
Величину удельной теплоты сгорания устанавливают на опыте. Мы будем использовать уже готовые результаты таких исследований, представленные в таблице 1.
| Вещество | $q, space frac{Дж}{кг}$ | Вещество | $q, space frac{Дж}{кг}$ |
| Порох | $0.38 cdot 10^7$ | Древесный уголь | $3.4 cdot 10^7$ |
| Дрова сухие | $1.0 cdot 10^7$ | Природный газ | $4.4 cdot 10^7$ |
| Торф | $1.4 cdot 10^7$ | Нефть | $4.4 cdot 10^7$ |
| Каменный уголь | $2.7 cdot 10^7$ | Бензин | $4.6 cdot 10^7$ |
| Спирт | $2.7 cdot 10^7$ | Керосин | $4.6 cdot 10^7$ |
| Антрацит | $3.0 cdot 10^7$ | Водород | $12 cdot 10^7$ |
Возьмем табличное значение удельной теплоты сгорания нефти — $4.4 cdot 10^7 frac{Дж}{кг}$. Эта величина говорит нам о том, что при полном сгорании нефти массой $1 space кг$ выделяется $4.4 cdot 10^7 frac{Дж}{кг}$ энергии.
Формула для расчета количества теплоты, выделяемого при сгорании топлива
Для расчета полного количества теплоты, выделяемого при полном сгорании топлива некоторой массы, используют формулу:
$Q = qm$,
где $Q$ — выделяемое количество теплоты,
$q$ -удельная теплота сгорания топлива,
$m$ — масса сгораемого топлива.
Упражнения
Упражнение №1
Какое количество теплоты выделится при полном сгорании керосина объемом $2 space л$ и плотностью $800 frac{кг}{м^3}$?
Дано:
$V = 2 space л$
$rho = 800 frac{кг}{м^3}$
$q = 4.6 cdot 10^7 frac{Дж}{кг}$
СИ:
$2 cdot 10^{-3} space м^3$
$Q — ?$
Посмотреть решение и ответ
Скрыть
Решение:
Формула для расчета количества теплоты:
$Q = qm$.
Массу выразим через объем и плотность: $m = rho V$.
Рассчитаем количество теплоты:
$Q = qrho V = 4.6 cdot 10^7 frac{Дж}{кг} cdot 800 frac{кг}{м^3} cdot 2 cdot 10^{-3} space м^3 = 7360 cdot 10^4 space Дж = 73.6 cdot 10^6 space Дж = 73.6 space МДж$.
Ответ: $Q = 73.6 space МДж$.
Упражнение №2
Вычислите массу сухих дров, если при их полном сгорании выделилось $70 000 space кДж$ энергии.
Дано:
$Q = 70 000 space кДж$
$q = 1.0 cdot 10^7 frac{Дж}{кг}$
СИ:
$7 cdot 10^7 space Дж$
$m — ?$
Посмотреть решение и ответ
Скрыть
Решение:
Из формулы $Q = qm$ выразим массу дров $m$:
$m = frac{Q}{q}$.
Рассчитаем:
$m = frac{7 cdot 10^7 space Дж}{1.0 cdot 10^7 frac{Дж}{кг}} = 7 space кг$.
Ответ: $m = 7 space кг$.