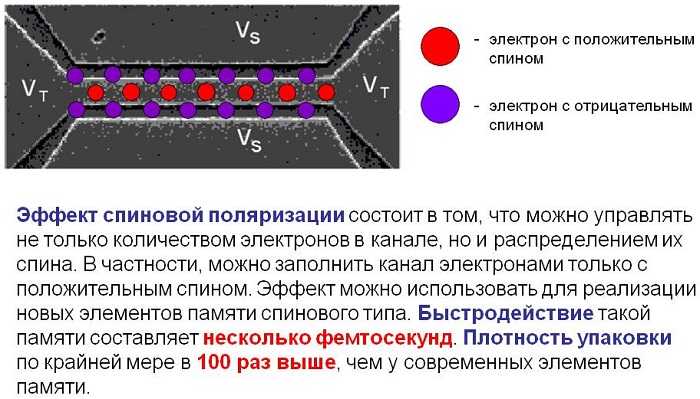
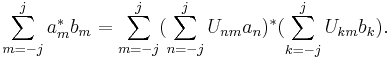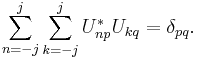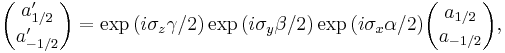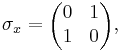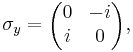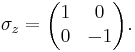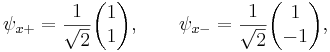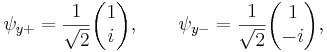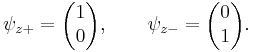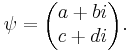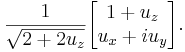2.1. Три основополагающие идеи (положения) квантовой механики:
1.
Квантование
энергии электронов в атоме – принцип
дискретности физических величин в
микромире (микроявлений и микрообъектов),
которые могут
изменяться не непрерывно, а скачкообразно,
принимая только определенные – дискретные
значения. О таких величинах говорят,
что они квантуются.
Макс
Планк (нем.
физик,1900 г.):
тепловое
излучение (абсолютно черного тела)
состоит из дискретных порций – квантов
энергии.
Значение
одного кванта энергии ∆E
= hν
= Eион
+ Eкин
= Eион
+ mv2/
2.
h
(постоянная Планка) – мера дискретности,
которая как бы определяет границу между
микро- и макромирами. Это
одна из фундаментальнейших постоянных
природы. Она
входит во все квантово-механические
соотношения (h
= 6,626 .10
-34 Дж
.с);
ν
= с/λ .
2. Двойственная природа (корпускулярно–волновой дуализм) электрона.
Луи
де Бройль, фр.
физик – квантовый механик, 1924 г.:
при
своем движении электрон (е—),
как и др. частицы
микромира (микрочастицы), обладает
корпускулярно–волновой
двойственностью,
т.е.
одновременно
является и дискретной (отдельной)
материальной
частицей с
массой покоя (m),
зарядом (z),
размерами, и
волной,
имея все ее свойства (дифракция,
интерференция и др.).
Этот
постулат выражается уравнением
волны де Бройля:
λ = h/
mv,
т.е.:
частице, имеющей
массу m
и движущейся со скоростью v,
соответствует волна длиной λ .
Постоянная
Планка h
связывает воедино корпускулярный и
волновой характер движения материи.
В
одних условиях на первый план выступают
волновые свойства объектов, в других –
корпускулярные, в третьих – те и другие
одновременно. Свободный или связанный
электрон нельзя назвать строго ни волной
ни частицей. Электрон
– это частица,
если речь идет о дискретности,
но это и волна,
если обсуждается характер
его движения.
Из
уравнения де Бройля следует: чем
меньше масса материальной
частицы и больше
ее скорость, тем характернее для нее
волновые свойства.
Создать
наглядную
модель микрообъекта
принципиально
невозможно!
3. Принцип
неопределенности Гейзенберга
(1927 г.):
(Вернер
Гейзенберг, нем. физик — квантовый
механик)
Для
электрона, как для любой микрочастицы-волны,
в принципе
невоз-можно
одновременно с одинаковой точностью
измерить координату (местонахождение)
и скорость движения (или импульс) — в
любой момент времени.
Математическим
выражением этого принципа является
соотношение:
∆x
= m .∆v
> h
/ 2π,
где ∆x
– неопределенность
(погрешность измерения) положения
электрона (любой микрочастицы),
∆v
– неопределенность
в измерении его скорости (или импульса
∆р =
m
.∆v).
Чем
меньше значение ∆x,
т.е. чем точнее определяем положение
микрообъекта (в частности, электрона),
тем больше неопределенность (ошибка) в
определении значения его скорости или
импульса, и наоборот.
2.2. Основные особенности квантового состояния электрона и электронной структуры атомов.
Движение
(состояние) электрона в поле ядер атомов
описывают с помощью волн де Бройля,
которые в трехмерной, пространственной,
системе координат математически
отображаются волновой функцией Ψ(x,
y,
z).
Волновые функции
Ψ(x,
y,
z),
«пси-функции»,
функции пространственных координат
электрона –
это разрешенные
квантовые состояния электронов,
определяющие энергетические
уровни в атоме
и
области наиболее
вероятного
нахождения электронов в трехмерном
пространстве вокруг атомного ядра.
Иначе
(образно) волновую функцию Ψ(x,
y,
z)
можно представить
как
амплитуду 3-х-мерной электронной волны,
точнее –
амплитуды
колебания вероятного
присутствия
электрона в данной области пространства.
Другими словами,
колеблется не сам электрон, а вероятность
его обнаружения в данной области атомного
пространства.
Для
волновой функции Ψ(x,
y,
z)
Движение электрона
в атоме носит вероятностный
характер – это
один из
постулатов квантовой механики, квантовой
химии.
Наиболее
вероятное квантовое
состояние электрона –
область околоядерного пространства, в
котором электрон может находиться в
разные моменты времени с максимальной
вероятностью (до 98%),–
называют атомной
электронной орбиталью
(АО) или
«электронным облаком» —
совокупностью
различных положений быстро движущегося
электрона.
Математически
АО представляют как Ψ
2(x,
y,
z)
.∆V,
т.е.
как произведение
квадрата
волновой функции
Ψ 2(x,
y,
z)
– плотности
вероятности
— на элементарный
объем атомного пространства
∆V.
Волновое
уравнение Шредингера
(1926 г.):
Эрвин
Шредингер, австр.
физик, предложил
уравнение, связывающее энергию
одноэлектронного атома водорода с его
пространственными координатами (x,
y,
z)
и волновой
функцией Ψ(x,
y,
z),
соответствующей
амплитуде
трехмерного волнового процесса:
— h2/
8π2m
[δ2
Ψ(x)/
δx2
+ δ2
Ψ(x)/
δx2
+ δ2
Ψ(x)/
δx2]
= (Eполн
– Eпотенц)
Ψ(x,
y,
z).
Уравнение Шредингера строго не выводится
(скорее постулируется, исходя из уравнения
двумерной волны де Бройля). Тем не менее
оно описывает реальное
поведение (состояние) электрона в атоме
и позволяет с большой точностью
рассчитывать вероятнось нахождения
электрона в данный момент времени в
любой точке пространства, занимаемого
атомом.
Квантовые
числа
Решения
(корни) уравнения Шредингера
содержат постоянные n,
l,
ml
, которые
назвали квантовыми
числами. Это
квантовые дискретные характеристики
волновой функции Ψ(x,
y,
z),
описывающие
силовое поле околоядерного пространства,
в котором может находиться электрон,
т. е. его энергетические уровни, подуровни
и атомные орбитали.
Любое
устойчивое состояние электрона в атоме
характеризуют определенными значениями
4-х квантовых
чисел: n
(главное),
l
(орбитальное),
ml
(магнитное),
ms
(спиновое).
Каждой
АО, т.е.
наиболее вероятному квантовому состоянию
электрона, соответствует свой
набор указанных
квантовых чисел.
Главное
квантовое число n
определяет:
а) уровень электронной
энергии
атомной орбитали и
атома, если этот
уровень является внешним, наиболее
удаленным от ядра; б) номер
(расстояние от ядра) данного квантового
(энергетического) уровня и
атомной орбитали.
Квантовое число
п
принимает значения
целых чисел, начиная с единицы:
п= 1,2,3,…,∞. С
величиной п
связано и
максимально
возможное
число электронов N(е)
на энергетическом
уровне: N(е)
= 2п2.
В атоме на
уровне п = 1,
например. может
быть не более двух электронов,
на уровне п
= 2 –
восьми, на
п = 3 –
восемнадцати
электронов и
т.д.
Орбитальное
квантовое число l
принимает
значения целых чисел от 0
до п–1,
характеризуя: а) энергию
электронов на подуровне, при
этом число п
здесь
соответствует номеру квантового уровня,
на котором впервые
появляется этот
подуровень; б) форму
электронной орбитали, АО:
s
– АО
(l
= 0) имеет
форму сферы,
р-АО
(l
= 1) – форму объемной восьмерки (гантели);
d
— АО
(l
= 2) имеет форму четырех объемных лепестков
(двух гантелей) и более сложную.
Магнитное
квантовое число
ml
характеризует
магнитный момент
электрона при движении по АО
и пространственную
ориентацию АО, принимая
значения: ml
= 0, ±1, ±2,…,
± l.
Для каждого
значения l,
таким образом, разрешено (2l
+1) знчений ml.
Все орбитали одного подуровня l
имеют одинаковую
энергию (энергетически вырождены), но
по-разному ориентированы в пространстве
магнитного поля ядра относительно друг
друга.
Спиновое
квантовое число ms
электрона имеет два значения, ±1/2,
характеризуя собственный магнитный
момент количества движения электрона
вокруг ядра атома при одновременном
вращении вокруг своей оси в двух взаимно
противоположных направлениях.
Атомные
орбитали, для
которых значения l
=
0, 1, 2, 3, называют
соответственно s
-, p
-, d
—,
f
— АО.
Так же называют и энергетические
подуровни,
s
-, p
-, d
—,
f
— подуровни,
включающие 1, 3, 5 и 7 соответствующих АО,
и химические
элементы,
образующие s
—,
p
—,
d
—,
f
— электронные
семейства, в
атомах которых электроны заполняют
соответствующие подуровни.
Например,
квантовому состоянию электрона 3s2
(второй
электрон на
3s
–АО) отвечает
набор квантовых чисел:
п = 3, l
= 0, ml
= 0,
ms
= — ½.
Заполнение
энергетических уровней, подуровней и
атомных орбиталей подчиняется четырем
основным правилам и принципам:
1.
Принцип Паули:
в атоме не может
быть даже двух электронов с одинаковым
набором 4-х квантовых чисел.
Из
этого следует, что каждая АО может быть
занята не более чем двумя электронами,
причем с разными по знаку спиновыми
квантовыми числами
ms,
равными +
½. Такие два электрона называют спаренными,
с антипараллельными спинами.
2.
Принцип
минимальной энергии:
устойчивому
(невозбужденному) состоянию атома
отвечает такое расположение электронов
по АО, при котором энергия атома
минимальна; АО заполняются в порядке
последовательного возрастания их
энергий, начиная с первого энергетического,
квантового, уровня (п = 1).
3.
Правило
Клечковского
(«минимального
(n
+ l)»)
определяет порядок
заполнения
электронами АО многоэлектронного
атома:
заполнение
энергетических уровней и подуровней
многоэлектронного атома, находящегося
в основном (невозбужденном) состоянии,
происходит в порядке увеличения суммы
главного и орбитального квантовых
чисел (n
+ l),
а при равных значениях (n
+ l)
– в порядке возрастания n.
(Не
забываем при этом, что каждому
типу подуровня
всегда
соответствует единственное
значение орбитального квантового числа
l).
Исключения
из правила Клечковского
— так
называемые «провалы
электронов» с
пs—
на (п-1) d-АО
у атомов d-металлов:
Cr,
Cu,
Ag,
Au,
Mo,
Ru,
Rh,
Pd,
Pt
—
связаны с повышенной устойчивостью
атомов в таких состояниях их валентных
электронов, когда они заполняют d—
подуровень либо наполовину
(5 неспаренных электронов), либо полностью
(10 электронов с антипараллельными
спинами). В свободном атоме d-АО
являются большими
по размерам и размытыми в пространстве.
Когда они заселены электронами наполовину
или полностью, то размеры их меньше,
орбитали сжаты в пространстве и, как
показывают квантово-механические
расчеты, их энергия меньше и, значит,
выше устойчивость.
4.
Правило Гунда
(«максимального
спина»,
которому
подчиняется
размещение электронов на
АО энергетического
подуровня:
В
данном подуровне электроны стремятся
занять энергетические состояния (АО)
таким образом, чтобы суммарный спин их
был максимальным, т.е. электроны
заполняют АО (квантовые ячейки) сначала
по одному электрону с mS
= +1/2,
затем – по второму, с
mS
= –1/2.
При
любом ином размещении электронов в
подуровне атом находится в возбужденном,
неустойчивом состоянии с более высокой
энергией.
Суммарный
спин электронов в подуровне определяют
как S(nе-)
= 1/2 nе-
,
где nе-–
число электронов в подуровне, S
— спин электрона,
равный 1/2.
Указанные
принципы и правила являются выражением
квантово-механических законов и позволяют
построить электронные оболочки атомов
элементов или ионов, т.е. их электронные
конфигурации
– распределение
электронов по квантовым уровням,
подуровням и атомным орбиталям.
Существуют
следующие
виды электронных конфигураций атомных
структур, условно
отражающих их
электронное строение:
а) электронные
схемы, когда
изображают ядро
в виде круга с атомным номером (зарядом
ядра, числом электронов) в центре и
справа – дугами – квантовые уровни п=
1, 2, 3, 4 и т.д.; под
каждой дугой пишут число электронов на
данном уровне;
б)
электронные формулы — строчной
записью энергетической
последовательности квантовых уровней
и подуровней, используя
символы подуровней,
перед которыми ставят число
номера уровня,
а в виде показателей
степеней у символов
указывают числа
электронов в каждом подуровне;
сумма показателей степеней должна быть
равна общему числу электронов в атоме,
т.е. порядковому номеру элемента;
в)
электронно-графические формулы — схемы,
представляющие, в соответствии с
электронной формулой, энергетическую
последовательность квантовых уровней
и подуровней, а
также атомные
орбитали с
помощью квантовых
ячеек, каждая
из которых графически,
условно,
изображает
одну
АО на
подуровне –
квадратиком, кружком или чертой.
Электрон
в квантовой ячейке изображают стрелкой,
направление вверх которой условно
принято за положительное значение
спинового квантового числа ms
(+1/2), вниз – за
отрицательное (–1/2). По принципу Паули
в каждой АО (квантовой ячейке) могут
находиться или один, неспаренный,
электрон или пара электронов с
противоположными (антипараллельными)
спинами.
Пример:
запишем электронную
конфигурацию атома
кремния в основном
(невозбужденном) состоянии в
виде электронной
формулы (б):
14Si
(n=3, IVA –
группа):
1s2
2s2
2p6
3s2
3p2.
Учитывая,
что р-электроны
имеют три, 2l+1,
состояния (ml
= +l,0
= +1,0,-1 для соответственно
рx
,
рy
и рz),
а d—
электроны – пять квантовых состояний
(ml
= +2, +1, 0, -1,
-2, для dxy
, dxz
, dyz
, dz2
и dx2
– y2),
электронные формулы можно записывать
более подробно, например, для атома
кремния:
14Si
(n=3, IVA –
группа):
1s2
2s2
2px2
2py2
2pz2
3s2
3px1
3py1
.
Химические
свойства элемента, по современной теории
строения вещества, определяются прежде
всего электронной конфигурацией
валентных — внешних
квантовых уровней, подуровней и орбиталей,
поэтому часто записывают сокращенную
электронную формулу,
показывающую строение именно валентных
слоев электронов, а внутренние,
завершенные слои заменяют
символом ближайшего благородного газа
с указанием
его порядкового номера
(общего числа электронов в атоме) и
номера периода,
в котором находится.
Валентные
электроны:
у
s—
и р-элементов
находятся на
одном энергетическом
уровне – внешнем
п-уровне
атома;
у
d–элементов
—
на двух, внешнем
(п)
и предвнешнем (п
– 1),
квантовых уровнях;
у
f–элементов
— на
трех уровнях:
внешнем (п),
предвнешнем (п
– 1)
и предпредвнешнем (п
— 2).
Пример: Запишем
сокращенную
электронную формулу
для атома р-элемента
– кремния: 14Si
(n=3,
IVA
–
группа): [10Ne,
n=2]
3s2
3p2
.
Недостатком
электронных формул
является использование только двух
квантовых чисел: п
и l.
Электронно-графические
формулы более
полно описывают состояние электронов
в атомах, с помощью 4-х квантовых чисел.
Периодический
Закон химических элементов Д.И.Менделеева
– один
из важнейших законов природы, который
в современной трактовке имеет следующую
формулировку: свойства
элементов, а также формы и свойства их
соединений находятся в периодической
зависимости от величины зарядов ядер
их атомов (или порядковых номеров).
Периодический
Закон позволяет уточнить понятие
«химический
элемент»: это
совокупность атомов с одинаковым
(положительным) зарядом ядра.
Периодическая
Система элементов
– это естественная
классификация химических элементов на
основе Периодического Закона, строго
упорядоченное множество химических
элементов, их систематизация.
Периодическая
Система отражает закономерное изменение
химических и ряда физических свойств
элементов. Основные особенности
химического поведения элементов
определяются зарядом ядер и строением
электронных оболочек внешних энергетических
уровней их атомов.
Химические
соединения элементов, сходные по
химическому составу и электронной
структуре, т.е. имеющие аналогичные
молекулярные и электронные формулы,
называют
однотипными соединениями. Они
различаются
лишь
одним химическим
элементом, причем эти элементы принадлежат
к одной группе или подгруппе Периодической
системы и находятся в этих соединениях
в одинаковом валентном состоянии. К ним
относятся бинарные и более сложные
соединения разных классов: оксиды,
гидроксиды, гидриды и другие.
Например,
однотипными оксидами являются СО2,
SiO2,
GeO2.
В
соответствии с Периодическим Законом
химические и физические свойства таких
соединений периодически изменяются в
зависимости от заряда ядра.
Существует
понятие и однотипных
химических реакций. Это
такие реакции, в которых участвуют
однотипные
соединения, находящиеся в одинаковых
агрегатных состояниях,
причем стехиометрические коэффициенты
при формулах соответствующих веществ
равны.
Периодическая
Таблица элементов Д.И.Менделеева
является табличной
формой выражения Периодической Системы.
Известно
более 500 графических форм Периодической
системы элементов, из которых около 100
– «геометрические» (треугольные,
цилиндрические, пространственные и
плоскостные фигуры, кривые и т.п.) и более
400 – табличные. Однако общее признание
и использование получили всего три
табличных варианта, близких по форме к
предложенным самим Д.И.Менделеевым:
длинно-, полудлинно-
и короткопериодная.
Наиболее
распространена привычная для нас
короткопериодная
таблица,
представляющая собой сочетание 10
горизонтальных рядов (7 периодов,
из которых 3
первых называют
малыми, с 4 по
7 – большими) и
8 вертикальных столбцов элементов –
групп, каждая
из которых разделена на две
подгруппы.
В
каждом периоде
располагаются элементы с
одинаковым для
электронов внешнего энергетического
уровня главным
квантовым числом (п),
т.е. с одинаковым
числом энергетических уровней в атомах
этих элементов.
Номер
периода равен числу энергетических
(квантовых) уровней в атоме.
Группы
отражают последовательность заполнения
электронами АО подуровней и состоят из
элементов с одинаковым
числом валентных
электронов,
определяющих высшую
валентность элемента
(как его способность образовывать
наибольшее число химических связей), и
отсюда — высшую
положительную степень окисления атома
при образовании
химических соединений.
Именно
поэтому Д.И.Менделеев в группы (и особенно
в подгруппы) выделил химические элементы,
имеющие сходные химические свойства.
В
главной подгруппе
(А) валентные электроны атомов
— внешние s–
или
р– электроны находятся
на одном,
внешнем,
энергетическом уровне;
у атомов элементов
побочных (Б) подгрупп
валентные электроны
располагаются на
двух или
трех энергетических
уровнях: у
d–элементов
– на внешнем п
и предвнешнем (п
– 1), т.е.
их число равно
сумме внешних
s–
и
предвнешних d–
электронов);
у f–элементов
– на внешнем, предвнешнем и предпредвнешнем
(п — 2),
и число их
валентных электронов равно
сумме внешних
s-,
предвнешних s–,
p–,
d–
и предпредвнешних s–,
p–,
d–,
f–
электронов).
Элементы
одной и той же подгруппы,
имеющие сходные
окончания электронных формул с
распределением
валентных электронов,
называют электронными
аналогами. Таковыми
являются,
например,
элементы IIIA-
подгруппы Al,
Ga
и In.
Они изоэлектронны.
Изоэлектронными
друг другу
(но не
электронными аналогами!)
могут быть также
ионы и атомы
элементов разных групп,
например: Al3+,
Si4+
и Ne.
Идентичность
электронного строения атомов
элементов подгрупп
определяет сходство не
только их
химических, но
и физических
свойств.
Строго
говоря, свойства
химического элемента
объединяют все
без исключения
его характеристики
в состоянии свободных атомов или ионов,
гидратированных или сольватированных,
простого вещества, а также формы и
свойства образуемых им многочисленных
сложных соединений, хотя обычно под
свойствами элемента подразумевают
свойства его свободных
атомов и простого
вещества.
Большинство этих свойств проявляет
явную периодическую зависимость от
порядкового номера элемента.
Важнейшие
среди физических
и химических
свойств, особо значимые при объяснении
или предсказании химического
поведения
элементов и образуемых ими соединений,
это: размеры
атомов и ионов, энергия ионизации,
сродство к электрону, электроотрицательность,
степень окисления.
Радиус атома
(иона) как принятый показатель
размера атома или иона – наиболее
важное физическое свойство атома (иона),
влияющее на его химические свойства.
Чем больше атомный радиус, тем слабее
удерживаются ядром внешние валентные
электроны и тем легче вступают во
взаимодействие, и, наоборот, с уменьшением
радиуса атома притяжение электронов к
ядру усиливается, и их отрыв требует
больше энергии. Истинные размеры
изолированных атомов или ионов –
абсолютные радиусы – непосредственно
измерить невозможно, т.к. атомы не имеют
строго определенных границ вследствие
волновой природы электронов. Поэтому
на практике используют так называеиые
эффективные размеры – радиусы
атомов или ионов в соединениях,
определяемые экспериментально, в
основном спектроскопическими и
дифракционными физическими методами.
Обычно измеряют межъядерные расстояния
либо в молекулах газовой фазы, либо в
кристаллах, из значений которых вычисляют
радиусы связанных атомов,
атомные или ионные, разделяя каждое
межъядерное расстояние на две части и
считая одну из них радиусом атома (иона)
первого из двух связанных, а другую –
радиусом второго атома (иона). При таком
разделении учитывают степени окисления
атомов, природу химической связи между
атомами, ионами или молекулами вещества,
характер координации частиц и др.
факторы. Получаемый таким способом
радиус, в зависимости от типа химической
связи или кристаллической решетки,
называют ковалентным (равен половине
расстояния между ядрами двух одинаковых
атомов, связанных ординарной ковалентной
сигма-связью), металлическим (в
металлах и сплавах), ионным (между
ядрами ионов) или ван-дер-ваальсовым
(между не взаимодействующими химически,
но связанными невалентными межмолекулярными
силами, ассоциированными атомами или
молекулами, например, атомами аргона в
твердом аргоне или молекулами твердого
азота), который можно приближенно считать
радиусом свободного атома. В
квантово-механических расчетах используют
орбитальный радиус атома r,
который считают лучшим описанием
эффективных размеров атома – это
теоретически рассчитанное положение
(расстояние от ядра) главного максимума
зарядовой плотности — энергии его внешних
электронов или иначе — расстояние от
ядра атома до наиболее удаленной точки
поверхности, описывающей атомную
орбиталь: r =
rБ
n2,
где rБ
– коэффициент пропорциональности,
радиус Бора (53 пм), n
– главное квантовое число, номер уровня
энергии.
В периодах атомные
радиусы изменяются периодически
от максимальных для щелочных металлов
до минимальных у благородных газов.
Уменьшение значений радиусов при
переходе от щелочного металла к ближайшему
по периоду благородному газу имеет, за
исключением ряда Li – Ne
(2 период), немонотонный характер,
особенно при появлении между щелочным
металлом и благородным газом семейств
переходных элементов, d-металлов
и f- лантаноидов или
актиноидов. В больших периодах в
семействах d- и f-
элементов наблюдается менее резкое
уменьшение радиусов, так как заполняются
электронами орбитали пред-внешних и
пред-предвнешних — уплотняющих слоев.
В подгруппах, с ростом номера
периода (числа электронных слоев),
радиусы атомов элементов и однотипных
ионов в общем увеличиваются, за некоторыми
исключениями: r(Ga)<r(Al),
r(Au)<r(Ag),
r(Ta)<r(Nb),
r(Hf) <r(Zr)
и др.- обусловленными появлением в 4-ом
и 6-ом энергетических уровнях соответственно
d- и f-
электронов (эффект «d- и
лантаноидного сжатия» электронных
слоев).
Энергия
(потенциал, энтальпия) ионизации
(I)– минимальная
энергия, которую необходимо затратить
для отрыва и удаления электрона от
свободного атома, иона или молекулы,
находящихся в газовой фазе в устойчивом,
низшем энергетическом состоянии.
Простейшей химической
реакцией, характеризующей свойства
свободных атомов, является процесс
отрыва электронов от невозбужденного
атома:
Э(г) =
Э+(г) + е—.
Энергия ионизации
количественно характеризует
способность атома (иона,
молекулы) удерживать электроны,
что является важнейшим показателем
химической активности,
восстановительной способности атома
или другой структурной частицы вещества.
По мере последовательного
отрыва электронов от атома положительный
заряд образующегося иона возрастает.
Поэтому последовательно возрастает и
затрата энергии (потенциал ионизации),
необходимой для отрыва электронов. Для
многоэлектронных атомов определены
последовательные энергии ионизации
для отрыва 1-го, 2-го, 3-го и т.д. электронов:
I1 < I2
< I3 и т.д.
Обычно энергию
ионизации определяют, исследуя пределы
спектров, т.е. частот волн спектров
поглощения или испускания, при которых
отдельные линии сливаются в сплошную
полосу, что соответствует уходу электрона
из поля ядра, его отрыву от атома.
Cродство
к электрону (Еср) –
это энергия, выделяющаяся при захвате
электрона свободным атомом, молекулой
или радикалом в газовой фазе в основном
(невозбужденном) состоянии, превращая
их в анионы.
Сродство к электрону
количественно характеризует
склонность атома, молекулы,
иона к образованию анионов –
окислительную способность определенной
частицы, которая для атомов элементов
в периодах в общем возрастает слева
направо и убывает сверху вниз внутри
группы.
Величины сродства к
электрону точно определены лишь для
немногих атомов неметаллов (Н, С, О, S,
I, Cl, F
и др.), а для молекул и радикалов
недостаточно надежны. Прямое вычисление
сродства к электрону атомов выполняют
по формуле: Еср = h
. c/лямбда0, где
лямбда0 – длина световой волны,
соответствующей порогу фотоотрыва
электрона от аниона.
Электроотрицательностью
(ЭО) называют величину энергии
притяжения валентных электронов атомом
элемента в сложных соединениях.
Известны разные
способы расчета электроотрицательности.
Способность атома
притягивать к себе электронную плотность
другого атома при взаимодействии с ним
зависит как от его энергии сродства к
электрону, так и от способности другого
атома отдавать электрон, т.е. от его
энергии ионизации, поэтому почти все
существующие способы приближенного
расчета ЭО основаны на соотношении
между этими двумя величинами.
Например, по Малликену,
ЭО (Х)– это полусумма энергий
ионизации (I) и сродства к электрону
(Еср): Х =
(I + Еср).
Поскольку энергия
сродства к электрону определена не для
всех элементов, а для других получены
неточные ее значения, чаще используют
величины относительной электроотрицательности
(ОЭО) атомов –
электроотрицательности, рассчитанной
по отношению к ЭО какого-либо активного
металла, принятой за единицу: лития
(шкала Полинга), кальция (шкала Малликена)
или актиния (шкала Оллреда-Рохова).
В большинстве случаев
энергия ионизации атома существенно
выше его сродства к электрону, поэтому
закономерность периодической зависимости
ЭО от заряда ядра примерно такая
же, как для энергии ионизации:
электроотрицательность возрастает в
Периодической Системе в направлении
слева направо для элементов каждого
периода и уменьшается сверху вниз для
элементов одной и той же группы.
Чем выше
электроотрицательность элемента, тем
сильнее проявляются его окислительные
и неметаллические свойства, поэтому
самыми сильными окислителями
являются неметаллы с практически
самой высокой электроотрицательностью
(теоретически ЭО выше только у
инертных газов гелия и неона, ОЭО
которых соответственно равны 5,5 и 4,8
по шкале Оллреда-Рахова), фтор (ОЭО
≈ 4,0) и кислород (ОЭО ≈ 3,5), а
самыми слабыми – наиболее активные
металлы–восстановители с наименьшей
электроотрицательностью: франций и
цезий (их ОЭО ≈ 0,8).
Значениями ОЭО
пользуются обычно для приближенной
теоретической оценки «металличности
– неметалличности» или амфотерности
элемента, а также полярности
химической связи между атомами:
значения ОЭО (наиболее активных
металлов) = 0,7 — 1,3; ОЭО (неметаллов) =
1,8 – 5,5; ОЭО (амфотерных металлов)
имеют значения, по разным данным (шкалам
Оллреда-Рахова, Полинга или Малликена),
в диапазоне от 1,3 — 1,5 до 1,8 — 2,4.
Лекции
№№ 6 — 8
Тема:
Строение
вещества
Строение атома
Автор статьи — профессиональный репетитор И. Давыдова (Юдина).
Атом — в переводе с древнегреческого – неделимый — это наименьшая частица химического элемента, являющаяся носителем его свойств. Современные представления о строении атома требуют для понимания знаний основ квантовой механики, поэтому мы ограничимся упрощенной моделью.
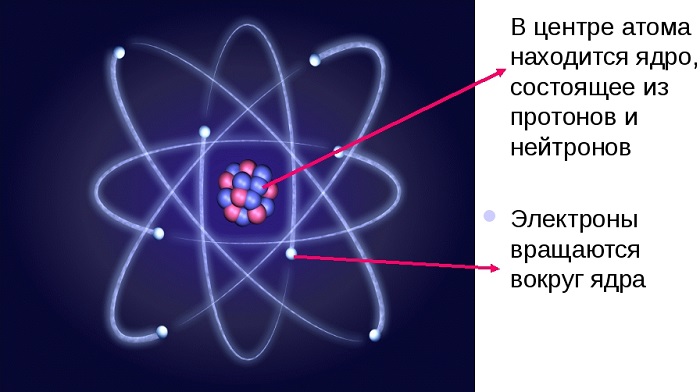
Атом состоит из ядра (в составе которого протоны и нейтроны) и электронов. Несмотря на то, что ядро составляет большую часть массы атома, оно очень мало.
| Заряд z | Масса m | |
| Протон p+ | +1 | 1 |
| Нейтрон n0 | 0 | 1 |
| Электрон e— | -1 | 0 |
Количество протонов равно количеству электронов и равно номеру атома в периодической таблице. Число нейтронов равно разности атомной массы и номера элемента.
Бор – пятый элемент периодической таблицы, в его атоме 5 протонов и 5 электронов. Атомная масса ≈ 11, количество нейтронов равно 11 – 5 = 6.
Элементы, имеющие одинаковое количество протонов в ядре, но различающиеся числом нейтронов, называются изотопами.
Например, 35Cl и 37Cl – изотопы, различающиеся атомной массой и количеством нейтронов.
| Число протонов | Число нейтронов | Число электронов | |
| 35Cl | 17 | 18 | 17 |
| 37Cl | 17 | 20 | 17 |
Вокруг ядра по различным траекториям — орбиталям движутся электроны. Каждой орбитали соответствует определенный уровень энергии, чем ближе орбиталь к ядру, тем меньшей энергией должен обладать электрон, чтобы находиться на ней.
Порядок заполнения орбиталей:
Электроны располагаются на орбиталях в соответствии со следующими правилами:
- Принцип наименьшей энергии: в первую очередь электроны заполняют наиболее низкие по энергии уровни (ближайшие к ядру).
Энергия орбиталей на уровнях и подуровнях изменяется следующим образом: 1s < 2s < 2р < Зs < Зр < 4s < 3d < 4р < 5s <4d < 5р < 6s < 4f ≈ 5d < 6p < 7s < 5f ≈6d < 7p . (●)
| Тип орбитали | Число орбиталей на энергетическом уровне | Максимальное количество электронов на этих орбиталях |
| s | 1 | 2 |
| p | 3 | 6 |
| d | 5 | 10 |
| f | 7 | 14 |
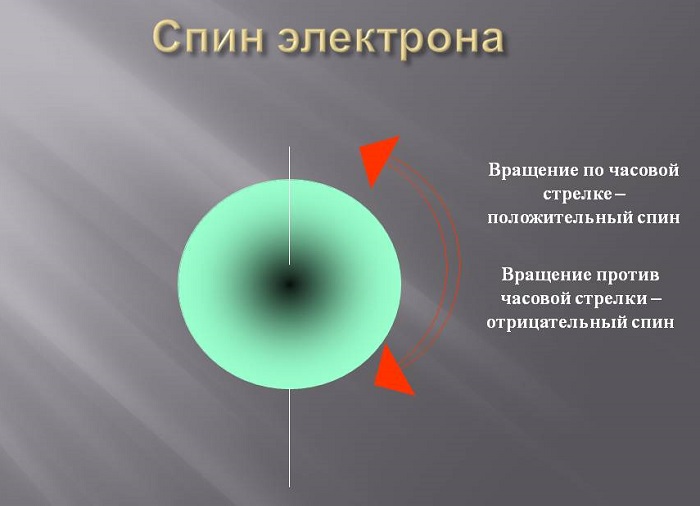
Перед оставшимися двумя принципами введем понятие спина электрона. Спин – характеристика самого электрона, представить его (это упрощенная модель, а ненастоящий физический смысл понятия спин!) можно как направление движения электрона вокруг своей оси: по или против часовой стрелки. Возможных значений всего два: +1/2 (обозначаем стрелкой вверх) и -1/2 (обозначаем стрелкой вниз).
- Принцип Паули: на каждой орбитали может быть не более двух электронов, причем их спины должны быть различными.
- Правило Хунда: суммарный спин системы должен быть максимально возможным.
С правилом Паули всё достаточно ясно: спины двух электронов на одной орбитали различны, а значит у одного электрона +1/2 (стрелочка вверх), у другого – -1/2 (стрелочка вниз). Но каков смысл правила Хунда? В данном случае обратимся всё к тем же значениям спина электрона. При заполнении электронного уровня всегда сначала заполняется один подуровень, только затем электроны помещаются на следующий. Рассмотрим p-подуровень. На нём имеются 3 орбитали (см. таблицу выше). В целом, есть разные варианты развития событий. Допустим, у нас есть 4 электрона, которые надо расположить на подуровне. Мы можем поместить два в первую ячейку, два во вторую. Посчитаем суммарный спин. У двух элетронов спин 1/2, у других -1/2. Тогда при сложении мы получаем ноль. Теперь расположим три первых электрона по одному, оставшийся поместим на первую орбитал (в пару). Теперь суммарный спин 1. Значит, подходит второй случай. Для того чтобы каждый раз не высчитывать суммарный спин, можно запомнить, что вначале следует расположить все имеющиеся электроны по одному, и если на подуровне уже не останется свободных ячеек, начинать составлять пары.
Рассмотрим заполнение орбиталей электронами на нескольких примерах. У каждого следующего элемента таблицы Менделеева на один протон и один электрон больше, чем у предыдущего. У элементов главных подгрупп всегда заполняется внешний электронный уровень, у элементов побочных – один из предыдущих.
— магний – двенадцатый элемент, имеет по 12 протонов и электронов, находится в главной подгруппе. Распределим эти электроны в соответствии с рассмотренными выше правилами, не забывая, что на каждом подуровне может быть не более двух электронов.
Магний – элемент третьего периода, следовательно, первый и второй энергетические уровни полностью заполнены — 1s22s22p6.Магний находится во второй группе, значит, на третьем уровне у него два электрона — 3s2. Итого получаем1s22s22p63s2.
В атоме магния в основном состоянии нет неспаренных электронов.
Если атому сообщили дополнительную энергию (например, нагрели), то электронная пара может распарится и один из электронов переходит на свободную орбиталь того же энергетического уровня. В возбужденном состоянии атом магния имеет два неспаренных электрона и может образовать две связи (валентность II).
— фосфор – пятнадцатый элемент, находится в главной подгруппе. Распределяем 15 электронов: Фосфор — элемент третьего периода, следовательно, первый и второй энергетические уровни полностью заполнены — 1s22s22p6.Фосфор находится в пятой группе, значит, на третьем уровне у него пять электронов — 3s23p3. Итого получаем1s22s22p63s23p3.
В атоме фосфора в основном состоянии 3 неспаренных электрона. В возбужденном состоянии атом фосфора имеет пять неспаренных электронов и может образовать пять связей (валентность V).
— цирконий – сороковой элемент, распределяем 40 электронов. Цирконий – элемент побочной подгруппы! Поэтому у него заполняется предыдущий электронный уровень (4d-подуровень). Цирконий – второй d – элемент в пятом периоде, значит, он содержит 2 электрона на 4d – подуровне. Итого получаем: 1s22s22p63s23p64s23d104p65s24d2.
В атоме циркония в основном состоянии 2 неспаренных электрона.
В возбужденном состоянии цирконий имеет четыре неспаренных электрона.
Важно отметить, что в обычном состоянии цирконий не может образовывать связей, так как для этого необходимы неспаренные электроны на внешнем электронном уровне. Соответственно, во всех соединениях цирконий находится в возбуждённом состоянии.
Исключениями из общего порядка заполнения электронных подуровней являются хром, марганец, медь, серебро и золото – у них наблюдается «провал» электрона с внешного s – подуровня на предвнешний d. (Атому более комфортно иметь на d-подуровне 5 или 10 электронов, чем 4 или 9). Например, электронные конфигурации хрома и меди вместо 4s23d4 и 4s23d9 имеют вид 4s13d5 и 4s13d10.
Задания для тренировки:
- Сколько протонов и электронов содержит ион NO2—
1) 46p, 46e
2) 23p, 24e
3) 23р, 23e
4) 46p, 47e - Чем отличаются изотопы одного и того же химического элемента?
1) Числом протонов
2) Числом электронов
3) Зарядом ядра
4) Массовым числом - Укажите атом, в котором больше всего электронов:
1) 2Н
2) 40Аr
3) 41Ar
4) 39К - Изобразить электронно-графическую схему атома хлора в основном и всех возможных возбужденных состояниях. Какие валентности способен проявлять хлор?
- Объяснить, почему сера проявляет валентность VI, а кислород – не проявляет, хотя оба эти элемента содержат по 6 электронов на внешнем слое.
Благодарим за то, что пользуйтесь нашими статьями.
Информация на странице «Строение атома» подготовлена нашими авторами специально, чтобы помочь вам в освоении предмета и подготовке к экзаменам.
Чтобы успешно сдать нужные и поступить в высшее учебное заведение или техникум нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими материалами из данного раздела.
Публикация обновлена:
07.05.2023
Спин электронов это квантовая особенность электронов. Это своего рода угловой момент.
Величина этого углового момента постоянна. Подобно заряду и массе покоя, спин является основным, неизменным свойством электрона.
Это внутреннее свойство, такое как масса или электрический заряд. Когда говорят о спине, вместо буквы l пишется буква s.
Что такое спин электрона и Квантовое число электронного спина
В качестве метода обучения мы иногда можем сравнить вращение электрона с вращением Земли вокруг своей оси каждые 24 часа.
Если электрон вращается по часовой стрелке вокруг своей оси, это называется вращением вверх, а против часовой стрелки-вращением вниз. Это подходящее объяснение, хотя и не полностью оправданное математически.
Угловой момент вращения, связанный со спином электрона, не зависит от орбитального углового момента, который связан с электронами, движущимися вокруг ядра.
Определение спин электронов
Спин электронов не используется для определения электронных оболочек, подоболочек или орбиталей, в отличие от квантовых чисел n, l и ml.
Спин электронов задается уравнением ∥S∥=√s * (s+1) * h.
Где
s-квантованный вектор спина.
Вектор спина обозначается ||s||
Квантовое число спина
Квантовое число спина s относительно углового момента спина.
h-постоянная Планка, h = 6,62607004 × 10-34м2 кг / с
В квантовой теории электрон рассматривается как минутный магнитный стержень, и его спин обращен к северному полюсу минутного стержня.
Если два ближайших электрона имеют одинаковое направление вращения, образуемое ими магнитное поле усиливает друг друга, и, следовательно, создается сильное магнитное поле.
Если ближайшие электроны имеют противоположное направление вращения, и магнитное поле, создаваемое ими, отменяет друг друга, и магнитного поля не существует.
Квантовое число спина S = n / 2
n считается неотрицательным целым числом.
Значения вращений являются 0, 1/2, 1, 3/2, 2, и т.д.
Суммарный момент импульса
Суммарный момент импульса » s » определяется по формуле:
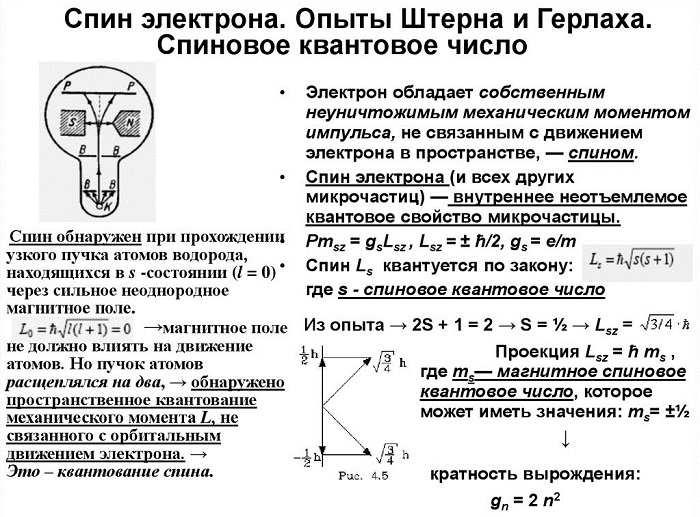
s =√n* (n +1) * h,
s =√1 / 2 * ( 1 / 2 + 1) * h
s =√3 / 4 * h—
,где
к-постоянная Планка снижается и обозначается как h (h-бар)
h— = h / 2π.
Спин электрона против электронного спинового квантового числа.
Спин электрона и квантовое число
Спин электрона и квантовое число электронного спина обычно рассматриваются как одно и то же. Спин электрона и квантовое число электронного спина являются квантовыми числами.
На самом деле это разные, но почти родственные понятия. Спин электрона обозначается символом «s’, а квантовое число электронного спина обозначается символом «ms».
Спин электрона » s » имеет только 1 возможное значение. Это значение равно ½ (один на два). Подобно массе покоя и заряду электрона, спин не отличается.
В отличие от массы и заряда этого электрона, спин имеет ориентацию. Ориентация спина представлена квантовым числом спина, «ms».
‘ms » может быть как положительным, так и отрицательным.
Положение каждого элемента
Положение каждого элемента в периодической таблице дает важную информацию о структуре элементов, их свойствах и поведении в химических реакциях.
Периодическая таблица помогает вам узнать ее электронную конфигурацию, понять, как электроны организованы вокруг ядра.
Атомы используют свои электроны для участия в химических реакциях, поэтому знание электронной конфигурации элемента позволяет предсказать, как он реагирует, будет ли и как он взаимодействовать с атомами других элементов.
Атом
Атомы являются фундаментальными единицами материи, и они определяют структуру элементов. Слово «неделимый» происходит от греческого слова, потому что когда-то считалось, что атомы-это самые маленькие вещи во Вселенной, и эти атомы нельзя разделить дальше.
Теперь мы знаем, что атомы состоят из 3 частиц: протонов, нейтронов и электронов, и эти три частицы состоят из еще более мелких частиц, таких как кварки.
Ядро
Эрнест Резерфорд открыл ядро в 1911 году, физик из Новой Зеландии, который в 1920 году дал название протону для положительно заряженных частиц атома.
Резерфорд также сказал, что в ядре также есть нейтральная частица, которую Джеймс Чедвик, британский физик, смог доказать в 1932 году.
Практически вся масса атома остается в ядре. Протоны и нейтроны, образующие ядро, имеют примерно одинаковую массу, так что протон немного меньше и имеет одинаковый угловой момент, согласно данным Национальной лаборатории Лоуренса Беркли.
Протоны
Протоны-это положительно заряженные частицы, наблюдаемые в атомных ядрах. Резерфорд видел их в экспериментах с электронно-лучевыми трубками между 1911 и 1919 годами.
Протоны несколько меньше по массе, чем нейтроны с относительной массой 0,9986, так что по сравнению с массой нейтрона, равной 1 или около 1,673×10-27 кг.
Общее количество протонов в атоме определяет, какой это элемент. Например, атомы углерода имеют 6 протонов, атомы водорода-1, а атомы кислорода-8.
Число протонов в атоме также называется атомным номером этого элемента. Общее число протонов в атоме также определяет химическое поведение элемента.
В таблице элементов элементы расположены в порядке возрастания атомного номера.
Электроны
Электроны малы по сравнению с протонами и нейтронами, более чем в 1800 раз меньше, чем протон или нейтрон. Электроны имеют относительную массу 0,0005439, так что электрон сравнивается с массой нейтрона, равной единице или примерно 9, 109×10-31 кг.
Электрон был открыт британским физиком Дж.Дж. Томасоном в 1897 году. В основном известные как «корпускулы», электроны имеют отрицательный (-ve) заряд и электрически притягиваются к положительно заряженным протонам.
Атомное ядро окружено электронами по путям, называемым орбиталями, эта идея была выдвинута физиком Эрвином Шредингером в 1920-х годах.
Теперь эта модель известна как квантовая модель или система электронного облака. Внутренние орбитали, окружающие атом, имеют сферическую форму, но внешние орбитали гораздо сложнее.
Электронная конфигурация атома — это орбитальное описание положения электронов в типичном атоме.
Используя конфигурацию электронов и законы физики, химики могут предсказать свойства атома, такие как стабильность, температура кипения и проводимость.
Нейтроны
Нейтрон используется в качестве сравнения для определения относительной массы протонов и электронов, так что, таким образом, он имеет относительную массу 1 и имеет физическую массу 1, 6749×10-27 кг.
Наличие нейтрона было теоретизировано Резерфордом в 1920 году и обнаружено Чедвиком в 1932 году.
Нейтроны были обнаружены во время экспериментов, когда атомы были поражены тонким слоем бериллия. Субатомные частицы без заряда высвободили нейтрон.
После понимания того, что такое атом, ядро, протоны, нейтроны и нейтроны. Теперь давайте обсудим спин электрона.
Часто задаваемые вопросы и ответы?
Что такое спин электрона в физике?
Спин — это внутренняя, исключительно квантовая характеристика, которую нельзя объяснить в рамках релятивистской механики.
Если представлять частицу (например, электрон) как вращающийся шарик, а спин как момент, связанный с этим вращением, то оказывается, что поперечная скорость движения оболочки частицы должна быть выше скорости света, что недопустимо с позиции релятивизма.
Что такое спин у элементарных частиц?
Спин (от английского spin – вращаться) – собственный момент импульса элементарной частицы. Теперь вспомним, что такое момент импульса в классической механике.
Момент импульса – это физическая величина, характеризующая вращательное движение, точнее, количество вращательного движения.
Что такое полуцелый спин?
Полуцелый спин характеризует протоны и нейтроны, которые составляют ядра атомов известных химических элементов, таким же спином обладают электроны, ответственные за электрический ток.
Спин электрона простыми словами?
Спином называют собственный момент импульса частицы.
Момент импульса характеризует количество вращательного движения, то есть спин характеризует тот факт, что частицы ведут себя так, будто бы они вращаются вокруг своей оси.
Частицы похожи на маленькие волчки и ведут себя очень похожим образом.
Спин электрона (от англ. «вращение») относится к физическому свойству субатомных частиц, в соответствии с которым каждая элементарная частица имеет собственный момент импульса фиксированной величины.
Это внутреннее свойство, такое как масса или электрический заряд. Когда говорят о спине, вместо буквы l пишется буква s.
В 1920 году химики пришли к выводу, что с известными квантовыми числами (масса, электрический заряд) было невозможно полностью описать электроны в атоме. В химии электроны играют ведущую роль.
Что такое спин в физике
Около 1925 г. три исследователя Ральф Крониг, Гаудсмит и Уленбек начали с идеи, что электрон, который вращается вокруг атомного ядра, похож на Землю, двигающуюся вокруг Солнца.
Как Земля имеет вращательное движение, так и электрон, связанный с атомом, вращается сам по себе.
Полный угловой момент Земли представляет собой векторную сумму ее орбитального углового момента и ее углового момента вращения. Но в случае электрона нельзя рассчитать его угловой момент вращения так, как рассчитывают момент Земли, основываясь на массе, радиусе и угловой скорости.
Электрон является держателем отрицательного электрического заряда. Вращение создает магнитное поле, которое называется спином.
Спин обеспечивает меру собственного момента импульса каждой частицы. Он необходим, чтобы определить тип частицы.
Добавив спин в качестве четвертого числа, можно было дать более полное объяснение характеристик спектров атомов, обладающих одним электроном. Можно представить электрон как крутящийся мяч, а спин как связанный с этим вращением момент. Но в этом случае скорость движения получится выше скорости света.
Существование спина подтверждается многими экспериментальными результатами. До сих пор неизвестно, из чего складывается спин протона. Нельзя провести измерение относительно оси Х и оси У одновременно.
Вскоре концепция была распространена на все субатомные частицы, включая протоны, нейтроны и античастицы. Свойства большинства парамагнитных и ферромагнитных веществ определяет обусловленный спином электрона магнитный момент.
Техника и наука нашли широкое применение определенных свойств, связанных с этим физическим свойством. Правило Хунда говорит, что суммарный спин должен быть максимальным (при распределении электронов в пределах энергетического уровня).
Классификация элементарных частиц по спину
Какое значение может принимать спиновое квантовое число?
Принципы квантовой механики указывают, что значения спина в нормальных условиях ограничены целым или полуцелым числом, кратным постоянной Планка.
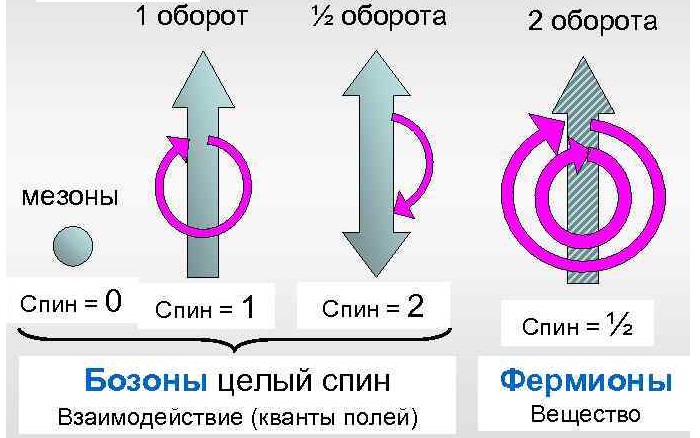
Фермионы (электроны, кварки, нейтрино) имеют полуцелые значения (½, 3/2).
Бозоны (фотоны, глюоны, бозоны) имеют спины 0, 1, 2. У фотона спин — 1.
Некоторые экзотические частицы, такие как пион, имеют значение 0.
1/2 — это спин одиночного электрона. Такая система называется дублет.
Магнитный спиновый момент существует для незаряженных частиц, таких как фотон. Ферромагнетизм возникает из-за выравнивания спинов (иногда и от орбитальных магнитных моментов).
В настоящее время микроэлектроника находит применение для определенных свойств или эффектов, связанных с природой вращения, таких как магнитосопротивление или гигантское магнитосопротивление, которое используется в жестких дисках.
Также рассматривается возможность использования этих свойств для будущих компьютеров, в которых спин изолированной системы может служить квантовым битом (кубитом). Сейчас ученые пытаются контролировать спин, используя сверхкороткие импульсы лазера.
Квантовое число характеризует собственный момент движения электрона, одно из состояний микрофизической системы (например, атома, молекулы и т. д.), возможных согласно квантовой теории. Обычно это целое или полуцелое число (n или n + 1/2).
Для четкого описания системы необходимо предоставить полный набор чисел (измеренных одновременно). Открытие трудно переоценить. Без него нельзя было бы построить квантовые вычислители, а многие свойства атомов и материалов так и остались бы загадкой.
Спин
Из
проекта Викизнание
Спин в квантовой механике обозначает собственный момент импульса
отдельных элементарных частиц и их связанных состояний в виде ядер и атомов. В отличие
от орбитального момента импульса, спин не связан с перемещением в пространстве
центра инерции частицы, и является её внутренней характеристикой. Поскольку
спин является вектором, он имеет направление в пространстве и отражает вращение
составных элементов частицы. У ядер и атомов спин определяется по правилам
квантовой механики как векторная сумма орбитальных и спиновых моментов импульса
составляющих частиц, с учётом квантования проекций моментов импульса. При
увеличении размеров системы и количества частиц в ней орбитальные моменты
импульса могут быть много больше, чем спиновые моменты импульса. Это приводит к
тому, что спин макросистемы в виде отдельного тела почти полностью зависит от
орбитального вращения элементов вещества тела вокруг некоторой оси.
В квантовой механике квантовые числа для спина не совпадают с квантовыми
числами для орбитального момента частиц, что приводит к неклассической
трактовке спина. Кроме этого, у спина и орбитального момента частиц возникает
различная связь с соответствующими магнитными дипольными моментами,
сопровождающими любое вращение заряженных частиц. В частности, в формуле для
спина и его магнитного момента гиромагнитное отношение не равно 1.
Концепция спина у электрона привлекается для объяснения многих явлений, таких
как расположение атомов в периодической системе химических элементов, тонкая
структура атомных спектров, эффект Зеемана, ферромагнетизм, а также для
обоснования принципа Паули. Недавно возникшая область исследований, называемая
«спинтроника», занимается манипуляциями спинов
зарядов в полупроводниковых устройствах. В ядерном магнитном резонансе
используется взаимодействие радиоволн со спинами ядер, позволяющее осуществлять
спектроскопию химических элементов и получать изображения внутренних органов в медицинской
практике. Для фотонов как частиц света спин связывается с поляризацией света.
Математическая теория спина была использована для построения теории изоспина элементарных частиц.
Оглавление
- 1 История
- 2 Спиновое квантовое число
- 2.1 Спин элементарных частиц
- 2.2 Спин составных частиц
- 2.3 Спин атомов и молекул
- 3 Связь между спином и
статистикой - 4 Спиновый магнитный момент
- 5 Ориентация спина
- 5.1 Квантовое число проекции
спина и мультиплетность - 5.2 Вектор спина
- 6 Математическая формулировка
спина в квантовой механике - 6.1 Оператор спина
- 6.2 Спин и принцип запрета
Паули - 6.3 Спин и вращения системы
координат - 6.4 Спин и лоренцевские преобразования
- 6.5 Матрицы Паули и
операторы спина - 6.6 Измерение спина вдоль
осей x, y, z - 6.7 Измерения спина вдоль
произвольной оси - 6.8 Совместимость измерений
спина - 7 Использование концепции
спина в науке и технике - 8 Обобщение спина
- 9 Сущность спина
- 9.1 Спин электрона
- 9.2 Характерный спин
- 9.3 Предельные соотношения
для нуклонов - 10 Ссылки
- 11 Справочная литература
- 12 Внешние ссылки
- 13 Смотри также
История
В 1922 г. был описан опыт Штерна — Герлаха,
который обнаружил пространственное квантование направления магнитных моментов у
атомов. Впоследствии, в 1927 г. это было интерпретировано как доказательство
существования спина у электронов. [1]
В 1924 г. Вольфганг Паули ввёл двухкомпонентную внутреннюю степень свободы
для описания эмиссионных спектров валентного электрона в щелочных металлах. Это
позволило ему сформулировать принцип Паули, согласно которому в некоторой системе
взаимодействующих частиц у каждого электрона должен быть свой собственный
неповторяющийся набор квантовых чисел (все электроны в каждый момент времени
находятся в разных состояниях). Поскольку физическая интерпретация спина у
электрона была неясна с самого начала (и это имеет место до сих пор), в 1925 г.
Ральф Крониг (ассистент известного физика Альфреда
Ланде) высказал предположение о спине как результате собственного вращения
электрона. Однако согласно Паули, в таком случае поверхность электрона должна
вращаться быстрее скорости света, что кажется невероятным. Тем не менее осенью 1925 г. Дж. Уленбек и С. Гаудсмит
постулировали, что электрон обладает спином
в
единицах постоянной
Дирака , и спиновым магнитным моментом, равным магнетону Бора. Это
предположение и было принято научным сообществом, поскольку удовлетворительно
объясняло известные факты.
В 1927 г. Паули модифицировал открытое ранее Шрёдингером и Гейзенбергом
уравнение Шрёдингера с целью учёта спиновой переменной, используя
спиновые операторы и матрицы Паули. Модифицированное таким образом
уравнение носит сейчас название уравнение Паули. При таком подходе у электрона
появляется новая спиновая часть волновой функции, которая описывается спинором
— «вектором» в некотором абстрактном спиновом пространстве.
В 1928 году Поль Дирак построил релятивистскую теорию спина на основе
четырёхкомпонентной величины, называемой биспинором.
Спиновое квантовое число
Спин элементарных частиц
В теории элементарных частиц обычно предполагается, что фотон, электрон и кварки не делятся на более мелкие
части и являются самыми «элементарными». Однако спин, который приписывается
этим частицам, слишком велик, чтобы его можно было объяснить вращением
составляющего вещества при известных оценках размеров частиц. Поэтому для этих
частиц спин полагается некоторым внутренним свойством, наподобие массы и
заряда, требующим особого, пока ещё не известного обоснования.
В квантовой механике спиновый момент импульса любой системы квантуется.
Амплитуда или длина вектора спинового момента в каждом состоянии равна:
где есть постоянная Дирака, а спиновое квантовое число s является положительным целым или полуцелым числом (0, 1/2, 1, 3/2, 2, …) и зависит от типа
частицы. В противоположность этому орбитальный момент импульса имеет только
целые квантовые числа.
Спин составных частиц
К составным частицам можно отнести атомные ядра, состоящие из нуклонов, а
также адроны, согласно кварковой концепции
состоящие из кварков. Спин составной частицы находится векторным суммированием
орбитальных и спиновых моментов импульса всех составляющих её частиц, с учётом
правил квантового сложения, и также квантуется, как любой момент импульса. В
квантовой механике каждая составная частица имеет некоторый минимально
возможный спин, не обязательно равный нулю (в этом состоянии моменты импульса
составляющих частиц частично компенсируют друг друга, уменьшая спин составной
частицы до минимума). Если же моменты импульса составляющих частиц
складываются, то это может приводить к состояниям, в которых составная частица
имеет значительный спин. Так, одним из наибольших спинов среди адронов обладает
барионный резонанс Δ(2950) со спином 15/2. Спин
ядер из-за их относительно больших размеров может превышать 20 .
В качестве других примеров можно привести Δ-барион
и какой-либо нуклон, протон или нейтрон. В кварковой
теории у Δ-бариона спины всех трёх кварков
складываются, давая спин 3/2. В нуклоне спины двух кварков противоположны и
вычитаются, и спин 1/2 нуклона равен спину третьего кварка. Картина однако усложняется тем, что в нуклонах кроме кварков
предполагаются глюоны как переносчики взаимодействия,
а также виртуальные частицы. Вследствие этого распределение момента импульса
между кварками и глюонами в адронах точно не
определено.
Спин атомов и молекул
Размеры атомов и молекул много больше размеров атомных ядер, так что спин
какого-либо атома определяется его электронной оболочкой. В заполненных атомных
оболочках количество электронов чётно и их суммарный момент импульса равен
нулю. Поэтому за спин атомов и молекул ответственны неспаренные
электроны, находящиеся обычно на внешней оболочке. Считается, что именно спин неспаренных электронов приводит к явлению парамагнетизма.
Ниже указаны спины некоторых элементарных и составных частиц.
|
спин |
общее название |
примеры |
|
0 |
скалярные частицы |
π-мезоны, K-мезоны, хиггсовский |
|
1/2 |
спинорные частицы |
электрон, кварки, протон, нейтрон, атомы и |
|
1 |
векторные частицы |
фотон, глюон, векторные мезоны, ортопозитроний |
|
3/2 |
спин-векторные |
Δ-изобары, гравитино |
|
2 |
тензорные частицы |
гравитон, тензорные мезоны |
Связь между спином и статистикой
В квантовой механике волновая функция системы из нескольких одинаковых
частиц может быть либо симметричной (неизменной) относительно перестановки
местами двух любых частиц, либо антисимметричной, что приводит к умножению
волновой функции на −1. В первом случае говорят, что частицы подчиняются
статистике Бозе – Эйнштейна, а сами частицы
называются бозонами. Во втором случае частицы называются фермионами и
подчиняются статистике Ферми – Дирака.
В 1940 г. Паули доказал теорему о связи спина со статистикой, которая
утверждает: «Частицы с целым спином (s = 0, 1,
2, …) являются бозонами, а частицы с полуцелым спином
(s = 1/2, 3/2, …) – фермионами». [2]
Это означает, что симметрия волновой функции относительно перестановки
одинаковых частиц определяется спиновыми квантовыми числами данных частиц.
Свойством частиц – бозонов является то, что в одном и том же квантовом
состоянии может находиться одновременно множество частиц. У фермионов каждая
частица в соответствии с принципом запрета Паули имеет квантовое состояние, не
совпадающее с состояниями других частиц.
Спиновый магнитный момент
Спин является частью полного механического момента импульса частицы, и если
последняя заряжена, то спину по формулам классической электродинамики можно
поставить в соответствие определённый магнитный дипольный момент. При этом
часто используется так называемое гиромагнитное отношение как отношение
магнитного момента к механическому моменту. Для частицы с массой m, зарядом q и спином S спиновый магнитный момент μ равен:
где безразмерная величина g называется g-фактором. Для чисто орбитального
(например, кругового) вращения элементов заряженного вещества частицы вокруг
оси g-фактор должен быть равен 1. У электрона g-фактор почти точно равен 2, что
существенно отличает спин от орбитального вращения. Отличие g-фактора электрона
от 2 в квантовой электродинамике обосновывается как следствие взаимодействия
заряда электрона с окружающим электромагнитным полем, включая самодействие поля
электрона. За счёт спинового магнитного момента частицы могут взаимодействовать
друг с другом и с внешними магнитными полями.
Как правило принимается, что нейтрино электрически
нейтральны, но при наличии некоторой ненулевой массы покоя у них не исключается
наличие магнитного момента.[3] [4] [5] Формула
для предполагаемого магнитного момента нейтрино имеет вид:
где есть масса-энергия
нейтрино в электронвольтах, –
магнетон Бора. Если исходить из оценок массы-энергии нейтрино, не превышающих
значение 1 eV, то из соображений ограниченности электромагнитной энергии по
сравнению с энергией покоя ожидается, что магнитный момент нейтрино не
превышает 10−14. [6]
Из имеющихся экспериментальных данных магнитный момент нейтрино не превышает
1,2 × 10–10 от величины магнитного момента электрона.
Наличие спина у составных частиц приводит к соответствующему спиновому
магнитному моменту. Многие нейтральные адроны, невзирая на равенство нулю у них
суммарного заряда, обладают магнитным моментом, причём направление магнитного
момента обычно противоположно спину. Это ясно указывает на их сложную
внутреннюю электромагнитную структуру. С точки зрения кварков, которым
приписываются различные заряды, магнитные моменты адронов приблизительно могут
быть получены как комбинации спиновых и орбитальных магнитных моментов
составляющих адроны кварков.
В веществе большинства тел магнитные моменты атомов направлены случайным
образом в различные стороны и взаимно вычитают друг друга, обращая суммарное
магнитное поле в нуль. В ферромагнитных материалах
ниже температуры Кюри возникает внутренняя магнитная упорядоченность за счёт
доменной структуры. В каждом домене магнитные моменты атомов выстраиваются
приблизительно параллельно, усиливая общее магнитное поле. В свою очередь
магнитные поля доменов суммируются векторно, приводя
к достаточно устойчивой намагниченности ферромагнетиков и превращая их в
магниты.
Магнитная упорядоченность возникает и под действием внешнего магнитного
поля. В парамагнитных материалах магнитные моменты атомов устанавливаются вдоль
приложенного магнитного поля, тогда как в диамагнитных веществах атомные
магнитные моменты направлены против поля и ослабляют его. Электронный
парамагнетизм есть следствие ориентации электронных магнитных моментов, которые
начинают прецессировать вдоль направления поля. Диамагнетизм вытекает из
действия закона электромагнитной индукции, согласно которому при изменении
магнитного потока в системе зарядов возникает электродвижущая сила.
Появляющееся по действием
этой силы движение зарядов приводит к магнитному полю, направленному
противоположно исходному магнитному полю (правило Ленца). Считается, что
существенная доля магнитных моментов атомов связана со спином электронов, хотя
вклады в магнитные эффекты делают и орбитальные магнитные моменты электронов.
Ориентация спина
Квантовое число проекции спина и мультиплетность
Поскольку спин является вектором момента импульса, он имеет и амплитуду и направление в пространстве. В квантовой механике
используется понятие о проекции момента импульса на некоторую выделенную ось
(обычно направление этой оси в пространстве задаётся внешним магнитным полем).
Пусть выделенное направление фиксируется осью z используемой системы отсчёта. Тогда возможные
проекции спина на эту ось имеют значения:
где s
есть спиновое квантовое число для частицы или системы частиц. Общее
число проекций спина sz равно 2s+1. В стандартной теории в
приближении спин-орбитальной связи число 2s+1 называется мультиплетностью спиновой системы.
В частности, для частиц со спином 1/2 получается
только два значения для проекции спина: sz
= +1/2 и sz = -1/2. Отсюда следует,
что для электрона в водородоподобном атоме мультиплетность равна 2, а спектры
таких атомов имеют дублетную природу. При наличии двух электронов, как это
происходит в гелии, суммарный спин обоих электронов равен 0 либо 1.
Соответственно, мультиплетность будет равна 1 для парагелия с одиночными
линиями в спектре, и равна 3 для ортогелия с триплетными линиями в спектре.
Вектор спина
В каждом квантовом состоянии можно ввести вектор спина ,
чьими компонентами являются ожидаемые значения проекций спина на оси системы
координат .
Этот вектор указывает «направление» спина, соответствующее в
классическом пределе оси вращения. В квантовомеханических
вычислениях вектор спина имеет особенность – его компоненты sx, sy и sz
не могут быть измерены одновременно из-за квантового принципа неопределённости Гейзенберга.
Однако для статистически больших наборов частиц при одинаковых начальных
квантовых состояниях, как это имеет место в опыте Штерна — Герлаха,
вектор спина и связанный с ним вектор магнитного момента имеют хорошо
определённое экспериментально направление – оно задаётся той ориентацией
детектора, при которой отмечается наибольшее
количество частиц из всего используемого набора.
Вследствие связи между спином и его магнитным моментом внешнее магнитное
поле будет приводить к прецессии спина вдоль магнитного поля. Этот эффект
аналогичен классическому гироскопическому эффекту – магнитное поле действует на
магнитный дипольный момент и создаёт крутящий момент, который прикладывается к
спиновому механическому моменту частицы и приводит к прецессии оси вращения и
спина частицы.
В квантовой механике спин описывается не просто вектором как классический
момент импульса, а с помощью математических объектов – спиноров. Поведение
векторов и спиноров при вращении координат различается. Например, каждое
вращение частицы со спином 1/2 на 360 градусов приводит частицу не в прежнее
состояние, а в состояние с противоположной квантовомеханической
фазой. Для частицы с нулевым спином её квантовое состояние при вращении не
меняется. Если же у частицы спин равен 2, то при вращении на 180 градусов она
получает прежнее квантовое состояние.
Математическая формулировка спина в квантовой механике
Оператор спина
Оператор спина подчиняется тем же соотношениям, что и оператор орбитального
момента импульса:
где εijk – символ Леви-Чивиты. Собственные векторы операторов S2
и Sz (выраженные через кет-векторы в общем S-базисе) равны:
где через m
обозначено квантовое число проекции спина на выделенную ось.
Операторы увеличения и уменьшения спина, действующие на данные собственные
векторы, дают соотношения:
,
где
В отличие от орбитального момента импульса, указанные собственные векторы (и
соответствующие матричные элементы) не выражаются через сферические гармоники и
не являются функциями углов θ и φ. Величины s и m могут быть полуцелыми числами.
В квантовой механике спин квантуется в единицах постоянной
Дирака , которая образуется путём деления постоянной Планка (постоянной
действия) на 2π. При этом функция состояния частицы зависит как от координат в виде радиус-вектора
, так и от
в виде дискретного набора
величин:
Здесь можно выделить бозоны (s = 0 или 1 или 2 или
…) и фермионы (s = 1/2 или 3/2 или 5/2 или …). В
процессах взаимодействия сохраняется общий момент импульса системы,
складывающийся из орбитального момента импульса и спина.
Спин и принцип запрета Паули
Для систем из N идентичных частиц действует принцип Паули, который
устанавливает, что перестановка между любыми двумя из N частиц может
привести к изменению волновой функции системы:
Для бозонов фактор ( − 1)2s
равен +1, а для фермионов равен –1. В квантовой механике все частицы
разделяются на бозоны и фермионы. В релятивистской квантовополевой
теории суперсимметрии допускаются частицы, имеющие и
бозонные и фермионные компоненты.
Электроны являются фермионами с величиной
s = 1/2; кванты света ( фотоны)
являются бозонами с величиной s = 1. Фотоны являются релятивистскими объектами и хорошо
вписываются в релятивистскую квантовую электродинамику. Однако полуцелые квантовые числа для спина фермионов отличаются от
целых квантовых чисел для орбитального момента и для бозонов, приводя к
затруднению при классическом объяснении спина.
Спин и вращения системы координат
Согласно квантовой механике проекция момента импульса на выделенную ось
квантуется, образуя ряд дискретный значений. В связи с этим наиболее подходящим
квантовомеханическим способом описания спина частицы
являются комплексные числа, соответствующие амплитудам вероятности
нахождения заданной величины проекции спина на выделенную ось. Например,
для частицы со спином 1/2 требуется два числа
, задающие амплитуды вероятности нахождения проекций
спина, равных и
, и
удовлетворяющие условию:
Поскольку эти числа зависят от выбора осей координат, при вращении осей они
должны преобразовываться соответствующим образом. Из линейности преобразований,
которые описываются матрицей вращения, результат последовательного вращения,
представляемого двумя матрицами A и B, должен быть равен с точностью до фазы
результату вращения, представляемого матрицей AB. Кроме этого, вращения
сохраняют квантовомеханическое произведение, задающее
матрицы преобразования:
С точки зрения математики, эти матрицы определяют унитарное проективное
представление группы вращения SO(3). Каждое такое представление соответствует
представлению покрывающей группы для SO(3), которым является SU(2). Имеется
одно n-мерное неприводимое представление SU(2) для каждого измерения, причём
это представление является n-мерным действительным для нечётных n и n-мерным комплексным для чётных n
(следовательно будет 2n действительное представление).
В частности, если у частиц спин 1/2, то при вращениях он трансформируется
согласно 2-мерному представлению, которое генерируется матрицами Паули:
где α, β, γ являются углами Эйлера.
При наличии у частиц более высоких спинов 1 и 3/2 они трансформируются аналогичным
образом с помощью многомерных представлений и соответствующих матриц вращения.
Спин и лоренцевские преобразования
При попытке использовать аналогичный указанному
выше подход для поведения спина при преобразованиях Лоренца возникает
препятствие. Оно связано с тем, что в отличие от группы преобразований вращения
SO(3), группа лоренцевских преобразований SO(3,1) не
является компактной и не имеет необходимого унитарного ограниченно-мерного
представления.
В случае частиц со спином 1/2 можно найти конструкцию, которая включает
ограниченно-мерное представление и скалярное произведение, соответствующее
этому представлению. Каждой частице можно приписать 4-компонентный спинор
Дирака ψ. Такие
спиноры преобразуются при преобразованиях Лоренца по следующему закону:
где γμ есть гамма-матрицы,
ωμν – антисимметричные 4×4 матрицы, параметризующие преобразование. При этом сохраняется
следующее скалярное произведение:
Матрицы Паули и операторы спина
Квантовомеханические операторы, связанные со
спиновыми наблюдаемыми величинами, имеют вид:
В особом случае спина 1/2 имеются три матрицы Паули σx, σy и σz:
Измерение спина вдоль осей x, y, z
Каждая из эрмитовых матриц Паули имеет два
собственных значения, +1 и -1. Соответствующими нормализованными волновыми
собственными векторами являются следующие:
Согласно постулатам квантовой механики, эксперимент, направленный на
измерение компонент электронного спина вдоль осей x, y или z может дать только
собственные значения спинового оператора (Sx, Sy, Sz) на эти оси, равные и
.
Квантовое состояние частицы с учётом спина может быть представлено
двухкомпонентным спинором:
Когда спин измеряется по отношению к заданной оси,
например оси x, вероятность, что измерение даст значение , равна
. Соответственно, вероятность того, что при измерении будет
получено значение , равна
. В ходе измерения спина спиновое состояние частицы в виде волновой
функции редуцируется так, что получается какое-либо собственное состояние.
В результате, если при измерении вдоль заданной оси получилось собственное
значение, то и последующие аналогичные измерения вдоль этой оси не изменят
результата (так как , и
т.д.).
Измерения спина вдоль произвольной оси
Оператор спина вдоль произвольной оси может быть получен с помощью спиновых
матриц Паули. Допустим u = (ux,uy,uz)
есть произвольный единичный вектор. Тогда оператор спина в этом направлении
определяется выражением . Оператор Su имеет собственные значения
,
как и обычные спиновые матрицы. Аналогичным способом находятся операторы спина
в произвольном направлении и для спинов более высокого порядка.
Нормализованный спинор для спина 1/2
в (ux,uy,uz) направлении (который справедлив для всех
случаев спиновых состояний, кроме состояния спин вниз, где получается 0/0),
имеет вид:
Этот спинор получается после диагонализации
σu–матрицы и определения
собственных состояний и собственных значений спина.
Совместимость измерений спина
Поскольку матрицы Паули не коммутируют между собой, измерения спина вдоль
осей системы отсчёта не совместны друг с другом. Это означает
например, что при известном спине вдоль оси
x
последующее измерение спина вдоль оси
y
изменяет значение спина, имевшееся вдоль оси x ранее. Это видно из свойств собственных
векторов (собственных состояний) матриц Паули:
Если при измерении спина частицы вдоль оси
x
получено значение ,
это значит, что волновая функция спинового состояния редуцировалась в
собственное состояние . Если затем измерять спин частицы вдоль
оси y,
спиновое состояние станет равным либо либо
, каждое с вероятностью
.
Допустим, было измерено значение .
Если теперь вернуться к измерению спина вдоль оси x, вероятность
получения значения или
будет равна
(эти вероятности равны
и
). Это
означает, что первоначальное значение спина вдоль оси x
изменилось за счёт проведённого измерения вдоль оси y,
так как вероятность получения значения спина
теперь равна только
.
Использование концепции спина в науке и технике
Понятие спина широко используется в ядерном магнитном резонансе в химической
спектроскопии, в электронном парамагнитном резонансе в химической и физической
спектроскопии, в магниторезонансных измерениях плотности протонных спинов с
целью сканирования внутренних органов в медицине, в технологиях современных
компьютерных жёстких дисков на основе гигантского магниторезистивного эффекта.
Спин рассматривается как возможный носитель двоичной информации в спиновых
транзисторах. Электроника, связанная с такими транзисторами, носит название спинтроника. [7]
Спин и принцип Паули оказываются необходимыми в квантовой механике для
объяснения ряда явлений и закономерностей, таких например, как периодическая
таблица Дмитрия Менделеева.
Обобщение спина
Введение спина означает применение новой физической идеи: постулирование
того, что существует пространство состояний, никак не связанных с перемещением
частицы в обычном пространстве. Обобщение этой идеи в ядерной физике привело к
понятию изотопического спина, который действует в особом изоспиновом
пространстве. В дальнейшем, при описании сильных
взаимодействий были введены внутреннее цветовое пространство и квантовое
число цвет, как более сложный аналог спина.
Сущность спина
Особенностью квантовой механики является то, что в ней реальные движения
частиц заменяются квантованными волновыми движениями, а результаты
экспериментов вычисляются в виде вероятностей тех или иных событий. Такой
подход принципиально не может объяснить природу спина, поскольку для этого требуются
субстанциональные модели частиц. Некоторые такие модели на основе теории бесконечной вложенности материи,
а также концепция динамического спина электрона были предложены Сергеем
Федосиным в 2009 г. [8] В теории бесконечной вложенности материи
спин ряда одинаковых объектов рассматривается как собственный характерный
момент импульса, которым в среднем обладают данные объекты. Если у элементарных
частиц характерный спин измеряется в единицах , то на
звёздном уровне материи вырожденные объекты типа
нейтронных звёзд имеют характерный момент импульса порядка Дж•с (смотри звёздная
постоянная Дирака). Различие спинов как характерных моментов импульса
приводит к различию соотношений
неопределённости на разных уровнях материи, например: [9]
для уровня элементарных
частиц,
для уровня звёзд.
Одним из следствий этого становится то, что приписывание частицам,
составляющим объект, того же самого значения спина, которым обладает данный
объект, оказывается не всегда правильным (такая ситуация предполагается для
трёх кварков внутри нуклона согласно квантовой хромодинамике
и особенно в преонных моделях элементарных частиц, где в результате
возникает «парадокс масс»).
Спин электрона
Расчёт баланса сил на поверхности электрона с учётом действия сильной гравитации и электрической
силы Кулона показывает, что электрон как самостоятельная частица не может иметь
какой-то определённый радиус – электрическая сила расталкивает частицы вещества
сильнее, чем сила гравитации. Стабилизация электрона в виде облака возможна в
атомах, где имеются дополнительные гравитационные и электрические силы
притяжения со стороны ядра, силы отталкивания от других электронов и
центростремительные силы при вращении вещества.
В субстанциональной модели спин
электрона носит не статическую, а динамическую природу. Он появляется за счёт
сложного движения электронного облака вокруг ядра в результате взаимодействия с
фотоном или другим электроном. Вещество электрона вращается вокруг центра
инерции облака, давая орбитальную компоненту момента импульса. Кроме этого
возникает общее вращение облака вокруг ядра атома, выражающееся во вращении
центра инерции облака относительно ядра и в появлении соответствующей
компоненты момента импульса. Эта компонента и является так называемым
динамическим спином электрона. Она ответственна за излучение электромагнитного
кванта при переходе электрона с верхнего уровня энергии на нижний, а также за
спиновый магнитный момент. В отсутствие динамического спина излучение из атома
стремится к нулю. Вследствие различия вращательных движений вещества,
ответственных за динамический спин и орбитальное вращение, возникает различие
значений g-факторов в формулах, связывающих спиновый и орбитальный моменты
импульса и соответствующие им магнитные моменты.
Согласно расчётам в основном состоянии атома, а также в s-состояниях
магнитный момент электрона в атоме связан не со спином (в этих состояниях
динамический спин равен нулю, центр электронного облака не вращается
относительно ядра), а с орбитальным вращением вещества электронного облака.
Динамический спин и соответствующий ему спиновый магнитный момент для
простейшего случая плоского движения вещества могут иметь два направления
относительно орбитального момента электрона. Это приводит к энергии
взаимодействия магнитного момента электрона и магнитного момента ядра,
вращающегося относительно центра инерции электронного облака. Данная энергия
приводит к расщеплению уровней энергии на дублеты в водородоподобном атоме, к
мультиплетности и к тонкой структуре атомных спектров. В субстанциональной
модели электрона даётся своё объяснение лэмбовскому
сдвигу уровней энергии, принципу Паули, магнитомеханическим явлениям с
электронами, связывающим намагничение образцов с их
вращением.
Характерный спин
В ряде случаев характерный спин элементарных частиц можно найти прямым
расчётом. В частности для некоторых адронов, исходя из аналогии строения их
вещества с нейтронными звёздами, используется соотношение между радиусом и массой
адрона: [10]
где и
– радиус и масса протона.
В следующей таблице приведены массы и радиусы протона, пиона и мюона,
необходимые для расчёта их спина. Радиус мюона находился с помощью теории подобия уровней материи, исходя из
радиуса белого карлика, соответствующего мюону.
|
Характеристики |
||||||
|
Частица |
Масса-энергия, |
Масса, 10–27 |
Радиус, 10–16 |
Энергия связи |
Характерный |
Квантовый спин |
|
Протон p+ |
938,272029 |
1,6726 |
8,7 |
938,272 |
5,34 |
ħ/2 |
|
Пион π+ |
139,567 |
0,249 |
16,4 |
11 |
0,54 |
0 |
|
Мюон μ+ |
105,658 |
0,188 |
10900 |
0,095 |
9,1 |
ħ/2 |
Массы частиц получаются путём деления массы-энергии, переведенной из МэВ в Дж,
на квадрат скорости света. Характерный момент импульса объекта находится по
формуле:
причём характерная скорость частиц вещества объекта связана с абсолютной
величиной полной энергии объекта в поле сильной гравитации: [9]
здесь для объектов типа нуклонов и нейтронных звёзд,
– постоянная сильной гравитации.
Для протона была также найдена формула ,
так что для характерного спина протона получается: , где
– скорость
света и характерная скорость частиц вещества протона, – постоянная Планка. Если применить
такой же подход для характерного спина мюона, получится следующее:
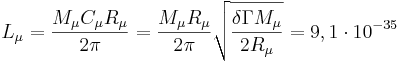
Характерный спин мюона превышает значение
квантового спина ħ/2 , принятого для фермионов и
лептонов. Для пиона при его радиусе согласно таблице спин получается
равным 0,05 ħ , то есть значительно меньше
минимального спина фермиона, равного ħ/2. Вследствие
этого квантовый спин пиона полагается равным нулю, а сам пион считается
бозоном. В квантовой статистике представление пиона в виде бозона существенно
отличает пион от протона, являющегося фермионом. Однако пион отличается от
протона лишь уменьшенной массой, так что общепринятое подразделение
элементарных частиц по значению спина на фермионы и бозоны не совсем корректно
в свете того, что бозонам и фермионам предписывается кардинальное различие в
поведении за счёт действия принципа Паули.
Предельные соотношения для нуклонов
Можно предположить, что протон имеет не только квантовомеханический
спин, равный , но
и предельный момент импульса собственного вращения как некоторый максимальный
спин. Тогда при предельном вращении возникает формула для магнитного момента
протона: [8]
Данная формула для нейтрона несколько изменяется, поскольку в отличие от
протона нейтрон в субстанциональной
модели имеет более сложную внутреннюю электромагнитную структуру с
неоднородным распределением электрического заряда.
Максимальный спин протона позволяет оценить его радиус путём сравнения
момента импульса поля сильной гравитации и спина. [11]
Ссылки
- B. Friedrich, D. Herschbach.
Stern
and Gerlach: How a Bad Cigar Helped Reorient
Atomic Physics. Physics Today, 2003, Vol. 56, issue 12, page 53. - W. Pauli «The Connection Between Spin and Statistics», Phys. Rev. 58, 716-722 (1940), pdf.
- W.J. Marciano, A.I. Sanda.
Exotic decays of the muon and heavy leptons in gauge theories. Physics Letters, 1977, Vol. B67, issue 3, page 303–305. - B.W. Lee, R.E. Shrock.
Natural suppression of symmetry violation in gauge theories: Muon- and
electron-lepton-number nonconservation. Physical Review, 1977, Vol. D16, issue 5, page 1444–1473. - K. Fujikawa, R.
E. Shrock. Magnetic Moment of a Massive Neutrino
and Neutrino-Spin Rotation. Physical Review Letters, 1980, Vol. 45, issue 12, page 963–966. - N.F. Bell et al. How Magnetic is
the Dirac Neutrino? Physical Review Letters, 2005, Vol. 95, issue 15, page
151802. arXiv hep-ph/0504134.
- Spintronics. Feature Article в Scientific American, June 2002.
- Федосин С.Г. Физические теории и бесконечная
вложенность материи. Пермь, 2009, 844 стр., Табл. 21, Ил.41, Библ. 289
назв. ISBN 978-5-9901951-1-0. - Федосин С. Г. Физика и философия подобия от преонов
до метагалактик, Пермь: Стиль-МГ, 1999, ISBN 5-8131-0012-1, 544 стр.,
Табл.66, Ил.93, Библ. 377 назв. - Комментарии к книге: Федосин
С.Г. Физические теории и бесконечная вложенность материи. Пермь, 2009, 844
стр., Табл. 21, Ил.41, Библ. 289 назв. ISBN 978-5-9901951-1-0. - Федосин С.Г. Современные проблемы физики. В
поисках новых принципов, М: Эдиториал УРСС,
2002, ISBN 5-8360-0435-8, 192 стр., Ил.26, Библ. 50 назв.
Справочная литература
- «Физическая
энциклопедия» под ред. Прохорова А.М. -М.: Научное издательство
«Большая российская энциклопедия».-1994 г. ISBN 5-85270-087-8.
Внешние ссылки
- Bigs animation The spin.
- Goudsmit on the discovery of electron spin.
- Nature
magazine Milestones in the field of ‘spin’ since 1896.
См. также
- Субстанциональная модель электрона
- Субстанциональная модель нейтрона
- Субстанциональная модель протона
- Принцип неопределённости Гейзенберга
- Модель кварковых квазичастиц
- Гравитационная модель сильного
взаимодействия