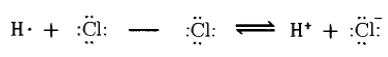Елена Алексеевна Сабыбина
Эксперт по предмету «Химия»
Задать вопрос автору статьи
Процесс поляризации
Определение 1
Поляризация — это процесс электростатического воздействия на частицу, в результате которого происходит смещение в ней электрических зарядов.
Процесс поляризации включает в себя с одной стороны поляризующее действие ионов, с другой — поляризуемость.
-
Поляризующее действие катиона. Зависит от электронной структуры иона, величины заряда и радиуса. Поляризующее действие будет тем значительнее, чем меньше радиус, главное квантовое число внешних электронных орбиталей и больше величина заряда.
Например: сильное поляризующее действие характерно катионам первых рядов Периодической системы.
-
Поляризуемость анионов. Зависит от тех же факторов, что и поляризующее действие катионов. Чем больше у аниона радиус и заряд, тем сильнее он поляризуется.
Сдай на права пока
учишься в ВУЗе
Вся теория в удобном приложении. Выбери инструктора и начни заниматься!
Получить скидку 3 000 ₽
Поляризующее действие катиона заключается в оттягивании на себя электронного облака от аниона. В результате степень ковалентности увеличивается, ионность связи уменьшается, то есть связь становится ковалентной полярной.
Поляризация ионов по своему эффекту противоположна поляризации ковалентной связи.
Поляризуемость и ее свойства
Определение 2
Поляризуемость — способность вещества приобретать электрический дипольный момент под действием внешнего электрического поля. Это способность к деформации электронного облака частицы под действием электростатического поля другого иона. Поляризующее действие иона будет определять напряженность этого поля.
Поляризуемость характеризует способность молекулы становиться полярной в результате действия внешнего электрического поля. Соединение поляризуется также при действии молекул друг на друга, например, во время химических реакций.
Результатом поляризации может стать полный разрыв связи. При этом осуществляется переход связывающей электронной пары к одному из атомов и образуются разноименные ионы. Ассиметричный разрыв связи с образованием таких ионов называется гетеролитическим:
«Поляризуемость» 👇
Рисунок 1.
Поляризуемость может быть вызвана:
-
смещением электронов или атомных ядер под действием электрического поля;
-
изменением геометрии молекулы;
-
поворотом молекулы;
-
смещением иона в соседнюю свободную кристаллографическую позицию (поляризуемость Сканави) и др.
Поляризуемость ионов зависит от электронной структуры иона, его заряда и размера. В каждой подгруппе периодической системы поляризуемость ионов элементов растет с увеличением их порядкового номера.
Поляризующее действие ионов тем значительнее, чем:
-
устойчивее электронная оболочка иона;
-
больше заряд;
-
меньше радиус иона.
Поляризуемость возрастает:
-
при увеличении размеров молекулы (атома);
-
с возрастанием атомного номера;
-
увеличении легкости возбуждения атома.
Например: Октан более поляризуем, чем гексан, так как имеет больше электронов. Но гексадиен тоже будет более поляризуем, чем гексан, что связано с наличием у гексадиена подвижных $pi $-электроны. А $pi $-электроны более чувствительны к изменению электрического поля, чем $sigma $-электроны.
Поляризуемость влияет на:
-
кислотность и основность молекул в газовой фазе;
-
жесткость кислот и оснований Льюиса;
-
скорость нуклеофильного замещения.
Расчет поляризуемости молекул
Поляризация проявляется в возникновении индуцированного дипольного момента $mu_{инд}$; у частиц (в результате смещения электронов и ядер).
Индуцированный дипольный момент является пропорциональным напряженности внешнего электрического поля:
$mu_{инд} = alpha cdot varepsilon_0 cdot Е$,
где $mu_инд$ — индуцированный дипольный момент, Д;
$alpha $ — коэффициент пропорциональности — поляризуемость частицы, $frac{Кл cdot f {м^2}}{B}$;
$E$ — напряженность электрического поля, $B$.
Для ионов поляризуемость пропорциональна кубу их радиуса.
В электрическом поле у полярной молекулы с постоянным дипольным моментом появляется еще индуцированный дипольный момент. Тогда учитывается суммарная относительная диэлектрическая проницаемость. Это выражается уравнением Дебая:
$N(frac{alpha + mu^2}{3varepsilon_0kT})=3(varepsilon-1)(varepsilon+2)$,
где $N$ — число молекул в единице объема образца;
$alpha $ — поляризуемость молекулы;
$varepsilon_0$ — постоянный дипольный момент молекулы;
$k$ — постоянная Больцмана;
$T$ — абсолютная температура.
Если построить график зависимости правой части этого уравнения от $frac{1}{T}$, то
можно определить $frac{mu^2}{3varepsilon_0k}$ и , следовательно, постоянный дипольный момент молекулы. Поляризуемость определяется по отрезку, отсекаемому на оси ординат при $frac{1}{T} = 0$.
При очень высоких температурах диполь вращается так быстро, что его величина обнуляется и остается только индуцированный диполь. Он располагается в направлении индуцирующего его поля и может сохраняться при самых высоких температурах.
Влияние поляризации на свойства веществ.
Поляризуемость может объяснить некоторые особенности свойств веществ:
-
Растворимость.
Например: хлорид серебра $AgCl$ растворяется в воде намного хуже, чем хлорид натрия $NaCl$ или хлорид калия $KCl$. Радиус иона серебра $Ag^+$ соизмерим с радиусами ионов натрия $Na^+$ и калия $К^+$, но поляризуемость иона серебра гораздо больше (он имеет $18$ электронов на внешнем уровне), чем ионов натрия и калия. Поэтому межъядерное расстояние в хлориде серебра меньше, а энергия разрыва связи больше, чем в молекулах хлоридов натрия и калия.
-
Температура плавления. Взаимная поляризация ионов способствует разрушению кристаллов. При этом понижается температура плавления, и тем больше, чем сильнее деформируется кристаллическая решетка.
Например: В молекулах фторидов рубидия $RbF$ и титана $TiF$ радиусы катионов одинаковы, но ион титана $Ti^+$ сильнее поляризуется и поэтому оказывает сильное поляризующее действие на ион фтора $F^-$, чем ион рубидия $Rb^+$. Температура плавления фторида рубидия составляет $798^circ C$, а т. пл. фторида титана $327^circ C$.
-
Температура диссоциации. Процессу поляризации будет способствовать повышение температуры. При этом увеличивается амплитуда колебаний ионов, что иногда приводит к перестройке структура вещества. Наблюдается полиморфное превращение. При нагревании возможен и полный переход электронов от аниона к катиону — происходит термическая диссоциация вещества. Чем сильнее будет поляризующее действие, тем ниже температура диссоциации.
Например: в ряду соединений данного катиона $MCl — MI$ и данного ниона $NaГ — LiГ$ температура разложения будет понижаться.
Находи статьи и создавай свой список литературы по ГОСТу
Поиск по теме
Поляризация вещества
В веществах
различают свободные и связанные заряды.
Cвободными
называются такие заряды, которые под
действием сил поля могут свободно
перемещаться в веществе, их перемещение
не ограничивается внутримолекулярными
силами. Под связанными зарядами понимают
такие, которые под действием сил поля
могут смещаться только в пределах
молекулы. Связанные заряды не отделимы
от вещества поэтому сумма положительных
связанных зарядов равна сумме
отрицательных.
Д
тела в электростатическом поле
поляризуются. Под поляризацией понимают
упорядоченное изменение расположения
связанных зарядов под действием сил
поля. Наглядно можно показать поляризацию
с помощью рис.11.5, на котором изображено
тело при отсутствии электростатического
поля и при его наличии. Если поля нет,
то молекулы (диполи) расположены в
хаотическом беспорядке (рис.11.5,а). В
поляризованном же теле положительные
связанные заряды смещаются в сторону
более высокого потенциала, а отрицательные
– в сторону меньшего (рис.11.5,б), причем
смещаются настолько, что силы воздействия
электрического поля уравновешиваются
внутримолекулярными силами. В результате
поляризации на поверхности вещества
как бы обнажаются положительные или
отрицательные связанные заряды причем
сумма первых из них в точности равна
сумме вторых. Диполи создают свои поля.
В неполяризованном веществе их суммарное
действие равно нулю, а в поляризованном
– нет, оно приводит к ослаблению
результирующего поля и его необходимо
учитывать. С этой целью вводится понятие
электрического момента диполя.
Электрическим моментом двух равных по
величине и противоположных по знаку
зарядов, находящихся друг от друга на
расстоянииl,
называется произведение
Это вектор, направленный от —q
к +q
(рис.11.6). Под
действием внешнего поля диполи вещества
стремятся ориентироваться так, чтобы
их электрические моменты совпадали с
напряженностью внешнего поля. Практическое
значение имеет конечно не один диполь
и его электрический момент (он чрезвычайно
мал), а сумма электрических моментов
диполей, находящихся в единице объёма,
которую принято называть вектором
поляризации
,
т.е.Для
большинства диэлектриков вектор
поляризации пропорционален напряженности
поляа коэффициент пропорциональности между
нимиk
называется
электрической восприимчивостью.
Кроме рассмотренных
выше векторных величин
и
,
физический смысл которых мы выяснили,
в теории поля в расчет вводят ещё вектор,
который называется вектором электрического
смещения или вектором электрической
индукции. Он определяется следующим
образом:где
называется относительной диэлектрической
проницаемостью среды, в которой создано
поле, аабсолютная диэлектрическая проницаемость
среды, в которой создано поле.показывает во сколько раз электрические
свойства среды отличаются от свойств
вакуума (это отличие имеет место за счет
поляризации). Для всех средопределено экспериментальным путем и
приводится в справочниках.
Теорема Гаусса
Теорема Гаусса
представляет собой основной закон
электростатического поля. Он обнаружен
экспериментальным путем и математически
записывается так
поток вектора электрического смещения
через любую замкнутую поверхность,
окружающую некоторый объём, равен
алгебраической сумме свободных зарядов,
находящихся внутри этой поверхности
(в суммезаряды
берутся со своими знаками). Посколькуто
.
Для однородных и изотропных средявляется
постоянной величиной и её можно вынести
за знак интеграла, тогдаИнтересно, что поток вектораD
или Е
зависит только от
и не зависит от расположения зарядов
внутри замкнутой поверхности. Поток
вектораЕ
создается не только свободными, но и
связанными зарядами. Последние можно
учитывать не через
,
а через отдельно взятую сумму связанных
зарядов и тогда формула теоремы Гаусса
выглядит так:Эти три формулы представляют собой
интегральную форму записи теоремы
Гаусса, которая с большой эффективностью
и простотой может быть использована
для расчета напряженности поля в
какой-либо точке, если через неё можно
провести замкнутую поверхность, все
точки которой находятся в одинаковых
условиях по отношению к зарядам, создающим
поле. В качестве примера рассчитаем
поле, создаваемое точечным зарядом.
Т
называется заряд, расположенный на теле
очень малых геометрических размеров.
На рис.11.7 он изобразится в виде точки
(отсюда и название). Допустим, что этот
заряд является положительным и расположен
в среде с проницаемостью.
Возьмём произвольную точку, отстоящую
на расстояниеr
от точечного
заряда. Напряженность в этой точке будет
направлена по радиальной линии (см.
рис.11.7). Для её расчета применим формулу
С этой целью проведём через данную точку
замкнутую сферическую поверхность с
центром, совпадающим с точечным зарядом.
Вектор элементарной поверхностинаправляется в сторону внешней нормали
к площадке (она расположена в окрестности
рассматриваемой точки). Поскольку в
нашем примере векторыЕ
и ds
совпадают, то их произведение совпадает
с произведением модулей. Кроме того во
всех точках рассматриваемой сферы
величина вектора Е
одинакова в силу симметрии. С учётом
сказанного имеем:
поскольку поверхность сферы равна
Сумма свободных зарядов равна только
заданному точечному заряду.
Подставляя эти значения в формулу
теоремы Гаусса, получаем:Таким образом, в данном поле напряженность
изменяется обратно пропорциональноr2.
Произведём расчет
потенциала в данном поле, исходя из
формулы
.
Если учесть, что напряженность, а значит
и потенциал, зависят только от радиуса,
то последняя формула перепишется так
откуда
Отсюда следует, что потенциал в данном
поле изменяется обратно пропорционально
r.
Постоянная интегрирования А зависит
от того, где расположить точку с нулевым
потенциалом.
Интегральная форма
записи теоремы Гаусса не даёт ответа
на вопрос о том, как связана напряженность
поля в данной точке с зарядом в этой же
точке. Ответ на этот вопрос даёт
дифференциальная форма этой теоремы,
которая вытекает из интегральной. Для
этого выражение
поделим на величину объёма, ограниченного
поверхностью интегрированияЭто соотношение справедливо для объёма
любой величины. Устремим его к нулю
(говорят, что стянем поверхность в
точку). ТогдаПредел отношения потока вектораD
через замкнутую поверхность, ограничивающую
некоторый объём, к величине этого объёма
называется дивергенцией вектора D
()
или истоком, или расхождением. В правой
части последнего равенства стоит
объёмная плотность свободного зарядаρсв.
Тогда
Это и есть теорема Гаусса в дифференциальной
форме. Её суть поясним с помощью трех
случаев, о
на рис.11.8. Если в рассматриваемой точке
поля объёмная плотность свободного
заряда положительна, то из бесконечно
малого объёма, окружающего данную точку,
линии вектораD
исходят (исток положительный, расхождение
положительное, дивергенция положительная).
Если в рассматриваемой точке поля
объёмная плотность свободного заряда
отрицательная, то в бесконечно малый
объём, окружающий данную точку, линии
вектора D
входят (исток отрицательный, расхождение
отрицательное, дивергенция отрицательная).
И, наконец, если в рассматриваемой точке
нет свободного заряда, то в такой точке
нет ни стока ни истока линий вектора D,
т.е. в такой точке лини вектора D
не начинаются и не заканчиваются, а
пронизывают бесконечно малый объём,
окружающий данную точку.
Поскольку
то
Для однородных и изотропных сред
является
постоянной величиной и её можно вынести
за знакdiv,
тогда получим:
Если явление поляризации учитывать с
помощью связанных зарядов, то последнее
выражение можно так переписатьгдеρ
связ—
объёмная плотность связанных зарядов.
Опуская вывод выражения
,
запишем его в прямоугольной системе
координатона
представляет собой сумму частных
производных проекций вектораЕ
по трём координатным осям. Покажем, что
скалярное произведение оператора набла
и вектора Е
означает взятие дивергенции от последнего:
В связи с этим
теорему Гаусса в дифференциальной форме
часто записывают так
Поляризуемость
Определение 1
Поляризация — это процесс электростатического воздействия на частицу, в результате которого происходит смещение в ней электрических зарядов.
Процесс поляризации включает в себя с одной стороны поляризующее действие ионов, с другой — поляризуемость.
-
Поляризующее действие катиона. Зависит от электронной структуры иона, величины заряда и радиуса. Поляризующее действие будет тем значительнее, чем меньше радиус, главное квантовое число внешних электронных орбиталей и больше величина заряда.
Например: сильное поляризующее действие характерно катионам первых рядов Периодической системы.
-
Поляризуемость анионов. Зависит от тех же факторов, что и поляризующее действие катионов. Чем больше у аниона радиус и заряд, тем сильнее он поляризуется.
Поляризующее действие катиона заключается в оттягивании на себя электронного облака от аниона. В результате степень ковалентности увеличивается, ионность связи уменьшается, то есть связь становится ковалентной полярной.
Ничего непонятно?
Попробуй обратиться за помощью к преподавателям
Поляризация ионов по своему эффекту противоположна поляризации ковалентной связи.
Поляризуемость и ее свойства
Определение 2
Поляризуемость — способность вещества приобретать электрический дипольный момент под действием внешнего электрического поля. Это способность к деформации электронного облака частицы под действием электростатического поля другого иона. Поляризующее действие иона будет определять напряженность этого поля.
Поляризуемость характеризует способность молекулы становиться полярной в результате действия внешнего электрического поля. Соединение поляризуется также при действии молекул друг на друга, например, во время химических реакций.
Результатом поляризации может стать полный разрыв связи. При этом осуществляется переход связывающей электронной пары к одному из атомов и образуются разноименные ионы. Ассиметричный разрыв связи с образованием таких ионов называется гетеролитическим:
Рисунок 1.
Поляризуемость может быть вызвана:
- смещением электронов или атомных ядер под действием электрического поля;
- изменением геометрии молекулы;
- поворотом молекулы;
- смещением иона в соседнюю свободную кристаллографическую позицию (поляризуемость Сканави) и др.
Поляризуемость ионов зависит от электронной структуры иона, его заряда и размера. В каждой подгруппе периодической системы поляризуемость ионов элементов растет с увеличением их порядкового номера.
Поляризующее действие ионов тем значительнее, чем:
- устойчивее электронная оболочка иона;
- больше заряд;
- меньше радиус иона.
Поляризуемость возрастает:
- при увеличении размеров молекулы (атома);
- с возрастанием атомного номера;
- увеличении легкости возбуждения атома.
Например: Октан более поляризуем, чем гексан, так как имеет больше электронов. Но гексадиен тоже будет более поляризуем, чем гексан, что связано с наличием у гексадиена подвижных $pi $-электроны. А $pi $-электроны более чувствительны к изменению электрического поля, чем $sigma $-электроны.
Поляризуемость влияет на:
- кислотность и основность молекул в газовой фазе;
- жесткость кислот и оснований Льюиса;
- скорость нуклеофильного замещения.
Расчет поляризуемости молекул
Поляризация проявляется в возникновении индуцированного дипольного момента $mu_{инд}$; у частиц (в результате смещения электронов и ядер).
Индуцированный дипольный момент является пропорциональным напряженности внешнего электрического поля:
$mu_{инд} = alpha cdot varepsilon_0 cdot Е$,
где $mu_инд$ — индуцированный дипольный момент, Д;
$alpha $ — коэффициент пропорциональности — поляризуемость частицы, $frac{Кл cdot f {м2}}{B}$;
$E$ — напряженность электрического поля, $B$.
Для ионов поляризуемость пропорциональна кубу их радиуса.
В электрическом поле у полярной молекулы с постоянным дипольным моментом появляется еще индуцированный дипольный момент. Тогда учитывается суммарная относительная диэлектрическая проницаемость. Это выражается уравнением Дебая:
$N(frac{alpha + mu2}{3varepsilon_0kT})=3(varepsilon-1)(varepsilon+2)$,
где $N$ — число молекул в единице объема образца;
$alpha $ — поляризуемость молекулы;
$varepsilon_0$ — постоянный дипольный момент молекулы;
$k$ — постоянная Больцмана;
$T$ — абсолютная температура.
Если построить график зависимости правой части этого уравнения от $frac{1}{T}$, то
можно определить $frac{mu2}{3varepsilon_0k}$ и , следовательно, постоянный дипольный момент молекулы. Поляризуемость определяется по отрезку, отсекаемому на оси ординат при $frac{1}{T} = 0$.
При очень высоких температурах диполь вращается так быстро, что его величина обнуляется и остается только индуцированный диполь. Он располагается в направлении индуцирующего его поля и может сохраняться при самых высоких температурах.
Влияние поляризации на свойства веществ
Поляризуемость может объяснить некоторые особенности свойств веществ:
-
Растворимость.
Например: хлорид серебра $AgCl$ растворяется в воде намного хуже, чем хлорид натрия $NaCl$ или хлорид калия $KCl$.
Радиус иона серебра $Ag+$ соизмерим с радиусами ионов натрия $Na+$ и калия $К+$, но поляризуемость иона серебра гораздо больше (он имеет $18$ электронов на внешнем уровне), чем ионов натрия и калия.
Поэтому межъядерное расстояние в хлориде серебра меньше, а энергия разрыва связи больше, чем в молекулах хлоридов натрия и калия.
-
Температура плавления. Взаимная поляризация ионов способствует разрушению кристаллов. При этом понижается температура плавления, и тем больше, чем сильнее деформируется кристаллическая решетка.
Например: В молекулах фторидов рубидия $RbF$ и титана $TiF$ радиусы катионов одинаковы, но ион титана $Ti+$ сильнее поляризуется и поэтому оказывает сильное поляризующее действие на ион фтора $F-$, чем ион рубидия $Rb+$. Температура плавления фторида рубидия составляет $798circ C$, а т. пл. фторида титана $327circ C$.
-
Температура диссоциации. Процессу поляризации будет способствовать повышение температуры. При этом увеличивается амплитуда колебаний ионов, что иногда приводит к перестройке структура вещества.
Наблюдается полиморфное превращение. При нагревании возможен и полный переход электронов от аниона к катиону — происходит термическая диссоциация вещества.
Чем сильнее будет поляризующее действие, тем ниже температура диссоциации.
Например: в ряду соединений данного катиона $MCl — MI$ и данного ниона $NaГ — LiГ$ температура разложения будет понижаться.
Дипольный момент — Химия
Министерство общего и профессионального образования РФ
Московский Государственный Технический Университет
им. Н.Э.Баумана
Доклад
Дипольный момент молекулы и связи
Галямовой Ириной
Проверил Волков А.А.
г.Москва, 2001г.
Представим себе, что можно найти “центры тяжести” отрицательных и положительных частей молекулы. Тогда условно все вещества можно разбить на две группы. Одну группу составляют те, в молекулах которых оба “центра тяжести” совпадают. Такие молекулы называются неполярными.
К ним относятся все ковалентные двухатомные молекулы вида А2, а также молекулы, состоящие из трех и более атомов, имеющие высокосимметричное строение, например СО2, СS2 , СCl4 , С6 H6.
Во вторую группу входят все вещества, у которых “центры тяжести” зарядов в молекуле не совпадают, молекулы которых характеризуются электрической асимметрией. Эти молекулы называют полярными.
К ним относятся молекулы вида АВ, в которых элементы А и В имеют различную электроотрицательность, и многие более сложные молекулы. Систему из двух разноименных электрических зарядов, равных по абсолютной величине, называют диполем.
Величина дипольного момента сильно влияет на свойства полярных молекул и веществ, построенных из таких молекул.
Полярные молекулы поляризуются в электрическом поле, устанавливаясь по силовым линиям поля, ориентируются в электических полях, создаваемых ионами в растворах, взаимодействуют между собой, замыкая свои электрические поля.
Дипольный момент образуется за счет смещения центров положительного и отрицательного зарядов на некоторую величину l, называемую длиной диполя.
Чем более полярны молекулы, чем значительнее смещены валентные электронные пары к одному из атомов, тем больше . И наоборот, если электрическая ассиметрия молекул незначительна, то величина невлика .
Для системы из двух частиц дипольный момент равен: = el.
Где e— величина заряда;l— расстояние между центрами. Однако, определяя сразу величину дипольного момента, мы не знаем ни величины заряда e, локализованного в полярной молекуле, ни расстояния между центрами l.
Принимаем e равным заряду электрона(1,6021*10-19Кл) и тогда получаем приведенную длину диполя l, которая является условной величиной. В качестве единицы измерения дипольных моментов принят дебай(названный в честь голландского физика П.Дебая, разработавшего теорию полярных молекул).в системе СИ 1D=0,33*10-29Кл*м.
Дипольные моменты обычно определяют экспериментально, измеряя относительную диэлектрическую проницаемость веществ при различных температурах. Если вещество поместить в электрическое поле, создаваемое конденсатором, то емкость последнего возрастет в раз, т.е. =c/c0 (где c0 и с- емкость конденсатора в вакууме и в среде вещества).
Энергия электрического поля в конденсаторе U выражается соотношением:
U=1/2cV2,
где V- напряжение на обкладках конденсатора.
Из приведенного уравнения видно, что конденсатор в среде вещества имеет больший запас энергии, чем в вакууме (с>1). Это обусловлено тем, что под действием электрического поля происходит поляризация среды — ориентация диполей и деформация молекул. Первый эффект зависит от температуры, второй — не зависит.
Температурную зависимость относительно диэлектической проницаемости вещества выражает уравнение Ланжевена-Дебая:
’
где М- относительная молекулярная масса вещества; плотность вещества, NA- постоянная Авогадро; k- постоянная Больцмана, равная R/ NA (R- универсальная газовая постоянная); деформационная поляризуемость молекул.
Измерив при двух температурах, с помощью уравнения Ланжевена-Дебая можно определить и Есть и другие методы экспериментального определения
Значения дипольных моментов для некоторых связей между разнородными атомами приведены в таблице:
Не следует путать дипольный момент связи и дипольный момент молекулы, так как в молекуле могут существовать несколько связей, дипольные моменты которых суммируются как векторы.
Кроме того, на величину дипольного момента молекулы могут влиять магнитные поля орбиталей, содержащих электронную пару,- «неподеленные» электроны.
Большое влияние на полярность молекулы оказывает ее симметрия.
Например, молекула метана CH4 обладает высокой степенью симметрии (центрированный тетраэдр), и поэтому векторная сумма дипольных моментов связей (=0,4D) равна нулю:
Sсв=0
Если заменить водородные атомы на атомы хлора и получить молекулу CCl4, у которой дипольный момент связи =2,05D, те в пять раз больший, чем для C-H, то результат останется прежним, так как молекула CCl4 обладает таким же строением.
рис.2. схема строения молекулы СО2
Связь С=О обладает дипольным моментом 2,7D, однако линейная молекула СО2
Является неполярной до тех пор, пока ее структура не исказится под действием других молекул(напр, Н2О).Структура линейной молекулы СО2, в которой атом углерода гибридизирован частично: 2s22p2 2s12p3 2q22p2 ,представлена на рис.2. Дипольные моменты связей, обладая различными знаками, дают общий депольный момент, равный нулю:
Sсв=0.
Таким образом, полярность молекул определяется довольно сложно, так как она учитывает все взаимодействия, которые могут возникнуть в такой сложной структуре, как молекула.
Кроме того, ”полярность” молекулы не определяется лишь величиной дипольного момента, а зависит также от размеров и конфигурации молекул. Например, молекула воды более резко проявляет свои полярные свойства (образование гидратов, растворимость и т.д.
), чем молекула этилового спирта, хотя дипольные моменты у них почти одинаковые (н2о=1,84D; с2н5он=1,70D).
Значения дипольных моментов для некоторых полярных молекул:
Дипольный момент полярной молекулы может изменять свою величину под действием внешних электрических полей, а также под действием электрических полей других полярных молекул, однако при удалении внешних воздействий дипольный момент принимает прежнюю величину.
Некоторые молекулы, неполярные в обычных условиях, могут получать так называемый индуцированный или “наведенный” дипольный момент, тоже исчезающий при снятии поля.
Величина индуцированного момента в первом приближении пропорциональна напряженности электрического поля E: инд=0E, где- коэффициент поляризуемости, []=м3,0электрическая постоянная.
Физико-химические особенности полярных молекул определяются их способностью реагировать на внешние электрические поля (электрическая поляризация) и на поля, созданные другими полярными молекулами. В частности, за счет взаимодействия с полярными молекулами воды такие полярные молекулы, как HF, HCl и др.,могут подвергаться электролитической диссоциации.
Дополнительно используемая литература:
1.Общая и неорганическая химия. Карапетьян, Дракин
2. Теоретические основы общей химии. Горбунов, Гуров, Филиппов
Электрический дипольный момент
Электрическим дипольным моментом или просто дипольным моментом системы зарядов q i называется сумма произведений величин зарядов на их радиус-векторы.
.
Обычно дипольный момент обозначается латинской буквой d или латинской буквой p.
Естественными единицами измерения дипольного заряда в системе СИ является кулон на метр, хотя такая единица чрезвычайно велика для практического использования, поэтому применяются другие единицы. В атомной физике обычно используется единица Дебай.
Дипольный момент имеет чрезвычайное значение в физике при изучении нейтральных систем. Действие электрического поля на нейтральную систему зарядов и электрическое поле создано нейтральной системой определяются в первую очередь дипольным моментом. Это, в частности, касается атомов и молекул.
Нейтральные системы зарядов с отличным от нуля дипольным моментом называют диполями.
1. Свойства
Всего определенный выше дипольный момент зависит от системы отсчета. Однако для нейтральной системы сумма всех зарядов равна нулю, поэтому зависимость от системы отсчета исчезает.
Самый диполь состоит из двух одинаковых по абсолютной величине, но противоположных по направлению зарядов + q и-q, которые находятся на определенном расстоянии r друг от друга. Дипольный момент тогда равна по абсолютной величине qr и направлен от положительного до отрицательного заряда.
В случае непрерывного распределения заряда с плотностью дипольный момент определяется интегрированием
.
2. Энергия диполя во внешнем электрическом поле
При условии, когда размеры системы зарядов гораздо меньше характерной длины, на которой меняется Электро поле, а в целом для атомов и молекул это справедливо даже тогда, когда внешнее электрическое поле — это поле электромагнитной волны в видимом диапазоне, энергия системы зарядов очень простым образом выражается через дипольный момент.
.
3. Момент силы, действующей на диполь в электрическом поле
Электрическое поле пытается ориентировать диполь вдоль силовых линий, создавая момент силы , Равный
.
Эта формула тоже справедлива при условии, когда поле в рамках системы зарядов однородно.
4. Электрическое поле, созданное диполем
Основном возникает задача определения электрического поля на расстоянии, намного превышающей расстояние между зарядами. В таком случае потенциал электрического поля определяется по формуле
,
а его напряженность
,
где — Это радиус-вектор точки, в которой определяется напряженность электрического поля.
Отсюда видно, что создано диполем электрическое поле спадает с расстоянием как 1 / r 3. Сравнению с другими типами полей, создаваемых нейтральными атомами и молекулами это падение очень медленное. Диполи взаимодействуют друг с другом даже на значительном расстоянии. Поле, созданное диполем неизотропне, и даже меняет знак в зависимости от направления.
5. Взаимодействие диполей
Энергия взаимодействия двух диполей и задается формулой
.
В зависимости от взаимной ориентации диполей, а такой от ориентации относительно линии, которая их соединяет, диполи могут как притягиваться, так и отталкиваться.
Осклилькы взаимодействие между диполями приходит довольно медленно, физические системы, состоящие из молекул с отличным от нуля дипольным моментом очень сильно связаны. Такой системой является вода.
Молекула воды имеет довольно значительный дипольный момент, поскольку атом кислорода в ней оттягивает на себя электроны, и становится отрицательно заряженным, оставляя положительный заряд на двух атомах водорода.
Благодаря взаимодействию между диполями вода связана гораздо сильнее, чем другие вещества из сравнительной молярной массой. Вода жидкость при комнатных температурах, в то время, когда гораздо тяжелее кислород или двуокись углерода остаются газами.
Следует отметить, что нейтральные атомы и молекулы, которые не имеют собственного дипольного момента, приобретают дипольный момент в электрическом поле. Такой дипольный момент называется приведенным.
6. Квантовая механика
Оператор диполя в квантовой механике записывается как произведение заряда на радиус-вектор. Для системы многих частиц
в общем не отличается от определения классической механики.
Средний дипольный момент электронов квантовомеханического состояния, описывается волновой функцией ψ равна
,
где интегрирование проводится по координатном пространства всех электронов.
7. Таблица дипольных моментов некоторых молекул
| Молекула | Дипольный момент в Деба | Дипольный момент в 10 -30 ? Кл ? м |
| CO | 0,11 | 0,367 |
| HI | 0,38 | 1,268 |
| HBr | 0,74 | 2,469 |
| H 2 S | 0,92 | 3,069 |
| PF 3 | 1,025 | 3,419 |
| HCl | 1,03 | 3,436 |
| NH 3 | 1,46 | 4,871 |
| H 2 O | 1,844 | 6,152 |
| HF | 1,9 | 6,338 |
| CH 2 O | 2,34 | 7,806 |
| NaCl | 8,5 | 28,356 |
| KF | 8,6 | 28,690 |
| KI | 9,24 | 30,825 |
| KCl | 10,27 | 34,261 |
| KBr | 10,41 | 34,728 |
| CsCl | 10,42 | 34,761 |
См.. также
Магнитный момент
Квадрупольный момент
Мультипольные моменты
From Wikipedia, the free encyclopedia
Polarizability usually refers to the tendency of matter, when subjected to an electric field, to acquire an electric dipole moment in proportion to that applied field. It is a property of all matter, considering that matter is made up of elementary particles which have an electric charge, namely protons and electrons. When subject to an electric field, the negatively charged electrons and positively charged atomic nuclei are subject to opposite forces and undergo charge separation. Polarizability is responsible for a material’s dielectric constant and, at high (optical) frequencies, its refractive index.
The polarizability of an atom or molecule is defined as the ratio of its induced dipole moment to the local electric field; in a crystalline solid, one considers the dipole moment per unit cell.[1] Note that the local electric field seen by a molecule is generally different from the macroscopic electric field that would be measured externally. This discrepancy is taken into account by the Clausius–Mossotti relation (below) which connects the bulk behaviour (polarization density due to an external electric field according to the electric susceptibility 

Magnetic polarizability likewise refers to the tendency for a magnetic dipole moment to appear in proportion to an external magnetic field. Electric and magnetic polarizabilities determine the dynamical response of a bound system (such as a molecule or crystal) to external fields, and provide insight into a molecule’s internal structure.[2] «Polarizability» should not be confused with the intrinsic magnetic or electric dipole moment of an atom, molecule, or bulk substance; these do not depend on the presence of an external field.
Electric polarizability[edit]
Definition[edit]
Electric polarizability is the relative tendency of a charge distribution, like the electron cloud of an atom or molecule, to be distorted from its normal shape by an external electric field.
The polarizability 


Polarizability has the SI units of C·m2·V−1 = A2·s4·kg−1 while its cgs unit is cm3. Usually it is expressed in cgs units as a so-called polarizability volume, sometimes expressed in Å3 = 10−24 cm3. One can convert from SI units (

≃ 8.988×1015 ×
where 


The polarizability of individual particles is related to the average electric susceptibility of the medium by the Clausius–Mossotti relation:
where R = molar refractivity , 


Polarizability for anisotropic or non-spherical media cannot in general be represented as a scalar quantity. Defining 








Tensor[edit]
To describe anisotropic media a polarizability rank two tensor or 

so that:
The elements describing the response parallel to the applied electric field are those along the diagonal. A large value of 



Application in crystallography[edit]
The matrix above can be used with the molar refractivity equation and other data to produce density data for crystallography. Each polarizability measurement along with the refractive index associated with its direction will yield a direction specific density that can be used to develop an accurate three dimensional assessment of molecular stacking in the crystal. This relationship was first observed by Linus Pauling.[1]
Tendencies[edit]
Generally, polarizability increases as the volume occupied by electrons increases.[7] In atoms, this occurs because larger atoms have more loosely held electrons in contrast to smaller atoms with tightly bound electrons.[7][8] On rows of the periodic table, polarizability therefore decreases from left to right.[7] Polarizability increases down on columns of the periodic table.[7] Likewise, larger molecules are generally more polarizable than smaller ones.
Water is a very polar molecule, but alkanes and other hydrophobic molecules are more polarizable. Water with its permanent dipole is less likely to change shape due to an external electric field. Alkanes are the most polarizable molecules.[7] Although alkenes and arenes are expected to have larger polarizability than alkanes because of their higher reactivity compared to alkanes, alkanes are in fact more polarizable.[7] This results because of alkene’s and arene’s more electronegative sp2 carbons to the alkane’s less electronegative sp3 carbons.[7]
Ground state electron configuration models are often inadequate in studying the polarizability of bonds because dramatic changes in molecular structure occur in a reaction.[clarification needed][7]
Magnetic polarizability[edit]
Magnetic polarizability defined by spin interactions of nucleons is an important parameter of deuterons and hadrons. In particular, measurement of tensor polarizabilities of nucleons yields important information about spin-dependent nuclear forces.[9]
The method of spin amplitudes uses quantum mechanics formalism to more easily describe spin dynamics. Vector and tensor polarization of particle/nuclei with spin S ≥ 1 are specified by the unit polarization vector 
See also[edit]
- Dielectric
- Electric susceptibility
- Polarization density
- MOSCED, an estimation method for activity coefficients which uses polarizability as one of its parameters
References[edit]
- ^ a b Lide, David (1998). The CRC Handbook of Chemistry and Physics. The Chemical Rubber Publishing Company. pp. 12–17.
- ^ L. Zhou; F. X. Lee; W. Wilcox; J. Christensen (2002). «Magnetic polarizability of hadrons particles from lattice QCD» (PDF). European Organization for Nuclear Research (CERN). Retrieved 25 May 2010.
- ^ Introduction to Electrodynamics (3rd Edition), D.J. Griffiths, Pearson Education, Dorling Kindersley, 2007, ISBN 81-7758-293-3
- ^ Atkins, Peter; de Paula, Julio (2010). «17». Atkins’ Physical Chemistry. Oxford University Press. pp. 622–629. ISBN 978-0-19-954337-3.
- ^ Electrodynamics of Continuous Media, L.D. Landau and E.M. Lifshitz, Pergamon Press, 1960, pp. 7 and 192.
- ^ C.E. Solivérez, Electrostatics and Magnetostatics of Polarized Ellipsoidal Bodies: The Depolarization Tensor Method, Free Scientific Information, 2016 (2nd edition), ISBN 978-987-28304-0-3, pp. 20, 23, 32, 30, 33, 114 and 133.
- ^ a b c d e f g h Anslyn, Eric; Dougherty, Dennis (2006). Modern Physical Organic Chemistry. University Science. ISBN 978-1-891389-31-3.[1]
- ^ Schwerdtfeger, Peter (2006). «Computational Aspects of Electric Polarizability Calculations: Atoms, Molecules and Clusters». In G. Maroulis (ed.). Atomic Static Dipole Polarizabilities. IOS Press.[2][permanent dead link]
- ^ a b A. J. Silenko (18 Nov 2008). «Manifestation of tensor magnetic polarizability of the deuteron in storage ring experiments». The European Physical Journal Special Topics. Springer Berlin / Heidelberg. 162 (1): 59–62. Bibcode:2008EPJST.162…59S. doi:10.1140/epjst/e2008-00776-9. S2CID 122690288.
Как и для веществ с неполярными молекулами, электронную поляризацию веществ с полярными молекулами можно приравнять к мольной рефракции (Рз = м) и вычислить по уравнению Лорентца — Лоренца (I, 137). [c.56]
Молекулярная рефракция равна электронной поляризации вещества п — 1 [c.131]
Поляризация вещества описывается уравнением [c.130]
Таким образом, молярная поляризация веществ с постоянными диполями складывается из двух членов, один из которых зависит, а другой не зависит от температуры. [c.100]
I — толщина слоя раствора с — концентрация активного (т. е. вращающего плоскость поляризации) вещества. [c.60]
Таким образом, суммарная поляризация вещества Р складывается из ориентационной Р и деформационной Яд поляризаций [c.189]
Оно выражает линейную зависимость поляризации вещества от абсолютной температуры. Если измерить емкость конденсатора с изучаемым веществом (а следовательно, и е) при разных температурах п построить график зависимости Р от 1/Т, то получится прямая. По наклону прямой (В) можно найти дипольный момент (в О) из выражения [c.190]
Дипольный момент молекул тех же веществ можно рассчитать и используя уравнение (1.6), описывающее линейную зависимость общей мольной поляризации вещества от 1/Т. Строят зависимость Р ои = /(1/7 ). Тангенс угла наклона прямой к оси абсцисс равен [c.9]
Поляризация ориентации. Постоянные молекулярные диполи стремятся ориентировать свои вектора (см. рис. 1.31) параллельно вектору напряженности поля. Эта ориентация увеличивает общую поляризацию вещества, так как ведет к сложению дипольных моментов. [c.258]
Величина обусловлена поляризацией вещества и связана с ней соотношением [c.349]
П — поляризация вещества при бесконечном разведении в неполярном растворителе. [c.33]
Поляризация вещества и диэлектрическая постоянная [c.85]
Различают правовращающие и левовращающие вещества, в зависимости от направления производимого вращения. К правовращающим веществам относятся такие, которые вращают плоскость поляризации в направлении часовой стрелки, если смотреть навстречу лучу. Величину вращения плоскости поляризации веществом определяют тем углом, на который нужно повернуть анализатор, чтобы снова получить темноту, наблюдавшуюся до внесения оптически деятельного вещества между николями. Для однородных веществ угол вращения пропорционален длине слоя, через который проходит свет. Он также зависит от температуры, длины волны применяемого света и в случае газов — от давления. Для жидких веществ давление имеет небольшое влияние, и поэтому обычно колебание давления во внимание не принимают. Для оптически деятельного вещества угол вращения зависит также от концентрации его раствора, если растворитель представляется оптически недеятельным. [c.173]
Данные о связи между диэлектрической проницаемостью и поляризацией вещества, определяющей взаимодействие молекул, можно найти в специальной литературе. [c.34]
Макроскопическое поле Е есть векторная сумма Е = Е + E внешнего поля 0 и поля Е обусловленного поляризацией вещества Р во внешнем поле [c.258]
Существует связь между явлением рефракции и поляризацией вещества в электромагнитном поле видимого света. В результате поляризации вещества (молекул, атомов) поток световых частиц—V фотонов отклоняется от заданного направления. Следовательно , преломление луча может зависеть не только от внешних факторов, но и от внутренней структуры вещества. [c.364]
Дипольные моменты низкомолекулярпых веществ. Исследование диэлектрической поляризации вещества позволяет определить величину дипольного момента его молекул, связанную с ди- электрической проницаемостью е уравнением (8) (стр. 273). По величине ди1 ОЛьного момента можно сделать некоторые выводы [c.287]
В итоге, независимо от механизма поляризации вещества — путем деформации молекул или ориентации их постоянных дипольных моментов, — его поляризованность увеличивается пропорционально напряженности поля. [c.648]
Анализ влияния поляризации вещества на напряженность поля внутри вещества удобно проводить с помощью представления о связанных зарядах. В сущности, это альтернативный способ количественного описания поляризации. [c.649]
Полученные результаты также подтверждаются величинами дипольных моментов молекул масел, смол и асфальтенов, выделенных из гудрона Западно-Сибирских нефтей и полученных из них битумов. Все ингредиенты нефтяного остатка и полученных из него битумов имеют дипольный момент, величина которого возрастает при переходе от масел к асфальтенам. Определение дипольных моментов производили двумя методами по концентрационной и температурной зависимости мольной поляризации веществ. [c.788]
Таким образом, наблюдаемый эффект связан, по-видимому, с поляризацией веществ в электрическом поле, перераспределением зарядов, электростатическим, диполь-дипольным взаимодействием материалов и микробных клеток, которые, как известно, обладают в водной среде значительным дипольным моментом [255, 256, 258]. Это взаимодействие в определенной степени обеспечивает удерживание дисперсных частиц различными зернистыми и волокнистыми материалами в электрическом поле. [c.225]
Поляризация вещества определяется молекулярными параметрами дипольным моментом молекулы, ее поляризуемостью и числом молекул в единице объема. А такая важная макроскопическая величина, как диэлектрическая проницаемость (показатель преломления), в свою очередь связана с поляризацией вещества. Таким образом, устанавливается зависимость макроскопических параметров вещества от молекулярных, которую можно описать различными уравнениями, полученными для определенных моделей молекулярного строения вещества. [c.10]
Следует отметить, что угол вращения плоскости поляризации веществом зависит от длины волны проходящего света. Так, например, для кварца (толщина пластинки 1 мм) угол поворота плоскости поля- [c.130]
Поляризация — это явление образования или ориентации электрических моментов молекул вещества в направлении электрического поля вследствие взаимного смещения электрической плотности в молекуле. Поляризация вещества ведет к появлению электрических зарядов. В связи с этим склонность молекул к поляризации имеет важное значение в процессах электриза- ции топлива. Поляризация численно измеряется в м и относится к молю (мольная поляризация) или единице объема (удельная поляризация) вещества. Чем больше величина удельной поляризации, тем легче топливо электризуется. [c.83]
Таким образом, общая поляризация вещества является линейной функцией 1/7″, если вещество имеет полярный характер. Как будет показапо ниже, уравненне (10) ложпт в основе одного из наиболее употребительных методов определения величины дипольного момента. [c.400]
Таким образом, вычитая из поляризации вещества в г азообразнслм или жидком состоянии поляризацию вещества в твердом состоянии, получают величину ориентационной ноляризацни [c.412]
Для определения величины ориентационной поляризации / орнент можно применить еще другой метод. Измерением диэлектричес1 ой проницаомостп находят общую поляризацию вещества / общ, а затем вычисляют сумму Ратомн+ электрон- Вычитанием этой суммы из общей поляризации получают ориентационную поляризацию [c.412]
Поляризуемость зависит от свойств и размеров электронного облака и служит одной из важнейших характеристик электрических свойств молекулы (атома, иона). Из уравнения (1.2) следует, что при =1 а=цинд, т. е. поляризуемость равна дипольному люменту, индуцированному электрическим полем с напряженностью, равной единице. Поляризуемость имеет размерность объема и численно близка к кубу эффективного радиуса г молекулы (атома, иона) Например, анв=0,20-см , ан2 = 0,32> 10- см , асс14 = = 10,14″10-2< см и азпС1<= 13,04 10″ см . Чем труднее смещаются электроны молекулы под действием электрического поля, тем меньше поляризуемость. Все изменения, происходящие в структуре молекулы (атома, иона) под воздействием внешнего электрического поля, называются электрической поляризацией вещества или просто поляризацией. Поляризация, отнесенная к одному молю вещества, называется мольной поляризацией, а к единице массы — удельной поляризацией. Поляризация неполярных молекул практически не зависит от присутствия других молекул в системе и от внешних условий (давление, температура), которые определяют состояние вещества. Поляризация же полярных молекул зависит от этих факторов. Существуют три основных вида поляризации, являющиеся составляющими общей поляризации [c.6]
Величину Р200 находят экстраполяцией на бесконечное разбавление значений поляризации вещества Р2, рассчитанных для растворов вещества разной концентрации по формуле [c.206]
Аналогом электрической поляризации вещества является его намагн1гченность М [c.656]
Полярнметрия основана на измерении оптического вращения плоско-поляризованного света при прохождении света через образец. Оптическим вращением называется изменение плоскости поляризации плоскополяризованного света (вращение плоскости поляризации). Вещества, способные к изменению плоскости поляризации плоскополяризованного света при прохождении света через образец, называются оптически активными. [c.59]
Для оценки поляризации связей, т. е. смещения электронов в направлении связей, вызванного разницей зарядов атомов, Фольберт [92] предложил пользоваться для поляризации веществ величиной [c.30]