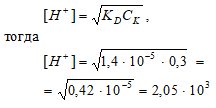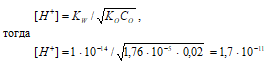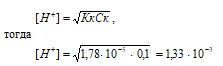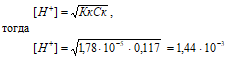Расчет рН растворов сильных и слабых электролитов
Сильные
кислоты и основания
(табл.2.1) в растворах диссоциируют пол-
ностью,
поэтому концентрация ионов водорода и
ионов гидроксила равна
общей
концентрации сильного электролита.
Для
сильных оснований:
[OH—]
= См;
для
сильных
кислот:
[H+]
=
См.
Таблица
2.1
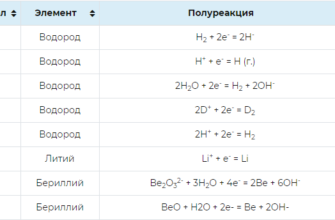
Сильные электролиты
-
Класс
Формулы
электролитовКислота
HNO3,
H2SO4,
HCl, HBr, HI, HMnO4,
HClO4Основание
LiOH ,
KOH, RbOH, CsOH, NaOH, Ba(OH)2,
Ca(OH)2,
Sr(OH)2Соль
Растворимые
соли
Слабым
электролитом
принято считать химические соединения,
молекулы которых даже в сильно разбавленных
растворах не полностью диссоциируют
на ионы. Степень диссоциации слабых
электролитов для децимолярных растворов
(0,1М) меньше 3%. Примеры слабых электролитов:
все органические кислоты, некоторые
неорганические кислоты (например, H2S,
HCN), большинство гидроксидов (например,
Zn(OH)2,
Cu(OH)2).
Для
растворов слабых
кислот
концентрация ионов водорода [H+]
в растворе рассчитывается по формуле:
где:
Кк –
константа диссоциации слабой кислоты;
Ск –
концентрация кислоты, моль/дм3.
Для
растворов слабых
оснований
концентрация гидроксильных ионов
рассчитывается по формуле:
где:
Ко –
константа диссоциации слабого основания;
Сосн. –
концентрация основания, моль/дм3.
Таблица
2.2
Константы диссоциации слабых кислот и оснований при 25 оС
|
Формула |
Константа |
|
СH3COOH |
1,86 |
|
HCN |
7,2 |
|
HOCl |
5,0 |
|
HBO2 |
7,5 |
|
HOBr |
2,5 |
|
HF |
6,2 |
|
HNO2 |
5,1 |
|
HIO |
2,3 |
|
HOCN |
2,7 |
|
NH4OH |
1,79 |
|
AgOH |
5,0 |
2.2.
Примеры решения индивидуального задания
Пример
№1.
Условие
задания: Определить
концентрацию
водородных и гидроксильных ионов в
растворе, если
рН =5,5.
Решение
Концентрация
ионов водорода рассчитывается по
формуле:
[Н+]
= 10-рН
[Н+]
= 10-5,5
=
3,16 •10-6
моль/дм3
Концентрация
гидроксильных ионов рассчитывается по
формуле:
[OН—]
= 10-рOН
рОН
= 14 – рН = 14 – 5,5 = 8,5
[OН—]
= 10 -8,5
=
3 • 10-9
моль/дм3
Пример
№ 2.
Условие
задания: Вычислить
рН 0,001 М раствора HС1.
Решение
Кислота
HС1 является сильным электролитом
(табл.2.1) и в разбавленных растворах
практически полностью диссоциирует на
ионы:
HС1⇄
Н+
+
С1—
Поэтому
концентрация ионов [Н+]
равна общей концентрации кислоты:
[Н+]
= См = 0,001 М.
[Н+]
= 0,001= 1·10-3
моль/дм3
Тогда:
рН
= – lg[H+]
= – lg 1 • 10-3
= 3
Пример
№ 3.
Условие
задания:
Вычислить
рН 0,002 М раствора NaOH.
Решение
Основание
NaOH является сильным электролитом
(табл.2.1) и в разбавленных растворах
практически полностью диссоциирует на
ионы:
NaOH
⇄Na++OH—
Поэтому
концентрация гидроксильных ионов равна
общей концентрации основания: [ОH—]=
См
= 0,002
М.
Тогда:
рОН
= – lg[ОН—]
= – lgСм = – lg 2 •10-3
= 2,7
Исходя
из формулы: рН + рОН = 14, находим рН
раствора:
рН
= 14 – 2,7 = 11,3
Пример
№4.
Условие
задания: Вычислить
рН 0,04 М раствора NH4OH,
если
константа диссоциации Кд(NH4OH)
= 1,79·10-5
(табл.2.2).
Решение
Основание
NH4OH
является слабым электролитом и в
разбавленных растворах очень незначительно
диссоциирует на ионы.
Концентрация
гидроксильных ионов [ОH—]
в растворе слабого основания рассчитывается
по формуле:
моль/дм3
рОН
= – lg[ОH—]
= – lg 8,5·10-2
= 1,1
Исходя
из формулы: рН + рОН = 14, находим рН
раствора:
рН
= 14 – рOН = 14 – 1,1 = 12,9
Пример
№5.
Условие
задания: Вычислить
рН
0,17
М раствора
уксусной
кислоты (CH3COOH),
если константа диссоциации Кд(CH3COOH)
= 1,86 • 10-5
(табл.2.2).
Решение
Кислота
CH3COOH
является слабым электролитом и в
разбавленных растворах очень незначительно
диссоциирует на ионы.
Концентрация
ионов водорода [H+]
в растворе слабой кислоты рассчитывается
по формуле:
Тогда:
моль/дм3
Вычисляем
pH
раствора по формуле: рН = – lg [H+]
pH
= – lg 1,78 • 10-3
=
2,75
2.3.
Индивидуальные задания
Условия
заданий
(табл.
2.3):
Задание
№ 1.
Вычислить концентрацию водородных и
гидроксильных ионов в растворе при
определенном значении рН (см. пример №
1);
Задание
№ 2.
Вычислить рН раствора сильного электролита
(кислоты, основания) при заданной
концентрации (см. пример № 2, 3);
Задание
№ 3.
Вычислить рН раствора слабого электролита
(кислоты, основания) при заданной
концентрации (см. пример № 4, 5).
Таблица
2.3
Состав
исследуемой воды
|
№ задания |
Условия |
||||
|
Задание № 1 |
Задание |
Задание |
|||
|
рН |
Сильный |
Концентрация, |
Слабый электролит |
Концентрация, |
|
|
1 |
6,05 |
НСl |
0,033 |
NH4OH |
0,01 |
|
2 |
8,5 |
HNO3 |
0,091 |
HCN |
0,09 |
|
3 |
5,5 |
HI |
0,032 |
HOCl |
0,05 |
|
4 |
7,7 |
NaOH |
0,054 |
HBO2 |
0,36 |
|
5 |
6,3 |
HBr |
0,076 |
HOBr |
0,22 |
|
6 |
6,5 |
KOH |
0,045 |
HF |
0,63 |
|
7 |
8,9 |
HClO4 |
0,027 |
HNO2 |
0,55 |
|
8 |
8,5 |
HMnO4 |
0,005 |
HOI |
0,03 |
|
9 |
6,5 |
CsOH |
0,008 |
HOCN |
0,19 |
|
10 |
6,1 |
HNO3 |
0,004 |
NH4OH |
0,082 |
|
11 |
6,5 |
HI |
0,001 |
AgOH |
0,04 |
|
12 |
6,9 |
LiOH |
0,009 |
СH3COOH |
0,26 |
|
13 |
8,8 |
HBr |
0,005 |
HCN |
0,075 |
|
14 |
6,9 |
RbOH |
0,036 |
HOCl |
0,07 |
|
15 |
7,3 |
HClO4 |
0,0022 |
HBO2 |
0,15 |
|
16 |
6,3 |
HMnO4 |
0,063 |
HOBr |
0,23 |
|
17 |
7,4 |
KOH |
0,055 |
HF |
0,34 |
|
18 |
6,7 |
HNO3 |
0,003 |
HNO2 |
0,18 |
|
19 |
8,2 |
HI |
0,019 |
HOI |
0,39 |
|
20 |
8,3 |
HNO3 |
0,082 |
HOCN |
0,15 |
|
21 |
6,1 |
CsOH |
0,004 |
NH4OH |
0,33 |
|
22 |
6,9 |
HCl |
0,026 |
AgOH |
0,091 |
|
23 |
8,2 |
HClO4 |
0,075 |
HBO2 |
0,32 |
|
24 |
8,6 |
HMnO4 |
0,007 |
HOBr |
0,054 |
|
25 |
8,5 |
LiOH |
0,015 |
HF |
0,076 |
|
26 |
8,2 |
HNO3 |
0,0023 |
HNO2 |
0,045 |
|
27 |
8,0 |
HI |
0,034 |
HOI |
0,27 |
Продолжение
табл. 2.3
|
28 |
7,9 |
NaOH |
0,018 |
HOCN |
0,35 |
|
29 |
7,9 |
HBr |
0,039 |
NH4OH |
0,08 |
|
30 |
8,1 |
HCl |
0,015 |
AgOH |
0,4 |
|
31 |
6,1 |
HNO3 |
0,003 |
NH4OH |
0,032 |
|
32 |
6,5 |
HI |
0,002 |
AgOH |
0,02 |
|
33 |
6,9 |
LiOH |
0,008 |
СH3COOH |
0,24 |
|
34 |
8,8 |
HBr |
0,003 |
HCN |
0,073 |
|
35 |
6,9 |
RbOH |
0,033 |
HOCl |
0,072 |
|
36 |
7,3 |
HClO4 |
0,0012 |
HBO2 |
0,16 |
|
37 |
6,3 |
HMnO4 |
0,033 |
HOBr |
0,24 |
|
38 |
7,4 |
KOH |
0,045 |
HF |
0,35 |
|
39 |
6,7 |
HNO3 |
0,004 |
HNO2 |
0,28 |
|
40 |
8,2 |
HI |
0,029 |
HOI |
0,29 |
|
41 |
8,3 |
HNO3 |
0,081 |
HOCN |
0,05 |
|
42 |
6,1 |
CsOH |
0,006 |
NH4OH |
0,033 |
|
43 |
6,9 |
HCl |
0,023 |
AgOH |
0,29 |
|
44 |
8,2 |
HClO4 |
0,078 |
HBO2 |
0,62 |
|
45 |
8,6 |
HMnO4 |
0,006 |
HOBr |
0,024 |
|
46 |
8,5 |
LiOH |
0,012 |
HF |
0,036 |
|
47 |
8,2 |
HNO3 |
0,0021 |
HNO2 |
0,025 |
|
48 |
8,0 |
HI |
0,037 |
HOI |
0,027 |
|
49 |
7,9 |
NaOH |
0,013 |
HOCN |
0,015 |
|
50 |
7,9 |
HBr |
0,034 |
NH4OH |
0,08 |
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
10.02.20161.72 Mб14referat_turbaza.docx
- #
- #
- #
- #
- #
- #
Перейти к содержанию
Автор Владислав Панарин На чтение 2 мин Просмотров 19.6к. Опубликовано 26.02.2021 Обновлено 18.07.2022
Вам также может понравиться
Таблица электроотрицательности химических элементов
016.3к.
Константы нестойкости комплексных соединений.
020.2к.
Константы устойчивости комплексных соединений.
128.6к.
Электрохимический ряд напряжений (активности) металлов —
017.5к.
Таблица растворимости — это наглядная таблица со списком
019к.
Длиннопериодная периодическая таблица (система) химических
011.3к.
Короткопериодная периодическая таблица (система) химических
012.7к.
Стандартные окислительно-восстановительные потенциалы
074.7к.
Теоретическое введение
Примеры решения задач
Задачи для самостоятельного решения
Теоретическое введение
Равновесие процесса диссоциации воды:
Н2О ↔ Н+ + ОН—
описывается константой Кw, которая носит название “ионное произведение воды”. Ионное произведение воды равно:
Кw = [Н+] [ОН— ] (1)
Для разбавленных водных растворов ионное произведение воды не зависит от состава раствора и постоянно при данной температуре. Так, Кw=10— 14 для воды, миллимолярных растворов К2SO4, H2SO4 и KOH при Т=298 К. Строго говоря, постоянство Кw справедливо в случае, когда аналитические концентрации ионов заменены их активностями (лишь для малых концентраций Н+ и ОН— значения концентрации и активности практически совпадают).
Процесс диссоциации Н2О идет с поглощением теплоты, поэтому при повышении температуры в интервале от 0 до 100оС величина Кw увеличивается.
Для практических целей удобно пользоваться не концентрацией ионов водорода, а её водородным показателем – отрицательным десятичным логарифмом – рН. Величина рН равна:
рН = — lg[H+]. (2)
Как выше отмечалось, более строгим является уравнение рН = – lg aН+, где aН+ – активность ионов водорода. Однако для практических целей при расчете рН разбавленных растворов обычно используется уравнение (2).
При этом:
рН + рОН = 14, (3)
где рОН = — lg[ОH—].
Для нейтральных растворов рН = 7, для кислых растворов рН < 7, а для щелочных растворов рН > 7. В аналитической практике редко приходится работать с растворами, рН которых выходит из интервала 0 ÷14. Тем не менее, в сильнощелочной среде рН может быть немного больше 14, а в очень кислой среде может принимать отрицательные значения.
Примеры решения задач
Задача 1. Вычислите рН 0,001М растворов HСl и КОН.
Решение. HСl и КОН являются сильными электролитами и в разбавленных растворах практически полностью диссоциируют на ионы. В растворе НСl: [Н+] = 0,001 моль/л.
рН = –lg [H+] = –lg 0,001 = 3
В растворе КОН: [ОН–] = 0,001 моль/л. рОН = –lg [ОH—] = –lg 0,001 = 3. рН=14 – 3 = 11.
Задача 2. Рассчитайте рН раствора КОН, 350 мл которого содержат 0,0035 моль КОН.
Решение.
КОН → К+ + ОН—
См(КОН) = 0,0035:0,35 = 0,01М. см(КОН) = [ОН–].
рОН = –lg [ОH—] = –lg 0,01 = 2.
рОН + рН = 14. рН = 14 – 2 = 12
или [Н+] = 10–14/[ОН–] = 10–14/0,01 = 10–12 моль/л.
рН = –lg 10–12 = 12.
Задача 3. Вычислите молярную концентрацию раствора Ba(OH)2, если рН раствора составляет 12 при 298 К.
Решение.
Ba(OH)2 → Ва2+ + 2ОН–
рОН = 14 – 12 = 2
-lg [ОH–] = 2, откуда [ОH–] = 0,01 М.
Cм(Ba(OH)2) = [ОH—]/2 = 0,01/2 = 0,005М.
Задача 4. Рассчитайте степень диссоциации и рН 0,01 М водного раствора аммиака при 298 К, если константа диссоциации NH4OH при указанной температуре равна 1,76·10–5.
Решение.
NH3 H2O ⇔ NH4+ + OH— или упрощенно: NH4ОH ⇔ NH4+ + OH—
KД = [NH4+]·[OH–]/[NH4OH],
Поскольку [NH4+]=[OH–] и Cм(NH4OH) ≈ [NH4OH], то
KД = [OH–]2/Cм(NH4OH)
[OH–] = √(KД·Cм(NH4OH)) = 4,2·10-4 моль/л.
[Н+] = 10-14/[ОН—] = 10-14/4,2·10-4 = 2,4·10-11 моль/л.
рН = –lg [H+] = –lg 2,4·10–11 = 10,6.
или 4,2 %.
Задача 5. К 1 л 0,01М раствора CH3CОOH добавили 6 г СН3СООNa. Определите рН полученного раствора при Т = 298 К, если при указанной температуре Кд(CH3CОOH) = 1,75·10–5.
Решение.
Присутствие в растворе CH3CОOH сильного электролита СН3СООNa приводит к сдвигу равновесия диссоциации уксусной кислоты влево в силу действия принципа Ле Шателье. В результате степень диссоциации уксусной кислоты уменьшается.
n(СН3СООNa) = 6:82 = 0,073 моль.
См(СН3СООNa) = 0,073/1 = 0,073 М
(считаем, что объем раствора после добавления 6 г СН3СООNa не изменился).
Ацетат–ионы в растворе образуются как за счет диссоциации уксусной кислоты:
CH3CОOH ⇔ СН3СОО– + Н+,
так и за счет диссоциации СН3СООNa:
СН3СООNa → СН3СОО— + Na+
Поскольку СН3СООNa в растворе диссоциирует полностью, то концентрацией ацетат-ионов, образующихся при диссоциации уксусной кислоты можно пренебречь, так как она мала по сравнению с величиной 0,073 моль/л. Принимаем, что:
См(CH3CОONa) = [CH3CОO—];
[CH3CОOH] = См(CH3CОOН).
Cледовательно,
[H+] = Кд · См(CH3CОOН) / [CH3CОO—]
[H+] = 1,75·10–5 · 0,01 / 0,073 = 2,4·10–6 моль/л.
рН = –lg2,4·10–6 = 5,6.
Задачи для самостоятельного решения
1. Определите величину рН 0,0001 М раствора HCl.
2. Определите рН 0,01 М раствора KOH.
3. рН раствора гидроксида бария равен 11. Определите концентрацию этого раствора.
4. Степень диссоциации в 0,01 М растворе муравьиной кислоты при некоторой температуре составляет 10 %. Определите рН этого раствора.
5. Рассчитайте рН 1 М раствора азотной кислоты. Степень диссоциации кислоты примите равной 100 %.
6. Определите, сколько граммов Ba(OH)2 необходимо растворить в 5 л воды, чтобы рН раствора стал равен 10.
7. Определите рН раствора H2SO4, титр которого равен 0,005 г/см3. Степень диссоциации серной кислоты примите равной 100 % по двум ступеням.
14.8. Степень диссоциации муравьиной кислоты в 0,34 М растворе составляет 2,3 %. Определите константу диссоциации HCOOH и рН этого раствора.
9. Вычислите рН 0,01М раствора NH4OH, содержащего в 1 л 0,02 моль NH4Cl при 298 К, если при указанной температуре Кд(NH4OH) = 1,76·10–5.
10. Как изменится рН, если к 0,2М раствору циановодородной (синильной) кислоты добавить 5 мл 1 мас.% раствора KCN, плотность которого равна 1,01 г/см3? Константа диссоциации HCN при 298 К составляет 4,9·10–10.
Загрузить PDF
Загрузить PDF
В быту под pH подразумевают обычно шкалу, используемую для описания нейтральности или, наоборот, недостатка нейтральности того или иного вещества. В научном значении величина pH соответствует количеству ионов в химическом растворе. Если вы изучаете химию или связанные с ней предметы, вам может понадобиться рассчитать уровень pH, основываясь на концентрации веществ в растворе. Значение pH находится по следующей формуле: pH = -lg[H3O+].
-
1
Ознакомьтесь с понятием pH. Величина pH соответствует концентрации ионов водорода в растворе. Раствор с повышенной концентрацией ионов водорода называется кислотным, а раствор с пониженной концентрацией этих ионов – щелочным.[1]
Ионы водорода кратко обозначают как H+. Их можно представлять и в составе соединения, тогда они называются гидроксонием и записываются как H30+.- Ознакомьтесь со шкалой pH. Значения на шкале pH изменяются от 1 до 14. Чем меньше число, тем более кислотным является данный раствор. И наоборот, чем выше значение, тем более щелочным является раствор.[2]
Например, pH апельсинового сока составляет 2, поскольку этот сок представляет собой довольно кислотную жидкость. У хлорного отбеливателя pH равно 12, так как в нем много щелочи.[3]
В середине шкалы располагаются относительно нейтральные растворы, такие как вода, pH которой составляет 7. - Разница между двумя растворами на 1 пункт по шкале pH означает, что они различаются по кислотности в 10 раз. Например, если взять два раствора со значениями pH 6 и 7, кислотность первого раствора с pH 6 будет выше кислотности второго раствора с pH 7 в 10 раз. А, например, кислотность раствора с pH 6 выше кислотности раствора с pH 8 в 100 раз.[4]
- Ознакомьтесь со шкалой pH. Значения на шкале pH изменяются от 1 до 14. Чем меньше число, тем более кислотным является данный раствор. И наоборот, чем выше значение, тем более щелочным является раствор.[2]
-
2
Запомните уравнение для определения pH. Шкала pH вычисляется с помощью отрицательного десятичного логарифма. Отрицательный десятичный логарифм соответствует числу нулей, стоящих перед единицей, включая и ноль целых: например, отрицательный десятичный логарифм числа 0,1 равен 1, числа 0,01 — 2, и так далее.[5]
Формула для нахождения pH выглядит следующим образом: pH = -lg[H3O+].- Иногда формулу записывают в виде pH = -lg[H+]. Неважно, стоит ли в уравнении H3O+ или H+, обе формы записи равноценны.
- Для нахождения pH необязательно уметь рассчитывать десятичный логарифм, так как практически в каждом научном или инженерном калькуляторе есть опция его вычисления.
-
3
Ознакомьтесь с понятием концентрации. Концентрация какого-либо вещества соответствует числу частиц этого вещества, присутствующих в растворе.[6]
Как правило, концентрация выражается в количестве молей на единицу объема и обозначается как m/V, или M. В химических лабораториях концентрации растворов пишут на бутылках с ними. Если вы решаете химическую задачу, концентрация может быть дана в условии, либо ее требуется найти.Реклама
-
1
Вспомните формулу для нахождения pH. Вот эта формула: pH = -lg[H3O+].[7]
Убедитесь в том, что вы знакомы со всеми элементами, входящими в данную формулу. Посмотрите, какая величина соответствует концентрации.- В химии квадратные скобки означают концентрацию чего-либо. Так что формула для расчета pH читается как «pH равно отрицательному логарифму концентрации гидроксоний-ионов».
-
2
Определите действительную концентрацию. Внимательно прочитайте условие задачи. Найдите в исходных данных концентрацию кислоты или щелочи. Запишите полную формулу на листке бумаги, подставив в нее известные величины.[8]
Чтобы не возникло путаницы, рядом с числами всегда указывайте единицы измерения.- Например, если концентрация составляет 1,05 x 105 M, запишите формулу для расчета pH в следующем виде: pH = -lg[1,05 x 105 M]
-
3
Вычислите pH. Для этого удобно использовать научный калькулятор. Сначала введите знак минуса, нажав кнопку «+/-». Затем нажмите кнопку «log», соответствующую десятичному логарифму (в английском языке десятичный логарифм обозначается как log). На экране отобразится «-log».[9]
Затем нажмите левую скобку и введите концентрацию. При необходимости не забудьте указать значение степени.[10]
После этого закройте скобки.[11]
В результате на экране калькулятора вы увидите «-log(1,05×105). Нажмите «=». У вас должно получиться значение pH, приблизительно равное 4,98.Реклама
-
1
Определите, что дано и что требуется найти. Запишите формулу для вычисления pH. После этого выясните известные величины, выписав их значения под формулой. Например, если известно, что pH равно 10,1, запишите это число под pH в формуле.
-
2
Преобразуйте формулу. При этом вам понадобятся знания из школьного курса алгебры. Для вычисления концентрации по известному значению pH необходимо преобразовать формулу так, чтобы концентрация обособленно стояла с какой-либо из двух сторон уравнения. То есть необходимо, чтобы по одну сторону знака равенства было выражение, содержащее величину pH, а по другую — концентрация гидроксония. Сначала умножьте обе части уравнения на -1. Затем возведите 10 в степени, стоящие по обе стороны получившегося равенства.
- Преобразовывая равенство pH = -log[H3O+], получаем формулу +[H3O+] = 10-pH, то есть концентрация ионов равна десяти в степени -pH. Теперь вместо pH подставляем известное значение, в нашем случае 10,1.
-
3
Решите уравнение. Для возведения десяти в степень в калькуляторе предусмотрена определенная процедура. Сначала наберите 10. Затем нажмите клавишу возведения в степень «EXP». Введите знак минуса и значение степени. Нажмите «=».
- В нашем примере pH равно 10,1. Наберите «10» и нажмите клавишу «EXP». После этого нажмите «-/+», меняя знак. И наконец, введите значение pH «10,1» и нажмите клавишу «=». В результате у вас должно получиться 1e-100. Это означает, что концентрация составляет 1,00 x 10-100 M.
-
4
Обдумайте полученный ответ. Имеет ли он физический смысл? Если pH равно 10,1, это значит, что концентрация гидроксония чрезвычайно мала, и у вас щелочной раствор.[12]
Таким образом, найденная очень низкая концентрация соответствуетРеклама
Советы
- Если вычисление уровня pH поначалу кажется вам трудным, не забывайте, что существует множество источников, позволяющих больше узнать об этом вопросе. Воспользуйтесь учебником химии или попросите преподавателя помочь вам.
Реклама
Об этой статье
Эту страницу просматривали 130 279 раз.
Была ли эта статья полезной?
Как правильно рассчитать рН растворов сильных и слабых электролитов
Задача 40.
Вычислите рН 0,025 М раствора КОН.
Решение:
КОН – сильный электролит, который диссциирует по схеме: КОН = К+ + ОН–;
[ОН–] = СМ(КОН) = 0,025 моль/дм3;
рОН = – lg[OH–] = – lg2,5 · 10–2 = 2 – lg2,5 = 2 — 0,6 = 1,4;
pOH + pH = 14;
pH = 14 – pOH = 14 – 1,4 = 12,6.
Ответ: рН = 12,6.
Задача 41.
Вычислите концентрацию ионов [H+] и рН 0,3 М раствора пропионовой кислоты С2Н5СООН, если КD = 1,4 · 10–5.
Решение:
С2Н5СООН – слабая кислота. Для слабых кислот [H+] вычисляется по формуле:
рН = –lg[H+] = –lg2,05 · 10–3 = 3 – lg2,605 = 2,7.
Ответ: [H+] = 2,05 · 10–3 моль/л; рН = 2,7.
Задача 42.
Вычислите рН 0,02 М раствора аммиака, если КD = 1,76·10–5.
Решение:
В водном растворе аммиака имеет место равновесие:
NH3 + H2O ⇔ NН4+ + OH–.
Поскольку КО < 1 · 10–2, полагаем, что равновесная концентрация недиссоциированного основания равна его общей концентрации: CО(NH4OH) = 0,02 моль/дм3. Для слабых оснований [H+] вычисляют по формуле:
рН = –lg[H+] = –lg1,7 · 10–11 = 11 – lg1,7 = 10,77.
Ответ: [H+] = 1,7 · 10–11 моль/дм3; рН = 10,77.
Задача 43.
К 80 см3 0,2 Н. раствора СН3СООН прибавили 20 см3 0,2 н. раствора СН3СООNa. Рассчитайте рН полученного раствора, если Кк = 1,78 · 10–5.
Решение:
Объём раствора, полученного после сливания исходных растворов, равен 80 + 20 = 100 см3.
Рассчитаем нормальность веществ в полученном растворе смеси, получим:
Сн(СН3СООН) = [Сн(СН3СООН) . V(СН3СООН)]/V(p-pa) = (0,2 . 80)/100 = 0,16 моль/дм3;
Сн(СН3СООNa) = [Сн(СН3СООNa) . V(СН3СООNa)]/V(p-pa) = (0,2 . 20)/100 = 0,04 моль/дм3.
Для буферных растворов, образованных слабой кислотой и солью этой кислоты, [Н+] находят по формуле:
[H+] = Кк . (Ск/Cc);
Тогда
[H+] = 1,78 · 10–5 . (0,16/0,04) = 7,12 · 10–5 моль/дм3.
рН = –lg[H+]; pH = –lg7,12 · 10–5 = 5 – lg7,12 = 4,15.
Ответ: [H+] = 7,12 · 10–5 моль/дм3; рН = 4,15.
Задача 44.
Вычислите и сравните рН растворов: а) 0,1 М HCl и 0,1 М CH3COOH; б) растворов, содержащих 7 г/дм3 HCl и 7 г/дм3 CH3COOH.
Решение:
а) Расчет рН растворов: 0,1 М HCl, 0,1 М CH3COOH
1. рассчитаем рН раствора 0,1 М HCl
HCl — сильная кислота, которая диссциирует полностью, поэтому [H+] = СМ(HCl) = 0,1 моль/дм3.
Тогда
рН = –lg[H+]; pH = –lg1 · 10–1 = 1 – lg1 = 1.
2. рассчитаем рН раствора 0,1 М CH3COOH
CH3COOH (Кк = 1,78 · 10–5) – слабая кислота. Для слабых кислот [H+] вычисляется по формуле:
рН = –lg[H+] = –lg1,33 · 10–3 = 3 – lg1,33 = 2,88.
б) Расчет рН растворов, содержащих 7 г/дм3 HCl и 7 г/дм3 CH3COOH
1. Рассчитаем рН раствора HCl
Определим концентрацию HCl, получим:
СМ(HCl) = m(HCl)/M(HCl) = 7/36,5 = 0,19 = 1,9 · 10–1
Так как HCl сильный электролит, то [H+] = См(HCl) = 0,19 = 1,9 · 10–1 моль/дм3.
рН = –lg[H+]; pH = –lg1,9 · 10–1 = 1 – lg1,9 = 0,72.
2. Рассчитаем рН раствора CH3COOH
Определим концентрацию CH3COOH, получим:
СМ(CH3COOH) = m(CH3COOH)/M(CH3COOH) = 7/60 = 0,117.
CH3COOH – слабая кислота. Для слабых кислот [H+] вычисляется по формуле:
рН = –lg[H+]; pH = –lg1,44 · 10–3 = 3 – lg1,44 = 2,85.
Ответ: а) 1 и 2,88; б) 0,72 и 2,85.