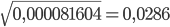Дано: С (NH₄OH) = 0,1M
Найти: pH; pOH
Решение:
Гидроксид аммония — слабое основание, диссоциирует не полностью.
[ОН⁻] = √ (Kд*См), где Кд — константа диссоциации, См — молярная концентрация
Табличное значение константы диссоциации Кд = 1,79*10⁻⁵
[OH⁻] = √ (1,79*10⁻⁵*0,1) = √ (1,79*10⁻⁶) ≈ 1,338 10⁻³ = 0,001338
рОН = — lg[OH⁻] = — lg0,001338 ≈ — (-2,9) = 2,9
pH = 14 — pOH = 14 — 2,9 = 11,1
Ответ: рН = 11,1; рОН = 2,9
Расчет рН растворов сильных и слабых электролитов
Сильные
кислоты и основания
(табл.2.1) в растворах диссоциируют пол-
ностью,
поэтому концентрация ионов водорода и
ионов гидроксила равна
общей
концентрации сильного электролита.
Для
сильных оснований:
[OH—]
= См;
для
сильных
кислот:
[H+]
=
См.
Таблица
2.1
Сильные электролиты
-
Класс
Формулы
электролитовКислота
HNO3,
H2SO4,
HCl, HBr, HI, HMnO4,
HClO4Основание
LiOH ,
KOH, RbOH, CsOH, NaOH, Ba(OH)2,
Ca(OH)2,
Sr(OH)2Соль
Растворимые
соли
Слабым
электролитом
принято считать химические соединения,
молекулы которых даже в сильно разбавленных
растворах не полностью диссоциируют
на ионы. Степень диссоциации слабых
электролитов для децимолярных растворов
(0,1М) меньше 3%. Примеры слабых электролитов:
все органические кислоты, некоторые
неорганические кислоты (например, H2S,
HCN), большинство гидроксидов (например,
Zn(OH)2,
Cu(OH)2).
Для
растворов слабых
кислот
концентрация ионов водорода [H+]
в растворе рассчитывается по формуле:
где:
Кк –
константа диссоциации слабой кислоты;
Ск –
концентрация кислоты, моль/дм3.
Для
растворов слабых
оснований
концентрация гидроксильных ионов
рассчитывается по формуле:
где:
Ко –
константа диссоциации слабого основания;
Сосн. –
концентрация основания, моль/дм3.
Таблица
2.2
Константы диссоциации слабых кислот и оснований при 25 оС
|
Формула |
Константа |
|
СH3COOH |
1,86 |
|
HCN |
7,2 |
|
HOCl |
5,0 |
|
HBO2 |
7,5 |
|
HOBr |
2,5 |
|
HF |
6,2 |
|
HNO2 |
5,1 |
|
HIO |
2,3 |
|
HOCN |
2,7 |
|
NH4OH |
1,79 |
|
AgOH |
5,0 |
2.2.
Примеры решения индивидуального задания
Пример
№1.
Условие
задания: Определить
концентрацию
водородных и гидроксильных ионов в
растворе, если
рН =5,5.
Решение
Концентрация
ионов водорода рассчитывается по
формуле:
[Н+]
= 10-рН
[Н+]
= 10-5,5
=
3,16 •10-6
моль/дм3
Концентрация
гидроксильных ионов рассчитывается по
формуле:
[OН—]
= 10-рOН
рОН
= 14 – рН = 14 – 5,5 = 8,5
[OН—]
= 10 -8,5
=
3 • 10-9
моль/дм3
Пример
№ 2.
Условие
задания: Вычислить
рН 0,001 М раствора HС1.
Решение
Кислота
HС1 является сильным электролитом
(табл.2.1) и в разбавленных растворах
практически полностью диссоциирует на
ионы:
HС1⇄
Н+
+
С1—
Поэтому
концентрация ионов [Н+]
равна общей концентрации кислоты:
[Н+]
= См = 0,001 М.
[Н+]
= 0,001= 1·10-3
моль/дм3
Тогда:
рН
= – lg[H+]
= – lg 1 • 10-3
= 3
Пример
№ 3.
Условие
задания:
Вычислить
рН 0,002 М раствора NaOH.
Решение
Основание
NaOH является сильным электролитом
(табл.2.1) и в разбавленных растворах
практически полностью диссоциирует на
ионы:
NaOH
⇄Na++OH—
Поэтому
концентрация гидроксильных ионов равна
общей концентрации основания: [ОH—]=
См
= 0,002
М.
Тогда:
рОН
= – lg[ОН—]
= – lgСм = – lg 2 •10-3
= 2,7
Исходя
из формулы: рН + рОН = 14, находим рН
раствора:
рН
= 14 – 2,7 = 11,3
Пример
№4.
Условие
задания: Вычислить
рН 0,04 М раствора NH4OH,
если
константа диссоциации Кд(NH4OH)
= 1,79·10-5
(табл.2.2).
Решение
Основание
NH4OH
является слабым электролитом и в
разбавленных растворах очень незначительно
диссоциирует на ионы.
Концентрация
гидроксильных ионов [ОH—]
в растворе слабого основания рассчитывается
по формуле:
моль/дм3
рОН
= – lg[ОH—]
= – lg 8,5·10-2
= 1,1
Исходя
из формулы: рН + рОН = 14, находим рН
раствора:
рН
= 14 – рOН = 14 – 1,1 = 12,9
Пример
№5.
Условие
задания: Вычислить
рН
0,17
М раствора
уксусной
кислоты (CH3COOH),
если константа диссоциации Кд(CH3COOH)
= 1,86 • 10-5
(табл.2.2).
Решение
Кислота
CH3COOH
является слабым электролитом и в
разбавленных растворах очень незначительно
диссоциирует на ионы.
Концентрация
ионов водорода [H+]
в растворе слабой кислоты рассчитывается
по формуле:
Тогда:
моль/дм3
Вычисляем
pH
раствора по формуле: рН = – lg [H+]
pH
= – lg 1,78 • 10-3
=
2,75
2.3.
Индивидуальные задания
Условия
заданий
(табл.
2.3):
Задание
№ 1.
Вычислить концентрацию водородных и
гидроксильных ионов в растворе при
определенном значении рН (см. пример №
1);
Задание
№ 2.
Вычислить рН раствора сильного электролита
(кислоты, основания) при заданной
концентрации (см. пример № 2, 3);
Задание
№ 3.
Вычислить рН раствора слабого электролита
(кислоты, основания) при заданной
концентрации (см. пример № 4, 5).
Таблица
2.3
Состав
исследуемой воды
|
№ задания |
Условия |
||||
|
Задание № 1 |
Задание |
Задание |
|||
|
рН |
Сильный |
Концентрация, |
Слабый электролит |
Концентрация, |
|
|
1 |
6,05 |
НСl |
0,033 |
NH4OH |
0,01 |
|
2 |
8,5 |
HNO3 |
0,091 |
HCN |
0,09 |
|
3 |
5,5 |
HI |
0,032 |
HOCl |
0,05 |
|
4 |
7,7 |
NaOH |
0,054 |
HBO2 |
0,36 |
|
5 |
6,3 |
HBr |
0,076 |
HOBr |
0,22 |
|
6 |
6,5 |
KOH |
0,045 |
HF |
0,63 |
|
7 |
8,9 |
HClO4 |
0,027 |
HNO2 |
0,55 |
|
8 |
8,5 |
HMnO4 |
0,005 |
HOI |
0,03 |
|
9 |
6,5 |
CsOH |
0,008 |
HOCN |
0,19 |
|
10 |
6,1 |
HNO3 |
0,004 |
NH4OH |
0,082 |
|
11 |
6,5 |
HI |
0,001 |
AgOH |
0,04 |
|
12 |
6,9 |
LiOH |
0,009 |
СH3COOH |
0,26 |
|
13 |
8,8 |
HBr |
0,005 |
HCN |
0,075 |
|
14 |
6,9 |
RbOH |
0,036 |
HOCl |
0,07 |
|
15 |
7,3 |
HClO4 |
0,0022 |
HBO2 |
0,15 |
|
16 |
6,3 |
HMnO4 |
0,063 |
HOBr |
0,23 |
|
17 |
7,4 |
KOH |
0,055 |
HF |
0,34 |
|
18 |
6,7 |
HNO3 |
0,003 |
HNO2 |
0,18 |
|
19 |
8,2 |
HI |
0,019 |
HOI |
0,39 |
|
20 |
8,3 |
HNO3 |
0,082 |
HOCN |
0,15 |
|
21 |
6,1 |
CsOH |
0,004 |
NH4OH |
0,33 |
|
22 |
6,9 |
HCl |
0,026 |
AgOH |
0,091 |
|
23 |
8,2 |
HClO4 |
0,075 |
HBO2 |
0,32 |
|
24 |
8,6 |
HMnO4 |
0,007 |
HOBr |
0,054 |
|
25 |
8,5 |
LiOH |
0,015 |
HF |
0,076 |
|
26 |
8,2 |
HNO3 |
0,0023 |
HNO2 |
0,045 |
|
27 |
8,0 |
HI |
0,034 |
HOI |
0,27 |
Продолжение
табл. 2.3
|
28 |
7,9 |
NaOH |
0,018 |
HOCN |
0,35 |
|
29 |
7,9 |
HBr |
0,039 |
NH4OH |
0,08 |
|
30 |
8,1 |
HCl |
0,015 |
AgOH |
0,4 |
|
31 |
6,1 |
HNO3 |
0,003 |
NH4OH |
0,032 |
|
32 |
6,5 |
HI |
0,002 |
AgOH |
0,02 |
|
33 |
6,9 |
LiOH |
0,008 |
СH3COOH |
0,24 |
|
34 |
8,8 |
HBr |
0,003 |
HCN |
0,073 |
|
35 |
6,9 |
RbOH |
0,033 |
HOCl |
0,072 |
|
36 |
7,3 |
HClO4 |
0,0012 |
HBO2 |
0,16 |
|
37 |
6,3 |
HMnO4 |
0,033 |
HOBr |
0,24 |
|
38 |
7,4 |
KOH |
0,045 |
HF |
0,35 |
|
39 |
6,7 |
HNO3 |
0,004 |
HNO2 |
0,28 |
|
40 |
8,2 |
HI |
0,029 |
HOI |
0,29 |
|
41 |
8,3 |
HNO3 |
0,081 |
HOCN |
0,05 |
|
42 |
6,1 |
CsOH |
0,006 |
NH4OH |
0,033 |
|
43 |
6,9 |
HCl |
0,023 |
AgOH |
0,29 |
|
44 |
8,2 |
HClO4 |
0,078 |
HBO2 |
0,62 |
|
45 |
8,6 |
HMnO4 |
0,006 |
HOBr |
0,024 |
|
46 |
8,5 |
LiOH |
0,012 |
HF |
0,036 |
|
47 |
8,2 |
HNO3 |
0,0021 |
HNO2 |
0,025 |
|
48 |
8,0 |
HI |
0,037 |
HOI |
0,027 |
|
49 |
7,9 |
NaOH |
0,013 |
HOCN |
0,015 |
|
50 |
7,9 |
HBr |
0,034 |
NH4OH |
0,08 |
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
10.02.20161.72 Mб14referat_turbaza.docx
- #
- #
- #
- #
- #
- #

andzuzin2011
+10
Решено
6 лет назад
Химия
10 — 11 классы
вычислить pH и pOH 0,1 M раствора гидроксида аммония NH4OH, Кд = 1,8*10^-5
Смотреть ответ
1
Ответ
4
(6 оценок)
3
gavrilka
6 лет назад
Светило науки — 481 ответ — 1524 помощи
NH4OH <-> NH4(+) + OH(-)
Кд=[NH4(+)]*[OH(-)]/[NH4OH]
[NH4(+)]=[NH4OH]=0,1 M
[OH(-)]=Кд*[NH4OH]/[NH4(+)]= 1,8*10^-5
pOH = -lg[OH(-)] = -lg(1,8*10^-5) = 4,74
pH = 14 — pOH = 14 — 4,74 = 9,26
(6 оценок)
https://vashotvet.com/task/4498628
Рекомендуемые сообщения
Решение задач по фото за 30 минут! Мы онлайн – кликай!
-
- Поделиться
Помогите решить.
Вычислить величину pH 0,1 н. раствора гидроксида аммония, в котором степень диссоциации NH4OH равна 1,5%
Я решал так:
α=1,5%=0,015=1,5*10-2
Концентрация ионов водорода [H+]=0,1*4*1,5*10-2=0.006
Найдем pH=-lg[H+].], следовательно pH=-lg0.006=2.22
Это правильно, если неправильно, то где ошибка?
Изменено 21 Октября, 2012 в 09:49 пользователем Stalker_Snake
Ссылка на комментарий
—>
- Автор
-
- Поделиться
Помогите решить.
Вычислить величину pH 0,1 н. раствора гидроксида аммония, в котором степень диссоциации NH4OH равна 1,5%
Я решал так:
α=1,5%=0,015=1,5*10-2
Концентрация ионов водорода [H+]=0,1*4*1,5*10-2=0.006
Найдем pH=-lg[H+].], следовательно pH=-lg0.006=2.22
Это правильно, если неправильно, то где ошибка?
Ссылка на комментарий
-
- Поделиться
вроде все верно, но у тебя получается кислая среда, это не правильно
рН — десятичный логарифм концентрации ионов Н(+) в растворе с обратным знаком
рОН- десятичный логарифм концентрации ионов ОН(-) в растворе с обратным знаком
Если не дано никаких дополнительных условий, будем считать, что гидроксид диссоциирует полностью:
NH4OH= NH4(+)+ OH(-)
конц ОН(-)=с(NH4OH)=0,1 моль/л, рОН=-lg0,1=1
рН=14-1=13
но это без учета степени диссоциации
Ссылка на комментарий
-
- Поделиться
На будущее — сразу — с подобными вопросами — в самый первый раздел ПОМОЩЬ.
Теперь к сути: то, что перед вами формула гидроксида аммония — ни на какие мысли это не наводит? Формально эта молекула диссоциирует с образованием гидроксид-иона, одного. Вот теперь, безо всякой четверки, считаете концентрацию этих самых гидроксидов, находите показатель от этой концентрации. Затем, исходя из ионного произведения воды (рН + рОН = 14), «плавно» переходите к рН.
Ссылка на комментарий
- Автор
-
- Поделиться
вроде все верно, но у тебя получается кислая среда, это не правильно
рН — десятичный логарифм концентрации ионов Н(+) в растворе с обратным знаком
рОН- десятичный логарифм концентрации ионов ОН(-) в растворе с обратным знаком
Если не дано никаких дополнительных условий, будем считать, что гидроксид диссоциирует полностью:
NH4OH= NH4(+)+ OH(-)
конц ОН(-)=с(NH4OH)=0,1 моль/л, рОН=-lg0,1=1
рН=14-1=13
но это без учета степени диссоциации
Спасибо, разобрался
Ссылка на комментарий
- Автор
-
- Поделиться
На будущее — сразу — с подобными вопросами — в самый первый раздел ПОМОЩЬ.
Теперь к сути: то, что перед вами формула гидроксида аммония — ни на какие мысли это не наводит? Формально эта молекула диссоциирует с образованием гидроксид-иона, одного. Вот теперь, безо всякой четверки, считаете концентрацию этих самых гидроксидов, находите показатель от этой концентрации. Затем, исходя из ионного произведения воды (рН + рОН = 14), «плавно» переходите к рН.
Понятно, спасибо. Да, я и в помощь написал, спасибо, учту.
Ссылка на комментарий
- Автор
-
- Поделиться
α=1,5%=0,015=1,5*10-2
Концентрация ионов водорода [OH+]=0,1*1*1,5*10-2=0.0015
Найдем pОH=-lg[OH+], следовательно pH=-lg0.0015=2.8
pH=14-pOH=14-2,8=11,2
ответ:11,2
Верно.
Ссылка на комментарий
Для публикации сообщений создайте учётную запись или авторизуйтесь
Вы должны быть пользователем, чтобы оставить комментарий
Войти
Уже есть аккаунт? Войти в систему.
Войти
Как правильно рассчитать рН растворов оснований и кислот
Расчёт рН раствора аммония гидроксида
Задача 139.
Рассчитайте рН 10% раствора аммония гидроксида (ρ = 0,958 г/мл).
Решение:
рК(NH4OH )= 4,76;
М(NH4OH) = 35,04 г/моль;
w% = 10% = 0,1;
pH = ?
1. Находим массу раствора, получим:
m(p-pa) = ρV = 0,958 г/мл • 1000 мл = 958 г.
2. Расчет массы NH4OH в растворе, получим:
w% = m(B)•100%/m(p-pa), где
m(B) — масса растворенного вещества; m(p-pa) — масса раствора.
m(B) = w%/m(p-pa)/100%;
m(NH4OH) = 10% * 958/100% = 95,8 г.
3. Рассчитаем концентрацию раствора аммония гидроксида, получим:
СМ(NH4OH) = m(NH4OH)/M(NH4OH) = 95,8 г/35,04 г/моль = 2,734 моль.
4. рН раствора аммония гидроксида проводим по формуле:
рН = 14 – 1/2(4,76- lg2,734) = 11,84.
Ответ: рН = 11,84.
Расчёт рН раствора серной кислоты
Задача 140.
Рассчитайте рН раствора серной кислоты с концентрацией 0,01 моль/л, если константы диссоциации ее по второй ступени Ка2 =1,02•10-2 моль/л.
Решение:
Уравнения ступеньчатой диссоциации кислоты:
H2SO4 = H(+) + HSO4(-);
HSO4(-) = H(+) + SO4(2-); Ка2 = 1,02•10-2.
Допустим, что на первой ступени кислота с концентрацией с моль/л образует с моль/л ионов H+ и с моль/л HSO4(-). Ионы HSO4(-) диссоциируя далее, дадут х моль/л ионов водорода и х моль/л ионов SO4(2-). Учитывая это, получим выражения для концентраций ионов в растворе кислоты, получим:
[H(+)] = (с + х);
[HSO4(-)] = (c — x);
[SO4(2-)] = х.
Тогда
Ка2 = {[H(+)][SO4(2-)]}/[HSO4(-)]
Следовательно
1,02•10-2 = [(c + x)•x]/(c — x), и при с = 10-2 моль/л;
1,02•10-2•(c — x) = cх + x2;
0,0102(0,01 — x) = 0,01х + x(2);
0,000102 — 0,0102х = 0,01х + x2;
x2 + 0,0202х — 0,000102 = 0, где
а — 1; b = 0,0202; с = -0,000102;
D = b2 — 4ac = (0,0202)2 — 4•1•(-0,000102) = 0,000408 — (-0.000408) = 0,00081604,
D > 0.
значит, решая уравнения, получим два значения х:
x1 = (-0,0202 + 0,0286)/(2•1) = 0,0042;
х2 = (-0,0202 — 0,0286)/(2•1) = -0.0244.
Примем за значение «х» положительное число, т.е. х = 0,0042.
Следовательно,
[H(+)] = (с + х) = 0,01 + 0,0042 = 0,0142 моль/л.
pH = -lg[H(+)] = -lg0,0142 = -lg1,42 • 10-2 = 2 — lg1,42 = 2 — 0,15 = 1,85.
Ответ: рН = 1,85.
Расчёт рН раствора соляной кислоты
Задача 141.
Вычислить значение рН раствора, полученного при сливании 50 мл 0,1 н HCl c 20 мл 0,1 н NaOH.
Дано:
Vк = 50 мл;
Vo = 20 мл;
Ск = 0,1 н;
Со = 0,1 н;
рН = ?
Решение:
1. Рассчитаем количество миллиэквивалентов взятых кислоты и основания (nк, nо, мэкв) до реакции, получим:
nк = Ск • V = 50•0,1 = 5 мэкв;
nо = Со • V = 20•0,1 = 2 мэкв.
2. Рассчитываем количество кислоты и основания после проведения реакции, получим:
nк = 5-2 = 3 мэкв;
nо = 0.
Таким образом, после проведения реакции в растворе останется сильная кислота HCl, которая будет определять рН раствора. Расчет ведут по формуле:
рН = — lg [H+] + [H+]ост = -lg[(Ск•Vк) – (Со•Vо)]/(Vk + Vo).
Тогда
рН = -lg(50•0,1) — (20•0,1)/(50 + 20) = -lg0,029 = 2 — 0,46 = 1,54.
Ответ: рН = 1,54.