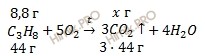Значит, дана реакция горения углерода, а это значит, что продуктами реакции, то есть веществами, которые участвуют в реакции будут кислород и углерод. Ход решения задачи разделим на два этапа.
Правильная запись дано и необходимых условий
Разработаем план записи данных:
- запишем вещества и их химические формулы, которые участвуют в реакции.
- записываем данные, которые даются в условии.
- записываем, что с чем реагирует.
- записываем то, что надо найти.
Значит, продукты реакции: углерод, химическая формула которого C, и кислород — O2.
Дано:
m(C) = 1 кг = 1000г.
взаимодействие C с O2;
Найти: V(угл. газа)-?
Последовательное решение задачи
Также запишем по пунктам этапы решения задачи и сразу же будем решать(m — масса вещества, v — количество вещества, M — молярная масса вещества, V — объем вещества):
- Запишем уравнение реакции и укажем агрегатное состояние веществ: C + O2 = CO2↑. C — твердое, O2/CO2↑ — газообразные.
- Из реакции — на 1 моль C расходуется 1 моль CO2;
- Найдем v(C), v(C) = m(C)/M(C).
M(C) = 12 г/моль.
v(C) = (1000 г) / (12 г/моль) = 83,33 моль.
- Так как v(C) : v(CO2) = 1 : 1, то v(CO2) = v(C) = 83,33 моль.
- Запишем формулу нахождения объема: V = v * Vm. Vm — молярный объем, который равен 22,4 л/моль, когда реакция протекает в нормальных условиях без каких-либо катализаторов и ускорителей реакции. Но, он используется для нахождения объема только газообразных веществ.
- V(CO2) = 83,33 моль * 22,4 л/моль = 1866,592 л.
Запишем ответ:
Таким образом получаем, что при сгорании 1 кг углерода (C), выделяется углекислый газ (CO2) с объемом в 1866,592 л. [V(CO2) = 1866,592 л]
Горение пропана
Рассчитать массу и объем газа, образовавшегося при горении пропана (C3H8) массой 8,8 грамм.
Решение задачи
Запишем реакцию горения пропана (C3H8):
Учитывая, что молярные массы пропана (C3H8) и углекислого газа (CO2) соответственно равны 44 г/моль и 44 г/моль, по уравнению реакции, найдем массу углекислого газа (CO2), который образуется при полном горении пропана (C3H8):
при горении пропана (C3H8) 8,8 г образуется x г CO2
при горении пропана (C3H8) образуется 1 г CO2
Откуда:
Учитывая, что пропан (C3H8) – газ, вычислим объем углекислого газа (CO2), который образуется при полном горении пропана (C3H8), по формуле перерасчета, устанавливающей связь между массой и объемом газа:
Получаем:
V (C3H8) = 26,4 ∙ 22,4 / 44 = 13,44 (л).
Ответ:
масса углекислого газа равна 26,4 грамма,
объем углекислого газа равен 13,44 литра.
Калькулятор позволяет рассчитать объем углекислого газа (СО2) при сжигании природного газа:
-
- приведенный к нормальным условиям (по стехиометрическим уравнениям);
- приведенный к рабочим условиям (исходя из температуры дымовых газов).
Калькулятор объема углекислого газа при сжигании газа
Общие данные
Объем углекислого газа образующегося при сжигании природного газа (алканов, парафинов, также насыщенных углеводородов) определяется согласно химическим уравнениями:
-
-
-
-
- CH4+2O2=>1CO2+2H2O;
- C2H6+3.5O2=>2CO2+3H2O;
- C3H8+5O2=>3CO2+4H2O;
- и т.д,
-
-
-
где красным (стехиометрические коэффициенты) выделено количество молекул углекислого газа выделяющегося при сжигании 1 молекулы природного газа. Так как согласно закону Авогадро в равных объёмах различных газов, взятых при одинаковых температурах и давлениях, содержится одно и то же количество молекул, то это соотношение верно и к объема веществ в уравнениях.
Более подробно методика расчет состава дымовых газов в зависимости от вида и состав топлива приведена в нормативном методе «ТЕПЛОВОЙ РАСЧЕТ КОТЛОВ (НОРМАТИВНЫЙ МЕТОД)».
Масса, объем, плотность и температура углекислого газа.
На практике (при решении инженерных задач) для определении параметров углекислого газа в составе дымовых газов можно использовать формулы для идеального газа. Это связано с тем, что в большинстве случаев параметры дымовых газов не сильно отличны от нормальных (стандартных) условий (особенно по давлению газа).
Температура дымовых газов, в том числе углекислого газа, зависит от технологического процесса. При сжигании газа в отопительном оборудовании (паровые и водогрейные котла, газовые водонагреватели) температура дымовых газов обычно составляет 160-180 ºС.
Литература
-
- ТЕПЛОВОЙ РАСЧЕТ КОТЛОВ (НОРМАТИВНЫЙ МЕТОД). Издание третье, переработанное и дополненное, Санкт-Петербург, 1998 г.
Примечание.
В комментарии приветствуются пожелания, замечания и рекомендации по улучшению программы.
Поделиться ссылкой:
Осуществим решение:
В соответствии с условием задачи запишем процесс:
СН₄ + 2 О₂ = СО₂ + 2 Н₂О + Q — горение метана, выделяется тепло, углекислый газ, вода;
Вычисления:
1 м³ — 1000 л
100 м³ — Х л СН₄ отсюда, Хл (СН₄) = 100 * 1000 / 1 = 100000 л
1 моль газа при н. у — 22,4 л
Х моль (СН₄) — 100000 отсюда, Х моль (СН₄) = 1 * 100000 / 22,4 = 4464,2 моль;
Y (CO₂) = 4464,2 моль так как количество веществ по уравнению равно 1 моль.
Находим объём продукта:
V (CO₂) = 4464,2 * 22,4 = 99998 л
Ответ: объём углекислого газа составляет 99998 л
2 л может быть? при создании уравнения коэффициенты не косаются этих двух веществ и там и там 1 следовательно количества вещества и объем равны
окраска не меняется , т.к. это алкан, а алка не содержат двойной связи
CH4 + 2O2 = CO2 + 2H2O
Найдем количество вещества метана :
n = V m = 222,4 = 0,08 моль.
По уравнению реакции пересчитаем на углекислый газ. Видно, что соотношение 1:1, значит углекислого газа тоже 0,08 моль. Вычисляем объем :
V = n*m = 0,08 * 22,4 = 2 л.
Это подробное решение как просили. А так сразу видно, без решения, что углекислого газа тоже выделится 2л, так как соотношение 1:1
аа, это левая сторона уравнения = правой стороне, так?