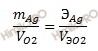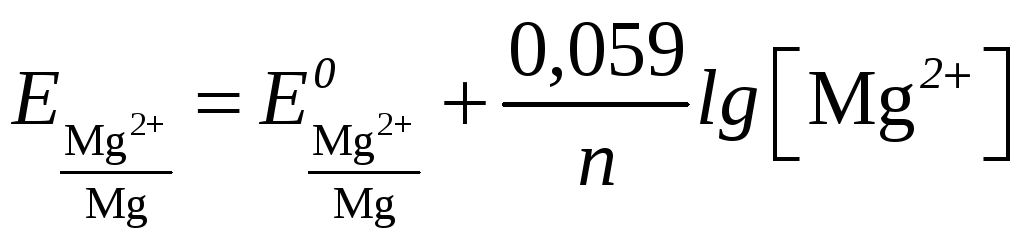В двух последовательно соединенных электролизерах находятся водные растворы AgNO3 и H2SO4, соответственно. Необходимо написать уравнения происходящих электродных процессов и рассчитать при стандартных условиях объем газа O2, выделившегося во втором электролизере, если в первом на катоде выделилось 5.6 г металла.
Я начал кое-что.
Первый электролизер: Диссоциация: AgNO3=Ag++NO3—. Катод: Ag++e=Ag. Анод: 2H2O-4e=O2+4H+. Суммарное ионное: 4Ag++2H2O=4Ag+O2+4H+. Суммарное молекулярное: 4AgNO3+2H2O=4Ag+O2+4HNO3.
Второй электролизер: Диссоциация: H2SO4=2H++SO42-. Катод: 2H++2e=H2. Анод: 2H2O-4e=O2+4H+. Суммарное ионное: 4H++2H2O=2H2+4H++O2. Суммарное молекулярное: 2H2O=2H2+O2.
Правильно сделал? Теперь надо найти при стандартных условиях объем газа O2, выделившегося во втором электролизере, если в первом на катоде выделилось 5.6 г металла. Вроде бы с помощью второго закона Фарадея. Мыслей нет по этому поводу.
Вычисление массы и объема веществ, образующихся при электролизе
Решение задач по химии на электролиз вещества
Задание 261.
Электролиз раствора К2SO4 проводили при силе тока 5 А в течение 3 ч. Составьте электронные уравнения процессов, происходящих на электродах. Какая масса воды при этом разложилась и чему равен объем газов (н.у.), выделившихся на катоде и аноде? Ответ: 5,03 г; 6,267 л; 3,133 л.
Решение:
Стандартный электродный потенциал системы К+ + 1
2Н2О + 2
На аноде будет происходить электрохимическое окисление воды, приводящее к выделению кислорода:
2Н2О — 4
поскольку, отвечающий этой системе стандартный электродный потенциал (+1,23 В) значительно ниже, чем стандартный электродный потенциал (+2,01 В), характеризующий систему: 2SO42- — 2
Массу разложившейся воды находим из уравнения Фарадея, имея в виду, что 3 ч = 10800 с и МЭ(Н2О) = 9 г/моль, получим:
m(H2O) = МЭ(В) . I . t/F = 9 . 5 . 10800/96500 = 5,036 г.
При вычислении объёмов выделившихся газов представим уравнение Фарадея в следующем виде:
V = VЭ . I . t/F
Здесь V – объём выделившегося газа, л; m(B) – масса выделившегося вещества, г; VЭ – эквивалентный объём газа, л/моль; МЭ(В) – масса эквивалента вещества, г/моль; I – сила тока, А; t – время, с; F – число Фарадея, 96500.
Поскольку при нормальных условиях эквивалентный объём водорода равен 11,2 л/моль, а кислорода – 5,6 л/моль, получим:
V(H2) = (11,2 . 5 . 10800)/96500 = 6,267 л;
V(О2) = (5,6 . 5 . 10800)/96500 = 3,133 л;
Ответ: m(H2O) 5,03 г; V(H2) = 6,267 л; V(О2) =3,133 л.
Задание 262.
При электролизе соли некоторого металла в течение 1,5 ч при силе тока 1,8 А на катоде выделилось 1,75 г этого металла. Вычислите эквивалентную массу металла. Ответ: 17.37 г/моль.
Решение:
Эквивалентную массу металла рассчитаем из уравнения Фарадея относительно эквивалентной массы вещества, подставив в него данные из задачи, получим:
m(В) = МЭ(В) . I . t/F;
МЭ(Ме) = m(В) . F/(I . t) = (1,75 . 96500)/(1,8 . 60 . 60 . 1,5) = 17,37 г/моль.
Здесь m(B) – масса выделившегося вещества, г; VЭ – эквивалентный объём газа, л/моль; МЭ(В) – масса эквивалента вещества, г/моль; I – сила тока, А; t – время, с; F – число Фарадея, 96500 Кл/моль.
Ответ: 17.37 г/моль.
Задание 263.
При электролизе раствора СuSO4 на аноде выделилось 168 см3 газа (н.у.). Составьте электронные уравнения процессов, происходящих на электродах, и вычислите, какая масса меди выделилась на катоде. Ответ:0,953г.
Решение:
Стандартный электродный потенциал системы Cu2+ + 2
Cu2+ + 2
На аноде будет происходить электрохимическое окисление воды, приводящее к выделению кислорода:
2Н2О — 4
поскольку, отвечающий этой системе стандартный электродный потенциал (+1,23 В) значительно ниже, чем стандартный электродный потенциал (+2,01 В), характеризующий систему: 2SO42- — 2 = 2S2O82-. Ионы SO42-, движущиеся при этом к аноду, будут накапливаться в анодном пространстве.
Эквивалентный объём кислорода равен 5,6 л/моль. Тогда количество эквивалентов выделившегося кислорода равно:
(О2) = V(O2)/VЭ(О2) = 0,168/5,6 = 0,03 моль.
Так как (О2) = (Cu), то можно рассчитать массу выделившейся меди при электролизе сульфата меди, получим:
m(Cu) = (Cu) . MЭ(Cu) = 0,03 . 31,77 = 0,953 г.
Ответ: m(Cu) = 0,953 г.
Задание 264.
Электролиз раствора Na2SO4 проводили в течение 5 ч при силе тока 7 А. Составьте электронные уравнения процессов, происходящих на электродах. Какая масса воды при этом разложилась и чему равен объем газов (н.у.), выделившихся на катоде и аноде? Ответ: 11,75 г; 14,62 л; 7,31 л.
Решение:
Стандартный электродный потенциал системы Na+ +1
2Н2О + 2
На аноде будет происходить электрохимическое окисление воды, приводящее к выделению кислорода:
2Н2О — 4
поскольку, отвечающий этой системе стандартный электродный потенциал (+1,23 В) значительно ниже, чем стандартный электродный потенциал (+2,01 В), характеризующий систему: 2SO42- — 2 = 2S2O82-. Ионы SO42-, движущиеся при этом к аноду, будут накапливаться в анодном пространстве.
Массу разложившейся воды находим из уравнения Фарадея, имея в виду, что 5 ч = 18000 с и МЭ(Н2О) = 9 г/моль, получим:
m(H2O) = МЭ(В) . I . t/F = 9 . 7 . 18000/96500 = 11,75 г.
При вычислении объёмов выделившихся газов представим уравнение Фарадея в следующем виде:
V = VЭ . I. t/F
Здесь V – объём выделившегося газа, л; m(B) – масса выде m(H2O) = 11,75 г; V(H2) = 14,62 л;V(О2) = 7,31 л.лившегося вещества, г; VЭ – эквивалентный объём газа, л/моль; МЭ(В) – масса эквивалента вещества, г/моль; I – сила тока, А; t – время, с; F – число Фарадея, 96500.
Поскольку при нормальных условиях эквивалентный объём водорода равен 11,2 л/моль, а кислорода – 5,6 л/моль, получим:
V(H2) = (11,2 . 7 . 10800)/96500 = 14,62 л;
V(О2) = (5,6 . 7 . 10800)/96500 = 7,31 л
Ответ: V(H2) = 14,62 л; V(О2) = 7,31 л.
Записать реакции электролиза на инертных электродах и вычислить массу вещества, полученного на катоде и объем газа, выделившегося на аноде, при электролизе раствора соли нитрата серебра (AgNO3), если время электролиза 20 минут, а сила тока I=2А, если выход по току Вт=100%. Какие вещества будут выделяться на электродах при замене инертного анода на металлический (Ag)?
Решение задачи
Электролиз раствора соли нитрата серебра (AgNO3):
(-) К: Ag+, H2O.
(+) А: NO3— , H2O.
Катионы металла (Ag+), имеющие большое значение ϕ0 при электролизе полностью восстанавливаются. Следовательно:
(-) К: Ag+ + e—= Ag0;
(+) A: 2H2O — 4e— = O2↑+4H+
Анион NO3— неокисляем. Суммарное уравнение электролиза раствора соли нитрата серебра (AgNO3):
Итак, в ходе электролиза раствора соли нитрата серебра на инертных электродах будут выделяться серебро (на катоде) и кислород (на аноде).
Найдем массу серебра, полученного на катоде согласно закону Фарадея. Закон Фарадея выражается следующей формулой:
Где:
m — масса образовавшегося на электродах или подвергшегося превращению вещества, г;
Мэ — его эквивалентная масса, г/ моль;
I — сила тока, А (ампер);
t — время, с;
F — число Фарадея (96500 Кл/моль), т.е. количество электричества, необходимое для осуществления электрохимического превращения одного эквивалента вещества.
Учитывая, что эквивалентная масса серебра (Ag+) равна 108 г/моль (смотри таблицу Менделеева), следовательно, его эквивалентная масса равна 108 г/моль, получаем:
m (Ag) = 108 ⋅ 2 ⋅ 1200 /96500 = 2,69 (г).
II закон Фарадея. При прохождении одинакового количества электричества через растворы (расплавы) различных электролитов массы (объемы) выделяющихся веществ пропорциональны их эквивалентным массам (объемам).
Получаем:
Откуда:
Так как масса серебра равна 2,69 г; Vэ(O2) = 5,6 л/моль; Э (Ag) = M (Ag) / n = 108 /1 = 108 г/моль (n -количество электронов, принимающих участие в анодном процессе).
V (O2) = 2,69 ⋅ 5,6 /108 = 0,14 (л)
Ответ:
масса серебра 2,69 грамма,
объем кислорода 0,14 литра.
При замене инертного анода на серебряный, на аноде становится возможным протекание еще одного окислительного процесса — растворение серебра, из которого сделан анод:
(+) А: Ag0 — e—= Ag+
Этот процесс характеризуется более низким значение потенциала, чем остальные возможные анодные процессы. Поэтому при электролизе раствора соли нитрата серебра (AgNO3) с серебряным анодом на аноде происходит реакция окисления серебра (Ag), а в анодном пространстве будет накапливаться AgNO3.
Суммарная электродная реакция выразится уравнением в ионном виде:
Ag0 + Ag+ = Ag+ + Ag0
Так как ионы сокращаются, то составить молекулярное уравнение электролиза раствора соли нитрата серебра (AgNO3) невозможно. Это означает, что электролиз раствора соли нитрата серебра (AgNO3) с анодом из серебра (Ag) сводится к переносу серебра с анода на катод.

Ребят,хелпаните с электролизом.С объяснением,если можно.
1) Вычислите массу газа,выделившегося на аноде при электролизе водного раствора 13 г хлорида меди CuCl2.
2) При электролизе водного раствора бромида натрия на аноде выделился бром массой 8 г. Вычислите объем газа,выделившегося на катоде.
3) При электролизе водного раствора хлорида меди на катоде выделилось 8 г меди. Определите объем газа,выделившегося на аноде.
Светило науки — 1136 ответов — 4751 помощь
1)
На катоде:
Cu⁺² + 2e → Cu⁰
На аноде:
2Cl⁻ — 2e → Cl₂↑
CuCl₂ = Cu + Cl₂↑
n(CuCl₂) = n(Cl₂)
n(CuCl₂) = m/M = 13г/135 г/моль= 0,096 моль
m(Cl₂) = n*M = 0,096 моль* 71 г/моль = 6,82 г
2)
На катоде:
2H₂O + 2e → H₂↑ + 2OH⁻
На аноде:
2Br⁻ — 2e →Br₂
2NaBr + 2H₂O = 2NaOH + H₂↑ + Br₂
n(H₂) = n(Br₂)
n(Br₂) = m/M = 8 г. /160 г/моль = 0,05 моль
V(H₂) = n*Vm = 0,05моль*22,4л/моль = 1,12 л.
3)
На катоде:
Cu⁺² + 2e → Cu⁰
На аноде:
2Cl⁻ — 2e → Cl₂↑
CuCl₂ = Cu + Cl₂↑
n(CuCl₂) = n(Cl₂) = n(Cu)
n(Cu) = m/M = 8г/64г/моль = 0,125 моль
V(Cl₂) = n*Vm = 0,125 моль*22,4 л/моль = 2,8 л.
Количественные
законы электролиза, открытые М. Фарадеем,
выражают связь между количеством
прошедшего через электролит электричества,
массой и химической природой веществ,
претерпевших превращение на электродах.
1. Массы
(m) веществ выделяемых
на электродах при электролизе
пропорциональны количеству электричества
(q) прошедшего
через электролит.
2. Массы
различных веществ, подвергшихся
электрохимическому превращениюх в
результате прохождения через электролит
одного и того же количества электричества,
пропорциональны химическим эквивалентам
(Э) этих веществ.
3.
Для выделения из раствора электролита
одного грамм-эквивалента любого вещества
нужно пропустить через раствор F=96500
Кл
электричества.
Математически
законы Фарадея можно записать в виде
одного уравнения:
(12.6)
(коэффициент
называется электрохимическим
эквивалентом).
Законы
Фарадея записываются также в другой
форме:
(12.7)
В случае определения
объема выделившегося газа (на катоде,
аноде) при электролизе используется
следующая формула:
(12.8)
В
приведенных уравнениях:
m
– масса восстановленного или окисленного
вещества, кг;
I
– сила тока, пропускаемого через
электролизер, А;
M
– молярная масса восстановленного или
окисленного внещества, кг/моль;
V
– объем выделившегося газа, м3;
– объем, занимаемый 1 молем газа при
нормальных условиях.
12.2. Примеры решения задач
Пример
1.
Составить
электронные уравнения процессов,
происходящих на электродах при электролизе
водного раствора сульфата меди с
использованием:
а)
инертных электродов;
б) медных
электродов.
Решение.
CuSO4
диссоциирует в растворе по уравнению:
а) для
инертных электродов:
На
катоде происходит восстановление ионов
меди и образуется медь по реакции:
,
т.к. Cu
расположен в ряду напряжений правее
водорода.
На аноде
окисляется вода и образуется кислород
по реакции:
.
Составляем
уравнения полуреакций:
б) для
медных электродов:
Медь
выделяется на катоде, анод растворяется,
а количество CuSO4 в
растворе в течении всего процесса
остается неизменным.
Таким
образом, на катоде так же как и в случае
инертных электродов восстанавливается
медь:
,
а на аноде происходит окисление меди
(растворение анода) по реакции:
Составляем
уравнения полуреакций:
Пример 2.
Составить
электронные уравнения процессов,
происходящих на электродах при электролизе
расплава хлорида калия.
Решение.
КCl
в расплаве диссоциирует по уравнению:
На катоде
происходит восстановление ионов калия
и образуется калий по реакции:
.
На аноде
окисляются ионы хлора и образуется хлор
по реакции:
.
Составляем
уравнения полуреакций:
Пример
3.
Составить
электронные уравнения процессов,
происходящих на электродах при
электролизе:
а)
расплава гидроксида калия;
б)
раствора гидроксида калия с инертными
(нерастворимыми) электродами.
Решение.
KOH
диссоциирует по уравнению:
а) для
расплава гидроксида калия:
На катоде
происходит восстановление ионов калия
и образуется калий по реакции:
.
На аноде
окисляются анионы
и образуется кислород по реакции:
.
Составляем
уравнения полуреакций:
б) для
раствора гидроксида калия с инертными
(нерастворимыми) электродами:
Так как
калий расположен в ряду напряжений
левее водорода, то на катоде происходит
восстановление воды и образуется водород
по реакции: .
На аноде
окисляются анионы
и образуется кислород по реакции:
.
Составляем
уравнения полуреакций:
Таким
образом электролиз раствора гидроксида
калия сводится к электролизу воды.
Пример 4.
Определить
массу металлического никеля, выделившегося
на катоде при пропускании через раствор
сульфата никеля NiSO4
тока силой 5 ампер в течение 10 минут?
Решение.
Воспользовавшись
формулой (12.7), запишем:
В
указанной формуле:
M=58,69
г/моль – молярная масса никеля;
n=2
– число электронов, участвующих в
процессе окисления-восстановления;
I=5
A – сила тока, пропускаемого
через электролизер;
– время протекания тока.
Пример
5.
При
электролизе раствора сульфата меди
подается ток силой 10 А и используется
медный анод массой 9 г. Сколько времени
может протекать электролиз до полного
растворения анода?
Решение.
Воспользуемся
формулой (12.7). Выразим из нее время:
В
указанной формуле:
M=63,5
г/моль – молярная масса меди;
n=2
– число электронов, участвующих в
процессе окисления-восстановления;
I=10
A – сила тока, пропускаемого
через электролизер;
m=9
г – масса анода (масса меди, которая
восстановится на катоде.
Пример
6.
Сколько
времени нужно пропускать через раствор
кислоты ток силой 8 А, чтобы получить 10
л водорода (при н. у.)?
Решение.
Воспользовавшись
формулой (12.8), выразим из нее время:

Пример 7.
Сколько граммов KOH
образовалось у катода
при электролизе раствора K2SO4,
если на аноде выделилось
11,2 л кислорода, измеренного при нормальных
условиях?
Решение.
При
электролизе K2SO4
на катоде и аноде протекают следующие
процессы:
Из
уравнения реакции видно, что n=4,
соответственно на один моль кислорода
выделяется 4 моля KOH.
11,2 л кислорода составляют
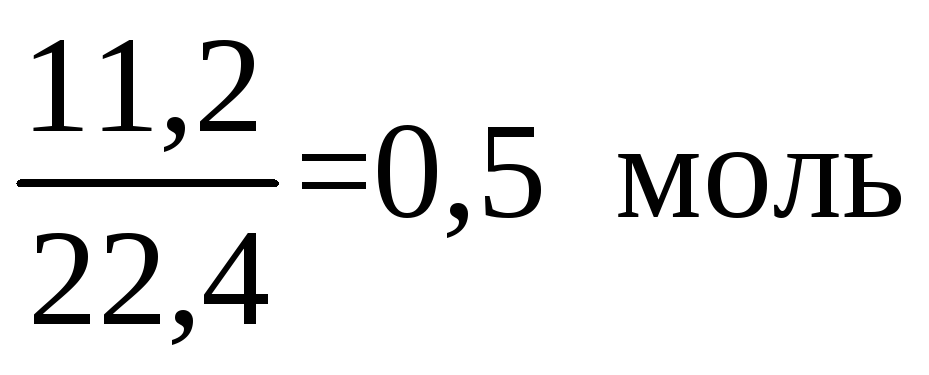
Тогда KOH
образуется 2 моль или
,
где M=56
г/моль – молярная масса гидроксида
калия.
Пример 8.
Магниевую пластинку опустили в раствор
его соли. При этом электродный потенциал
магния оказался равен – 2,41 В. Вычислите
концентрацию ионов магния в моль/л.
Решение.
Стандартный
потенциал магния берем из приложения
Д.
Задача решается на основании уравнения
Нернста (12.4):
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #