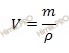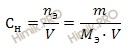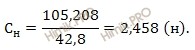Иодометрия
Иодометрия
-метод количественного объемного
анализа, в основе которого лежит реакция
восстановления свободного йода в йод-ион
или окисления йод-иона в свободный иод.
Направление реакции зависит от
окислительной способности вступающих
в реакцию с йодом веществ: например с
Na2S2O3
реакция идет слева направо, с КМп04,
К2Сг2О7-справа
налево. Степень окислительной способности
кислородсодержащих соединений зависит
от активной реакции среды (концентрации
ионов); меняя ее, легко можно изменить
направление процесса. Главнейшей в
йодометрии реакцией является восстановление
J раствором тиосульфата натрия
(гипосульфита натрия- Na2S2O3).
Индикатором
при титровании служит обычно раствор
крахмала
(0,2%-ного раствора на 100 см3
жидкости), дающего с йодом в присутствии
растворимых иодидов синее окрашивание.
При титровании до исчезновения синего
окрашивания последнее часто вновь
появляется через некоторое время. Это
может зависеть 1) от медленного течения
реакции восстановления йода; 2) от
окислительных процессов за счет кислорода
воздуха (особенно при солнечном свете);
3) от участия в реакции посторонних
веществ; особенно сильно влияет азотистая
кислота; присутствуя в ничтожном
количестве (напр. в лабораторном воздухе).
Для приготовления раствора Na2S2O3
около 25 г химически чистого препарата)
растворяют в 1 л воды и устанавливают
титр спустя 10-14 дней после приготовления.
Раствор тиосульфата нужно хранить в
темном месте и титр следует проверять
раз в 2 месяца.
Децинормальный
раствор иода готовится растворением
12,8-13 г иода и 25 г йодистого калия в 1 литре
воды. Раствор не стоек, и титр его следует
проверять; раствор надо хранить в
темноте. Титр устанавливают по раствору
тиосульфата. Благодаря очень большой
чувствительности реакции иода с крахмалом
и отчетливости изменения цвета при
конце титрования. Йодометрия считается
одним из лучших методов коли-чественного
анализа и получила широкое применение
в химии.
Лабораторная работа
Опыт
1. Приготовление рабочего раствора
тиосульфата натрия и определение его
концентрации по титрованному раствору
перманганата калия.
Рассмотрим
окислительно-восстановительные процессы
в реакции тиосульфата натрия с йодом:
2Na2S2O3
+
I2
= Na2S4O6
+ 2NaI
2S2O32-
— 2е—
= S4O62-
I2
+ 2е—
= 2I—
2S2O32-
+ I2
=
S4O62-
+ 2I—
Так
как два иона S2O32-
Теряют два электрона (по одному на
каждый ион), то грамм-эквивалент
восстановителя (тиосульфата натрия)
равен:
г-экв
Na2S2O3
· 5Na2O
==
= 248,19г.
Приготовить
титрованный раствор тиосульфата натрия
по точной навеске нельзя вследствие
того, что кристаллы тиосульфаты натрия
на воздухе выветриваются, и химический
состав их не всегда соответствует
формуле Na2S2O3
·
5H2O.Поэтому
тиосульфат натрия готовят приблизительной
концентрации, растворяя навеску
тиосульфата натрия в свежекипяченой и
охлажденной дистиллированной воде.
Раствор выдерживают 8-10 дней. Хранят
раствор в бутыли из темного стекла с
пробкой, снабженной хлоркальциевой
трубкой. Концентрация тиосульфата
натрия устанавливается с помощью
окислителя с известной концентрации.
В качестве таких окислителей применяют
перманганат калия (в кислой среде),
бихромат калия (в кислой среде) и йод.
Выполнение
работы.
В коническую колбу влить последовательно
20-25 мл. 2 н. серной кислоты, 15-20 мл. 10%-го
раствора йода калия и точно отмеренный
объем (отмерять пипеткой) титрированного
раствора перманганата калия. Происходит
реакция:
2KMnO4
+ 10KI
+ 8H2SO4
= 5I2
↓+ 2MnSO4
+ 6K2SO4
+ 8H2O
Накрыв
колбу стеклом, смесь выдерживают 3-5 мин,
поместив колбу в темное место. Затем
добавить 100 мл дистиллированной воды и
титровать тиосульфатом натрия:
I2
+ 2Na2S2O3
= Na2S4O6
+ 2NaI
Сначала
титруют без крахмала до получения
бледно-желтой окраски раствора. Затем,
прилить 2-3 мл раствора крахмала и
продолжать титровать до полного
исчезновения окраски. Тиосульфат натрия
следует приливать осторожно, перемешивая
содержимое колбы после каждой прибавленной
капли. Титрование повторить не менее
трех раз. Из реакции видно, что перманганат
калия непосредственно с тиосульфатом
натрия не взаимодействует, но число
затраченных грамм-эквивалентов
тиосульфата равно числу грамм-эквивалентов
йода, а последнее – числу грамм-эквивалентов
перманганата калия. Поэтому, зная
концентрацию перманганата калия и
тиосульфата натрия, можно, пользуясь
основным соотношением объемного анализа,
рассчитать концентрацию тиосульфата
натрия по формуле: V
KMnO4
·
N
KMnO4=
V
Na2S2O3·
N
Na2S2O3
N
Na2S2O3
= V KMnO4·
N
KMnO4/V
Na2S2O3
Затем
рассчитываем титр раствора тиосульфата
натрия:
TNa2S2O3
=
Э
Na2S2O3 N
Na2S2O3 ·1000
Опыт
2. Приготовление рабочего раствора йода
и определение его нормальности и титра
по титрованному раствору тиосульфата
натрия.
Для
приготовления раствора йода по точной
навеске его необходимо очищать возгонкой.
Но можно приготовить титрованный раствор
и из йода без предварительной очистки.
Готовится раствор приблизительно нужной
концентрации, а затем определяют его
нормальность по раствору тиосульфата
натрия. Для приготовления 0,02 н. раствора
йода отвешивают около 2,7 г. кристаллического
йода (грамм-эквивалент йода равен 126,91
г; 126,91 · 0,02 = 2,54 г.) и растворяют его в
концентрированном растворе йодистого
калия (йод плохо растворим в воде).
Растворение йода проводят в мерной
литровой колбе, а затем разбавляют
дистиллированной водой до метки.
Выполнение
работы.
В коническую колбу влить определенный
объем 10мл (отмеренный пипеткой)
приготовленного раствора йода.
Разбавить приблизительно таким же
объемом дистиллированной воды.
Титровать рабочим раствором тиосульфата
натрия до появления светло-желтого
окрашивания. Добавить 2 мл раствора
крахмала и продолжать титрование до
полного обесцвечивания раствора.
Нормальность раствора йода определить
по уравнению:
NI
= N
Na2S2O3·
V
Na2S2O3/
VI
T
I
= Э
I
· N
Na2S2O31000
Опыт
3. Определение
нормальности и титра по дихромату калия.
Дихромат
калия не изменяется при хранении.
Применение его основано на том, что он
легко выделяет иод из йодистого калия.
Выделившийся йод оттитровывают рабочим
раствором тиосульфата натрия. Реакция
протекает по уравнению:
К2Сг2О7+
6KI
+ 7H2SO4
= 3I2
↓+ Сг2(SO4)
3+
4K2SO4
+ 7H2O
М
1/6 К2Сг2О7=249,22/6=49,03г,
Э
К2Сг2О7
=49,03.
Выполнение
работы.
Для приготовления раствора необходимо
взвесить на часовом стекле навеску
0,2452г К2Сг2О7
. Взятую навеску перенести в мерную
колбу емкостью 100 мл, после чего с помощью
промывалки ополоснуть часовое стекло
дистиллированной водой. После растворения
довести объем раствора водой до метки.
В бюретку налить раствор тиосульфата
натрия. В колбу для титрования (200мл)
внести 10 мл К2Сг2О7,
15 мл KI
и 10 мл H2SO4
. Поставить колбу на 5 мин в темное место.
Затем в колбу для титрования долить 100
мл воды, для снижения концентрации Н
–ионов. И титруют раствором тиосульфата
до бледно-желтой окраски раствора.
Прибавить 2 мл раствора крахмала и
продолжать титрование до исчезновения
синей окраски раствора. Нормальность
раствора йода определить по уравнению:
N
Na2S2O3=
N
К2Сг2О7·
V
Na2S2O3/
V
Na2S2O3
T
Na2S2O3=
Э
К2Сг2О7·
N
Na2S2O3
/
1000
Контрольные
вопросы.
1.
В иодометрии титрантом является
стандартный раствор:
а.
I2
б.KI
в.Na2S2O3
г.KIO3
2.
Иодометрическое титрование сильных
кислот проводят способом:
а.
прямого титрования б.обратного
титрования в.титрования заместителя
г.
реверсивного титрования
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Помогите пожалуйста разобраться с задачей, почти решила…
-
Tenka
- Сообщения: 61
- Зарегистрирован: Пт дек 11, 2009 4:57 pm
Помогите пожалуйста разобраться с задачей, почти решила…
Всем привет.
Меня уже бесит одна задача. Не хватает у меня ума…помогите пожалуйста.
Навеска тиосульфата натрия 0,1522 г растворена в 20,00 мл воды.
Определить молярность йода, если на титрование полученного раствора израсходовано 15,00 мл йода.
Вот, что я нашла
мЭ (тиосульфата) = 0,24821
Т (тиосульфата) = 0,00761
мЭ (йода) = 0,2538
Ну ещё сомнительно нашла массу раствора тиосульфата = P*V=3,044
Не знаю что ещё можно, ну никак((( Надеюсь на вашу помощь
Заранее спсибо
-
Maryna
- Лиса-Алиса
- Сообщения: 7002
- Зарегистрирован: Пт июл 28, 2006 12:14 pm
- Контактная информация:
Re: Помогите пожалуйста разобраться с задачей, почти решила…
Сообщение
Maryna » Пт дек 11, 2009 5:07 pm
Для начала напишите уравнение реакции взаимодействия тиосульфата и йода.
Затем рассчитайте молярную массу тиосульфата и определите, сколько его у Вас молей есть. В соответствии с уравнением реакции определите число моль йода. Почти все.
-
Tenka
- Сообщения: 61
- Зарегистрирован: Пт дек 11, 2009 4:57 pm
Re: Помогите пожалуйста разобраться с задачей, почти решила…
Сообщение
Tenka » Пт дек 11, 2009 5:16 pm
вот реакция будет
J2 + 2Na2S2O3 = 2NaJ + Na2S4O6
молярная масса 1 моля тиосульфата 158. Молей тут 2, значит 316. на два моля приходится два заряда йода. Значит мЭ = 316/2*1000 = 0,158.
Ну а йода два моля участвует…и как это мне поможет?)
-
Tenka
- Сообщения: 61
- Зарегистрирован: Пт дек 11, 2009 4:57 pm
Re: Помогите пожалуйста разобраться с задачей, почти решила…
Сообщение
Tenka » Пт дек 11, 2009 5:27 pm
Молярность вычисляется же по формуле нормальность йода/Э йода. Э = 1. А как нормальность найти, при этом используя предложенные данные?
-
Tenka
- Сообщения: 61
- Зарегистрирован: Пт дек 11, 2009 4:57 pm
Re: Помогите пожалуйста разобраться с задачей, почти решила…
Сообщение
Tenka » Пт дек 11, 2009 5:32 pm
пожалуйста помогите((( нервы уже не выдержали(
-
Maryna
- Лиса-Алиса
- Сообщения: 7002
- Зарегистрирован: Пт июл 28, 2006 12:14 pm
- Контактная информация:
Re: Помогите пожалуйста разобраться с задачей, почти решила…
Сообщение
Maryna » Пт дек 11, 2009 6:14 pm
я прошу меня извинить, но нормальностями в обычной практике никогда не пользуюсь. Я Вам так попробую объяснить.
Моли нужно находить из массы данной Вам соли. Число моль тиосульфата = масса / молярная масса. Раз говорится, что его оттитровали ВЕСЬ, значит, йода на титрование ушло МОЛЬ в два раза больше, чем соли, если верить Вашему уравнению. Теперь у Вас есть количество вещества (моль) йода. Ищите его массу! Объем раствора есть, масса йода в нем будет — найдете концентрацию. Правда, непонятно, зачем дано количество воды
-
SkydiVAR
- Сообщения: 9330
- Зарегистрирован: Пн янв 19, 2009 12:51 am
- Контактная информация:
Re: Помогите пожалуйста разобраться с задачей, почти решила…
Сообщение
SkydiVAR » Пт дек 11, 2009 6:20 pm
Tenka писал(а):вот реакция будет
J2 + 2Na2S2O3 = 2NaJ + Na2S4O6
молярная масса 1 моля тиосульфата 158. Молей тут 2, значит 316. на два моля приходится два заряда йода. Значит мЭ = 316/2*1000 = 0,158.
Ну а йода два моля участвует…и как это мне поможет?)
В соответствии с реакцией, на каждый моль йода расходуется два моля тиосульфата. В 0,1522 г тиосульфата содержится х моль тиосульфата, значит на реакцию с этим количеством тиосульфата израсходовалось у моль йода. У моль йода содержится в 15,00 мл раствора йода, значит в 1000,00 мл раствора будет содержаться Z моль йода. Теперь смотрим определение понятия «молярность» и радуемся.
ЗЫ: MPS, масса йода не интересна — вопрос в определении молярности раствора йода. А объем воды, действительно, нигде не используется. Кстати, не указано, тиосульфат в виде безводной соли брали или в виде пентагидрата. Видимо, надо считать все-таки на пентагидрат. Ну, или, на то и другое и представить преподу оба ответа с комментарием.
ЗЗЫ: Tenka, поскольку это аналитика, мольмассы следует брать хотя бы с двумя значащими цифрами после запятой.
Меч-кладенец — оружие пофигистов.
-
Tenka
- Сообщения: 61
- Зарегистрирован: Пт дек 11, 2009 4:57 pm
Re: Помогите пожалуйста разобраться с задачей, почти решила…
Сообщение
Tenka » Пт дек 11, 2009 6:41 pm
вы меня запутали… зачем тогда в условии сказано про 20 мл? Получается 15 мл йода оттитровали 20 мл раствора.
Формула Молярности = нормальность/эквивалент. Мне нужно нормальность йода в его 15 мл. Какой формулой рассчитать, не знаю((( в том то и проблема
-
SkydiVAR
- Сообщения: 9330
- Зарегистрирован: Пн янв 19, 2009 12:51 am
- Контактная информация:
Re: Помогите пожалуйста разобраться с задачей, почти решила…
Сообщение
SkydiVAR » Пт дек 11, 2009 7:00 pm
Tenka писал(а):Навеска тиосульфата натрия 0,1522 г растворена в 20,00 мл воды.
Определить молярность йода, если на титрование полученного раствора израсходовано 15,00 мл йода.
В первом посте Вы желали узнать молярность йода… Зачем для этого нормальность?
А объем воды… Может, для того, чтобы показать, что реакция шла в растворе? Могли бы и 20 литров написать — результат бы не изменился…
Меч-кладенец — оружие пофигистов.
-
Tenka
- Сообщения: 61
- Зарегистрирован: Пт дек 11, 2009 4:57 pm
Re: Помогите пожалуйста разобраться с задачей, почти решила…
Сообщение
Tenka » Пт дек 11, 2009 7:04 pm
хорошо…это поняла. Но масса растворителя как сказано в википедии мне не известна, то есть масса навески иода. А согласно приведенной вами формуле навеска исслед. вещ-ва вообще не учитывается.(((
-
Maryna
- Лиса-Алиса
- Сообщения: 7002
- Зарегистрирован: Пт июл 28, 2006 12:14 pm
- Контактная информация:
Re: Помогите пожалуйста разобраться с задачей, почти решила…
Сообщение
Maryna » Пт дек 11, 2009 7:17 pm
SkydiVar, согласна, масса йода не нужна. Отвыкла от концентраций моль/л
Если Tenka принесет два решения, одно из них с учетом наличия кристаллизационной воды в тиосульфате, думаю, препод будет восхищен!
-
Tenka
- Сообщения: 61
- Зарегистрирован: Пт дек 11, 2009 4:57 pm
Re: Помогите пожалуйста разобраться с задачей, почти решила…
Сообщение
Tenka » Пт дек 11, 2009 7:27 pm
спасибо, но врятли Тенка сможет)) я запуталась
-
Maryna
- Лиса-Алиса
- Сообщения: 7002
- Зарегистрирован: Пт июл 28, 2006 12:14 pm
- Контактная информация:
Re: Помогите пожалуйста разобраться с задачей, почти решила…
Сообщение
Maryna » Пт дек 11, 2009 7:33 pm
Вам дан объем раствора йода. Вы нашли число моль йода. Концентрация — это число моль / объем. Что конкретно Вам непонятно? С числом моль йода вопросы есть?
-
Tenka
- Сообщения: 61
- Зарегистрирован: Пт дек 11, 2009 4:57 pm
Re: Помогите пожалуйста разобраться с задачей, почти решила…
Сообщение
Tenka » Пт дек 11, 2009 7:36 pm
концентрация получилась 0,13333. Просто понимаете, я думаю что навеска и.о.в. дана не зря
-
Maryna
- Лиса-Алиса
- Сообщения: 7002
- Зарегистрирован: Пт июл 28, 2006 12:14 pm
- Контактная информация:
Re: Помогите пожалуйста разобраться с задачей, почти решила…
Сообщение
Maryna » Пт дек 11, 2009 7:38 pm
и.о.в. — это что?
сейчас пересчитаю
хм, у меня получилось 0,032 моль/л. А у Вас в каких единицах?
-
Tenka
- Сообщения: 61
- Зарегистрирован: Пт дек 11, 2009 4:57 pm
Re: Помогите пожалуйста разобраться с задачей, почти решила…
Сообщение
Tenka » Пт дек 11, 2009 7:45 pm
исследуемое определяемое вещество, то есть тиосульфат натрия. А стандартный раствор — иод. Если б к примеру в 20 мл воды было растворено 10 г навески, на титрование иода ушло бы больше объема
-
Maryna
- Лиса-Алиса
- Сообщения: 7002
- Зарегистрирован: Пт июл 28, 2006 12:14 pm
- Контактная информация:
Re: Помогите пожалуйста разобраться с задачей, почти решила…
Сообщение
Maryna » Пт дек 11, 2009 7:56 pm
Я не поняла, почему Вы считаете, что масса тиосульфата не использовалась??? А откуда же моли йода взялись??
-
Tenka
- Сообщения: 61
- Зарегистрирован: Пт дек 11, 2009 4:57 pm
Re: Помогите пожалуйста разобраться с задачей, почти решила…
Сообщение
Tenka » Сб дек 12, 2009 8:36 am
Ну, я конечно не уверена, но моли мы взяли из уравнения. Что на 2 моля тиосульфата приходится 1 моль иода. И навеска не использовалась для этого определения…
-
Maryna
- Лиса-Алиса
- Сообщения: 7002
- Зарегистрирован: Пт июл 28, 2006 12:14 pm
- Контактная информация:
Re: Помогите пожалуйста разобраться с задачей, почти решила…
Сообщение
Maryna » Сб дек 12, 2009 10:28 am
Это неправильно. Так…. Попробую по методу SkydiVar‘а про болты и гайки.
Вам дали коробку объемом, скажем, 2 л. Известно, что в этой коробке 20 гаек. Дали вторую коробку, с болтами, объемом 0.5 л. На один болт надевается 2 гайки. И сказали, что все гайки из первой коробки были израсходованы на болты из второй. Сколько болтов во второй коробке?
-
SkydiVAR
- Сообщения: 9330
- Зарегистрирован: Пн янв 19, 2009 12:51 am
- Контактная информация:
Re: Помогите пожалуйста разобраться с задачей, почти решила…
Сообщение
SkydiVAR » Сб дек 12, 2009 2:02 pm
Tenka, просто сделайте ту последовательность операций, что я описал и озвучьте числа X,Y и Z. OK?
Меч-кладенец — оружие пофигистов.
Нормальность — раствор — иод
Cтраница 1
Нормальность раствора иода определяют титрованием: 10мл бензольного раствора иода титруют тиосульфатом в тех Hie условиях, что при анализе.
[1]
Нормальность раствора иода определяют титрованием: 10 мл бензольного раствора иода титруют тиосульфатом в тех же условиях, что при анализе.
[2]
Нормальность раствора иода вычисляют, как обычно.
[3]
Зная нормальность раствора иода и затраченные на титрование объемы растворов его и тиосульфата, можно найти нормальность и титр последнего.
[4]
Вычислите нормальность раствора иода, если на титрование 0 2905 г АзаОз было израсходовано 40 5 мл раствора его.
[5]
Зная нормальность раствора иода и затраченные на титрование объемы вычисляют количество Na2S2O3 в анализируемой жидкости. С помощью рабочего раствора иода определяют также содержание других восстановителей: мышьяковистой, сернистой и сероводородной кислот, их солей, SnCl, и других.
[6]
Зная нормальность раствора иода и затраченные на титрование объемы растворов его и тиосульфата, можно найти нормальность и титр последнего. Обратно, по известной нормальности или титру раствора Na2S2O3 можно подсчитать нормальность и титр раствора иода.
[7]
Зная нормальность раствора иода и затраченные на титрование объемы, вычисляют количество тиосульфата натрия Na2S2O3 в анализируемой жидкости.
[8]
Зная нормальность раствора иода и затраченные на титрование объемы растворов его и тиосульфата, можно найти нормальность и титр последнего.
[9]
Затем определяют нормальность раствора иода титрованием рабочим раствором тиосульфата натрия.
[10]
Если известны нормальности растворов иода и тиосульфата, то расчет ведут по типу вычисления при титровании по остатку ( см. формулу За, стр.
[11]
Для установления нормальности раствора иода отбирают пипеткой 25 0 мл раствора иода в колбу для титрования, добавляют 20 — 30 мл воды и титруют 0 1 N раствором тиосульфата до желтой окраски. Затем добавляют 2 — Змл раствора крахмала и продолжают титровать синий раствор до полного обесцвечивания. Если крахмал прибавить раньше, когда иода в растворе еще много, то образуется соединение иода с крахмалом, которое медленно реагирует с тиосульфатом, поэтому легко перетитровать.
[12]
Какой должна быть нормальность раствора иода, чтобы при анализе навески 0 500 г число миллилитров, затраченное на титрование, равнялось процентному содержанию сурьмы.
[13]
Титруют несколько навесок As2O3 и находят нормальность раствора иода.
[14]
Точное титрование повторите 2 — 3 раза и, взяв среднее из сходящихся отсчетов, вычислите нормальность раствора иода.
[15]
Страницы:
1
2
Для публикации сообщений создайте учётную запись или авторизуйтесь
Вы должны быть пользователем, чтобы оставить комментарий
Войти
Уже есть аккаунт? Войти в систему.
Войти
Чему равна нормальность 10-процентного (по массе) раствора йодата калия (KIO3), плотность которого равна 1,052 г/мл, если он восстанавливается до свободного йода?
Решение задачи
I способ решения (II способ)
Напомню, что под нормальной концентрацией понимают количество грамм-эквивалентов данного вещества, содержащегося в 1 л раствора. Нормальную концентрацию выражают в моль-экв/л или используют сокращение «н», «N».
Таким образом, для вычисления нормальности раствора йодата калия (KIO3) необходимо знать, сколько граммов йодата калия (KIO3) содержится в 1 л раствора.
Учитывая, что раствор йодата калия (KIO3) 10-процентный, следовательно, в 100 г раствора содержится 10 г вещества йодата калия (KIO3). Рассчитаем объем, который занимает данное весовое количество раствора йодата калия (KIO3), используя формулу:
Получаем:
Вычислим, сколько грамм йодата калия (KIO3) содержится в 1 литре (1 л = 1000 мл) раствора. Составим соотношение:
в 95,057 мл раствора содержится 10 г KIO3
в 1000 мл раствора содержится г KIO3
Откуда:
Вычислим нормальность 10-процентного раствора йодата калия (KIO3), по формуле:
Рассчитаем молярную массу йодата калия (KIO3):
M (KIO3) = 39 + 127 + 3 ∙ 16 = 214 (г/моль).
Рассчитаем молярную массу эквивалента йодата калия (KIO3) по формуле:
Фактор эквивалентности (fэкв) – число, показывающее какая доля частицы (атома, молекулы) этого вещества равноценна одному иону водорода (H+) в реакциях обмена или одному электрону в окислительно-восстановительных реакциях.
Учитывая, что по условию задачи йодат калия (KIO3) восстанавливается до свободного йода:
следовательно, fэкв = 1/5, рассчитаем молярную массу эквивалента йодата калия (KIO3):
MЭ (KIO3) = 214 ∙ 1/5 = 42,8 (г/моль).
Вычислим нормальность 10-процентного раствора йодата калия (KIO3):
Ответ: нормальность йодата калия = 2,458 моль-экв/л.