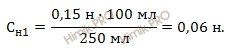Определите нормальную концентрацию (молярная концентрация эквивалента) раствора соляной кислоты (HCl), если на нейтрализацию 250 миллилитров ее потребовалось 100 миллилитров 0,15 н раствора гидроксида натрия (NaOH).
Решение задачи
Напомню, что под нормальной концентрацией понимают количество грамм-эквивалентов данного вещества, содержащегося в 1 л раствора. Нормальную концентрацию выражают в моль-экв/л или используют сокращение «н», «N»
По условию задачи протекает реакция нейтрализации соляной кислоты (HCl) раствором гидроксида натрия (NaOH):
Существует правило: растворы разной нормальности реагируют между собой в объемах обратно пропорциональных их нормальностям:
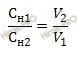
CH1 – нормальная концентрация раствора соляной кислоты (HCl);
V1 – объем раствора соляной кислоты (HCl);
CH2 – нормальная концентрация раствора гидроксида натрия (NaOH);
V2 – объем раствора гидроксида натрия (NaOH).
Запишем формулу расчета нормальной концентрации раствора соляной кислоты (HCl):
Таким образом, получаем:
Ответ: нормальная концентрация раствора соляной кислоты равна 0,06 н.
Загрузить PDF
Загрузить PDF
Нормальность отображает концентрацию кислоты или щелочи в растворе. Чтобы узнать нормальность раствора, в расчетах можно использовать как молярность, так и эквивалентную массу молекулы. Если вы решили использовать молярность, используйте формулу N = M(n), где M — это молярность, а n — количество молекул водорода или гидроксида. Если же вы решили использовать эквивалентную массу, используйте формулу N = eq ÷ V, где eq — это количество эквивалентов, а V — объем раствора.
-
1
Сложите молярную массу всех компонентов раствора. Найдите элементы химической формулы на периодической таблице, чтобы узнать их атомную массу, которая соответствует молярной. Запишите молярную массу каждого элемента и умножьте ее на количество этих элементов. Сложите молярную массу всех компонентов, чтобы узнать общую молярную массу.[1]
- Например, если необходимо узнать молярную массу серной кислоты (H2SO4), узнайте молярную массу водорода (1 г), серы (3 г) и кислорода (16 г).
- Умножьте массу на количество компонентов в составе. В нашем примере присутствует 2 атома водорода и 4 атома кислорода. Общая молярная масса водорода равна 2 x 1 г = 2 г. Молярная масса кислорода в этом растворе будет равна 4 x 16 г = 64 г.
- Сложите все молярные массы вместе. У вас получится 2 г + 32 г + 64 г = 98 г/моль.
- Если вы уже знаете молярность искомого раствора, перейдите сразу к Шагу 4.
-
2
Разделите фактическую массу раствора на молярную массу. Узнайте фактическую массу раствора. Она будет указана либо на емкости с раствором, либо в самой задаче. После этого разделите массу раствора на общую молярную массу, найденную ранее. Результатом станет количество молей в растворе, после которого должно быть написано «моль».[2]
- Например, если вы пытаетесь узнать нормальность 100 г H2SO4, которую растворили в 12 литрах жидкости, используйте фактическую массу и разделите ее на молярную. В результате у вас выйдет: 100 г ÷ 98 г/моль = 1,02 моль.
- 1 моль равен 6.02 x 1023 атомам или молекулам раствора.
-
3
Разделите результат на объем раствора в литрах, чтобы узнать молярность. Возьмите только что вычисленное количество молей в растворе и разделите его на общий объем измеряемого раствора. В результате вы узнаете молярность (M), с помощью которой можно узнать концентрацию раствора.[3]
- Исходя из нашего примера, получится такая формула: 1.02 моль ÷ 12 л = 0.085 M.
Совет: обязательно переведите объем раствора в литры, если еще этого не сделали. В противном случае вы получите неправильный ответ.
-
4
Умножьте молярность на количество молекул водорода или гидроксида. Взгляните на химическую формулу, чтобы узнать количество атомов водорода (H) в кислоте или молекул гидроксида в (ОН) в основании. Затем умножьте молярность раствора на количество молекул водорода или гидроксида в этом растворе, чтобы узнать нормальную концентрацию, или нормальность. В конце ответа напишите сокращение «N».[4]
- В нашем примере у серной кислоты (H2SO4) 2 атома водорода. Значит формула будет такой: 0,085 M x 2 = 0,17 N.
- В другом примере у гидроксида натрия (NaOH) с молярностью 2 M всего 1 молекула гидроксида. Следовательно, формула будет следующей: 2 M x 1 = 2 N.
Реклама
-
1
Узнайте общую молярную массу раствора. Взгляните на химическую формулу раствора и найдите каждый элемент в периодической таблице. Запишите молярную массу каждого элемента и умножьте ее на количество этих элементов в формуле. Сложите вместе все молярные массы, чтобы узнать общую молярную массу в граммах.[5]
- Например, если вы хотите узнать молярную массу Ca(OH)2,тогда узнайте молярную массу кальция (40 г), кислорода (16 г) и водорода (1 г).
- В формуле 2 атома кислорода и водорода. Общая масса кислорода будет следующей: 2 x 16 г = 32 г. Молярная масса водорода будет равна: 2 x 1 г = 2 г.
- Сложите вместе все молярные массы, чтобы получить 40 г + 32 г + 2 г = 74 г/моль.
-
2
Разделите молярную массу на количество молекул водорода или гидроксида. Узнайте количество атомов водорода (H) в кислоте или молекул гидроксида (ОН) в основании. Разделите только что полученную общую молярную массу на количество атомов или молекул, чтобы узнать вес 1 эквивалента, который будет равен массе 1 моли водорода или гидроксида. В конце ответа напишите сокращение «Г.-э.», означающее массу эквивалента.[6]
- В нашем примере у Ca(OH)2 2 две молекулы водорода, значит, масса эквивалента будет равна 74 г/моль ÷ 2 = 37 Г.-э.
-
3
Разделите фактическую массу раствора на массу эквивалента. После того, как вы узнаете массу эквивалента, разделите ее на массу раствора, которая указана на емкости с раствором или в решаемой задаче. Ответом станет количество эквивалентов в растворе, чтобы вы потом смогли рассчитать нормальность. В конце ответа поставьте сокращение «э.»[7]
- Если в нашем примере 75 г Ca(OH)2, то формула будет такой: 75 г ÷ 37 Г.-э = 2,027 э.
-
4
Разделите число эквивалентов на объем раствора в литрах. Узнайте общий объем раствора и запишите ответ в литрах. Возьмите только что полученное количество эквивалентов и разделите его на объем раствора, чтобы узнать нормальность. В конце ответа поставьте сокращение «N».[8]
- Если в растворе объемом 8 л находится 75 г Ca(OH)2, тогда разделите количество эквивалентов на объем следующим способом: 2,027 э. ÷ 8 л = 0,253 N.
Реклама
Советы
- Нормальная концентрация, или нормальность, обычно используется для измерения кислот и оснований. Если вам нужно определить концентрацию другого раствора, для этого, как правило, измеряют молярность.
Реклама
Что вам понадобится
- Периодическая таблица
- Калькулятор
Об этой статье
Эту страницу просматривали 92 249 раз.
Была ли эта статья полезной?
Думаю, что данную химическую задачу можно решить по действиям.
Дано:
V (р-ра KOH) = 24,85 мл;
T (KOH) = 0,02806 г/мл (титр раствора гидроксида калия);
V (р-ра HCl) = 25 мл = 0,025 л.
Найти: CN (HCl) — ?
Решение:
1) Пишем уравнение химической реакции титрования раствора гидроксида калия (едкого кали) соляной кислотой:
KOH + HCl = KCl + H2O.
2) Находим массу чистого гидроксида калия в титруемом растворе:
m (KOH) = V (р-ра KOH) * T (KOH) = 24,85 мл * 0,02806 г/мл = 0,6973 г.
3) Находим количество вещества едкого кали, бывшего в оттитрованном растворе:
v (ню) (KOH) = m(KOH)/M(KOH) = 0,6973 г : 56 г/моль = 0,01245 моль.
4) Согласно уравнению реакции, отношение коэффициента перед HCl к коэффициенту перед KOH равно единице (1 : 1 = 1). Значит, количество вещества HCl, ушедшей на титрование, будет равно количеству оттитрованного KOH: v (ню) (HCl) = v (ню) (KOH) = 0,01245 моль.
5) Находим нормальную концентрацию HCl, учитывая то, что число эквивалентности соляной кислоты всегда равно единице:
CN (HCl) = z * [v (ню) (HCl)/(V(р-ра HCl))] = 1 * (0,01245 моль)/(0,025 л) = 0,498 моль-экв/л.
Ответ: CN (HCl) = 0,498 моль-экв/л. Если же нужно найти нормальную концентрацию в грамм-эквивалентах на литр, то необходимо полученное в ответе число домножить на молярную массу соляной кислоты, то есть на 36,5 г/моль. Получится: 0,498 моль-экв/л * 36,5 г/моль = 18,177 г-экв/л.
Способы выражения концентрации растворов
Существуют
различные способы выражения состава раствора. Наиболее часто используют
массовую долю растворённого вещества, молярную и нормальную
концентрацию.
Массовая доля растворённого вещества w(B) — это безразмерная величина, равная отношению массы растворённого вещества к общей массе раствора m:
w(B)= m(B) / m
Массовую долю растворённого вещества w(B) обычно выражают в долях единицы или в процентах. Например, массовая доля растворённого вещества — CaCl2
в воде равна 0,06 или 6%. Это означает,что в растворе хлорида кальция
массой 100 г содержится хлорид кальция массой 6 г и вода массой 94 г.
Пример
Сколько грамм сульфата натрия и воды нужно для приготовления 300 г 5% раствора?
Решение
m(Na2SO4) = w(Na2SO4) / 100 = (5300) / 100 = 15 г
где w(Na2SO4) — массовая доля в %,
m — масса раствора в г
m(H2O) = 300 г — 15 г = 285 г.
Таким образом, для приготовления 300 г 5% раствора сульфата натрия надо взять 15 г Na2SO4 и 285 г воды.
Молярная концентрация C(B) показывает, сколько моль растворённого вещества содержится в 1 литре раствора.
C(B) = n(B) / V = m(B) / (M(B)V),
где М(B) — молярная масса растворенного вещества г/моль.
Молярная концентрация измеряется в
моль/л и обозначается «M». Например, 2 MNaOH — двухмолярный раствор
гидроксида натрия. Один литр такого раствора содержит 2 моль вещества
или 80 г (M(NaOH) = 40 г/моль).
Пример
Какую массу хромата калия K2CrO4 нужно взять для приготовления 1,2 л 0,1 М раствора?
Решение M(K2CrO4) = C(K2CrO4)
V M(K2CrO4) = 0,1 моль/л 1,2 л 194 г/моль = 23,3 г.
Таким образом, для приготовления 1,2 л 0,1 М раствора нужно взять 23,3 г K2CrO4 и растворить в воде, а объём довести до 1,2 литра.
Концентрацию раствора можно выразить
количеством молей растворённого вещества в 1000 г растворителя. Такое
выражение концентрации называют моляльностью раствора.
Нормальность
раствора обозначает число грамм-эквивалентов данного вещества в одном
литре раствора или число миллиграмм-эквивалентов в одном миллилитре
раствора.
Грамм — эквивалентом вещества
называется количество граммов вещества, численно равное его
эквиваленту. Для сложных веществ — это количество вещества,
соответствующее прямо или косвенно при химических превращениях 1 грамму
водорода или 8 граммам кислорода.
Эоснования = Моснования / число замещаемых в реакции гидроксильных групп
Экислоты = Мкислоты / число замещаемых в реакции атомов водорода
Эсоли = Мсоли / произведение числа катионов на его заряд
Пример
Вычислите значение грамм-эквивалента (г-экв.) серной кислоты, гидроксида кальция и сульфата алюминия.
Э H2SO4 = М H2SO4 / 2 = 98 / 2 = 49 г
Э Ca(OH)2 = М Ca(OH)2 / 2 = 74 / 2 = 37 г
Э Al2(SO4)3 = М Al2(SO4)3 / (23) = 342 / 2= 57 г
Величины нормальности обозначают буквой «Н». Например, децинормальный раствор серной кислоты обозначают «0,1 Н раствор H2SO4«.
Так как нормальность может быть определена только для данной реакции,
то в разных реакциях величина нормальности одного и того же раствора
может оказаться неодинаковой. Так, одномолярный раствор H2SO4 будет однонормальным, когда он предназначается для реакции со щёлочью с образованием гидросульфата NaHSO4, и двухнормальным в реакции с образованием Na2SO4.
Пример
Рассчитайте молярность и нормальность 70%-ного раствора H2SO4 (r = 1,615 г/мл).
Решение
Для вычисления молярности и нормальности надо знать число граммов H2SO4 в 1 л раствора. 70% -ный раствор H2SO4 содержит 70 г H2SO4 в 100 г раствора. Это весовое количество раствора занимает объём
V = 100 / 1,615 = 61,92 мл
Следовательно, в 1 л раствора содержится 701000 / 61,92 = 1130,49 г H2SO4
Отсюда молярность данного раствора равна: 1130,49 / М (H2SO4) =1130,49 / 98 =11,53 M
Нормальность этого раствора (считая, что кислота используется в реакции в качестве двухосновной) равна 1130,49 / 49 =23,06 H
Пересчет концентраций растворов из одних единиц в другие
При пересчете процентной
концентрации в молярную и наоборот, необходимо помнить, что процентная
концентрация рассчитывается на определенную массу раствора, а молярная
и нормальная — на объем, поэтому для пересчета необходимо знать
плотность раствора. Если мы обозначим: с — процентная концентрация; M —
молярная концентрация; N — нормальная концентрация; э — эквивалентная
масса, r — плотность раствора; m — мольная масса, то формулы для пересчета из процентной концентрации будут следующими:
M = (cp 10) / m
N = (cp 10) / э
Этими же формулами можно воспользоваться, если нужно пересчитать нормальную или молярную концентрацию на процентную.
Пример 1
Какова молярная и нормальная концентрация 12%-ного раствора серной кислоты, плотность которого р = 1,08 г/см3?
Решение
Мольная масса серной кислоты равна 98. Следовательно,
m(H2SO4) = 98 и э(H2SO4) = 98 : 2 = 49.
Подставляя необходимые значения в формулы, получим:
а) Молярная концентрация 12% раствора серной кислоты равна
M = (121,08 10) / 98 = 1,32 M
б) Нормальная концентрация 12% раствора серной кислоты равна
N = (121,08 10) / 49 = 2,64 H.
Иногда в лабораторной практике
приходится пересчитывать молярную концентрацию в нормальную и наоборот.
Если эквивалентная масса вещества равна мольной массе (Например, для
HCl, KCl, KOH), то нормальная концентрация равна молярной концентрации.
Так, 1 н. раствор соляной кислоты будет одновременно 1 M раствором.
Однако для большинства соединений эквивалентная масса не равна мольной
и, следовательно, нормальная концентрация растворов этих веществ не
равна молярной концентрации.
Для пересчета из одной концентрации в другую можно использовать формулы:
M = (NЭ) / m
N = (Mm) / Э
Пример
Нормальная концентрация 1 М раствора серной кислоты N = (198) / 49 = 2 H.
Пример
Молярная концентрация 0,5 н. Na2CO3
M = (0,553) / 106 = 0,25 M.Упаривание, разбавление, концентрирование,
смешивание растворов
Имеется mг исходного раствора с массовой долей растворенного вещества w1 и плотностью r1.
Упаривание раствора
В результате упаривания исходного раствора его масса уменьшилась на Dm г. Определить массовую долю раствора после упаривания w2
Решение
Исходя из определения массовой доли, получим выражения для w1 и w2 (w2 > w1):
w1 = m1 / m
(где m1 — масса растворенного вещества в исходном растворе)
m1 = w1m
w2 = m1 / (m — Dm) = (w1m) / (m — Dm)
Пример
Упарили 60 г 5%-ного раствора сульфата меди до 50 г. Определите массовую долю соли в полученном растворе.
m = 60 г; Dm = 60 — 50 = 10 г; w1 = 5% (или 0,05)
w2 = (0,0560) / (60 — 10) = 3 / 50 = 0,06 (или 6%-ный)
Концентрирование раствора
Какую массу вещества (X г) надо
дополнительно растворить в исходном растворе, чтобы приготовить раствор
с массовой долей растворенного вещества w2?
Решение
Исходя из определения массовой доли, составим выражение для w1 и w2:
w1 = m1 / m2, (где m1 — масса вещества в исходном растворе).
m1 = w1m
w2 = (m1+x) / (m + x) = (w1m + x) / (m+x)
Решая полученное уравнение относительно х получаем:
w2m + w2 x = w1 m + x
w2m — w1 m = x — w2 x
(w2 — w1)
m = (1 — w2) x
x = ((w2 — w1)m) / (1 — w2)
Пример
Сколько граммов хлористого калия надо растворить в 90 г 8%-ного раствора этой соли, чтобы полученный раствор стал 10%-ным?
m = 90 г
w1 = 8% (или 0,08), w2 = 10% (или 0,1)
x = ((0,1 — 0,08) 90) / (1 — 0,1) = (0,02 90) / 0,9 = 2 г
Смешивание растворов с разными концентрациями
Смешали m1 граммов раствора №1 c массовой долей вещества w1 и m2 граммов раствора №2 c массовой долей вещества w2. Образовался раствор (№3) с массовой долей растворенного вещества w3. Как относятся друг к другу массы исходных растворов?
Решение
Пусть w1 > w2, тогда w1 > w3 > w2. Масса растворенного вещества в растворе №1 составляет w1
m1, в растворе №2 — w2 m2. Масса образовавшегося раствора (№3) — (m1 — m2). Сумма масс растворенного вещества в растворах №1 и №2 равна массе этого вещества в образовавшемся растворе (№3):
w 1m1 + w 2 m2 = w3 (m1 + m2)
w1m1 + w 2 m2 = w3 m1 + w3 m2
w 1m1 — w 3 m1 = w3 m2 — w2 m2
(w1— w3)m1 = (w3— w2) m2
m1 / m2 = (w3— w2 ) / (w1— w3)
Таким образом, массы смешиваемых растворов m1 и m2 обратно пропорциональны разностям массовых долей w1 и w2 смешиваемых растворов и массовой доли смеси w3. (Правило смешивания).
Для облегчения использования правила смешивания применяют правило креста :
| w1 | (w3 — w2) / |
m1 | |
| w3 | |||
| / w2 |
(w1 — w3) | m2 |
m1 / m2 = (w3 — w2) / (w1 — w3)
Для этого по диагонали из большего значения концентрации вычитают меньшую, получают (w1 — w3), w1 > w3 и (w3 — w2), w3 > w2. Затем составляют отношение масс исходных растворов m1 / m2 и вычисляют.
Пример
Определите массы исходных растворов
с массовыми долями гидроксида натрия 5% и 40%, если при их смешивании
образовался раствор массой 210 г с массовой долей гидроксида натрия 10%.
| 40% | 5% / |
m1 | |
| 10% | |||
| / 5% |
30% | m2=210-m1 |
5 / 30 = m1 / (210 — m1)
1/6 = m1 / (210 — m1)
210 — m1 = 6m1
7m1 = 210
m1 =30 г; m2 = 210 — m1 = 210 — 30 = 180 г
Разбавление раствора
Исходя из определения массовой доли,
получим выражения для значений массовых долей растворенного вещества в
исходном растворе №1 (w1) и полученном растворе №2 (w2):
w1 = m1 / (r1V1) откуда V1= m1 /( w1 r1)
w2 = m2 / (r2V2)
m2 = w2r2 V2
Раствор №2 получают, разбавляя раствор №1, поэтому m1 = m2. В формулу для V1 следует подставить выражение для m2. Тогда
V1= (w2r2 V2) / (w1 r1)
m2 = w2 • r2 • V2
или
| w1 • r1 • V1 | = | w2 • r2 • V2 |
| m1(раствор) | m2(раствор) |
m1(раствор) / m2(раствор) = w2 / w1
При одном и том же количестве растворенного вещества массы растворов и их массовые доли обратно пропорциональны друг другу.
Пример
Определите массу 3%-ного раствора пероксида водорода, который можно получить разбавлением водой 50 г его 3%-ного раствора.
m1(раствор) / m2(раствор) = w2 / w1
50 / x = 3 / 30
3x = 50
30 = 1500
x = 500 г
Последнюю задачу можно также решить, используя «правило креста»:
| 30% | 3% / |
50 | |
| 3% | |||
| / 0% |
27% | X |
3 / 27 = 50 / x
x = 450 г воды
450 г + 50 г = 500 г
…
Существует множество способов измерить концентрацию раствора. Это так называемые способы выражения концентрации раствора.
Концентрация раствора — это количество вещества, находящегося в единице объема или массы раствора.
Что такое раствор
Среди окружающих нас веществ, лишь немногие представляют собой чистые вещества. Большинство являются смесями, состоящими из нескольких компонентов, которые могут находиться в одном или различных фазовых состояниях.
Смеси, имеющие однородный состав являются гомогенными, неоднородный состав – гетерогенными.
Иначе, гомогенные смеси, называют растворами, в которых одно вещество полностью растворяется в другом (растворителе). Растворитель – это тот компонент раствора, который при образовании раствора сохраняет свое фазовое состояние. Он обычно находится в наибольшем количестве.
Существуют растворы газовые, жидкие и твердые. Но более всего распространены жидкие растворы, поэтому, в данном разделе, именно на них мы сосредоточим свое внимание.
Концентрацию раствора можно охарактеризовать как:
- качественную
- количественную.
Качественная концентрация характеризуется такими понятиями, как разбавленный и концентрированный раствор.
С этой точки зрения растворы можно классифицировать на:
- Насыщенные – растворы с максимально возможным количеством растворенного вещества. Количество растворяемого вещества, необходимое для получения насыщенного раствора определяет растворимость этого вещества.
- Ненасыщенные – любые растворы, которые все еще могут растворять введенное вещество.
- Пересыщенные – растворы, в которых растворено больше вещества, чем максимально возможное. Такие растворы очень нестабильны и в определенных условиях растворенное вещество будет выкристаллизовываться из него, до тех пор, пока не образуется насыщенный раствор.
Количественная концентрация выражается через молярную, нормальную (молярную концентрацию эквивалента), процентную, моляльную концентрации, титр и мольную долю.
Способы выражения концентрации растворов
Молярная концентрация растворов (молярность)
Наиболее распространенный способ выражения концентрации растворов – молярная концентрация или молярность. Она определяется как количество молей n растворенного вещества в одном литре раствора V. Единица измерения молярной концентрации моль/л или моль ·л-1:
См = n/V
Раствор называют молярным или одномолярным, если в 1 литре раствора растворено 1 моль вещества, децимолярным – растворено 0,1 моля вещества, сантимолярным — растворено 0,01 моля вещества, миллимолярным — растворено 0,001 моля вещества.
Термин «молярная концентрация» распространяется на любой вид частиц.
Вместо обозначения единицы измерения — моль/л, возможно такое ее обозначение – М, например, 0,2 М HCl.
Молярная концентрация эквивалента или нормальная концентрация растворов (нормальность).
Понятие эквивалентности мы уже вводили. Напомним, что эквивалент – это условная частица, которая равноценна по химическому действию одному иону водорода в кислотоно-основных реакциях или одному электрону в окислительно – восстановительных реакциях.
Например, эквивалент KMnO4 в окислительно – восстановительной реакции в кислой среде равен 1/5 (KMnO4).
Еще одно необходимое понятие — фактор эквивалентности – это число, обозначающее, какая доля условной частицы реагирует с 1 ионом водорода в данной кислотоно-основной реакции или с одним электроном в данной окислительно – восстановительной реакции.
Он может быть равен 1 или быть меньше 1. Фактор эквивалентности, например, для KMnO4 в окислительно – восстановительной реакции в кислой среде составляет fэкв(KMnO4) = 1/5.
Следующее понятие – молярная масса эквивалента вещества х. Это масса 1 моля эквивалента этого вещества, равная произведению фактора эквивалентности на молярную массу вещества х:
Мэ = fэкв· М(х)
Молярная концентрация эквивалента (нормальность) определяется числом молярных масс эквивалентов на 1 литр раствора.
Эквивалент определяется в соответствии с типом рассматриваемой реакции. Единица измерения нормальной концентрации такая же как и у молярной концентрации — моль/л или моль·л-1
Сн = nэ/V
Для обозначения нормальной концентрации допускается сокращение «н» вместо «моль/л».
Процентная концентрация раствора или массовая доля
Массовая концентрация показывает сколько единиц массы растворенного вещества содержится в 100 единицах массы раствора.
Это отношение массы m(х) вещества x к общей массе m раствора или смеси веществ:
ω(х) = m(х)/m
Массовую долю выражают в долях от единицы или процентах.
Моляльная концентрация раствора
Моляльная концентрация раствора b(x) показывает количество молей n растворенного вещества х в 1 кг. растворителя m. Единица измерения моляльной концентрации — моль/кг :
b(x) = n(x)/m
Титр раствора
Титр раствора показывает массу растворенного вещества х, содержащуюся в 1 мл. раствора. Единица измерения титра — г/мл:
Т(х) = m(х)/V,
Мольная или молярная доля
Мольная или молярная доля α(х) вещества х в растворе равна отношению количества данного вещества n(х) к общему количеству всех веществ, содержащихся в растворе Σn:
α(х) = n(х)/Σn
Между приведенными способами выражения концентраций существует взаимосвязь, которая позволяет, зная одну единицу измерения концентрации найти (пересчитать) ее в другие единицы. Существуют формулы, позволяющие провести такой пересчет, которые, в случае необходимости, вы сможете найти в сети. В разделе задач показано, как произвести такой пересчет, не зная формул.
Пример перевода процентной концентрации в молярную, нормальную концентрацию, моляльность, титр
Дан раствор объемом 2 л с массовой долей FeSO4 2% и плотностью 1029 кг/м3. Определить молярность, нормальность, моляльность и титр этого раствора раствора.
Решение.
1. Рассчитать молярную массу FeSO4:
M (FeSO4) =
56+32+16·4 = 152 г/моль
2. Рассчитать молярную массу эквивалента:
Мэ = fэкв·
М(FeSO4) = 1/2·152
= 76 г/моль
3. Найдем m раствора объемом 2 л
m = V·ρ = 2·10-3 ·1029
= 2,06 кг
4. Найдем массу 2 % раствора по формуле:
m(FeSO4) = ω(FeSO4) · mр-ра
m(FeSO4) =
0,02·2,06 = 0,0412 кг = 41,2 г
5. Найдем молярность, которая определяется как количество молей растворенного вещества в одном литре раствора:
n = m/М
n = 41,2/152 = 0,27 моль
См = n/V
См = 0,27/2 = 0,135 моль/л
6. Найдем нормальность:
nэ = m/Мэ
nэ = 41,2/76 = 0,54 моль
Сн = nэ/V
Сн = 0,54/2 = 0,27 моль/л
7. Найдем моляльность раствора. Моляльная концентрация равна:
b (x) = n(x)/m
Масса растворителя, т.е.
воды в растворе равна:
mH2O = 2,06-0,0412
= 2,02 кг
b
(FeSO4) = n(FeSO4)/m = 0,27/2,02 = 0,13 моль/кг
8. Найдем титр раствора, который показывает какая масса вещества содержится в 1 мл раствора:
Т(х) = m (х)/V
Т(FeSO4) = m (FeSO4)/V = 41,2/2000 = 0,0021 г/мл
Еще больше задач приведены в разделе Задачи: Концентрация растворов, Правило креста