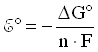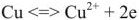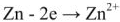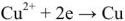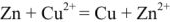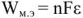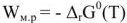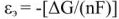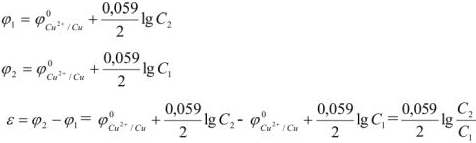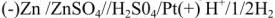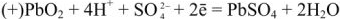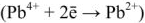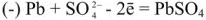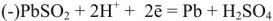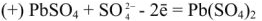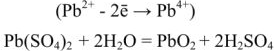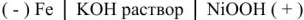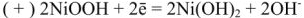Напряжение гальванического элемента
— это предельное значение разности
электродных потенциалов (напряжений)
элемента (
),
при токе через элемент, стремящийся к
нулю.
Оно равно разности равновесных потенциалов
катода и анода элемента.
По уравнению, связывающему химическую
и электрическую энергии при известных
значениях энергии Гиббса реакции G,
рассчитывают величину
:
,
где n — число электронов, участвующих в
процессе;
F — постоянная Фарадея, равная 96500 Кл/моль;
—
напряжение гальванического элемента.
При стандартных условиях, т.е. при
концентрациях реагентов и продуктов
реакции, равных 1 моль/л, температуре
298 К и давлении 1,01· 105 Па:
,
где
—
стандартное напряжение гальванического
элемента.
Откуда стандартная энергия Гиббса
реакции элемента Даниэля-Якоби:
G(298 К) = -212,3 кДж/моль
= -212,3 кВт· с/моль.
Стандартное напряжение элемента
Даниэля-Якоби равно:
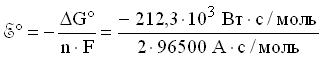
8.1.4. ВОДОРОДНАЯ ШКАЛА
ПОТЕНЦИАЛОВ
Наиболее часто в качестве электрода
сравнения (эталона) принято использовать
водородный электрод. Поэтому измеряют
напряжение гальванического элемента,
составленного из исследуемого и
стандартного водородного электрода,
стандартный электродный потенциал
которого принимают равным нулю. Схему
такого элемента записывают следующим
образом: слева — водородный электрод,
справа — измеряемый электрод. Например,
схема гальванического элемента для
измерения потенциала цинкового электрода
имеет вид:
H2, Pt | H+ || Zn2+ | Zn,
а схема элемента для измерения потенциала
медного электрода:
H2, Pt | H+ || Cu2+ | Cu,
Напряжение гальванического элемента
равна разности потенциалов правого и
левого электродов:
А так как потенциал левого электрода
условно принимают равным нулю, то
напряжение измеряемого элемента будет
равна потенциалу правого электрода,
т.е. стандартному электродному потенциалу.
Для водородно-цинкового элемента
напряжение равно:
т.е. водородный электрод заряжен менее
отрицательно, чем цинковый. Таким
образом, во внешней цепи электроны
перемещаются от цинкового электрода к
водородному. Для медно-водородного
электрода:
т.е. медный электрод заряжен более
положительно, чем водородный. Таким
образом, во внешней цепи электроны
перемещаются от водородного электрода
к медному. Тогда стандартное напряжение
для элемента Даниэля-Якоби равно:
Стандартные электродные потенциалы
металлических электродов в водных
растворах приведены в справочной
литературе. Величины стандартных ЭП
металлов () являются
мерой восстановительной способности
их атомов и мерой окислительной
способности ионов металлов. Чем более
отрицательное значение имеет потенциал
системы Ме/Меn+, тем более сильной
восстановительной способностью обладает
атом. И наоборот, чем более положителен
потенциал металлического электрода,
тем более сильной окислительной
способностью обладают его ионы. Например,
к наиболее сильным восстановителям (в
водном растворе) относится литий
(Li/Li+
= -3,04 B), а к наиболее сильным окислителям
— ионы золота Au3+, Au+ (Au/Au3+
= +1,50 B, Au/Au+
= +1,69 B).
8.1.5. ПОТЕНЦИАЛЫ
МЕТАЛЛИЧЕСКИХ ЭЛЕКТРОДОВ
Электродный потенциал любой
окислительно-восстановительной системы,
находящейся в нестандартных условиях,
можно рассчитать по уравнению Нернста:
где: — электродный
потенциал окислительно-восстановительного
электрода, В;
— стандартный электродный потенциал
этого электрода, В;
R — универсальная газовая постоянная,
равная 8,314 Дж/моль· К
T — температура, K;
n — число электронов в уравнении электродной
реакции;
F — число Фарадея, равное 96500 Кл/моль ;
ок., восст.
— активности окисленной формы восстановителя
(Меn+) и восстановленной формы
окислителя (Ме) в электродной реакции.
Подставив в уравнение Нернста T = 298 K, R,
F и введя множитель 2,3 (переход к десятичным
логарифмам), получим:
Уравнение Нернста для металлического
электрода имеет вид:
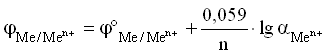
Для разбавленных растворов, в которых
активности мало отличаются от концентрации
(a С):
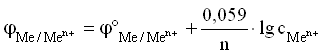
Величина Me/Men+
называется стандартным ЭП металлического
электрода. Значение ЭП металлического
электрода равно величине стандартного
ЭП металлического электрода при
концентрации ионов металла в растворе,
равной 1 моль/л. Таким образом, стандартный
электродный потенциал (напряжение) —
напряжение гальванического элемента,
содержащего в качестве левого электрода
стандартный водородный электрод, а в
качестве правого электрода — измеряемый
электрод, в условиях , когда активности
всех участников окислительно-восстановительной
реакции равны единице, а внешнее давление
составляет 1 атм.
8.1.6. ПОТЕНЦИАЛЫ ГАЗОВЫХ
ЭЛЕКТРОДОВ
Существуют металлы, отличающиеся высокой
химической стойкостью (платина, золото
и др.), которые практически не могут
посылать свои ионы в раствор. Электроды,
изготовленные из подобных металлов,
называют инертными.
Однако такие металлы могут адсорбировать
молекулы, атомы и ионы других веществ.
Например, платина адсорбирует на своей
поверхности многие газы и, в частности,
водород. Если такая платиновая пластина,
насыщенная адсорбированным водородом
находится в растворе, содержащем катионы
H+ (H3O+), то на поверхности
ее будет протекать следующий процесс:
Такой электрод называется водородным
(H2, Pt | 2H+). Водородный электрод
(рис.8.3) относится к газовым электродам.
В этом электроде скачок потенциала
отвечает установлению равновесия между
катионами H+ и молекулами H2
через посредство платиновой поверхности,
имеющей свободные электроны и адсорбирующей
водород.
Рис. 8.3. Схема водородного электрода.
Уравнение Нернста для водородного
электрода имеет вид:
H2/2H+ = -0,059· lg c(H+)
Учитывая, что lg c(H+) = -pH, получим:
H2/2H+ = -0,059· рН
Аналогично водородному электроду можно
создать кислородный электрод. Для этого
металлическую пластину, например, Pt,
необходимо привести в контакт с O2
и раствором, содержащим ионы, которые
образуются при восстановлении кислорода
(ионы OH—)
O2, Pt | OH—
На кислородном электроде протекает
реакция, выражаемая уравнением:
Можно рассчитать потенциал кислородного
электрода при любых значениях рН и
давлении кислорода. Если p = 1 атм (101 кПа),
то
OH—/O2 = 1,23 – 0,059· pH
Зависимость потенциала водородного и
кислородного электродов от рН растворов
приведена на рис.8.4
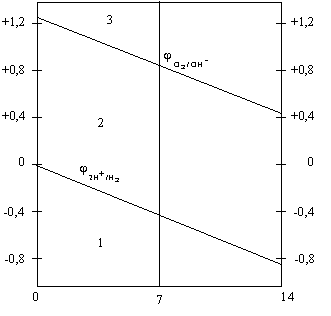
Рис. 8.4. Зависимость потенциалов
водородного и кислородного электродов
от рН среды (диаграмма Пурбэ).
8.1.7.ПОЛЯРИЗАЦИЯ В
ЭЛЕКТРОХИМИЧЕСКИХ ПРОЦЕССАХ
Равновесные потенциалы электродов
могут быть определены в условиях
отсутствия в цепи тока. При прохождении
электрического тока потенциалы электродов
меняются. Это явление называют
поляризацией:
-
= i — p
,
где — поляризация;
i — потенциал электрода при
прохождении тока;
p — равновесный потенциал (i = 0).
Так как поляризация может наблюдаться
как на катоде, так и на аноде, то различают
катодную К
и анодную A
поляризации.
Любая электрохимическая реакция
многостадийна. Условно ее можно разбить
на 3 стадии: 1) подвод реагентов к электроду;
2) собственно электрохимическая реакция;
3) отвод продуктов реакции от электрода.
Если бы все эти стадии протекали
мгновенно, то потенциал электрода при
прохождении тока не изменялся бы и,
соответственно, поляризация была бы
равна нулю. Однако, все три стадии
протекают с конечными скоростями, причем
одна из них лимитирует всю реакцию и
для ее ускорения необходимо изменение
потенциала электрода, т.е. поляризация.
Следовательно, возникновение поляризации
обусловлено замедленностью отдельных
стадий электрохимического процесса.
Соответственно, в зависимости от
характера замедленной стадии на электроде
возникает или концентрационная, или
электрохимическая поляризация.
Изменение потенциала электрода вследствие
изменения концентрации реагентов в
приэлектродном слое при прохождении
тока называется концентрационной
поляризацией.
Изменение потенциала, обусловленное
замедленностью собственно электрохимических
стадий реакций, называется электрохимической
поляризацией (перенапряжением).
Потенциал катода в любой
электрохимической системе при прохождении
электрического тока становится более
отрицательным, а потенциал анода —
более положительным.
Графическую зависимость потенциала от
плотности тока называют поляризационной
кривой. На рис.8.5 представлены
поляризационные кривые электродов.
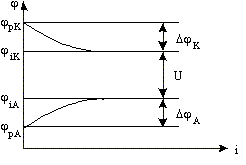
Рис. 8.5. Поляризационные кривые
электродов.
Плотность тока:
,
где I — сила тока, А;
S — площадь электродов, м2
Величину поляризации электрода можно
определить по разности между потенциалом
при прохождении тока и равновесным
потенциалом p.
А разность потенциалов катода и анода
при прохождении тока называется
напряжением.
U = iK — iA
Таким образом, напряжение гальванического
элемента при прохождении электрического
тока меньше его напряжения при I
0 вследствие поляризации электродов и
омических потерь.
U = Eэ — K
— A — I· R
Двойной электрический слой
Образование гальванического элемента
Схема гальванического элемента
Электроды в гальваническом элементе
Процессы на катоде
Процессы на аноде
Электроды сравнения
Водородный электрод
Хлорид-серебряный электрод
Электродные потенциалы металлов (ряд
напряжений)
ЭДС гальванического элемента
Условие образования гальванического
элемента
Поляризация в гальваническом элементе
Концентрационная поляризация
Электрохимическая поляризация
Способы уменьшения поляризации
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Гальванический элемент (гэ). Напряжение гальванического элемента
Гальванический элемент — это, прибор, который преобразует химическую энергию окислительно-восстановительной реакции в электрическую энергию.
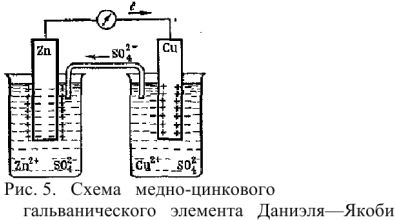
Схема простейшего ГЭ Даниэля-Якоби представлена на рис. 5.
Гальванический элемент состоит из двух электродов, каждый из которых опущен в сосуд с соответствующим раствором соли: цинковый электрод погружен в раствор соли 
Сосуды соединены электролитическим мостиком, заполненным концентрированным раствором электролита (например, 

На поверхности цинковой пластины возникает двойной электрический слой и устанавливается равновесие
В результате протекания этого процесса возникает электродный потенциал цинка. На поверхности медной пластины также возникает двойной электрический слой и устанавливается равновесие
поэтому возникает электродный потенциал меди. Потенциал цинкового электрода имеет более отрицательное значение, чем потенциал медного электрода, поэтому при замыкании внешней цепи, т.е. при соединении цинка с медью металлическим проводником, электроны будут переходит от цинка к меди. В результате перехода электронов от цинка к меди равновесие на цинковом электроде сместиться вправо, поэтому в раствор перейдет дополнительное количество ионов цинка. В то же время равновесие на медном электроде сместиться влево и произойдет разряд ионов меди.
Итак, при работе элемента Даниэля-Якоби протекают следующие процессы:
1) реакция окисления цинка
Процессы окисления в электрохимии получили название анодных процессов, а электроды, на которых идут процессы окисления, называют анодами;
2) реакция восстановления ионов меди
Процессы восстановления в электрохимии получили название электродных процессов, а электроды, на которых идут процессы восстановления, назвают катодами;
3) движение электронов во внешней цепи;
4) движение ионов в растворе: через электролитический мостик анионов 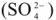
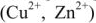
Вследствие этой химической реакции в гальваническом элементе возникает движение электронов во внешней цепи и ионов внутри элемента, т.е. электрический ток, поэтому суммарная химическая реакция, протекающая в гальваническом элементе, называется токообразующей.
При схематической записи, заменяющей рисунок гальванического элемента, границу раздела между проводником 1-го рода и проводником 2-го рода обозначают одной вертикальной чертой, а границу раздела между проводниками 2-го рода — двумя чертами. Схема элемента Даниэля-Якоби, например, записывается в виде:
для упрощения в таких схемах обычно опускается внешняя цепь. Как видно, в гальваническом элементе идет химическая реакция, а во внешней цепи элемента протекает электрический ток, т.е. в гальваническом элементе происходит превращение химической энергии в электрическую.
Электродвижущая сила. Напряжение элемента. Электрическая работа равна произведению разности потенциалов электродов на количество электричества. Максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента, называется электродвижущей силон (ЭДС) элемента. Она равна разности равновесных потенциалов катода и анода элемента.
=
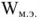
где 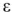
В то же время максимальная полезная работа 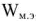
Так как 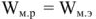
Значения термодинамических характеристик процесса получаются равными 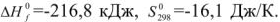
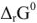
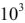
Согласно уравнения Нернста один и тот же электрод при различных концентрациях ионов имеет различное значение потенциала, поэтому возможны так называемые концентрационные ГЭ. Рассмотрим, например, ГЭ, составленный из двух медных электродов, опущенных в электролиты с разными концентрациями ионов 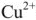
Схема такого ГЭ:
Положим, что 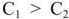
Работа в концентрационном ГЭ совершается не за счет реакции окисления восстановления, а за счет выравнивания концентрации растворов. Если концентрация электролитов отличаются в 10 раз, то напряжение (э.д.с.) ГЭ равна 0,0295 в, а если в 100 раз, то — 0,059 в.
Применяются для определения одной из концентраций 
Концентрационная и химическая поляризация электронов.
На медном катоде в замкнутом элементе происходит восстановление ионов меди. При этом концентрация их при электродном слое снижается и тем сильнее, чем больше сила тока. Это затрудняет протекание реакции восстановления, и скорость катодной реакции определяется скоростью диффузии ионов к электроду. Уменьшение концентрации катионов меди по формуле Нернста приводит к уменьшению величины потенциала меди. Цинковый анод растворяется и тем с большей скоростью, чем больше сила тока. Это приводит к накоплению ионов цинка в приэлектродном слое, в результате чего его потенциал смещается по указанной причине в положительную сторону. Электроды в этом случае поляризуются благодаря изменению концентрации ионов у их поверхности. Такая поляризация носит название концентрационный или диффузионный.
В ряде случаев кроме поляризации, при протекании тока имеет место и так называемая химическая поляризация. Для иллюстрации этого явления составим следующую цепь:
В данном случае на платине восстанавливаются не ее ионы, поскольку их нет в растворе, а ионы водорода до атомного водорода, который адсорбируется на платине и частично растворяется в ней, а также превращается в молекулярный водород. Платиновый электрод, таким образом, превратится в водородный, т.е. изменится химическая природа электрода. При этом его потенциал сместится в отрицательную сторону. Иными словами, произойдет химическая поляризация катода, которая, как и концентрационная, приводит к уменьшению напряжения гальванического элемента.
Классификация гальванических элементов
Гальванический элемент состоит из двух электродов: катода (+) и анода (-) и из одного или дух электролитов, разделенных между собой пористой перегородкой, ограничивающей их смешивание. Известны типы гальванических элементов: химические, концентрационные,
окислительно-восстановительные. В гальваническую пару можно сочетать также электроды, принадлежащие к различным видам. При таком сочетании электродов не представляется возможным классифицировать элементы, исходя из природы электродов. Классификация окажется очень громоздкой. Поэтому элементы подразделяют по другим признакам: по особенностям работы, назначению и конструкциям.
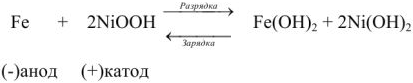
Гальванические элементы делят на первичные химические источники тока и вторичные. К первичным относятся вес ранее рассмотренные элементы. Их можно использовать только один раз. После разряда они становятся непригодными к дальнейшей работе.
К вторичным относят аккумуляторы (накопители электричества). Аккумулятор после разряда можно снова зарядить, г.е. превратить продукты реакции путем электролиза в исходные вещества. При этом электрическая энергия превращается в химическую.
Первичные источники тока в свою очередь делят на элементы с жидким электролитом (наливные) и «сухие» (непроливающиеся) элементы с загущенным электролитом. Сухие элементы можно подразделить по признаку катодных деполяризаторов на элементы с твердыми окислителями, воздушной системы и смешанной марганцово-воздушной системы.
Аккумуляторы. Аккумуляторы — обратимые гальванические элементы.
Вещества, из которых изготовляют электроды, и электролиты подобраны в аккумуляторах с таким расчетом, чтобы обратимость химических процессов при электролизе (зарядке) достигалась с минимальной потерей энергии на побочные реакции и в виде теплоты.
Понятно, что медно-цинковый элемент с двумя разделенными пористой перегородкой растворами не пригоден в качестве аккумулятора. Так как происходящие в нем диффузионные процессы необратимы. При этом восстановление ионов цинка до металлического при зарядке будет сопровождаться побочной реакцией восстановления водорода.
Из огромного количества исследованных гальванических элементов удовлетворяют указанным требованиям свинцовый аккумулятор Плантэ, железо-никелевый (кадмиево-никелевый) аккумулятор Эдиссона и серебряно-цинковый аккумулятор Андре.
Свинцовый аккумулятор (рис. 6) был изобретен в результате работ Якоби, Плате и братьев Тюдор. В незаряженном виде он состоит из свинцовых пластин, отлитых в виде решеток. Отверстия отрицательных решеток заполнены пастой из свинцового глета РЬО и воды, а положительных — суриком 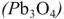

Перед использованием в аккумулятор наливают 30%-ый раствор серной кислоты.
При этом образуется гальваническая цепь:
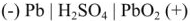

При разрядке аккумулятора на электродах протекают следующие реакции: на катоде
на аноде
Вещества катода и анода превращаются в сернокислый свинец, а химическая энергия — в электрическую.
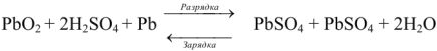
При зарядке аккумулятора на электродах протекают следующие реакции:
на катоде
на аноде
Суммируя процессы зарядки и разрядки, получим:
В гальваническом элементе катод заряжен положительно, а анод -отрицательно. При электролизе, наоборот, катод заряжен отрицательно, а анод -положительно. Однако в любом случае на катоде протекает реакция восстановления, а на аноде — окисления. При зарядке и разрядке аккумулятора полярность электродов остается неизменной.
Исходя из равновесных потенциалов 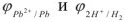
После того как на катоде закончится восстановление катионов свинца до металлического свинца, а на аноде — окисление 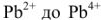
Емкость свинцового аккумулятора около 35вт/ч (20000 кулонов) на 1 кг веса. Последняя возрастает с повышением концентрации кислоты до некоторого предела; максимум емкости соответствует концентрации кислоты около 30% (плотность 1,224).
Свинцовый аккумулятор отдает около 80% подведенной к нему электроэнергии и дает примерно 4 а/ч на 1 дм2 поверхности пластин. Аккумулятор считают практически разряженным, если его напряжение на зажимах упало на 10% (от 2 в).
В щелочном аккумуляторе Эдиссона электродами служат порошкообразное железо и (гидрат окиси никеля, который частично дегидратируется до 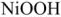
К электролиту часто добавляют гидрат окиси лития 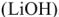
Электроды щелочных аккумуляторов изготавливают в виде пакетов из стальной стали с большим числом отверстий для прохода электролита к действующей массе, закладываемой в пакеты. При сборке пластины изолируют одну от другой эбонитовыми стержнями.
При разрядке на электродах протекают следующие процессы:
на катоде
на аноде
Напряжение щелочного аккумулятора равна 1,33 — 1,40 в.
При зарядке на катоде железо из гидрата закиси восстанавливается до металлического; на аноде 
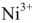
Суммарно процесс зарядки и разрядки можно изобразить следующим уравнением:
Максимальное напряжение при зарядке щелочного аккумулятора равно 1,8 в, конечное напряжение при разрядке 1 — 1,1 в. К.п.д. у щелочных аккумуляторов меньше, чем у свинцовых. Преимуществом щелочных аккумуляторов является их малый вес, простота ухода за ними, а также то обстоятельство, что случайные короткие замыкания не приносят такого вреда, как свинцовым аккумуляторам. При большой скорости образования сернокислого свинца он полу рыхлым, в результате чего электроды аккумулятора разрушаются.
Срок службы щелочных аккумуляторов в зависимости от электролита составляет 250-750 циклов.
Эта теория взята со страницы помощи по химии:
Онлайн помощь по химии
Возможно эти страницы вам помогут:
Э.Д.С. гальванического элемента определяется по формуле, применение которой рассмотрим в данной статье.
Содержание:
1.Что такое Э.Д.С. и от чего она зависит
2. Стандартные электродные потенциалы
2.1.Как устроен и как работает гальванический элемент с водородным электродом
2.2. Э.Д.С. гальванического элемента с водородным электродом
2.3. Э.Д.С. гальванического элемента определяется по формуле, учитывающей электродные потенциалы участников процесса
2.4. Ряд напряжений металлов. Что это такое и каково его значение
3.Примеры вычислений Э.Д.С. гальванического элемента и электродных потенциалов
Гальванический элемент является прибором, который позволяет при посредстве химической реакции получить электрическую энергию. А происходит это потому, что один металл готов отдать свои электроны другому, тот же, в свою очередь, их принять.
Но что обеспечивает такую готовность, какая сила заставляет эти электроны перемещаться?
Для сравнения способности одного металла отдавать свои электроны другому измеряют и рассчитывают электродвижущую силу (обозначим ее как Э.Д.С.)
Что такое Э.Д.С. и от чего она зависит
Сила, позволяющая перемещаться электронам по цепи в гальваническом элементе, называется электродвижущей силой (E), которая в данном случае означает то же, что и напряжение, и потенциал. Поэтому Э.Д.С. измеряется в вольтах.
Вспомним, что 1 вольт (В) представляет собой электродвижущую силу, которая позволяет заряду в 1 кулон (Кл) приобрести энергию в 1 джоуль (Дж).
ЭДС гальванического элемента определяется многими факторами:
— проводимым в элементе химическим процессом;
— концентрацией участников процесса (как реагентов, так и продуктов);
— температурой.
Если гальванический элемент работает в стандартных условиях, то его Э.Д.С. называется стандартной и обозначается Е°.
Стандартные электродные потенциалы
Еще со времен Галилея известно, что все в мире относительно. С тех пор любые события, процессы и явления мы можем рассматривать относительно других событий, процессов или явлений.
Чтобы понять, какова же Э.Д.С. конкретного металла, нужно сравнить ее с такой Э.Д.С., величина которой нам наверняка известна. Для этого был составлен гальванический элемент с газообразным водородом в качестве электрода.
Как устроен и как работает гальванический элемент с водородным электродом
Значение потенциала водородного электрода, с которым будут сравниваться величины измеряемых потенциалов электродов гальванического элемента, условно принимается на ноль.
Конечно же сам водород подключить к цепи мы не можем, так как это газообразное вещество.
Итак, в цепь включена тонкая платиновая Pt пластинка, имеющая дополнительное покрытие из платины, осажденной на ее поверхности электролитическим путем. Здесь адсорбируется газообразный водород, который дополнительно удерживается стеклянной колбой. Последняя же заполнена электролитом: 2н. раствором серной кислоты H2SO4. Кроме того, сюда из баллона подается водород H2.
Вторая часть гальванического элемента, как обычно, представлена цинковой пластинкой (анод), погруженной в раствор соли этого же металла, например, сульфата цинка ZnSO4 . Электроны анода после замыкания цепи переходят в катодное пространство и обеспечивают там восстановление ионов водорода H+:
Схематично рассмотренный гальванический элемент записывают так:
После замыкания цепи стрелка прибора покажет величину потенциала 0,76 В.
ЭДС гальванического элемента с водородным электродом
Итак. Стрелка вольтметра остановилась на значении 0,76 В. Это и есть величина Э.Д.С. гальванического элемента, устройство которого мы рассмотрели.
Поскольку в гальваническом элементе всегда одновременно протекают два противоположных процесса: окисление и восстановление, то Э.Д.С. элемента будет представлена суммой двух потенциалов: окислительного и восстановительного соответственно
Тогда посчитаем:
Поскольку в ходе процесса окисляется цинк, посчитанное (и измеренное) значение Э.Д.С. будет относиться не столько ко всему элементу, сколько к цинковому аноду.
Именно таким же образом, имея в распоряжении стандартный водородный электрод, были получены значения других стандартных электродных потенциалов.
Э.Д.С. гальванического элемента определяется по формуле, учитывающей электродные потенциалы участников процесса
Возможны случаи, когда электрод в одном гальваническом элементе является анодом, а в другом (в паре с другим металлом) катодом. Иными словами, в зависимости от ситуации он может как окисляться, так и восстанавливаться. Какой же электродный потенциал будет иметь металл?
В таких ситуациях работает правило:
потенциалы окислительного и восстановительного процессов имеют одинаковое численное значение и противоположны по знаку
Например, для цинка:
Важно отметить, что в справочных таблицах стандартных электродных потенциалов принято отображать только восстановительные процессы. Поэтому, если электрод, значение Э.Д.С. которого вам надо взять из такой таблицы, является участником окислительного процесса, вы находите в ней значение Э.Д.С. для него, как для участника восстановительного процесса, и меняете знак на противоположный.
Итак, в самом общем случае Э.Д.С. гальванического элемента определяется по формуле:
Необходимо учесть, что
Э.Д.С. гальванического элемента всегда положительна
Определим Э.Д.С. гальванического элемента, состоящего из медного и цинкового электродов, погруженных в растворы их солей:
Для вычисления воспользуемся справочной таблицей стандартных электродных потенциалов металлов и формулой для расчета Э.Д.С., учитывая, что из двух значений потенциалов, меньшее будет соответствовать окислительным процессам на аноде, а большее – восстановительным процессам на катоде.
По данным таблицы восстановительный потенциал цинка равен -0,763 В. В данном процессе цинк окисляется, значит, его окислительный потенциал составляет +0,763 В. Медь восстанавливается, ее потенциал равен +0,337 В.
Ряд напряжений металлов. Что это такое и каково его значение
Если измерить указанным выше образом значения стандартных электродных потенциалов металлов и расположить их в порядке возрастания, то получится знаменитый ряд напряжений металлов (не совсем верный термин). Лучше его называть рядом стандартных электродных потенциалов металлов. Он имеет еще несколько названий: электрохимический ряд активности металлов, ряд Бекетова. В нем кроме металлов присутствует единственный неметалл водород. Надеемся, теперь понятно, почему.
Вот этот ряд:
Li Rb K Cs Ba Sr Ca Na Mg Be Al Mn Zn Cr Fe Cd Co Ni Sn Pb (H) Cu Hg Ag Pt Au
Каково же значение данного ряда?
По величинам стандартных электродных потенциалов можно предположить, насколько ярко выражены те или иные свойства соответствующих металлов:
1) Чем меньше величина потенциала, тем более активным является металл. Так, ряд начинается литием. Величина его потенциала Е°=-3,045 В. Это самое маленькое значение среди всех остальных. И действительно, литий очень активный металл. Он легко окисляется и трудно восстанавливается из своего иона.
2) Все металлы, стоящие в данном ряду левее водорода (т.е. имеющие отрицательное значение потенциала) вытесняют его из разбавленных кислот (кислот, подобных соляной, серной).
3) Каждый предыдущий металл ряда вытесняет все последующие из растворов их солей. Например:
Этот вывод можно подтвердить расчетами:
А вот такая реакция не возможна:
И это также легко подтверждается вычислением Э.Д.С. предполагаемого окислительно-восстановительного процесса:
Полученное отрицательное значение Э.Д.С. говорит о том, что переход электронов с меди на железо не возможен.
4) Если построить из металлов данного ряда гальванический элемент, то его Э.Д.С. будет тем больше, чем больше разность стандартных электродных потенциалов этих металлов.
Например, какой окислительно-восстановительный процесс будет идти эффективнее: вытеснение железа из его соли магнием или цинком? Для ответа на этот вопрос необходимо посчитать Э.Д.С. обоих процессов и сравнить полученные значения:
В обоих случаях Э.Д.С. положительна. Значит, процессы возможны. Однако, взаимодействие сульфата железа (II) с магнием более эффективно, чем с цинком почти в 6 раз.
Примеры вычислений Э.Д.С. гальванического элемента и электродных потенциалов
Разберем еще несколько примеров, в которых применяется формула, по которой определяется Э.Д.С. гальванического элемента.
Задача 1. Рассчитайте, будет ли протекать реакция при погружении пластинки железа в 1М раствор сульфата никеля.
Решение:
Так как значение Э.Д.С. предполагаемой окислительно-восстановительной реакции положительное, то такая реакция возможна.
Задача 2. Рассчитайте Э.Д.С., укажите направление движения электронов в имеющейся комбинации электродов:
Решение:
Окисляется свинцовый Pb анод, его электроны будут переходить на серебряный Ag катод.
Задача 3. Подтвердите расчетом, будет ли металлический никель растворяться: а) в 2М растворе серной кислоты; б) в растворе сульфата калия с той же активностью ионов.
Решение:
Задача 4. Определите возможность протекания в водном растворе реакции между хлором и хлоридом железа (II).
Решение:
Задача 5. Вычислите стандартную Э.Д.С. гальванического элемента, в котором протекает реакция:
Решение:
Важный вывод из этой задачи:
значение Э.Д.С. гальванического элемента зависит от концентраций участников окислительно-восстановительного процесса, но не зависит от их количеств.
Количество вещества йода, которое мы умножили в окислительной полуреакции на три для соблюдения электронного баланса, не имеет значения, и поэтому величину стандартного электродного потенциала этой полуреакции на три умножать не нужно. Так же поступают во всех подобных случаях.
Таким образом, ЭДС гальванического элемента определяется по формуле, учитывающей значения стандартных электродных потенциалов. Она позволяет определить эффективность окислительно-восстановительного процесса, как в гальваническом элементе, так и при взаимодействии металла с раствором соли другого металла.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
Напряжение — гальванический элемент
Cтраница 1
Напряжение гальванического элемента тем выше, чем больше отличаются между собой значения стандартного потенциала электродов.
[1]
Напряжение гальванического элемента может изменяться в зависимости от концентрации находящегося в нем электролита. Например, изменяя концентрацию ионов цинка в цинковом полуэлементе, мы сместим, согласно принципу Ле Ша-телье, равновесие между цинком и ионами цинка, и вследствие этого изменится электродный потенциал цинка. При [ Zn2 ] 1 моль / л стандартный потенциал этого электрода равен 0 76 В, но при уменьшении [ Zn2 ] равновесие Zn Zn2 2e — смещается в правую сторону, а поскольку электродный потенциал является мерой способности реакции к самопроизвольному протеканию, ясно, что в данной ситуации он должен возрасти.
[3]
Чтобы вычислить напряжение гальванического элемента, в котором протекает заданная реакция, прежде всего представляют эту реакцию в виде двух полуреакций.
[4]
Каким образом напряжение гальванического элемента связано со свободной энергией протекающей в нем реакции. Что называется стандартным потенциалом.
[5]
Как вычислить напряжение гальванического элемента, если известны протекающие в нем электродные полуреакции и их потенциалы.
[6]
Чему равно напряжение полученного гальванического элемента. Определите AG298 для протекающей в нем реакции.
[7]
Количественной характеристикой служит напряжение гальванического элемента 0 75 В. Эта величина считается положительной, если электроны во внешней цепи двигаются от водородного к платиновому электроду.
[9]
В результате измерения напряжения гальванического элемента Zn — H, изображенного на рис. 19.3, в котором [ Zn2 ] 1 М и РНг 1 атм, было установлено, что при 25 С Е 0 45 В.
[10]
Потенциометрия представляет собой метод измерения напряжения гальванических элементов, составленных из двух полуэлементов, характеризующихся определенными значениями потенциалов. Один из полуэлементов должен быть стандартным электродом сравнения.
[12]
Из этого выражения видно, что напряжение гальванического элемента, используемого в качеств источника тока, меньше его ЭДС. Если же уменьшать силу тока, что достигается увеличением сопротивления внешней цепи, то в пределе при бесконечно малой силе тока разность потенциалов между электродами становится равной ЭДС элемента. Но бесконечно малая сила тока означает бесконечно медленное протекание химической реакции.
[13]
Из этого выражения видно, что напряжение гальванического элемента, используемого в качеств источника тока, меньше его ЭДС. Если же уменьшать силу тока, что достигается увеличением сопротивления внешней цепи, то в пределе при бесконечно малой силе тока разность потенциалов между электродами становится равной ЭДС элемента. Но бесконечно малая сила тока означает бесконечно медленное протекание химической реакции.
[14]
Выбор оборудования и приборов для измерения напряжения гальванического элемента определяется требуемой точностью измерений. Для получения эталонных данных необходимо составлять цепь элемента без жидкостного соединения, измерение напряжения которого приводят с помощью прецизионных вольтметров.
[15]
Страницы:
1
2
3