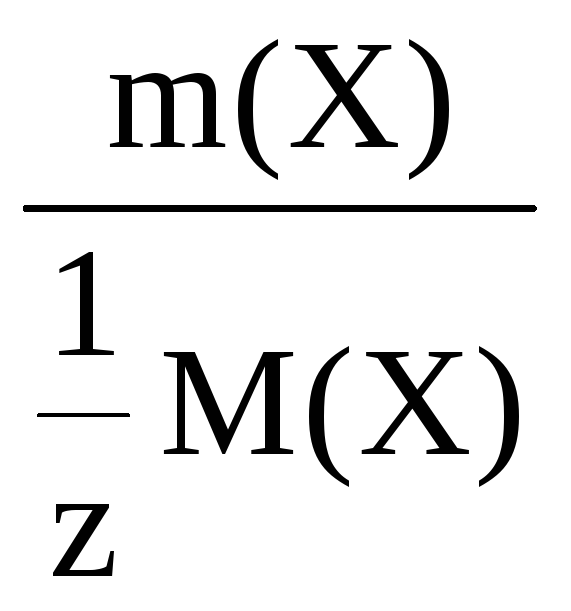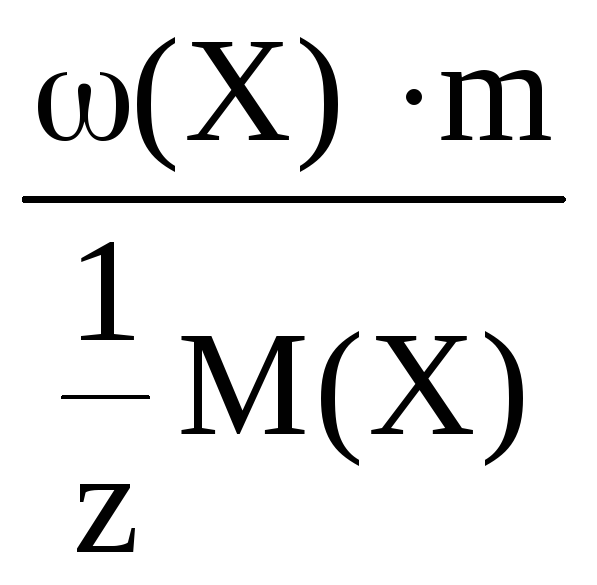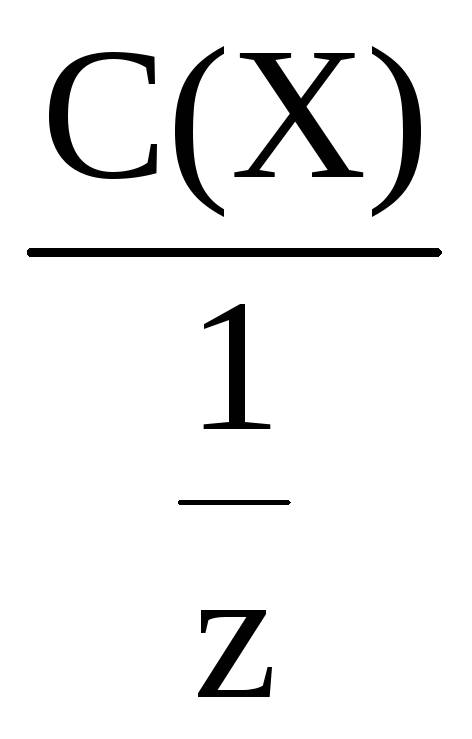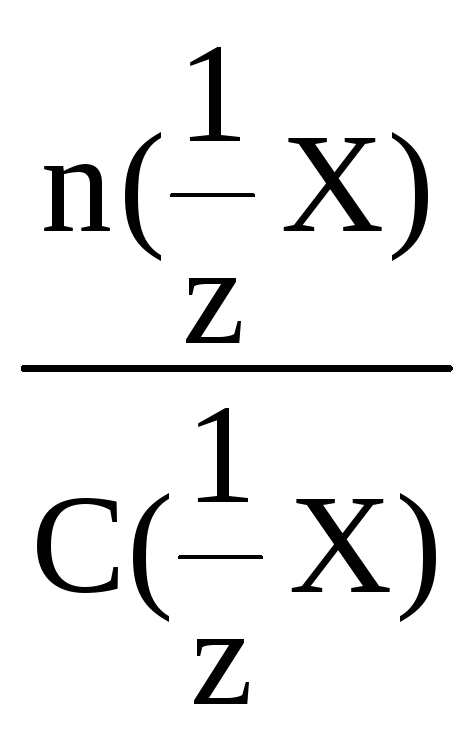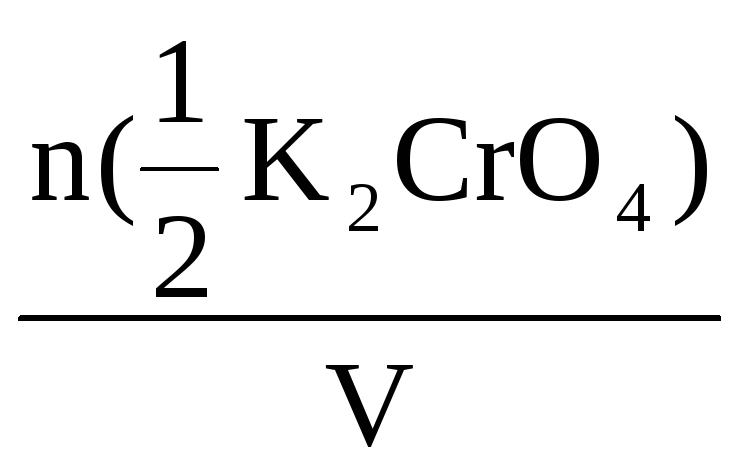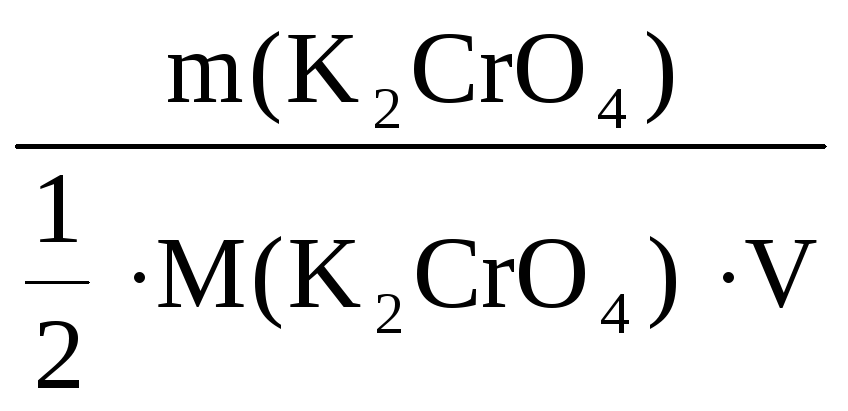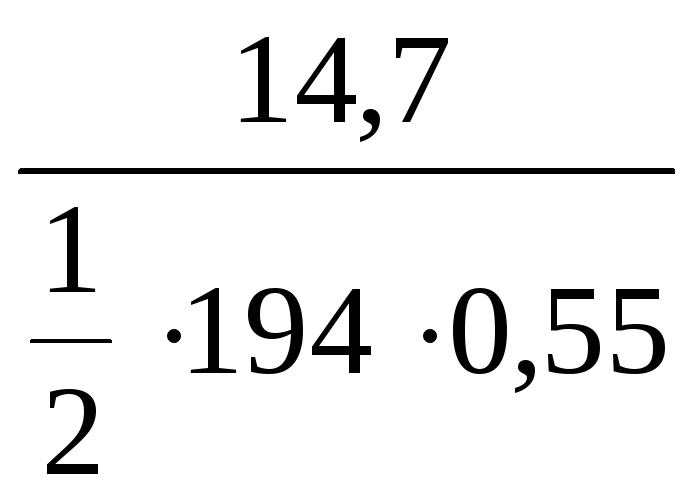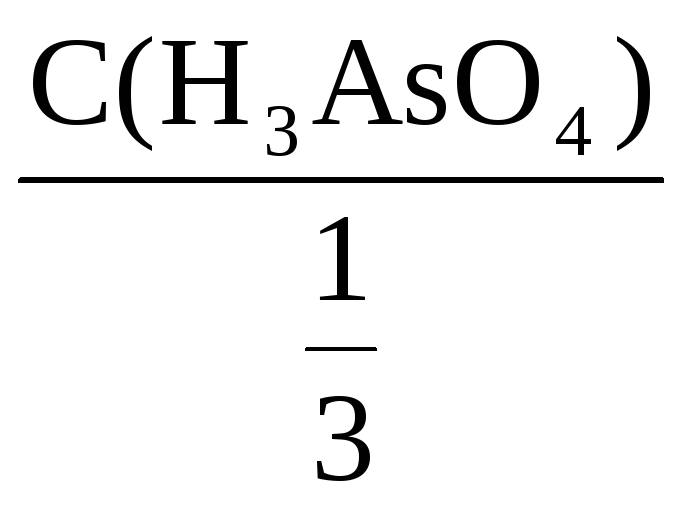В уроке 15 «Моляльность и молярность» из курса «Химия для чайников» рассмотрим понятия растворитель и растворенное вещество научимся выполнять расчет молярной и моляльной концентрации, а также разбавлять растворы. Невозможно объяснить что такое моляльность и молярность, если вы не знакомы с понятием моль вещества, поэтому не поленитесь и прочитайте предыдущие уроки. Кстати, в прошлом уроке мы разбирали задачи на выход реакции, посмотрите если вам интересно.
Химикам нередко приходится работать с жидкими растворами, так как это благоприятная среда для протекания химических реакций. Жидкости легко смешивать, в отличие от кристаллических тел, а также жидкость занимает меньший объем, по сравнению с газом. Благодаря этим достоинствам, химические реакции могут осуществляться гораздо быстрее, так как исходные реагенты в жидкой среде часто сближаются и сталкиваются друг с другом. В прошлых уроках мы отмечали, что вода относится к полярным жидкостям, и потому является неплохим растворителем для проведения химических реакций. Молекулы H2O, а также ионы H+ и OH—, на которых вода диссоциирована в небольшой степени, могут способствовать запуску химические реакций, благодаря поляризации связей в других молекулах или ослаблению связи между атомами. Вот почему жизнь на Земле зародилась не на суше или в атмосфере, а именно в воде.
Содержание
- Растворитель и растворенное вещество
- Расчет концентрации раствора
- Молярная концентрация
- Моляльная концентрация
- Разбавление растворов
Растворитель и растворенное вещество
Раствор может быть образован путем растворения газа в жидкости или твердого тела в жидкости. В обоих случаях жидкость является растворителем, а другой компонент — растворенное вещество. Когда раствор образован путем смешивания двух жидкостей, растворителем считается та жидкость, которая находится в большем количестве, иначе говоря имеет бОльшую концентрацию.
Расчет концентрации раствора
Молярная концентрация
Концентрацию можно выражать по разному, но наиболее распространенный способ — указание его молярности. Молярная концентрация (молярность) — это число молей растворенного вещества в 1 литре раствора. Единица молярности обозначается символом M. Например два моля соляной кислоты на 1 литр раствора обозначается 2 М HCl. Кстати, если на 1 литр раствора приходится 1 моль растворенного вещества, тогда раствор называется одномолярным. Молярная концентрация раствора обозначается различными символами:
- cx, Смx, [x], где x — растворенное вещество
Формула для вычисления молярной концентрации (молярности):
- См = n/V, моль/л
где n — количество растворенного вещества в молях, V — объем раствора в литрах.
Пару слов о технике приготовления растворов нужной молярности. Очевидно, что если добавить к одному литру растворителя 1 моль вещества, общий объем раствора будет чуть больше одного литра, и потому будет ошибкой считать полученный раствор одномолярным. Чтобы этого избежать, первым делом добавляем вещество, а только потом доливаем воду, пока суммарный объем раствора не будет равным 1 л. Полезно будет запомнить приближенное правило аддитивности объемов, которое гласит, что объем раствора приближенно равен сумме объемов растворителя и растворенного вещества. Растворы многих солей приближенно подчиняются данному правилу.
Пример 1. Химичка дала задание растворить в литре воды 264 г сульфата аммония (NH4)2SO4, а затем вычислить молярность полученного раствора и его объем, основываясь на предположении об аддитивности объемов. Плотность сульфата аммония равна 1,76 г/мл.
Решение:
Определим объем (NH4)2SO4 до растворения:
- 264 г / 1,76 г/мл = 150 мл = 0,150 л
Пользуясь правилом аддитивности объемов, найдем окончательный объем раствора:
- 1,000 л + 0,150 л = 1,150 л
Число молей растворенного сульфата аммония равно:
- 264 г / 132 г/моль = 2,00 моля (NH4)2SO4
Завершающий шаг! Молярность раствора равна:
- 2,000 / 1,150 л = 1,74 моль/л, т.е 1,74 М (NH4)2SO4
Приближенным правилом аддитивности объемов можно пользоваться только для грубой предварительной оценки молярности раствора. Например, в примере 1, объем полученного раствора на самом деле имеет молярную концентрацию равную 1,8 М, т.е погрешность наших расчетов составляет 3,3%.
Моляльная концентрация
Наряду с молярностью, химики используют моляльность, или моляльную концентрацию, в основе которой учитывается количество использованного растворителя, а не количество образующегося раствора. Моляльная концентрация — это число молей растворенного вещества в 1 кг растворителя (а не раствора!). Моляльность выражается в моль/кг и обозначается маленькой буквой m. Формула для вычисления моляльной концентрации:
- m = n/m
где n — количество растворенного вещества в молях, m — масса растворителя в кг
Для справки отметим, что 1 л воды = 1 кг воды, и еще, 1 г/мл = 1 кг/л.
Пример 2. Химичка попросила определить моляльность раствора, полученного при растворении 5 г уксусной кислоты C2H4O2 в 1 л этанола. Плотность этанола равна 0,789 г/мл.
Решение:
Число молей уксусной кислоты в 5 г равно:
- 5,00 г / 60,05 г/моль = 0,833 моля C2H4O2
Масса 1 л этанола равна:
- 1,000 л × 0,789 кг/л = 0,789 кг этанола
Последний этап. Найдем моляльность полученного раствора:
- 0,833 моля / 0,789 кг растворителя = 0,106 моль/кг
Единица моляльности обозначается Мл, поэтому ответ также можно записать 0,106 Мл.
Разбавление растворов
В химической практике часто занимаются разбавлением растворов, т.е добавлением растворителя. Просто нужно запомнить, что число молей растворенного вещества при разбавлении раствора остается неизменным. И еще запомните формулу правильного разбавления раствора:
- Число молей растворенного вещества = c1V1 = c2V2
где с1 и V1 — молярная концентрация и объем раствора до разбавления, с2 и V2 — молярная концентрация и объем раствора после разбавления. Рассмотрите задачи на разбавление растворов:
Пример 3. Определите молярность раствора, полученного разбавлением 175 мл 2,00 М раствора до 1,00 л.
Решение:
В условие задача указаны значения с1, V1 и V2, поэтому пользуясь формулой разбавления растворов, выразим молярную концентрацию полученного раствора с2
- с2 = c1V1 / V2 = (2,00 М × 175 мл) / 1000 мл = 0,350 М
Пример 4 самостоятельно. До какого объема следует разбавить 5,00 мл 6,00 М раствора HCl, чтобы его молярность стала 0,1 М?
Ответ: V2 = 300 мл
Без сомнения, вы и сами догадались, что урок 15 «Моляльность и молярность» очень важный, ведь 90% все лабораторных по химии связаны с приготовлением растворов нужной концентрации. Поэтому проштудируйте материал от корки до корки. Если у вас возникли вопросы, пишите их в комментарии.
Молярная концентрация (молярность), Сm – это характеристика раствора, способ выражения концентрации растворенного вещества в растворе. Молярная концентрация равна отношению количества растворенного вещества к объему раствора:
где νр.в. – количество растворенного вещества, моль
Vр-ра – объем раствора, л
Иногда молярную концентрацию вещества А обозначают так: [A].
Молярная концентрация измеряется в моль/л или М.
Несколько задач на молярную концентрацию.
1. Определите молярную концентрацию раствора азотной кислоты, если в 500 мл раствора содержится 6,3г азотной кислоты. Ответ: 0,2М
Решение: молярная концентрация — это отношение количества растворенного вещества к объему раствора в литрах. Количество азотной кислоты:
ν(HNO3) = m/M(HNO3) = 6,3 г/ 63 г/моль = 0,1 моль
С(HNO3) = ν(HNO3)/Vр-ра = 0,1 моль/ 0,5 л = 0,2 моль/л
2. Определить молярную концентрацию раствора серной кислоты, если в 2л раствора содержится 0,98г кислоты. Ответ: 0,005М
3. Какую массу хлорида натрия надо растворить в воде, чтобы получить 1л раствора с молярной концентрацией соли 0,02моль/л? Ответ: 1,17г
4. Какое количество вещества (в моль) гидроксида калия содержится в 200мл раствора, если молярная концентрация щёлочи равна 0,9моль/л? Ответ: 0,18моль
5. Какая масса хлороводорода содержится в 250мл раствора соляной кислоты с молярной концентрацией 1 моль/л? Ответ: 9,125г
6. В каком объёме раствора серной кислоты с концентрацией 1 моль/л содержится 4,9г серной кислоты? Ответ: 50мл
7. Смешали 400мл раствора хлорида натрия с молярной концентрацией 1 моль/л и 600мл раствора хлорида натрия с концентрацией соли 2 моль/л. Определить количество вещества хлорида натрия в получившемся растворе и молярную концентрацию этого раствора. Ответ: 1,6М
From Wikipedia, the free encyclopedia
«Molarity» redirects here. Not to be confused with Molality or Morality.
| Molar concentration | |
|---|---|
|
Common symbols |
c |
| SI unit | mol/m3 |
|
Other units |
mol/L |
|
Derivations from |
c = n/V |
| Dimension |  |
Molar concentration (also called molarity, amount concentration or substance concentration) is a measure of the concentration of a chemical species, in particular of a solute in a solution, in terms of amount of substance per unit volume of solution. In chemistry, the most commonly used unit for molarity is the number of moles per liter, having the unit symbol mol/L or mol/dm3 in SI unit. A solution with a concentration of 1 mol/L is said to be 1 molar, commonly designated as 1 M.
Definition[edit]
Molar concentration or molarity is most commonly expressed in units of moles of solute per litre of solution.[1] For use in broader applications, it is defined as amount of substance of solute per unit volume of solution, or per unit volume available to the species, represented by lowercase 
Here, 





In thermodynamics the use of molar concentration is often not convenient because the volume of most solutions slightly depends on temperature due to thermal expansion. This problem is usually resolved by introducing temperature correction factors, or by using a temperature-independent measure of concentration such as molality.[3]
The reciprocal quantity represents the dilution (volume) which can appear in Ostwald’s law of dilution.
- Formality or analytical concentration
If a molecular entity dissociates in solution, the concentration refers to the original chemical formula in solution, the molar concentration is sometimes called formal concentration or formality (FA) or analytical concentration (cA). For example, if a sodium carbonate solution (Na2CO3) has a formal concentration of c(Na2CO3) = 1 mol/L, the molar concentrations are c(Na+) = 2 mol/L and c(CO2−3) = 1 mol/L because the salt dissociates into these ions.[4]
Units[edit]
In the International System of Units (SI) the coherent unit for molar concentration is mol/m3. However, this is inconvenient for most laboratory purposes and most chemical literature traditionally uses mol/dm3, which is the same as mol/L. This traditional unit is often called a molar and denoted by the letter M, for example:
- mol/m3 = 10−3 mol/dm3 = 10−3 mol/L = 10−3 M = 1 mM = 1 mmol/L.
To avoid confusion with SI prefix mega, which has the same abbreviation, small caps ᴍ or italicized M are also used in journals and textbooks.[5]
Sub-multiples such as millimolar consist of the unit preceded by an SI prefix:
| Name | Abbreviation | Concentration | |
|---|---|---|---|
| (mol/L) | (mol/m3) | ||
| millimolar | mM | 10−3 | 100=1 |
| micromolar | μM | 10−6 | 10−3 |
| nanomolar | nM | 10−9 | 10−6 |
| picomolar | pM | 10−12 | 10−9 |
| femtomolar | fM | 10−15 | 10−12 |
| attomolar | aM | 10−18 | 10−15 |
| zeptomolar | zM | 10−21 | 10−18 |
| yoctomolar | yM | 10−24 (6 particles per 10 L) |
10−21 |
| rontomolar | rM | 10−27 | 10−24 |
| quectomolar | qM | 10−30 | 10−27 |
[edit]
Number concentration[edit]
The conversion to number concentration 
where 
Mass concentration[edit]
The conversion to mass concentration 
where 

Mole fraction[edit]
The conversion to mole fraction 
where 

A simpler relation can be obtained by considering the total molar concentration, namely, the sum of molar concentrations of all the components of the mixture:
Mass fraction[edit]
The conversion to mass fraction 
Molality[edit]
For binary mixtures, the conversion to molality 
where the solvent is substance 1, and the solute is substance 2.
For solutions with more than one solute, the conversion is
Properties[edit]
Sum of molar concentrations – normalizing relations[edit]
The sum of molar concentrations gives the total molar concentration, namely the density of the mixture divided by the molar mass of the mixture or by another name the reciprocal of the molar volume of the mixture. In an ionic solution, ionic strength is proportional to the sum of the molar concentration of salts.
Sum of products of molar concentrations and partial molar volumes[edit]
The sum of products between these quantities equals one:
Dependence on volume[edit]
The molar concentration depends on the variation of the volume of the solution due mainly to thermal expansion. On small intervals of temperature, the dependence is
where 

Examples[edit]
- 11.6 g of NaCl is dissolved in 100 g of water. The final mass concentration ρ(NaCl) is
- ρ(NaCl) = 11.6 g/11.6 g + 100 g = 0.104 g/g = 10.4 %.
The volume of such a solution is 104.3mL (volume is directly observable); its density is calculated to be 1.07 (111.6g/104.3mL)
The molar concentration of NaCl in the solution is therefore
- c(NaCl) = 11.6 g/58 g/mol / 104.3 mL = 0.00192 mol/mL = 1.92 mol/L.
Here, 58 g/mol is the molar mass of NaCl.
- A typical task in chemistry is the preparation of 100 mL (= 0.1 L) of a 2 mol/L solution of NaCl in water. The mass of salt needed is
- m(NaCl) = 2 mol/L × 0.1 L × 58 g/mol = 11.6 g.
To create the solution, 11.6 g NaCl is placed in a volumetric flask, dissolved in some water, then followed by the addition of more water until the total volume reaches 100 mL.
- The density of water is approximately 1000 g/L and its molar mass is 18.02 g/mol (or 1/18.02 = 0.055 mol/g). Therefore, the molar concentration of water is
- c(H2O) = 1000 g/L/18.02 g/mol ≈ 55.5 mol/L.
Likewise, the concentration of solid hydrogen (molar mass = 2.02 g/mol) is
- c(H2) = 88 g/L/2.02 g/mol = 43.7 mol/L.
The concentration of pure osmium tetroxide (molar mass = 254.23 g/mol) is
- c(OsO4) = 5.1 kg/L/254.23 g/mol = 20.1 mol/L.
- A typical protein in bacteria, such as E. coli, may have about 60 copies, and the volume of a bacterium is about 10−15 L. Thus, the number concentration C is
- C = 60 / (10−15 L) = 6×1016 L−1.
The molar concentration is
- c = C/NA = 6×1016 L−1/6×1023 mol−1 = 10−7 mol/L = 100 nmol/L.
- Reference ranges for blood tests, sorted by molar concentration:
See also[edit]
- Molality
- Orders of magnitude (molar concentration)
References[edit]
- ^ Tro, Nivaldo J. (6 January 2014). Introductory chemistry essentials (Fifth ed.). Boston. p. 457. ISBN 9780321919052. OCLC 857356651.
- ^ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the «Gold Book») (1997). Online corrected version: (2006–) «amount concentration, c«. doi:10.1351/goldbook.A00295
- ^ a b Kaufman, Myron (2002). Principles of thermodynamics. CRC Press. p. 213. ISBN 0-8247-0692-7.
- ^ Harvey, David (2020-06-15). «2.2: Concentration». Chemistry LibreTexts. Retrieved 2021-12-15.
- ^ «Typography of unit symbols for Molar and Liter in siunitx». TeX — LaTeX Stack Exchange.
External links[edit]
- Molar Solution Concentration Calculator
- Experiment to determine the molar concentration of vinegar by titration
Молярная концентрация (молярность)
– это количество моль вещества,
содержащееся в 1 литре раствора.
С(Х) =
,
моль/л
где Х – количество вещества, моль;
V – объем раствора, л.
Объем раствора связан с массой раствора
следующим образом:
V =
,
мл,
где ρ – плотность раствора, г/мл.
Молярная концентрация эквивалента
– это количество моль вещества
эквивалента, содержащееся в 1 литре
раствора.
С(Х)
=
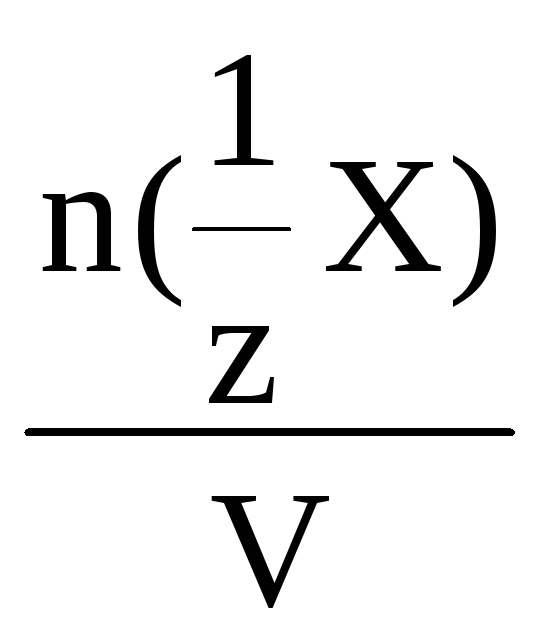
моль/л
где n(Х)
– количество вещества эквивалента,
моль;
V – объем раствора, л.
n(Х)
=
=
где m(X) –
молярная масса растворенного вещества;
m(X) – масса растворенного вещества;
m – масса раствора;
ω(Х) – массовая доля раствора.
Молярная концентрация эквивалента
всегда больше или равна молярной
концентрации. Это положение используется
при проверке полученных данных.
С(Х)
=
Молярную концентрацию эквивалента
часто называют нормальной и обозначают
1,0
н.; 0,5 н. и т.д.
Приведенные выше расчетные формулы
позволяют определять объем раствора,
количество вещества и количество
вещества эквивалента:
V =
или V
=
n(X) = C(X)·V или n(X)
= C(X)·V
2. 1. Определение молярной концентрации вещества с(х) по массе вещества и массы вещества по заданной молярной концентрации
Пример 1. Рассчитать молярную
концентрацию и молярную концентрацию
эквивалента K2CrO4, если в 0,55
л раствора растворено 14,7 г вещества
(реакции обменные).
Решение:
С(K2CrO4) =
=
=
= 0,14 моль/л
Далее определяем фактор эквивалентности
K2CrO4, он равен
.
С(K2CrO4)
=
=
=
= 0,28 моль/л
или С(K2CrO4)
= z·С(K2CrO4) = 0,14·2 = 0,28 моль/л.
Ответ: С(K2CrO4) = 0,14 моль/л;
С(K2CrO4)
= 0,28 моль/л
Пример 2. Определить массу вещества,
содержащегося в 200 мл раствора нитрата
никеля с молярной концентрацией
С(Ni(NO3)2) = 0,125 моль/л.
Решение:
m(Ni(NO3)2) = n(Ni(NO3)2)·m(Ni(NO3)2)
Объем раствора необходимо перевести в
литры: 200 мл = 0,2 л.
n(Ni(NO3)2) = C(Ni(NO3)2)·V
= 0,125·0,2 = 0,025 моль
m(Ni(NO3)2) = 0,025·183 = 4,575 г
Ответ: m(Ni(NO3)2) = 4,575 г.
Пример 3. Рассчитать молярную
концентрацию эквивалента в растворе
HCl. ω(HCl) = 25%, ρ = 1,15 г/мл.
Решение:
С(HCl) =
=
m(HCl) = ω(HCl)·m(р-ра) = ω(HCl)·V(р-ра) ρ
Если объем раствора не задан, то удобно
принимать его равным 1 л (1000 мл).
m(HCl) = 0,25·1000·1,15 = 287,5 г
С(HCl) =
= 7,877 моль/л
Фактор эквивалентности HCl = 1, поэтому
молярная концентрация и молярная
концентрация эквивалента равны.
Ответ: молярная концентрация
эквивалента С(HCl) = 7,877 моль/л.
Пример 4. В 0,6 л воды растворили
100 л бромоводорода. Рассчитать С(HBr) в
растворе, если ρ = 1,15 г/мл.
Решение:
С(HBr) =
Рассчитываем количество вещества
бромоводорода:
n(HBr) =
=
=
4,464 моль
Рассчитываем объем раствора:
V =
=
=
V =
= 836 мл = 0,836 л
Находим молярную концентрацию раствора
HBr:
С(HBr) =
= 5,34 моль/л
Ответ: С(HBr) = 5,34 моль/л
Пример 5. Рассчитать молярную и
молярную концентрацию эквивалента
раствора мышьяковой кислоты (H3AsO4).
Плотность раствора 1,08 г/мл, массовая
доля H3AsO4 9%.
Решение:
Фактор эквивалентности H3AsO4
=
С(H3AsO4) =
С(
H3AsO4)
=
= 3С(H3AsO4)
Объем раствора принимаем равным 1 л =
1000 мл.
m(H3AsO4) = V·ρ·ω(H3AsO4)
= 1000·1,08·0,09 = 97,2 г
n(H3AsO4) =
=
= 0,68 моль
С(H3AsO4) =
= 0,68 моль/л; С(H3AsO4)
= 3·0,68 = 2,04 моль/л
Ответ: С(H3AsO4) = 0,68 моль/л,
С(H3AsO4)
= 2,04 моль/л
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Для характеристики количественного состава раствора используется молярная концентрация растворённого вещества.
Молярная концентрация — это отношение количества растворённого вещества к объёму раствора:
c(в−ва)=n(в−ва)V(р−ра).
В этой формуле:
(c(в-ва)) — молярная концентрация растворённого вещества;
(n(в-ва)) — количество растворённого вещества;
(V(р-ра)) — объём раствора.
Объём раствора можно вычислить по его плотности и массе:
Молярная концентрация обычно выражается в моль/л, моль/дм³ или обозначается буквой (M). Пример:
1)c=1,5моль/л=1,5моль/дм³;2)c=1,5M.
Могут использоваться также такие единицы измерения, как ммоль/л, моль/м³ и др.
По известной молярной концентрации можно вычислить объём раствора и количество растворённого вещества:
V(р−ра)=n(в−ва)c(в−ва);
n(в−ва)=c(в−ва)⋅V(р−ра).
Если выразить количество вещества через массу и молярную массу, то формула для молярной концентрации будет выглядеть так:
c(в−ва)=m(в−ва)M(в−ва)⋅V(р−ра).