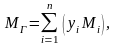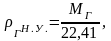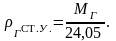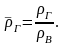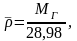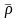Что такое определение молекулярного веса газообразных веществ

При вычислениях атомных весов первоначально принимали за единицу вес атома водорода, как самого легкого элемента, и по отношению к нему вычисляли атомные веса других элементов. Но так как для большинства элементов атомные веса определяются из их кислородных соединений, то фактически вычисления производились по отношению к атомному весу кислорода, который считался равным 16.
Отношение между атомными весами кислорода и водорода принималось равным 16:1. В последствии более точные исследования показали, что это отношение равно 15,88 : 1, или 16 : 1,008. Следовательно, если считать атомный вес водорода равным 1, атомный вес кислорода будет 15,88. Из практических соображений было решено оставить для кислорода атомный вес 16, приняв для водорода атомный вес 1,008.
Таким образом, в настоящее время единицей веса атомов является 1/16часть веса атома кислорода. Эта единица получила название«кислородной един ицы». Вес атома водорода равен 1,008 кислородной единицы, вес атома серы — 32,06 кислородной единицы и т, д.
Атомным весом элемента называется вес его атома, выраженный в кислородных единицах.
Так как вес молекулы любого вещества равен сумме весов образующих ее атомов, то понятно, что молекулярные веса должны выражаться в тех же единицах, что и атомные веса. Например, вес молекулы водорода, состоящей из двух атомов, равен 2,016 кислородной единицы; вес молекулы кислорода, также состоящей из двух атомов, равен 32 кислородным единицам; вес молекулы воды, содержащей два атома водорода и один атом кислорода, равен 16 + 2,016=18,016 кислородной единицы и т. д.
Молекулярным весом простого или сложного вещества называется вес его молекулы, выраженный в кислородных единицах.
Посмотрим теперь, как определяются молекулярные веса газообразных веществ.
По закону Авогадро, равные объемы газов, взятых при одинаковом давлении и одинаковой температуре, содержат равное число молекул. Отсюда следует, что веса равных объемов двух газов должны относиться друг к другу, как их молекулярные веса.
Возьмем например, по одному литру двух различных газов. Пусть в каждом из них содержится по N молекул. Обозначим вес литра первого газа через g, а второго через g1. Молекулярные веса газов обозначим соответственно через М и M1. Так как вес литра газа равен сумме весов находящихся в нем молекул, то
g = N • M и g1 = N • M1
Разделив первое равенство на второе, получим: (1)
Отношение веса данного газа к весу того же объема другого газа, взятого при той же температуре и том же давлении, называется плотностью первого газа по второму. Например, 1 л углекислого газа весит 1,98 г, а 1 л водорода при тех же условиях 0,09 г, откуда плотность углекислого газа по водороду будет 1,98:0,09 = 22.
Обозначив плотность газа буквой D, перепишем уравнение (1):
откуда
M = D•M1 (2)
Молекулярный вес газа равен его плотности по отношению к другому газу, умноженной на молекулярный вес второго газа.
Очень часто плотности различных газов определяют по отношению к водороду как самому легкому из всех тазов. Так как молекулярный вес самого водорода равен 2,016, то в этом случае формула для расчета молекулярных весов принимает вид:
М = 2,016 • D
или, если округлить молекулярный вес водорода до 2:
М = 2 • D
Вычисляя, например, по этой формуле молекулярный вес углекислого газа, плотность которого по водороду, как указано выше, равняется 22, находим:
М = 2 • 22 = 44
Нередко также вычисляют молекулярный вес газа, исходя из его плотности по воздуху. Хотя воздух представляет собой смесь нескольких газов, все же мы можем говорить о среднем молекулярном весе воздуха, определяемом из плотности воздуха по водороду. Найденный таким путем молекулярный вес воздуха равен 29.
Обозначив плотность исследуемого газа по воздуху через D1 получим следующую формулу для вычисления молекулярных весов:
М = 29 • D1
Число 29 полезно запомнить, так как его часто применяют при расчетах.
Практически определение молекулярного веса сводится к измерению веса и объема некоторого количества исследуемого газа и последующему вычислению его плотности, после чего молекулярный вес находят прямо по формуле.
Плотность газа может быть вычислена по отношению к любому другому газу, молекулярный вес которого и вес единицы объема известны. Но так как в справочниках указываются веса газов при нормальных условиях, а на опыте обычно приходится измерять вес и объем исследуемого газа при других условиях, то для вычисления плотности газа нужно предварительно привести измеренный объем газа к нормальным условиям (0° и 760 мм давления).
Приведение к нормальным условиям производится на основании уравнения, объединяющего газовые законы Бойля-Мариотта и Геи-Люссака:
где р и υ — соответственно давление и объем газа в условиях опыта; Р0-нормальное давление; υ0— объем газа при нормальных условиях; Т — абсолютная температура газа.
Определяя из этого уравнения υ0, получаем формулу для вычисления объема газа при 0° и 760 мм давления:
Пример расчета молекулярного веса
Из опыта найдено, что 380 мл газа при температуре 27° и давлении 800 мм рт. ст. весят 0,455 г. Определить молекулярный вес газа, если известно, что 1 л воздуха при нормальных условиях весит 1,293 г.
Приводим найденный объем газа к нормальным условиям. Получаем:
Определяем теперь вес 1 л этого газа (g) при нормальных условиях:
Так как 1 л воздуха весит 1,293 г, то плотность нашего газа по воздуху
а молекулярный вес
М = 29 • 0,97 ≈ 28
Заметим, что для определения молекулярного веса газа указанным способом совершенно не требуется знать химический состав газа, надо знать только его плотность.
16 17 18
Статья на тему Определение молекулярного веса
Одним из важных
параметров газа является его молекулярная
масса,
которая определяется путем суммирования
масс атомов, входящих в молекулу.
Молекулярная масса
углеводородного газа, представляющего
собою смесь компонентов, при известном
объёмном составе, рассчитывается по
формуле:
(2.6)
где yi
– объёмная
доля i—
го компонента в газовой смеси;
Mi
– молекулярная
масса i—
го компонента;
n
– число компонентов в смеси газов.
Под плотностью
углеводородного газа понимают его
массу, заключенную в 1 м3
при определенных условиях (нормальных
или стандартных), в системе СИ измеряется
в кг/м3.
г
= m/V.
(2.7)
Под нормальными
условиями понимают условия, при которых
давление Р = 0,1 МПа, а температура Т = 273
К (0С);
под стандартными условиями – Р = 0,1 МПа,
Т = 293 К (20С).
Для всех газов
объем 1 киломоля постоянен и равен при
нормальных условиях – 22,41 м3,
при стандартных условиях – 24,05 м3.
Зная молекулярную массу газа, плотность
газа при нормальных условиях можно
вычислить по формуле:
(2.8)
при стандартных
условиях – по формуле:
(2.9)
На практике часто
пользуются относительной
плотностью газа,
равной отношению плотности газа к
плотности воздуха при определенных
условиях:
(2.10)
При расчетах
следует помнить, что плотность воздуха
при нормальных условиях
составляет
вн.у.
= 1,293
кг/м3,
при стандартных
вст.у.
= 1,205
кг/м3.
Зная молекулярную
массу газа МГ,
относительную плотность газа можно
также рассчитать по формуле:
(2.11)
где 28,98 –
молекулярная масса воздуха.
Задача 2.2. Даны
составы газов типичных газовых,
газоконденсатных и нефтяных месторождений.
Рассчитать молекулярную массу Мi
каждого компонента, входящего в состав
газа, молекулярную массу газа Мг,
плотность газа при нормальных (гн.у.)
и стандартных
условиях (гст.у.),
а также относительную плотность по
воздуху
г
(при нормальных
и стандартных условиях). Определить тип
газа (природный, попутный или газ
газоконденсатного месторождения).
Исходные данные для расчетов приведены
в таблицах 2.2 и 2.3.
Таблица 2.2 –
Компонентный состав газа
|
Вариант |
Месторождение |
Компонентный |
|||||||
|
СН4 |
С2Н6 |
С3Н8 |
С4Н10 |
С5Н12 и выше |
СО2 |
N2 |
H2S |
||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
1 |
Самотлорское |
53,40 |
7,20 |
15,1 |
8,30 |
6,30 |
0,10 |
9,60 |
— |
|
2 |
Уренгойское |
98,84 |
0,10 |
0,03 |
0,02 |
0,01 |
0,30 |
1,70 |
— |
|
3 |
Оренбургское |
84,00 |
5,00 |
1,60 |
0,70 |
1,80 |
1,10 |
4,20 |
1,60 |
|
4 |
Шатлыкское |
95,60 |
2,00 |
0,34 |
0,10 |
0,05 |
1,15 |
0,76 |
— |
|
5 |
Астраханское |
58,80 |
1,88 |
0,60 |
0,23 |
0,12 |
11,0 |
1,37 |
26,0 |
|
6 |
Ромашкинское |
37,30 |
20,70 |
18,9 |
9,50 |
4,80 |
— |
8,80 |
— |
|
7 |
Туймазинское |
39,47 |
16,83 |
6,58 |
2,80 |
1,10 |
— |
31,62 |
1,60 |
|
8 |
Южно-Первомайское |
55,18 |
13,67 |
8,09 |
1,02 |
20,20 |
0,30 |
1,54 |
— |
|
9 |
Бавлинское |
35,00 |
20,70 |
19,9 |
9,80 |
5,80 |
0,40 |
8,40 |
— |
|
10 |
ПО Пермьнефть |
38,70 |
22,60 |
10,7 |
2,70 |
0,70 |
0,50 |
23,8 |
0,30 |
|
11 |
Коробковское |
81,50 |
8,00 |
4,00 |
2,30 |
0,50 |
0,50 |
3,20 |
— |
|
12 |
ПО Самаранефть |
58,00 |
17,20 |
7,40 |
2,10 |
0,50 |
0,80 |
13,50 |
0,50 |
|
13 |
Ямбургское |
89,67 |
4,39 |
1,64 |
0,74 |
2,36 |
0,94 |
0,26 |
— |
|
14 |
ПО Грознефть |
76,70 |
13,20 |
5,40 |
2,50 |
2,20 |
— |
— |
— |
|
15 |
Медвежье |
98,78 |
0,10 |
0,02 |
— |
— |
0,10 |
1,00 |
— |
|
16 |
Вуктыльское |
74,80 |
8,70 |
3,90 |
1,80 |
6,4 |
0,10 |
4,30 |
— |
|
17 |
Тенгизское |
42,23 |
8,47 |
5,21 |
3,34 |
21,18 |
2,60 |
0,77 |
16,2 |
|
18 |
Карачаганакское |
72,99 |
6,22 |
2,59 |
1,50 |
7,55 |
5,35 |
0,57 |
3,23 |
|
19 |
Калужское |
88,18 |
2,94 |
2,31 |
2,48 |
3,59 |
0,50 |
— |
— |
|
20 |
Узеньское |
50,10 |
20,10 |
16,8 |
7,70 |
3,00 |
— |
2,30 |
— |
|
21 |
Талинское |
44,88 |
7,38 |
3,85 |
1,39 |
42,50 |
— |
— |
— |
|
22 |
Марковское |
45,46 |
11,23 |
5,55 |
4,13 |
33,12 |
— |
0,51 |
— |
|
23 |
Уренгойское |
82,27 |
6,56 |
3,24 |
1,49 |
5,62 |
0,50 |
0,32 |
— |
|
24 |
Северо-Соленинское |
89,52 |
4,15 |
1,82 |
0,48 |
2,58 |
0,49 |
0,96 |
— |
|
25 |
Совхозное ПХГ |
84,85 |
5,77 |
2,33 |
0,75 |
0,35 |
0,95 |
5,00 |
— |
|
26 |
Дмитриевское |
35,88 |
2,82 |
1,69 |
2,17 |
56,12 |
0,33 |
0,99 |
— |
|
27 |
Северо-Ставропольское |
92,80 |
2,80 |
0,90 |
0,40 |
0,10 |
0,50 |
2,50 |
— |
|
28 |
Александровское |
85,10 |
1,93 |
6,74 |
3,38 |
0,28 |
2,57 |
— |
— |
|
29 |
Радаевское |
32,70 |
13,40 |
15,2 |
4,90 |
2,60 |
27,8 |
3,20 |
— |
|
30 |
Ново-Дмитриевское |
64,76 |
9,68 |
10,8 |
7,02 |
6,01 |
0,81 |
0,91 |
— |
Таблица 2.3 – Атомные
массы компонентов
|
Компонент |
Водород |
Углерод |
Кислород |
Сера |
Азот |
|
Атомная масса |
1,008 |
12,011 |
15,999 |
32,064 |
14,007 |
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
По этой ссылке вы найдёте полный курс лекций по математике:
Определение молекулярной массы по относительной плотности другого газа: Определение молекулярной массы газа по молярному объему: Определение молекулярной массы газа по уравнению Клапейрона-Менделеева: Пример 15 Вычислите относительную молекулярную массу оксида серы (IV) по значению его относительной плотности по водороду, равной 32. Решение: , что соответствует относительной молекулярной массе, равной 64. Ответ: M(S02) = 64 г/моль.
Пример 16 Определите относительную молекулярную массу газа, если при нормальных условиях 0,824 г его занимают объем 0,260 л. Дано:Найти: М( газа) Решение: При н. у. 1 моль любого газа занимает объем 22,4 л. Вычислив массу 22,4 л данного газа, получают его молярную массу: газа занимают объем 0,260 л Следовательно, молярная масса газа равна 71,0 г/моль, а его относительная молекулярная масса— 71. Ответ: М(газа) = 71,0 г. Пример 17 Рассчитайте относительную молекулярную массу вещества, 500 мл паров которого при 87 °С и давлении 720 мм рт. ст. имеют массу 0,93 г. Найти: М(вещества)
Решение: По уравнению Клапейрона-Менделеева: Относительная молекулярная масса вещества равна 58. Ответ: М(вещества) — 58 г/моль. Вопросы и задачи для самостоятельного решения 1. Каково практическое значение закона сохранена массы вещества? 2L Сформулируйте закон объемных отношений. Укажите, какова его роль в развитии атомно-молекулярных представлений? 3. Каково значение закона Авогадро? Как можно воспользоваться этим законом для определения величин молярных масс веществ? 4. Какие газовые законы вам известны? Какие функциональные связи они вскрывают?
Возможно вам будут полезны данные страницы:
5. Укажите основные факторы, приводящие к отклонению свойств идеальных газов от предсказываемых уравнением состояния идеальных газов.
6. При разложении 12,25 г хлората калия образовалось 4,8 г кислорода. Какова масса образовавшегося при этом хлорида калия. Подтвердите расчетами выполнение закона сохранения массы веществ. Ответ: 7,45 г. 7. Какие количества кислорода и магния необходимо взять для получения 8 г оксида магния? Ответ: 8. Сколько г сульфида цинка должно получиться, если для реакции взято 8 г серы и 32,7 г цинка? 9. Определите молярную массу эквивалента металла, если его соединение с иодом содержит 94,8 % иода.
Молярная масса эквивалента иода равна 127. 10. 1 г металла соединяется с 1,78 г серы или с 8,89 г брома. Найдите молярные массы эквивалентов брома и металла, зная, что молярная масса эквивалента серы равна 16. Но Мышьяк образует два оксида, из которых один содержит 34,8%, а другой— 24,3% кислорода.
Определите молярную массу эквивалента мышьяка в том и другом оксиде. Как относятся эти величины друг к другу? 12. Олово образует два оксида, содержащих: первый 78,8 % олова, а второй — 88,12 % олова. Вычислите молярные массы эквивалентов олова, исходя из состава этих оксидов, и найдите соотношения между полученными величинами. 13. Оксид металла содержит 28,57 % кислорода, а соединение того же металла с фтором — 48,72 % фтора. Рассчитайте из этих данных молярную массу эквивалента фтора. Ответ: 18,9. 14. 1,6 г кальция и 2,615 г цинка вытесняют из кислоты одинаковые количества водорода.
Найдите молярную массу эквивалента
цинка, зная, что молярная масса эквивалента кальция равна 20. Ответ: 32,7. 15. Одно и то же количество металла соединяется с 0,2 г кислорода и с 3,173 г одного из галогенов. Определите молярную массу эквивалента галогена. Ответ: 126,9. 16. При нейтрализации некоторой кислоты едким натром на 1,125 г кислоты расходуется 1 г едкого натра, молярная масса эквивалента которого равна 40. Вычислите молярную массу эквивалента кислоты.
Ответ: 45. 17. Определите молярную массу эквивалента хлорного железа, зная, что 1,3 г его взаимодействует без остатка с 1 г едкого натра, молярная масса эквивалента которого равна 40. Ответ: 52. 18. Отразите уравнением процесс полного сгорания метана и рассчитайте отношения между объемами участвующих в реакции газов, учитывая, что они измерены при одинаковых условиях. Ответ: СН4 : 02 = 1 : 2. 19. Один грамм воздуха при нормальных условиях занимает объем 773 мл.
Какой объем займет то же количество воздуха при 0 °С и давлении, равном 700 мм рт. ст.? Ответ: 839 мл. 20. В сосуде емкостью 1 л находится 0,05 моль газа при 0 °С. Определите давление газа в сосуде. Ответ: 1,12 атм. 21. Найдите молекулярную массу вещества, зная, что 380 мл его паров при 97 °С и давлении 740 мм рт. ст. имеют массу 1,9 г. Ответ: 156. 22. Определите молекулярную массу вещества, зная, что масса 200 мл его паров при нормальных условиях равна 0,232 г. Ответ: 26. 23. Масса 1 л озона при нормальных условиях равна 2,146 г.
Подтвердите расчетом, что значение его молекулярной массы равно 48, и найдите плотность озона по воздуху. Ответ: 1,66. 24. Плотность этилена по кислороду 0,875. Рассчитайте молекулярную массу этилена. Ответ: 28. 25. Определите давление кислорода, если 0,1 кг его находится в сосуде объемом 0,02 м3 при 20 °С. Ответ: 380 640 Па. 26. Какой объем займет 1 кг воздуха при температуре 17 °С и давлении 1 атм? Ответ: 820 л. 27. Найдите массу 1 л бромистого водорода при нормальных условиях.
Какова плотность этого газа по воздуху? Ответ: 3,62 г; 2,79. 28. На сжигание 1 г металла требуется 462 мл (н. у.) кислорода. Рассчитайте молярную массу эквивалента этого металла. Ответ: 12,12. 29. 0,2 г металла вытеснили 197 мл водорода, который был собран и измерен при 20 °С и 780 мм рт. ст. Найдите молярную массу эквивалента этого металла. Ответ: 11,90. 30. При нагревании 4,3 г оксида металла было получено 580 мл кислорода, объем которого измерен при 10 °С и 850 мм рт. ст. Найдите молярную массу эквивалента металла, если известно, что 1 л кислорода при н. у. имеет массу 1,43 г. Ответ: 30,44. 31.
Найдите плотность по воздуху газовой смеси, состоящей из 60 % оксида серы (IV) и 40 % оксида углерода (IV). Ответ: 1,93. 32. Для полного восстановления 42 г оксида металла потребовалось 9,56 л водорода, взятого при 7 °С и 730 мм рт. ст. Рассчитайте молярную массу эквивалента металла. Ответ: 32. 33. Найдите объемный состав смеси кислорода с озоном, плотность которой по воздуху равна 1,21. Ответ: 02 : 03 = 4 :1. 34. Какой объем при н. у. займут 28,2 • 1021 молекул газа? Ответ: 1,05 л. 35.
Какой объем водорода полностью сгорит в 1 л воздуха? Ответ: 0,42 л. 36. При некоторой температуре плотность паров серы по воздуху равна 8,83. Из какого количества атомов состоит молекула серы при этой температуре? Ответ: из восьми. 37. Рассчитайте объем оксида углерода (IV), образовавшегося при взрыве 17 л метана с 36 л кислорода. Ответ: 17 л. 38. Газовая смесь объемом 10,6л (н. у.), применяемая для получения аммиака, имеет массу 6,57 г. Каков состав газовой смеси? Ответ: 4,85л N2; 5,75л Н2. 39. Смесь азота с водородом объемом 1 л при температуре 0 °С и давлении 2 атм имеет массу 1 г. Определите объемный состав смеси. Ответ: 35,36% N2.
Как определить молярную массу газа
Что такое молярная масса? Это масса одного моля вещества, то есть такого его количества, в котором содержится столько же атомов, сколько в 12 граммах углерода. Молярную массу сложного вещества вычисляют, складывая молярные массы входящих в него элементов. Например, NaCl — хорошо знакомая всем нам поваренная соль. Какова ее молярная масса? Заглянув в Таблицу Менделеева, получите ответ: 23 + 35,5 = 58,5. Часто ставится задача определить молярную массу газа. Как это можно сделать?

Инструкция
Зная формулу газа, его молярную массу можно вычислить путем элементарного подсчета. Возьмите углекислый газ. Его формула – СО2. Значит его молярная масса такова: 12 + 32 (молярная масса кислорода с учетом индекса «2») = 44.
Ну а если вам надо вычислить молярную массу неизвестного нам газа, находящегося в каком-то замкнутом объеме, например, герметично закрытом баллоне? Тут нам на помощь придет универсальное уравнение Менделеева–Клапейрона, описывающее состояние «идеального газа». Разумеется, ни один газ не удовлетворяет условиям «идеального», но при давлении и температуре, несущественно отличающихся от нормальных, это уравнение очень удобно для расчетов. А полученная при вычислениях погрешность весьма незначительна и ею смело можно пренебречь.
Универсальное уравнение имеет такой вид: PV = MRT/m, гдеР – давление газа в Паскалях;
V – его объем в кубических метрах;
M – фактическая масса газа;
m – его молярная масса;
R – универсальная газовая постоянная;
Т – температура газа в градусах Кельвина.
Вы увидите, что молярная масса вычисляется по формуле MRT/PV. Например, надо найти молярную массу газа, если известно, что 3 килограмма этого газа находятся в герметичной емкости объемом 1,7 кубических метра при давлении 100000 Па и температуре 27 градусов по Цельсию.
Подставьте известные значения в эту формулу, разумеется, не забыв сначала преобразовать в одну систему величин. Иначе выйдет полная несуразица. 3,0*8,31*300/170000=0,04399 кг/моль.
Ну а поскольку молярная масса вещества измеряется в граммах на моль, умножьте полученный результат на 1000 и получите ответ: молярная масса газа, находящегося при таких условиях, равна 43,99 грамма/моль или с учетом округления — 44 грамма/моль. То есть это тот же самый углекислый газ.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Молярная масса газа
Молярная масса газа
Молярную массу обычно выражают в г/моль, реже в кг/кмоль. Поскольку в одном моле любого вещества содержится одинаковое число структурных единиц, то молярная масса вещества пропорциональная массе соответствующей структурной единицы, т.е. относительной атомной массе данного вещества (Mr):
M = κ × Mr,
где κ – коэффициент пропорциональности, одинаковый для всех веществ. Относительная молекулярная масса – величина безразмерная. Её вычисляют, используя относительные атомные массы химических элементов, указанных в Периодической системе Д.И. Менделеева.
Молекулярную массу вещества в газообразном состоянии можно определить, используя понятие о его молярном объеме. Для этого находят объем, занимаемый при нормальных условиях определенной массой данного вещества, а затем вычисляют массу 22,4 л этого вещества при тех же условиях.
Для достижения данной цели (вычисление молярной массы) возможно использование уравнения состояния идеального газа (уравнение Менделеева-Клапейрона):
pV = mRT / M,
где p – давление газа (Па), V – объем газа (м3), m – масса вещества (г), M – молярная масса вещества (г/моль), Т – абсолютная температура (К), R – универсальная газовая постоянная равная 8,314 Дж/(моль×К).
Молярную массу газа можно рассчитать, как произведение его плотности по отношению к любому другому газу на молекулярную массу последнего. Под плотностью понимают отношение массу определенного объема данного газа к массе такого же объема другого газа (при одинаковых температуре и давлении), молекулярная масса которого известна.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |