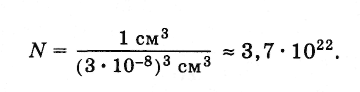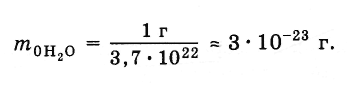В 1,0 см3 любого газа, находящегося при нормальных условиях (температура t0 = 0,0 °С, давление р0 = 1,0 · 105 Па), содержится 2,7 · 1019 молекул. Чтобы представить, насколько велико это число, предположим, что из отверстия в ампуле вместимостью V = 1,0 см3 ежесекундно вылетает 100 молекул. Тогда, для того чтобы все молекулы вылетели из ампулы, потребуется 8,6 млрд лет, т. е. промежуток времени, сравнимый с возрастом Вселенной (12–15 млрд лет). Такое огромное число молекул в веществе свидетельствует о том, что их размеры очень малы. Каковы же размеры и масса частиц вещества? Как определить число атомов в любом макроскопическом теле?
Молекулярно-кинетическая теория предоставляет возможность оценить массу и размеры частиц, образующих макроскопические тела. Молекулы, как и атомы, не имеют чётких границ. Если представить молекулу в виде шарика, то её радиус имеет значение от 0,1 нм у простейших до 100 нм у сложных молекул, состоящих из нескольких тысяч атомов. Например, оценочный диаметр молекулы водорода составляет 0,2 нм, а диаметр молекулы воды — 0,3 нм. При таких размерах число частиц в веществе очень велико. Например, в одном грамме воды содержится 3,3 · 1022 молекул.
Размеры и масса молекулы возрастают с увеличением числа атомов, которые входят в её состав. Атомы и молекулы (кроме многоатомных молекул органических веществ) имеют массу порядка 10–26 кг. Из-за малых значений выражать массы атомов и молекул в килограммах (кг) неудобно. Поэтому для измерения масс атомов и молекул в химии и физике используют атомную единицу массы (а. е. м.). Атомную единицу массы выражают через массу изотопа углерода :
Массу молекулы (или атома), выраженную в атомных единицах массы, называют относительной молекулярной массой Mr (или относительной атомной массой Ar). Относительная молекулярная (или атомная) масса Mr показывает, во сколько раз масса m0 молекулы (или атома) больше атомной единицы массы:
В периодической системе химических элементов Д. И. Менделеева (см. форзац 2) возле символов элементов указаны и их относительные атомные массы. В большинстве случаев при проведении расчётов значение относительной атомной массы округляют до целого числа, используя правила приближённых вычислений. Так, например, относительная атомная масса водорода равна 1, кислорода — 16, азота — 14.
Количество вещества, содержащегося в макроскопическом теле, определяют числом частиц в нём. Приведённые выше примеры показывают, насколько велико это число. Поэтому при расчётах принято использовать не абсолютное число частиц вещества, а относительное:
т. е. количество вещества ν определяют отношением числа частиц N этого вещества к постоянной Авогадро NA.
Основной единицей количества вещества в СИ является 1 моль (моль). 1 моль равен количеству вещества, содержащему столько же частиц, сколько атомов содержится в 0,012 кг изотопа углерода . Значит, в одном моле любого вещества находится одинаковое число атомов или молекул. Это число частиц обозначили NA и назвали постоянной Авогадро в честь итальянского учёного Амедео Авогадро (1776 – 1856). Постоянная Авогадро является одной из фундаментальных физических постоянных, её значение
В молекулярно-кинетической теории наряду с относительной молекулярной (или атомной) массой используют молярную массу M — массу вещества, взятого в количестве ν = 1 моль. Молярную массу M определяют отношением массы m вещества к его количеству ν:
Основной единицей молярной массы в СИ является килограмм на моль . Молярная масса вещества связана с его относительной молекулярной массой следующим соотношением:
Молярную массу вещества также можно вычислить по формуле
С учётом того, что , получим формулу для расчёта числа молекул в данном веществе:
От теории к практике
1. Во сколько раз число молекул водорода, взятого в количестве νв = 8 моль, больше числа молекул азота, количество вещества которого νа = 4 моль?
2. Используя выражение , рассчитайте число молекул в одном грамме воды и убедитесь в справедливости приведённого в начале параграфа значения.
1. В каких единицах измеряют массы атомов и молекул?
2. Что такое количество вещества? Назовите единицу этой физической величины.
3. Что такое постоянная Авогадро?
4. Что называют молярной массой вещества?
5. Объясните, почему количество вещества ν, его масса m и молярная масса М связаны соотношением .
6. Докажите, что молярную массу М можно связать с относительной молекулярной (атомной) массой Мr вещества соотношением .
7. Докажите, что концентрацию частиц вещества можно определить по формуле , где m0 — масса одной молекулы, ρ — плотность вещества.
Домашняя лаборатория
1. Предложите способ определения примерного числа молекул, испарившихся с каждого квадратного сантиметра поверхности воды, налитой в стакан, за промежуток времени Δt = 1 с.
Оборудование: стакан с водой, электронные весы (как можно с большей точностью измерения), секундомер, линейка.
2. Предложите способ определения числа частиц в кусочке мела (СаСО3).
Оборудование: кусочек мела, электронные весы.
Примеры решения задач
Пример 1. Определите молярную массу и массу одной молекулы сульфата меди(II) CuSO4.
Решение. Чтобы вычислить молярную массу М любого вещества, необходимо по химической формуле найти относительную молекулярную массу Mr этого вещества и полученное значение умножить на . Поскольку химическая формула сульфата меди(II) имеет вид CuSO4, то
Тогда молярная масса
Для определения массы молекулы CuSO4 воспользуемся формулой *:
Ответ:
Пример 2. Определите количество вещества и число атомов, содержащихся в железном бруске объёмом V = 100 см3. Плотность железа .
Дано:
ν — ?
N — ?
Решение: Количество вещества можно определить, воспользовавшись формулой , где m — масса железного бруска, а
— молярная масса железа. Поскольку
, то
.
Число атомов в данном железном бруске .
Ответ: ν = 14 моль, N = 8,4 · 1024.
* При решении задач постоянную Авогадро принять равной NA = 6,02 · 1023 моль–1 ↑
Упражнение 1
1. Определите молярные массы и массы молекул: а) воды H2O; б) углекислого газа CO2; в) аммиака NH3; г) азотной кислоты HNO3.
2. В стакан налита вода H2O массой m = 0,20 кг. Определите количество вещества и число молекул воды в стакане.
3. Определите массу молекул сероводорода H2S.
4. Сравните число частиц вещества в алюминиевом и медном кубиках одинакового объёма. Плотность алюминия , плотность меди
5. В серебряной пластинке атомов. Определите объём пластинки, если плотность серебра
.
7. Вода в открытом сосуде испарилась за промежуток времени Δt = 6,0 суток. Определите массу воды, находившейся в сосуде, если с её поверхности ежесекундно вылетало в среднем молекул.
8. Масса газа, молекулы которого состоят из атомов водорода и углерода, . Определите массы всех атомов водорода и углерода, если число молекул газа
.
9. Капелька духов, содержавшая ароматическое вещество массой , испарилась в комнате вместимостью
. Молярная масса ароматического вещества
. Определите среднее число
молекул этого вещества, попадающих при каждом вдохе в лёгкие человека, если объём вдыхаемого воздуха
.
Многие опыты показывают, что размер молекулы очень мал. Линейный размер молекулы или атома можно найти различными способами. Например, с помощью электронного микроскопа, получены фотографии некоторых крупных молекул, а с помощью ионного проектора (ионного микроскопа) можно не только изучить строение кристаллов, но определить расстояние между отдельными атомами в молекуле.
Используя достижения современной экспериментальной техники, удалось определить линейные размеры простых атомов и молекул, которые составляют около 10-8 см. Линейные размеры сложных атомов и молекул намного больше. Например, размер молекулы белка составляет 43*10-8 см.
Для характеристики атомов используют представление об атомных радиусах, которые дают возможность приближённо оценить межатомные расстояния в молекулах, жидкостях или твёрдых телах, так как атомы по своим размерам не имеют чётких границ. То есть атомный радиус – это сфера, в которой заключена основная часть электронной плотности атома (не менее 90…95%).
Размер молекулы настолько мал, что представить его можно только с помощью сравнений. Например, молекула воды во столько раз меньше крупного яблока, во сколько раз яблоко меньше земного шара.
Моль вещества
Массы отдельных молекул и атомов очень малы, поэтому в расчётах удобнее использовать не абсолютные значения масс, а относительные.
Относительная молекулярная масса (или относительная атомная масса) вещества Мr – это отношение массы молекулы (или атома) данного вещества к 1/12 массы атома углерода.
Мr = (m0) : (m0C / 12)
где m0 – масса молекулы (или атома) данного вещества, m0C – масса атома углерода.
Относительная молекулярная (или атомная) масса вещества показывает, во сколько раз масса молекулы вещества больше 1/12 массы изотопа углерода С12. Относительная молекулярная (атомная) масса выражается в атомных единицах массы.
Атомная единица массы – это 1/12 массы изотопа углерода С12. Точные измерения показали, что атомная единица массы составляет 1,660*10-27 кг, то есть
1 а.е.м. = 1,660 * 10-27 кг
Относительная молекулярная масса вещества может быть вычислена путём сложения относительных атомных масс элементов, входящих в состав молекулы вещества. Относительная атомная масса химических элементов указана в периодической системе химических элементов Д.И. Менделеева.
В периодической системе Д.И. Менделеева для каждого элемента указана атомная масса, которая измеряется в атомных единицах массы (а.е.м.). Например, атомная масса магния равна 24,305 а.е.м., то есть магний в два раза тяжелее углерода, так как атомная масса углерода равна 12 а.е.м. (это следует из того, что 1 а.е.м. = 1/12 массы изотопа углерода, который составляет большую часть атома углерода).
Зачем измерять массу молекул и атомов в а.е.м., если есть граммы и килограммы? Конечно, можно использовать и эти единицы измерения, но это будет очень неудобно для записи (слишком много чисел придётся использовать для того, чтобы записать массу). Чтобы найти массу элемента в килограммах, нужно атомную массу элемента умножить на 1 а.е.м. Атомная масса находится по таблице Менделеева (записана справа от буквенного обозначения элемента). Например, вес атома магния в килограммах будет:
m0Mg = 24,305 * 1 a.e.м. = 24,305 * 1,660 * 10-27 = 40,3463 * 10-27 кг
Массу молекулы можно вычислить путём сложения масс элементов, которые входят в состав молекулы. Например, масса молекулы воды (Н2О) будет равна:
m0Н2О = 2 * m0H + m0O = 2 * 1,00794 + 15,9994 = 18,0153 a.e.м. = 29,905 * 10-27 кг
Количество вещества принято считать пропорциональным числу частиц. Количество вещества – это физическая величина, характеризующая относительное число молекул и атомов в теле. Единица количества вещества называется молем (моль).
Моль равен количеству вещества системы, в которой содержится столько же молекул, сколько содержится атомов в 0,012 кг углерода С12. То есть, если у нас есть система с каким-либо веществом, и в этой системе столько же молекул этого вещества, сколько атомов в 0,012 кг углерода, то мы можем сказать, что в этой системе у нас 1 моль вещества.
Постоянная Авогадро
Количество вещества ν равно отношению числа молекул в данном теле к числу атомов в 0,012 кг углерода, то есть количеству молекул в 1 моле вещества.
ν = N / NA
где N – количество молекул в данном теле, NA – количество молекул в 1 моле вещества, из которого состоит тело.
NA – это постоянная Авогадро. Количество вещества измеряется в молях.
Постоянная Авогадро – это количество молекул или атомов в 1 моле вещества. Эта постоянная получила своё название в честь итальянского химика и физика Амедео Авогадро (1776 – 1856).
В 1 моле любого вещества содержится одинаковое количество частиц.
NA = 6,02 * 1023 моль-1
Молярная масса – это масса вещества, взятого в количестве одного моля:
μ = m0 * NA
где m0 – масса молекулы.
Молярная масса выражается в килограммах на моль (кг/моль = кг*моль-1).
Молярная масса связана с относительной молекулярной массой соотношением:
μ = 10-3 * Mr [кг*моль-1]
Масса любого количества вещества m равна произведению массы одной молекулы m0 на количество молекул:
m = m0N = m0NAν = μν
Количество вещества равно отношению массы вещества к его молярной массе:
ν = m / μ
Массу одной молекулы вещества можно найти, если известны молярная масса и постоянная Авогадро:
m0 = m / N = m / νNA = μ / NA
Более точное определение массы атомов и молекул достигается при использовании масс-спректрометра – прибора, в котором происходит разделение пучком заряженных частиц в пространстве в зависимости от их массы заряда при помощи электрических и магнитных полей.
Для примера найдём молярную массу атома магния. Как мы выяснили выше, масса атома магния равна m0Mg = 40,3463 * 10-27кг. Тогда молярная масса будет:
μ = m0Mg * NA = 40,3463 * 10-27 * 6,02 * 1023 = 2,4288 * 10-2 кг/моль
То есть в одном моле «помещается» 2,4288 * 10-2 кг магния. Ну или примерно 24,28 грамм.
Как видим, молярная масса (в граммах) практически равна атомной массе, указанной для элемента в таблице Менделеева. Поэтому когда указывают атомную массу, то обычно делают так:
Атомная масса магния равна 24,305 а.е.м. (г/моль).
Можете посчитать молярную массу для различных элементов и убедиться в правоте этого утверждения. Для расчёта молярной массы можно использовать простой калькулятор, который находится внизу страницы:
Определение размеров молекул
1 способ. Основан на том, что молекулы вещества, когда оно находится в твердом или жидком состоянии, можно считать плотно прилегающими друг к другу. В таком случае для грубой оценки можно считать, что объем V некоторой массы m вещества просто равен сумме объемов содержащихся в нем молекул. Тогда объем одной молекулы мы получим, разделив объем V на число молекул N.
Число молекул в теле массой m равно, как известно, 
где М — молярная масса вещества NA — число Авогадро.
Отсюда объем V0 одной молекулы определяется из равенства
В это выражение входит отношение объема вещества к его массе.
Обратное же отношение
есть плотность вещества,
так что
Плотность практически любого вещества можно найти в доступных всем таблицах. Молярную массу легко определить, если известна химическая формула вещества.
Объем одной молекулы, если считать ее шариком, равен 
где r — радиус шарика.
Поэтому 
откуда мы и получаем выражение для радиуса молекулы:
Первый из этих двух корней — постоянная величина, равная ≈ 7,4 · 10-9 моль 1/3, поэтому формула для r принимает вид 
Например, радиус молекулы воды, вычисленный по этой формуле, равен rВ ≈ 1,9 · 10-10 м.
Описанный способ определения радиусов молекул не может быть точным уже потому, что шарики нельзя уложить так, чтобы между ними не было промежутков, даже если они соприкасаются друг с другом. Кроме того, при такой «упаковке» молекул – шариков были бы невозможны молекулярные движения. Тем не менее, вычисления размеров молекул по формуле, приведенной выше, дают результаты, почти совпадающие с результатами других методов, несравненно более точных.
2 способ. Метод Ленгмюра и Дево. В данном методе исследуемая жидкость должна растворяться в спирте (эфире) и быть легче воды, не растворяясь в ней. При попадании капли раствора на поверхность воды спирт растворяется в воде, а исследуемая жидкость образует пятно площадью S и толщиной d (порядка диаметра молекул).
Если допустить, что молекула имеет форму шара, то объем одной молекулы равен:

Необходимо определить диаметр молекулы d. В микропипетку набрать 0,5 мл раствора и, расположив ее над сосудом, отсчитать число капель n, содержащихся в этом объеме. Проделав опыт несколько раз, найти среднее значение числа капель в объеме 0,5 мл, а затем подсчитать объём исследуемой жидкости в капле: 
В ванну налить воду толщиной 1 – 2 см. Насыпать тальк тонким слоем на лист бумаги, ударяя слегка пальцем по коробочке. Расположив лист бумаги выше и сбоку от ванны на расстоянии 10 – 20 см, тальк сдуть с бумаги. На поверхность воды в ванне из пипетки капнуть одну каплю раствора. Линейкой измерить, средний диаметр образовавшегося пятна D и подсчитываю его площадь. Опыт повторить 2- 3 раза, а затем подсчитать диаметр молекул d.
3 способ. Определение диаметра молекулы. Будем считать, что капля масла растекается по воде до тех пор, пока толщина масляной плёнки не станет равной одной молекуле, тогда диаметр одной молекулы можно определить по формуле: d=V/S, где V – объём капли масла, S — площадь масленого пятна.
Объём капли масла можно определить следующим образом: накапать 100 капель из капилляра в сосуд и измерить массу масла в нём. После этого массу, выраженную в килограммах, поделить на плотность масла, которую можно взять из таблицы плотности некоторых веществ (плотность масла растительного 800 кг/м3).
Затем полученный результат поделить на количество капель. Объём капли можно определить также с помощью мерного цилиндра: накапать масло в цилиндр, измерить его объём в см3 и перевести в м3, для чего поделить на 1000000, затем на количество капель масла. После того, как объём капли стал известен нужно капнуть одну каплю масла на поверхность воды, которая налита в широкий сосуд.
Для ускорения реакции предварительно немного нужно нагреть воду – приблизительно до 400С. Масло начнёт растекаться, и в результате получится круглое пятно. После того, как пятно перестанет расширяться, с помощью линейки измерить его диаметр и рассчитать площадь пятна по формуле:
Практическое получение наночастиц
В современном мире в связи с общей тенденцией к миниатюризации большими темпами стала развиваться такая наука, как нанотехнология. Методы нанотехнологии позволяют получить принципиально новые устройства и материалы с характеристиками, значительно превосходящими их современный уровень, что весьма важно для интенсивного развития многих областей техники, биотехнологии, медицины, охраны окружающей среды и др.
Ход работы:
1) Определение объёма капли

2) Определение объёма капли путём взвешивания.
1. На весы накапали 10 капель растительного масла, измерили массу
mk=0,2 г
- Масса 1 капли m1=0,2 г/10=0,02 г
- Определение объёма капли V=m1/q=0,01г/0,8 г/см3=13 мм3
3) Определяем площадь пятна Sмасла=ПR2=11304 мм2
(Приложение 1,2,3,4,5)
4) Площадь пятна нефти Sнефти=20*16=32000 мм2
(Приложение 6,7,8,9)
5) Определяем толщину плёнки h=V/S
Для масла h=13/11304=1,2*10-7=120 нм
Для нефтиh=13/32000=4*10-8 м=40 нм
Вывод: В лабораторных условиях можно получать нанопленки
Заключение
Мы измерили толщину наноплёнок масла и нефти, изучили физические свойства плёнок и методы их получения, также ознакомились с физическими методами исследования микро- и наномасшатабных объектов.
К сожалению, из таких жидкостей как кислоты(уксусная, ортофосфорная, борная), моющие средства и мыло у нас не получилось сделать наноплёнки, потому что все эти жидкости гидрофобные(боятся воды).Мы пытались получить пленки с помощью скотча, но электронные весы позволяют измерять массу с точностью до десятых долей грамма
Список использованной литературы
- Анциферов Л.И. Самодельные приборы для физического практикума в средней школе. М.: Просвещение, 1985.
- Блудов М.И. Беседы по физике. М.: Просвещение, 1984.
- Буров В.А. Практикум по физике в средней школе. М.: Просвещение, 1973.
Приложения

Размеры атомов и молекул
Туннельные
микроскопы обеспечивают увеличение в
100 млн раз. Это позволяет измерять размеры
атомов с очень большой точностью. Так,
диаметр атома углерода оказался равным
1,4·10-8
см. Такой же порядок имеют и размеры
других атомов.
Размеры атомов и
молекул, найденные другими методами,
оказываются примерно такими же.
Эти
размеры так малы, что их невозможно себе
представить. Что вам может сказать,
например, число 2,3·10-8см
— размер молекулы водорода? В таких
случаях прибегают к помощи сравнений.
Если, например, вашу голову увеличить
до размеров средней звезды типа Солнца,
то молекула при этом увеличится до
размеров головы.
А
вот еще сравнение. Если представить
себе, что все размеры в мире возросли в
108
раз, то молекула водорода будет выглядеть
как шарик диаметром всего в 2,3 см (средних
размеров слива), а рост человека стал
бы равным 170 000 км, размер мухи — 10 000 км,
толщина волоса — 10км, размер красного
кровяного тельца (эритроцита) — 700 м.
Число молекул
При
столь малых размерах молекул число их
в любом макроскопическом теле чрезвычайно
велико. Подсчитаем приблизительное
число молекул в капле воды массой 1 г и,
следовательно, объемом 1 см3.
Диаметр молекулы воды равен приблизительно
3·10-8см.
Считая, что каждая молекула воды при
плотной упаковке молекул занимает объем
(3·10-8
см)3,
можно найти число молекул в капле,
разделив объем капли (1 см3)
на объем, приходящийся на одну молекулу:
Представьте
себе, что поверхность земного шара
твердая и гладкая. На всей поверхности
вплотную друг к другу стоят люди. Число
людей при этом будет чуть меньше числа
молекул в 1 см3
воздуха при нормальном атмосферном
давлении и температуре 0 °С.
Надо
помнить основные положения
молекулярно-кинетической теории. Атомы
имеют размеры порядка 10-8см.
Изображения
атомов, полученные с помощью туннельного
микроскопа, не оставляют никаких сомнений
в их существовании,
§ 2.2. Масса молекул. Постоянная Авогадро
Массы молекул
очень малы, если выражать их в граммах
или килограммах, а число молекул в
макроскопических телах огромно. С очень
маленькими и очень большими числами
иметь дело неудобно. Ученые нашли
довольно простой способ избежать этого
неудобства и характеризовать массы
молекул и их число вполне обозримыми
числами, не выходящими далеко за пределы
сотни. Сейчас вы познакомитесь с тем,
как это делается.
Масса молекулы воды
В
предыдущем параграфе мы выяснили, что
в 1 г воды содержится 3,7·1022
молекул. Следовательно, масса одной
молекулы равна:
Массы такого же
порядка имеют и молекулы других веществ,
исключая огромные молекулы органических
соединений. Например, масса молекулы
гемоглобина превышает массу молекулы
воды в несколько десятков тысяч раз.
Относительная молекулярная масса
Так
как массы молекул очень малы, удобно
использовать не абсолютные значения
масс, а относительные. По международному
соглашению, принятому в 1961 г., массы всех
молекул сравнивают с
массы атома углерода* (так называемая
углеродная шкала атомных масс). Главная
причина выбора углеродной шкалы атомных
масс состоит в том, что углерод входит
в огромное число различных органических
соединений. Этот выбор позволяет очень
точно сравнивать массы атомов тяжелых
элементов с массой атома углерода.
Множительвведен для того, чтобы относительные
массы атомов были близки к целым числам.
Относительная масса атома углерода
точно равна 12, а атома водорода примерно
равна единице.
*
Точнее, с
массы атома наиболее
распространенного изотопа углерода-12.
Относительной
молекулярной (или атомной) массой
вещества Мr
называют
отношение массы молекулы (или атома)
данного вещества к
массы
атома углерода т0С:

(2.2.1)
Относительные
атомные массы всех химических элементов
точно измерены. Складывая относительные
атомные массы, можно вычислить
относительную молекулярную массу.
Например, относительная молекулярная
масса воды Н2О
приближенно равна 18, так как относительные
атомные массы водорода и кислорода
примерно равны 1 и 16:2-1 + 16=18.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Основные положения МКТ. Масса и размер молекул. Количество вещества. Молекулярная физика
- Подробности
- Обновлено 07.10.2018 21:04
- Просмотров: 1193
МКТ — это просто!
«Ничто не существует, кроме атомов и пустого пространства …» — Демокрит
«Любое тело может делиться до бесконечности» — Аристотель
Основные положения молекулярно-кинетической теории (МКТ)
Цель МКТ — это объяснение строения и свойств различных макроскопических тел и тепловых явлений, в них протекающих, движением и взаимодействием частиц, из которых состоят тела.
Макроскопические тела — это большие тела, состоящие из огромного числа молекул.
Тепловые явления — явления, связанные с нагреванием и охлаждением тел.
Основные утверждения МКТ
1. Вещество состоит из частиц (молекул и атомов).
2. Между частицами есть промежутки.
3. Частицы беспорядочно и непрерывно движутся.
4. Частицы взаимодействуют друг с другом (притягиваются и отталкиваются).
Подтверждение МКТ:
1. экспериментальное
— механическое дробление вещества; растворение вещества в воде; сжатие и расширение газов; испарение; деформация тел; диффузия; опыт Бригмана: в сосуд заливается масло, сверху на масло давит поршень, при давлении 10 000 атм масло начинает просачиваться сквозь стенки стального сосуда;
— диффузия; броуновское движение частиц в жидкости под ударами молекул;
— плохая сжимаемость твердых и жидких тел; значительные усилия для разрыва твердых тел; слияние капель жидкости;
2. прямое
— фотографирование, определение размеров частиц.
Броуновское движение
Броуновское движение — это тепловое движение взвешенных частиц в жидкости (или газе).
Броуновское движение стало доказательством непрерывного и хаотичного (теплового) движения молекул вещества.
— открыто английским ботаником Р. Броуном в 1827 г.
— дано теоретическое объяснение на основе МКТ А. Эйнштейном в 1905 г.
— экспериментально подтверждено французским физиком Ж. Перреном.
Масса и размеры молекул
Размеры частиц
Диаметр любого атома составляет около см.
Число молекул в веществе
где V — объем вещества, Vo — объем одной молекулы
Масса одной молекулы
где m — масса вещества,
N — число молекул в веществе
Единица измерения массы в СИ: [m]= 1 кг
В атомной физике массу обычно измеряют в атомных единицах массы (а.е.м.).
Условно принято считать за 1 а.е.м. :
Относительная молекулярная масса вещества
Для удобства расчетов вводится величина — относительная молекулярная масса вещества.
Массу молекулы любого вещества можно сравнить с 1/12 массы молекулы углерода.
где числитель — это масса молекулы, а знаменатель — 1/12 массы атома углерода
— это величина безразмерная, т.е. не имеет единиц измерения
Относительная атомная масса химического элемента
где числитель — это масса атома, а знаменатель — 1/12 массы атома углерода
— величина безразмерная, т.е. не имеет единиц измерения
Относительная атомная масса каждого химического элемента дана в таблице Менделеева.
Другой способ определения относительной молекулярной массы вещества
Относительная молекулярная масса вещества равна сумме относительных атомных масс химических элементов, входящих в состав молекулы вещества.
Относительную атомную массу любого химического элемента берем из таблицы Менделеева!)
Количество вещества
Количество вещества (ν) определяет относительное число молекул в теле.
где N — число молекул в теле, а Na — постоянная Авогадро
Единица измерения количества вещества в системе СИ: [ν]= 1 моль
1 моль — это количество вещества, в котором содержится столько молекул (или атомов), сколько атомов содержится в углероде массой 0,012 кг.
Запомни!
В 1 моле любого вещества содержится одинаковое число атомов или молекул!
Но!
Одинаковые количества вещества для разных веществ имеют разную массу!
Постоянная Авогадро
Число атомов в 1 моле любого вещества называют числом Авогадро или постоянной Авогадро:
Молярная масса
Молярная масса (M) — это масса вещества, взятого в одном моле, или иначе — это масса одного моля вещества.
где
— масса молекулы
— постоянная Авогадро
Единица измерения молярной массы: [M]=1 кг/моль.
Формулы для решения задач
Эти формулы получаются в результате подстановки вышерассмотренных формул.
Масса любого количества вещества
и формула для 7 класса
Количество вещества
Число молекул в веществе
Молярная масса
Масса одной молекулы
Связь между относительной молекулярной массой и молярной массой
Молекулярная физика. Термодинамика — Класс!ная физика
Основные положения МКТ. Масса и размер молекул. Количество вещества. —
Взаимодействие молекул. Строение твердых тел, жидкостей и газов. —
Идеальный газ. Основное уравнение МКТ. —
Температура. Тепловое равновесие. Абсолютная шкала температур. —
Уравнение состояния идеального газа. —
Изопроцессы. Газовые законы. —
Взаимные превращения жидкостей и газов. Влажность воздуха. —
Твердые тела. Кристаллические тела. Аморфные тела.