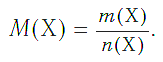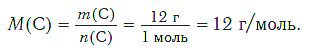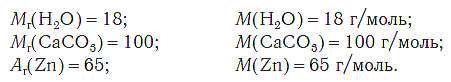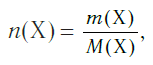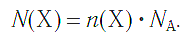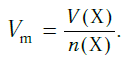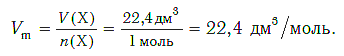В этой статье мы собираемся проанализировать, как найти массу из молей и молярной массы.
Найти массу из молей и молярной массы очень просто. Это можно сделать, используя приведенное ниже соотношение:
Где,

n = количество молей (моль)
m = масса в граммах (г)
M = молярная масса (г/моль)
Мы можем лучше понять это, решив несколько примеров:
Как найти массу из молей и молярной массы Примеры:
1. Рассчитайте массу О2, если молярная масса равна 10.2 моль.
Решение:
Молярная масса = O2 = 16×2 = 32 г/моль
n = 10.2 моль
m = n × M = 10.2 моль × 32 г/моль = 326.4 г
2. На пляже XYZ в песке много минералов. SiO2 был одним из них, который был оценен, и у него было 12.5 молей, так какова масса SiO2 ?
Решение:
Молярная масса = SiO2 = 28 + 16×2 = 60 г.
n = 12.5 моль
m = n × M = 12.5 моль × 60 г/моль = 750 г
3. Рассчитайте массу 7.86 моль Хлорид кальция?
Решение:
Мы знаем, что формула хлорида кальция CaCl2.
Молярная масса = CaCl2 = 40 + 35.45×2 = 110.90 г/моль
n = 7.86 моль
m = n × M = 7.86 моль × 110.90 г/моль = 871.674 г
4. Студент в лаборатории приготовил 6.8 моль KNO3 и использовал его для титрования, поэтому для проведения расчетов какова будет его масса?
Решение:
Молярная масса = KNO3 = 39 + 14 + 3×16 = 110 г/моль
n = 6.8 моль
m = n×M = 6.8 моль × 110 г/моль = 748 г
5. Рассчитайте массу FeCl3 с числом молей, равным 5.7 моля.
Решение:
Молярная масса = FeCl3 = 55.845 +35.453×3 = 162.204 г/моль
n = 5.7 моль
m = n × M = 5.7 × 162.204 = 924.562 г
6. Рассчитайте массу 2.7 молей сульфата бария.
Решение:
Молярная масса = BaSO4 = 137.33 + 32.06 + 64 = 233.39 г/моль
n = 2.7 моль
м = п × М = 2.7 × 233.39 = 630.153 г
7. Рассчитайте массу 3.98 моль хлорида стронция.
Решение:
Молярная масса = SrCl2 = 87.62 + 35.453 + 35.453 = 158.52 г/моль.
n = 3.98 моль
м = п × М = 3.98 × 158.52 = 630.90 г
8. Рассчитайте массу 4.32 моля фосфата аммония.
Решение:
Молярная масса = (NH4)3PO4 = 14.01 × 3 + 12 + 30.97 + 16 = 149.12 г/моль.
n = 4.32 моль
м = п × М = 4.32 × 149.12 = 644.198 г
9. Рассчитайте массу 3.7 молей нитрата магния.
Решение:
Молярная масса = Mg(NO3)2 = 24 + 2×14 + 6×16 = 148 г/моль
n = 3.7 моль
м = п × М = 3.7 × 148 = 547.6 г
10.Рассчитайте массу 4.24 моль гидроксида алюминия.
Решение:
Молярная масса = Al(OH)3 = 27 + 16×3 + 3 = 78 г/моль
n = 4.24 моль
m = n × M = 4.24 × 78 = 330.72 г
11. Рассчитайте массу 1.49 моль йодида свинца (II).
Решение:
Молярная масса = PbI2 = 207.2 + 253.80 = 461 г/моль
n = 1.49 моль
m = n × M = 1.49 × 461 = 686.89 г
12. Рассчитайте массу 5.34 молей карбоната магния.
Решение:
Молярная масса = МгСО3 = 24 +12 + 16×3 =84 г/моль
n = 5.34 моль
m = n×M = 5.34 + 84 = 448.56 г
13.Рассчитайте массу 6.136 молей мышьяковой кислоты.
Решение:
Молярная масса = H3AsO4 = 3 + 74.9 + 3×16 = 141.9 г/моль
n = 6.136 моль
m = n × M = 6.136 × 141.9 = 870.69 г
14. Рассчитайте массу 4.59 моль карбоната лития.
Молярная масса = Li2CO3 = 13.88 + 12 + 3×16 = 73.89 г/моль
n = 4.59 моль
m = n × M = 4.59 × 73.89 = 339.15 г
15. Рассчитайте массу 4.999 молей бытового отбеливателя.
Решение:
Молярная масса = NaOCl = 23 + 16 + 35.4 = 74.4 г/моль
n = 4.999 моль
m = n × M = 4.99 × 74.4 = 371.92 г
16. Рассчитайте массу 2.156 моль дихромата калия.
Решение:
Молярная масса = K2Cr2O7 = 78 + 104 + 112 = 294 г/моль
n = 2.156 моль
m = n × M = 2.156 × 294 = 633.96 г
Узнайте больше о: Как Чтобы найти молярную массу из молярности: подробное объяснение
Как рассчитать молярную массу без массы ?
Обычно наиболее распространенным методом нахождения молярной массы является использование формулы M = m/n, которая подробно обсуждалась в предыдущем разделе.
Используя метод коллигативных свойств, мы можем вычислить молярную массу, не вдаваясь в картину. Давайте проанализируем, как в следующем разделе:
Бензол используется для растворения вещества (неизвестного вещества, молярная масса которого должна быть оценена) и доводится до 1.55 % (% массы неизвестной смеси к бензолу). Температура кипения бензола повышается примерно на 2.3%.
Учитывая коллигативные свойства:
Фактическая температура кипения бензола = 80 градусов по Цельсию.
ΔT = изменение температура кипения (1.84 градуса) 80×0.023
I = Вант-Гофф (коэффициент), для бензола считается быть одним, поскольку это не электролит.
m = моляльность
K = константа для бензола (точка кипения) составляет около 2.53.
Теперь,

= 1.84/1× 2.53
m = 0.728 моль (неизвестно)/кг бензола
Мы взяли смесь 1.55%.
Таким образом, на 1.55 г раствора приходится 1.55% массы, что означает 100 г неизвестного вещества.
Следовательно, неизвестная молярная масса будет отношением:
Молярная масса = рассчитанная из бензольного метода/ 0.728 моль
Вася Иванов
Мореплаватель — имя существительное, употребляется в мужском роде. К нему может быть несколько синонимов.
1. Моряк. Старый моряк смотрел вдаль, думая о предстоящем опасном путешествии;
2. Аргонавт. На аргонавте были старые потертые штаны, а его рубашка пропиталась запахом моря и соли;
3. Мореход. Опытный мореход знал, что на этом месте погибло уже много кораблей, ведь под водой скрывались острые скалы;
4. Морской волк. Старый морской волк был рад, ведь ему предстояло отчалить в долгое плавание.
Как найти массу вещества через объем
Масса вещества m — это величина, равная произведению молярной массы вещества M и количества вещества n. Формула расчета усложняется, если и эти показатели придется рассчитывать через другие известные.

Вам понадобится
- Таблица плотностей, калькулятор.
Инструкция
Если в задаче вам известны следующие данные: давление p, объем v, температура T в градусах термодинамической шкалы Кельвина (К) и молярная масса вещества M, тогда массу данного вещества m найдите по формуле: p*v=m/M*R*T, выразив из нее m. У вас должна получиться следующая формула: m=M*p*v/(R*T) . R — это универсальная газовая постоянная, равная 8,314 Дж/(моль*К) .
Решите предлагаемое задание. Задача: Найдите массу вещества m, если p=10 Па, v=2 кубических метра, T=30 К, M=24 кг/моль. Подставьте все известные значения в последнюю формулу и сосчитайте (ответ: масса вещества m примерно равна 1,9 кг).
Найти массу вещества m можно также, если вам известны только объем v и само вещество. Это позволяет сделать следующая формула: m=ro*v, где ro — это плотность вещества (масса его единичного объема), измеряется в кг/кубический метр. Найти плотность самого вещества можно найти в таблице плотностей.
Теперь решите предлагаемое задание: найдите массу алюминия m, если v=2 кубических метра. Чтобы решить данную задачу, найдите плотность алюминия в таблице плотностей ( ro (алюминия) =2,7*10^3 кг/кубический метр) и сосчитайте значение массы алюминия m по уже известной формуле. В итоге вы получите ответ, что масса алюминия m равна 5400 кг).
Нужно ли вообще знать объем тела и плотность вещества, из которого оно сделано, чтобы найти его массу? Например, известно, что объем латуни равен объему алюминия, но масса латуни больше массы алюминия. Можно предположить, что у латуни и алюминия разная плотность. Вывод: чтобы найти массу тела, надо знать его объем и массу единицы объема. Масса единицы объема — это и есть плотность вещества ro.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Основные формулы для решения задач по химии
05-Авг-2012 | комментариев 450 | Лолита Окольнова
Все, все основные задачи по химии решаются с помощью
нескольких основных понятий и формул.
У всех веществ разная масса, плотность и объем. Кусочек металла одного элемента может весить во много раз больше, чем точно такого же размера кусочек другого металла.
Моль (количество моль)
обозначение: моль, международное: mol — единица измерения количества вещества. Соответствует количеству вещества, в котором содержится NA частиц (молекул, атомов, ионов). Поэтому была введена универсальная величина — количество моль. Часто встречающаяся фраза в задачах — «было получено… моль вещества»
NA = 6,02 · 1023
NA — число Авогадро. Тоже «число по договоренности». Сколько атомов содержится в стержне кончика карандаша? Несколько миллионов. Оперировать такими величинами не удобно. Поэтому химики и физики всего мира договорились — обозначим 6,02 · 1023 частиц (атомов, молекул, ионов) как 1 моль вещества.
1 моль = 6,02 · 1023 частиц
Это была первая из основных формул для решения задач.
Молярная масса вещества
Молярная масса вещества — это масса одного моль вещества. Обозначается как M
Есть еще молекулярная масса — Mr
Находится по таблице Менделеева — это просто сумма атомных масс вещества.
Например, нам дана серная кислота — H2SO4. Давайте посчитаем молярную массу вещества: атомная масса H =1, S-32, O-16.
Mr(H2SO4)=1•2+32+16•4=98 гмоль.
Вторая необходимая формула для решения задач —
формула массы вещества:
Т.е., чтобы найти массу вещества, необходимо знать количество моль (n), а молярную массу мы находим из Периодической системы.
Закон сохранения массы — масса веществ, вступивших в химическую реакцию, всегда равна массе образовавшихся веществ.
Если мы знаем массу (массы) веществ, вступивших в реакцию, мы можем найти массу (массы) продуктов этой реакции. И наоборот.
Третья формула для решения задач по химии —
объем вещества:
Откуда взялось число 22.4? Из закона Авогадро:
в равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул.
Согласно закону Авогадро, 1 моль идеального газа при нормальных условиях (н.у.) имеет один и тот же объём Vm = 22,413 996(39) л
Т.е., если в задаче нам даны нормальные условия, то, зная количество моль (n), мы можем найти объем вещества.
Итак, основные формулы для решения задач по химии
Число Авогадро NA
6,02 · 1023 частиц
Количество вещества n (моль)
n=mM
n=V22.4 (лмоль)
Масса вещества m (г)
m=n•Mr
Объем вещества V(л)
V=n•22.4 (лмоль)
или вот еще удобная табличка:
Это формулы. Часто для решения задач нужно сначала написать уравнение реакции и (обязательно!) расставить коэффициенты — их соотношение определяет соотношение молей в процессе.
В ОГЭ и ЕГЭ по химии задач , в которых нужно было бы найти только объем массу кол-во моль нет — это обычно ЧАСТЬ решения задачи. Однако, чтобы легко решать более сложные задачи, нужно тренироваться на таких вот небольших упражнениях.
Находим количество вещества по массе
1 Какое количество вещества алюминия содержится в образце металла массой 10.8 г?2 Какое количество вещества содержится в оксиде серы (VI) массой 12 г?
3 Определите количество моль брома, содержащееся в массе 12.8 г.
Находим массу по количеству вещества:
4. Определите массу карбоната натрия количеством вещества 0.25 моль.Объем по количеству вещества:
5. Какой объем будет иметь азот при н.у., если его количество вещества 1.34 моль?6. Какой объем занимают при н.у. 2 моль любого газа?
Ответы:/p>
- 0.4 моль
- 0.15 моль
- 0.08 моль
- 26.5 г
- 30 л
- 44.8 л
Категории:
|
Обсуждение: «Основные формулы для решения задач по химии»
(Правила комментирования)
В уроке 9 «Молярная масса и молярный объем» из курса «Химия для чайников» выясним, что подразумевается под молярной массой и молярным объемом; приведем формулы для их вычисления. Напоминаю, что в прошлом уроке «Химическое количество вещества и моль» мы выяснили, что такое химическое количество вещества; рассмотрели моль в качестве единицы количества вещества, а также познакомились с постоянной Авогадро.
Молярная масса
Вы знаете, что одинаковое химическое количество любых веществ содержит одно и то же число структурных единиц. Но у каждого вещества его структурная единица имеет собственную массу. Поэтому и массы одинаковых химических количеств различных веществ тоже будут различны.
Молярная масса — это масса порции вещества химическим количеством 1 моль.
Молярная масса вещества Х обозначается символом M(Х). Она равна отношению массы данной порции вещества m(Х) (в г или кг) к его химическому количеству n(Х) (в моль):
В Международной системе единиц молярная масса выражается в кг/моль. В химии чаще используется дольная единица — г/моль.
Определим молярную массу углерода. Масса углерода химическим количеством 1 моль равна 0,012 кг, или 12 г. Отсюда:
Молярная масса любого вещества, если она выражена в г/моль, численно равна его относительной молекулярной (формульной) массе.
Например:
На рисунке 47 показаны образцы веществ (H2O, CaCO3, Zn), химическое количество которых одно и то же — 1 моль. Как видите, массы разных веществ химическим количеством 1 моль различны.
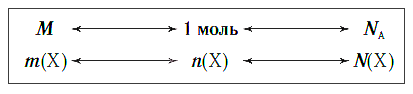
Молярная масса является важной характеристикой каждого отдельного вещества. Она отражает зависимость между массой и химическим количеством вещества. Зная одну из этих величин, можно определить вторую — массу по химическому количеству:
и, наоборот, химическое количество по массе:
а также число структурных единиц:
Взаимосвязь между этими тремя характеристиками вещества в любом его агрегатном состоянии можно выразить простой схемой:
Молярный объем
В отличие от твердых и жидких веществ все газообразные вещества химическим количеством 1 моль занимают одинаковый объем (при одинаковых условиях). Эта величина называется молярным объемом и обозначается Vm.
Подобно молярной массе, молярный объем газа равен отношению объема данного газообразного вещества V(Х) к его химическому количеству n(Х):
Так как объем газа зависит от температуры и давления, то при проведении различных расчетов берутся обычно объемы газов при нормальных условиях (сокращенно — н. у.). За нормальные условия принимаются температура 0 °С и давление 101,325 кПа.
Установлено, что при нормальных условиях отношение объема любой порции газа к химическому количеству газа есть величина постоянная и равная 22,4 дм3/моль. Другими словами, молярный объем любого газа при нормальных условиях:
Молярный объем — это объем, равный 22,4 дм3, который занимает 1 моль любого газа при нормальных условиях.
Пример 1. Вычислите химическое количество SiO2, масса которого равна 240 г.
Спойлер
[свернуть]
Пример 2. Определите массу серной кислоты H2SO4, химическое количество которой 2,5 моль.
Спойлер
[свернуть]
Пример 3. Сколько молекул CO2 и сколько атомов кислорода содержится в углекислом газе массой 110 г?
Спойлер
[свернуть]
Пример 4. Какой объем занимает кислород химическим количеством 5 моль при нормальных условиях?
Спойлер
[свернуть]
Краткие выводы урока:
- Масса вещества химическим количеством 1 моль называется его молярной массой. Она равна отношению массы данной порции вещества к его химическому количеству.
- Объем газообразных веществ химическим количеством 1 моль при нормальных условиях одинаков и равен 22,4 дм3.
- Величина, равная 22,4 дм3/моль, называется молярным объемом газов.
Надеюсь урок 9 «Молярная масса и молярный объем» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Данный урок был заключительным в главе «Основные химические понятия».