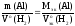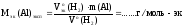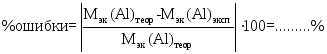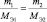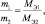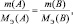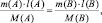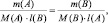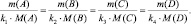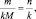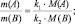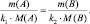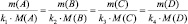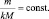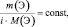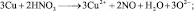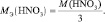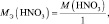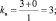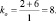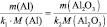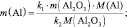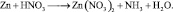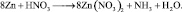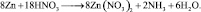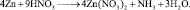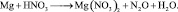Определение молярной массы эквивалента алюминия
Цель работы: Освоить метод определения молярной массы эквивалента металла, основанный на вытеснении водорода из разбавленных растворов кислот или щелочей.
Оборудование и реактивы: прибор для определения молярной массы эквивалента металла (Рис. 2.1.); раствор соляной кислоты (HCl) 0,5 н; раствор едкого натра (NaOH) 0.5 н, микронавеска аллюминия ~ 0,002 г.
Принцип действия прибора для определения молярной массы эквивалента металлов
Прибор состоит из бюретки (1) ёмкостью 20 – 50 мл, открытой трубки (2), служащей в качестве уравнительного сосуда, стеклянного тройника с краном или зажимом (3) и сосуда Ландольдта (двухколенная пробирка) (4). Бюретка и уравнительная трубка содержат столько воды, чтобы при равенстве уровней воды в каждой трубке мениск в бюретке оказался на нулевом делении. Пробки – каучуковые, хорошо подогнанные и плотно закрывающие отверстия. Весь прибор крепится на металлическом штативе.
Ход опыта.
1) Навеску алюминиевой фольги или кусочка проволоки поместить в одно из колен сосуда (4). Во второе колено налить раствор кислоты или щелочи (избыток по сравнению с расчетным количеством).
2) Проверить прибор на герметичность. Для этого плотно вставить пробки, закрыть зажим (3) и опустить уравнительную трубку на 10 – 15 см. если прибор герметичен, то уровень воды в бюретке несколько снизится, а затем останется без изменения.
3) Привести давление в бюретке к атмосферному: вода в бюретке и в уравнительной трубке должна быть на одном и том же уровне.
4) Перелить раствор кислоты или щелочи в колено с навеской металла.
5) Наблюдать за течением опыта, периодически опуская уравнительную трубку, чтобы уровни воды в ней и в бюретке были примерно одинаковы.
6) После окончания реакции дать пробирке охладиться до комнатной температуры; привести давление к атмосферному (уравнять уровни воды в трубке и бюретке) и отсчитать объем выделившегося водорода.
7) Записать результаты эксперимента:
1. Навеска алюминия (m)…………………….. г.
2. Объем выделившегося водорода (V)…. мл
3. Температура опыта………………………….. °С
4. Атмосферное давление (Р)……………….. мм. рт. ст.
5. Давление водяного пара при температуре опыта (20°) мм. рт. ст.
Обработка результатов эксперимента
1) При взаимодействии алюминия с кислотой или щелочью происходят реакции:
Следовательно на 2 моль алюминия выделяется в обоих случаях 3 моль . Фактор эквивалентности для алюминия

2) Привести объем водорода к нормальным условиям, воспользовавшись формулой объединенного газового закона.
Водород в приборе находится в смеси с парами воды, следовательно необходимо рассчитать его парциальное давление:
(Значение давления насыщенных водяных паров при температуре опыта надо взять в Приложении 1.)
3) По закону эквивалентов определить молярную массу эквивалента алюминия:
4) Вычислить относительную погрешность опыта:в
Проанализировать причины ошибки.
Последовательность расчетов:
1.Найти давление паров сухого водорода Р(атм) – Р(паров воды)
2.Найт и Объемную долю водорода в смеси с водяными парами : φ =Р(водорода) / Р(атм)
3.Найти объем сухого водорода: ( V(нач.) —V (кон.)) *φ 20
4.Привести объем водорода к нормальным условиям по формуле объединенного газового закона.
Молярная масса эквивалента вещества
Вычислить молярные массы эквивалента вещества: хлорида цинка (ZnCl2), карбоната натрия (Na2CO3), гидроксида алюминия (Al(OH)3).
Решение задачи
Хлорид цинка (ZnCl2)относится к классу солей, в своем составе содержит один атом металла со степенью окисления +2. Эквивалентное число для соли находим по формуле:
Получаем:
z (ZnCl2 )= 1 ⋅ 2 = 2
Молярная масса хлорида цинка (ZnCl2) равна:
М (ZnCl2 ) = 65 + 2 ⋅ 35,5 = 136 (г/моль).
Теперь можно вычислить молярную массу эквивалента вещества хлорида цинка (ZnCl2) по формуле:
Получаем:
M (1/2 ZnCl2) = 136 / 2 = 68 (г/моль).
Карбонат натрия (Na2CO3) относится к классу солей, в своем составе содержит два атома металла со степенью окисления +1. Эквивалентное число для соли находим по формуле:
Получаем:
z (Na2CO3)= 2 ⋅ 1 = 2
Молярная масса карбоната натрия (Na2CO3) равна:
М (Na2CO3) = 2 ⋅ 23 + 12 + 3 ⋅ 16 = 106 (г/моль).
Теперь можно вычислить молярную массу эквивалента вещества карбоната натрия (Na2CO3) по формуле:
Получаем:
M (1/2 Na2CO3) = 106 / 2 = 53 (г/моль).
Гидроксид алюминия (Al(OH)3)относится к классу оснований, в своем составе содержит три группы ОН–, эквивалентное число z (Al(OH)3) = 3. Таким образом, химический эквивалент данного соединения – это условная частица, составляющая 1/3 часть реально существующей молекулы гидроксида алюминия (Al(OH)3).
Молярная масса гидроксида алюминия (Al(OH)3) равна:
М (Al(OH)3) = 27 + 3 ⋅ (16 + 1) = 78 (г/моль).
Теперь можно вычислить молярную массу эквивалента вещества гидроксида алюминия (Al(OH)3) по формуле:
Получаем:
M (1/3 Al(OH)3) = 78 / 3 = 26 (г/моль).
Ответ:
молярная масса эквивалента вещества хлорида цинка 68 г/моль;
молярная масса эквивалента вещества карбоната натрия 53 г/моль;
молярная масса эквивалента вещества гидроксида алюминия 26 г/моль.
Расчет экспериментального значения молярной массы эквивалентов алюминия и ошибки эксперимента.
1.
Приведение объема водорода к нормальным
условиям.
Пользуясь
объединенным газовым законом Бойля-Мариотта
и Гей-Люссака
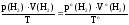
вычислить
объем выделившегося в результате реакции
водорода при н.у.
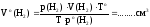
где
Vо(Н2)
— объем выделившегося в результате
реакции водорода,
приведенный
к н.у.;
V(Н2)
— объем выделившегося в результате
реакции водорода
при
при комнатной температуре;
p(Н2)
= p(атм.)
– p(Н2О)
– парциальное давление водорода в
приборе;
ро(Н2)
= 760 мм рт. ст. – нормальное давление;
Т
= toС
+ 273, К — комнатная температура, выраженная
в К;
То
= 273 К, температура при н.у.
2.
Расчет экспериментального значения
молярной массы эквивалентов алюминия
по закону эквивалентов
(см. теоретическая часть, уравнение 31)
3.
Расчет теоретического значения молярной
массы эквивалентов алюминия
(см. теор. часть, уравнение 18). Реакция
(44) является окислительно-восстановительной.
Эквивалентное число алюминия Z(Al)
в этой реакции равно трем, т.к. одна
формульная единица алюминия в ходе
реакции отдает три электрона:
Alo
– 3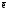
N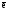
4.
Вычисление ошибки эксперимента:
Вопросы к защите лабораторной работы №1.
1.
Что называют эквивалентом вещества?
2.
В чем заключается отличие эквивалента
от формульной единицы вещества?
3.
Что показывает эквивалентное число?
Какие значения оно может принимать?
4.
Почему эквивалентное число для одного
и того же вещества может иметь разные
значения? От чего это зависит?
5.
Как рассчитывается эквивалентное число
вещества в окислительно-восстановительных
реакциях?
6.
Что называют молярной массой эквивалентов
вещества? Как она может быть рассчитана?
Единицы измерения?
7.
Как рассчитать Мэк(В)
оксидов, кислот, оснований, солей по
правилу сложения (аддитивности)?
8.
Что называют молярным объемом эквивалентов
газообразного вещества? Как он может
быть рассчитан? Единицы измерения.
9.
Как формулируется закон эквивалентов?
Приведите его математическое выражение.
10.
Сущность метода определения Мэк(Al)
в данной работе.
11.
Как проверяют прибор для определения
объема выделившегося в реакции газа на
герметичность?
12.
Как производят замер объема выделившегося
водорода?
13.
С какой целью совмещают уровни воды в
бюретке и уравнительной воронке?
14.
Как приводят объем водорода к нормальным
условиям (н.у.)? Зачем это делают?
15.
Как рассчитывают парциальное давление
водорода в данной работе?
16.Какой
объем кислорода при н.у. требуется для
сжигания 16 моль эквивалентов магния?
17.Вычислите
Мэк всех веществ и Vэк
газов в реакциях:
a)
KHS + KOH = K2S
+ H2O
б)
C(т)
+ 2N2O(г)
= CO2(г)
+ 2N2(г)
в)
2KClO3
(т)
= 2KCl
(т)
+ 3O2
(г)
г)
I2
(г)
+
5CO2(г)
= I2O5(т)
+ 5CO(г)
Лабораторная работа №2. Определение молярной массы сложного вещества.
Цель
работы:
определение молярной массы эквивалентов
неизвестной кислоты методом титрования.
Приборы
и реактивы:
раствор NaOH,
0,1 н раствор HCl,
бюретки, фенолфталеин, раствор неизвестной
кислоты, конические колбы.
Молярную
массу неизвестной кислоты определяют
титрованием раствора данной кислоты
раствором щелочи (NaOH),
концентрация которого должна быть
известна. Раствор,
концентрация которого точно установлена,
называется титрованным.
Сущность
метода титрования
состоит в точном определении объема
титрованного раствора, который надо
прибавить к определенному объему
анализируемого вещества, чтобы протекающая
между ними химическая реакция прошла
в строго эквивалентных количествах,
т.е. чтобы после реакции не осталось
избытка ни одного из реагирующих веществ.
Заметить конец реакции позволяет
индикатор, изменяющий свою окраску в
момент окончания реакции, т.е. в момент
достижения точки эквивалентности.
Расчеты по результатами титрования
проводят с использованием закона
эквивалентов.
Для
реагирующих между собой веществ А и В,
находящихся в растворах, закон эквивалентов
запишется следующим образом (см. теор.
часть, уравн. 27):
nэк(А)
= nэк(В)
где
nэк(А),
nэк(В)
– количество вещества эквивалентов
реагентов.
Количество
вещества эквивалентов nэк
можно рассчитывать по разному в
зависимости от данных величин (см. теор.
часть, уравнения (21) и (33)).
Если
известна молярная концентрация
эквивалентов и объем раствора, то :
nэк(А)
= Cэк(А)
· V(А), (45)
nэк(В)
= Cэк(В)
· V(В). (46)
Если
известна масса растворенного вещества
m(B)
и его молярная масса эквивалентов
Mэк(В),
то:
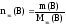
Следовательно,
форма записи закона эквивалентов для
реагирующих между собой веществ,
находящихся в растворах, так же может
быть различна:
Cэк(А)
· V(А)
= Cэк(В)
· V(В) (48)
или
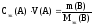
Зная
три величины из четырех в уравнениях
(48) и (49), можно рассчитать четвертую, в
частности Mэк(В).
Данная
лабораторная работа включает два опыта.
В
первом опыте уcтанавливают
точную концентрацию раствора щелочи
(NaOH).
Во
втором опыте, используя титрованный
раствор NaOH,
определяют молярную массу эквивалентов
неизвестной кислоты.
Опыт
1.
Установление
точной концентрации раствора NaOH.
1.В
две чистые конические колбы из бюретки
налейте по 10 см3
раствора HCl,
молярная концентрация эквивалентов
которого известна.
2.В
колбы с растворами HCl
добавьте по 2 – 3 капли фенолфталеина,
который в кислой среде останется
бесцветным.
3.Заполните
бюретку, установленную на рабочем месте,
раствором NaOH,
концентрацию которого необходимо
определить. Уровень раствора NaOH
в бюретке должен быть выше нулевого
деления.
4.Удалите
воздух из носика бюретки и установите
уровень раствора NaOH
в бюретке на нулевое деление.
5.Оттитруйте
раствор кислоты в первой колбе. Для
этого в колбу с отмеренным объемом
кислоты приливайте из бюретки раствор
NaOH,
регулируя одной рукой подачу раствора
из бюретки, а другой перемешивая раствор
кислоты. Капля за каплей щелочь постепенно
нейтрализует кислоту в соответствии с
реакцией:
NaOH
+ HCl
= NaCl
+ H2O. (50)
При
достижении точки эквивалентности, в
которой
nэк(NaOH)
= nэк(HCl), (51)
добавление
одной капли раствора щелочи вызовет
появ-
ление розовой окраски
фенолфталеина. Титрование считается
законченным, когда розовая окраска при
перемешивании раствора не
исчезает в течение ≈ 1мин.
Избыточное
количество щелочи недопустимо!
6.
По показанию бюретки (нижняя точка
мениска раствора) определите объем
щелочи V1(NaOH),
пошедший на титрование.
7.
Установите уровень раствора NaOH
в бюретке на нулевую отметку, доливая
раствор щелочи в бюретку через воронку.
8.
Оттитруйте раствор HCl
во второй колбе. Определите объем щелочи
V2(NaOH)(см.
п. 5 и п. 6).
9.
Из полученных двух результатов V1(NaOH)
и V2(NaOH)
вычислите среднее значение V(NaOH).
10.
Рассчитайте Сэк(NaOH),
используя закон эквивалентов (уравнение
(48)).
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
§ 2.1.3. Закон эквивалентов. Закон приведённого количества вещества
Закон эквивалентов гласит:
Вещества взаимодействуют друг с другом равными количествами молярных масс эквивалентов:
nЭ1 = nЭ2,
где nЭ1 – количество молярных масс эквивалента одного вещества; nЭ2 – количество молярных масс эквивалента другого вещества, взаимодействующего с первым. Действительно, если рассчитать количества молярных масс эквивалентов взаимодействующих веществ для любой из рассмотренных выше реакций, то они окажутся равными.
Последнее равенство можно представить иначе:
или
где m1 и m2 – массы реагирующих веществ; МЭ1 и МЭ2 – молярные массы их эквивалентов.
Все три последние равенства являются математическими формами записи закона эквивалентов.
Согласно закону эквивалентов для реакции:
k1А + k2B = k3C + k4D
должно выполняться
где m(A) и m(B) массы веществ А и В соответственно, МЭ(А) и МЭ(B) – молярные массы их эквивалентов. Или в соответствии с (2):
где M(A) и M(B) молярные массы веществ А и В, l(A) и l(B) количества активных связей в молекулах А и В соответственно.
После простейшего преобразования можно легко получить:
поскольку, в данном случае l(B) = k1; l(A) = k2, то:
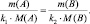
Так как последнее равенство справедливо для любой пары участвующих в реакции веществ (исходных и продуктов), то можно утверждать, что
То есть, в пределах любой одной и той же химической реакции
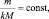
где 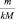
где n – количество вещества.
Приведённым количеством вещества называется отношение количества вещества к его стехиометрическому коэффициенту.
Равенства (2.3) и (2.4) представляют собой математические формы записи закона приведённого количества вещества, согласно которому
приведённые количества веществ участвующих в реакции (исходных и продуктов) равны между собой.
Закон приведённого количества вещества вытекает также из простого анализа привычных пропорций:
k1А + k2B = k3C + k4D;
В общем случае
или
Согласно следствию закона приведённого количества вещества
приведённые количества элементов одного и того же сложного вещества равны между собой
где m(Э) – масса или процентное содержание одного из элементов в данной навеске вещества; М(Э) – молярная масса этого элемента; i – индекс этого элемента в данном веществе, величина 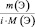
Иногда, в одной и той же реакции вещество может проявлять различные молярные массы эквивалента, что может некорректно восприниматься как нарушение закона эквивалентов. Например, при реакции разбавленной азотной кислоты с медью:
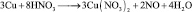
из восьми молекул азотной кислоты 2 молекулы являются окислителями, превращаясь в NO, а 6 молекул участвуют в процессе, не сопровождающемся изменением степени окисления. То есть, вся реакция делится на два взаимодействия:
Хотя, реально частица O2– не существует, однако, из приведённой схемы видно, что в первом взаимодействии.
А во втором взаимодействии
при этом, в обоих случаях закон эквивалентов выполняется – количества молярных масс эквивалентов всех взаимодействующих веществ и частиц равны шести.
При составлении уравнений окислительно-восстановительных реакций, стехиометрические коэффициенты перед восстановителем (kв), отдающим nв электронов, и перед окислителем (kо), принимающим nо электронов, можно рассчитывать с помощью следующих формул:
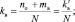
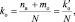
где mв – количество молекул восстановителя, не участвующих в восстановлении; mo – количество молекул окислителя, не принимающих участия в окислении; N – максимальное число, которому кратны все коэффициенты уравнения. Например, для реакции (2.5)
nо = 3; nв = 2; mo = 6; mв = 0; N = 1,
поэтому
Примеры решения задач
1. Пользуясь, следствиями закона эквивалентов, определить массу алюминия, израсходованного на получение 5,1 г оксида алюминия, если молярная масса алюминия 27 г/моль, молярная масса оксида алюминия 102 г/моль.
Прежде, чем приступить к решению подобной задачи целесообразно записать уравнение реакции
4Al + 3O2 = 2Al2O3.
|
Дано: m(Al2O3) = 5,1 г M(Al) = 27 г/моль М(Al2O3) = 102 г/моль k1 = 4 моль k2 = 2 моль |
Решение: Согласно следствию закона эквивалентов: или |
|
m(Al) – ? |
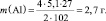
Ответ: m(Al) = 2,7 г.
2. Пользуясь равенствами 2.6 и 2.7 расставить коэффициенты в схеме реакции взаимодействия цинка с очень разбавленной азотной кислотой:
Решение
В данной реакции окислителем является азотная кислота, в которой атом азота принимает 8 электронов, то есть nо = 8. Поскольку mв = 0, то 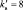
Из последней схемы видно, что mo = 16; nв = 2. Следовательно 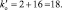
Все коэффициенты можно сократить на 2, то есть в данном случае N = 2. Поэтому, окончательно kв = 4; kо = 9
Задачи для самостоятельного решения
1. Пользуясь законом приведённого количества вещества, определить массу сульфита натрия, необходимую для полного превращения 0,2 моль перманганата калия в сульфат марганца по реакции:
2KMnO4 + 5Na2SO3 + 3H2SO4 = 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O. (2.8)
Сколько грамм воды выделится в результате этой реакции?
2. Определить массу бихромата калия, необходимую для полного превращения 49,8 г. иодида калия в йод по реакции:
K2Cr2O7 + 7H2SO4 + 6KI = Cr2(SO4)3 + 4K2SO4 + 3I2 + 7H2O. (2.9)
Сколько грамм йода образуется в результате этой реакции?
Решить задачу двумя способами – пользуясь пропорциями и пользуясь законом приведёного количества вещества.
3. Пользуясь законом приведённого количества вещества, определить химическую формулу оксида меди, если в нём содержится 89 массовых процента меди, и 11 массовых процента кислорода.
4. Пользуясь равенствами (2.6) и (2.7) расставить коэффициенты в схеме реакции:
1. Сформулируйте закон эквивалентов и закон приведённого количества вещества.
2. Что такое приведённое количество вещества?
3. Выведите закон приведённого количества вещества из закона эквивалентов.