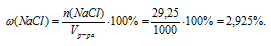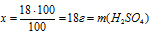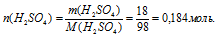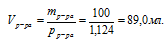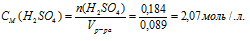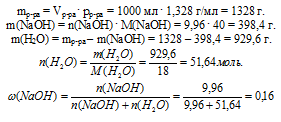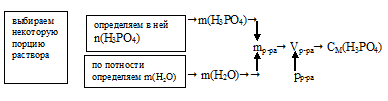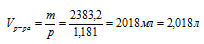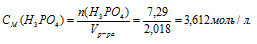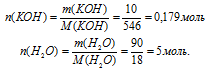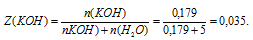Как вычислить массовую долю, если известна плотность
Массовая доля – это величина, показывающая, каково отношение массы какого-либо компонента, входящего в состав раствора или сплава, или смеси к общей массе всех компонентов. Она может выражаться либо в долях единицы, либо в процентах. Легко понять, что чем ближе массовая доля к единице, тем больше содержание этого компонента в растворе, сплаве или смеси.

Инструкция
Давайте рассмотрим пример с веществом – хлоридом натрия, или, по-другому, поваренной солью. Предположим, у вас есть 200 миллилитров водного раствора поваренной соли, и вам надо вычислить ее массовую долю.
Есть разные способы решения этой задачи. Для начала рассмотрите самый простой. Если бы у вас было 200 миллилитров чистой воды, сколько бы весило такое ее количество? Разумеется, 200 граммов или 0,2 килограмма. Ведь плотность пресной воды практически равна единице. А сколько весит раствор поваренной соли? Взвесьте сначала емкость с раствором, желательно на лабораторных весах для большей точности.
Предположим, общий вес составил 320 граммов. Перелейте раствор в какую-то другую посуду, и взвесьте пустую емкость. Оказалось, что она весит ровно 100 граммов. Следовательно, вес раствора соли составит: 320 – 100 = 220 граммов. То есть его плотность равна: 220/200 = 1,1 граммов/мл.
Для простоты вычислений допустим, что при растворении соли в воде ее объем увеличился настолько незначительно, что этим можно пренебречь. Получается, что в 200 миллилитрах раствора содержится: 200 граммов чистой воды и 20 граммов хлористого натрия, составляя суммарно те самые 220 граммов. Какова же массовая доля хлористого натрия? Задача решается в одно действие: 20/220 = 0,909. Или, если считать в процентах, 9,09%. Можно принять округленное значение: 9,1%.
Ну, а если бы вы по какой-то причине не смогли ни измерить объема раствора хлористого натрия, ни узнать его массу? Как тогда определить массовую долю раствора? Очень просто. Сначала вам надо измерить плотность раствора соли специальным прибором – плотномером. А потом с помощью специальных таблиц (они есть во многих химических или физических справочниках) определить, какой процентной концентрации раствора поваренной соли соответствует такая плотность. Процентная же концентрация, как вам известно, одно из выражений массовой доли. Вот так вы нашли ответ на поставленный вопрос.
Источники:
- плотность поваренной соли
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Отношение количества
или массы вещества, содержащегося в
системе, к объему или массе этой системы
называется концентрацией.
Рассмотрим несколько
способов выражения концентрации.
Процентная
концентрация
(массовая доля растворенного вещества)
(ω) показывает, сколько единиц массы
растворенного вещества содержится в
100 единицах массы раствора. Массовая
доля – безразмерная величина, ее выражают
в долях единицы или процентах:
,
где ω – массовая
доля (%) растворенного вещества; m1
– масса растворенного вещества, г; m
– масса раствора, г.
Масса раствора
равна произведению объема раствора V
(мл) на его плотность r
(г/см3):
,
тогда
.
Молярная
концентрация (молярность)
раствора – показывает, сколько молей
растворенного вещества содержится в
1л раствора.
Молярную концентрацию
(моль на литр) выражают формулой
,
где m1
– масса растворенного вещества, г; М –
молярная масса растворенного вещества,
г/моль; V
– объем раствора, л.
Количество вещества
в молях определяется по формуле:
n
= m1
/М, тогда
Нормальная
концентрация (нормальность раствора)
показывает, сколько грамм-эквивалентов
растворенного вещества содержится в 1
л раствора (моль на литр):
,
где m1
– масса растворенного вещества, г; V
– объем раствора, л.
Э – эквивалентная
масса растворенного вещества (г/моль),
которую рассчитывают по формуле:
Э=(г/моль),
где М – мольная
масса вещества, n
– количество катионов (анионов), В
– валентность. Валентность – это
способность атомов элемента присоединять
определенное число атомов другого
элемента. Эквивалент кислоты можно
определить по формуле: Э = М (кислоты)
/ основность (число атомов водорода).
Например: Э
Н2SO4==49г/моль;
эквивалент основания по формуле: Э = М
(основания) / кислотность (число ОН—
групп), так Э
Fe(OH)3==35,6г/моль;
эквивалент соли по формуле: Э = М(соли)
/ число атомов металла * валентность
металла,
Э Al2(SO4)3==114г/моль.
Моляльность
раствора Сm
показывает
количество растворенного вещества,
находящееся в 1 кг растворителя:
,
где m2
– масса растворителя, кг; n
– количество растворенного вещества,
моль.
Пример
1.
Вычислить молярность и нормальность
40 %-го раствора фосфорной кислоты,
плотность которого 1,25 г/см3.
Объем раствора 1л.
Решение.
Для расчета молярности и нормальности
раствора найдем массу фосфорной кислоты
в 1 л (1000 мл) 40 %-го раствора:
w
= m1
· 100/V
∙ r;
.Молярная
масса Н3РO4
равна 98 г/моль, следовательно,
=
500/98 = 5,1 моль/л.
Молярная
масса эквивалента Н3РO4
равна 98/3 = 32,7 г/моль.
Тогда
СН
= 500/32,7 =
1,53 моль/л.
Пример
2.
Вычислить
массовую долю КОН в 2н. растворе, плотность
которого 1,08 г/см3.
Решение.
Поскольку
нормальность рассчитывается на 1 л
раствора, найдем массу растворенного
вещества в 1 л:
СН=
m1/Э∙V;
ЭKOH
= 56 г/моль;
mКОН=2∙56∙1=112
г.
Теперь
вычислим массовую доли КОН в растворе,
содержащем 112
г
гидроксида калия:
w=
m1∙100/V∙r=112∙100/1000∙1,08=10,4
%.
Пример 3.
На нейтрализацию 50 см3
раствора кислоты израсходовано 25 см3
0,5 н. раствора щелочи. Чему равна молярная
концентрация эквивалентов кислоты?
Решение.
Так как вещества взаимодействуют между
собой в эквивалентных соотношениях, то
растворы равной молярной концентрации
эквивалентов реагируют в равных объемах.
При разных молярных концентрациях
эквивалентов объемы растворов реагирующих
веществ обратно пропорциональны их
нормальностям, т.е.
V1:
V2
= С2
: С1
или V1∙
С1
= V2
∙
С2
50С1
= 25 • 0,5; откуда С1
= 25 • 0,5 / 50 = 0,25н.
Задание:
решить следующие задачи, принимая объем
раствора равным
1 л:
|
Вариант |
Вещество |
Концентрация |
Плотность |
Вычислить |
|
121 |
Na2CO3 |
0,30 |
1,030 |
Процентную |
|
122 |
HNO3 |
9,0 |
1,275 |
Процентную |
|
123 |
NH4Cl |
10 |
1,028 |
Молярную |
|
124 |
Al2(SO4)3 |
0,55 |
1,176 |
Процентную |
|
125 |
HNO3 |
2 |
— |
Нормальную |
|
126 |
HCl |
15,0 |
1,073 |
Нормальную |
|
127 |
H2SO4 |
13,0 |
1,680 |
Процентную |
|
128 |
H3PO4 |
44,0 |
1,285 |
Нормальную |
|
129 |
HClO4 |
9,0 |
1,150 |
Процентную |
|
130 |
H2SO4 |
2 |
— |
Нормальную |
|
131 |
CH3COOH |
34,0 |
1,043 |
Молярную |
|
132 |
BaCl2 |
2,30 |
1,203 |
Процентную |
|
133 |
K2CO3 |
4 |
— |
Нормальную |
|
134 |
CuSO4 |
14,0 |
1,155 |
Нормальную |
|
135 |
FeCl3 |
1,90 |
— |
Нормальную |
|
136 |
K2CO3 |
6,0 |
1,567 |
Процентную |
|
137 |
NaCl |
3 |
— |
Молярную |
|
138 |
NaCl |
20 |
1,148 |
Молярную |
|
139 |
HClO4 |
4,0 |
1,230 |
Процентную |
|
140 |
K2CO3 |
3 |
— |
Нормальную |
Задание: решить
следующие задачи
|
№ задачи |
|
|
141 |
На |
|
142 |
Смешали |
|
143 |
Определить |
|
144 |
Смешали |
|
145 |
Для |
|
146 |
Смешали |
|
147 |
На |
|
148 |
Смешали |
|
149 |
На |
|
150 |
Вычислить |
|
151 |
Определить |
|
152 |
Вычислить |
|
153 |
Определить |
|
154 |
Определить |
|
155 |
Вычислить |
|
156 |
Вычислить |
|
157 |
Определить |
|
158 |
Смешали |
|
159 |
Определить |
|
160 |
Вычислить |
Соседние файлы в папке му по химии
- #
- #
- #
- #
- #
- #
- #
В этой статье мы коснемся нескольких краеугольных понятий в химии, без которых совершенно невозможно
решение задач. Старайтесь понять смысл физических величин, чтобы усвоить эту тему.
Я постараюсь приводить как можно больше примеров по ходу этой статьи, в ходе изучения вы увидите множество примеров
по данной теме.

Относительная атомная масса — Ar
Представляет собой массу атома, выраженную в атомных единицах массы. Относительные атомные массы указаны в периодической
таблице Д.И. Менделеева. Так, один атом водорода имеет атомную массу = 1, кислород = 16, кальций = 40.
Относительная молекулярная масса — Mr
Относительная молекулярная масса складывается из суммы относительных атомных масс всех атомов, входящих в состав вещества.
В качестве примера найдем относительные молекулярные массы кислорода, воды, перманганата калия и медного купороса:
Mr (O2) = (2 × Ar(O)) = 2 × 16 = 32
Mr (H2O) = (2 × Ar(H)) + Ar(O) = (2 × 1) + 16 = 18
Mr (KMnO4) = Ar(K) + Ar(Mn) + (4 × Ar(O)) = 39 + 55 + (4 * 16) = 158
Mr (CuSO4*5H2O) = Ar(Cu) + Ar(S) + (4 × Ar(O)) + (5 × ((Ar(H) × 2) +
Ar(O))) = 64 + 32 + (4 × 16) + (5 × ((1 × 2) + 16)) = 160 + 5 * 18 = 250
Моль и число Авогадро
Моль — единица количества вещества (в системе единиц СИ), определяемая как количество вещества, содержащее столько же структурных единиц
этого вещества (молекул, атомов, ионов) сколько содержится в 12 г изотопа 12C, т.е. 6 × 1023.
Число Авогадро (постоянная Авогадро, NA) — число частиц (молекул, атомов, ионов) содержащихся в одном моле любого вещества.

Больше всего мне хотелось бы, чтобы вы поняли физический смысл изученных понятий. Моль — международная единица количества вещества, которая
показывает, сколько атомов, молекул или ионов содержится в определенной массе или конкретном объеме вещества. Один моль любого вещества
содержит 6.02 × 1023 атомов/молекул/ионов — вот самое важное, что сейчас нужно понять.
Иногда в задачах бывает дано число Авогадро, и от вас требуется найти, какое вам дали количество вещества (моль). Количество вещества в химии
обозначается N, ν (по греч. читается «ню»).
Рассчитаем по формуле: ν = N/NA количество вещества 3.01 × 1023 молекул воды и 12.04 × 1023 атомов углерода.

Мы нашли количества вещества (моль) воды и углерода. Сейчас это может показаться очень абстрактным, но, иногда не зная, как найти
количество вещества, используя число Авогадро, решение задачи по химии становится невозможным.
Молярная масса — M
Молярная масса — масса одного моля вещества, выражается в «г/моль» (грамм/моль). Численно совпадает с изученной нами ранее
относительной молекулярной массой.
Рассчитаем молярные массы CaCO3, HCl и N2
M (CaCO3) = Ar(Ca) + Ar(C) + (3 × Ar(O)) = 40 + 12 + (3 × 16) = 100 г/моль
M (HCl) = Ar(H) + Ar(Cl) = 1 + 35.5 = 36.5 г/моль
M (N2) = Ar(N) × 2 = 14 × 2 = 28 г/моль
Полученные знания не должны быть отрывочны, из них следует создать цельную систему. Обратите внимание: только что мы рассчитали
молярные массы — массы одного моля вещества. Вспомните про число Авогадро.
Получается, что, несмотря на одинаковое число молекул в 1 моле (1 моль любого вещества содержит 6.02 × 1023 молекул),
молекулярные массы отличаются. Так, 6.02 × 1023 молекул N2 весят 28 грамм, а такое же количество молекул
HCl — 36.5 грамм.
Это связано с тем, что, хоть количество молекул одинаково — 6.02 × 1023, в их состав входят разные атомы, поэтому и
массы получаются разные.

Часто в задачах бывает дана масса, а от вас требуется рассчитать количество вещества, чтобы перейти к другому веществу в реакции.
Сейчас мы определим количество вещества (моль) 70 грамм N2, 50 грамм CaCO3, 109.5 грамм HCl. Их молярные
массы были найдены нам уже чуть раньше, что ускорит ход решения.

ν (CaCO3) = m(CaCO3) : M(CaCO3) = 50 г. : 100 г/моль = 0.5 моль
ν (HCl) = m(HCl) : M(HCl) = 109.5 г. : 36.5 г/моль = 3 моль
Иногда в задачах может быть дано число молекул, а вам требуется рассчитать массу, которую они занимают. Здесь нужно использовать
количество вещества (моль) как посредника, который поможет решить поставленную задачу.
Предположим нам дали 15.05 × 1023 молекул азота, 3.01 × 1023 молекул CaCO3 и 18.06 × 1023 молекул
HCl. Требуется найти массу, которую составляет указанное число молекул. Мы несколько изменим известную формулу, которая поможет нам связать
моль и число Авогадро.

Теперь вы всесторонне посвящены в тему. Надеюсь, что вы поняли, как связаны молярная масса, число Авогадро и количество вещества.
Практика — лучший учитель. Найдите самостоятельно подобные значения для оставшихся CaCO3 и HCl.
Молярный объем
Молярный объем — объем, занимаемый одним молем вещества. Примерно одинаков для всех газов при стандартной температуре
и давлении составляет 22.4 л/моль. Он обозначается как — VM.
Подключим к нашей системе еще одно понятие. Предлагаю найти количество вещества, количество молекул и массу газа объемом
33.6 литра. Поскольку показательно молярного объема при н.у. — константа (22.4 л/моль), то совершенно неважно, какой газ мы
возьмем: хлор, азот или сероводород.
Запомните, что 1 моль любого газа занимает объем 22.4 литра. Итак, приступим к решению задачи. Поскольку какой-то газ
все же надо выбрать, выберем хлор — Cl2.


Моль (количество вещества) — самое гибкое из всех понятий в химии. Количество вещества позволяет вам перейти и к
числу Авогадро, и к массе, и к объему. Если вы усвоили это, то главная задача данной статьи — выполнена 

Относительная плотность и газы — D
Относительной плотностью газа называют отношение молярных масс (плотностей) двух газов. Она показывает, во сколько раз одно вещество
легче/тяжелее другого. D = M (1 вещества) / M (2 вещества).
В задачах бывает дано неизвестное вещество, однако известна его плотность по водороду, азоту, кислороду или
воздуху. Для того чтобы найти молярную массу вещества, следует умножить значение плотности на молярную массу
газа, по которому дана плотность.
Запомните, что молярная масса воздуха = 29 г/моль. Лучше объяснить, что такое плотность и с чем ее едят на примере.
Нам нужно найти молярную массу неизвестного вещества, плотность которого по воздуху 2.5

Предлагаю самостоятельно решить следующую задачку (ниже вы найдете решение): «Плотность неизвестного вещества по
кислороду 3.5, найдите молярную массу неизвестного вещества»

Относительная плотность и водный раствор — ρ
Пишу об этом из-за исключительной важности в решении
сложных задач, высокого уровня, где особенно часто упоминается плотность. Обозначается греческой буквой ρ.
Плотность является отражением зависимости массы от вещества, равна отношению массы вещества к единице его объема. Единицы
измерения плотности: г/мл, г/см3, кг/м3 и т.д.
Для примера решим задачку. Объем серной кислоты составляет 200 мл, плотность 1.34 г/мл. Найдите массу раствора. Чтобы не
запутаться в единицах измерения поступайте с ними как с самыми обычными числами: сокращайте при делении и умножении — так
вы точно не запутаетесь.

Иногда перед вами может стоять обратная задача, когда известна масса раствора, плотность и вы должны найти объем. Опять-таки,
если вы будете следовать моему правилу и относится к обозначенным условным единицам «как к числам», то не запутаетесь.
В ходе ваших действий «грамм» и «грамм» должны сократиться, а значит, в таком случае мы будем делить массу на плотность. В противном случае
вы бы получили граммы в квадрате 
К примеру, даны масса раствора HCl — 150 грамм и плотность 1.76 г/мл. Нужно найти объем раствора.

Массовая доля — ω
Массовой долей называют отношение массы растворенного вещества к массе раствора. Важно заметить, что в понятие раствора входит
как растворитель, так и само растворенное вещество.
Массовая доля вычисляется по формуле ω (вещества) = m (вещества) / m (раствора). Полученное число будет показывать массовую долю
в долях от единицы, если хотите получить в процентах — его нужно умножить на 100%. Продемонстрирую это на примере.

Решим несколько иную задачу и найдем массу чистой уксусной кислоты в широко известной уксусной эссенции.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Определение массовой доли, молярности и мольной доли
Задача 4.
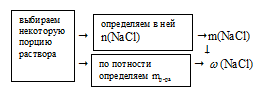
Определите массовую долю NаС1 в 0,5 М водном растворе (плотность раствора принять равной 1,000 г/мл).
Дано:
молярная концентрация NаС1 в р-ре: См(NаС1) = 0,5 моль/л.;
плотность раствора: рр-ра = 1,000 г/мл.
Найти:
массовую долю NаС1 в растворе.
Решение:
Схематично алгоритм решения можно представить так:
Наиболее удобно выбрать именно объем раствора, т.к. известная концентрация выражена в моль/л. Причем разумнее всего взять объем равный 1 л.
По записи концентрации (0,5 моль/л) видно, что в этом 1 л раствора содержится 0,5 моль чистой соли NаС1.
Определим массу 0,5 моль NаС1:
m(NаС1) = n(NаС1) . М(NаС1) = 0,5 . 58,5 = 29,25 г.
Определим массу раствора:
mр-ра = Vр-ра . pр-ра = 1000мл . 1 г/мл = 1000 г.
Массовую долю NаС1 в растворе определяем, пользуясь соотношением:
Ответ: 
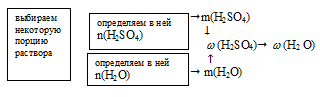
Задача 5.
Определить молярность 18%-ного раствора Н2SО4 в воде (рр-ра = 1,124 г/мл).
Дано:
массовая доля Н2SО4 в растворе: 
плотность раствора: рр-ра = 1,124 г/мл.
Найти:
молярную концентрацию Н2SО4 в растворе.
Решение:
Схематично алгоритм решения можно представить так:
Наиболее удобно выбрать именно массу раствора, т.к. известна массовая доля. Причем разумнее всего взять массу 100 г.
1. Находим массу серной кислоты в выбранной массе раствора:
100 г составляют 100%
х г составляют 18%
в 100 г 18% -ного раствора.
2. Определяем количество вещества в 18 г Н2SО4
3. Используя плотность, находим объем 100 г раствора:
4. Объем переводим в литры, т.к. молярная концентрация измеряется в моль/л: Vр-ра = 89 мл = 0,089 л.
5. Определяем молярную концентрацию:
Ответ: СМ(Н2SО4) = 2,07 моль/л.
Задача 6.
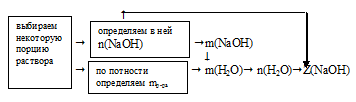
Определите мольную долю NаОН в водном растворе, если его концентрация равна 9,96 моль/л, а плотность 1,328 г/мл.
Дано:
молярная концентрация NаОН в растворе: См(NаОН) = 9,96 моль/л;
плотность раствора: рр-ра = 1,328 г/мл.
Найти:
мольную долю NаОН в растворе.
Решение:
Схематично алгоритм решения можно представить так:
Наиболее удобно выбрать именно объем раствора, т.к. известная концентрация выражена в моль/л. Причем разумнее всего взять объем равный 1 л.
По записи концентрации (9,96 моль/л) видно, что в этом 1 л раствора содержится 9,96 моль чистого NаОН.
Для определения мольной доли NаОН еще необходимо выявить количество вещества (n, моль) воды в выбранной порции раствора (1л). Для этого определим массу раствора и вычтем из нее массу NаОН.
Ответ1: 
Задача 7.
Мольная доля водного раствора Н3РО4 в воде составляет 7,29%(мольн.) Определите молярность этого раствора, если его плотность 1,181 г/мл.
Дано:
мольная доля Н3РО4 в растворе: Z(Н3РО4) = 7,29%;
плотность раствора: рр-ра= 1,181 г/мл.
Найти:
молярную концентрацию Н3РО4 в растворе.
Решение:
Схематично алгоритм решения можно представить так:
Наиболее удобно выбрать такое количество раствора, в котором:
n(Н3РО4) + n(Н2О) = 100 моль.
В этой порции раствора количество вещества Н3РО4 численно совпадает с мольной долей: Z(Н3РО4) = 7,29 моль.
Для определения молярности нам осталось выявить объем выбранной порции раствора. Его можно вычислить, используя плотность раствора. Но для этого необходимо знать его массу. Массу же раствора можно рассчитать исходя из количеств веществ компонентов (Н3РО4 и Н2О) раствора.
1. Выбранная нами порция содержит суммарно 100 моль. Количество вещества Н3РO4 нам известно. Используя эти данные, находим n(Н2О).
п(Н2О) = 100 – 7,29 = 92,71 моль.
2. Определим массу 92,71 моль воды:
m(Н2О) = n(Н2О) . М(Н2О) = 92,71 . 18 = 1669 г.
3. Определим массу 7,29 моль Н3РО4:
m(Н3РO4) = n(Н3РО4) . М(Н3РО4) = 7,29 . 98 = 714,4 г.
4. Находим массу выбранной порции раствора:
mр-ра = m(Н2О) + m(Н3РО4) = 1669 + 714,4 =2383 г.
5. Используя данные о плотности раствора, находим его объем:
6. Теперь определим молярную концентрацию:
Ответ: СМ(Н3РО4) = 3,612моль/л.
Задача 8.
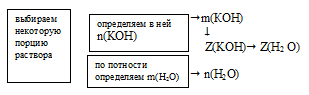
Определите мольные доли веществ в водном растворе КОН, если массовая доля гидроксида калия в нем составляет 10,00%.
Дано:
массовая доля КОН в растворе: 
Найти:
мольную долю КОН и Н2O(в растворе: Z(КОН) = ?; Z(H2O) = ?
Решение:
Схематично алгоритм решения можно представить так:
Наиболее удобно выбрать именно массу раствора, т.к. известна массовая доля. Причем разумнее всего взять массу 100 г. В этом случае массы каждого компонента совпадут с численным значением массовой доли:
m(КОН) = 10 г, m(Н2О) = 100 – m(КОН) = 100 – 10 = 90 г.
1. Определим количество вещества (n, моль) воды и КОН.
2. Определяем мольную долю КОН
3. Определяем мольную долю воды:
Z(Н2O) = 1 – Z(КОН) = 1 – 0,035 = 0,965.
Ответ: Z(КОН) = 0,035 (доли от 1) или 3,5%(мольн.);
Задача 9.
Определите массовые доли веществ в водном растворе Н2SО4, если мольная доля серной кислоты в нем составляет 2,000%.
Дано:
мольная доля Н2SО4 в растворе: Z (Н2SО4)= 2,000%;
Найти:
массовые доли Н2SО4 и Н2О в растворе: 

Решение:
Схематично алгоритм решения можно представить так:
Наиболее удобно выбрать такое количество раствора, в котором n(Н2SО4) + n(Н2О) = 100 моль. В этой порции раствора количество вещества Н2SО4 численно совпадает с мольной долей: nН2SО4= 2 моль.
1. Находим количество вещества воды в выбранной порции
n(Н2О) = 100 моль – 2 моль = 98 моль.
2. Определяем массы Н2SО4 и Н2О по найденным значениям количеств веществ.
m (Н2SО4) = n(Н2SО4) . М(Н2SО4) = 2 . 98 = 196 г.
m(Н2О) = n(Н2О) . М(Н2О) = 98 . 18 = 1764 г.
3. По массам компонентов раствора находим их массовые доли.
Ответ: 

Комментарии;
1 Мольная доля выражена в долях от единицы.
Содержание материала
- В данный момент вы не можете посмотреть или раздать видеоурок ученикам
- Получите невероятные возможности
- Видео
- Нахождение массовой доли вещества в смесях и растворах
- Относительная атомная и молекулярная масса
- Связь с другими способами выражения концентрации
- Вопросы для самопроверки:
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности
1. Откройте доступ ко всем видеоурокам комплекта. 2. Раздавайте видеоуроки в личные кабинеты ученикам. 3. Смотрите статистику просмотра видеоуроков учениками.
Нет, спасибо
Получить доступ
Нахождение массовой доли вещества в смесях и растворах
Массовая доля химического соединения в смеси или растворе определяется по той же формуле, только в числителе будет масса вещества в растворе (смеси), а в знаменателе — масса всего раствора (смеси):
? = (m (в-ва) · m (р-ра)) / 100% .
Следует обратить внимание, что массовая концентрация — это отношение массы вещества к массе всего раствора, а не только растворителя.
Например, растворили 10 г поваренной соли в 200 г воды. Нужно найти процентную концентрацию соли в полученном растворе.
Для определения концентрации соли нам нужна m раствора. Она составляет:
m (р-ра) = m (соли) + m (воды) = 10 + 200 = 210 (г).
Находим массовую долю соли в растворе:
? = ( 10 · 210) / 100% = 4,76%
Таким образом, концентрация поваренной соли в растворе составит 4,76%.
Если в условии задачи дается не m, а объем раствора, то его нужно перевести в массу. Делается это обычно через формулу для нахождения плотности:
p = m / V,
где m — масса вещества (раствора, смеси), а V — его объем.
Такую концентрацию используют чаще всего. Именно ее имеют в виду (если нет отдельных указаний), когда пишут о процентном содержании веществ в растворах и смесях.
Видео
Относительная атомная и молекулярная масса
В формуле нахождения массовой доли мы видим две важные составляющие: относительную массу атома элемента (Ar) и относительную массу молекулы вещества (Mr). Разберемся, что это такое. И та, и другая величина — это отношение реальной массы к эталонной единице, за которую взята 1/12 массы атома углерода.
Относительная атомная масса элемента (Ar) говорит о том, насколько масса его атома больше 1/12 массы атома углерода. Для каждого элемента эта величина является постоянной и ее можно увидеть в таблице Менделеева.
Относительная молекулярная масса соединения (Mr) складывается из относительных атомных масс всех элементов в составе его молекулы. Она показывает, насколько молекула вещества больше 1/12 массы атома углерода.
Это не измеряемые величины, то есть они не имеют единиц измерения. Буква r в обозначениях относительной атомной и молекулярной массы восходит к английскому слову relative — «относительный».
Важно
Численно относительная молекулярная масса вещества равна его молярной массе, что удобно использовать в расчетах. Но путать эти два понятия не стоит. Относительная молекулярная масса характеризует 1 молекулу вещества, в то время как молярная масса — 1 моль вещества.
Связь с другими способами выражения концентрации
Формула перехода от массовой доли к молярности:
где СМ – молярная концентрация раствора моль/л; ρ – плотность раствора, г/л; 
Формула перехода от массовой доли к титру:
где Т – титр раствора г/мл; ρ – плотность раствора, г/мл; 
Вопросы для самопроверки:
-
Как обозначается массовая доля и в чем она выражается?
-
В чем разница между молекулярной массой вещества и его молярной массой?
-
Как найти массовую долю элемента в веществе, если мы знаем массу элемента и массу вещества?
-
Как рассчитать массовую долю вещества в растворе?
-
В каких безразмерных и размерных величинах можно выразить концентрацию раствора?