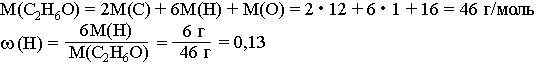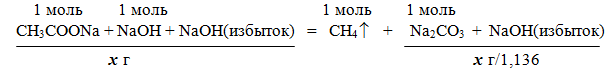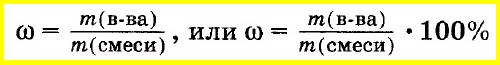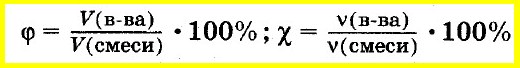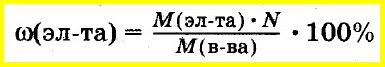Определение массовой доли (ω) вещества
Многие характеристики вещества являются суммой нескольких составляющих, каждая из которых представляет определенную долю от целого.
Математически долю каждой составляющей определяют как частное от деления части на целое (меньшей величины на большую).
Важными характеристиками состава многокомпонентных систем (молекул, смесей веществ, растворов, сополимеровСополимеры – высокомолекулярные соединения, макромолекулы которых содержат два (и более) типа структурных звеньев.) являются массовые, мольные и объёмные доли отдельных компонентов.
Массовая доля компонента (вещества, химического элемента) – содержание компонента в многокомпонентной системе (смеси веществ, растворе, молекуле), определяемое как отношение массы этого компонента к суммарной массе всех компонентов системы.
Таким образом, для нахождения массовой доли вещества в смеси (и решения обратной задачи) служит соотношение:
ω(вещества) = m(вещества) / m(смеси).
Массовую долю элемента в веществе можно определить, используя молярные массы:
ω(элемента) = M(элемента) / M(вещества).
Например, массовая доля водорода ω(H) в этиловом спирте С2Н5ОН вычисляется следующим образом:
Часто долю выражают в процентах. Для этого полученный результат умножают на 100. То есть в данном случае ω(H)=13%. Это означает, что в каждом г (кг, т) С2Н6O содержится 0,13 г (кг, т) водорода или каждые 100 г (кг, т) С2Н6O содержат 13 г (кг, т) водорода.
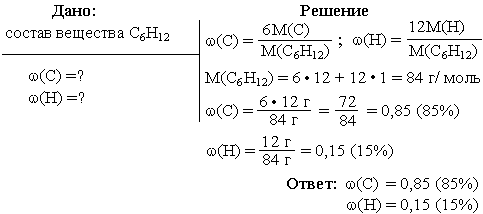
Задача 1. Вычислить массовые доли каждого из элементов, входящих в состав углеводорода, формула которого C6H12.
Задача 2. Из нефти получают бензин (массовая доля его в нефти составляет 25%) и мазут (55%). При дальнейшей переработке мазута получают еще некоторое количество бензина (60% от массы мазута). Рассчитайте массу бензина, который будет получен из нефти массой 200 кг.
Задача 3. Смесь ацетата натрия с избытком гидроксида натрия прокалили. После прокаливания масса сухого остатка оказалась в 1,136 раза меньше массы исходной смеси. Вычислите массовые доли компонентов исходной смеси.
Решение
При сплавлении ацетата натрия CH3COONa с гидроксидом натрия образуется метан CH4 (реакция Дюма).
Уравнение реакции:
Решение задач с долей вещества в смеси, в соединении
Ключевые слова конспекта: массовая доля вещества в смеси или растворе, молярная доля вещества, объемная доля вещества, массовая доля элемента в соединении, масса элемента, массовая доля элемента.
Массовую долю вещества в смеси или растворе вычисляют как отношение массы вещества, входящего в состав смеси, к массе всей смеси. Массовую долю часто выражают в процентах. Для этого отношение массы вещества к массе смеси умножают на 100%:
Аналогично объемную долю вещества вычисляют как отношение объема вещества к объему смеси, а молярную долю вещества — как отношение количества вещества одного из компонентов смеси к сумме количеств веществ всех компонентов смеси:
Массовую долю элемента в соединении вычисляют как отношение массы элемента, входящего в состав данного соединения, к массе всего соединения:
Зная молекулярную формулу соединения, массу элемента, входящего в его состав, вычисляют как произведение молярной массы элемента на число атомов этого элемента в соединении.
В этом случае массовую долю элемента в соединении рассчитывают как отношение этой величины к молярной массе всего соединения:
Цитаты из пособия «Задачи по химии 8-9 кл.» (авт. О.С. Габриелян и др.) использованы в учебных целях. Ссылка на покупку книги указана в конце конспекта.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Задача № 1.
25 г оксида магния смешали с 35 г оксида алюминия. Определите массовую долю оксида магния в данной смеси.
Ответ. ω(MgO) = 0,417, или 41,7%.
Задача № 2.
Вычислите объемную долю азота в смеси газов, содержащей 32 л азота, 48 л углекислого газа, 36 л гелия и 14 л водорода.
Ответ. φ(N2) = 0,246, или 24,6%.
Задача № 3.
Вычислите молярную и массовую долю (в %) оксида углерода (II) в смеси, содержащей 16,8 л (н. у.) оксида углерода (II) и 13,44 л (н. у.) оксида углерода (IV).
Ответ. χ(СО) = 55,56%, ω(СО) = 44,3%.
Задача № 4.
В воде растворили 15 г хлорида натрия. Вычислите массу полученного раствора, если массовая доля соли в нем равна 5%.
Ответ: m(р-ра) = 300 г.
Задача № 5.
Образец сплава меди с цинком имеет массу 75 г. Массовая доля меди в этом сплаве равна 64%. Определите массу цинка в данном образце.
Ответ. m(Zn) = 27 г.
[highlight]Задача № 6.[/highlight] Объемная доля аммиака в смеси с кислородом равна 40%. Вычислите плотность данной смеси по воздуху.
Посмотреть РЕШЕНИЕ
Ответ. Dвозд(смеси) = 0,896.
Задача № 7.
Найдите массовую долю кислорода в фосфате натрия.
Посмотреть РЕШЕНИЕ
Ответ. ω (O) = 39%.
[highlight]Задача № 8.[/highlight] Определите массовую долю фосфора в смеси, содержащей 55 г фосфата натрия и 70 г дигидрофосфата натрия.
Посмотреть РЕШЕНИЕ
Ответ. ω(Р) = 22,77%
[highlight]Задача № 9.[/highlight] Массовая доля серы в техническом сульфате натрия равна 20,48%. Рассчитайте массовую долю примесей в данном продукте (в %).
Посмотреть РЕШЕНИЕ
Ответ. ω (примесей) = 9,12%.
Задача № 10.
Плотность смеси оксида азота (II) и оксида азота (IV) по водороду равна 17,8. Найдите массовую долю оксида азота (IV) в данной смеси.
Посмотреть РЕШЕНИЕ
Ответ. ω(NO2) = 45,2%.
Решение задач с долей вещества в смеси, в соединении. Выберите дальнейшие действия:
- Перейти к следующей теме: Решение задач на вывод формул соединений
- Вернуться к списку конспектов по Химии.
- Проверить знания по Химии.
- Купить книгу Задачи по химии и способы их решения. 8-9 кл. / О.С. Габриелян и др. — М.: Дрофа.
Массовая доля — один из важных параметров, который активно используется для расчетов и не только в химии. Приготовление сиропов и рассолов, расчет внесения удобрений на площадь под ту или иную культуру, приготовление и назначение лекарственных препаратов. Для всех этих расчетов нужна массовая доля. Формула для ее нахождения будет дана ниже.
В химии она рассчитывается:
- для компонента смеси, раствора;
- для составной части соединения (химического элемента);
- для примесей к чистым веществам.
Раствор — это тоже смесь, только гомогенная.
Массовая доля — это отношение массы компонента смеси (вещества) ко всей его массе. Выражают в обычных числах или в процентах.
Формула для нахождения такая:
? = (m (сост. части) · m (смеси, в-ва)) / 100% .
Содержание:
- Нахождение массовой доли химического элемента
- Нахождение массовой доли вещества в смесях и растворах
- Массовая доля примесей
- Видео
Нахождение массовой доли химического элемента
Массовая доля химического элемента в веществе находится по отношению атомной массы химического элемента, умноженной на количество его атомов в этом соединении, к молекулярной массе вещества.
Например, для определения w кислорода (оксигена) в молекуле углекислого газа СО2 вначале найдем молекулярную массу всего соединения. Она составляет 44. В молекуле содержится 2 атома кислорода. Значит w кислорода рассчитываем так:
w(O) = (Ar(O) · 2 ) / Mr(СО2)) х 100%,
w(O) = ((16 · 2) / 44) х 100% = 72,73%.
Аналогичным образом в химии определяют, например, w воды в кристаллогидрате — комплексе соединения с водой. В таком виде в природе находятся многие вещества в минералах.
Например, формула медного купороса CuSO4 · 5H2O. Чтобы определить w воды в этом кристаллогидрате, нужно в уже известную формулу подставить, соответственно, Mr воды (в числитель) и общую m кристаллогидрата (в знаменатель). Mr воды 18, а всего кристаллогидрата — 250.
w( H2O ) = ((18 · 5) / 250 ) · 100% = 36%
Нахождение массовой доли вещества в смесях и растворах
Массовая доля химического соединения в смеси или растворе определяется по той же формуле, только в числителе будет масса вещества в растворе (смеси), а в знаменателе — масса всего раствора (смеси):
? = (m (в-ва) · m (р-ра)) / 100% .
Следует обратить внимание, что массовая концентрация — это отношение массы вещества к массе всего раствора, а не только растворителя.
Например, растворили 10 г поваренной соли в 200 г воды. Нужно найти процентную концентрацию соли в полученном растворе.
Для определения концентрации соли нам нужна m раствора. Она составляет:
m (р-ра) = m (соли) + m (воды) = 10 + 200 = 210 (г).
Находим массовую долю соли в растворе:
? = ( 10 · 210) / 100% = 4,76%
Таким образом, концентрация поваренной соли в растворе составит 4,76%.
Если в условии задачи дается не m, а объем раствора, то его нужно перевести в массу. Делается это обычно через формулу для нахождения плотности:
p = m / V,
где m — масса вещества (раствора, смеси), а V — его объем.
Такую концентрацию используют чаще всего. Именно ее имеют в виду (если нет отдельных указаний), когда пишут о процентном содержании веществ в растворах и смесях.
Массовая доля примесей
В задачах часто дается концентрация примесей в веществе или вещества в его минералах. Следует обратить внимание на то, что концентрация (массовая доля) чистого соединения будет определяться путем вычитания из 100% доли примеси.
Например, если говорится, что из минерала получают железо, а процент примесей 80%, то чистого железа в минерале 100 — 80 = 20%.
Соответственно, если написано, что в минерале содержится только 20% железа, то во все химические реакции и в химическом производстве будут участвовать именно эти 20%.
Например, для реакции с соляной кислотой взяли 200 г природного минерала, в котором содержание цинка 5%. Для определения массы взятого цинка пользуемся той же формулой:
? = (m (в-ва) · m (р-ра)) / 100% ,
из которой находим неизвестную m раствора:
m (Zn) = ( w · 100% ) / m (минер.)
m (Zn) = (5 · 100) / 200 = 10 (г)
То есть, в 200 г взятого для реакции минерала содержится 5% цинка.
Задача. Образец медной руды массой 150 г содержит сульфид меди одновалентной и примеси, массовая доля которых составляет 15%. Вычислите массу сульфида меди в образце.
Решение задачи возможно двумя способами. Первый — это найти по известной концентрации массу примесей и вычесть ее из общей m образца руды. Второй способ — это найти массовую долю чистого сульфида и по ней уже рассчитать его массу. Решим обоими способами.
- I способ
Вначале найдем m примесей в образце руды. Для этого воспользуемся уже известной формулой:
? = ( m (примесей) · m (образца)) / 100% ,
m(примес.) = (w · m (образца)) · 100% , (А)
m(примес.) = (15 · 150) / 100% = 22,5 (г).
Теперь по разности найдем количество сульфида в образце:
150 — 22,5 = 127,5 г
- II способ
Вначале находим w соединения:
100 — 15 = 85%
А теперь по ней, воспользовавшись той же формулой, что и в первом способе (формула А), найдем m сульфида меди:
m(Cu2S) = (w · m (образца)) / 100% ,
m(Cu2S) = (85 · 150) / 100% = 127,5 (г).
Ответ: масса сульфида меди одновалентного в образце составляет 127,5 г.
Видео
Из видео вы узнаете, как правильно производить рассчеты по химическим формулам и как найти массовую долю.