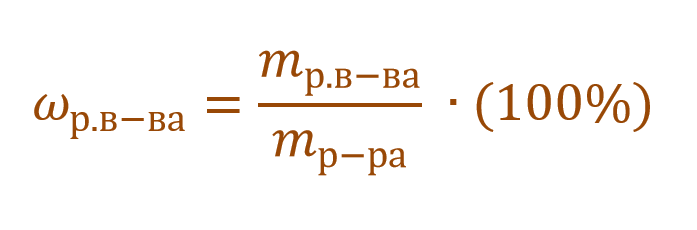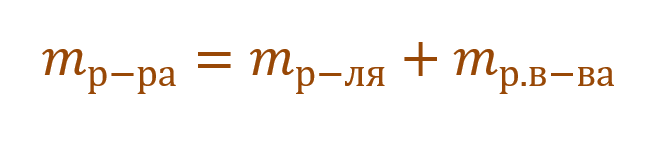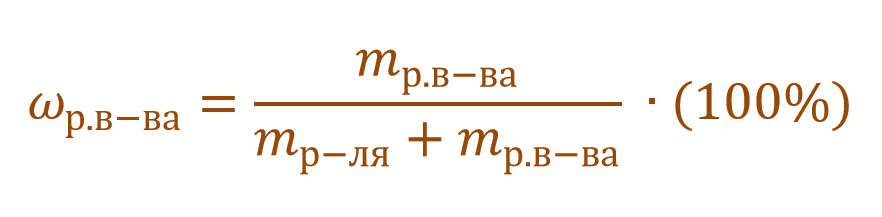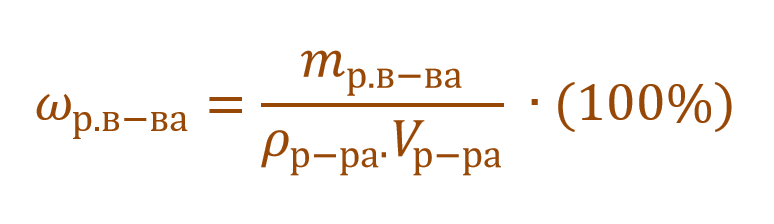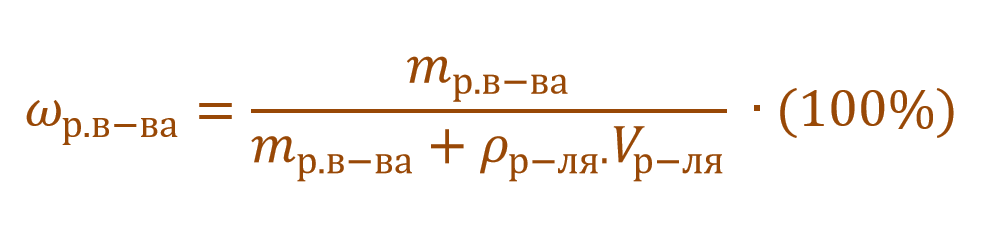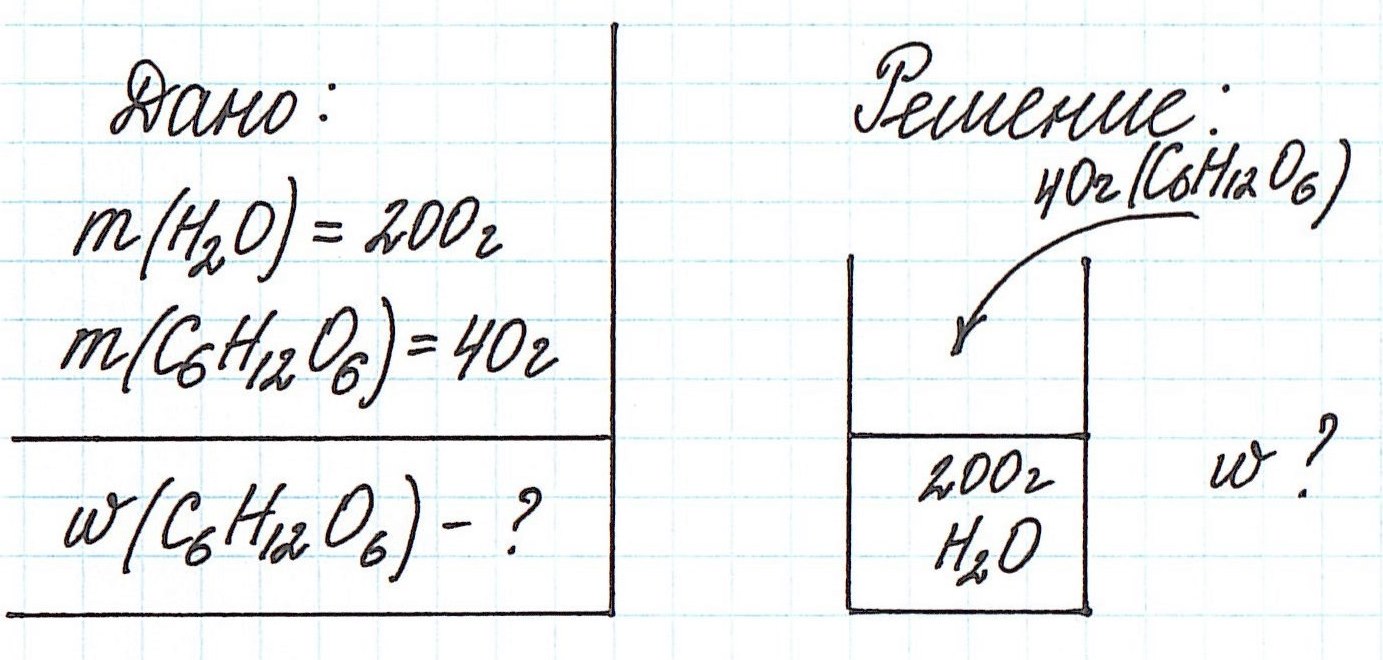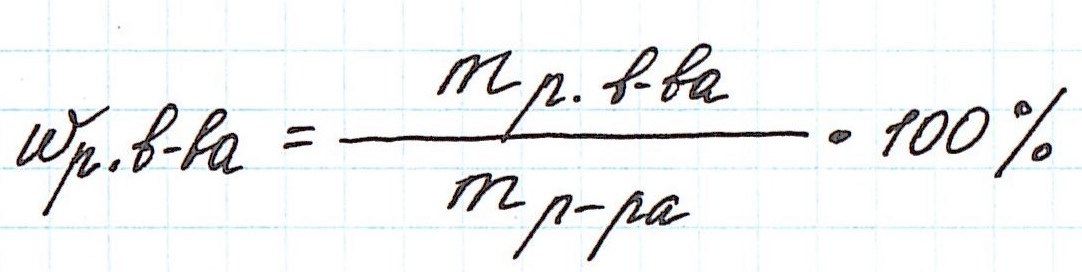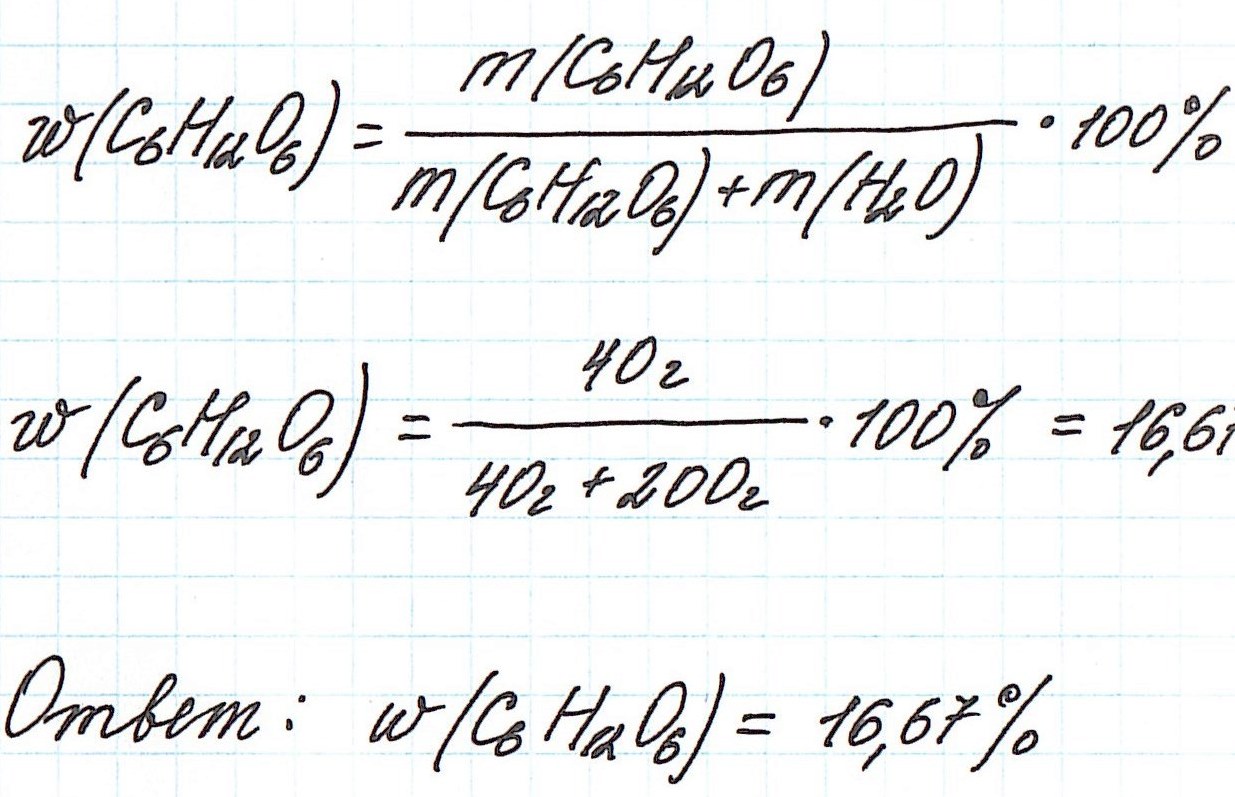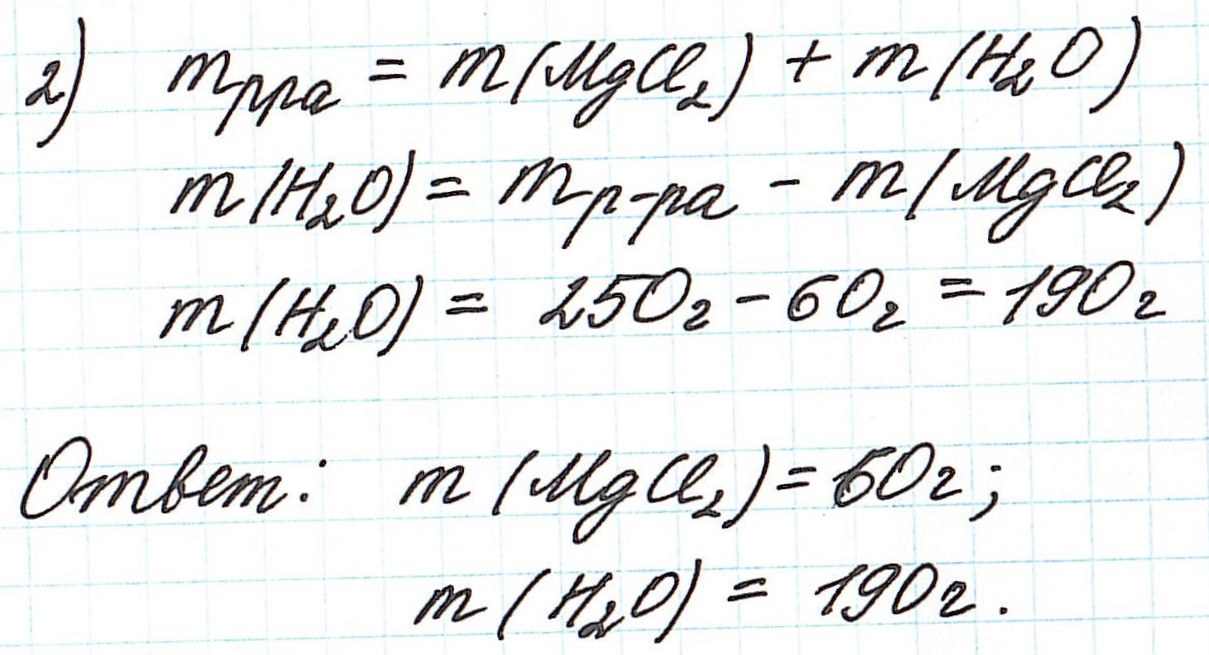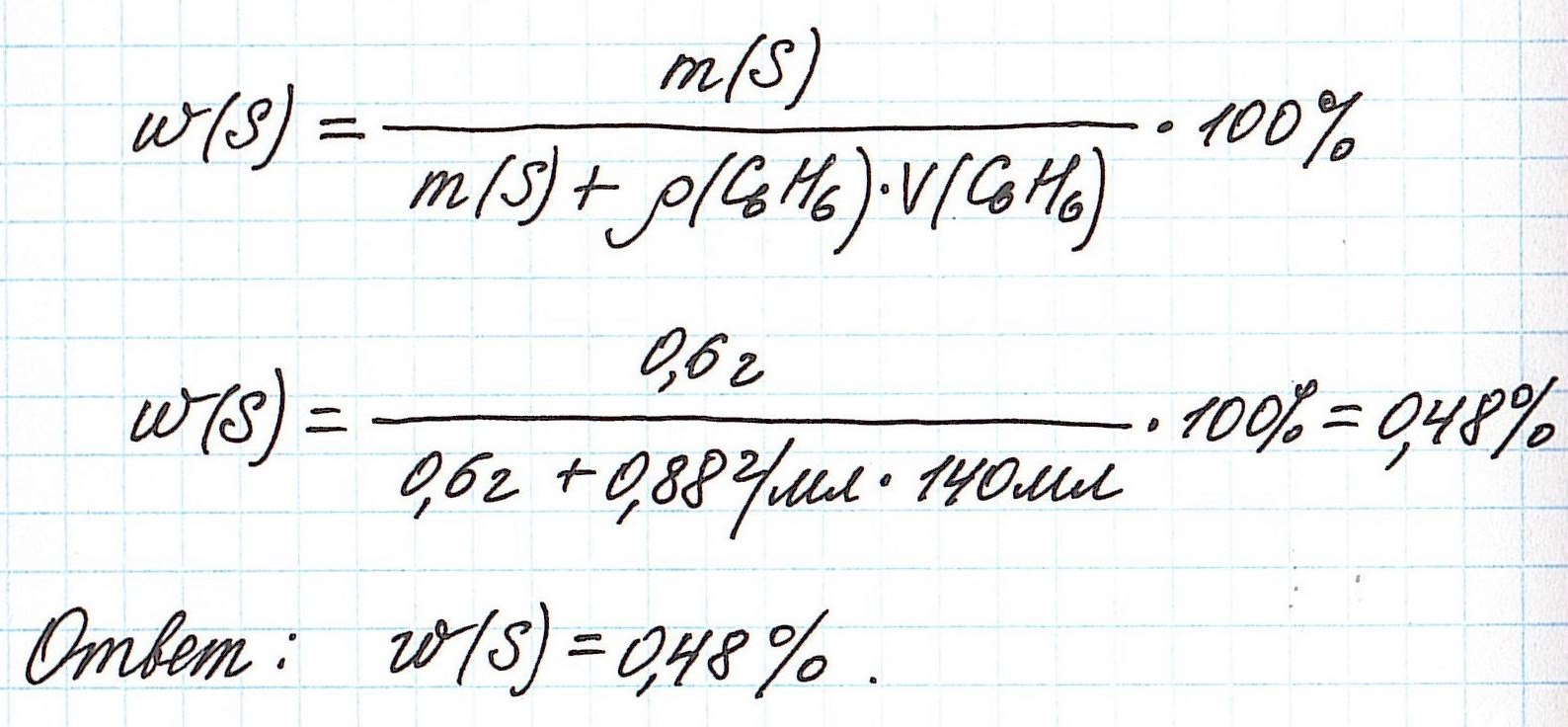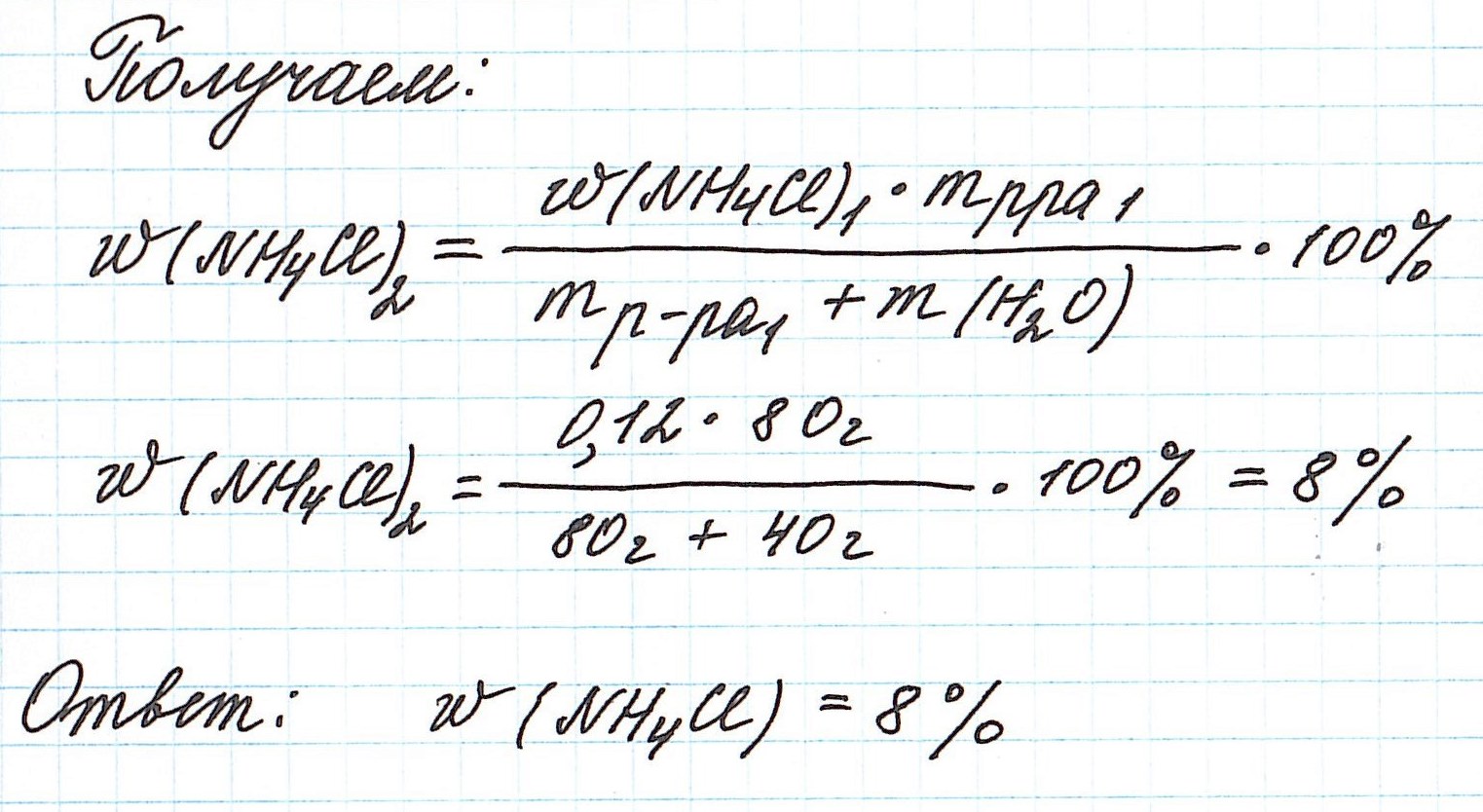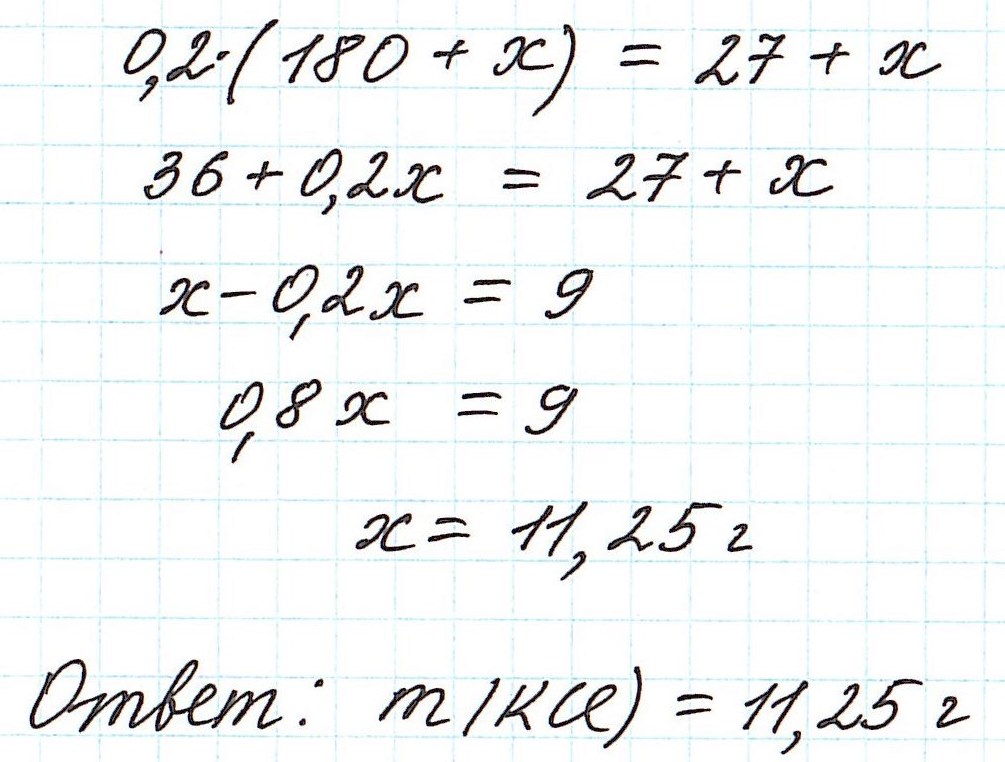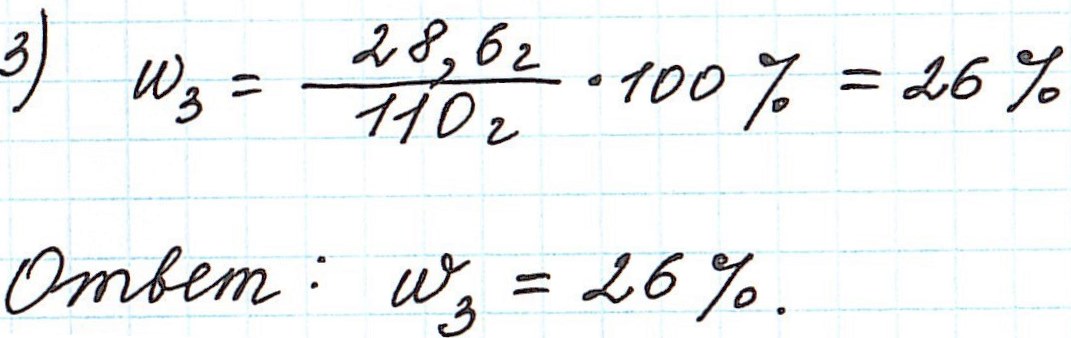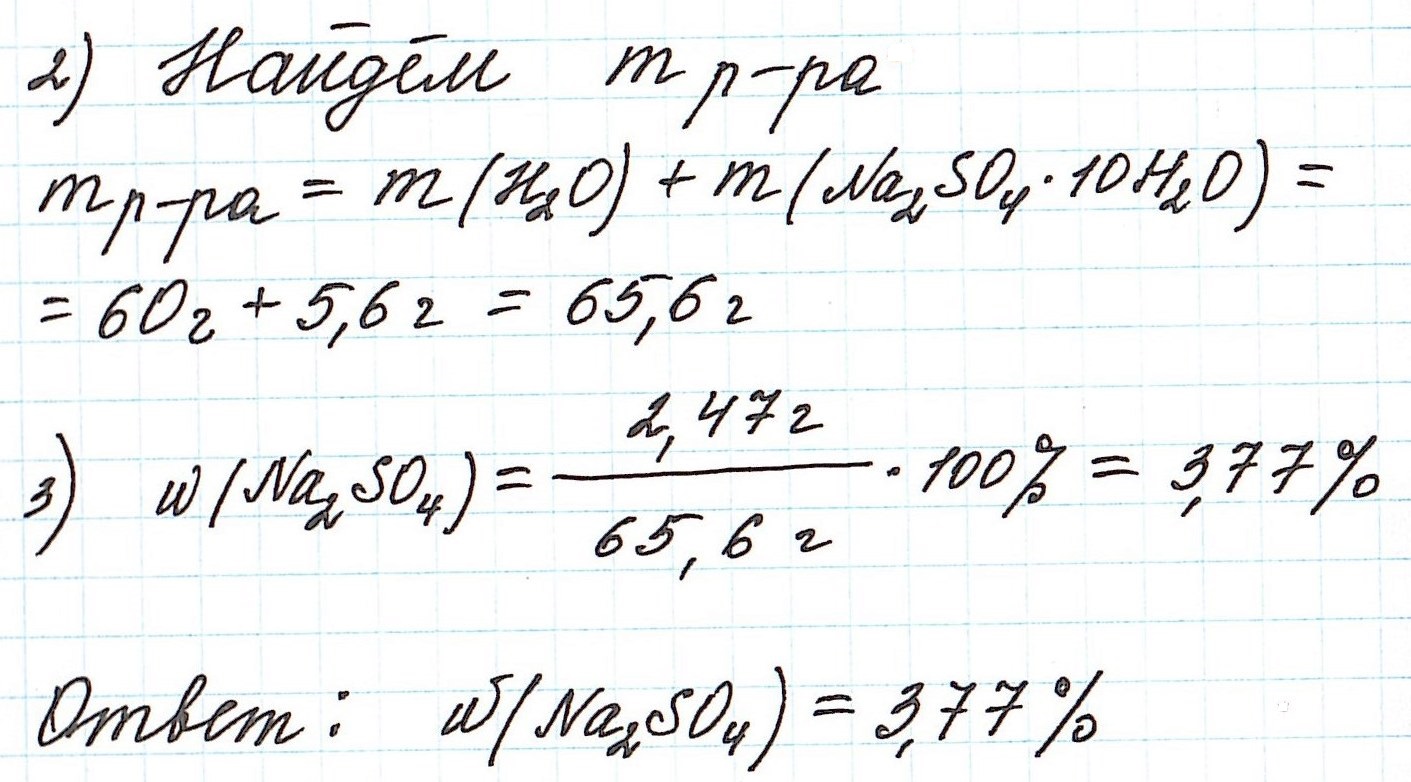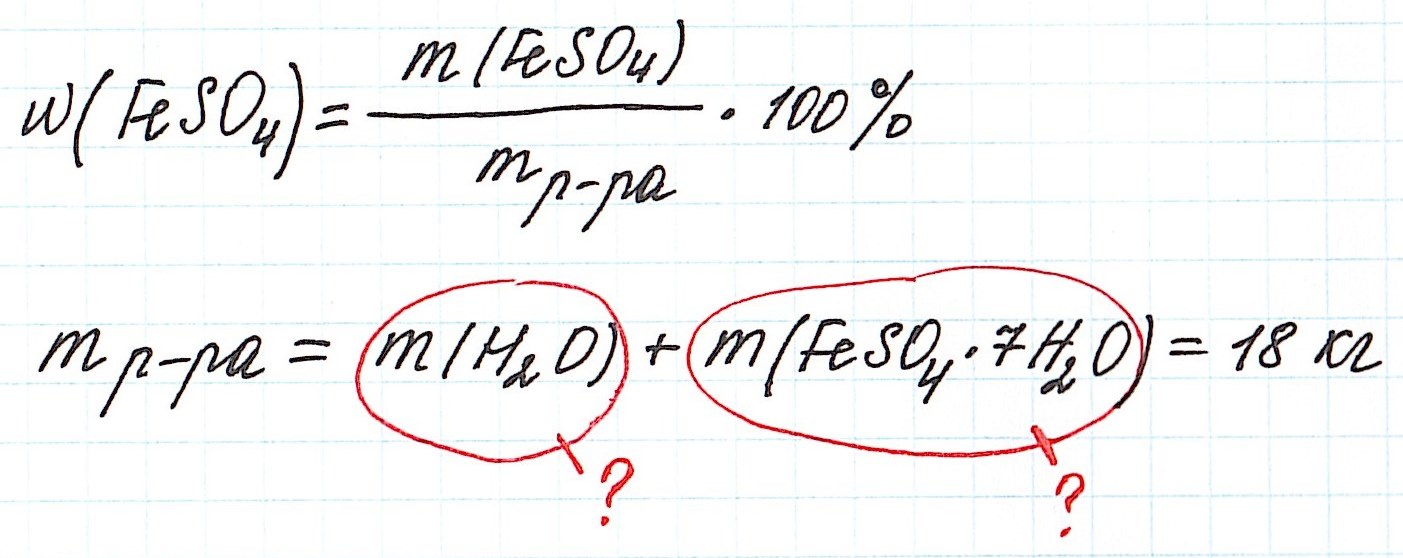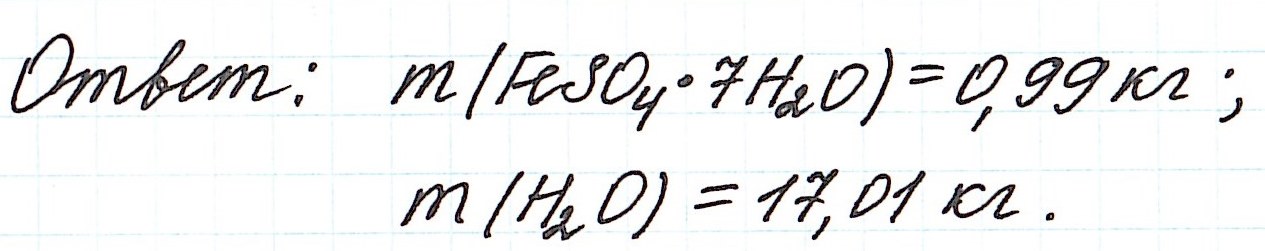Формула концентрации раствора. Их множество. И каждая соответствует тому или иному способу выражения концентрации. А в химии их применяются достаточно: массовая доля растворенного вещества, молярная, нормальная, моляльная, титр и др.
Зачем так много? Ответ на этот вопрос очень прост. Каждый вид концентрации удобен в том или ином случае, когда применение другого вида концентрации неуместно.
Например, при исследовании содержания массы вещества в очень небольшом объеме раствора удобно пользоваться титром. А в каких-то технологиях вообще концентрация заменяется другими количественными характеристиками раствора. Так, в технологии посола рыбы для расчета необходимой концентрации тузлука (раствора поваренной соли) используют не его процентную концентрацию, а плотность.
Содержание:
1. Концентрация – что это такое
2. Формула концентрации раствора: основные виды
3. Массовая доля растворенного вещества и примеры ее вычисления
- разбавление раствора водой
- концентрирование раствора путем упаривания
- концентрирование раствора путем добавления растворенного вещества
- смешивание двух растворов
- применение кристаллогидратов для приготовления раствора (задачи на кристаллогидраты)
4. Правило «креста» в химии растворов как метод решения задач на процентную концентрацию растворов
Концентрация – что это такое
Любой раствор имеет различные характеристики: качественные и количественные. Одной из важнейших количественных характеристик является концентрация раствора.
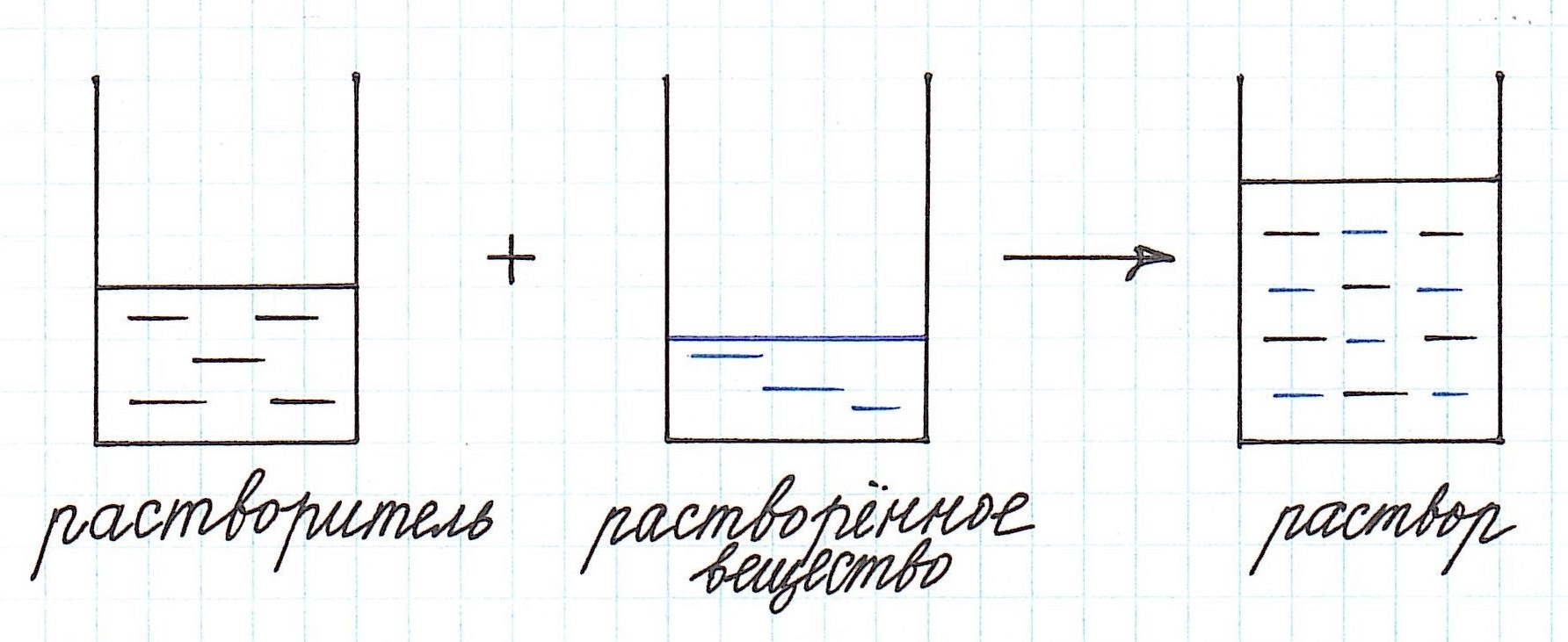
Концентрация раствора – это количество растворенного вещества, содержащееся в определенном количестве раствора.
Как видно из приведенного определения, основными компонентами раствора являются:
— растворитель;
— растворенное вещество.
Растворенного вещества в растворе всегда меньше, а растворителя больше.
И вот именно с вычислением количественного содержания растворенного вещества чаще всего и связаны все расчеты, основанные на применении формулы концентрации раствора.
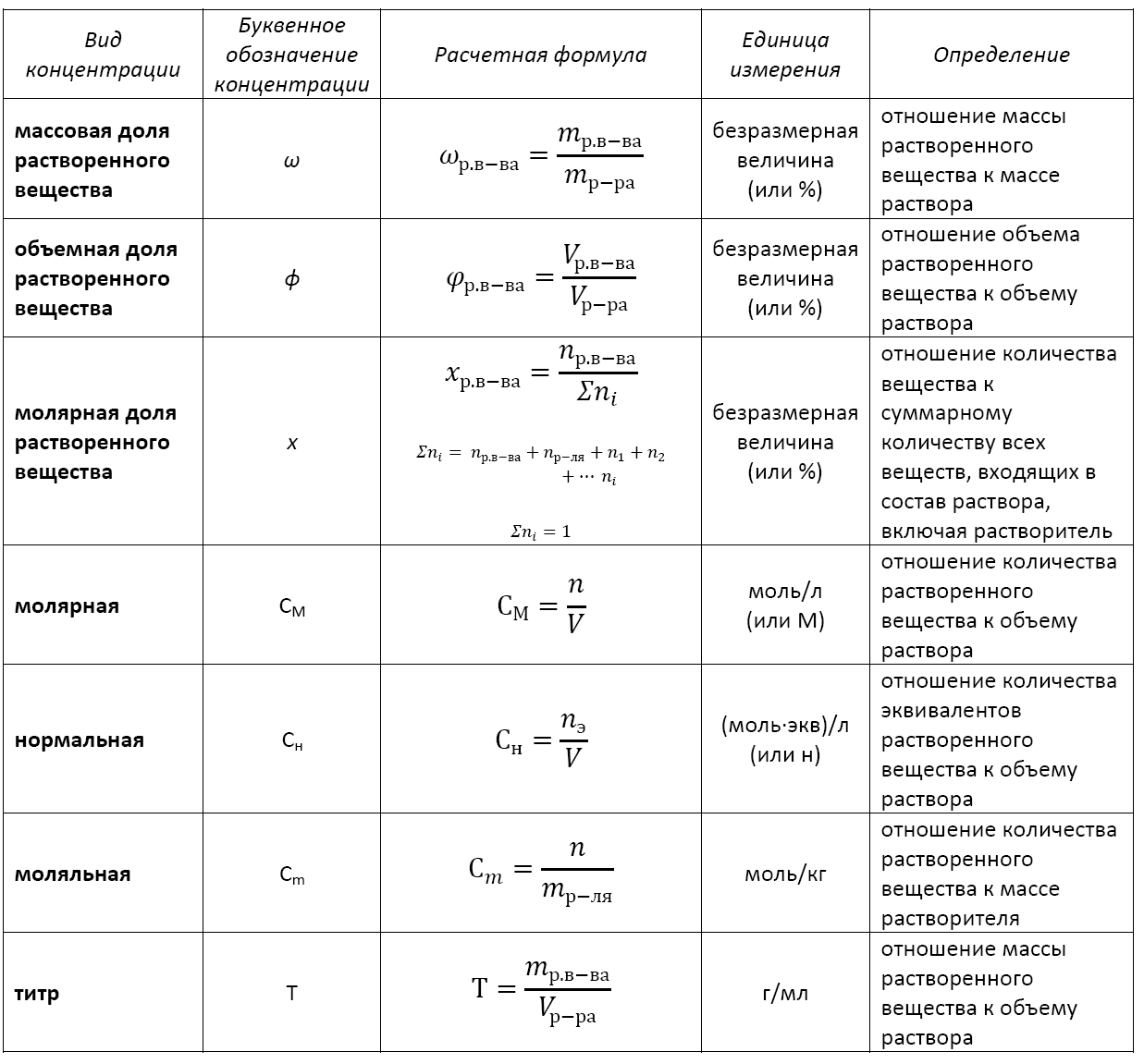
Существует несколько видов концентрации раствора:
— массовая доля растворенного вещества;
— объемная доля растворенного вещества;
— молярная доля растворенного вещества;
— молярная (или молярность);
— моляльная (или моляльность);
— нормальная (или эквивалентная);
— титр.
Формула концентрации раствора: основные виды
Применение того или иного вида концентрации уместно в каждом конкретном случае. Не существует какой-то универсальной концентрации или универсальной формулы концентрации раствора.
Кстати, с помощью математических преобразований можно перейти от одной концентрации к другой или найти взаимосвязь между разными их видами.
Основные расчетные формулы концентрации раствора приведены в таблице:
Массовая доля растворенного вещества и примеры ее вычисления
Массовая доля растворенного вещества – это отношение массы растворенного вещества к массе раствора.
Ее расчетная формула выглядит так:
где ωр.в-ва – массовая доля растворенного вещества, mр.в-ва – масса растворенного вещества, mр-ра – масса раствора.
ωр.в-ва представляет собой долю или от единицы или от 100%. Так, например, имеется двухпроцентный раствор NaCl. Его концентрация будет записана в первом случае ω(NaCl) = 0,02, а во втором – ω(NaCl) = 2%. Форма записи основной сути не меняет. Можно записывать и так, и так.
Что же означает выражение ω(NaCl) = 0,02 или ω(NaCl) = 2%? Буквально следующее: в 100 г водного раствора поваренной соли содержится 2 г этой соли и 98 г воды.
Необходимо помнить, что раствор состоит из растворителя и растворенного вещества. Поэтому масса раствора будет состоять из массы растворителя и массы растворенного вещества:
Тогда основную расчетную формулу для массовой доли растворенного вещества можно преобразовать:
Очень часто в расчетах с процентной концентрацией используются плотность и объем раствора:
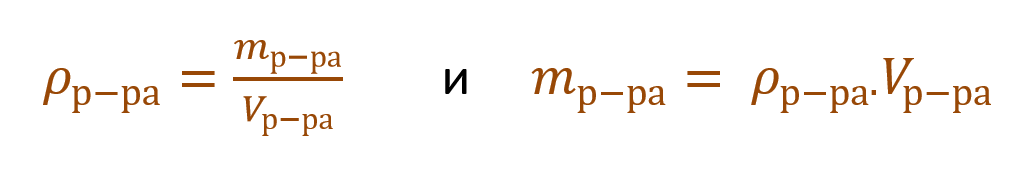
В других ситуациях могут использоваться объем и плотность не раствора, а растворителя. Тогда основная формула для расчета концентрации будет выглядеть так:
На практике бывает необходимо не только приготовить раствор с какой-либо определенной концентрацией, но и увеличить, либо уменьшить ее значение. Это достигается различными приемами:
— упариванием раствора;
— добавлением растворенного вещества;
— добавлением к раствору растворителя (например, воды).
Кроме того, приходится часто смешивать друг с другом растворы разных концентраций.
Разберем все возможные случаи.
Мы рекомендуем задачи, в которых речь идет о растворах, решать с использованием схематических рисунков. Это очень наглядно, особенно, когда речь идет о смешивании растворов.
Начнем с самого простого: вычислим концентрацию раствора.
Пример 1. В 200 г воды растворили 40 г глюкозы. Вычислите массовую долю глюкозы в полученном растворе.
Обратите внимание, что речи о каком-либо химическом взаимодействии не идет! Поэтому записывать уравнения реакций не требуется!
Запишем общую формулу для расчета массовой доли растворенного вещества:
В данной задаче глюкоза (C6H12O6) – растворенное вещество, а вода (H2O) – растворитель. Масса раствора будет складываться из массы глюкозы и массы воды:
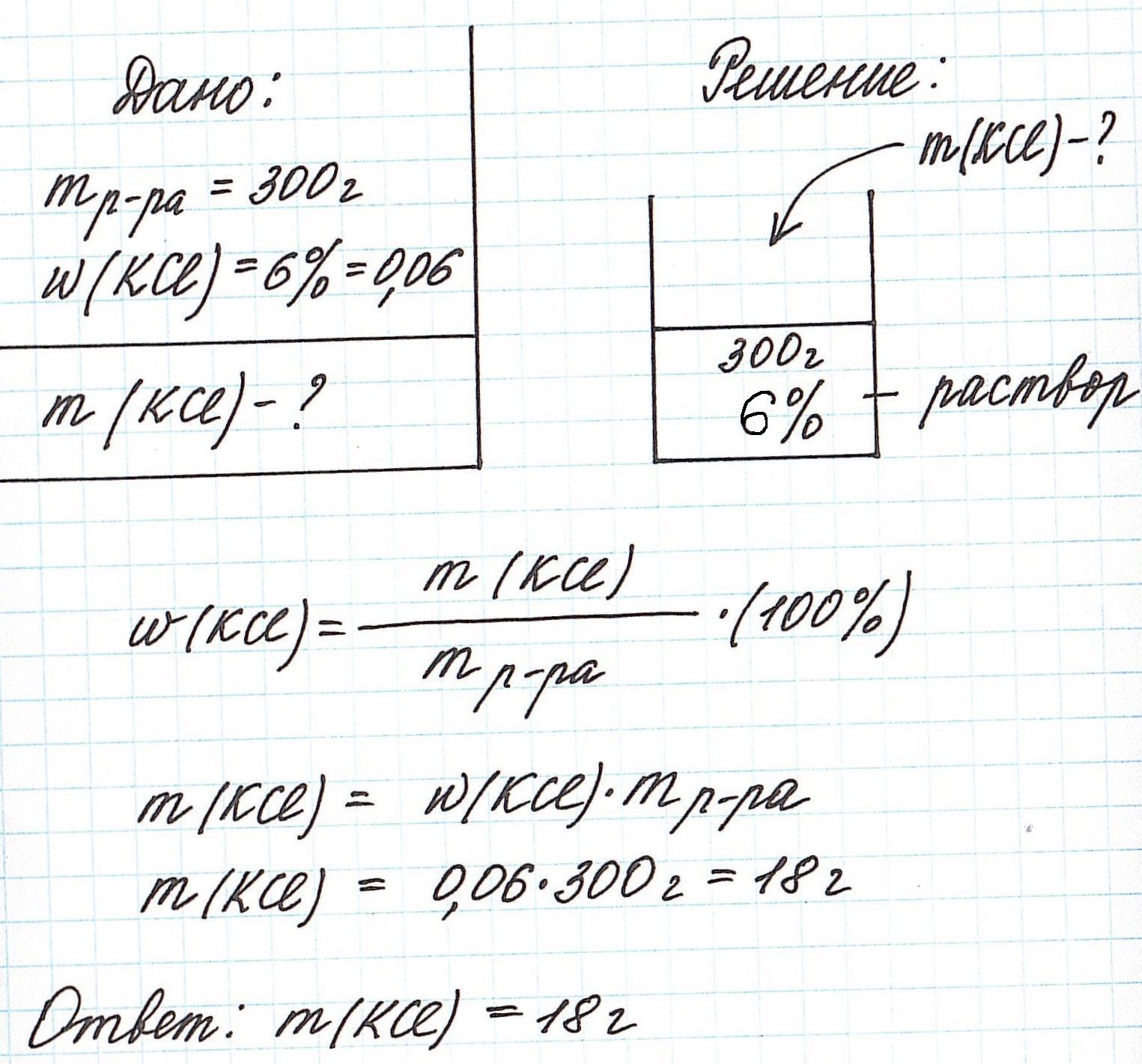
Пример 2. Рассчитайте, сколько потребуется хлорида калия, чтобы приготовить 300 г раствора с массовой долей соли 6%.
Обратите внимание, для того, чтобы расчеты были менее громоздкими, будем использовать выражение концентрации не в %, а в долях от единицы.
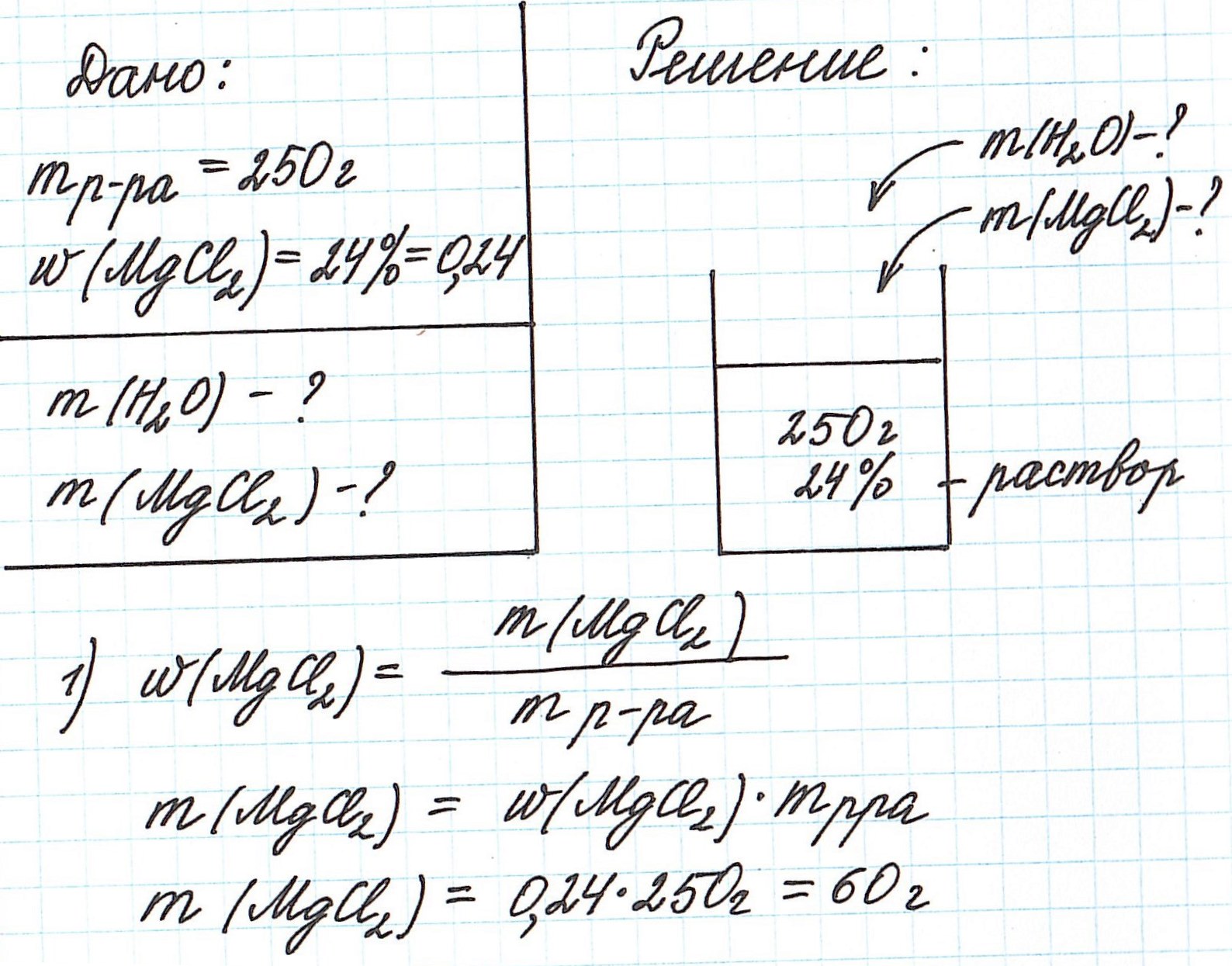
Пример 3. Необходимо приготовить 250 г раствора с массовой долей хлорида магния 24%. Рассчитайте массу требуемых воды и соли.
Так как раствор готовится из хлорида магния и воды, то и масса раствора равна сумме масс хлорида магния и воды:
Рассмотрим задачу, в которой в качестве растворителя выступает не вода, а другое вещество.
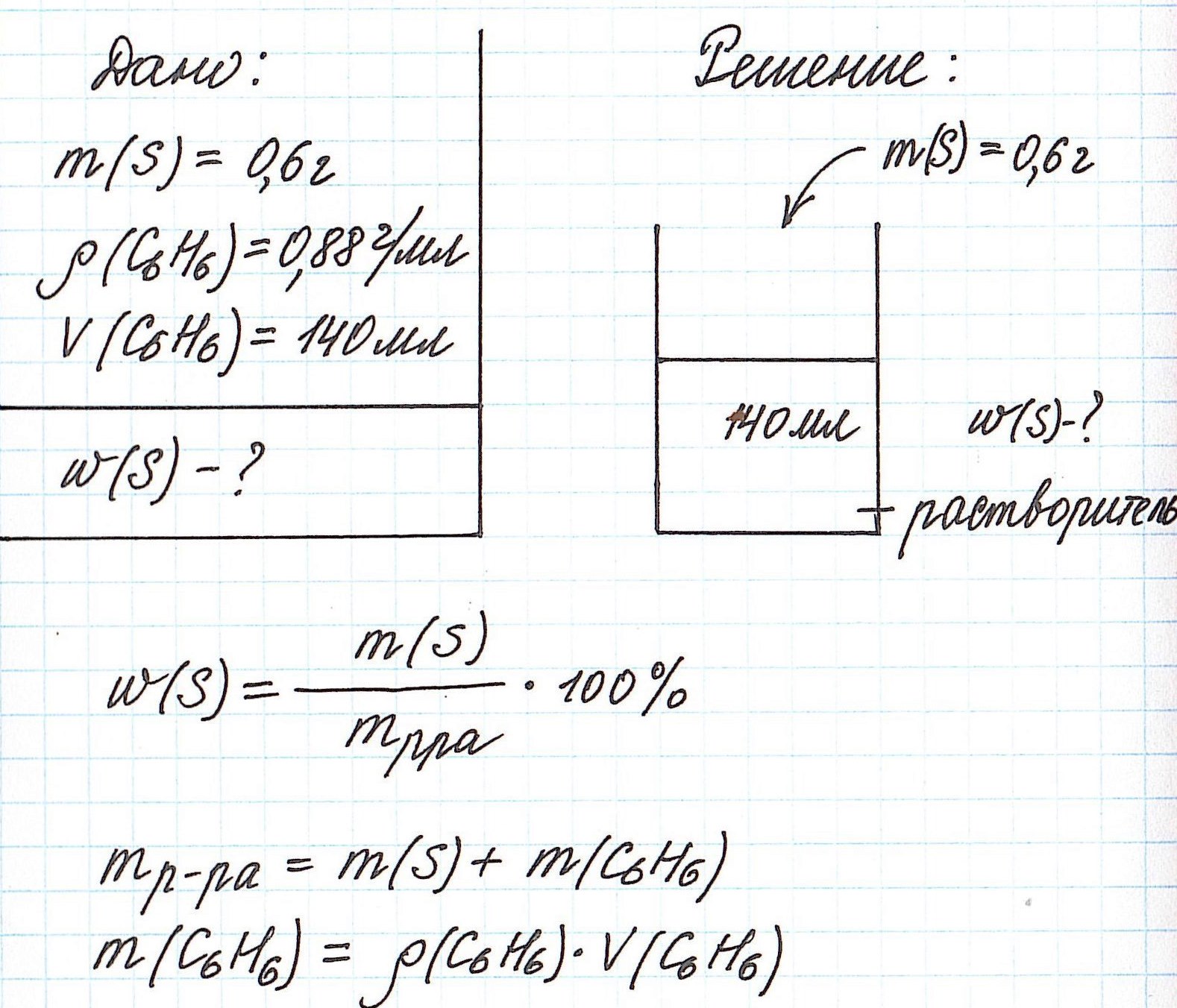
Пример 4. В органическом растворителе бензоле объемом 140 мл растворили серу массой 0,6 г. Вычислите массовую долю серы в полученном растворе, если плотность бензола составляет 0,88 г/мл.
Обратите внимание, что здесь:
— масса раствора не известна;
— масса растворителя (бензола) не известна;
— известны объем и плотность растворителя (бензола), что позволяет нам найти его массу;
— масса раствора состоит из массы растворителя (бензол) и массы растворенного вещества (сера).
Объединим все расчетные формулы в одну и подставим в нее имеющиеся численные значения:
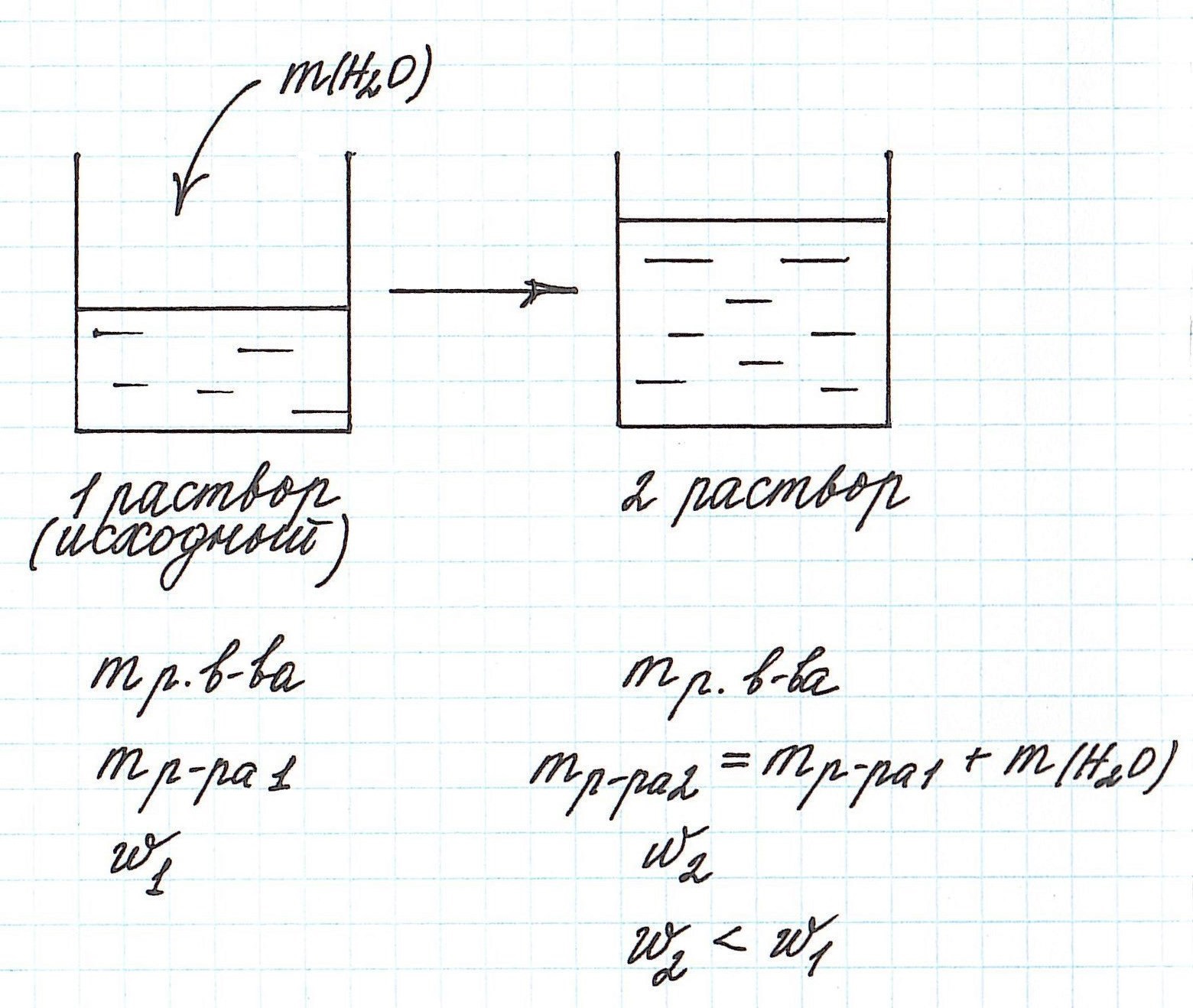
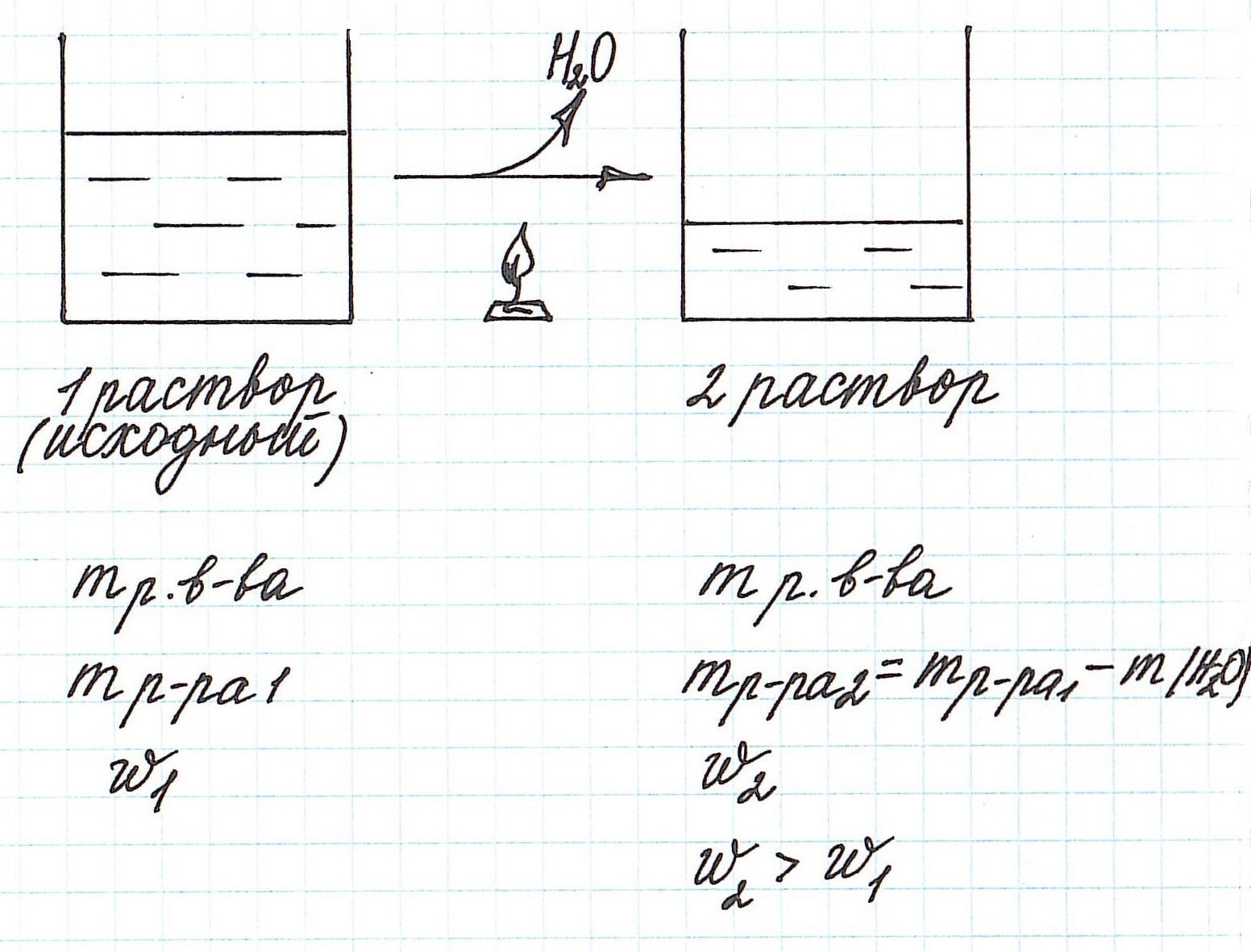
Вычисление массовой доли растворенного вещества при разбавлении раствора водой
Разбавление раствора водой приводит к уменьшению его концентрации.
Запомним, что в таких случаях:
— увеличивается масса раствора;
— увеличивается масса растворителя;
— масса растворенного вещества остается постоянной.
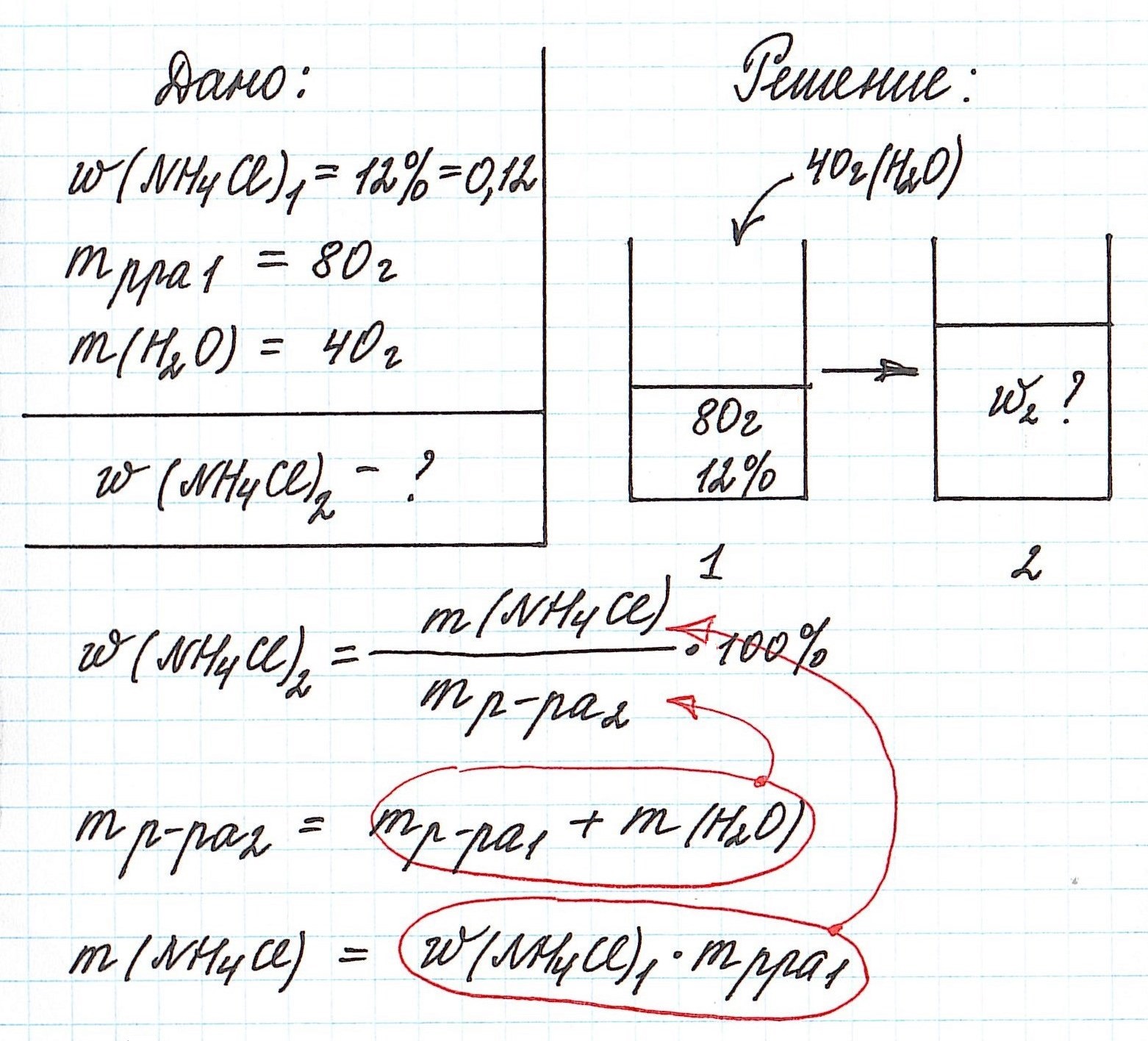
Пример 5. К 80 г раствора с массовой долей NH4Cl 12% добавили 40 г воды. Вычислите массовую долю хлорида аммония в полученном растворе.
Объединим все полученные формулы в одну и подставим имеющиеся данные:
Пример 6. Рассчитайте объем раствора фосфорной кислоты (массовая доля кислоты 12%, плотность 1,065 г/мл), который потребуется для приготовления раствора с массовой долей H3РO4 4% объемом 250 мл (плотность 1,02 г/мл).
В данной задаче речь напрямую о разбавлении раствора не идет. Но судя по тому, что исходный раствор имел концентрацию 12%, а конечный – 4%, становится ясно: последний раствор можно получить путем разбавления первого водой.
Вычисление массовой доли растворенного вещества при концентрировании раствора путем упаривания
Упаривание раствора, т.е. его нагревание, при котором происходит испарение воды, приводит к увеличению концентрации.
Учтите, что при этом:
— уменьшается масса раствора;
— уменьшается масса растворителя;
— масса растворенного вещества остается постоянной (при условии, что растворенное вещество не разлагается при данной температуре).
Пример 7. Из 200 г 27%-ного раствора глюкозы выпарили 20 г воды. Определите массовую долю глюкозы в полученном растворе.
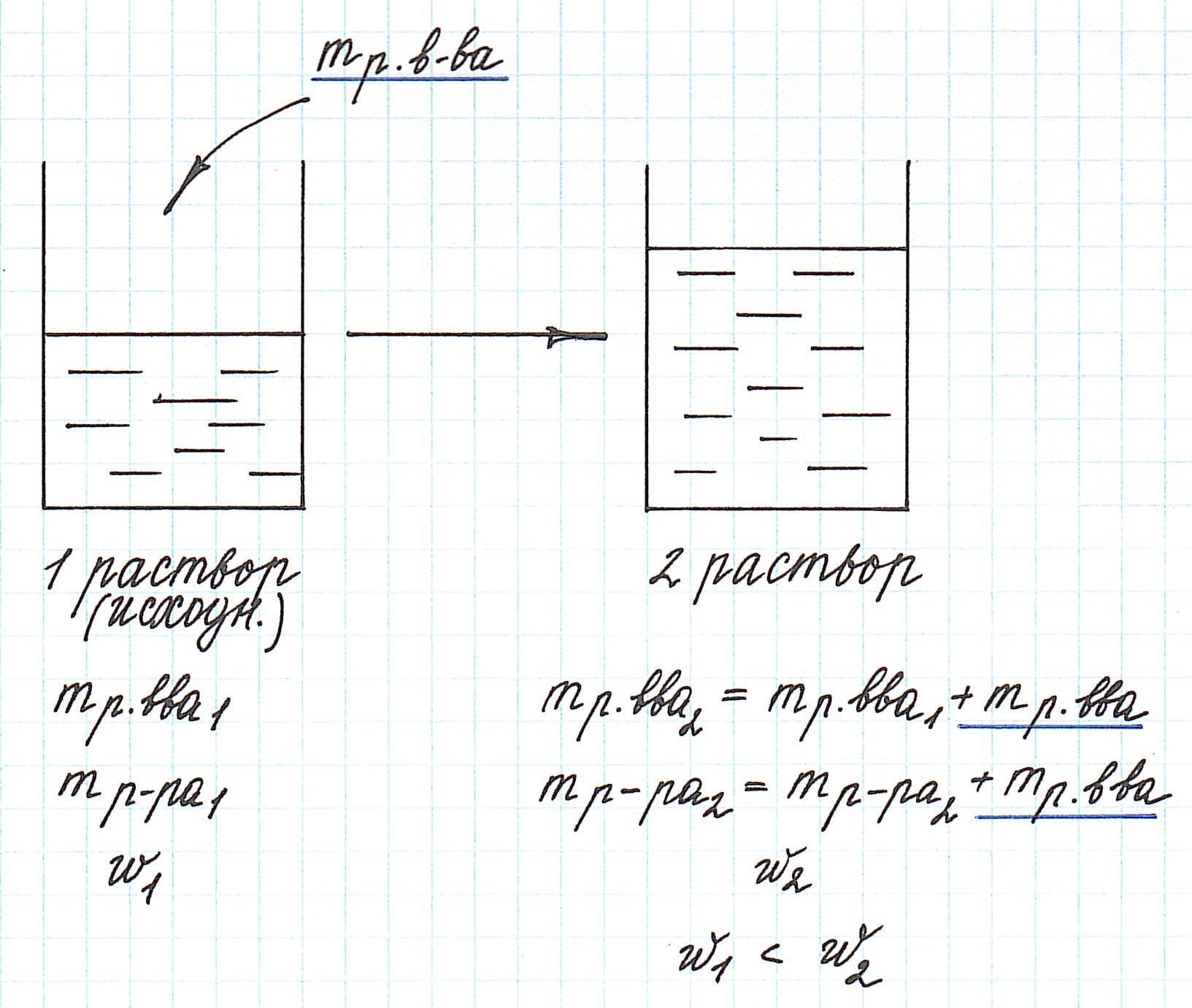
Вычисление массовой доли растворенного вещества при концентрировании раствора путем добавления растворенного вещества
Добавление к уже существующему раствору новой порции растворенного вещества приводит к увеличению концентрации раствора.
Помните, что в таких случаях:
— увеличивается масса раствора;
— увеличивается масса растворенного вещества.
Пример 8. Определите массу хлорида калия, который надо добавить к 180 г 15%-ного раствора этой соли, чтобы получить 20%-ный раствор.
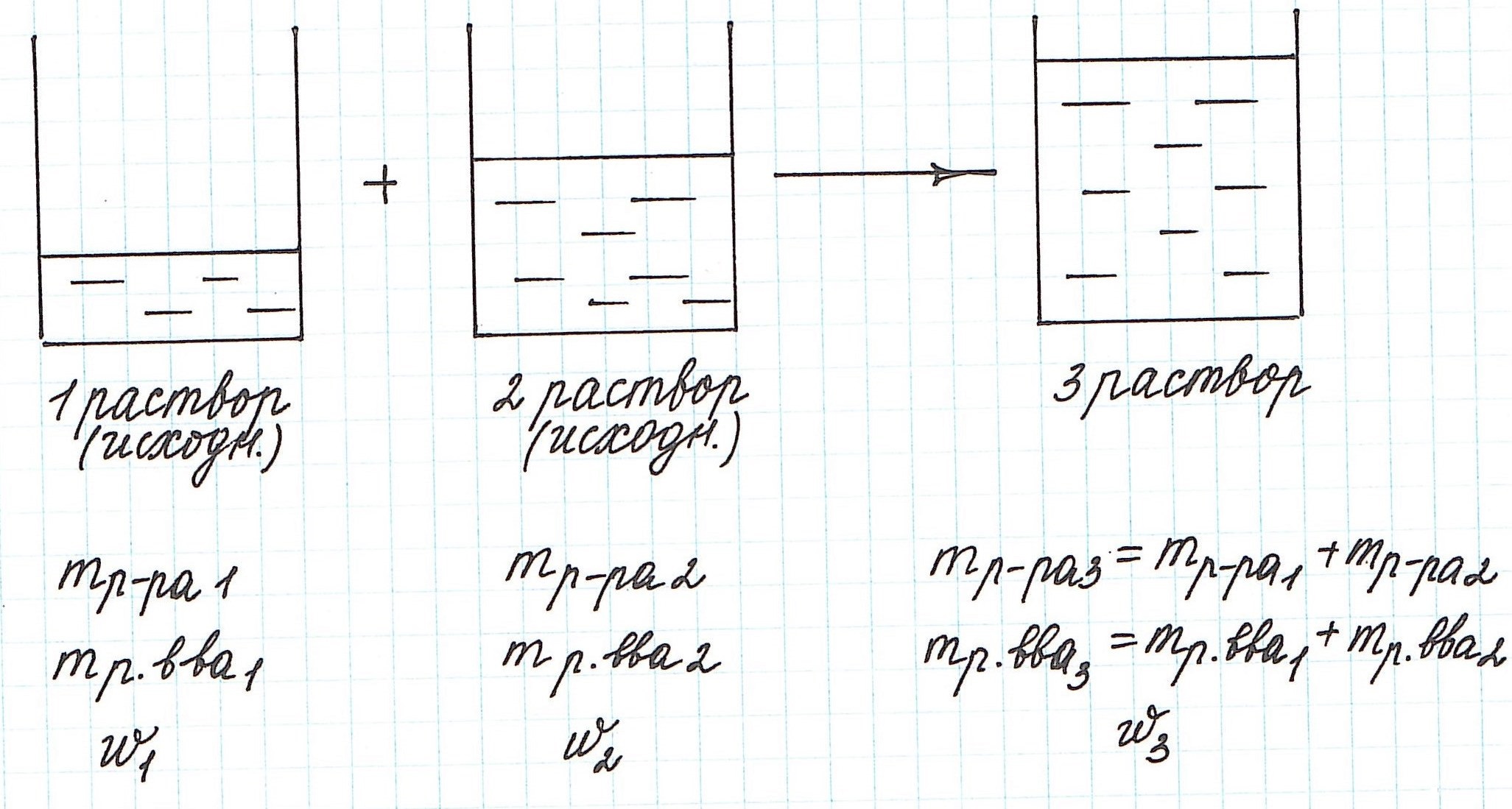
Вычисление массовой доли растворенного вещества при смешивании двух растворов
При смешивании двух растворов (речь о растворах одного и того же вещества конечно же) изменяются все количественные характеристики:
— увеличивается масса раствора;
— увеличивается масса растворенного вещества;
— изменяется массовая доля растворенного вещества.
Пример 9. Смешали 80 г 32%-ного раствора и 30 г 10%-ного раствора нитрата меди (II). Какова концентрация соли в полученном растворе?
Вычисление массовой доли растворенного вещества с применением кристаллогидратов для приготовления раствора
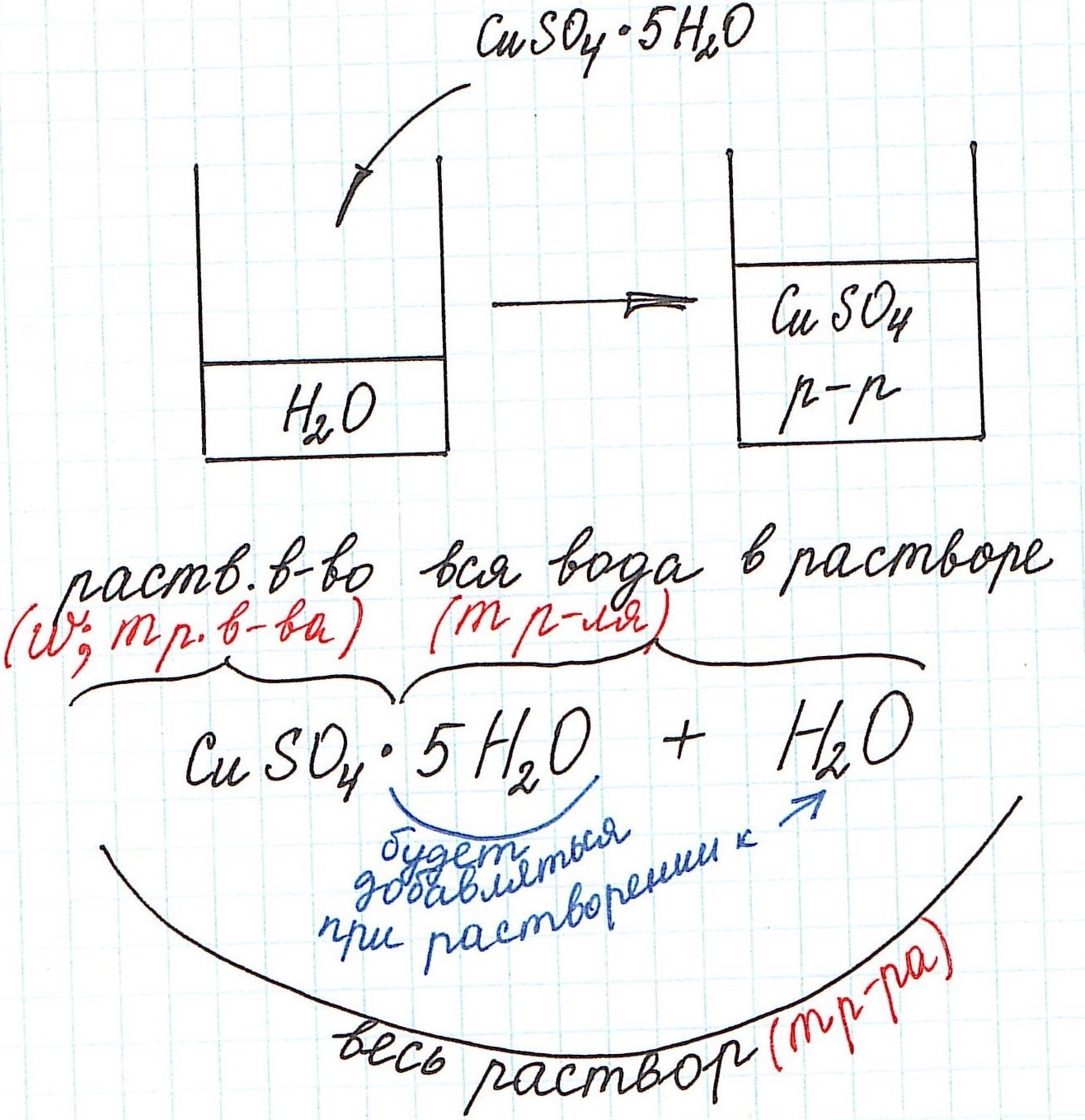
Кристаллогидраты используются для приготовления растворов довольно часто. Кристаллогидраты представляют собой вещества, в состав которых помимо основного вещества входят молекулы воды. Например:
CuSO4·5H2O – кристаллогидрат сульфата меди (II) (или медный купорос);
Na2SO4·10H2O – кристаллогидрат сульфата натрия (или глауберова соль).
Больше примеров здесь.
Вода, входящая в состав кристаллогидрата, называется кристаллизационной.
Кристаллогидраты различаются прочностью связи между основным веществом и кристаллизационной водой. Одни из них теряют воду при комнатной температуре с течением времени и перестают быть кристаллогидратами (например, Na2СO3·10H2O). Другие – обезвоживаются только при сильном нагревании (например, CuSO4·5H2O).
При расчете концентрации с использованием кристаллогидратов для получения растворов часто приходится учитывать и кристаллизационную воду.
Но сначала поясним некоторые нюансы на конкретном примере:
1) Формула CuSO4·5H2O означает, что 1 моль CuSO4·5H2O содержит 1 моль CuSO4 и 5 моль H2O. Это можно было бы записать так:
n(CuSO4) = n(CuSO4·5H2O); n(H2O) = 5n(CuSO4·5H2O)
2) Относительная молекулярная (и численно молярная) масса будет складываться из относительной молекулярной массы вещества и относительной молекулярной массы воды. Например:
Mr(CuSO4·5H2O) = Mr(CuSO4) + 5·Mr(H2O) = 160 + 5·18 = 250 и, соответственно,
M(CuSO4·5H2O) = M(CuSO4) + 5·M(H2O) = 160 + 5·18 = 250 г/моль.
3) Еще одну особенность поясним с помощью рисунка:
Итак, разберем несколько типичных задач.
Пример 10. В 60 г воды растворили глауберову соль Na2SO4·10H2O массой 5,6 г. Какова массовая доля сульфата натрия в полученном растворе?
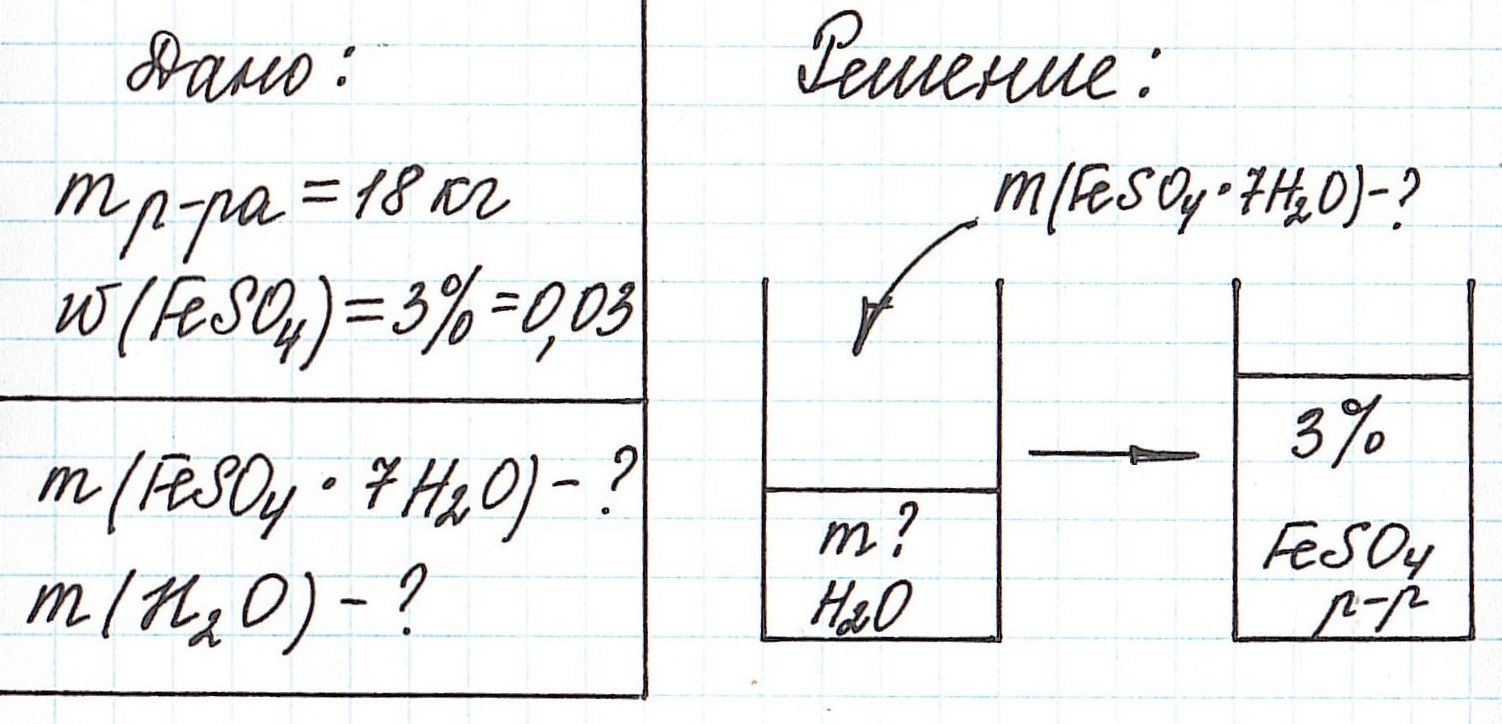
Пример 11. Какая масса железного купороса FeSO4·7H2O и воды потребуется для приготовления 18 кг раствора сульфата железа (II) с массовой долей FeSO4 3%?
Обратите внимание, что масса раствора дана не в граммах (г), а в килограммах (кг). Для того, чтобы привести в ходе расчетов все единицы измерения к единой системе, можно перевести килограммы в граммы и вычислять как обычно.
Но есть более простой способ. Можно считать количество вещества не в моль, а в киломоль (кмоль). Молярную массу вычислять не в г/моль, а в кг/кмоль. В этом случае ответ в задаче мы сразу получим в килограммах.
Пример 12. Вычислите массу кристаллогидрата сульфата никеля NiSO4·7H2O, который надо добавить к 180 г раствора с массовой долей сульфата никеля 1,5%, чтобы получить раствор с массовой долей соли 6%?
Правило «креста» в химии растворов как метод решения задач на процентную концентрацию растворов
Правилом «креста» (или «квадратом Пирсона») очень удобно пользоваться в расчетах, связанных с разбавлением или смешиванием растворов.
Общая схема вычислений выглядит так:
Пример 13. Какую массу 5%-ного раствора глюкозы надо добавить к 70 г 21%-ного раствора этого же вещества, чтобы получить 12%-ный раствор?
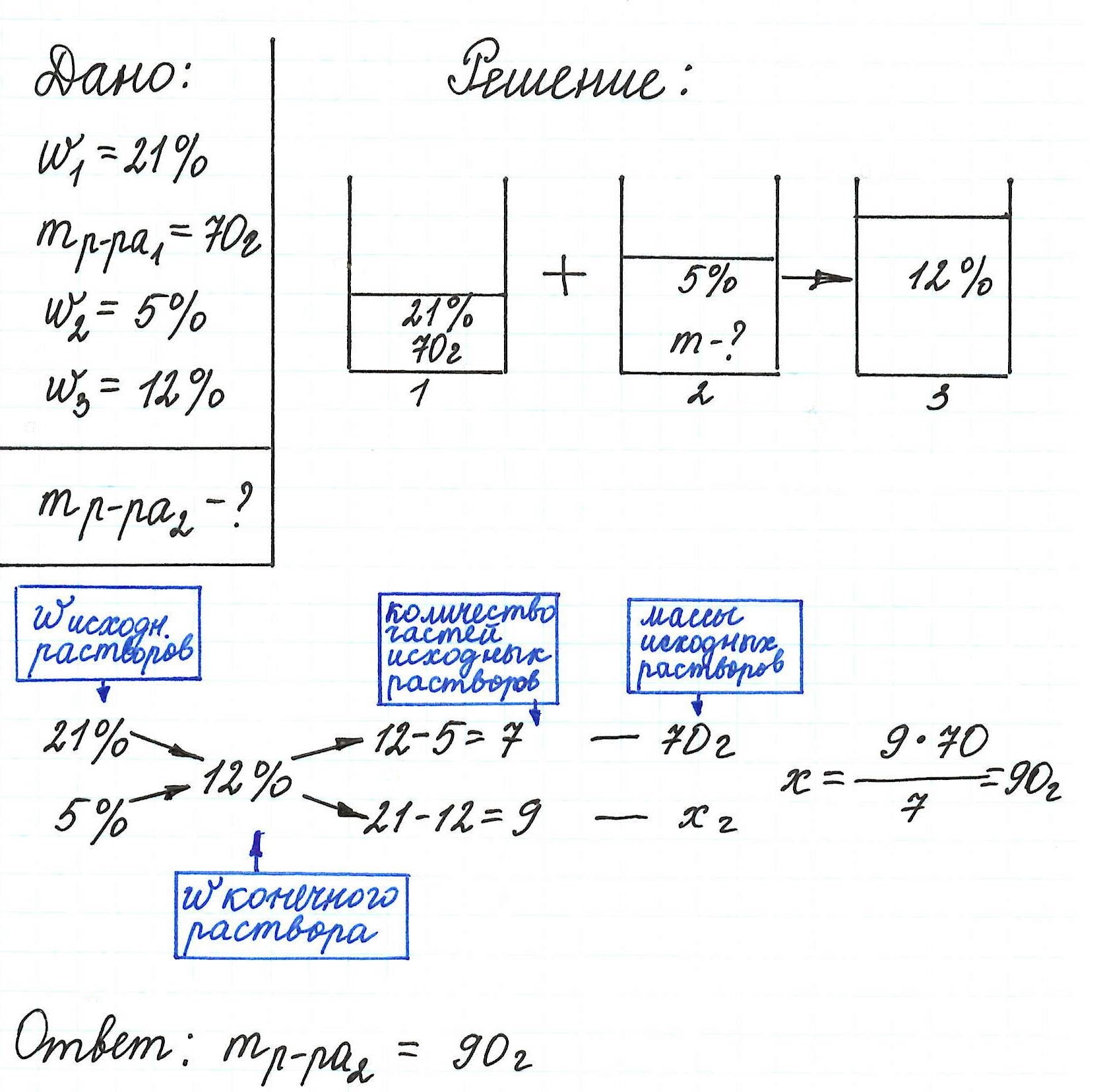
Еще примеры с применением правила «креста» можно посмотреть здесь.
Мы рассмотрели достаточно примеров расчетов, где используется формула такой концентрации раствора как массовая доля растворенного вещества. Как видим, ситуаций, в которых требуется ее применение, множество. Однако, есть достаточно случаев, когда более приемлемыми являются формулы других концентраций (молярной, нормальной, титра и т.д.). Об этом читайте в других статьях.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
или на Одноклассниках
Пожалуйста, оцените публикацию. Большая просьба, если вы оцениваете публикацию от 1 до 3 звезд, обязательно оставьте свой комментарий с указанием того, что не так с этой публикацией. Мы постараемся устранить недостатки.
Ваше мнение для нас важно!
ОПРЕДЕЛЕНИЕ МАССОВОЙ ДОЛИ ВЕЩЕСТВА В РАСТВОРЕ ПОСЛЕ ЕГО УПАРИВАНИЯ
Оценка 4.8
Решение расчетных задач по химии для большинства школьников является сложной задачей. Чтобы научить школьников решать задачи, каждый учитель использует свои собственные приемы. В своей педагогической практике я использую прием индивидуального маршрутного образовательного листа для школьника, который составляю отдельно на каждый тип задач. В каждом таком листе для понимания школьником смысла расчетных задач обязательно формулирую название типа задач, даю в качестве примера одно из условий, его краткую запись, необходимую расчетную формулу (формулы), оформляю задачи в соответствии с требованиями. При систематическом использовании таких маршрутов учащиеся учатся разбирать образцы, усваивают порядок действий, в дальнейшем осваивают способы решения задач заданного типа.
Материалы на данной страницы взяты из открытых истончиков либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.
Как найти массовую долю вещества
Людям в зависимости от рода их профессии приходится сталкиваться с растворами, имеющими строго заданное содержание в них растворенного вещества: приготовление лекарственных растворов, растворение проявителя для фотографий, раствор для аккумулятора с содержанием серной кислоты и т.д. Поэтому на уроках химии школьники с помощью задач учатся рассчитывать массовую долю растворенных веществ – отношение массы растворенного вещества к общей массе раствора.
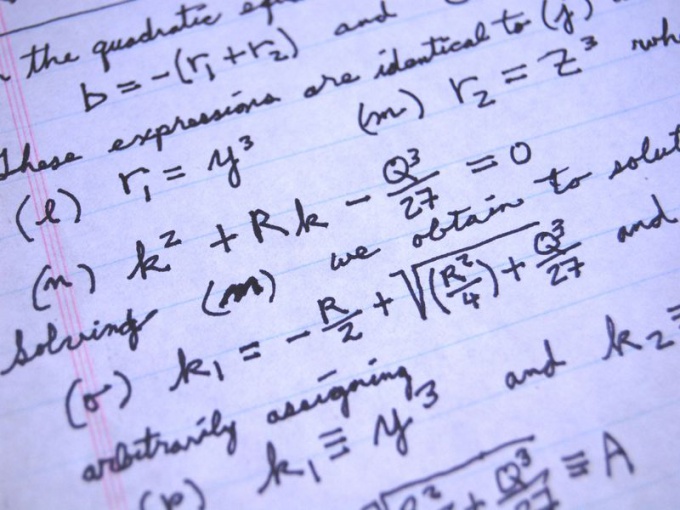
Инструкция
Прочитайте внимательно задачу. Кратко с левой стороны страницы запишите ее данные с использованием буквенных обозначений и формул химических веществ, если они есть. Определите из вопроса задачи, что нужно найти.
Запишите с правой стороны листа общую формулу массовой доли растворенного вещества
ω = m1 / m,
где m1 – масса растворенного вещества, а m – масса всего раствора.
Если содержание массовой доли растворенного вещества нужно узнать в процентах, умножьте полученное число на 100%:
ω = m1 / m х 100%
В задачах, где нужно вычислить массовые доли каждого из элементов, входящих в состав химического вещества, используйте таблицу Д.И. Менделеева. Например, узнайте массовые доли каждого из элементов, входящих в состав углеводорода, формула которого C6H12
m (C6H12) = 6 х 12 + 12 х 1= 84 г/моль
ω (С) = 6 m1(С) / m (C6H12) х 100% = 6 х 12 г / 84 г/моль х 100% = 85%
ω (Н) = 12 m1(Н) / m (C6H12) х 100% = 12 х 1 г / 84 г/моль х 100% = 15%
Полезный совет
Задачи на нахождение массовой доли вещества после упаривания, разбавления, концентрирования, смешивания растворов решайте с помощью формул, полученных из определения массовой доли. Например, задачу на упаривание можно решить с помощью такой формулы
ω 2= m1 / (m – Dm) = (ω 1• m) / (m – Dm), где ω 2 – массовая доля вещества в упаренном растворе, Dm — разница между массами до нагревания и после.
Источники:
- как определить массовую долю вещества
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Способы выражения концентрации растворов
Существуют
различные способы выражения состава раствора. Наиболее часто используют
массовую долю растворённого вещества, молярную и нормальную
концентрацию.
Массовая доля растворённого вещества w(B) — это безразмерная величина, равная отношению массы растворённого вещества к общей массе раствора m:
w(B)= m(B) / m
Массовую долю растворённого вещества w(B) обычно выражают в долях единицы или в процентах. Например, массовая доля растворённого вещества — CaCl2
в воде равна 0,06 или 6%. Это означает,что в растворе хлорида кальция
массой 100 г содержится хлорид кальция массой 6 г и вода массой 94 г.
Пример
Сколько грамм сульфата натрия и воды нужно для приготовления 300 г 5% раствора?
Решение
m(Na2SO4) = w(Na2SO4) / 100 = (5300) / 100 = 15 г
где w(Na2SO4) — массовая доля в %,
m — масса раствора в г
m(H2O) = 300 г — 15 г = 285 г.
Таким образом, для приготовления 300 г 5% раствора сульфата натрия надо взять 15 г Na2SO4 и 285 г воды.
Молярная концентрация C(B) показывает, сколько моль растворённого вещества содержится в 1 литре раствора.
C(B) = n(B) / V = m(B) / (M(B)V),
где М(B) — молярная масса растворенного вещества г/моль.
Молярная концентрация измеряется в
моль/л и обозначается «M». Например, 2 MNaOH — двухмолярный раствор
гидроксида натрия. Один литр такого раствора содержит 2 моль вещества
или 80 г (M(NaOH) = 40 г/моль).
Пример
Какую массу хромата калия K2CrO4 нужно взять для приготовления 1,2 л 0,1 М раствора?
Решение M(K2CrO4) = C(K2CrO4)
V M(K2CrO4) = 0,1 моль/л 1,2 л 194 г/моль = 23,3 г.
Таким образом, для приготовления 1,2 л 0,1 М раствора нужно взять 23,3 г K2CrO4 и растворить в воде, а объём довести до 1,2 литра.
Концентрацию раствора можно выразить
количеством молей растворённого вещества в 1000 г растворителя. Такое
выражение концентрации называют моляльностью раствора.
Нормальность
раствора обозначает число грамм-эквивалентов данного вещества в одном
литре раствора или число миллиграмм-эквивалентов в одном миллилитре
раствора.
Грамм — эквивалентом вещества
называется количество граммов вещества, численно равное его
эквиваленту. Для сложных веществ — это количество вещества,
соответствующее прямо или косвенно при химических превращениях 1 грамму
водорода или 8 граммам кислорода.
Эоснования = Моснования / число замещаемых в реакции гидроксильных групп
Экислоты = Мкислоты / число замещаемых в реакции атомов водорода
Эсоли = Мсоли / произведение числа катионов на его заряд
Пример
Вычислите значение грамм-эквивалента (г-экв.) серной кислоты, гидроксида кальция и сульфата алюминия.
Э H2SO4 = М H2SO4 / 2 = 98 / 2 = 49 г
Э Ca(OH)2 = М Ca(OH)2 / 2 = 74 / 2 = 37 г
Э Al2(SO4)3 = М Al2(SO4)3 / (23) = 342 / 2= 57 г
Величины нормальности обозначают буквой «Н». Например, децинормальный раствор серной кислоты обозначают «0,1 Н раствор H2SO4«.
Так как нормальность может быть определена только для данной реакции,
то в разных реакциях величина нормальности одного и того же раствора
может оказаться неодинаковой. Так, одномолярный раствор H2SO4 будет однонормальным, когда он предназначается для реакции со щёлочью с образованием гидросульфата NaHSO4, и двухнормальным в реакции с образованием Na2SO4.
Пример
Рассчитайте молярность и нормальность 70%-ного раствора H2SO4 (r = 1,615 г/мл).
Решение
Для вычисления молярности и нормальности надо знать число граммов H2SO4 в 1 л раствора. 70% -ный раствор H2SO4 содержит 70 г H2SO4 в 100 г раствора. Это весовое количество раствора занимает объём
V = 100 / 1,615 = 61,92 мл
Следовательно, в 1 л раствора содержится 701000 / 61,92 = 1130,49 г H2SO4
Отсюда молярность данного раствора равна: 1130,49 / М (H2SO4) =1130,49 / 98 =11,53 M
Нормальность этого раствора (считая, что кислота используется в реакции в качестве двухосновной) равна 1130,49 / 49 =23,06 H
Пересчет концентраций растворов из одних единиц в другие
При пересчете процентной
концентрации в молярную и наоборот, необходимо помнить, что процентная
концентрация рассчитывается на определенную массу раствора, а молярная
и нормальная — на объем, поэтому для пересчета необходимо знать
плотность раствора. Если мы обозначим: с — процентная концентрация; M —
молярная концентрация; N — нормальная концентрация; э — эквивалентная
масса, r — плотность раствора; m — мольная масса, то формулы для пересчета из процентной концентрации будут следующими:
M = (cp 10) / m
N = (cp 10) / э
Этими же формулами можно воспользоваться, если нужно пересчитать нормальную или молярную концентрацию на процентную.
Пример 1
Какова молярная и нормальная концентрация 12%-ного раствора серной кислоты, плотность которого р = 1,08 г/см3?
Решение
Мольная масса серной кислоты равна 98. Следовательно,
m(H2SO4) = 98 и э(H2SO4) = 98 : 2 = 49.
Подставляя необходимые значения в формулы, получим:
а) Молярная концентрация 12% раствора серной кислоты равна
M = (121,08 10) / 98 = 1,32 M
б) Нормальная концентрация 12% раствора серной кислоты равна
N = (121,08 10) / 49 = 2,64 H.
Иногда в лабораторной практике
приходится пересчитывать молярную концентрацию в нормальную и наоборот.
Если эквивалентная масса вещества равна мольной массе (Например, для
HCl, KCl, KOH), то нормальная концентрация равна молярной концентрации.
Так, 1 н. раствор соляной кислоты будет одновременно 1 M раствором.
Однако для большинства соединений эквивалентная масса не равна мольной
и, следовательно, нормальная концентрация растворов этих веществ не
равна молярной концентрации.
Для пересчета из одной концентрации в другую можно использовать формулы:
M = (NЭ) / m
N = (Mm) / Э
Пример
Нормальная концентрация 1 М раствора серной кислоты N = (198) / 49 = 2 H.
Пример
Молярная концентрация 0,5 н. Na2CO3
M = (0,553) / 106 = 0,25 M.Упаривание, разбавление, концентрирование,
смешивание растворов
Имеется mг исходного раствора с массовой долей растворенного вещества w1 и плотностью r1.
Упаривание раствора
В результате упаривания исходного раствора его масса уменьшилась на Dm г. Определить массовую долю раствора после упаривания w2
Решение
Исходя из определения массовой доли, получим выражения для w1 и w2 (w2 > w1):
w1 = m1 / m
(где m1 — масса растворенного вещества в исходном растворе)
m1 = w1m
w2 = m1 / (m — Dm) = (w1m) / (m — Dm)
Пример
Упарили 60 г 5%-ного раствора сульфата меди до 50 г. Определите массовую долю соли в полученном растворе.
m = 60 г; Dm = 60 — 50 = 10 г; w1 = 5% (или 0,05)
w2 = (0,0560) / (60 — 10) = 3 / 50 = 0,06 (или 6%-ный)
Концентрирование раствора
Какую массу вещества (X г) надо
дополнительно растворить в исходном растворе, чтобы приготовить раствор
с массовой долей растворенного вещества w2?
Решение
Исходя из определения массовой доли, составим выражение для w1 и w2:
w1 = m1 / m2, (где m1 — масса вещества в исходном растворе).
m1 = w1m
w2 = (m1+x) / (m + x) = (w1m + x) / (m+x)
Решая полученное уравнение относительно х получаем:
w2m + w2 x = w1 m + x
w2m — w1 m = x — w2 x
(w2 — w1)
m = (1 — w2) x
x = ((w2 — w1)m) / (1 — w2)
Пример
Сколько граммов хлористого калия надо растворить в 90 г 8%-ного раствора этой соли, чтобы полученный раствор стал 10%-ным?
m = 90 г
w1 = 8% (или 0,08), w2 = 10% (или 0,1)
x = ((0,1 — 0,08) 90) / (1 — 0,1) = (0,02 90) / 0,9 = 2 г
Смешивание растворов с разными концентрациями
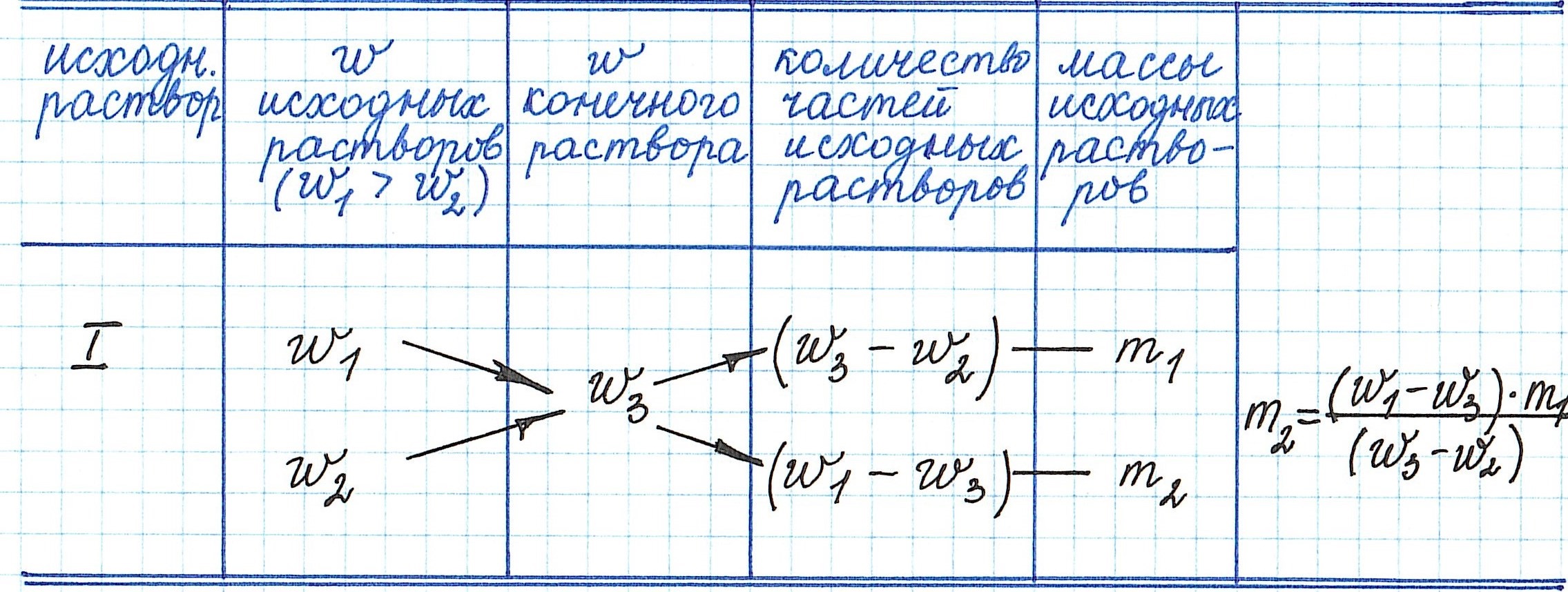
Смешали m1 граммов раствора №1 c массовой долей вещества w1 и m2 граммов раствора №2 c массовой долей вещества w2. Образовался раствор (№3) с массовой долей растворенного вещества w3. Как относятся друг к другу массы исходных растворов?
Решение
Пусть w1 > w2, тогда w1 > w3 > w2. Масса растворенного вещества в растворе №1 составляет w1
m1, в растворе №2 — w2 m2. Масса образовавшегося раствора (№3) — (m1 — m2). Сумма масс растворенного вещества в растворах №1 и №2 равна массе этого вещества в образовавшемся растворе (№3):
w 1m1 + w 2 m2 = w3 (m1 + m2)
w1m1 + w 2 m2 = w3 m1 + w3 m2
w 1m1 — w 3 m1 = w3 m2 — w2 m2
(w1— w3)m1 = (w3— w2) m2
m1 / m2 = (w3— w2 ) / (w1— w3)
Таким образом, массы смешиваемых растворов m1 и m2 обратно пропорциональны разностям массовых долей w1 и w2 смешиваемых растворов и массовой доли смеси w3. (Правило смешивания).
Для облегчения использования правила смешивания применяют правило креста :
| w1 | (w3 — w2) / |
m1 | |
| w3 | |||
| / w2 |
(w1 — w3) | m2 |
m1 / m2 = (w3 — w2) / (w1 — w3)
Для этого по диагонали из большего значения концентрации вычитают меньшую, получают (w1 — w3), w1 > w3 и (w3 — w2), w3 > w2. Затем составляют отношение масс исходных растворов m1 / m2 и вычисляют.
Пример
Определите массы исходных растворов
с массовыми долями гидроксида натрия 5% и 40%, если при их смешивании
образовался раствор массой 210 г с массовой долей гидроксида натрия 10%.
| 40% | 5% / |
m1 | |
| 10% | |||
| / 5% |
30% | m2=210-m1 |
5 / 30 = m1 / (210 — m1)
1/6 = m1 / (210 — m1)
210 — m1 = 6m1
7m1 = 210
m1 =30 г; m2 = 210 — m1 = 210 — 30 = 180 г
Разбавление раствора
Исходя из определения массовой доли,
получим выражения для значений массовых долей растворенного вещества в
исходном растворе №1 (w1) и полученном растворе №2 (w2):
w1 = m1 / (r1V1) откуда V1= m1 /( w1 r1)
w2 = m2 / (r2V2)
m2 = w2r2 V2
Раствор №2 получают, разбавляя раствор №1, поэтому m1 = m2. В формулу для V1 следует подставить выражение для m2. Тогда
V1= (w2r2 V2) / (w1 r1)
m2 = w2 • r2 • V2
или
| w1 • r1 • V1 | = | w2 • r2 • V2 |
| m1(раствор) | m2(раствор) |
m1(раствор) / m2(раствор) = w2 / w1
При одном и том же количестве растворенного вещества массы растворов и их массовые доли обратно пропорциональны друг другу.
Пример
Определите массу 3%-ного раствора пероксида водорода, который можно получить разбавлением водой 50 г его 3%-ного раствора.
m1(раствор) / m2(раствор) = w2 / w1
50 / x = 3 / 30
3x = 50
30 = 1500
x = 500 г
Последнюю задачу можно также решить, используя «правило креста»:
| 30% | 3% / |
50 | |
| 3% | |||
| / 0% |
27% | X |
3 / 27 = 50 / x
x = 450 г воды
450 г + 50 г = 500 г
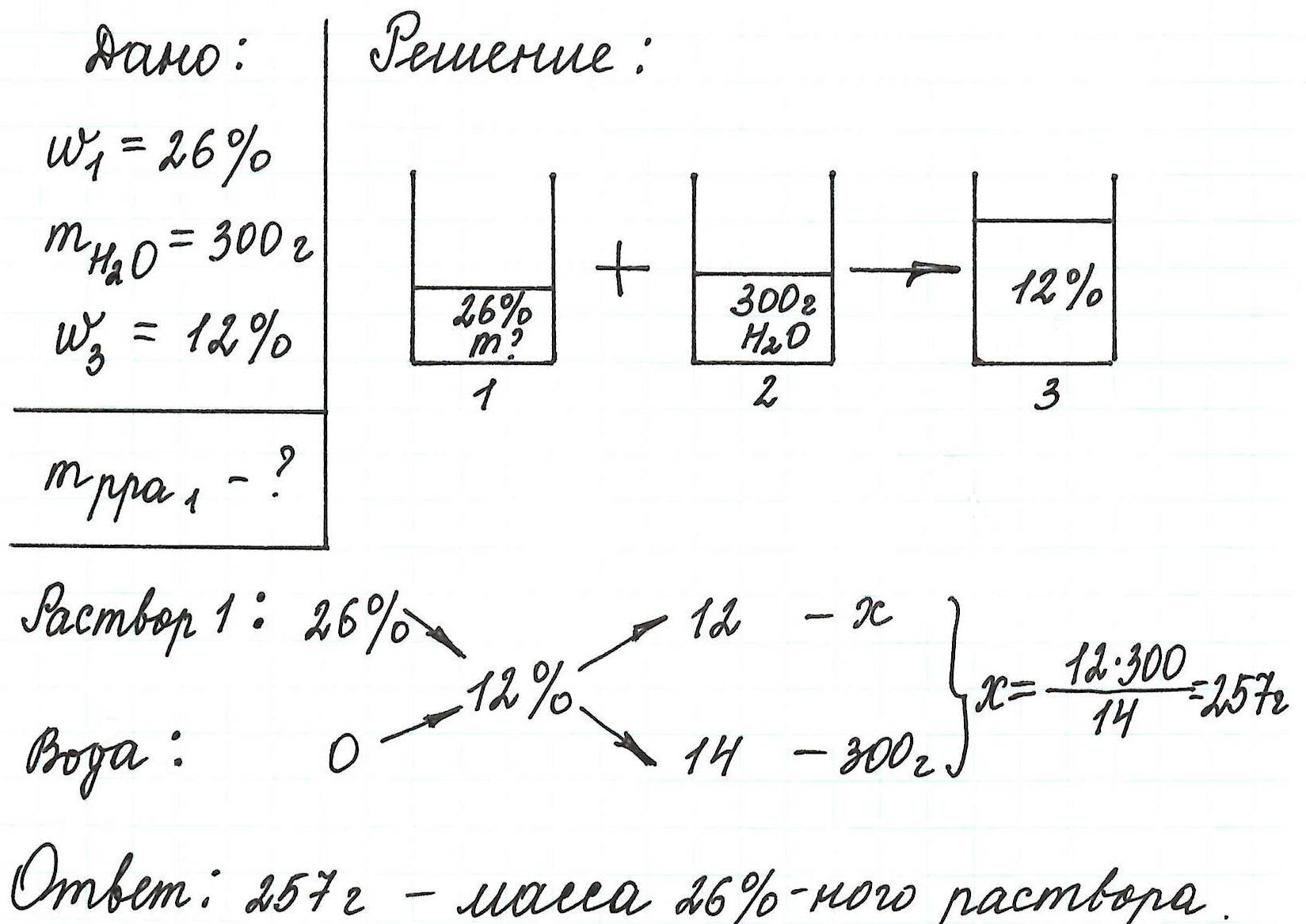
После упаривания 500 мл 10 %−ного раствора карбоната натрия (плотность 1,1 г/мл) его масса уменьшилась на 100 г. Какова массовая доля соли в полученном растворе?
reshalka.com
ГДЗ Химия 8 класс класс Габриелян. §22. Примените свои знания. Номер №9
Решение
Дано:
V (
N
a
2
C
O
3
) = 500 мл
ω = 10%
р = 1,1 г/мл
Δm (
N
a
2
C
O
3
) = 100 г
Найти:
ω
1
− ?
Решение:
Запишем формулу для нахождения новой массовой доли:
ω
1
= m(в−ва) : (m(р−ра) − m(воды)) * 100%
m(р−ра) = V * р = 500 мл * 1,1 г/мл = 550 г
m(в−ва) = m(р−ра) * ω = 550г * 0,1 = 55 г
ω
1
= 55 г : (550 г − 100 г) * 100% = 12,2%
Ответ: массовая доля соли в полученном растворе − 12,2 %.