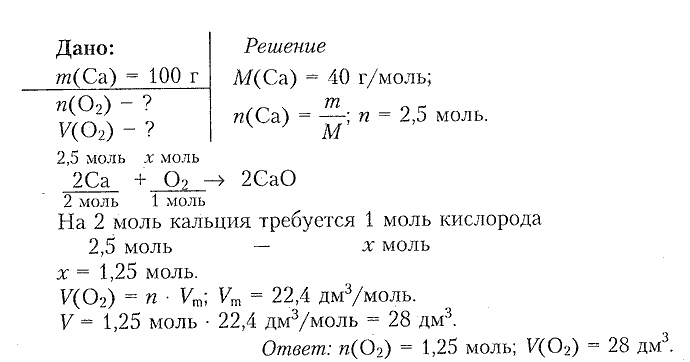CaCl2- хлорид кальция,
FeO — оксид железа (II),
Al2S3 — сульфид алюминия,
KI — иодид калия
w(X) = Ar(X) * a
Mr вещ-ва
CaCl2
Mr(СаСl2) = 40 + 35,5 *2 = 111
w(Cl) = 35,5 * 2 = 0,64 = 64 %
111
FeO
Mr(FeO) = 56 + 16 = 72
w(O) = 16*1 = 0,22 = 22 %
72
Al2S3
Mr(Al2S3) = 27 * 2 + 32 * 3 = 150
w(O) = 32*3 = 0,64 = 64 %
150
KI
Mr(KI) = 39 + 127 = 166
w(O) = 127 * 1 = 0,77 = 77 %
166
Как определить массовую долю неметалла в оксидах?
Спасибо заранее).
На этой странице вы найдете ответ на вопрос Как определить массовую долю неметалла в оксидах?. Вопрос
соответствует категории Химия и уровню подготовки учащихся 5 — 9 классов классов. Если ответ полностью не удовлетворяет критериям поиска, ниже можно
ознакомиться с вариантами ответов других посетителей страницы или обсудить с
ними интересующую тему. Здесь также можно воспользоваться «умным поиском»,
который покажет аналогичные вопросы в этой категории. Если ни один из
предложенных ответов не подходит, попробуйте самостоятельно сформулировать
вопрос иначе, нажав кнопку вверху страницы.
1. Из приведенного перечня простых веществ неметаллов выпишите в тетрадь вещества: а) молекулярного строения; б) немолекулярного строения: углерод (графит), углерод (алмаз), кислород, озон, азот, гелий, иод, кремний.
Простые вещества неметаллов молекулярного строения: кислород, озон, азот, гелий; иод. Простые вещества неметаллов немолекулярного строения: углерод (графит), углерод (алмаз), кремний.
2. В каких агрегатных состояниях могут находиться неметаллы в обычных условиях?
Неметаллы в обычных условиях могут находиться в газообразном состоянии, в виде жидкостей или в виде твердых веществ. Из 10 типичных неметаллов в обычных условиях половина — газообразные вещества.
3. Какие агрегатные состояния характерны для простых веществ VIIA-группы? Приведите примеры.
Агрегатные состояния простых веществ: фтор и хлор — газы, бром — жидкий, иод и астат — твёрдые.
4. Дайте определение понятия «аллотропия».
Существование элемента в виде нескольких простых веществ называют аллотропией.
5. Чем отличаются друг от друга аллотропные модификации одного и того же элемента: а) графит и алмаз; б) кислород и озон?
Аллотропные модификации одного и того же элемента отличаются по составу, строению молекул и различным свойствам, например алмаз и графит.
6. Рассчитайте химическое количество и объем (н. у.) кислорода, который потребуется для сжигания металлического кальция массой 100 г.
7. Назовите следующие соединения: $mathrm{CaCI_2,}$ $mathrm{FeO,}$ $mathrm{AI_2S_3,}$ $mathrm{KI.}$ Рассчитайте массовую долю неметалла в каждом из них.
- $mathrm{CaCI_2}$ — хлорид кальция;
- $mathrm{FeO}$ — оксид железа (II);
- $mathrm{AI_2S_3}$ — сульфид алюминия;
- $mathrm{KI}$ — иодид калия.
Расчёт массовых долей:
8. Определите степени окисления атомов в указанных бинарных соединениях. Назовите эти соединения: $mathrm{l_2O_5,}$ $mathrm{CS_2,}$ $mathrm{CaS,}$ $mathrm{PCI_5.}$
- $mathrm{l_2O_5}$ — оксид иода (V);
- $mathrm{CS_2}$ — сероуглерод;
- $mathrm{CaS}$ — сульфид кальция;
- $mathrm{PCI_5}$ — пентахлорид фосфора.
9. Запишите уравнение реакции хлора с иодидом натрия. Укажите окислитель и восстановитель. Определите массу иодида натрия, который вступит в реакцию с хлором объемом 11,2 дм$^3$ (н. у.).
Присоединяйтесь к Telegram-группе @superresheba_9,
делитесь своими решениями и пользуйтесь материалами, которые присылают другие участники группы!
Ответ:
Для расчета массовой доли неметаллов в соединении НBrO3 (бромат водорода) нужно определить молярные массы каждого элемента в соединении и использовать их для расчета массовых долей.
Молярные массы элементов:
Водород (H): 1 г/моль
Бром (Br): 79,9 г/моль
Кислород (O): 16 г/моль
Массовая доля неметаллов (брома и кислорода) в соединении вычисляется как сумма масс атомов брома и кислорода, деленная на молярную массу всего соединения, и умноженная на 100%:
Массовая доля брома:
Масса брома = молярная масса брома × количество атомов брома = 79,9 г/моль × 1 = 79,9 г
Массовая доля брома = (масса брома / молярная масса соединения) × 100% = (79,9 г / (1 г/моль + 79,9 г/моль + 3 × 16 г/моль)) × 100% ≈ 39,6%
Массовая доля кислорода:
Масса кислорода = молярная масса кислорода × количество атомов кислорода = 16 г/моль × 3 = 48 г
Массовая доля кислорода = (масса кислорода / молярная масса соединения) × 100% = (48 г / (1 г/моль + 79,9 г/моль + 3 × 16 г/моль)) × 100% ≈ 23,8%
Таким образом, массовая доля неметаллов (брома и кислорода) в соединении НBrO3 составляет примерно 39,6% брома и 23,8% кислорода.