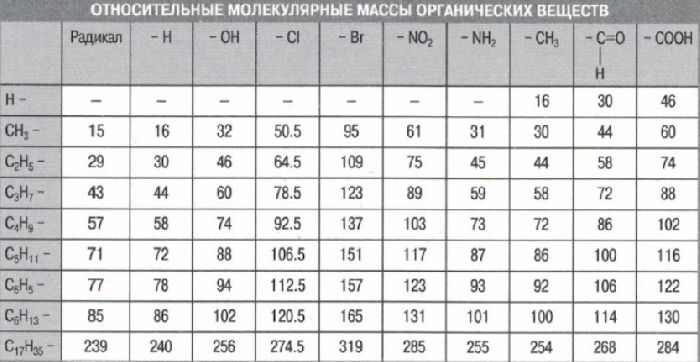
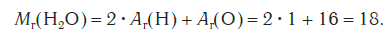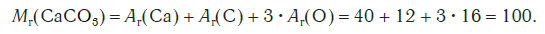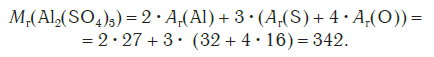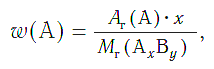Масса атома обозначается символом
ma
и может выражаться в единицах массы: килограммах или граммах.
Массы атомов малы. Так, масса атома водорода равна
ma(H)=1,67⋅10−24г
, а масса атома углерода —
ma(C)=19,94⋅10−24г
. Использовать такие числа неудобно, поэтому в химии применяется относительная атомная масса
Ar
.
Относительная атомная масса — это отношение массы атома к атомной единице массы.
В качестве атомной единицы массы (а. е. м.) выбрана (1/12) часть массы атома углерода. Эта единица обозначается буквой (u) (от английского «unit» — единица):
.
Относительная атомная масса — безразмерная величина, которая показывает, во сколько раз масса атома больше атомной единицы массы.
Относительные атомные массы химических элементов приведены в Периодической таблице. В расчётах обычно используют их значения, округлённые до целых.
Пример:
в Периодической таблице приведено значение относительной атомной массы магния — (24,305). Округлённое значение — (24). Значение атомной массы углерода — (12,011), а её округлённое значение — (12).
Исключение — относительная атомная масса хлора:
Ar(Cl)=
(35,5).
Значения относительных атомных масс некоторых элементов
| Элемент | H | He | Li | C | N | O | F | Ne | Na | Mg | Al | P | S | Cl | Ar | Ca | Fe | Cu | Zn |
|
Ar |
1 |
4 |
7 |
12 |
14 |
16 |
19 |
20 |
23 |
24 |
27 |
31 |
32 |
35,5 |
40 |
40 |
56 |
64 |
65 |
Относительная молекулярная масса
Mr
— это отношение массы молекулы или формульной единицы к атомной единице массы.
,
Относительная молекулярная масса показывает, во сколько раз масса молекулы или формульной единицы больше атомной единицы массы. Это тоже безразмерная величина. Она равна сумме относительных атомных масс всех химических элементов с учётом индексов в формуле вещества.
Пример:
относительная молекулярная масса углекислого газа:
.
Относительная молекулярная масса фосфата натрия:
.
Относительная молекулярная масса сульфата алюминия:
.
В уроке 7 «Относительная молекулярная и относительная формульная массы» из курса «Химия для чайников» научимся вычислять относительную молекулярную массу, а также относительную формульную массу веществ; кроме того, выясним что такое массовая доля и приведем формулу для ее вычисления. Напоминаю, что в прошлом уроке «Валентность» мы дадим определение валентности, научились ее определять; рассмотрели элементы с постоянной и переменной валентностью, кроме того научились составлять химические формулы по валентности.
Каждый химический элемент характеризуется определенным значением относительной атомной массы. Состав любого вещества выражается молекулярной или простейшей формулой его структурной единицы. Такая структурная единица состоит из определенного числа атомов химических элементов. Поэтому масса структурной единицы может быть выражена в атомных единицах массы.
Содержание
- Относительная молекулярная масса
- Относительная формульная масса
- Вычисление массовой доли химического элемента по формуле вещества
Относительная молекулярная масса
Вещества молекулярного строения характеризуются величиной относительной молекулярной массы, которая обозначается Mr.
Относительная молекулярная масса — это физическая величина, равная отношению массы одной молекулы вещества к 1/12 части массы атома углерода.
Эта величина равна сумме относительных атомных масс всех химических элементов с учетом числа их атомов в молекуле. Например, рассчитаем относительную молекулярную массу воды H2O:
Относительная молекулярная масса серной кислоты H2SO4:
Относительные молекулярные массы, как и относительные атомные массы, являются величинами безразмерными. Значение Мr показывает, во сколько раз масса молекулы данного вещества больше атомной единицы массы u. Например, если Mr(H2O) = 18, это значит, что масса молекулы H2O в 18 раз больше 1/12 части массы атома углерода, т. е. в 18 раз больше атомной единицы массы. Соответственно, масса молекулы H2SO4 в 98 раз больше 1/12 части массы атома углерода.
Относительная формульная масса
Вещества немолекулярного строения также характеризуются подобной величиной, которая называется относительной формульной массой. Как и относительная молекулярная масса, она равна сумме относительных атомных масс всех элементов, входящих в состав структурной единицы таких веществ — формульной единицы, и также обозначается Mr. При этом, конечно, необходимо учитывать индексы у символов атомов.
Например, относительная формульная масса вещества CaCO3 равна:
Относительная формульная масса вещества Al2(SO4)3 равна:
Относительная формульная масса показывает, во сколько раз масса формульной единицы данного вещества больше 1/12 части массы атома углерода, или атомной единицы массы u.
Вычисление массовой доли химического элемента по формуле вещества
По формуле вещества можно рассчитать массовую долю атомов каждого химического элемента, который входит в состав этого вещества, т. е. определить, какую часть от общей массы вещества составляет масса атомов данного элемента.
Массовая доля (w) атомов химического элемента в веществе показывает, какая часть относительной молекулярной (формульной) массы вещества приходится на атомы данного элемента.
Массовая доля атомов элемента А в сложном веществе АxBy рассчитывается по формуле:
где w («дубль-вэ») — массовая доля элемента А;
Ar(А) — относительная атомная масса элемента А;
х, у — числа атомов элементов А и В в формуле вещества;
Mr(АхBy) — относительная молекулярная (формульная) масса вещества АхBy.
Массовые доли выражаются в долях единицы или в процентах.
Пример. Определите массовые доли элементов в фосфорной кислоте H3PO4
Спойлер
[свернуть]
Краткие выводы урока:
- Относительная молекулярная (формульная) масса вещества — это физическая величина, равная отношению массы молекулы (формульной единицы) вещества к 1/12 части массы атома углерода.
- Эта величина равна сумме относительных атомных масс химических элементов, входящих в состав молекулы (формульной единицы) данного вещества, с учетом числа атомов каждого элемента.
Надеюсь урок 7 «Относительная молекулярная и относительная формульная массы» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Download Article
Download Article
The molecular mass, often called the molecular weight (MW), is the weight of all atoms in a given molecular formula. Molecular weight is measured in Atomic Mass Units, usually expressed as u or amu.[1]
In order to calculate the molecular weight of a formula, you’ll need to add up the atomic masses of each element present.
-
1
Count how many atoms of each element exist in the molecule. First, list each element present in the molecule. You may use the chemical symbol or write out the name of the element. Then, count the atoms according to the molecular formula and write them next to the element’s name or symbol.[2]
- For example, carbon dioxide or CO2, list that there is 1 carbon (C) and 2 oxygens (O) present in the molecule.
- For methane, CH4, list carbon (C) and hydrogen (H). Methane comprises 1 atom of carbon and 4 atoms of hydrogen.
- For glucose, C6H12O6, list carbon (C), hydrogen (H), and oxygen (O). Glucose comprises 6 atoms of carbon, 12 atoms of hydrogen, and 6 atoms of oxygen.
-
2
Find the relative atomic mass of each element in the molecule. Use a copy of the Periodic Table of Elements. The Periodic Table lists the atomic mass of each element below the chemical symbol. For example, oxygen has a relative atomic mass of 15.9994 amu.[3]
- For carbon dioxide (CO2), the relative atomic mass is 12.011 amu for carbon and 15.999 for oxygen.
- The atomic mass of an element is roughly equal to the summed mass of the protons and neutrons that it contains. Note that the relative atomic mass you find in the periodic table is scaled: it accounts for all of the isotopes of the element in the proportions that they naturally occur.[4]
Advertisement
-
3
Calculate the total mass for each element in the molecule. Multiply the atomic mass of each element by the number of atoms of that element: (Atomic Mass of Element) x (# of atoms of that element). Do this for each element in the molecule.[5]
- In our carbon dioxide example, the mass of the single carbon atom is 12.011 amu. Since there are 2 oxygen atoms, you would write
.
- In our carbon dioxide example, the mass of the single carbon atom is 12.011 amu. Since there are 2 oxygen atoms, you would write
-
4
Add up the mass of all the atoms to find the molecular weight. Molecular weight = ∑
(
(Atomic Mass of Element)n x (# of atoms of that element)n
)
[6]
- Round the answer as necessary, using significant digits.
- Remember to use the proper units. amu is the old abbreviation for atomic mass units, but the «most correct» modern unit is a lower-case u.[7]
- For carbon dioxide, the molecular weight can be found like so:
.
Advertisement
-
1
Find the molecular weight of methane (CH4). The atomic mass of hydrogen is 1.008 u. The atomic mass of carbon is 12.011 u.[8]
There are 4 hydrogen atoms in methane. Add together the weight of all the atoms in methane to find the molecular weight.[9]
-
2
Calculate the molecular weight of glucose (C6H12O6). The atomic mass of carbon is 12.011 u. The atomic mass of hydrogen is 1.008 u. The atomic mass of oxygen is 15.999[10]
There are 6 carbon atoms, 12 hydrogen atoms, and 6 oxygen atoms. Add up the mass of all of the atoms in glucose to calculate the molecular weight.
Advertisement
Add New Question
-
Question
What is the molecular mass of phosphorus?
The molecular mass of Phosphorus is 30.974 to 3 decimal places, commonly written as 31 on the periodic table.
-
Question
Why are the hydrogen bonds weak?
Hydrogen has a low electronegativity, and thus is easily taken out of bonds.
-
Question
What is the molecular weight of CO2?
Williamsm917
Community Answer
44.01 g/mol. C has a molecular mass of 12.01. O has a molecular mass of 16. Therefore, the formula would be 12.01 + 2(16), which gives you the molecular mass 44.01 g/mol.
See more answers
Ask a Question
200 characters left
Include your email address to get a message when this question is answered.
Submit
Advertisement
Video
-
Make sure that you follow the appropriate rules for significant figures as required.
Advertisement
References
About This Article
Article SummaryX
To calculate molecular weight, start by listing all elements present in the molecule. Then, count the atoms using the molecular formula. For example, use the formula CH4 for methane, which comprises 1 atom of carbon and 4 atoms of hydrogen. In a copy of the Periodic Table of Elements, find the relative atomic mass of each element in the molecule. Then, multiply the atomic mass of an element by the number of atoms of the element in the molecule. To complete the calculation, add up the mass of all of the atoms to get the molecular weight. If you want to learn the units to use when you label your calculations, keep reading the article!
Did this summary help you?
Thanks to all authors for creating a page that has been read 149,271 times.
Reader Success Stories
-
R. Gangadharan
Dec 21, 2018
«It is very useful to understand through this simple way.»
Did this article help you?
Как определить молекулярную массу
Определения молекулярной массы вещества – это довольно специфическое, но важное умение, которое требуется для качественного изучения курса химии или физики. Данная тема относится к одному из базовых школьных разделов, на которых строится умения решать расчетные задачи, причем как на контрольной или на самостоятельной работе, так и во время практических занятий. И даже если уже не придется заниматься собственным образованием, то полученные знания могут пригодиться для ответов на вопросы своих пытливых детей.
Вам понадобится
- Таблица Д.И. Менделеева, ручка, калькулятор
Инструкция
Если внимательно рассмотреть таблицу химических элементов Дмитрия Ивановича Менделеева, то можно увидеть, что она имеет вид многоквартирного многоэтажного дома, в котором находятся «жильцы» – химические элементы. Каждый из них имеет фамилию (название) и химический символ. Причем каждый из элементов живет в своей собственной квартире, а потому имеет порядковый номер. Эта информация представлена во всех клеточках таблицы.
Однако там стоит еще одна цифра, на первый взгляд совсем непонятная. Мало того, она указана с несколькими значениями после запятой, что делается для большей точности. Именно на это число и нужно обратить внимание, потому что это и есть относительная атомная масса. Причем эта характеристика – величина постоянная, которую не требуется запоминать и можно найти по таблице. Кстати даже на ЕГЭ по химии таблица Д.И. Менделеева является справочным материалом, доступным для использования, и у каждого лежит в индивидуальном пакете – КИМе.
Молекулярная масса, а точнее относительная молекулярная масса вещества обозначается буквами (Mr) складывается из относительных атомных масс (Ar), образующих молекулу, элементов. Относительная атомная масса – это как раз та, загадочная цифра, которая стоит в каждой клеточке таблицы. Для расчетов необходимо эти значения округлять до целого числа. Исключением является только атом хлора, у которого относительная атомная масса составляет 35,5. Единиц измерения эта характеристика не имеет.
Пример 1. Найдите молекулярную массу гидроксида калия (KOH)
Молекула гидроксида калия состоит из одного атома калия (К), одного атома кислорода (О) и одного атома водорода (Н). Следовательно, находим:
Mr (KOH) = Ar (К) + Ar (О) + Ar (Н)
По таблице Д.И. Менделеева находим значения относительных атомных масс элементов:
Ar (К) = 39, Ar (О) = 16, Ar (Н) = 1
Отсюда: Mr (KOH) = 39 + 16 + 1 = 56
Пример 2. Найдите молекулярную массу серной кислоты (H2SO4 аш-два-эс-о-четыре)
Молекула серной кислоты состоит из двух атомов водорода (Н), одного атома серы (S) и четырех атомов кислорода (О). Следовательно, находим:
Mr (H2SO4) = 2Ar (H) + Ar (S) + 4Ar (O)
По таблице Д.И. Менделеева находим значения относительных атомных масс элементов:
Ar (К) = 39, Ar (О) = 16, Ar (Н) = 1
Отсюда: Mr (H2SO4) = 2 х 2 + 32 + 4 х 16 = 98
Видео по теме
Обратите внимание
При расчетах сначала выполняется умножение или деление, а только потом сложение или вычитание
Полезный совет
При определении относительной атомной массы округляйте значения, которые находятся в таблице Д.И. Менделеева до целого числа
Источники:
- как вычислить молекулярную массу
- Молекулярной массы определение
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Относительная молекулярная масса

4.3
Средняя оценка: 4.3
Всего получено оценок: 763.
4.3
Средняя оценка: 4.3
Всего получено оценок: 763.
В химии чрезвычайно важным является понятие «молекулярная масса». Молекулярную массу часто путают с молярной массой. Чем отличаются эти величины, и какими свойствами обладают?
Молекулярная масса
Атомы и молекулы – мельчайшие частицы любых химических вещества. Если постараться выразить их массу в граммах, то получится число, в котором перед запятой будет находиться около 20 нулей. Поэтому измерять массу в таких единицах, как граммы, неудобно. Чтобы выйти из этой ситуации, следует какую-нибудь очень малую массу принять за единицу, а все остальные массы выражать по отношению к ней. В качестве этой единицы используют 1/12 массы атома углерода.
Относительна молекулярная масса – это масса молекулы вещества, которую измеряют в атомных единицах массы. Молекулярная масса равна отношению массы молекулы того или иного вещества к 1/12 части массы атома углерода. Она показывает, во сколько раз масса молекулы определенного вещества больше 1/12 массы атома углерода.
Атомная единица массы (а. е. м.) равна 1,66*10 в -24 степени и представляет собой 1/12 часть массы атома углерода, то есть атома изотопа элемента углерода массовое число которого равно 12. Химический элемент в природе может иметь несколько устойчивых изотопов, поэтому, когда говорят об относительной атомной массе элемента или, как часто говорят, об атомной массе элемента A, то обязательно учитывают атомную массу всех устойчивых нуклидов.
Молекулярную массу часто путают с молярной массой, единицей измерения которой является г/моль. И действительно численно эти две величины абсолютно идентичны, однако размерность у них абсолютно разная.
Относительную молекулярную массу можно найти, сложив между собой атомные массы
Чтобы вычислить молекулярную массу простых и сложных веществ, необходимо найти сумму относительных атомных масс атомов, входящих в состав молекулы. Например, относительная молекулярная масса воды Mr (H2O), которая состоит, как известно, из двух атомов водорода и одного атома кислорода, равна 1*2+16=18.
Это означает, что масса молекулы воды в 18 раз больше 1/12 массы атома углерода. А молекулярная масса воздуха равна 29.
Атомная масса
Атомная масса химического элемента – также одно из важнейших обозначений в химии. Атомная масса – это средняя величина из атомных масс устойчивых природных изотопов этого элемента с учетом их относительного содержания в природе (их природного распространения). Так, в природе существуют два устойчивых изотопа элемента хлора Cl с массовыми числами 35 и 37:
Ar(Cl)=(34.97*0.7553)+(36.95*0.2447)=35.45 – именно такая величина принята для элемента хлора в качестве его относительной атомной массы.
Впервые вычисление атомных весов были сделаны Д. Дальтоном. Атомные веса элементов он относил к атомному весу водорода, приняв его за единицу. Однако вычисленные в соответствии с его принципом «наибольшей простоты» вес атома кислорода и некоторых других элементов оказались неверными.
Истинные атомные массы являются мизерными. Атом водорода весит 1,674*10 в -24 степени грамм, кислорода 26,67*10 в -24 степени грамм, а углерода 19,993*10 в -24 степени грамм.
Что мы узнали?
В школьной программе по химии (8 класс) большое внимание уделяется таким понятием, как относительная атомная и молекулярная масса вещества. Учащиеся изучают их отличия и особенности, а также учатся определять массы газов и веществ.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Жале Гаджибекова
10/10
-
Александр Котков
10/10
-
Мерьем Рифатова
9/10
-
Наталья Моя
8/10
-
Александр Котков
10/10
-
Александр Котков
10/10
-
Сергей Макаров
10/10
-
Анастасия Ватанина
9/10
Оценка доклада
4.3
Средняя оценка: 4.3
Всего получено оценок: 763.
А какая ваша оценка?