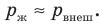Как твердые тела переходят в жидкое состояние посредством плавления, так и жидкости переходят в газообразное состояние посредством парообразования. Для осуществления этого процесса, жидкости необходимо сообщить определенное количество теплоты. Рассчитать эту энергию мы можем, используя такую величину, как удельная теплота парообразования.
На данном уроке вы познакомитесь с подробным решением задач на парообразование и конденсацию. Ниже приведены формулы из пройденных уроков, которые мы будем использовать:
- $Q = Lm$
- $Q = cm(t_2 — t_1)$
- $Q = qm$
- $Q = lambda m$
- $eta = frac{A_п}{A_з}$
Табличные значения величин, которые вам понадобятся:
- Удельная теплота парообразования
- Удельная теплоемкость
- Удельная теплота плавления
- Удельная теплота сгорания
Задача №1
Какое количество теплоты требуется для обращения в пар воды массой $0.2 space кг$ при температуре $100 degree C$?
Дано:
$m = 0.2 space кг$
$t = 100 degree C$
$L = 2.3 cdot 10^6 frac{Дж}{кг}$
$Q — ?$
Показать решение и ответ
Скрыть
Решение:
Температура, равная $100 degree C$ — это температура кипения воды. Значит, мы можем использовать формулу для расчета количества теплоты, необходимого для превращения жидкости в пар:
$Q = Lm$.
Рассчитаем:
$Q = 2.3 cdot 10^6 frac{Дж}{кг} cdot 0.2 space кг = 0.46 cdot 10^6 space Дж = 460 space кДж$.
Ответ: $Q = 460 space кДж$.
Задача №2
Какое количество энергии необходимо, чтобы $5 space л$ воды при $0 degree C$ довести до кипения и затем ее всю испарить?
Дано:
$V = 5 space л$
$t_1 = 0 degree C$
$t_2 = 100 degree C$
$L = 2.3 cdot 10^6 frac{Дж}{кг}$
$c = 4200 frac{Дж}{кг cdot degree C}$
$rho = 1000 frac{кг}{м^3}$
СИ:
$5 cdot 10^{-3} space м^3$
$Q — ?$
Показать решение и ответ
Скрыть
Решение:
Чтобы довести воду до кипения и испарить ее, нам нужно затратить некоторое количество теплоты на ее нагревание и некоторое количество теплоты на парообразование: $Q = Q_1 + Q_2$.
Изначально нам потребуется сообщить воде количество теплоты, необходимое для ее нагревания от $0 degree C$ до ее температуры кипения $100 degree C$. Это количество теплоты будет равно:
$Q_1 = cm(t_2 — t_1)$.
Выразим массу воды через плотность и объем и подставим в формулу:
$m = rho V$,
$Q_1 = c rho V(t_2 — t_1)$.
Рассчитаем:
$Q_1 = 4200 frac{Дж}{кг cdot degree C} cdot 1000 frac{кг}{м^3} cdot 5 cdot 10^{-3} space м^3 cdot (100 degree C — 0 degree C) = 21 space 000 frac{Дж}{degree C} cdot 100 degree C = 2.1 cdot 10^6 space = 2.1 space МДж$.
Теперь рассчитаем количество теплоты, которое необходимо сообщить жидкости, взятой при температуре кипения, для парообразования:
$Q_2 = Lm = L rho V$.
Рассчитаем эту энергию:
$Q_2 = 2.3 cdot 10^6 frac{Дж}{кг} cdot 1000 frac{кг}{м^3} cdot 5 cdot 10^{-3} space м^3 = 11.5 cdot 10^6 space Дж = 11.5 space МДж$.
Теперь мы можем рассчитать всю понадобившуюся энергию:
$Q = Q_1 +Q_2 = 2.1 space МДж + 11.5 space МДж = 13.6 space МДж$.
Ответ: $Q = 13.6 space МДж$.
Задача №3
Сколько теплоты выделится при конденсации $100 space г$ водяного пара, имеющего температуру $100 degree C$, и при охлаждении полученной воды до $20 degree C$?
Дано:
$m = 100 space г$
$t_1 = 100 degree C$
$t_2 = 20 degree C$
$L = 2.3 cdot 10^6 frac{Дж}{кг}$
$c = 4200 frac{Дж}{кг cdot degree C}$
СИ:
$m = 0.1 space кг$
$Q — ?$
Показать решение и ответ
Скрыть
Решение:
Общее количество теплоты будет складываться из энергии, которая выделится при конденсации (превращения пара в жидкость), и энергии, которая выделится при остывании жидкости: $Q = Q_1 + Q_2$.
Сначала рассчитаем количество теплоты, выделившееся при конденсации:
$Q_1 = Lm$,
$Q_1 = 2.3 cdot 10^6 frac{Дж}{кг} cdot 0.1 space кг = 0.23 cdot 10^6 space Дж = 230 space кДж$.
Теперь рассчитаем количество теплоты, которое выделится при охлаждении воды от $100 degree C$ до $20 degree C$. В задаче нужно затратить какую-то энергию, нам важно численное значение энергии, а не ее знак — ведь мы и так знаем, что энергия будет выделяться, а не поглощаться. Поэтому мы можем записать разницу температур как $t_1 — t_2$, чтобы избавиться от знака “минус”:
$Q_2 = cm(t_1 — t_2)$,
$Q_2 = 4200 frac{Дж}{кг cdot degree C} cdot 0.1 space кг cdot (100 degree C — 20 degree C) = 420 frac{Дж}{degree C} cdot 80 degree C = 33 space 600 space Дж = 33.6 space кДж$.
Определим общее выделившееся количество теплоты:
$Q = Q_1 + + Q_2 = 230 space кДж + 33.6 space кДж = 263.6 space кДж$.
Ответ: $Q = 263.6 space кДж$.
Задача №4
В сосуд, содержащий $30 space кг$ воды при $0 degree C$, вводится $1.85 space кг$ водяного пара, имеющего температуру $100 degree C$, вследствие чего температура воды становится равной $37 degree C$. Найдите удельную теплоту парообразования воды.
Дано:
$m_1 = 30 space кг$
$t_1 = 0 degree C$
$m_2 = 1.85 space кг$
$t_2 = 100 degree C$
$t = 37 degree C$
$c = 4200 frac{Дж}{кг cdot degree C}$
$L — ?$
Показать решение и ответ
Скрыть
Решение:
Когда в сосуд с водой одной температуры добавили пар с другой температурой, между этими двумя телами начинается теплообмен. Пар сначала конденсируется с выделением энергии и уже в виде воды будет охлаждаться также с выделением энергии. Эта энергия будет идти на нагревание воды.
Значит, мы можем записать следующее:
$Q_1 = Q_{2кон} + Q_2$,
где $Q_1$ — это количество энергии, необходимое для нагревания воды, $Q_{2кон}$ — количество теплоты, выделившееся при конденсации пара, $Q_2$ — количество теплоты, выделившееся при охлаждении сконденсированного пара в виде воды.
Удельная теплота парообразования, которую мы ищем, связана с величиной $Q_{2кон}$, которая по определению равна:
$Q_{2кон} = Lm_2$
Подставим в формулу для теплообмена между водой и паром:
$Q_1 = Lm_2 + Q_2$.
Выразим отсюда удельную теплоту парообразования:
$Lm = Q_1 — Q_2$,
$L = frac{Q_1 — Q_2}{m_2}$.
Рассчитаем количество теплоты, которое потребовалось на нагревание воды от $0 degree C$ до $37 degree$:
$Q_1 = cm_1(t — t_1)$,
$Q_1 = 4200 frac{Дж}{кг cdot degree C} cdot 30 space кг cdot (37 degree C — 0 degree C) = 126 space 000 frac{Дж}{degree C} cdot 37 degree C = 4662 cdot 10^3 space Дж$.
Теперь рассчитаем количество теплоты, которое выделилось при охлаждении воды (сконденсированного пара) от $100 degree C$ до $37 degree C$. Обратите внимание, что, составляя уравнение для энергообмена, мы уже учли, какая энергия выделяется, а какая — потребляется. Поэтому разница температур здесь запишется как $(t_2 — t)$, ведь знак “минус” мы уже учли выше.
$Q_2 = cm_2 (t_2 — t)$,
$Q_2 = 4200 frac{Дж}{кг cdot degree C} cdot 1.85 space кг cdot (100 degree C — 37 degree C) = 7770 frac{Дж}{degree C} cdot 63 degree C = 489 space 510 space Дж approx 490 cdot 10^3 space Дж$.
Теперь мы можем рассчитать удельную теплоту парообразования воды:
$L = frac{4662 cdot 10^3 space Дж — 490 cdot 10^3 space Дж}{1.85 space кг} approx 2255 cdot 10^3 frac{Дж}{кг} approx 2.3 cdot 10^6 frac{Дж}{кг}$.
Полученное значение удельной теплоты парообразования воды совпадает с табличным. Значит, расчеты выполнены верно.
Ответ: $L approx 2.3 cdot 10^6 frac{Дж}{кг}$.
Задача №5
Используя график зависимости количества теплоты, необходимого для перевода жидкости при температуре кипения в газообразное состояние, от массы (рисунок 1), определите для какой жидкости построен график, и вычислите количество теплоты, выделяющееся при конденсации пара этой жидкости массой $8 space кг$.
Для того, чтоб определить вид жидкости, нам нужно будет рассчитать ее удельную теплоту парообразования и сравнить с табличными данными.
Для этого из графика (рисунок 1) нам нужно взять какое-то значение количества теплоты и массы. Выберем удобные для нас и точные значения: при массе $2.5 space кг$ этой жидкости необходимо сообщить энергию в $1 space МДж$, чтобы превратить ее в пар.
Дано:
$Q_1 = 1 cdot МДж$
$m_1 = 2.5 space кг$
$m = 8 space кг$
СИ:
$Q_1 = 1 cdot 10^6 space Дж$
$L — ?$
$Q — ?$
Показать решение и ответ
Скрыть
Решение:
Используя данные графика, рассчитаем удельную теплоту парообразования:
$Q = Lm$,
$L = frac{Q}{m} = frac{1 cdot 10^6 space Дж}{2.5 space кг} = 0.4 cdot 10^6 frac{Дж}{кг}$.
Полученное значение удельной теплоты парообразования соответствует эфиру.
Вычислим, какое количество теплоты выделится при конденсации паров эфира массой $8 space кг$:
$Q = Lm$.
$Q = 0.4 cdot 10^6 frac{Дж}{кг} cdot 8 space кг = 3.2 cdot 10^6 space Дж = 3.2 space МДж$.
Ответ: эфир, $Q = 3.2 space МДж$.
Задача №6
Какое количество теплоты необходимо, чтобы превратить $1 space кг$ льда при $0 degree C$ в пар при $100 degree C$?
Дано:
$m = 1 space кг$
$t_1 = 0 degree C$
$t_2 = 100 degree C$
$lambda = 3.4 cdot 10^5 frac{Дж}{кг}$
$L = 2.3 cdot 10^6 frac{Дж}{кг}$
$c = 4200 frac{Дж}{кг cdot degree C}$
$Q — ?$
Показать решение и ответ
Скрыть
Решение:
Для того чтобы превратить лед в пар, сначала нам нужно его расплавить, затем нагреть получившуюся воду до температуры кипения и только потом сообщить еще какое-то количество теплоты, чтобы произошло парообразование: $Q = Q_1 + Q_2 + Q_3$.
Рассчитаем количество теплоты, которое необходимо сообщить льду, чтобы полностью расплавить его:
$Q_1 = lambda m$,
$Q_1 = 3.4 cdot 10^5 frac{Дж}{кг} cdot 1 space кг = 3.4 cdot 10^5 space Дж$.
Рассчитаем количество теплоты, которое необходимо сообщить воде, чтобы нагреть ее от $0 degree C$ до $100 degree C$:
$Q_2 = cm(t_2 — t_1)$,
$Q_2 = 4200 frac{Дж}{кг cdot degree C} cdot 1 space кг cdot (100 degree C — 0 degree C) = 4.2 cdot 10^5 space Дж$.
Рассчитаем количество теплоты, которое надо сообщить воде, чтобы полностью превратить ее в пар:
$Q_3 = Lm$,
$Q_3 = 2.3 cdot 10^6 frac{Дж}{кг} cdot 1 space кг = 23 cdot 10^5 space Дж$.
Просуммируем полученные энергии, чтобы узнать общее количество теплоты, которое потребовалось, чтобы превратить лед в пар:
$Q = Q_1 + Q_2 + Q_3 = 3.4 cdot 10^5 space Дж + 4.2 cdot 10^5 space Дж + 23 cdot 10^5 space Дж = 30.6 cdot 10^5 space Дж = 3060 space кДж$.
Ответ: $Q = 3060 space кДж$.
Задача №7
Какое количество пара при температуре $100 degree C$ требуется обратить в воду, чтобы нагреть железный радиатор массой $10 space кг$ от $10 degree C$ до $90 degree C$?
Дано:
$t = 100 degree C$
$L = 2.3 cdot 10^6 frac{Дж}{кг}$
$m_1 = 10 space кг$
$t_1 = 10 degree C$
$t_2 = 90 degree C$
$c = 460 frac{Дж}{кг cdot degree C}$
$m — ?$
Показать решение и ответ
Скрыть
Решение:
Рассчитаем количество теплоты, необходимое для нагревания железного радиатора:
$Q = cm_1 (t_2 — t_1)$,
$Q = 460 frac{Дж}{кг cdot degree C} cdot 10 space кг cdot (90 degree C — 10 degree C) = 4600 frac{Дж}{degree C} cdot 80 degree C = 368 space 000 Дж = 0,368 cdot 10^6 space Дж$.
Это же количество теплоты должно выделится при конденсации некоторой массы пара:
$Q = Lm$.
Выразими отсюда массу пара и рассчитаем ее:
$m = frac{Q}{L}$,
$m = frac{0,368 cdot 10^6 space Дж}{2.3 cdot 10^6 frac{Дж}{кг}} = 0.16 space кг = 160 space г$.
Ответ: $m = 160 space г$.
Воду, имеющую температуру $10 degree C$, нагревают до $90 degree C$, пропуская через нее водяной пар, температура которого $100 degree C$. Во сколько раз увеличится масса воды? Потерями теплоты пренебречь.
Дано:
$t_в = 10 degree C$
$t = 90 degree C$
$t_п = 100 degree C$
$L = 2.3 cdot 10^6 frac{Дж}{кг}$
$c = 4200 frac{Дж}{кг cdot degree C}$
$frac{m_в + m_п}{m_в} — ?$
Показать решение и ответ
Скрыть
Решение:
Водяной пар будет конденсироваться и выделять энергию. Эта энергия пойдет на нагревание воды.
При этом сконденсированный водяной пар в виде жидкости остается там же, смешиваясь с изначальной водой. В итоге, масса воды будет увеличиваться:
$m = m_в + m_п$.
Обратите внимание, что после того, как пар превратится в жидкость, ее температура все еще будет равна $100 degree C$. Она будет охлаждаться, передавая энергию изначальной массе воды для ее нагревания.
Итак, энергия выделившаяся при конденсации пара и дальнейшем охлаждении жидкости пойдет на нагревание изначальной массы воды. Тогда уравнение для теплообмена, происходящего между водой и паром можно записать в следующем виде:
$Q_1 + Q_2 = Q_3$.
Энергия, выделившаяся при конденсации пара:
$Q_1 = Lm_п$.
Энергия, выделившаяся при остывании воды:
$Q_2 = cm_п (t_п — t)$.
Энергия, которую необходимо затратить на нагревание изначальной массы воды:
$Q_3 = cm_в (t — t_в)$.
Обратите внимание, что, составляя уравнение для теплообмена, мы уже учли, какая энергия выделяется, а какая — потребляется. Поэтому разница температур здесь запишется как $t_в — t$, ведь знак “минус” мы уже учли выше.
Подставим эти в формулы в уравнение теплообмена:
$Lm_п + cm_п (t_п — t) = cm_в (t — t_в)$.
Отделим множители $m_п$ и $m_в$:
$m_п (L + c(t_п — t)) = cm_в (t — t_в)$,
$frac{m_п}{m_в} cdot (L + c(t_п — t)) = c(t — t_в)$,
$frac{m_п}{m_в} = frac{c(t — t_в)}{L + c(t_п — t)}$.
Теперь используем простой математический прием. Добавим единицу к левой и правой части нашего уравнения:
$1 + frac{m_п}{m_в} = 1 + frac{c(t — t_в)}{L + c(t_п — t)}$.
Выполним сложение в левой части уравнения:
$frac{m_в + m_п}{m_в} = 1 + frac{c(t — t_в)}{L + c(t_п — t)}$.
У нас получилось соотношение, которое показывает во сколько раз увеличилась масса воды. Рассчитаем его:
$frac{m_в + m_п}{m_в} = 1 + frac{4200 frac{Дж}{кг cdot degree C} cdot (100 degree C — 90 degree C)}{2.3 cdot 10^6 frac{Дж}{кг} + 4200 frac{Дж}{кг cdot degree C} cdot (100 degree C — 90 degree C)} = 1+ frac{42 cdot 10^3 frac{Дж}{кг}}{2.3 cdot 10^6 frac{Дж}{кг} + 0.042 cdot 10^6 frac{Дж}{кг}} = 1 + frac{42 cdot 10^3 frac{Дж}{кг}}{2.342 cdot 10^6 frac{Дж}{кг}} approx 1 + 0.02 approx 1.2$.
Т.е. масса воды после нагревания ее паром, увеличилась в 1.2 раза.
Ответ: $frac{m_в + m_п}{m_в} approx 1.2$.
Задача №9
В калориметр, содержащий воду при температуре кипения, бросили медный шар массой $0.5 space кг$ с температурой $500 degree C$. Вычислите массу испарившейся воды. Теплоемкостью калориметра пренебречь.
Дано:
$m = 0.5 space кг$
$t_1 = 500 degree C$
$t_2 = 100 degree C$
$L = 2.3 cdot 10^6 frac{Дж}{кг}$
$c = 400 frac{Дж}{кг cdot degree C}$
$m_1 — ?$
Показать решение и ответ
Скрыть
Решение:
Когда медный шар бросили в воду, между этими телами начался теплообмен. Медный шар начал охлаждаться и выделять энергию, которая пошла парообразование воды. Теплообмен прекратится, когда температура медного шара и воды выровняется — станет равна $100 degree C$. Обратите внимание, что парообразование тоже прекратится, так как воде перестанет сообщаться энергия.
Рассчитаем количество теплоты, которое выделится при остывании медного шара с $500 degree C$ до $100 degree$. При этом мы уже учли, какая энергия выделяется, а какая — потребляется. Поэтому разница температур здесь запишется как $t_1 — t_2$, ведь знак “минус” мы уже учли выше.
$Q = cm(t_1 — t_2)$,
$Q = 400 frac{Дж}{кг cdot degree C} cdot 0.5 space кг cdot (500 degree C — 100 degree C) = 200 frac{Дж}{degree C} cdot 400 degree C = 8 cdot 10^4 space Дж$.
Эта энергия будет израсходована на парообразование определенной массы воды:
$Q = Lm_1$.
Выразим отсюда массу испарившейся воды и рассчитаем ее:
$m_1 = frac{Q}{L}$,
$m_1 = frac{8 cdot 10^4 space Дж}{2.3 cdot 10^6 frac{Дж}{кг}} approx 0.035 space кг approx 35 space г$.
Ответ: $m_1 approx 35 space г$.
Задача №10
На примусе в медном чайнике массой $0.2 space кг$ вскипятили воду массой $1 space кг$, взятую при температуре $20 degree C$. В процессе кипячения $50 space г$ воды выкипело. Сколько в примусе сгорело бензина, если КПД примуса $30 %$?
Дано:
$m_ч = 0.2 space кг$
$m_в = 1 space кг$
$t_1 = 20 degree C$
$t_2 = 100 degree C$
$m_3 = 50 space г$
$eta = 30 % = 0.3$
$L = 2.3 cdot 10^6 frac{Дж}{кг}$
$c_ч = 400 frac{Дж}{кг cdot degree C}$
$c_в = 4200 frac{Дж}{кг cdot degree C}$
$q = 4.6 cdot 10^7 frac{Дж}{кг}$
СИ:
$m_3 = 0.05 space кг$
$m_б — ?$
Показать решение и ответ
Скрыть
Решение:
Из условий задачи ясно, что температура воды и чайника изначально была одинаковой. Потом чайник и воду стали нагревать до температуры кипения воды. Какое-то время после этого этим телам сообщалось еще какое-то количество теплоты, которое пошло на парообразование воды:
$Q = Q_1 + Q_2 + Q_3$.
Рассчитаем количество теплоты, которое необходимо сообщить медному чайнику, чтобы нагреть его:
$Q_1 = c_ч m_ч (t_2 — t_1)$,
$Q_1 = 400 frac{Дж}{кг cdot degree C} cdot 0.2 space кг cdot (100 degree C — 20 degree C) = 80 frac{Дж}{degree C} cdot 80 degree C = 6400 space Дж$.
Рассчитаем количество теплоты, которое необходимо сообщить воде, чтобы нагреть ее до температуры кипения:
$Q_2 = c_в m_в (t_2 — t_1)$,
$Q_2 = 4200 frac{Дж}{кг cdot degree C} cdot 1 space кг cdot (100 degree C — 20 degree C) = 4200 frac{Дж}{degree C} cdot 80 degree C = 336 space 000 space Дж$.
Рассчитаем количество теплоты, необходимое для превращения воды в пар:
$Q_3 = Lm_3$,
$Q_3 = 2.3 cdot 10^6 frac{Дж}{кг} cdot 0.05 space кг = 115 space 000 space Дж$.
Рассчитаем общее потребовавшееся количество теплоты:
$Q = Q_1 + Q_2 + Q_3 = 6400 space Дж + 336 space 000 space Дж + 115 space 000 space Дж = 457 space 400 Дж$.
Запишем формулу КПД для примуса:
$eta = frac{A_п}{A_з} = frac{Q}{Q_б}$.
Выразим отсюда количество теплоты, которое было выделено при сжигании спирта:
$Q_б = frac{Q}{eta}$.
С другой стороны, количество бензина, выделившееся при сгорании топлива, вычисляется по формуле:
$Q_б = qm_б$.
Подставим это выражение в формулу выше:
$qm_б = frac{Q}{eta}$.
Выразим отсюда массу сгоревшего бензина и рассчитаем ее:
$m_б = frac{Q}{eta cdot q}$,
$m_б = frac{457 space 400 Дж}{0.3 cdot 4.6 cdot 10^7 frac{Дж}{кг}} = frac{0.4574 cdot 10^6 space Дж}{1.38 cdot 10^6 frac{Дж}{кг}} approx 0.33 space кг approx 33 space г$.
Ответ: $m_б approx 33 space г$.
Сергей Феликсович Савельев
Эксперт по предмету «Физика»
Задать вопрос автору статьи
Конденсацию делят на происходящую:
- в объеме;
- на поверхности.
Переход газа в жидкость
Допустим, что у нас имеется некоторая масса пара. При постоянном давлении будем понижать температуру этого пара. Температуру опусти ниже точки росы. При таких условиях должна образовываться смесь, состоящая из двух фаз, компонентами которой являются:
- жидкость,
- насыщенный пар.
Однако эмпирически установлено, что возникновение капель жидкости возможно только в случае присутствия в газе центров конденсации. Такими центрами конденсации становятся:
- пылинки;
- ионы газов;
- шероховатости поверхностей твердых тел и др.
Определение 1
Превращение газообразного вещества в жидкость (реже в твердое вещество) называют конденсацией.
Сдай на права пока
учишься в ВУЗе
Вся теория в удобном приложении. Выбери инструктора и начни заниматься!
Получить скидку 3 000 ₽
Для паров, которые не контактируют ни с жидкостью, ни твердыми веществами способными к адсорбции, основным условием возникновения процесса конденсации является наличие центров конденсации.
Замечание 1
При отсутствии центров конденсации, процесс конденсации может начинаться в местах изменения (флуктуации) плотности пара.
Процесс конденсации является обратным к процессу испарения. При равенстве количества молекул, которые уходят из жидкости в пар, количеству молекул, возвращающихся из пара в жидкость говорят о состоянии динамического равновесия.
Температура называется критической, если она является максимальной и ниже нее возникает процесс конденсации.
Конденсация возможна из насыщенного и ненасыщенного пара.
Насыщенный пар
Определение 2
Пар, который находится в равновесии со своей жидкостью, называют насыщенным.
«Конденсация, формулы конденсации» 👇
Теперь рассмотрим процесс сжатия паров воды или эфира.
На первом этапе давление газа будет увеличиваться. Данный рост давления будет идти до тех пор, пока давление не станет равным давлению насыщенного пара при заданной температуре.
Давление пара прекращает свой рост, начинается конденсация пара в жидкость. Объем, где происходит сжатие, содержит не одно вещество – газ, возникает граница вещества, находящегося в двух состояниях: жидкость – газ.
Используя метод, приведенный выше, ученым XIX века удалось превратить в жидкость ряд веществ, которые были известны только в газообразной фазе. Так получили жидкие хлор и углекислый газ, производя их сжатие при низкой температуре.
В системе, состоящей из двух фаз, жидкость и ее пар находятся в динамическом равновесии и при заданной температуре обладают определёнными плотностями и давлениями.
Пар имеет наименование насыщенный, так как его невозможно «уплотнить» при заданной температуре. При попытке увеличения давления часть насыщенного пара переходит в жидкую фазу.
Данный процесс идет в системе двух фаз при изменении ее объема.
Плотность насыщенного пара при температуре $T_1$ составит:
$rho _{n1}=frac{m}{V_1}left(1right),$
где $V_1$ — объем насыщенного пара при $T_1$.
При температуре $T_2$ плотность пара составит:
$rho_{n2}=frac{m}{V_2}left(2right).$
Если температура увеличивается ($T_1$
Плотность насыщенного пара растет с увеличением температуры.
Замечание 2
При увеличении температуры плотность жидкости уменьшается.
Если температура системы увеличивается и приближается к некоторому критическому значению, разность плотностей жидкой и газообразных фаз уменьшается, и в некоторой критической точке плотности фаз становятся равными:
$rho _{kr}=frac{m}{V_{kr}}left(3right).$
Рисунок 1. Состояние насыщенного пара. Автор24 — интернет-биржа студенческих работ
На рис.1 имеется горизонтальный отрезок, соответствующий состоянию насыщенного пара. Поскольку отрезок горизонтален, то:
${left(frac{partial p}{partial V}right)}_T=0left(4right)$
Формула (4) показывает, что на указанном отрезке давление (плотность) не зависит от объема. Данный факт свидетельствует о том, что при увеличении плотности частиц в некоторой области, не появляются силы давления, которые стремились бы уменьшить эту плотность. Поэтому в критическом состоянии флуктуации плотности велики.
В двухфазной системе газ – жидкость, конденсация возникает при весьма малых пересыщениях и проходит с большой скоростью. При этом формируется состояние подвижного равновесия фаз системы. Выделение теплоты при конденсации определяют при помощи уравнения Клайперона — Клаузиуса.
Пересыщенный пар
При отсутствии центров конденсации капли жидкости не возникают, пар переходит в метастабильное состояние – пересыщенный (или переохлажденный) пар.
Одним из вариантов получения пересыщенного пара является процесс изотермического уменьшения объема до давления, которое выше, чем давление насыщенного пара при заданной температуре. График, связывающий давление пересыщенного пара и его объем изображен на рис.1.
Теплота фазового перехода
В системе двух фаз, состояния вещества имеют одинаковую температуру. При уменьшении объема некоторая доля пара переходит в жидкость, при этом для поддержания температуры неизменной от системы должна отводится часть теплоты. Данная теплота расходуется на изменение фазового состояния вещества и именуется теплотой фазового превращения (скрытой теплотой перехода).
Фазовые переходы, которые происходят с поглощением или выделением скрытой теплоты перехода называют фазовыми переходами первого рода.
Конденсация является фазовым переходом первого рода.
Уравнение Клапейрона — Клаузиуса
Уравнение Клапейрона — Клаузиуса связывает давление, при котором находится в динамическом равновесии система двух фаз, и ее температуру.
$frac{dp}{dT}=frac{L}{Tleft(V_1-V_2right)}left(5right),$ где:
- $L$ — скрытая теплота фазового перехода;
- $V_2$ — объем жидкой фазы;
- $V_1$ — объем газообразной фазы.
Уравнение (5) дает возможность определить давление как функцию от температуры.
Данное уравнение было получено в 1834 году французским инженером – исследователем Б. П. Э. Клайпероном, который рассмотрел цикл с рабочим телом в виде системы двух фаз (жидкости и насыщенного пара). Р.Ю. Клаузиус данное уравнение получил теоретически на основании второго начала термодинамики.
Уравнение Клапейрона — Клаузиуса можно применять для описания всех фазовых переходов первого рода.
Для проведения интегрирования уравнения (5) необходимо определить какова связь между теплотой конденсации (испарения) и температурой.
Находи статьи и создавай свой список литературы по ГОСТу
Поиск по теме
Испарение и конденсация: особенности процесса
Содержание:
- Испарение и конденсация — что это за процессы в физике
- Влажность воздуха
-
Процесс образования пара, что при этом происходит
- От чего зависит скорость испарения
- Какое количество теплоты выделяется
- Насыщенный, ненасыщенный и перенасыщенный пар
- Описание процесса перехода пара в жидкость, формула
- Где применяются процессы испарения и конденсации
Испарение и конденсация — что это за процессы в физике
Определение
Парообразование представляет собой явление превращения вещества из жидкого состояния в газообразное.
Процессы парообразования классифицируют на два типа:
- Испарение.
- Кипение.
Жидкость может испаряться с поверхности в любых температурных условиях. К примеру, высыхание лужи можно наблюдать, когда температура окружающей среды составляет 10, 20 или 30 °C. Исходя из этого, можно сформулировать физическое определение процесса испарения.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Определение
Испарение является процессом, при котором вещество переходит из жидкого состояние в газообразное с поверхности жидкости при любой температуре.
В процессе испарения молекулы высвобождаются из жидкости. При этом энергия жидкого вещества уменьшается вместе с понижением температуры. Практическим подтверждением таких изменений являются ощущения человека после купания. После выхода из водоема чувствуется холод. При этом, если наблюдается ветреная погода, то испарение протекает интенсивнее, и становится холоднее, чем при отсутствии ветра.
Примечание
Испарение характерно не только для жидкостей, но и для твердых тел. В качестве пояснения можно привести пример испарения льда. Это подтверждает процесс высыхания белья после стирки на морозе. Запах нафталина объясняется его испарением. Во время тушения пожаров применяют легко испаряющиеся жидкости.
Процесс испарения жидкости объясняет молекулярно-кинетическая теория. Молекулы вещества, находящегося в жидком состоянии, непрерывно перемещаются с разными скоростями. Определенные из них, обладающие самой большой скоростью и расположенные на границе поверхности жидкости и воздуха, со сравнительно большой энергией способны преодолеть притяжение соседних молекул, и покинуть жидкость. В результате образуется пар.
В связи с тем, что в процессе испарения жидкость покидают молекулы с большей внутренней энергией по сравнению с остальными, средняя скорость и средняя кинетическая энергия жидкости уменьшаются, за счет чего вещество остывает.
Скорость, с которой испаряется жидкость, определяется ее родом. Например, эфир переходит в газообразное состояние быстрее, чем вода или растительное масло. Также на скорость испарения влияет движение воздуха над поверхностью жидкости. Практически это можно проверить с помощью сушки вещей на открытом воздухе. Если на улице ветрено, белье высыхает быстрее.
Скорость, с которой испаряется жидкость, определяется ее температурой. В качестве примера можно рассмотреть воду, которая при 30 °C испарится быстрее, чем та же вода при температуре в 10 °C. Если воду налить в блюдце, то процесс ее испарения будет протекать быстрее по сравнению с испарением воды в стакане. Следовательно, на показатель скорости испарения оказывает влияние площадь поверхности жидкости.
Определение
Кипение является процессом интенсивного парообразования, протекающим в условиях нагрева жидкости, не только с поверхности, но и внутри нее.
Кипение представляет собой отдельный вид парообразования. Каждое вещество обладает определенной температурой кипения. В процессе испарения можно наблюдать не только образование пара, но и трансформацию молекул вещества из парообразного состояния в жидкое.
В качестве примера рассмотрим опыт с водой в стеклянной колбе. При повышении температуры жидкости спустя некоторое время возникают пузырьки. Они содержат воздух и насыщенный водяной пар, образованный в результате испарения воды внутри пузырьков. С повышением температуры можно наблюдать повышение давления внутри пузырьков, которые движутся вверх под действием выталкивающей силы.
В верхнем слое воды температура меньше, чем в нижнем. В пузырьках начинает происходить конденсация пара, что способствует уменьшению их объема. При равномерном нагреве воды пузырьки с паром поднимаются на поверхность и лопаются, после чего пар высвобождается во внешнюю среду. Вода кипит. Процесс протекает при определенной температуре, когда давление насыщенного пара в пузырьках равно атмосферному давлению.
Температура, при которой жидкость кипит, называют температурой кипения. Данный параметр определяется атмосферным давлением. Если оно повышается, то температура кипения будет выше. Опытным путем доказано, что при кипении температура жидкости сохраняет стабильное значение, несмотря на поступлении энергии из внешней среды.
Жидкость трансформируется в пар при кипении, что обусловлено отдалением молекул друг от друга и преодолением ими взаимного притяжения. Работа в этом случае совершается за счет подводимой к жидкости энергии.
Процесс заканчивается, когда весь объем жидкости будет преобразован в пар. Так как температура жидкости и пара во время кипения одинаковая, средняя кинетическая энергия молекул остается стабильной. В этом случае увеличивается только их потенциальная энергия.
На графике можно проследить взаимосвязь между температурой воды и временем при ее нагреве от комнатной температуры до температуры кипения (АБ), кипении (БВ), нагревании пара (ВГ), охлаждении пара (ГД), конденсации (ДЕ) и последующего охлаждения (ЕЖ).
Определение
Конденсация является процессом превращения пара в жидкость.
При конденсации пара выделяется энергия. В окружающем мире можно наблюдать данное явление, когда в вечернее время летом при понижении температуры воздуха выпадает роса. Она представляет собой водяной пар, который содержится в воздухе. В процессе охлаждения пар конденсируется, и капли воды оседают на траве.
Конденсация протекает в одно время с испарением. Молекулы, которые покидают жидкость и находятся над ее поверхностью, движутся хаотично. При столкновении с соседними молекулами в определенный момент времени они приобретают скорость, направленную к поверхности жидкости, и возвращаются в жидкую среду.
В открытом сосуде вещества испаряются быстрее, чем происходит конденсация. При этом жидкость теряет в массе. Пар, который формируется над поверхностью жидкости, является ненасыщенным.
При помещении жидкости в закрытый сосуд поначалу количество покинувших ее молекул превышает число вернувшихся обратно. Со временем плотность пара, находящегося над жидкостью, повышается да такого значения, что число молекул, которые высвобождаются из жидкости, становится равным числу молекул, вернувшихся в жидкость. При этом наступает динамическое равновесие жидкости с ее паром.
В состоянии динамического равновесия пар является насыщенным. Когда резервуар с жидкостью и насыщенным паром нагревают, возрастает количество молекул, покидающих жидкость. Постепенно оно становится больше, чем число молекул, возвращающихся в жидкую среду.
Со временем равновесие восстанавливается, однако увеличиваются показатели плотности и давления пара, находящегося над жидкостью. В качестве примеров конденсации можно привести:
- облака;
- запотевшие окна и краны, по которым течет холодная вода;
- туман у носика чайника.
Влажность воздуха
Воздух при любых условиях содержит водяной пар, который образован в результате испарения воды. Влажность характеризует концентрацию водяного пара в воздухе.
Определение
Абсолютная влажность воздуха ((rho)) представляет собой массу водяного пара, который содержится в 1 м³ воздуха, или является плотностью водяного пара, содержащегося в воздухе.
В том случае, когда относительная влажность воздуха составляет (9,41*10^{-3} kg/m^{3}), в 1 м³ содержится (9,41*10^{-3} kg) водяного пара. Относительная влажность – это величина, которая характеризует степень влажности воздуха.
Определение
Относительная влажность воздуха ((varphi)) является величиной, равной отношению плотности ((rho)), которой обладает водяной пар, содержащийся в воздухе, к плотности насыщенного водяного пара (rho _{0}) при этой температуре.
Формула расчета относительной влажности имеет вид:
(varphi =frac{rho}{rho _{0}}100%)
Температура, при которой водяной пар, содержащийся в воздухе, становится насыщенным, является точкой росы. Влажность измеряют с помощью психрометра, который состоит из влажного и сухого термометров. По показаниям этим приборов можно определить по таблице относительную влажность воздуха.
Процесс образования пара, что при этом происходит
В процессе испарения молекулы покидают жидкость, а также уносят с собой часть ее внутренней энергии. Известно, что температура оказывает влияние на скорость, с которой движутся молекулы. При одинаковой температуре скорость молекул, расположенных рядом, может несильно отличаться.
Однако определенная часть молекул будет перемещаться так быстро, что способна преодолеть притяжение других молекул, и покинуть жидкость. Данные молекулы испаряются, унося с собой энергию. Испарение является эндотермическим процессом, то есть протекает с поглощением энергии, которая высвобождается вместе с молекулами.
В результате потерь тепловой энергии в процессе испарения жидкость остывает. При повышении скорости испарения температура понижается сильнее. В том случае, когда жидкость испаряется медленно, тепловые потери восполняются. Это объясняется частичной отдачей тепловой энергии молекулами окружающего воздуха молекулам жидкости, что исключает значительное понижение ее температуры.
От чего зависит скорость испарения
Скорость испарения зависит от нескольких факторов. К ним относят:
- силу притяжения молекул к соседним, что определяется родом вещества;
- площадь поверхности жидкости;
- движение воздуха над поверхностью вещества;
- температуру.
Известно, что жидкости испаряются с неодинаковой скоростью. К примеру, вода будет испаряться медленнее, чем ацетон, так как сила притяжения молекул воды друг к другу больше, чем аналогичный показатель, характерный для молекул ацетона.
Примечание
В физике принято говорить не о силе притяжения молекул, а об их потенциальной энергии взаимодействий. Данная формулировка применима для описания процесса испарения веществ.
Скорость испарения также определяется движением воздуха над ее поверхностью. Некоторые молекулы, которые испаряются, не обладают запасом кинетической энергии. Такие молекулы находятся вблизи вещества и возвращаются через какое-то время обратно. Если дует ветер, то такие молекулы улетают без возможности вернуться назад. Таким образом, скорость испарения жидкости увеличивается.
Известно, что молекулы испаряются с поверхности. В связи с этим, испарение веществ происходит быстрее, если площадь поверхности больше.
Жидкости испаряются, независимо от температуры. При нагреве процесс ускоряется. Это связано с ростом числа молекул, которые обладают энергией, достаточной для высвобождения из вещества. Когда температура повышается, увеличивается количество молекул с кинетической энергией, превышающей потенциальную энергию взаимодействия молекул с соседними молекулами.
Какое количество теплоты выделяется
Вещества трансформируются из жидкого состояния в газообразное с неодинаковыми затратами энергии. Данная величина определяется, как удельная теплота парообразования.
Определение
Удельная теплота парообразования (L) является величиной, равной отношению количества теплоты, которое нужно сообщить веществу массой 1 кг, для превращения его из жидкого состояния в газообразное при температуре кипения.
В СИ удельная теплота парообразования обозначается, как L, и измеряется в Дж/кг.
Вычислить количество теплоты Q, необходимое для того, чтобы вещество с массой m превратилось из жидкости в газ, можно путем умножения удельной теплоты парообразования L на массу вещества:
Q=L*m
В процессе конденсации пара будет выделено некоторое количество теплоты. Ее величина равна количеству теплоты, которое необходимо израсходовать для того, чтобы превратить жидкость в пар при той же температуре.
Насыщенный, ненасыщенный и перенасыщенный пар
Определение
Паром жидкости называют газообразное состояние данной жидкости.
Над жидкостью всегда присутствуют ее пары, образованные в результате испарения этой жидкости. Благодаря диффузии, молекулы частично возвращаются обратно в вещество.
Определение
Ненасыщенный пар образуется в том случае, когда количество молекул, высвобождающихся из жидкости, больше числа молекул, вернувшихся в жидкость за тот же промежуток времени.
Определение
Насыщенный пар является паром, который находится в равновесии со своей жидкостью.
Пар насыщенный, если количество молекул, которые покинули жидкость в течение определенного времени, равно числу молекул, вернувшихся в жидкость за это же время. В этом случае допустимо говорить о динамическом равновесии пара и жидкости.
Получить насыщенный пар можно опытным путем, например, при ограничении объема над поверхностью воды. В таком случае процесс может длиться только до определенного момента. Когда пар становится насыщенным, то большей концентрации молекул (значит, и давления) насыщенного пара при той же температуре достичь нельзя.
Таким образом, давление насыщенного пара обладает единственным значением, которое определяется лишь его температурой. При уменьшении насыщенного пара в объеме при стабильной температуре происходит конденсация пара в жидкость, в связи с тем, что концентрация частиц и давления пара достигают максимального значения.
Особенность пара состоит в том, что его давление р не превышает давление насыщенного пара (p_{n}), то есть (pleq p_{n}). Давление (p_{n}) определяется лишь температурой. Данное значение можно взять из справочника. Когда (p< p_{n}), пар является ненасыщенным, а при (p= p_{n}) – насыщенным.
В любых процессах пар рассматривают в виде трехатомного газа. Тогда i, то есть число степеней свободы у молекул пара, равно 6. Молярная емкость (c_{v}) при стабильном объеме составляет 3R. Тога внутренняя энергия пара равна:
(U=3nu RT)
где (nu) является количеством моль пара.
Если рассмотреть какой-то объем пара, запертый в резервуаре под поршнем, то при отводе и подводе тепла ненасыщенный пар будет вести себя, как обычный газ. Его масса будет оставаться стабильной в отличие от массы насыщенного пара, которая может изменяться.
В случае ненасыщенного пара применимы законы Бойля-Мариотта, Гей-Люссака, Шарля, а для насыщенного – нет. Можно рассмотреть поведение пара при различных условиях на практических примерах.
Имеется некий закрытый сосуд объемом 0,5 л при температуре ({100}^circ C), в котором находятся в равновесии пары воды и капля воды. Необходимо вычислить массу водяного пара в сосуде. Следует учесть, что при температуре ({100}^circ C) давление насыщенного пара соответствует атмосферному, поэтому (p={10}^5) Па. Уравнение Менделеева-Клапейрона имеет вид:
(pV=frac{m}{mu}RT)
Таким образом:
(m=frac{mu pV}{RT})
По аналогии с молярной массой воды можно определить молярную массу водяного пара:
(left(H_2Oright): mu =left(2cdot 1+16right)cdot {10}^{-3}=18cdot {10}^{-3} {kg}/{mol})
Универсальная газовая постоянная (R=8,31 {J}/{left(molcdot Kright)})
Можно перевести единицы в систему СИ, тогда:
объем сосуда (V=0,5 l=5cdot {10}^{-4} m^3)
температура пара (T=373 K)
В таком случае, водяной пар обладает массой:
(m=frac{18cdot {10}^{-3}cdot {10}^5cdot 5cdot {10}^{-4}}{8,31cdot 373}=2,9cdot {10}^{-4} kg=0,3 g)
В другом примере рассматривается сосуд объемом 1 л при температуре ({100}^circ C), в котором находятся в равновесии вода, водяной пар и азот. Объем жидкой воды намного меньше, чем объем резервуара. Давление в сосуде равно 300 кПа, атмосферное давление составляет 100 кПа. Необходимо вычислить общее количество пара, парциальное давление азота в системе, массу водяного пара, массу азота.
В первую очередь следует обратиться к уравнению Менделеева-Клапейрона для водяного пара и азота:
(pV=nu RT)
Исходя из этого, можно рассчитать общее количество вещества в газообразном состоянии:
(nu =frac{pV}{RT})
Универсальная газовая постоянная (R=8,31 {J}/{left(molcdot Kright)})
Необходимо перевести величины в СИ:
объем сосуда (V=1 l={10}^{-3} m^3)
давление в сосуде (p=300 kPa=3cdot {10}^5 Pa)
температура (T=373 K)
Таким образом:
(nu =frac{3cdot {10}^5cdot {10}^{-3}}{8,31cdot 373}=0,097 mol)
Согласно закону Дальтона, давление в сосуде равно:
(p=p_{steam}+p_{N_2})
Исходя из этого, парциальное давление азота:
(p_{N_2}=p-p_{steam})
При температуре ({100}^circ C) давление насыщенного пара такое же, как атмосферное:
(p_{steam}=100 kPa)
В таком случае:
(p_{N_2}=300-100=200 kPa)
Уравнение Менделеева-Клапейрона:
(p_{steam}V=frac{m_{steam}}{{mu}_{steam}}RT)
Масса водяного пара:
(m_{steam}=frac{{mu}_{steam}p_{steam}V}{RT})
Молярная масса водяного пара:
(left(H_2Oright): mu =left(2cdot 1+16right)cdot {10}^{-3}=18cdot {10}^{-3} {kg}/{mol})
Таким образом:
(m_{steam}=frac{18cdot {10}^{-3}cdot {10}^5cdot {10}^{-3}}{8,31cdot 373}=0,00058 kg=0,58 g)
Масса азота:
(m_{N_2}=frac{{mu}_{N_2}p_{N_2}V}{RT})
Молярная масса азота:
(left(N_2right): mu =2cdot 14cdot {10}^{-3}=28cdot {10}^{-3} {kg}/{mol})
Таким образом:
(m_{N_2}=frac{28cdot {10}^{-3}cdot 2cdot {10}^5cdot {10}^{-3}}{8,31cdot 373}=0,0018 kg=1,8 g)
Определение
Перенасыщенным или пересыщенным паром называют пар, который получается из насыщенного при увеличении давления при стабильной температуре.
Перенасыщенный пар получают двумя методами:
- повышение давления;
- охлаждение насыщенного пара.
Пересыщенный пар является метастабильным. Данное понятие означает то, что пар остается в стабильном состоянии в течение длительного времени. Однако при изменении температуры снижается давление, и начинается конденсация. В результате пар становится насыщенным, то есть устанавливается динамическое равновесие.
Описание процесса перехода пара в жидкость, формула
В процессе конденсации пар превращается в жидкость. При этом количество частиц вещества, которые возвращаются в жидкость в течение определенного времени, превышает число молекул, высвобождающихся из жидкости. Испарение и конденсацию можно наблюдать повсеместно.
К примеру, когда вода испаряется с поверхности водной оболочки планеты (гидросферы), почвы и растений, в воздухе в любое время будет содержаться водяной пар. В процессе его конденсации формируются облака, и выпадают осадки.
Над свободной поверхностью постоянно присутствуют ее пары. В том случае, когда резервуар с жидкостью открыт, при стабильной температуре концентрация молекул пара изменяется, уменьшаясь и увеличиваясь. В замкнутом пространстве при определенной температуре процесс испарения протекает до некого момента.
Это обусловлено одновременным испарением и переходом водяного пара в жидкость. Таким образом, при повышении температуры, плотность и давление насыщенного пара также увеличиваются. Примерную зависимость данных показателей описывает уравнение состояния идеального газа:
p=nkT
Давление насыщенного пара при стабильном объеме увеличивается из-за роста температуры жидкости и повышения концентрации молекул пара, его плотности и массы. Поэтому рассматриваемая зависимость является приближенной.
В начальный момент времени скорость роста давления насыщенного пара больше, чем аналогичный показатель идеального газа. При испарении всей жидкости пар перестает быть насыщенным, а его давление при стабильном объеме увеличивается прямо пропорционально температуре.
Из этого следует, что при неизменной температуре давление и плотность насыщенного пара не определяется занимаемым им объемом. Давление и плотность насыщенного пара при определенной температуре являются максимальными для пара, находящегося в динамическом равновесии со своей жидкостью.
Когда объем ненасыщенного пара уменьшается, давление растет так же, как изменяется давление при уменьшении объема идеального газа. По достижению некого объема пар становится насыщенным. Дальнейшее сжатие приводит к превращению пара в жидкость. Когда весь пар трансформируется в жидкость, последующее уменьшение объема спровоцирует резкий рост давления, так как жидкости плохо сжимаются.
При температуре, превышающей некоторое значение, при любом сжатии пар не превратиться в жидкость. Таким образом, переход вещества из газообразного состояния в жидкое возможен не при любой температуре. Максимальная температура, при которой пар еще может превратиться в жидкость, называется критической температурой. Для каждого вещества характерна определенная критическая температура.
Примечание
Если температура вещества выше, чем критическая, то его состояние называют газом. Когда температура вещества ниже, чем критическая, пар может перейти в жидкое состояние. В таком случае он называется паром.
Примерную зависимость между давлением насыщенного пара и его плотностью описывают формулой:
(p_{H}=frac{rho _{h}}{mu }RT)
Где применяются процессы испарения и конденсации
Данные процессы активно применяются в технике и широко распространены в природе. На тепловых электростанциях вода превращается в пар, вращающий турбину. Отработанный пар после конденсации применяют для отопления разных объектов.
С помощью испарения сушат древесину, ягоды, разные материалы. Конденсация нередко используется для очистки воды. При этом грязную воду трансформируют в пар. Другие популярные области использования рассматриваемых процессов:
- организация холодильного процесса в холодильниках;
- снижение температуры воды в градирнях;
- разделение веществ в ректификационной колонне;
- сушка воздуха.
Процесс испарения активно используется в энергетике, холодильной технике, сушильном оборудовании, испарителях. К примеру, спускаемые аппараты в космической технике покрыты веществами, которые способы быстро испаряться. За счет испарения происходит охлаждение корпуса аппарата, когда он преодолевает слои атмосферы.
В природе можно наблюдать масштабное явление под названием круговорот воды. Следует отметить, что влажность воздуха влияет на здоровье человека. Данный показатель контролируют и регулируют при хранении книг, картин, овощей, фруктов, продуктов питания, древесины.
Идея процессов испарения и конденсации лежит в основе устройства дистиллятора. С его помощью получают химически чистую воду, которую, к примеру, используют для заливки автомобильных аккумуляторов. Перенасыщенный пар используют в камере Вильсона, что позволяет визуализировать и фотографировать частицы для изучения их поведения.
Задачи на парообразование и конденсацию
с решениями
Формулы, используемые на уроках «Задачи на парообразование и конденсацию».
Название величины |
Обозначение |
Единица измерения |
Формула |
Масса |
m |
кг |
m = Q / L |
Температура |
t |
°С |
|
Температура кипения |
tкип |
°С |
|
Удельная теплоемкость |
c |
Дж/кг°С |
|
Удельная теплота парообразования |
L |
Дж/кг |
L = Q / m |
Кол-во теплоты при нагревании |
Q |
Дж |
Q=cm(t2–t1) |
Кол-во теплоты при парообразовании |
Q |
Дж |
Q = Lm |
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Задача № 1.
Какое количество энергии требуется для обращения воды массой 150 г в пар при температуре 100 °С?
Задача № 2.
Какое количество энергии требуется для превращения воды массой 2 кг, взятой при температуре 20 °С, в пар?
Задача № 3.
Какое количество энергии нужно затратить, чтобы воду массой 5 кг, взятую при температуре 0 °С, довести до кипения и испарить её?
Задача № 4.
Какую энергию нужно затратить, чтобы расплавить кусок свинца массой 8 кг, взятый при температуре 27 °С?
Задача № 5.
Какое количество энергии требуется для превращения в пар спирта массой 200 г, взятого при температуре 18 °С?
Задача № 6.
Какое количество энергии требуется для превращения в пар воды массой 5 кг, взятой при температуре 20 °С?
Задача № 7.
Какое количество теплоты необходимо сообщить воде массой 10 г, взятой при температуре 0 °С, для того, чтобы нагреть ее до температуры кипения и испарить?
Задача № 8.
Из чайника выкипела вода объемом 0,5 л, начальная температура которой была равна 10 °С. Какое количество теплоты оказалось излишне затраченным?
Задача № 9.
Кофейник вместимостью 1,2 л заполнили водой при температуре 15 °С и поставили на плиту. Какое количество теплоты пошло на нагревание и кипение воды, если после снятия с плиты в результате испарения в кофейнике объем воды стал на 50 см3 меньше? (Изменение плотности воды с изменением температуры не учитывать.)
Задача № 10.
Какое количество теплоты выделяется при конденсации водяного пара массой 10 кг при температуре 100 °С и охлаждении образовавшейся воды до 20 °С?
Задача № 11.
Какое количество теплоты необходимо, чтобы из льда массой 2 кг, взятого при температуре -10 °С, получить пар при 100 °С?
Задача № 12.
Сколько энергии понадобится, чтобы полностью испарить 100 грамм ртути, взятой при температуре 27 °С?
Краткая теория для решения Задачи на парообразование и конденсацию.
Это конспект по теме «Задачи на парообразование и конденсацию». Выберите дальнейшие действия:
- Посмотреть конспект по теме Кипение. Удельная теплота парообразования
- Вернуться к списку конспектов по Физике.
- Проверить свои знания по Физике.
Содержание:
Парообразование и конденсация:
Любое вещество при определенных условиях может переходить из одного фазового (агрегатного) состояния в другое. Влажная одежда может «замерзнуть», а может высохнуть, водяной пар может собраться в капельки воды, образуя туман или росу, а может превратиться в иней. Вспомним, при каких условиях происходит переход вещества из жидкого состояния в газообразное и наоборот.
Каковы особенности испарения жидкости
Процесс перехода вещества из жидкого состояния в газообразное называют парообразованием.
Есть два способа перехода жидкости в газ: испарение и кипение.
Испарение — это процесс парообразования с поверхности жидкости.
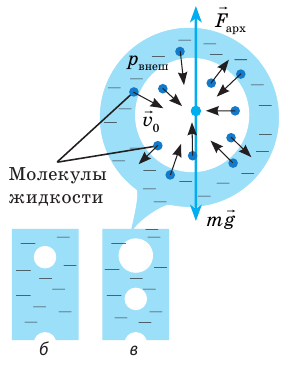
С точки зрения МКТ парообразование — это такой процесс, когда с поверхности жидкости вылетают быстрые молекулы. Действительно, молекулы жидкости непрерывно движутся (колеблются около положений равновесия, время от времени перепрыгивают с места на место), но силы притяжения не дают им разлететься. Однако в жидкости всегда есть молекулы, кинетическая энергия которых в несколько раз превышает ее среднее значение. Когда эти «быстрые» молекулы оказываются на поверхности жидкости, их энергии хватает для того, чтобы, преодолев притяжение соседних молекул, покинуть жидкость.
Зная механизм испарения, отметим некоторые его особенности.
- Испарение происходит при любой температуре. Чем выше температура жидкости, тем больше в ней «быстрых» молекул, поэтому с увеличением температуры скорость испарения увеличивается. Поскольку жидкость покидают молекулы, кинетическая энергия которых выше средней, то средняя кинетическая энергия оставшихся молекул уменьшается, то есть при отсутствии теплообмена процесс испарения вызывает охлаждение жидкости.
- Испарение сопровождается поглощением энергии: энергия расходуется на совершение работы против сил межмолекулярного притяжения и сил внешнего давления. Чем меньше давление на свободную поверхность жидкости, тем быстрее жидкость испаряется.
- Скорость испарения увеличивается при увеличении площади свободной поверхности жидкости (на поверхности жидкости будет больше молекул с достаточной кинетической энергией).
- Разные жидкости испаряются с разной скоростью (спирт испаряется почти мгновенно, вода — медленнее, а капля ртути будет испаряться годами, отравляя воздух). Очевидно, что медленнее испаряются те жидкости, молекулы которых сильнее взаимодействуют друг с другом.
Какой пар называют насыщенным
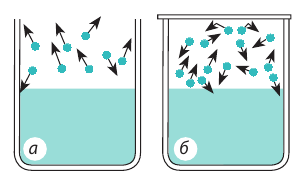
Скорость испарения зависит от движения воздуха: волосы быстрее высохнут, если их сушить феном; лужи после дождя быстрее исчезнут в ветреную погоду. Такую зависимость легко объяснить с точки зрения теплового движения молекул. Около поверхности жидкости всегда существует «облако» покинувших ее молекул, то есть пар этой жидкости. Молекулы пара беспорядочно движутся, сталкиваясь друг с другом и с молекулами других газов. Благодаря диффузии и движению воздуха некоторые молекулы пара удаляются от поверхности жидкости и уже никогда в нее не возвращаются. Другие молекулы, наоборот, могут оказаться так близко к поверхности, что силы межмолекулярного взаимодействия «захватывают» их и возвращают в жидкость (см. рис. 31.2). Если бы молекулы, покинувшие жидкость, не возвращались, то скорость испарения была бы огромной. Например, при комнатной температуре ведро воды испарилось бы менее чем за час.
Рис. 31.2. Молекулы, покинувшие жидкость, могут снова вернуться в нее вследствие теплового движения: а — пар над поверхностью жидкости ненасыщенный; б — пар над поверхностью жидкости насыщенный
Таким образом, наряду с процессом испарения, в ходе которого жидкость переходит в пар, существует обратный процесс, в ходе которого вещество из газообразного состояния переходит в жидкое.
Процесс перехода вещества из газообразного состояния в жидкое называют конденсацией.
Испарение сопровождается поглощением энергии; при конденсации энергия выделяется. Закроем крышкой сосуд с некоторым объемом жидкости (рис. 31.2, б). Поверхность жидкости по-прежнему будут покидать «быстрые» молекулы, масса жидкости будет уменьшаться, а концентрация молекул пара — увеличиваться. Одновременно часть молекул будет возвращаться из пара в жидкость. Очень быстро концентрация молекул пара над жидкостью станет настолько высокой, что число молекул, возвращающихся в жидкость, будет равно числу молекул, покидающих ее за то же время, — между процессами конденсации и испарения установится динамическое равновесие.
Пар, находящийся в состоянии динамического равновесия со своей жидкостью, называют насыщенным паром.
Обратите внимание! Концентрация молекул насыщенного пара — наибольшая возможная концентрация молекул пара при данной температуре; пар, концентрация молекул которого меньше, чем в насыщенном, называют ненасыщенным паром.
От каких факторов зависит давление насыщенного пара
Для насыщенного пара, как и для любого газа, справедливо равенство p=nkT. То есть при данной температуре T давление p насыщенного пара прямо пропорционально концентрации n его молекул.
Поскольку концентрация молекул насыщенного пара зависит от рода жидкости, то и давление насыщенного пара зависит от рода жидкости (табл. 1).
Таблица 1
Давление насыщенного пара при 20 °C
| Вещество | Давление, мм рт. ст. |
|---|---|
| Ртуть | 0,0013 |
| Вода | 17,36 |
| Хлороформ | 160,5 |
| Эфир | 442,4 |
| Хлор | 5798 (7,63 атм) |
| Аммиак | 6384 (8,4 атм) |
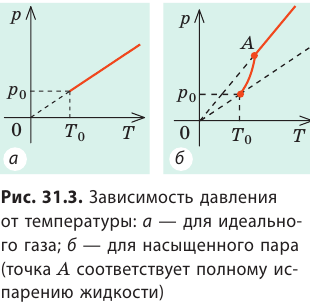
Чем больше силы межмолекулярного взаимодействия, тем меньше концентрация молекул насыщенного пара и, следовательно, тем меньше его давление. Кроме того, давление насыщенного пара зависит от температуры. При увеличении температуры давление насыщенного пара растет гораздо быстрее, чем давление идеального газа (рис. 31.3).
Дело в том, что одновременно с ростом температуры увеличивается концентрация молекул пара.
Обратите внимание! Если повышение температуры приведет к полному испарению жидкости, то в дальнейшем пар станет ненасыщенным и его давление будет линейно зависеть от температуры.
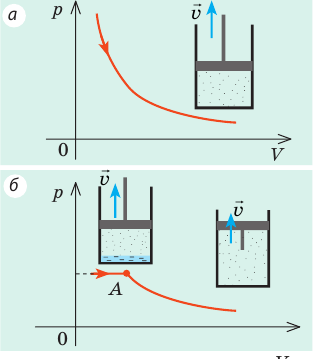
Давление, создаваемое насыщенным паром, — наибольшее давление, которое может создать пар данной жидкости при данной температуре. Если уменьшить объем, занимаемый насыщенным паром, то на короткое время концентрация молекул пара увеличится, динамическое равновесие нарушится и число молекул, поступающих в жидкость, превысит число молекул, покидающих ее.
Конденсация будет преобладать над испарением до тех пор, пока концентрация молекул пара не уменьшится до концентрации молекул насыщенного пара, а давление не станет равным давлению насыщенного пара. С увеличением объема, занимаемого насыщенным паром, наоборот, будет преобладать процесс испарения, и в результате снова установится начальное давление. Таким образом, в отличие от идеального газа, давление насыщенного пара не зависит от его объема (рис. 31.4).
Рис. 31.4. Зависимость давления от объема: а — для идеального газа; б — для насыщенного пара. Точка А соответствует полному испарению жидкости; пар становится ненасыщенным, и его давление уменьшается обратно пропорционально объему
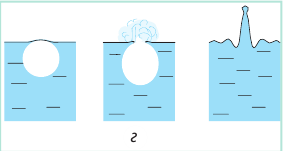
Как и почему кипит жидкость
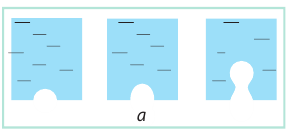
Если к сосуду с жидкостью подвести достаточное количество теплоты, температура жидкости будет увеличиваться, а дно и стенки сосуда покроются пузырьками. Эти пузырьки содержат воздух и насыщенный пар, давление которых будет расти с ростом температуры. Как только давление газа внутри пузырьков превысит внешнее давление, пузырьки начнут увеличиваться в объеме (рис. 31.5, а).
Рис. 31.5. Механизм кипения жидкости
Наконец под действием архимедовой выталкивающей силы они оторвутся от дна сосуда и начнут всплывать; на месте оторвавшихся пузырьков останется небольшое количество газа — «зародыши» новых пузырьков (рис. 31.5, б).
Рис. 31.5. Механизм кипения жидкости
Пока верхние слои жидкости чуть холоднее нижних, в верхних слоях часть водяного пара в пузырьках конденсируется и они «схлопываются». Этот процесс сопровождается шумом и образованием многочисленных мелких пузырьков газа — жидкость «кипит белым ключом». Когда жидкость полностью прогреется, пузырьки, поднимаясь, увеличиваются в объеме, ведь в их середину непрерывно испаряется жидкость (рис. 31.5, в). Достигнув поверхности жидкости, пузырьки лопаются, выбрасывая пар в атмосферу; жидкость при этом бурлит и клокочет — кипит (рис. 31.5, г).
Рис. 31.5. Механизм кипения жидкости
Кипение — процесс парообразования, который происходит по всему объему жидкости и сопровождается образованием и ростом пузырьков пара.
От каких факторов зависит температура кипения жидкости
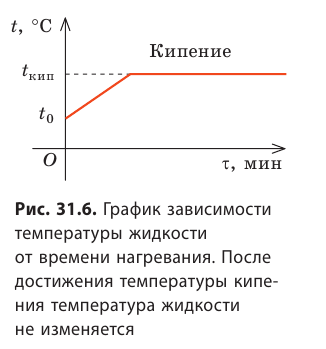
Продолжая нагревать уже кипящую жидкость, можно заметить, что во время кипения температура жидкости не изменяется (рис. 31.6).
Если увеличить количество теплоты, подводимой к жидкости, то увеличится количество пузырьков, то есть возрастет интенсивность парообразования. Таким образом, при кипении вся подводимая энергия идет на парообразование.
Жидкость начинает кипеть (пузырьки начинают увеличиваться в объеме) только тогда, когда давление газа в пузырьках (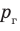
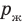
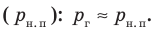

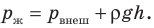
Кипение начинается при температуре, при которой давление насыщенного пара немного превышает внешнее давление.
Чем меньше внешнее давление, тем при более низкой температуре кипит данная жидкость (рис. 31.7). Если налить в колбу воду и насосом откачивать из колбы воздух, то вода закипит даже при комнатной температуре. И наоборот, если необходимо повысить температуру кипения жидкости, ее нагревают в условиях повышенного давления (рис. 31.8).
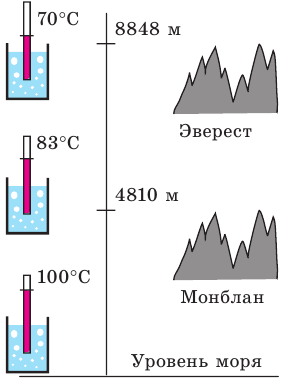
Рис. 31.7. температура кипения воды на разных высотах (и соответственно — при разном давлении)
Рис. 31.8. До высоких температур воду нагревают в автоклавах. При давлении свыше 100 атмосфер температура кипения воды увеличивается до 300 °С
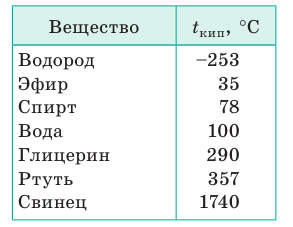
Поскольку давление насыщенного пара зависит от рода жидкости, то при одинаковом внешнем давлении каждое вещество имеет свою температуру кипения (табл. 2).
Таблица 2
Температура кипения веществ при нормальном атмосферном давлении
Чем меньше силы межмолекулярного притяжения в жидкости, тем ниже температура ее кипения. Температура кипения жидкости зависит от наличия в ней растворенного газа. Если долго кипятить воду и таким образом удалить из нее растворенный газ, то повторно при нормальном давлении эту воду можно будет нагреть до температуры выше 100 °С.
Выводы:
- Процесс перехода вещества из жидкого состояния в газообразное называют парообразованием. Парообразование может происходить двумя путями: испарением и кипением.
- Испарение — процесс парообразования с поверхности жидкости. Наряду с процессом испарения существует процесс конденсации — процесс перехода вещества из газообразного состояния в жидкое.
- Кипение — процесс парообразования, происходящий по всему объему жидкости и сопровождающийся образованием и увеличением пузырьков пара. Кипение начинается при температуре, при которой давление насыщенного пара в пузырьках немного превышает внешнее давление.
- Если за одинаковое время число молекул, вылетевших с поверхности жидкости, равно числу молекул, вернувшихся в жидкость, то жидкость и ее пар находятся в состоянии динамического равновесия. Пар, находящийся в состоянии динамического равновесия со своей жидкостью, называют насыщенным.
- Тепловое равновесие в физике
- Изопроцессы в физике
- Твердые тела и их свойства в физике
- Строение и свойства жидкостей в физике
- Идеальный газ в физике
- Уравнение МКТ идеального газа
- Уравнение состояния идеального газа
- Температура в физике