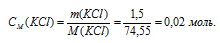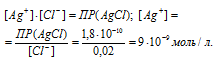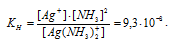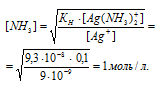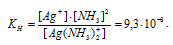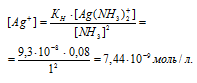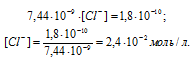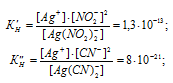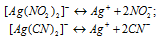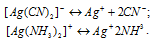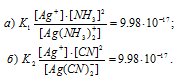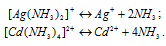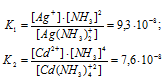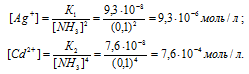Расчет концентрации ионов в растворе нескольких веществ
В
данном случае равновесие, устанавливающееся
при диссоциации слабого электролита,
может быть смещено под действием ионов,
образующихся при диссоциации другого
электролита, если эти ионы также являются
продуктом диссоциации первого электролита.
Пример
5
Рассчитать
концентрацию ионов ClO—
в растворе, 500 мл которого содержат 0.005
моля HClO
и 0.0005 моля HCl.
Решение
Концентрации
веществ в данном растворе равны
См(HClO)
= (
HClO)/V=0.005
моль/0.5 л =0.01 моль/л;
См(HCl)
= (
HCl)/V
= 0.0005 моль/0.5 л = 0.001 моль/л.
Их
схемы диссоциации
HClO
H+
+ ClO—,
HCl
H+
+ Cl—
видно,
что при диссоциации обоих веществ
образуется ион H+.
Однако, если диссоциация HCl
необратима, то диссоциация HClO
является обратимым процессом, описываемым
константой равновесия
Ка=
[H+][OCl—]/[HClO]
= 510-8.
Равновесная
концентрация водорода будет определяться
диссоциацией обоих веществ:
[H+]1=
См(HClO)
— слабый электролит (1);
[H+]2=
См(HCl)
= См(HCl)
= 0.001 моль/л – сильный электролит (=1);
[H+]
= [H+]1
+ [H+]2
= = [H+]1
+ 0.001 = х +0.001.
Равновесные
концентрации ионов ClO—
и молекул НClO
определяются диссоциацией первого
вещества:
[OCl—]=
См(HClO)
= [H+]1=
х,
[HClO]
= См(HClO)
— х = 0.01- х,
а
равновесная концентрация ионов Cl—
— диссоциацией второго вещества:
[Cl—]=
См(HCl)
= 0.01 моль/л.
Подставляя
значения равновесных концентраций в
выражение для константы равновесия,
получим уравнение
(х+0.001)х
/ (0.01-х) = 510-8.
Его
можно решить как квадратичное уравнение,
однако целесообразно предположить, что
х
0.001 и, следовательно, х
0.01, тогда
0.001х
/ 0.01 = 510-8,
откуда
х = [OCl—]=
510-7
моль/л, что действительно удовлетворяет
указанному выше предположению.
Задачи для самостоятельного решения
-
Вычислить
концентрацию ионов натрия и сульфат-ионов
в 5%- растворе сульфата натрия (=1.042
г/мл). -
Сколько
воды необходимо прибавить к 100 мл 0.01 М
раствора синильной кислоты HCN,
чтобы степень диссоциации кислоты
возросла в 4 раза? Как изменится рН
раствора? -
Во
сколько раз изменится степень диссоциации
HCN,
если к полученному в предыдущей задаче
раствору добавить 0.1 г HNO3?
-
Определить
рН 0.01М раствора гидроксида калия. -
Перекись
водорода Н2О2
является слабой кислотой. Вычислить
степень диссоциации и рН 1М раствора
перекиси водорода, если Ка=1.410-12. -
Рассчитать
концентрацию ионов НО2—
в растворе, 1 л которого содержит 1 моль
перекиси водорода и 0.001 моля HCl.
-
Вычислить
концентрацию хлорид-ионов в 0.03 М растворе
хлорида бария. -
Рассчитать
концентрации всех ионов, образующихся
при диссоциации H2S
в его 0.05 М растворе. -
К
0.2 М раствору HCN
добавили такое количество KCN,
что концентрация соли в растворе стала
равна 0.02 моль/л. Как изменится при этом
степень диссоциации синильной кислоты?
-
Определить
рН2%- раствора гидроксида натрия (=1.021
г/мл). -
Найти
концентрацию NH4OH,
при которой ее степень диссоциации
равна 2%. Вычислить концентрацию ионов
водорода в таком растворе. -
Как
изменится рН, если к 1 л 1 М раствора
гидроксида аммония прибавить 100 мл
20%- раствора хлорида аммония (=1.057
г/мл)?
-
Какой
раствор имеет более щелочную среду:
2%- раствор КОН (=1.016
г/мл) или 1.6%- раствор NaOH
(=1.016
г/мл)? -
Степень
диссоциации хлорноватистой кислоты
HClO
в ее 0.001 М растворе равна 0.71%. Определите
константу диссоциации и рН раствора. -
Рассчитать
концентрацию ионов ClO—
в растворе, 150 мл которого содержат 1.5
10-3
молей HClO
и 1.5 10-3
молей HCl.
-
Вычислить
концентрацию ClO4—
ионов в растворе, содержащем 3 г хлорной
кислоты HClO4
в 300 мл раствора. -
Определить
константу диссоциации плавиковой
кислоты HF
и рН раствора, если ее степень диссоциации
в 0.25 М растворе равна 5.1%. -
В
каком объемном отношении необходимо
смешать растворы из заданий 6.1 и 6.2,
чтобы степень диссоциации HF
уменьшилась в 6 раз?
-
Какую
массу КОН надо растворить в 1 л воды,
чтобы рН полученного раствора стал
равен 12? -
Степень
диссоциации бромноватистой кислоты
HBrO
в растворе и рН раствора соответственно
равны 0.04% и 5.3. Определить концентрацию
раствора кислоты и константу ее
диссоциации. -
Какую
массу КBrO
надо добавить к 1 л раствора HBrO
из предыдущего задания, чтобы концентрация
ионов водорода уменьшилась в 5 раз
-
Рассчитать
концентрации ионов бария и хлорид-ионов
в 3%- растворе хлорида бария BaCl2
(=1.025
г/мл). -
Во
сколько раз изменится степень диссоциации
и на сколько единиц изменится рН, если
раствор слабого электролита разбавить
в 100 раз? -
Во
сколько раз изменится степень диссоциации
слабого электролита, если в раствор
добавить соль, имеющую со слабым
электролитом одинаковые ионы, а
концентрации соли и слабого электролита
равны? Задачу решить в общем виде.
-
Вычислить
концентрацию нитрат-ионов в 0.02 М растворе
Al(NO3)3. -
Определить
концентрации всех ионов в 0.01 М растворе
угольной кислоты. -
К
0.1 М раствору HClO
добавили такое количество КClO,
что концентрация соли в растворе стала
равна 0.005 моль/л. Как изменилась степень
диссоциации кислоты?
-
Вычислить
концентрацию ионов Sr2+
и NO3—
в 8%- растворе Sr(NO3)2
(=1.072г/мл). -
Какой
объем воды необходимо прибавить к 300
мл 0.0025 М- раствора H2S,
чтобы степень диссоциации кислоты
возросла в 3 раза? Как изменится рН
раствора? -
Во
сколько раз изменится степень диссоциации
кислоты в полученном в предыдущей
задаче растворе, если к нему добавить
1 г серной кислоты?
-
Рассчитать
рН 0.3%- раствора HClO4
(=1.002
г/мл). -
Вычислить
степень диссоциации и рН в 0.01 М растворе
HClO. -
Рассчитать
концентрацию ионов ClО—
в растворе, 1 мл которого содержит
110-5
моля HClO
и 110-6
моля HCl.
-
Рассчитать
рН 0.2%- раствора Ва(ОН)2
(=1.002
г/мл). -
Рассчитать
концентрацию HClO,
при которой ее степень диссоциации
равна 0.2%. Вычислить рН такого раствора. -
Как
изменится рН раствора предыдущей
задачи, если к 2 л раствора прибавить 1
мл 2%- раствора KClO
(=1.013
г/мл)?
-
Какой
раствор имеет более кислую среду: 1%
-раствор HCl
(=1.003
г/мл) или 1%- раствор HClO4
(=1.005
г/мл)? -
Определить
константу диссоциации и степень
диссоциации NH4OH,
если рН его 0.1 М раствора равен 11.13. -
Рассчитать
концентрацию ионов аммония в растворе,
300 мл которого содержат 0.1 моля NH4OH
и 0.1 моля КОН.
-
Какую
массу гидроксида натрия необходимо
растворить в 3 л воды, чтобы рН полученного
раствора стал равен 11.5? -
Степень
диссоциации HClO
в растворе и рН раствора равны
соответственно 0.63% и 5.1. Рассчитать
концентрацию раствора и константу
диссоциации кислоты. -
Какую
массу КClO
надо добавить к 1 л раствора кислоты из
предыдущей задачи, чтобы концентрация
ионов водорода уменьшилась в 7 раз?
-
Вычислить
концентрацию ионов натрия и ионов
водорода в растворе, 200 мл которого
содержит 0.8 г гидроксида натрия. -
Определить
константу диссоциации NH4OH
и рН раствора, если степень диссоциации
этого основания в 0.2 М растворе равна
0.95%. -
В
каком объемном отношении следует
смешать растворы из заданий 15.1 и 15.2,
чтобы степень диссоциации NH4OH
уменьшилась в 20 раз?
-
Рассчитать
концентрации ионов калия и ионов HPO42-
в 3% -растворе K2HPO4
(=1.021
г/мл). -
Какой
объем воды необходимо прибавить к 20 мл
0.1 М- раствора NH4OH,
чтобы степень диссоциации этого
основания возросла в 10 раз? Как изменится
рН раствора? -
Как
изменится степень диссоциации NH4OH,
если к полученному в предыдущей задаче
раствору добавить 1 г NаOH?
-
Вычислить
концентрацию ионов бария и нитрат-ионов
в 0.003 М- растворе Ва(NО3)2. -
Рассчитать
концентрации ионов Н+,
Н2РО3—
и НРО32-
в 0.8 М- растворе фосфористой кислоты,
если ее константы диссоциации равны
Ка1=1.6
10-3
и Ка2=6.310-7. -
К
0.15 М- раствору NH4OH
добавили такое количество NH4Cl,
что концентрация соли в растворе стала
равна 0.2 моль/л. Рассчитать рН полученного
раствора.
-
Рассчитать
рН 0.2%- раствора азотной кислоты (=1.001
г/мл). -
Рассчитать
степень диссоциации и рН 0.1 М раствора
НСN. -
Рассчитать
концентрацию ионов СN—
в растворе, 2 л которого содержат 0.1 моля
НСN
и 0.0005 моля HCl.
-
Рассчитать
концентрацию ионов SO42-
в 3%- растворе Al2(SO4)3
(=1.025
г/мл). -
Рассчитать
степень диссоциации и концентрацию
угольной кислоты в растворе, если рН
раствора равен 4.5. -
Какую
массу азотной кислоты достаточно
растворить в 100 мл 0.02 М раствора угольной
кислоты, чтобы степень диссоциации
Н2СО3
уменьшилась в 150 раз?
-
Рассчитать
рН 0.1%- раствора соляной кислоты (=1.00
г/мл). -
Определить
константу диссоциации и степень
диссоциации HBrO,
если рН 0.001 М раствора этой кислоты
равен 5.85. -
Рассчитать
концентрацию ионов BrO—
в растворе, 200 мл которого содержат 0.01
моля HBrO
и 0.005 моля HBr.
-
Какую
массу LiOH
необходимо растворить в 1 л воды, чтобы
рН полученного раствора стал равен 11? -
Степень
диссоциации NH4OH
в растворе и рН раствора равны
соответственно 1.8% и 11. Рассчитать
концентрацию раствора и константу
диссоциации основания. -
Какую
массу NH4Cl
надо добавить к 1 л раствора предыдущей
задачи, чтобы концентрация ионов
водорода увеличилась в 10 раз?
-
Рассчитать
концентрацию ионов хлора в растворе,
в 100 л которого содержится 0.5 г ВаCl2. -
Определить
константу диссоциации HBrO
и рН раствора, если степень диссоциации
HBrO
в 0.01 М растворе равна 0.0447%. -
Какую
массу КBrO
необходимо добавить к 1 л раствора
предыдущей задачи, чтобы степень
диссоциации HBrO
уменьшилась в 10 раз?
-
Какую
массу азотной кислоты необходимо
растворить в 200 мл воды, чтобы рН
полученного раствора стал равен 2.5? -
Степень
диссоциации НСN
и рН раствора равны соответственно
0.089% и 6.05. Определить концентрацию
раствора и константу диссоциации
кислоты. -
Какую
массу КСN
необходимо добавить к 1 л раствора
предыдущей задачи, чтобы концентрация
ионов водорода уменьшилась в 200 раз?
-
Рассчитать
концентрации ионов калия и карбонат-ионов
в 5.2%- растворе К2СО3
(=1.044
г/мл). -
Какой
объем воды необходимо добавить к 10 мл
0.02 М раствора Н2СО3,
чтобы степень диссоциации кислоты
увеличилась в 2 раза? Как при этом
изменится рН раствора? -
Во
сколько раз изменится степень диссоциации
угольной кислоты в полученном в
предыдущей задаче растворе, если к нему
прибавить 0.001 г азотной кислоты?
-
Рассчитать
концентрации ионов алюминия и хлора в
0.2 М- растворе хлорида алюминия. -
Рассчитать
степень диссоциации H2S
и концентрацию кислоты, если рН раствора
равен 5.3. -
Какую
массу NaHS
достаточно растворить в 750 мл 0.001 М-
раствора H2S,
чтобы степень диссоциации кислоты
уменьшилась в 10 раз?
Соседние файлы в предмете Химия
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Решение: мембранный потенциал рассчитывается по формуле Нернста:
[ Delta varphi =frac{Rcdot T}{zcdot F}ln frac{{{C}_{c}}}{{{C}_{v}}}, ]
здесь: R = 8,31 Дж/(Моль∙К) — универсальная газовая постоянная, z = 1 — валентность иона хлора (основная), F = 9,65·104 Кл/моль – постоянная Фарадея, Cc – концентрация ионов снаружи (её требуется определить), Cv – концентрация внутри, T = 310 К – абсолютная температура. Тогда:
[ ln frac{{{C}_{c}}}{{{C}_{v}}}=frac{Delta varphi cdot zcdot F}{Rcdot T}, ]
[ frac{{{C}_{c}}}{{{C}_{v}}}={{e}^{frac{Delta varphi cdot zcdot F}{Rcdot T}}}, ]
[ {{C}_{c}}={{C}_{v}}cdot {{e}^{frac{Delta varphi cdot zcdot F}{Rcdot T}}}, ]
[ {{C}_{c}}=12cdot {{e}^{frac{75cdot {{10}^{-3}}cdot 1cdot 9,65cdot {{10}^{4}}}{8,31cdot 310}}}=12cdot {{e}^{2,8}}=12cdot 16,6=199,2. ]
Ответ: 199,2 мМоль/л.
Расчет концентрации ионов металлов и условия протекания реакций комплексных соединений
Задача 734.
Сколько молей аммиака должно содержаться в 1 л 0,1 М раствора [Ag(NH3)2]NO3, чтобы прибавление 1,5 г КСI к 1 л раствора не вызвало выпадения АgС1? ПР(AgCl) = 1,8 . 10-10.
Решение:
М(KCl) = 74,55г/моль. Находим концентрацию хлорида калия:
Теперь рассчитаем концентрацию ионов Ag+ из произведения растворимости AgCl, учитывая, что концентрация ионов равна концентрации KCl, получим:
Константа нестойкости иона [Ag(NH3)2]+ равна 9,3 . 10-9. Вторичная диссоциация комплексного иона протекает по схеме:
[Ag(NH3)2]+ = Ag+ + 2NH3
В присутствии избытка NH3, создаваемого в результате прибавления раствора аммиака, это равновесие смещено влево настолько, что количество NH3, образующегося при вторичной диссоциации, можно пренебречь. Тогда [NH3] = С(NH3 ) = 1 моль/л. По той же причине равновесная концентрация ионов [Ag(NH3)2]+ может быть приравнена общей концентрации комплексной соли (0,1 моль/л).
Выражение константы нестойкости комплексного иона [Ag(NH3)2]+ имеет вид:
Отсюда выражаем концентрацию в 0,1 М растворе комплексной соли [Ag(NH3)2]NO3:
Ответ: Чуть больше 1 моль/л.
Задача 735.
Какова концентрация ионов серебра в 0,08 М растворе [Ag(NH3)2]NO3, содержащем 1 моль/л аммиака? Сколько граммов NаСI можно прибавить к 1 л этого раствора до начала выпадения осадка АgС1? ПР(AgCl) = 1,8 . 10-10.
Решение:
М(NaCl) = 58,43г/моль. Константа нестойкости иона [Ag(NH3)2]+ равна 9,3 . 10-9. Вторичная диссоциация комплексного иона протекает по схеме:
[Ag(NH3)2]+ = Ag+ + 2NH3
В присутствии избытка NH3, создаваемого в результате прибавления раствора аммиака, это равновесие смещено влево настолько, что количество NH3, образующегося при вторичной диссоциации, можно пренебречь. Тогда
[NH3] = С(NH3 ) = 1 моль/л. По той же причине равновесная концентрация ионов [Ag(NH3)2]+ может быть приравнена общей концентрации комплексной соли (0,08 моль/л).
По условию задачи:
Отсюда выражаем концентрацию ионов Ag+:
Для того чтобы начал выпадать осадок соли AgCl при реакции:
[Ag(NH3)2]NO3 + NaCl = AgCl↓ + NaNO3 + 2NH3
необходимо чтобы произведение концентраций ионов Ag+ и Cl— было равно или больше ПР(AgCl), т.е. [Ag+] . [Cl—] = ПР(AgCl). Исходя из этого выражения, рассчитаем концентрацию ионов хлора, получим:
Следовательно, концентрация ионов хлора будет численно равна концентрации хлорида натрия ([Cl—] = [NaCl] = 2,4 . 10-2 моль/л), добавленного к раствору комплексной соли. Отсюда можно рассчитать массу хлорида натрия, получим:
m(NaCl) = [NaCl] . M(NaCl) = (2,4 . 10-2) . 58,43 = 1,4г.
Ответ: 1,4г.
Задача 736.
Константы нестойкости ионов [Ag(NO2)2]— и [Ag(CN)2]— соответственно равны 1.3 . 10-13 и 8 . 10-21. Каково соотношение равновесных концентраций ионов в растворах K[Ag(NO2)2](С1) и K[Ag(CN)2](Сl2) одинаковой молярной концентрации: а) С1 > С2; б) С1= С2; в) С1 < С2?
Решение:
Выражения констант нестойкости ионов имеют вид:
Вторичная диссоциация комплексных ионов:
Так как молярные концентрации комплексных солей одинаковы, то концентрационными величинами можно пренебречь, тогда
[Ag+](C1) = 1.3 . 10-13 моль/л); [Ag+](C2) = 8 . 10-21 моль/л).
Следовательно, С1 > С2.
Ответ: а).
Задача 737.
Иодид калия осаждает серебро в виде АgI из раствора [Ag(NH3)2]NO3, но не осаждает его из раствора K[Ag(CN)2] той же молярной концентрации. Каково соотношение между значениями констант нестойкости ионов[Ag(NH3)2]+(К1) и [Ag(CN)2]—(К2): а) К1 > К2; б) К1 = К2; в) К1 < К2?
Решение:
ПР(АgI) = 9,98 . 10-17.
Вторичная диссоциация комплексных ионов протекает по схемам:
Условие образование осадка АgI может быть записан следующим образом:
[Ag+] . [I—] = ПР(AgI) = 9,98 . 10-17.
В растворе комплексной соли при заданных условиях концентрации ионов Ag+ вычисляются из уравнения выражения констант нестойкости комплексных ионов, получим:
Концентрация ионов I— в обоих случаях одинакова, но в первом случае (К1 образуется осадок, а во втором случае (К2) – осадок не образуется. Поэтому можно записать:
K1 > ПР(АgI) — садок образуется;
K2 < ПР(АgI) — садок не образуется.
Отсюда К1 > K2.
Ответ: а).
Задача 738.
Константы нестойкости ионов [Ag(NH3)2]+ и [Сd(NH3)2+ близки по значению (соответственно 9,3 . 10-8 и 7,6 . 10-8). Указать правильные соотношения концентраций свободного иона металла С(Ag+) и С(Cd2+) в растворах [Ag(NH3)2]Cl и [Сd(NH3)Cl2 одинаковой молярной концентрации, содержащих, кроме того, 0,1 моль/л МН3: а) С(Ag+) > С(Cd2+); б) С(Ag+) = С(Cd2+); в) С(Ag+) < С(Cd2+).
Решение:
Вторичная диссоциация комплексных ионов протекает по следующим уравнениям:
В присутствии избытка NH3, создаваемого в результате прибавления раствора аммиака, это равновесие смещено влево настолько, что количество NH3, образующегося при вторичной диссоциации, можно пренебречь. Тогда [NH3] = С(NH3 ) = 0,1 моль/л. По той же причине равновесная концентрация ионов [Ag(NH3)2]+ и [Сd(NH3)2+ может быть приравнена общей концентрации комплексной соли, т.е. ими можно пренебречь.
По условию задачи:
Отсюда выражаем концентрацию ионов Ag+ и Cd2+:
Так как 9,3 . 10-8 < 7,6 . 10-8, то К1 < K2.
Ответ: в).
-
Кол-во молей хлорида натрия: 58,5 / (35,5+23) = 1 моль, тогда концентрация: 1 моль/1 л=1 моль/л. В молекуле хлорида натрия находится по одному атому хлора и натрия, тогда их концентрация равна концентрации хлорида натрия, т. е. 1 моль/л
- Комментировать
- Жалоба
- Ссылка
Найди верный ответ на вопрос ✅ «Вычислите молярную концентрацию ионов натрия и ионов хлора в растворе, в 1 л которого содержится хлорида натрия массой 58,5 г …» по предмету 📙 Химия, а если ответа нет или никто не дал верного ответа, то воспользуйся поиском и попробуй найти ответ среди похожих вопросов.
Искать другие ответы
Главная » Химия » Вычислите молярную концентрацию ионов натрия и ионов хлора в растворе, в 1 л которого содержится хлорида натрия массой 58,5 г
Концентрация — ион — хлор
Cтраница 1
Концентрация ионов хлора на поверхности образцов TJ — и 7-оксида алюминия отличается незначительно.
[1]
Концентрация ионов хлора в коррозионной среде ( см. рис. 22) также влияет на чувствительность алюминиевых сплавов к коррозионному растрескиванию.
[3]
Концентрация ионов хлора в щелочном растворе также играет важную роль в развитии коррозии. Скорость коррозионного растрескивания и развития коррозионно-устало-стных трещин, а также чувствительность к точечной коррозии существенно увеличиваются с ростом концентрации хлоридов в растворе.
[4]
Концентрация ионов хлора в насыщенном растворе хлорида калия постоянна, следовательно, потенциал каломельного электрода также постоянен.
[6]
Концентрация ионов хлора в насыщенном растворе хлористого калия постоянна, следовательно, потенциал каломельного электрода также будет постоянной величиной.
[7]
Концентрацию ионов хлора находят по калибровочному графику или методом добавок.
[8]
Концентрацию ионов хлора найдем, если к концентрации С1 — — ионов, создаваемой хлористым калием, прибавим концентрацию С1 — — ионов, получающуюся от диссоциации хлористого серебра, которая, очевидно, равна концентрации ионов серебра.
[9]
Концентрацию иона хлора определяют аргенто-метрическим методом.
[10]
Поскольку концентрация иона хлора фиксирована, потенциал хлорсе-ребряного электрода не меняется; его называют электродом сравнения.
[11]
Сравнивая концентрации ионов хлора и сульфата в воде Волги и Москвы-реки, легко убедиться в большей агрессивности воды Волги. Кроме того, в волжской воде меньше гидрокарбонатных ионов ( 73 мг / л), чем в воде Москвы-реки ( до 250 мг / л НСО-Г) Последнее свидетельствует о меньшей способности волжской воды образовывать на поверхности металла гидроокисно-карбонатные пленки, обладающие защитными свойствами. Вывод о большей агрессивности волжской воды, поступающей в г. Москву, по сравнению с водой Москвы-реки, подтверждается результатами наблюдений за коррозией гидротехнических сооружений на Москве-реке и канале им.
[12]
При концентрации ионов хлора 0 5 г-ион / л расход окислителя составляет 2 моля на аллильную группировку, при этом также образуется хлористый аллил, концентрация которого в ходе опыта падает, что, вероятно, связано с его более глубоким окислением под действием хлористого палладия.
[13]
Увеличение концентрации ионов хлора может привести к образованию монохло.
[14]
Возрастание концентрации ионов хлора и никеля в электролите вызывает снижение поляризации при выделении никеля, что в свою очередь, приводит к повышению скорости разряда никеля, а следовательно, к увеличению выхода никеля по току. Для повышения катодной плотности тока концентрацию ионов никеля в электролите поддерживают близкой к насыщенной.
[15]
Страницы:
1
2
3
4