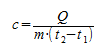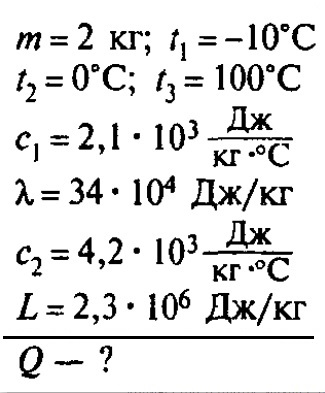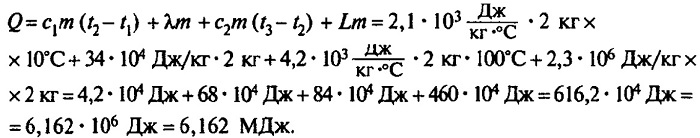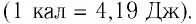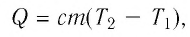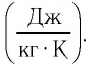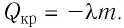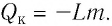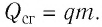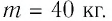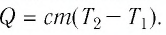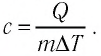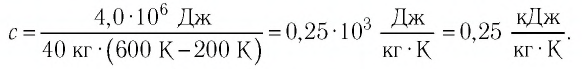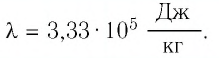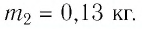Что такое тепло?
Начнем с вопроса одновременно легкого и сложного: что такое тепло?
Теплом называется природная энергия, которая создается беспорядочным движением частиц тела (атомов, молекул и т. п.) и проявляется в нагревании этого тела.
Такое определение не было известно людям сразу. Например, было такое предположение: теплота — это невидимая, невесомая жидкость, которая притекает в физические тела. И чем больше объем этой жидкости, тем тело горяче́е. Конечно же, эта гипотеза не нашла подтверждения.
Позже ученые обратили внимание на поведение молекул при нагревании или охлаждении тела. С ростом температуры скорость молекул возрастает, они чаще сталкиваются друг с другом. При этом растет потенциальная и кинетическая энергия, а значит, и внутренняя, что проявляется в буквальном нагревании тела. Такое хаотичное движение молекул называют тепловым движением.
Тепловое движение — процесс хаотичного движения частиц, образующих вещество.
Логично предположить: раз с ростом температуры скорость молекул увеличивается, то при понижении температуры скорость будет падать. Но возможна ли полная остановка движения? До какой температуры следует охладить тело в таком случае?
Чтобы это произошло, потребуется охладить тело до абсолютного нуля по шкале Кельвина, что соответствует −273,15 °C, или −459,67 °F. Молекулы в таких условиях прекратят движение и замрут в узлах кристаллической решетки. Но достичь такого температурного режима невозможно ни на планете Земля, ни во всей Вселенной, ни даже в лабораторных условиях.
Получай лайфхаки, статьи, видео и чек-листы по обучению на почту
Узнай, какие профессии будущего тебе подойдут
Пройди тест — и мы покажем, кем ты можешь стать, а ещё пришлём подробный гайд, как реализовать себя уже сейчас
Каким образом можно нагреть вещество?
На самом деле способов больше, чем один. Телу можно передать тепло непосредственно или же изменить его внутреннюю энергию, совершив над ним работу.
Теплопередача
К видам теплопередачи относятся теплопроводность, конвекция и излучение. Чтобы лучше понять, чем отличается один тип от другого, давайте разберем примеры.
-
Теплопроводность. Представьте, что ваши руки замерзли и вы держите в руках кружку кофе, чтобы их согреть. В таком случае тепло от более нагретого тела (кружки) передается менее нагретому (вашим рукам), до тех пор пока температура двух объектов не станет одинаковой. Так, горячая вода отдает свое тепло холодной при смешивании, а суп нагревает холодную ложку, если ее оставить в тарелке. Только аккуратно, не обожгитесь!
-
Конвекция — вид теплообмена, при котором внутренняя энергия передается струями и потоками самого вещества. Проще говоря, это процесс, который происходит в жидкостях и газах, когда слои вещества разной температуры перемешиваются. На этом принципе основано отопление помещения и проветривание комнаты. Кстати, ветры, дующие над поверхностью земного шара, — это тоже пример конвекции.
-
Излучение. Догадывались ли вы, что мы сталкиваемся с этим типом теплопередачи каждый день? Именно день, ведь солнечный свет излучает тепло с помощью электромагнитных волн, что делает жизнь на планете Земля возможной. По правде говоря, любое нагретое тело может стать источником тепла (человек, животные, свеча, костер, звезды). Это можно увидеть с помощью особого прибора — тепловизора.
Совершение работы над веществом
Здесь мы тоже не обойдемся без понятного примера. Возьмем пробирку с керосином, обыкновенный шнурок и термометр. Замерим начальную температуру и начнем натирать пробирку шнурком. Что произойдет с температурой? Она начнет возрастать. Это происходит благодаря теплопередаче? Или, может, невидимое излучение заставляет керосин нагреваться? Нет, мы изменили температуру вещества, совершив над ним работу.
Итак, подведем промежуточные итоги:
-
Тепло — это энергия, которая создается тепловым движением молекул.
-
Тепловое движение — процесс хаотичного движения частиц, образующих вещество.
-
С ростом температуры растет и скорость движения молекул, а полностью остановить это движение практически невозможно.
-
Изменить температуру тела можно двумя способами: с помощью теплопередачи или изменения внутренней энергии тела при совершении над ним работы.
Понятие тепловых явлений
Тепловые явления — это физические процессы, протекающие в телах при их нагревании или охлаждении. То есть это те явления, которые происходят с телами по мере изменения их температуры.
Давайте сделаем небольшую остановку на этом физическом понятии, а потом продолжим.
Температура — мера нагретости тела. Ее можно измерить с помощью термометра, или по-простому градусника. У этого прибора есть множество разновидностей, но в быту чаще всего пользуются ртутными (для измерения температуры человеческого тела), жидкостными (для измерения температуры воздуха или жидкости) и электронными термометрами.
В мире используют несколько температурных шкал: Цельсия, Кельвина и Фаренгейта. На онлайн-уроках физики в школе Skysmart вы подробнее познакомитесь с ними и научитесь легко переводить значения из одной шкалы в другую!
Какие бывают тепловые явления?
Давайте поразмышляем о том, что может происходить с телом под действием температуры. Для этого не придется идти далеко: достанем из холодильника кубик льда, опустим его в стакан и посмотрим, что получится. Спустя какое-то время лед начнет таять (или плавиться) и превратится в воду. Но на этом мы не остановимся! Перельем воду в кастрюлю и начнем нагревать на плите. Что произойдет тогда?
Абсолютно верно! Вода начнет нагреваться, а дальше — кипеть. Если вовремя не выключить плиту или не снять с нее кастрюлю, вся вода может выкипеть — превратиться в водяной пар.
За короткий промежуток времени мы смогли пронаблюдать воду в трех агрегатных состояниях: твердом, жидком и газообразном. А можно ли обратить процесс вспять и снова получить кубик льда?
Так просто это сделать не получится: должно быть, весь водяной пар разлетелся по квартире, и его будет очень сложно собрать воедино. Но это не говорит о том, что процесс перехода из одного агрегатного состояния в другое необратим.
Предположим, нам удастся добыть целый литр водяного пара. Охлаждая его, мы заметим, как пар конденсируется — превращается в капельки жидкости. А получить лед совсем просто, если поместить полученную жидкость в морозильную камеру.
Если внимательно проанализировать опыт, вы заметите, что переход из одного агрегатного состояния в другое не происходит мгновенно. Для этого необходимо нагреть или охладить вещество до определенной температуры, причем для каждого вещества эти температуры разные. Так, лед начинает таять при 0 °С, а железо плавится аж при 1 538 °С.
А как называются процессы, связанные с повышением и понижением температуры? Сколько их всего?
Начнем с самого легкого. Процессы, связанные с нагреванием или охлаждением, так и называются. Напомним, что эти процессы не ведут к изменению агрегатного состояния, а, можно сказать, являются подготовкой к нему.
Плавление — процесс перехода из твердого состояния в жидкое. А обратный процесс, когда жидкость превращается в твердое тело, называется кристаллизацией (или затвердеванием). Для этих процессов необходимо достичь одной и той же температуры вещества. То есть лед начнет плавиться при нуле градусов, но одновременно с этим вода начнет кристаллизоваться при этой температуре.
Парообразование (кипение) — процесс перехода жидкости в газ, а конденсация — обратный процесс перехода газа в жидкость. Для этих процессов также существует одна и та же температура. Ртуть кипит при температуре 356,7 °С, и при этой же температуре пары ртути превращаются в жидкость.
Отдельно выделим процесс сгорания вещества. Это явление также является тепловым, но, к сожалению, оно необратимо.
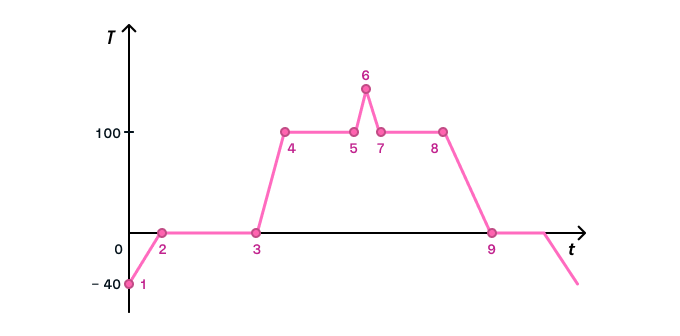
Рассмотрим график фазовых переходов для воды:
Обратите внимание на то, как одно тепловое явление сменяет другое.
Согласно графику, в начале опыта мы берем лед при температуре −40 °С и начинаем его нагревать. График этого процесса представлен наклонной прямой 1–2.
Достигнув 0 °С (точка 2), лед начинает таять. Для этого процесса не нужно увеличивать температуру, достаточно 0 °С, но понадобится время, чтобы процесс завершился. Поэтому плавление льда на графике представлено прямой линией 2–3, параллельной оси абсцисс.
Мы продолжаем нагревать воду (наклонная линия графика 3–4) до 100 °С — в этой точке начинается кипение. Если мы хотим показать на графике, что процесс кипения продолжается, от точки 100 °С мы бы провели прямую линию, параллельную оси абсцисс (4–5), а нагревание водяного пара выглядело бы как наклонная линия 5–6 (схожая с подобными процессами, уже представленными на графике).
Пойдем в обратном направлении: на графике процесс 6–7 — охлаждение пара, 7–8 — конденсация, 8–9 — охлаждение жидкости, 9–10 — кристаллизация, а дальше — охлаждение твердого тела.
Итого к тепловым явлениям относятся 7 процессов: сгорание, нагревание, охлаждение, кипение (парообразование), конденсация, плавление, кристаллизация (затвердевание).
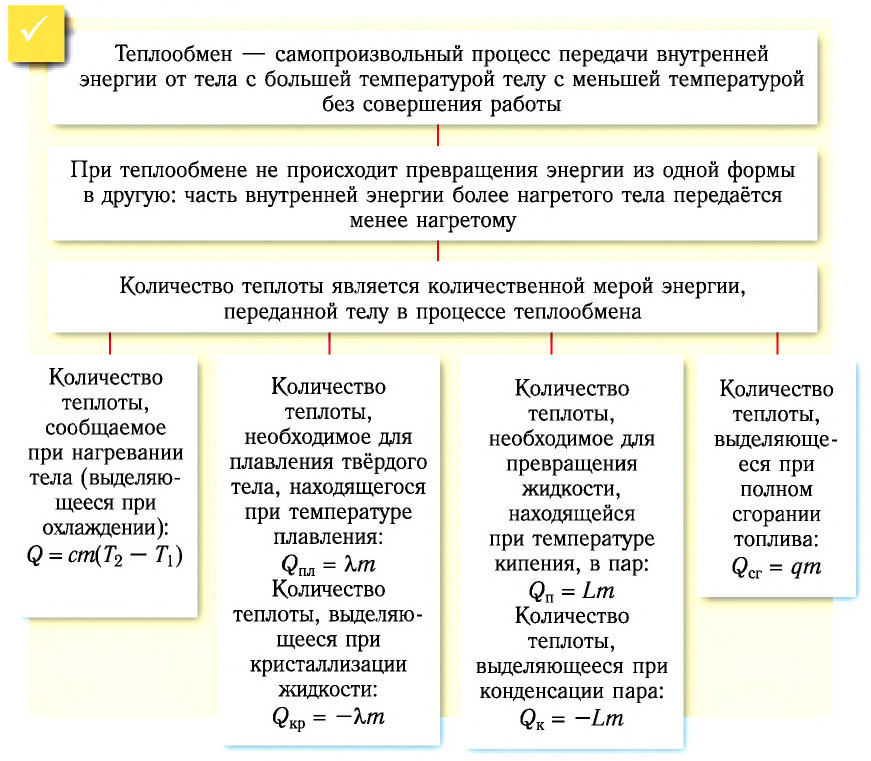
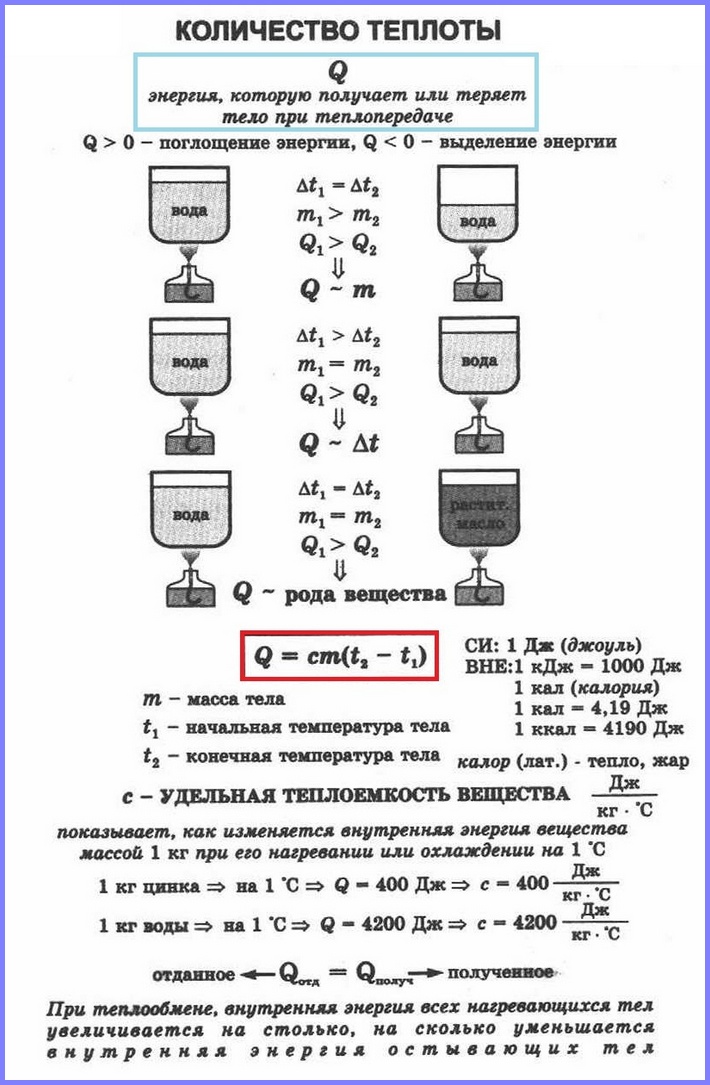
Формулы для расчета количества теплоты
Количество теплоты, которое необходимо для возникновения процесса или выделяется при нем, можно рассчитать по формулам.
Количество теплоты, необходимое для нагревания тела или выделяющееся при охлаждении
Q = cmΔt
Q — количество теплоты [Дж]
c — удельная теплоемкость вещества, из которого состоит тело [Дж/(кг·°C)]
m — масса тела [кг]
Δt — изменение температуры тела [°C]
Отдельно поговорим про с — удельную теплоемкость вещества. Это табличная величина, т. е. ее значение для каждого вещества различается, оно постоянно и его можно найти в конце учебника по физике или в интернете.
Количество теплоты, необходимое для плавления или выделяющееся при кристаллизации
Q = λm
Q — количество теплоты, необходимое для плавления кристаллического тела, находящегося при температуре плавления в нормальном атмосферном давлении [Дж]
m — масса тела [кг]
λ — удельная теплота плавления вещества, из которого состоит тело [Дж/кг]
Количество теплоты, необходимое для кипения или выделяющееся при конденсации
Q = Lm
Q — количество теплоты, необходимое для превращения в пар жидкости (выделяющееся при конденсации пара), находящейся при температуре кипения и нормальном атмосферном давлении [Дж]
m — масса тела [кг]
L — удельная теплота парообразования жидкости [Дж/кг]
Количество теплоты, выделяющееся при полном сгорании топлива
Q = qm
Q — количество теплоты, выделяющееся при полном сгорании топлива [Дж]
q — удельная теплота сгорания топлива [Дж/кг]
m — масса топлива [кг]
Как вы можете заметить, все формулы имеют одну и ту же логику: энергия Q прямо пропорциональна массе тела и удельным величинам. А значит, чем больше масса тела, тем больше энергии потребуется для его нагревания. Чем меньше тело, тем меньше энергии выделится при его остывании, и т. д.
Тепловые явления встроены в нашу жизнь на все сто процентов. Все — от кулинарии до погодных явлений, от медицины до промышленности — в той или иной мере зависит от процессов нагревания, плавления, кипения и других.
Мы можем плавить металлы и изготавливать из них различные предметы, повышать влажность воздуха, кипятить воду и выпекать булочки, изготавливать микросхемы и лекарства. Какой процесс ни возьмете, во всех можно отыскать примеры тепловых явлений.
Тепловые процессы в физике связаны между собой. Порой нагревание одного вещества влечет за собой плавление и даже кипение другого. Заинтригованы? Приходите на онлайн-уроки физики в школу Skysmart — там вы сможете детально разобраться в этом и других поразительных процессах.
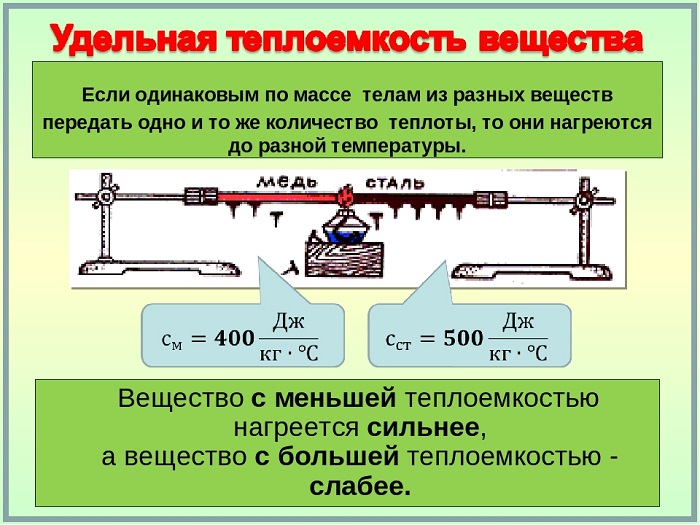
Физика под удельной теплоемкостью понимает количество теплоты, которое термодинамическое вещество или система способно поглотить до повышения температуры.
Определение из учебника говорит, что это количество тепла, необходимое для создания температуры при нагревании.
Количество теплоты
Единица измерения — джоуль. Другой распространенной формой измерения является использование калорий.
Обозначается латинской буквой Q.
Удельная теплоемкость вещества
Это физическая величина, выражающая количество тепла, необходимое веществу на единицу массы для повышения температуры на одну единицу.
Таким образом, удельная теплоёмкость является свойством вещества, поскольку его значение является репрезентативным для каждого вещества, каждое из которых, в свою очередь, имеет различные значения в зависимости от того, в каком состоянии оно находится (жидкое, твердое или газообразное).
Удельная теплоёмкость обозначается маленькой буквой c и измеряется в Дж/кг∗°С, представляет собой коэффициент повышения температуры в одной единице всей системы или всей массы вещества.
Кроме того, удельная теплоёмкость меняется в зависимости от физического состояния вещества, особенно в случае твердых частиц и газов, поскольку его молекулярная структура влияет на теплопередачу в системе частиц. То же самое относится и к условиям атмосферного давления: чем выше давление, тем ниже удельное тепло.
Основной состав удельной теплоты вещества должен быть с = С/m, т. е. удельная теплота равна соотношению калорийности и массы. Однако когда это применяется к данному изменению температуры, говорят о средней удельной теплоемкости, которая рассчитывается на основе следующей формулы:
где:
Q — передача тепловой энергии между системой и средой (Дж);
m — масса системы (кг);
Δt или (t2 — t1) — повышение температуры, которой она подвергается (°C).
Формула для нахождения количества теплоты Q:
Q = c∗m(t2 — t1)
Чем выше удельная теплоёмкость вещества, тем больше тепловой энергии потребуется, чтобы его температура повысилась. Например, для нагрева воды (своды = 4200 Дж/кг∗°С) потребуется больше тепловой энергии, чем для нагрева свинца (ссвинца = 140 Дж/кг∗°С).
Уравнение теплового баланса:
Q отданное + Q полученное = 0.
Ниже представлена таблица значений удельной теплоёмкости некоторых веществ:
Примеры решения задач
Следующие задачи покажут примеры расчета необходимого количества теплоты.
Задача №1
Сколько теплоты нужно, чтобы изо льда массой 2 кг, взятого при температуре -10°С, получить пар при 100°С?
Решение:
Ответ: чтобы изо льда массой 2 кг, взятого при температуре -10°С, получить пар при 100°С, нужно взять 6,162 мегаджоулей теплоты.
Задача №2
В железный котёл массой 5 кг налита вода массой 10 кг. Какое количество теплоты нужно передать котлу с водой для изменения их температуры от 10 до 100°С?
Начнем решение и отметим, что нагреваться будет и котёл, и вода. Разница температур составит 1000С — 100С = 900С. Т. е. и температура котла изменится на 90 градусов, и температура воды также изменится на 90 градусов.
Количества теплоты, которые получили оба объекта (Q1
– для котла и Q2 — для воды), не будут одинаковыми. Мы найдем общее количество теплоты по формуле теплового баланса Q = Q1 + Q2.
Содержание:
Количество теплоты:
В чём причина изменения внутренней энергии макроскопического тела при теплообмене?
Теплообмен
Другим способом изменения внутренней энергии термодинамической системы является теплообмен.
Теплообмен — самопроизвольный процесс передачи внутренней энергии от тела с большей температурой телу с меньшей температурой без совершения работы.
Теплообмен между контактирующими телами называют теплопередачей. За счёт переданной при этом энергии увеличивается внутренняя энергия одного тела и уменьшается внутренняя энергия другого. Если, например, привести в соприкосновение два тела с разными температурами, то частицы более нагретого тела будут передавать часть своей кинетической энергии частицам менее нагретого тела. В результате внутренняя энергия одного тела уменьшается, а другого увеличивается.
Таким образом, при теплопередаче не происходит превращения энергии из одной формы в другую: часть внутренней энергии более нагретого тела передаётся менее нагретому.
Количество теплоты и удельная теплоёмкость
Количественной мерой энергии, сообщённой телу (или отданной им) в процессе теплообмена, является количество теплоты.
В СИ единицей количества теплоты Q является джоуль (Дж). Иногда для измерения количества теплоты используют внесистемную единицу — калорию
Если процесс теплообмена не сопровождается изменением агрегатного состояния вещества, то
где 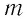
Удельная теплоёмкость зависит от свойств данного вещества и, как показывает опыт, в достаточно большом интервале температур практически не изменяется. Однако удельная теплоёмкость газа зависит от того, при каком процессе (изобарном или изохорном) осуществляется теплообмен.
Интересно знать:
Физическая величина, равная произведению массы тела на удельную теплоёмкость вещества, носит название теплоёмкость тела. Обозначают теплоёмкость С и измеряют в джоулях, деленных на кельвин 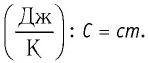
Удельная теплота плавления
Физическую величину, численно равную количеству теплоты, необходимому для превращения кристаллического вещества массой 1 кг, взятого при температуре плавления, в жидкость той же температуры, называют удельной теплотой плавления 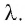
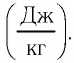
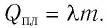
Удельная теплота парообразования
Физическую величину, численно равную количеству теплоты, которое необходимо передать жидкости массой 1 кг, находящейся при температуре кипения, для превращения её при постоянной температуре в пар, называют удельной теплотой парообразования L. Единицей измерения этой величины является джоуль, делённый на килограмм 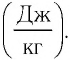
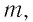
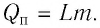
Удельная теплота сгорания топлива
Физическую величину, численно равную количеству теплоты, выделяющемуся при полном сгорании топлива массой 1 кг, называют удельной теплотой сгорания 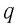
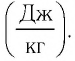
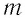
Это количество теплоты передаётся телам, образующим термодинамическую систему, и по отношению к ним является положительной величиной.
- Заказать решение задач по физике
Примеры решения задач
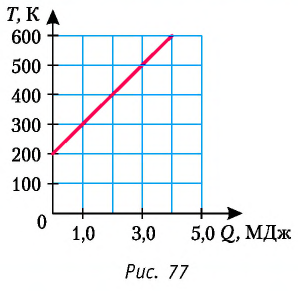
Пример №1
На рисунке 77 представлен график зависимости абсолютной температуры нагреваемого тела от переданного ему количества теплоты. Воспользовавшись таблицей на с. 84, определите вещество, из которого изготовлено тело, если его масса
Решение:
Для того чтобы определить вещество, из которого изготовлено тело, найдём его удельную теплоёмкость с. Анализируя график, делаем вывод, что при нагревании тела от температуры 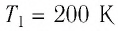
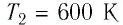
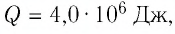
Следовательно, удельная теплоёмкость вещества
Полученное значение удельной теплоёмкости соответствует олову.
Ответ: 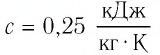
Пример №2
В налитую в сосуд воду, масса которой 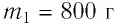
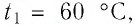
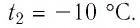
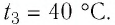
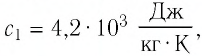
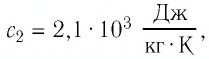
Решение:
Ответ:
- Расчет количества теплоты при нагревании и охлаждении
- Удельная теплота сгорания топлива
- Плавление и кристаллизация в физике
- Испарение жидкостей в физике
- Конвекция в физике
- Излучение тепла в физике
- Виды излучений в физике
- Инфракрасные излучения
«Количество теплоты. Удельная теплоёмкость»
Количество теплоты
Изменение внутренней энергии путём совершения работы характеризуется величиной работы, т.е. работа является мерой изменения внутренней энергии в данном процессе. Изменение внутренней энергии тела при теплопередаче характеризуется величиной, называемой количествоv теплоты.
Количество теплоты – это изменение внутренней энергии тела в процессе теплопередачи без совершения работы. Количество теплоты обозначают буквой Q.
Работа, внутренняя энергия и количество теплоты измеряются в одних и тех же единицах — джоулях (Дж), как и всякий вид энергии.
В тепловых измерениях в качестве единицы количества теплоты раньше использовалась особая единица энергии — калория (кал), равная количеству теплоты, необходимому для нагревания 1 грамма воды на 1 градус Цельсия (точнее, от 19,5 до 20,5 °С). Данную единицу, в частности, используют в настоящее время при расчетах потребления тепла (тепловой энергии) в многоквартирных домах. Опытным путем установлен механический эквивалент теплоты — соотношение между калорией и джоулем: 1 кал = 4,2 Дж.
При передаче телу некоторого количества теплоты без совершения работы его внутренняя энергия увеличивается, если тело отдаёт какое-то количество теплоты, то его внутренняя энергия уменьшается.
Если в два одинаковых сосуда налить в один 100 г воды, а в другой 400 г при одной и той же температуре и поставить их на одинаковые горелки, то раньше закипит вода в первом сосуде. Таким образом, чем больше масса тела, тем большее количество тепла требуется ему для нагревания. То же самое и с охлаждением.
Количество теплоты, необходимое для нагревания тела зависит еще и от рода вещества, из которого это тело сделано. Эта зависимость количества теплоты, необходимого для нагревания тела, от рода вещества характеризуется физической величиной, называемой удельной теплоёмкостью вещества.
Удельная теплоёмкость
Удельная теплоёмкость – это физическая величина, равная количеству теплоты, которое необходимо сообщить 1 кг вещества для нагревания его на 1 °С (или на 1 К). Такое же количество теплоты 1 кг вещества отдаёт при охлаждении на 1 °С.
Удельная теплоёмкость обозначается буквой с. Единицей удельной теплоёмкости является 1 Дж/кг °С или 1 Дж/кг °К.
Значения удельной теплоёмкости веществ определяют экспериментально. Жидкости имеют большую удельную теплоёмкость, чем металлы; самую большую удельную теплоёмкость имеет вода, очень маленькую удельную теплоёмкость имеет золото.
Поскольку кол-во теплоты равно изменению внутренней энергии тела, то можно сказать, что удельная теплоёмкость показывает, на сколько изменяется внутренняя энергия 1 кг вещества при изменении его температуры на 1 °С. В частности, внутренняя энергия 1 кг свинца при его нагревании на 1 °С увеличивается на 140 Дж, а при охлаждении уменьшается на 140 Дж.
Количество теплоты Q, необходимое для нагревания тела массой m от температуры t1°С до температуры t2°С, равно произведению удельной теплоёмкости вещества, массы тела и разности конечной и начальной температур, т.е.
Q = c ∙ m (t2 — t1)
По этой же формуле вычисляется и количество теплоты, которое тело отдаёт при охлаждении. Только в этом случае от начальной температуры следует отнять конечную, т.е. от большего значения температуры отнять меньшее.
Это конспект по теме «Количество теплоты. Удельная теплоёмкость». Выберите дальнейшие действия:
- Перейти к следующему конспекту: «Уравнение теплового баланса»
- Вернуться к списку конспектов по Физике
- Посмотреть решение типовых задач на количество теплоты
Содержание:
- Определение и формула количества теплоты
- Формула расчета теплоты при изменении температуры
- Формула количества теплоты при фазовых переходах
- Единицы измерения количества теплоты
- Примеры решения задач
Определение и формула количества теплоты
Внутреннюю энергию термодинамической системы можно изменить двумя способами:
- совершая над системой работу,
- при помощи теплового взаимодействия.
Передача тепла телу не связана с совершением над телом макроскопической работы. В данном случае изменение внутренней энергии вызвано тем,
что отдельные молекулы тела с большей температурой совершают работу над некоторыми молекулами тела, которое имеет меньшую температуру. В этом
случае тепловое взаимодействие реализуется за счет теплопроводности. Передача энергии также возможна при помощи излучения. Система
микроскопических процессов (относящихся не ко всему телу, а к отдельным молекулам) называется теплопередачей. Количество энергии,
которое передается от одного тела к другому в результате теплопередачи, определяется количеством теплоты, которое предано от одного тела другому.
Определение
Теплотой называют энергию, которая получается (или отдается) телом в процессе теплообмена с окружающими телами (средой).
Обозначается теплота, обычно буквой Q.
Это одна из основных величин в термодинамике. Теплота включена в математические выражения первого и второго начал термодинамики.
Говорят, что теплота – это энергия в форме молекулярного движения.
Теплота может сообщаться системе (телу), а может забираться от нее. Считают, что если тепло сообщается системе, то оно положительно.
Формула расчета теплоты при изменении температуры
Элементарное количество теплоты обозначим как $delta Q$. Обратим внимание,
что элемент тепла, которое получает (отдает) система при малом изменении ее состояния не является полным дифференциалом.
Причина этого состоит в том, что теплота является функцией процесса изменения состояния системы.
Элементарное количество тепла, которое сообщается системе, и температура при этом меняется от Tдо T+dT, равно:
$$delta Q=C d T(1)$$
где C – теплоемкость тела. Если рассматриваемое тело однородно, то формулу (1) для количества теплоты можно представить как:
$$delta Q=c m d T=nu c_{mu} d T(2)$$
где $c=frac{C}{m}$ – удельная теплоемкость тела, m – масса тела,
$c_{mu}=c cdot mu$ — молярная теплоемкость,
$mu$ – молярная масса вещества,
$nu=frac{m}{mu}$ – число молей вещества.
Если тело однородно, а теплоемкость считают независимой от температуры, то количество теплоты
($Delta Q$), которое получает тело при увеличении его температуры на величину
$Delta t = t_2 — t_1$ можно вычислить как:
$$Delta Q=c m Delta t(3)$$
где t2, t1 температуры тела до нагрева и после. Обратите внимание, что температуры при нахождении разности
($Delta t$) в расчетах можно подставлять как в градусах Цельсия, так и в кельвинах.
Формула количества теплоты при фазовых переходах
Переход от одной фазы вещества в другую сопровождается поглощением или выделением некоторого количества теплоты,
которая носит название теплоты фазового перехода.
Так, для перевода элемента вещества из состояния твердого тела в жидкость ему следует сообщить количество теплоты
($delta Q$) равное:
$$delta Q=lambda d m$$
где $lambda$ – удельная теплота плавления, dm – элемент массы тела.
При этом следует учесть, что тело должно иметь температуру, равную температуре плавления рассматриваемого вещества.
При кристаллизации происходит выделение тепла равного (4).
Количество теплоты (теплота испарения), которое необходимо для перевода жидкости в пар можно найти как:
$$delta Q=r d m$$
где r – удельная теплота испарения. При конденсации пара теплота выделяется. Теплота испарения равна теплоте конденсации одинаковых масс вещества.
Единицы измерения количества теплоты
Основной единицей измерения количества теплоты в системе СИ является: [Q]=Дж
Внесистемная единица теплоты, которая часто встречается в технических расчетах. [Q]=кал (калория). 1 кал=4,1868 Дж.
Примеры решения задач
Пример
Задание. Какие объемы воды следует смешать, чтобы получить 200 л воды при температуре t=40С, если температура
одной массы воды t1=10С, второй массы воды t2=60С?
Решение. Запишем уравнение теплового баланса в виде:
$$Q=Q_{1}+Q_{2}(1.1)$$
где Q=cmt – количество теплоты приготовленной после смешивания воды; Q1=cm1t1 —
количество теплоты части воды температурой t1 и массой m1;
Q2=cm2t2— количество теплоты части воды температурой t2 и массой m2.
Из уравнения (1.1) следует:
$$
begin{array}{l}
mathrm{cmt}=mathrm{cm}_{1} t_{1}+mathrm{~cm}_{2} t_{2} rightarrow mathrm{mt}=mathrm{m}_{1} t_{1}+mathrm{~m}_{2} t_{2} rightarrow \
rightarrow rho mathrm{Vt}=rho V_{1} t_{1}+rho mathrm{V}_{2} t_{2} rightarrow mathrm{Vt}=V_{1} t_{1}+V_{2} t_{2}(1.2)
end{array}
$$
При объединении холодной (V1) и горячей (V2) частей воды в единый объем (V) можно принять то, что:
$$$
V=V_{1}+V_{2}(1.3)
$$$
Так, мы получаем систему уравнений:
$$
left{begin{array}{c}
V t=V_{1} t_{1}+V_{2} t_{2} \
V=V_{1}+V_{2}
end{array}right.
$$
Решив ее получим:
$$
begin{array}{l}
V_{1}=frac{left(t_{2}-tright)}{t_{2}-t_{1}} V \
V_{2}=frac{left(t-t_{1}right)}{t_{2}-t_{1}} V
end{array}
$$
Проведем вычисления (это можно сделать, не переходя в систему СИ):
$$
begin{array}{l}
V_{1}=frac{(60-40)}{60-10} 200=80 text { (л) } \
V_{2}=frac{(40-10)}{60-10} 200=120 text { (л) }
end{array}
$$
Ответ. V1=80 л, V2=120 л.

236
проверенных автора готовы помочь в написании работы любой сложности
Мы помогли уже 4 430 ученикам и студентам сдать работы от решения задач до дипломных на отлично! Узнай стоимость своей работы за 15 минут!
Пример
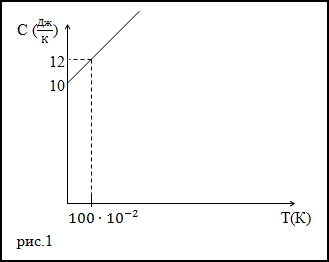
Задание. Теплоемкость тела изменяется по линейному закону (рис.1) в зависимости от абсолютной температуры в
рассматриваемом интервале $T_{1} leq T leq T_{2}$ .
Какое количество теплоты получает тело, если T1=300 К, T2=400 К.
Решение. Исследуя график функции теплоемкости (C(T)) (рис.1) запишем его аналитическое выражение, оно получится:
$C(T)=10+2 cdot 10^{-2} T$ (Дж/К)
Основой для решения задачи послужит формула для количества теплоты в виде:
$$delta Q=C d T(2.2)$$
Подставим полученное выражение для теплоемкости (2.1) в формулу (2.2) поведем интегрирование в заданном интервале температур:
$$
begin{array}{c}
Delta Q=int_{300}^{400}left(10+2 cdot 10^{-2} Tright) d T=left.left(10 cdot T+10^{-2} T^{2}right)right|_{300} ^{400}= \
=left(10 cdot 400+10^{-2} cdot(400)^{2}right)-left(10 cdot 300+10^{-2} cdot(300)^{2}right)=1700left(mathrm{~A}^{*}right)
end{array}
$$
Ответ. $Delta Q$=1700 Дж
Читать дальше: Формула напряженности магнитного поля.