Количество растворенного вещества : = c•V, где c – молярная концентрация растворенного вещества в моль/л, V – объем раствора в л. где m(р-ра) – масса раствора в г, – массовая доля растворенного вещества.
Как найти количество вещества через массовую долю?
Перемножив массовую долю с массой раствора: m = m(р—ра) × ω.
…
Для его нахождения нужно основываться на условии задачи, так как вычислить количество вещества можно по трём формулам:
- По массе. n=m/M — Массу вещества (в граммах) разделить на его молярную массу (в г/моль).
- По объёму. …
- По числу молекул.
Как найти массу вещества для приготовления раствора?
Масса раствора определяется по формуле m (раствора)= m (масса растворенного вещества)/ w (массовая доля растворенного вещества). Или m = r (плотность раствора — г/см3) * V (объем раствора).
Как вычислить концентрацию вещества в растворе?
Определяется по формуле: СМ= ν / V, (моль/л). Величина молярной концентрации показывает, сколько моль вещества содержится в 1 литре раствора.
Как найти массу если есть объем?
Масса тела зависит от его объема и плотности вещества, из которого состоит данное тело. — Как найти объем тела, если известна его масса и вещество, из которого состоит тело? Чтобы найти массу тела нежно его плотность умножить на объем. Чтобы найти объем тела, нужно его массу разделить на плотность.
Как найти массу вещества формула?
И наоборот, массу вещества определяют как произведение молярной массы на количество вещества: m = n . M. Так, масса 0,1 моля Na составляет 0,1 моль×23 г/моль = 2,3 Молярная масса численно всегда совпадает с молекулярной массой (или атомной массой — если вещество состоит не из молекул, а из атомов).
Как найти количество вещества газа?
n ( X ) = V ( X ) V m — химическое количество газа можно вычислить, если его объём разделить на молярный объём.
Как сделать процентный раствор?
Если вы хотите получить 1-процентный раствор любого вещества, то растворяете 10 г вещества в литре воды (или 100 г в 10 литрах). Соответственно, 2-процентный раствор содержит 20 г вещества в литре воды (200 г в 10 литрах) и так далее.
Как приготовить водный раствор вещества определенной концентрации?
ПРИГОТОВЛЕНИЕ РАСТВОРА ЗАДАННОЙ КОНЦЕНТРАЦИИ СМЕШИВАНИЕМ РАСТВОРОВ БОЛЕЕ ВЫСОКОЙ И БОЛЕЕ НИЗКОЙ КОНЦЕНТРАЦИИ. Раствор можно готовить, непосредственно вводя рассчитанное количество вещества в растворитель, или путем разбавления более концентрированных растворов до требуемого значения концентрации.
Как определить количество сухого вещества в растворе?
По определению концентрации чистого вещества в растворе – это количество граммов в 100мл. Следовательно, для расчета количества вещества в 1мл раствора необходимо имеющуюся массу чистого вещества в растворе разделить на 100. Ответ: 0,125г – доза сухого вещества в растворе.
Как определить процентное содержание вещества в растворе?
Таким образом расчет ведется по простой формуле:
- C (грамм) = (P * V) / 100, где
- P — процентное содержание, %,
- V — объем, мл
Как найти массу если известен объем и?
Вес можно рассчитать по формуле: m=V*p, где р – плотность, V – объем материала. Например, 10 м3 речного песка весят 13 тонн. Если известна масса материала, то объем можно узнать по формуле: V = m/ p.
Формула концентрации раствора. Их множество. И каждая соответствует тому или иному способу выражения концентрации. А в химии их применяются достаточно: массовая доля растворенного вещества, молярная, нормальная, моляльная, титр и др.
Зачем так много? Ответ на этот вопрос очень прост. Каждый вид концентрации удобен в том или ином случае, когда применение другого вида концентрации неуместно.
Например, при исследовании содержания массы вещества в очень небольшом объеме раствора удобно пользоваться титром. А в каких-то технологиях вообще концентрация заменяется другими количественными характеристиками раствора. Так, в технологии посола рыбы для расчета необходимой концентрации тузлука (раствора поваренной соли) используют не его процентную концентрацию, а плотность.
Содержание:
1. Концентрация – что это такое
2. Формула концентрации раствора: основные виды
3. Массовая доля растворенного вещества и примеры ее вычисления
- разбавление раствора водой
- концентрирование раствора путем упаривания
- концентрирование раствора путем добавления растворенного вещества
- смешивание двух растворов
- применение кристаллогидратов для приготовления раствора (задачи на кристаллогидраты)
4. Правило «креста» в химии растворов как метод решения задач на процентную концентрацию растворов
Концентрация – что это такое
Любой раствор имеет различные характеристики: качественные и количественные. Одной из важнейших количественных характеристик является концентрация раствора.
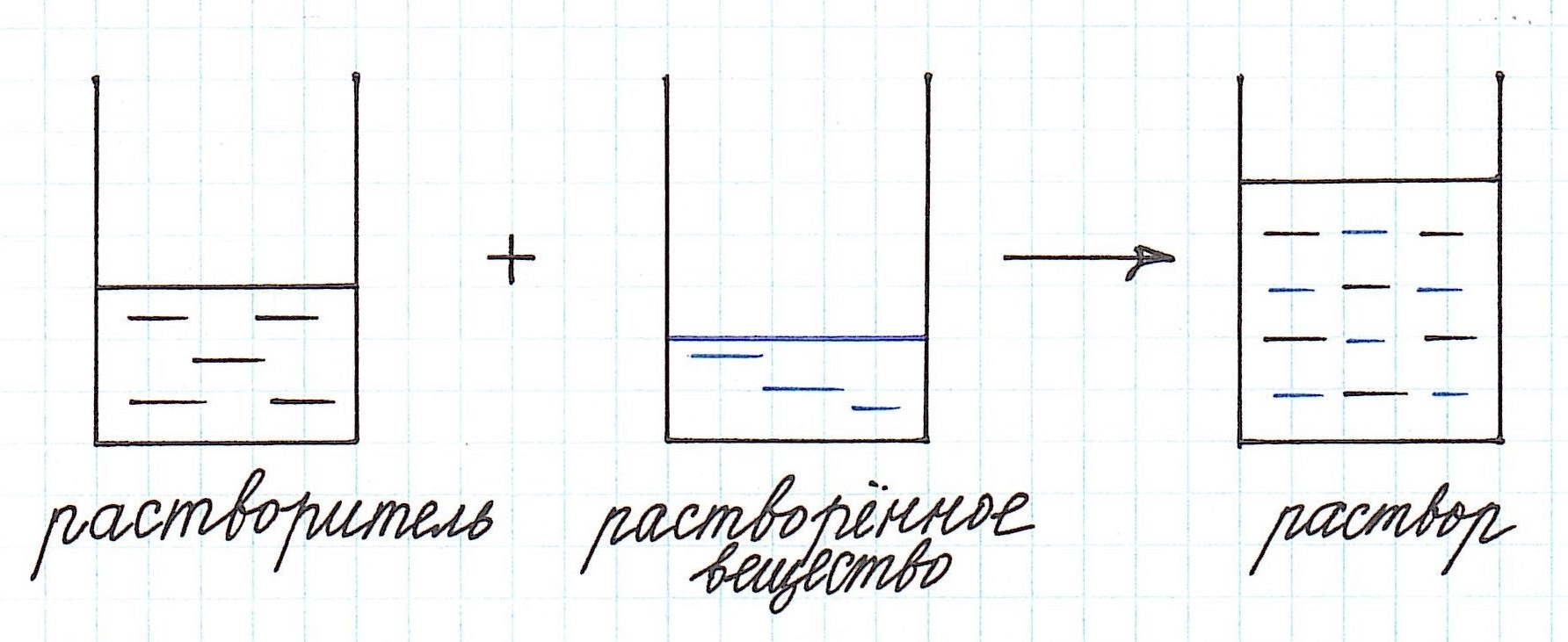
Концентрация раствора – это количество растворенного вещества, содержащееся в определенном количестве раствора.
Как видно из приведенного определения, основными компонентами раствора являются:
— растворитель;
— растворенное вещество.
Растворенного вещества в растворе всегда меньше, а растворителя больше.
И вот именно с вычислением количественного содержания растворенного вещества чаще всего и связаны все расчеты, основанные на применении формулы концентрации раствора.
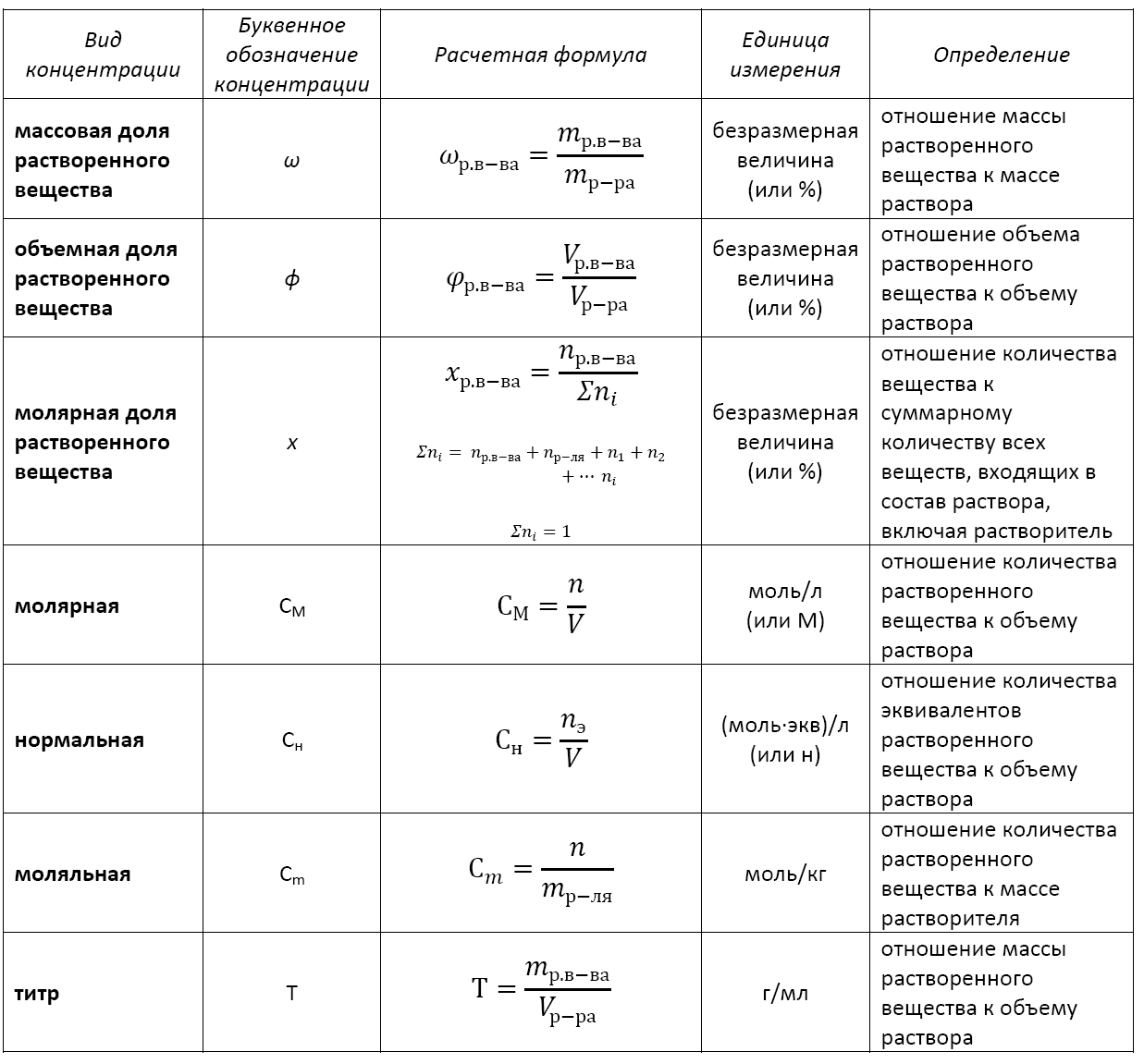
Существует несколько видов концентрации раствора:
— массовая доля растворенного вещества;
— объемная доля растворенного вещества;
— молярная доля растворенного вещества;
— молярная (или молярность);
— моляльная (или моляльность);
— нормальная (или эквивалентная);
— титр.
Формула концентрации раствора: основные виды
Применение того или иного вида концентрации уместно в каждом конкретном случае. Не существует какой-то универсальной концентрации или универсальной формулы концентрации раствора.
Кстати, с помощью математических преобразований можно перейти от одной концентрации к другой или найти взаимосвязь между разными их видами.
Основные расчетные формулы концентрации раствора приведены в таблице:
Массовая доля растворенного вещества и примеры ее вычисления
Массовая доля растворенного вещества – это отношение массы растворенного вещества к массе раствора.
Ее расчетная формула выглядит так:
где ωр.в-ва – массовая доля растворенного вещества, mр.в-ва – масса растворенного вещества, mр-ра – масса раствора.
ωр.в-ва представляет собой долю или от единицы или от 100%. Так, например, имеется двухпроцентный раствор NaCl. Его концентрация будет записана в первом случае ω(NaCl) = 0,02, а во втором – ω(NaCl) = 2%. Форма записи основной сути не меняет. Можно записывать и так, и так.
Что же означает выражение ω(NaCl) = 0,02 или ω(NaCl) = 2%? Буквально следующее: в 100 г водного раствора поваренной соли содержится 2 г этой соли и 98 г воды.
Необходимо помнить, что раствор состоит из растворителя и растворенного вещества. Поэтому масса раствора будет состоять из массы растворителя и массы растворенного вещества:
Тогда основную расчетную формулу для массовой доли растворенного вещества можно преобразовать:
Очень часто в расчетах с процентной концентрацией используются плотность и объем раствора:
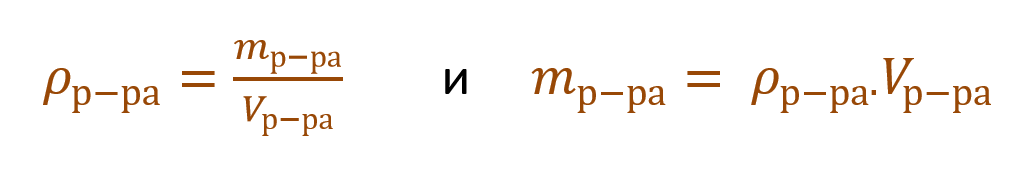
В других ситуациях могут использоваться объем и плотность не раствора, а растворителя. Тогда основная формула для расчета концентрации будет выглядеть так:
На практике бывает необходимо не только приготовить раствор с какой-либо определенной концентрацией, но и увеличить, либо уменьшить ее значение. Это достигается различными приемами:
— упариванием раствора;
— добавлением растворенного вещества;
— добавлением к раствору растворителя (например, воды).
Кроме того, приходится часто смешивать друг с другом растворы разных концентраций.
Разберем все возможные случаи.
Мы рекомендуем задачи, в которых речь идет о растворах, решать с использованием схематических рисунков. Это очень наглядно, особенно, когда речь идет о смешивании растворов.
Начнем с самого простого: вычислим концентрацию раствора.
Пример 1. В 200 г воды растворили 40 г глюкозы. Вычислите массовую долю глюкозы в полученном растворе.
Обратите внимание, что речи о каком-либо химическом взаимодействии не идет! Поэтому записывать уравнения реакций не требуется!
Запишем общую формулу для расчета массовой доли растворенного вещества:
В данной задаче глюкоза (C6H12O6) – растворенное вещество, а вода (H2O) – растворитель. Масса раствора будет складываться из массы глюкозы и массы воды:
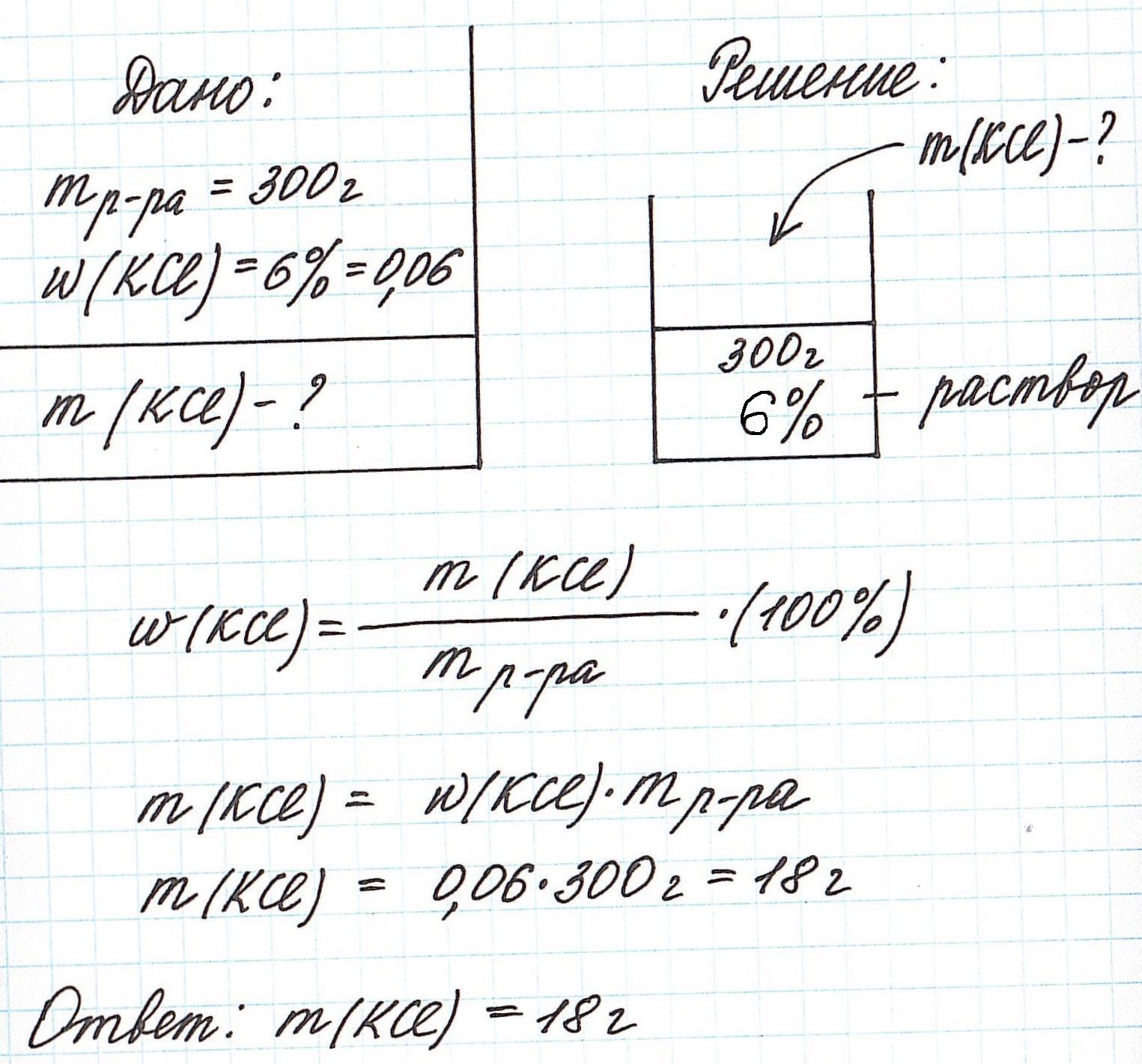
Пример 2. Рассчитайте, сколько потребуется хлорида калия, чтобы приготовить 300 г раствора с массовой долей соли 6%.
Обратите внимание, для того, чтобы расчеты были менее громоздкими, будем использовать выражение концентрации не в %, а в долях от единицы.
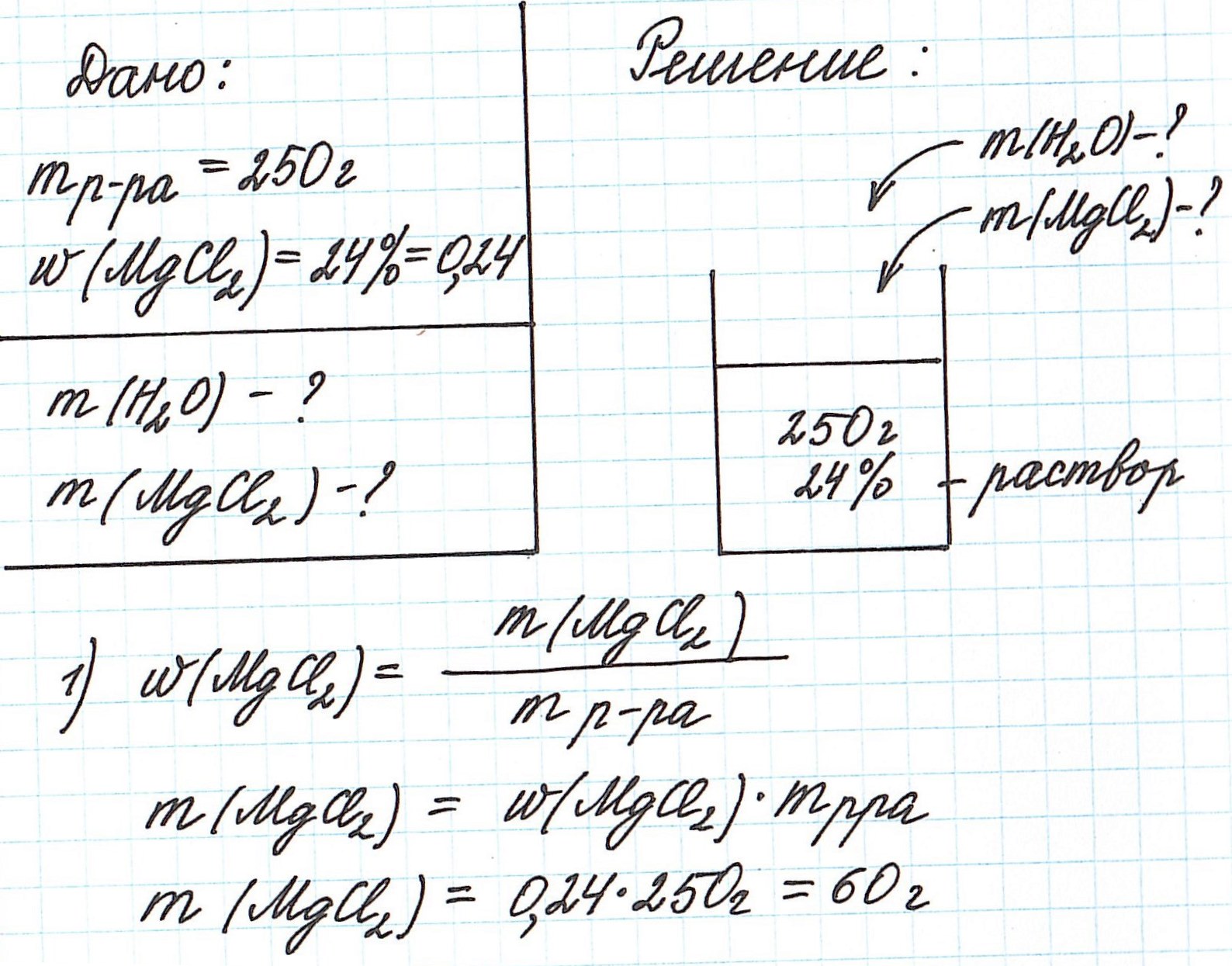
Пример 3. Необходимо приготовить 250 г раствора с массовой долей хлорида магния 24%. Рассчитайте массу требуемых воды и соли.
Так как раствор готовится из хлорида магния и воды, то и масса раствора равна сумме масс хлорида магния и воды:
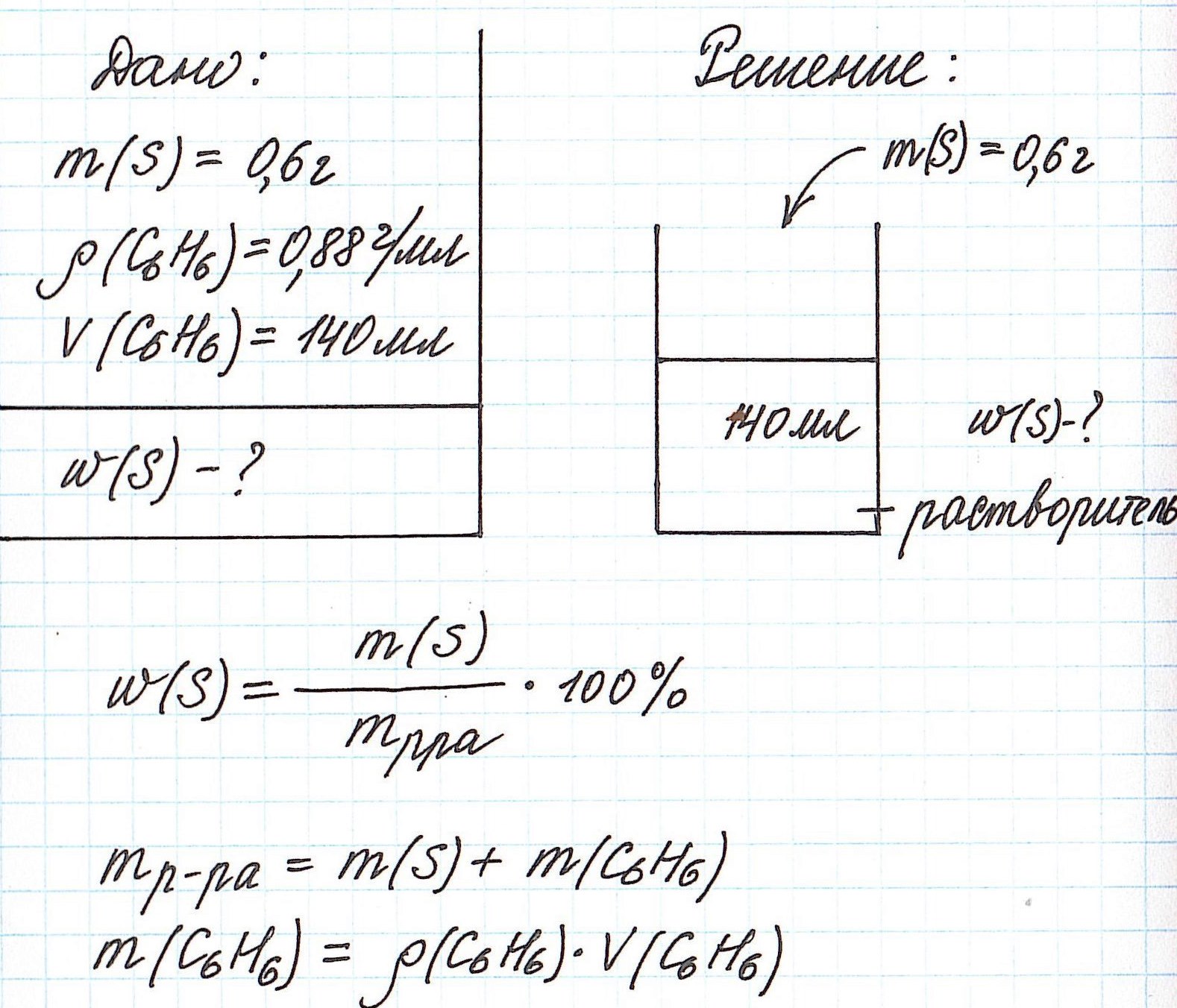
Рассмотрим задачу, в которой в качестве растворителя выступает не вода, а другое вещество.
Пример 4. В органическом растворителе бензоле объемом 140 мл растворили серу массой 0,6 г. Вычислите массовую долю серы в полученном растворе, если плотность бензола составляет 0,88 г/мл.
Обратите внимание, что здесь:
— масса раствора не известна;
— масса растворителя (бензола) не известна;
— известны объем и плотность растворителя (бензола), что позволяет нам найти его массу;
— масса раствора состоит из массы растворителя (бензол) и массы растворенного вещества (сера).
Объединим все расчетные формулы в одну и подставим в нее имеющиеся численные значения:
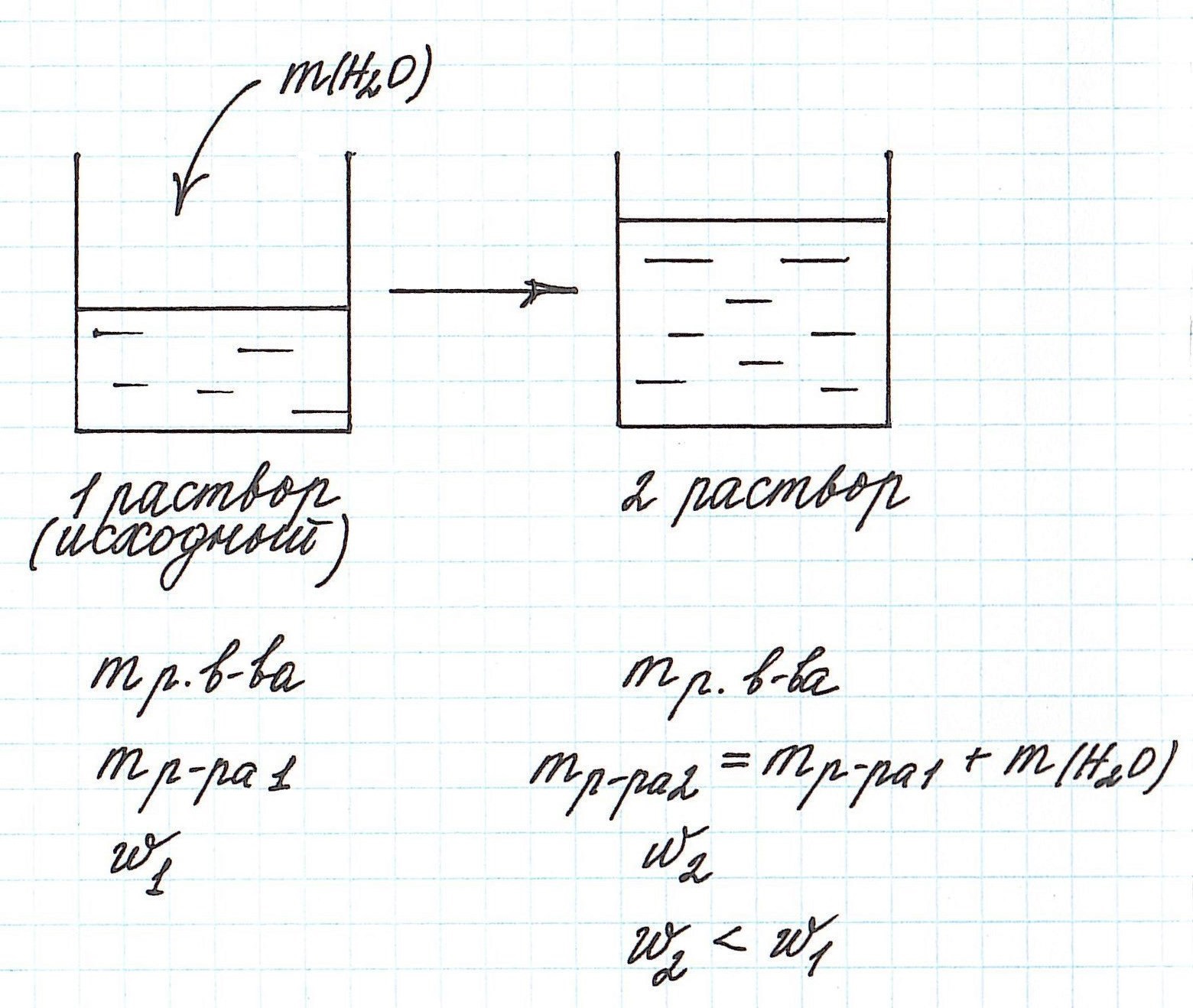
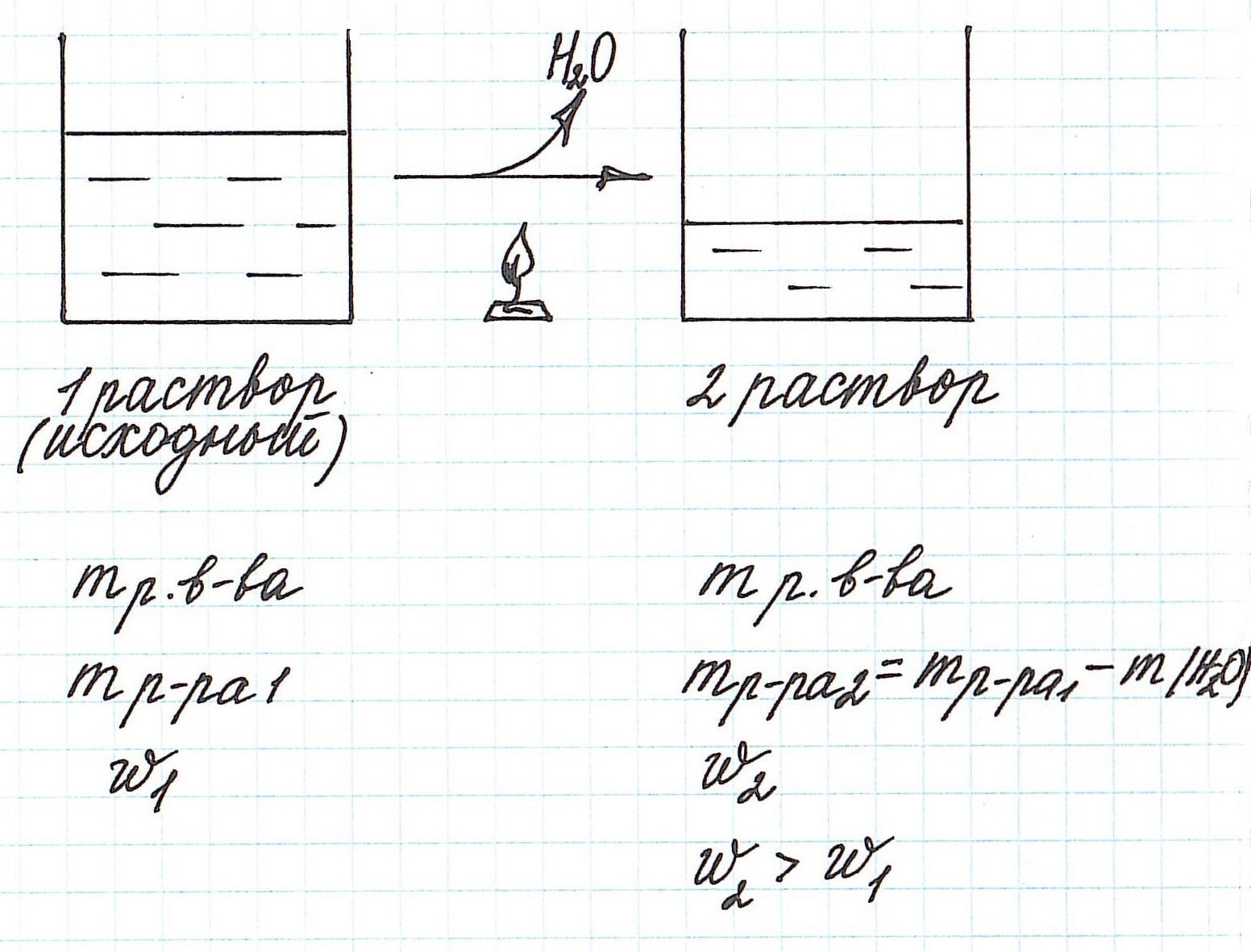
Вычисление массовой доли растворенного вещества при разбавлении раствора водой
Разбавление раствора водой приводит к уменьшению его концентрации.
Запомним, что в таких случаях:
— увеличивается масса раствора;
— увеличивается масса растворителя;
— масса растворенного вещества остается постоянной.
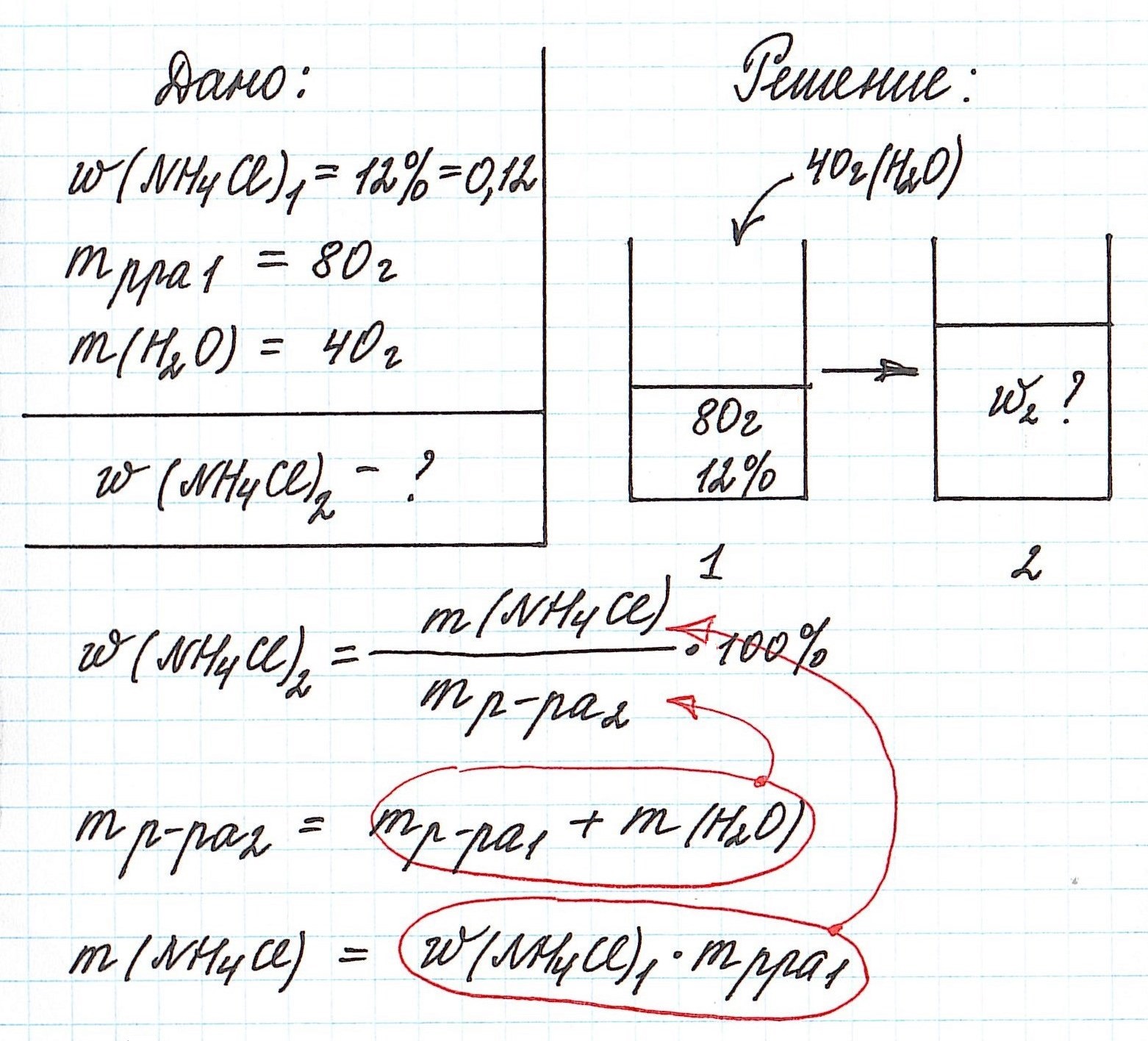
Пример 5. К 80 г раствора с массовой долей NH4Cl 12% добавили 40 г воды. Вычислите массовую долю хлорида аммония в полученном растворе.
Объединим все полученные формулы в одну и подставим имеющиеся данные:
Пример 6. Рассчитайте объем раствора фосфорной кислоты (массовая доля кислоты 12%, плотность 1,065 г/мл), который потребуется для приготовления раствора с массовой долей H3РO4 4% объемом 250 мл (плотность 1,02 г/мл).
В данной задаче речь напрямую о разбавлении раствора не идет. Но судя по тому, что исходный раствор имел концентрацию 12%, а конечный – 4%, становится ясно: последний раствор можно получить путем разбавления первого водой.
Вычисление массовой доли растворенного вещества при концентрировании раствора путем упаривания
Упаривание раствора, т.е. его нагревание, при котором происходит испарение воды, приводит к увеличению концентрации.
Учтите, что при этом:
— уменьшается масса раствора;
— уменьшается масса растворителя;
— масса растворенного вещества остается постоянной (при условии, что растворенное вещество не разлагается при данной температуре).
Пример 7. Из 200 г 27%-ного раствора глюкозы выпарили 20 г воды. Определите массовую долю глюкозы в полученном растворе.
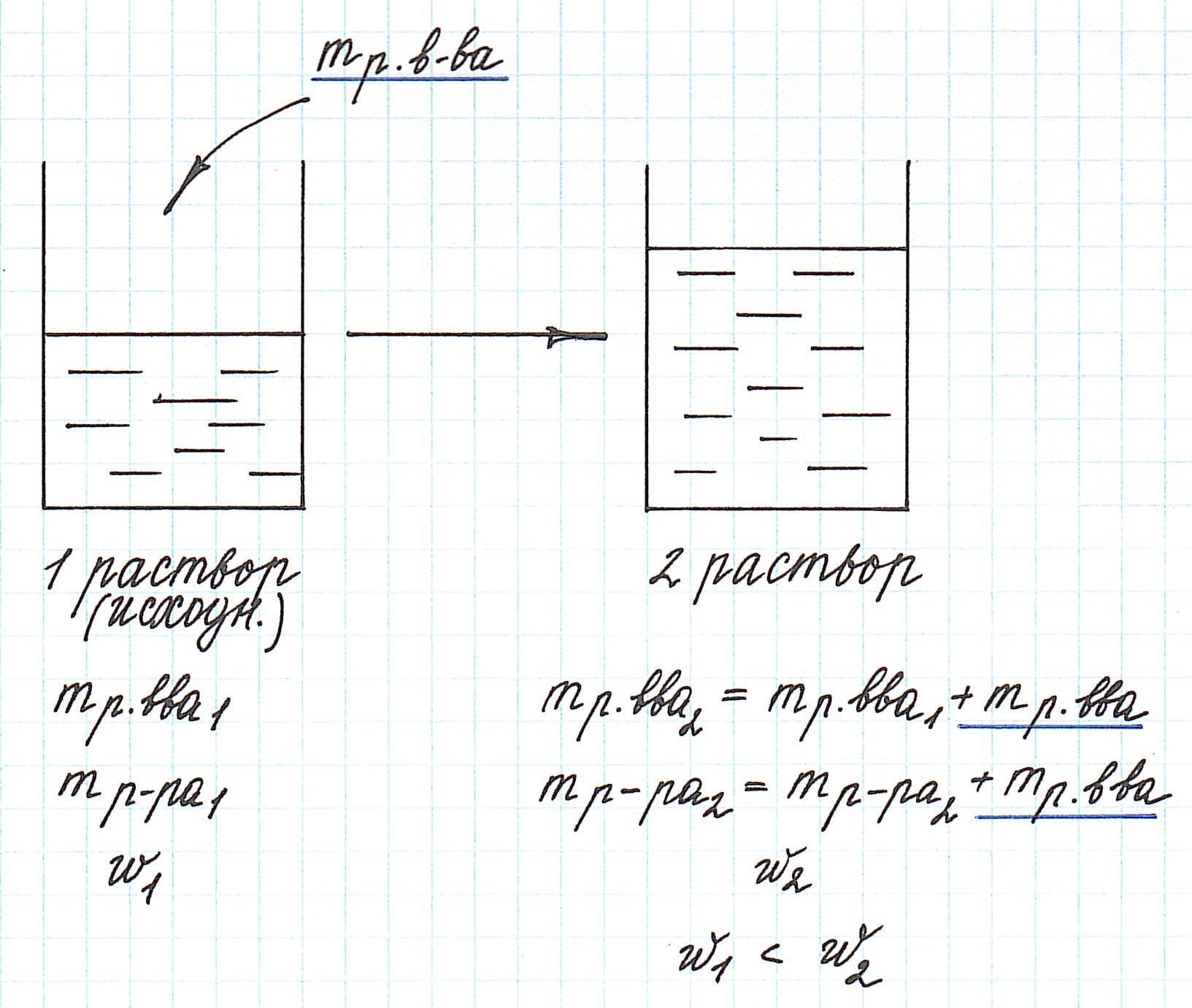
Вычисление массовой доли растворенного вещества при концентрировании раствора путем добавления растворенного вещества
Добавление к уже существующему раствору новой порции растворенного вещества приводит к увеличению концентрации раствора.
Помните, что в таких случаях:
— увеличивается масса раствора;
— увеличивается масса растворенного вещества.
Пример 8. Определите массу хлорида калия, который надо добавить к 180 г 15%-ного раствора этой соли, чтобы получить 20%-ный раствор.
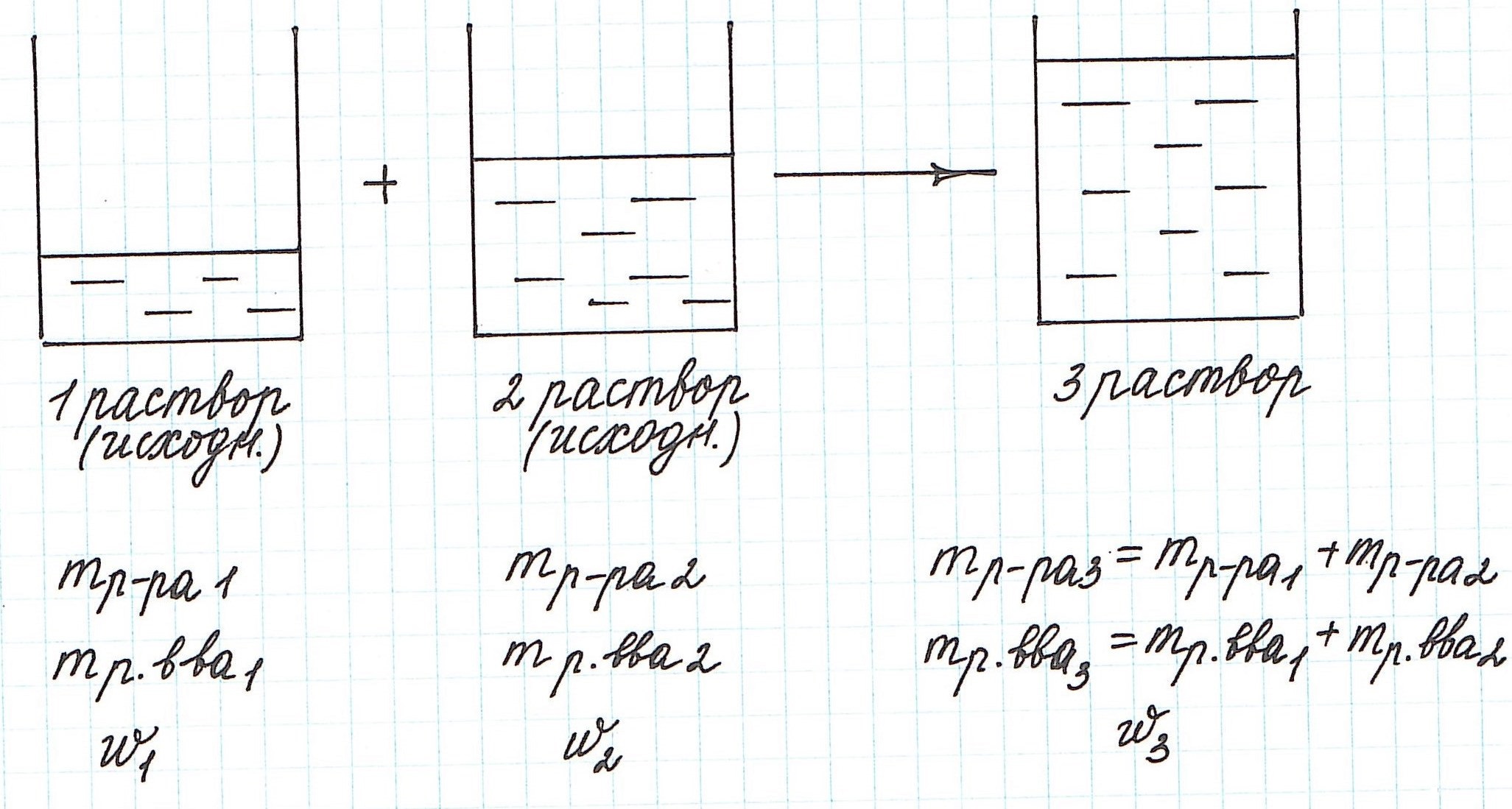
Вычисление массовой доли растворенного вещества при смешивании двух растворов
При смешивании двух растворов (речь о растворах одного и того же вещества конечно же) изменяются все количественные характеристики:
— увеличивается масса раствора;
— увеличивается масса растворенного вещества;
— изменяется массовая доля растворенного вещества.
Пример 9. Смешали 80 г 32%-ного раствора и 30 г 10%-ного раствора нитрата меди (II). Какова концентрация соли в полученном растворе?
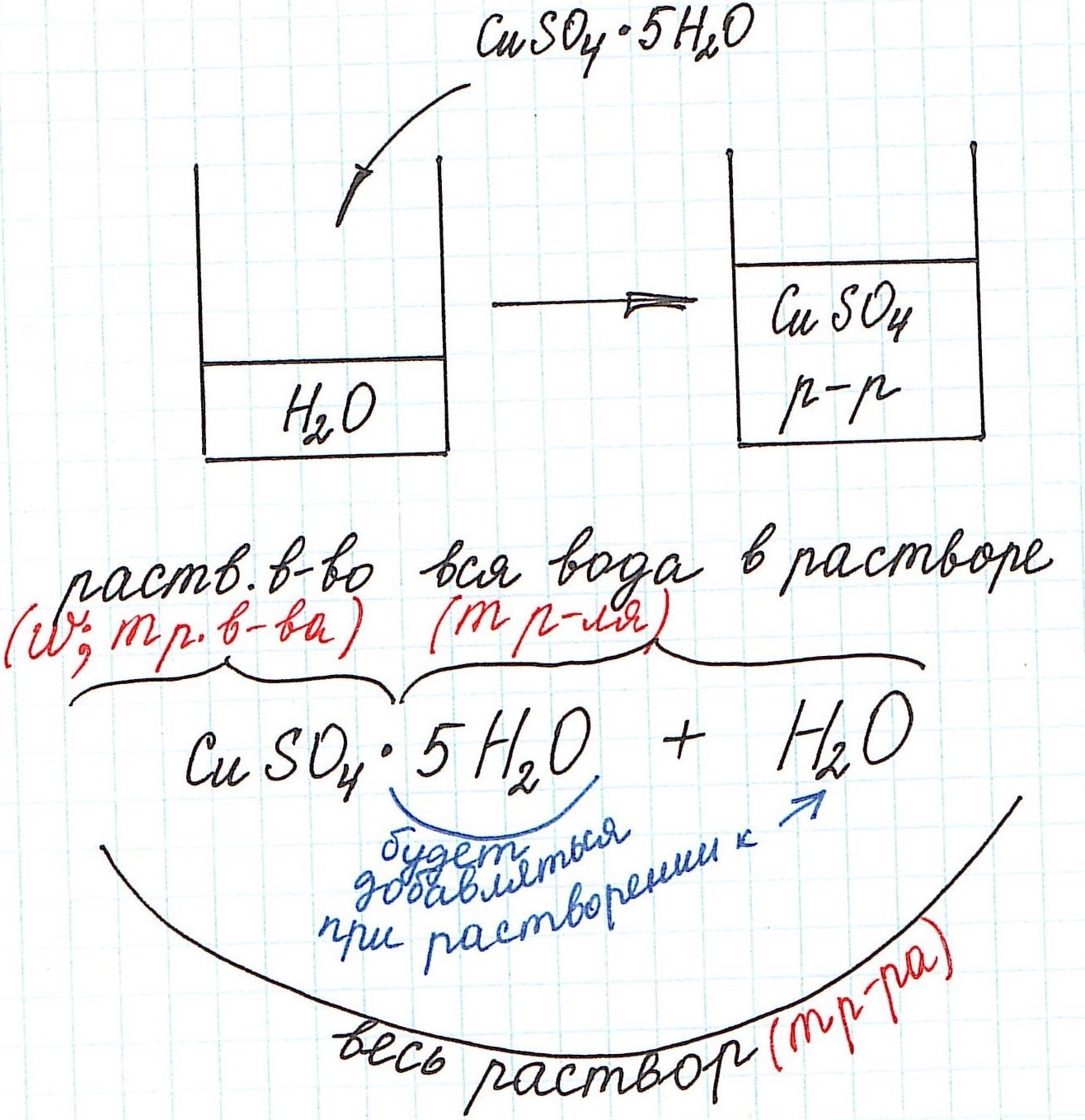
Вычисление массовой доли растворенного вещества с применением кристаллогидратов для приготовления раствора
Кристаллогидраты используются для приготовления растворов довольно часто. Кристаллогидраты представляют собой вещества, в состав которых помимо основного вещества входят молекулы воды. Например:
CuSO4·5H2O – кристаллогидрат сульфата меди (II) (или медный купорос);
Na2SO4·10H2O – кристаллогидрат сульфата натрия (или глауберова соль).
Больше примеров здесь.
Вода, входящая в состав кристаллогидрата, называется кристаллизационной.
Кристаллогидраты различаются прочностью связи между основным веществом и кристаллизационной водой. Одни из них теряют воду при комнатной температуре с течением времени и перестают быть кристаллогидратами (например, Na2СO3·10H2O). Другие – обезвоживаются только при сильном нагревании (например, CuSO4·5H2O).
При расчете концентрации с использованием кристаллогидратов для получения растворов часто приходится учитывать и кристаллизационную воду.
Но сначала поясним некоторые нюансы на конкретном примере:
1) Формула CuSO4·5H2O означает, что 1 моль CuSO4·5H2O содержит 1 моль CuSO4 и 5 моль H2O. Это можно было бы записать так:
n(CuSO4) = n(CuSO4·5H2O); n(H2O) = 5n(CuSO4·5H2O)
2) Относительная молекулярная (и численно молярная) масса будет складываться из относительной молекулярной массы вещества и относительной молекулярной массы воды. Например:
Mr(CuSO4·5H2O) = Mr(CuSO4) + 5·Mr(H2O) = 160 + 5·18 = 250 и, соответственно,
M(CuSO4·5H2O) = M(CuSO4) + 5·M(H2O) = 160 + 5·18 = 250 г/моль.
3) Еще одну особенность поясним с помощью рисунка:
Итак, разберем несколько типичных задач.
Пример 10. В 60 г воды растворили глауберову соль Na2SO4·10H2O массой 5,6 г. Какова массовая доля сульфата натрия в полученном растворе?
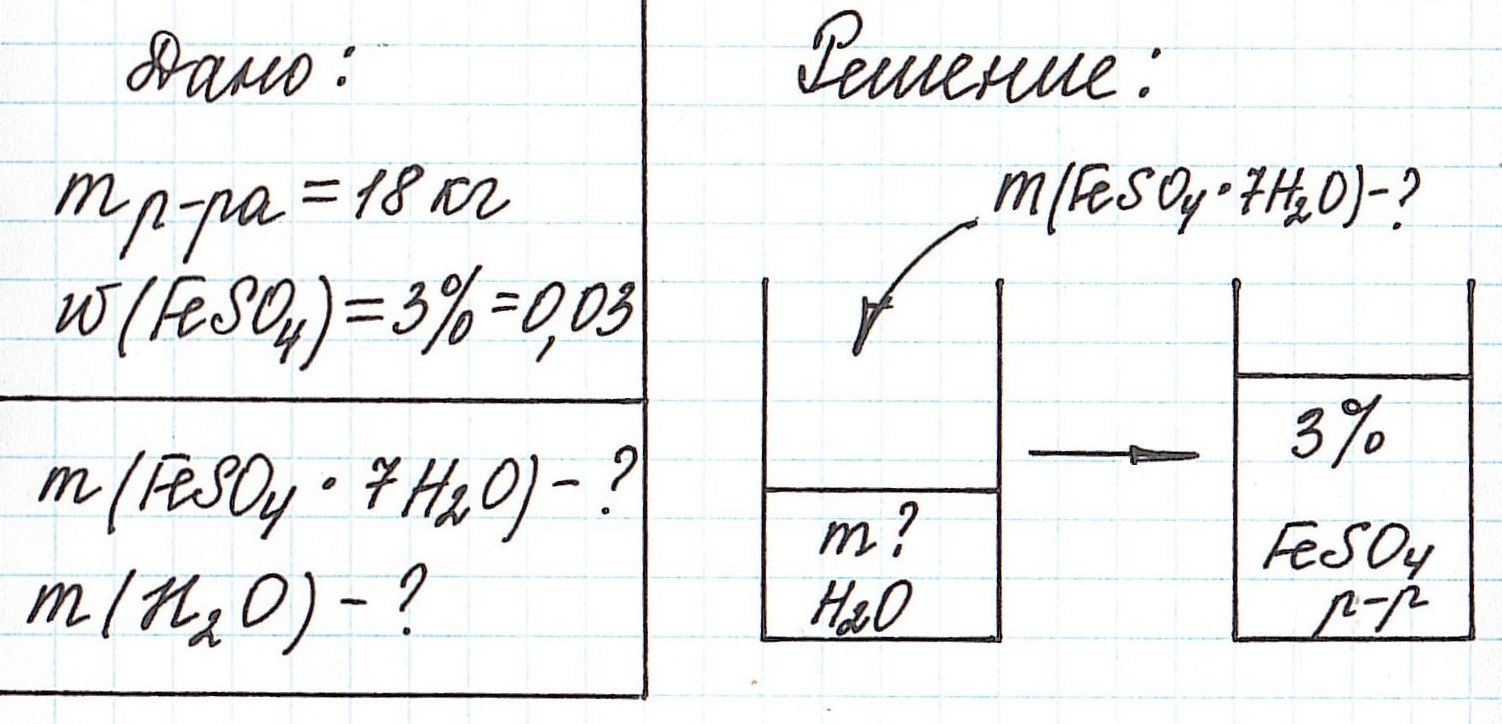
Пример 11. Какая масса железного купороса FeSO4·7H2O и воды потребуется для приготовления 18 кг раствора сульфата железа (II) с массовой долей FeSO4 3%?
Обратите внимание, что масса раствора дана не в граммах (г), а в килограммах (кг). Для того, чтобы привести в ходе расчетов все единицы измерения к единой системе, можно перевести килограммы в граммы и вычислять как обычно.
Но есть более простой способ. Можно считать количество вещества не в моль, а в киломоль (кмоль). Молярную массу вычислять не в г/моль, а в кг/кмоль. В этом случае ответ в задаче мы сразу получим в килограммах.
Пример 12. Вычислите массу кристаллогидрата сульфата никеля NiSO4·7H2O, который надо добавить к 180 г раствора с массовой долей сульфата никеля 1,5%, чтобы получить раствор с массовой долей соли 6%?
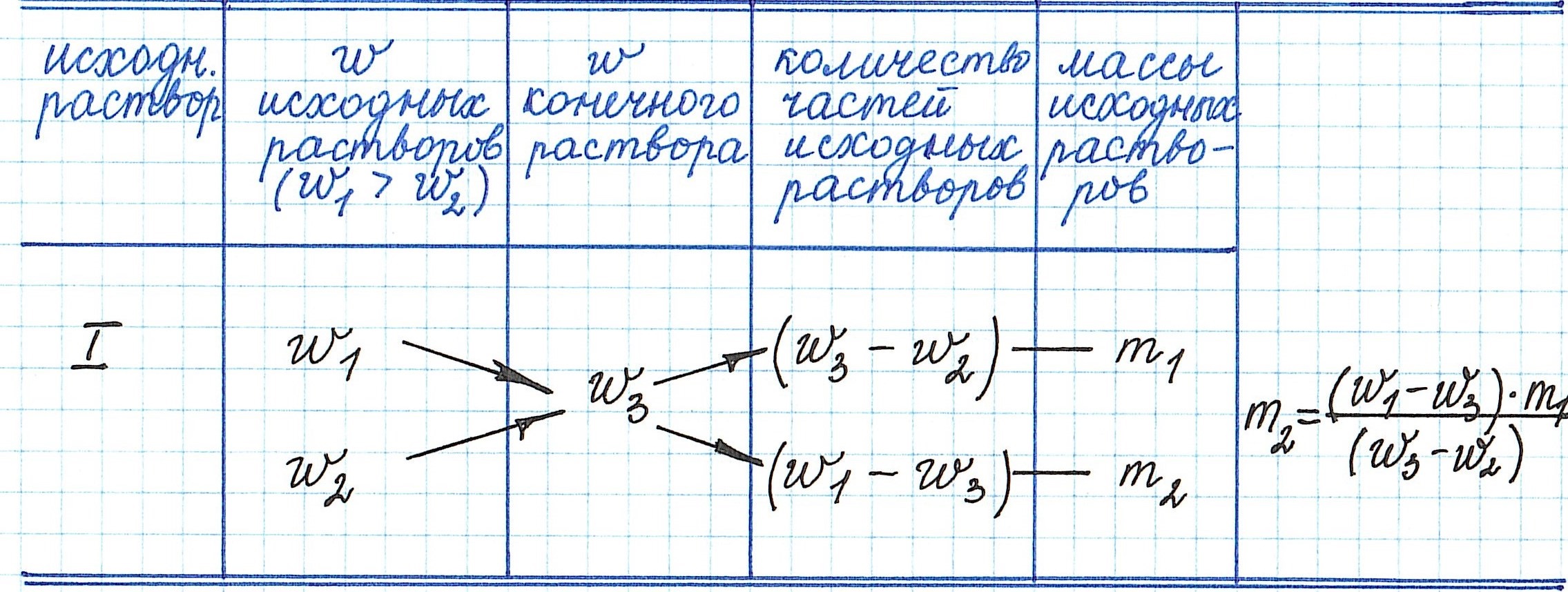
Правило «креста» в химии растворов как метод решения задач на процентную концентрацию растворов
Правилом «креста» (или «квадратом Пирсона») очень удобно пользоваться в расчетах, связанных с разбавлением или смешиванием растворов.
Общая схема вычислений выглядит так:
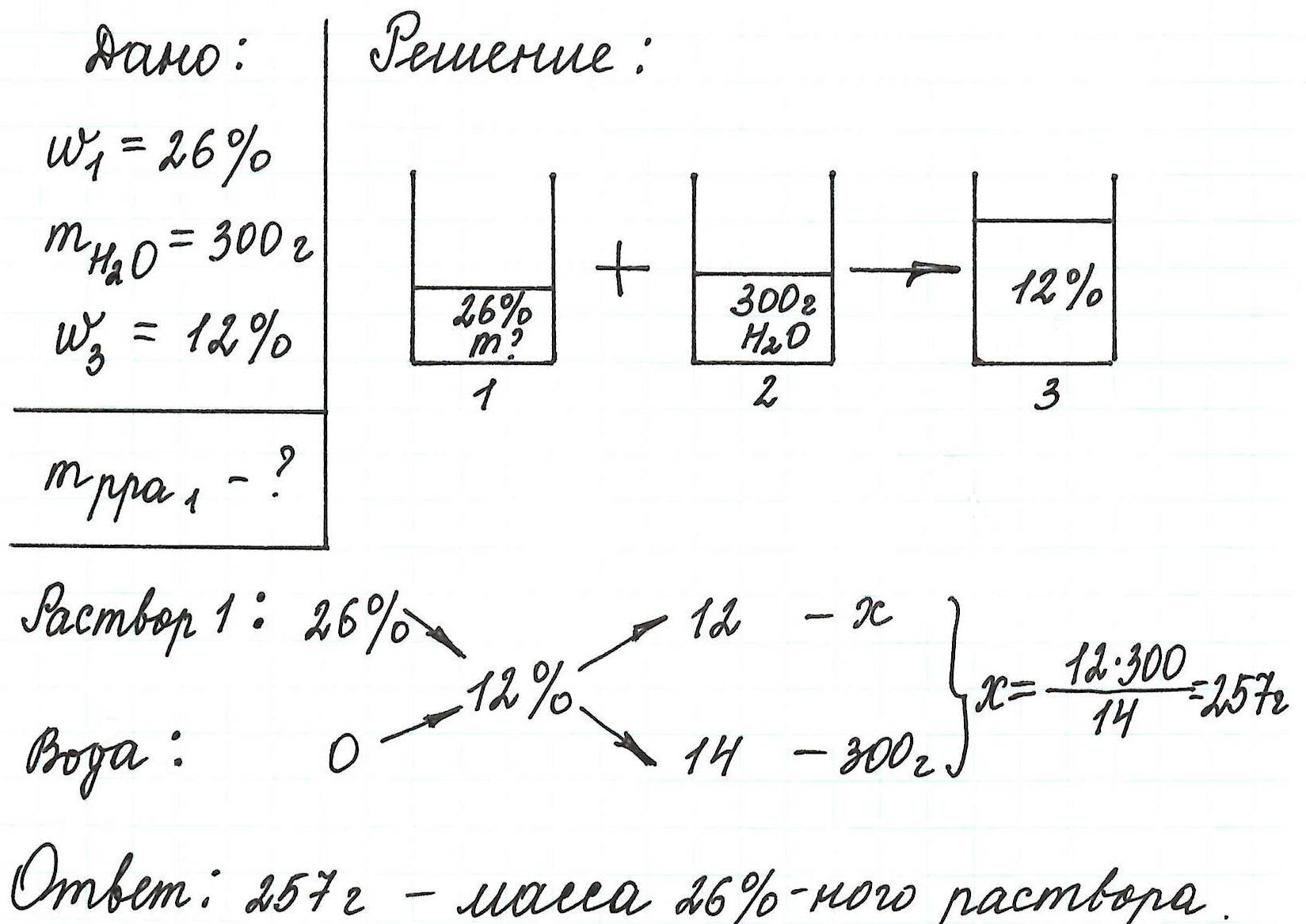
Пример 13. Какую массу 5%-ного раствора глюкозы надо добавить к 70 г 21%-ного раствора этого же вещества, чтобы получить 12%-ный раствор?
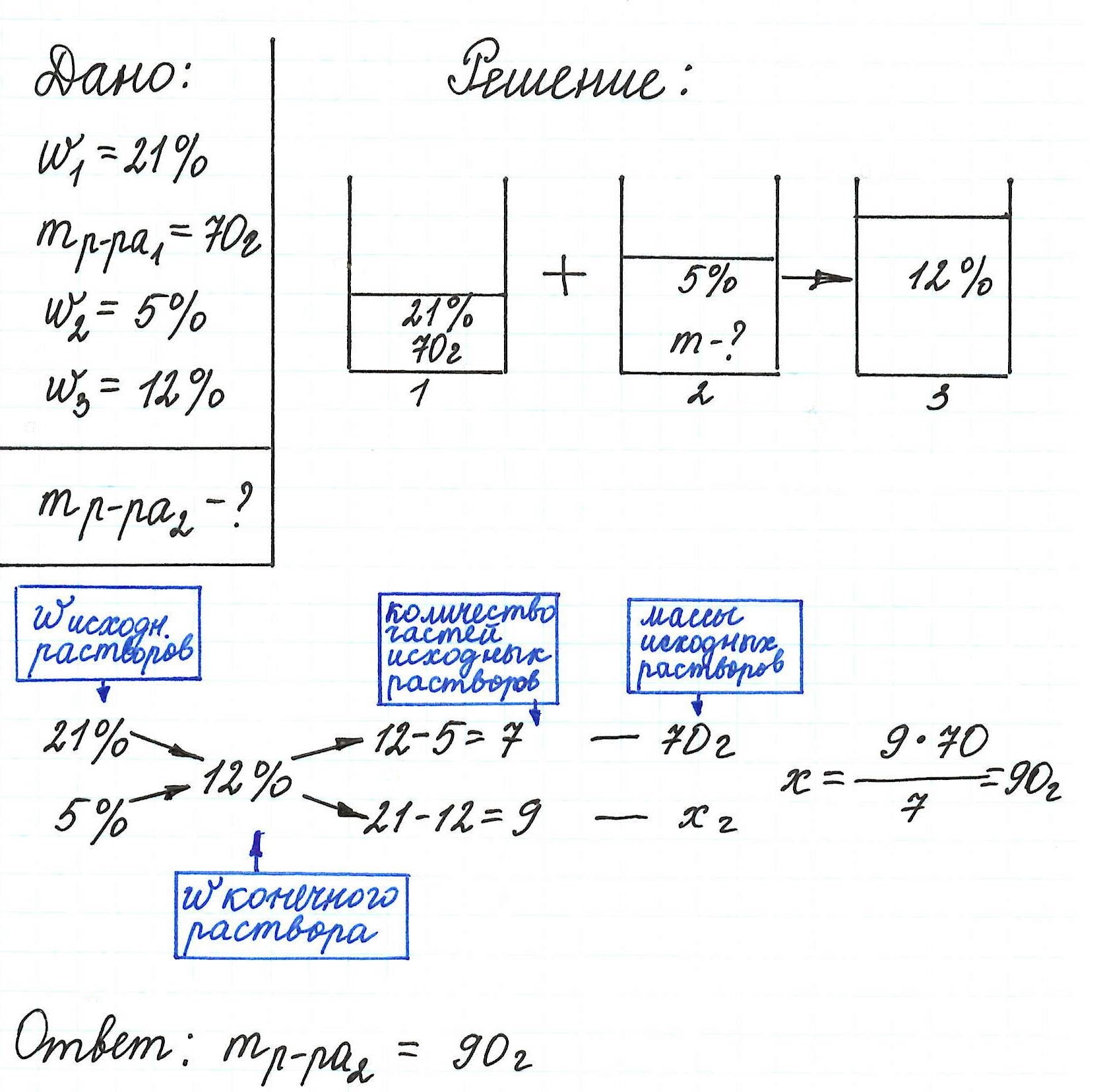
Еще примеры с применением правила «креста» можно посмотреть здесь.
Мы рассмотрели достаточно примеров расчетов, где используется формула такой концентрации раствора как массовая доля растворенного вещества. Как видим, ситуаций, в которых требуется ее применение, множество. Однако, есть достаточно случаев, когда более приемлемыми являются формулы других концентраций (молярной, нормальной, титра и т.д.). Об этом читайте в других статьях.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
или на Одноклассниках
Пожалуйста, оцените публикацию. Большая просьба, если вы оцениваете публикацию от 1 до 3 звезд, обязательно оставьте свой комментарий с указанием того, что не так с этой публикацией. Мы постараемся устранить недостатки.
Ваше мнение для нас важно!
Цель
работы:
освоить
ареометрические, пикнометрические и
рефрактометрические методы определения
концентрации сухих веществ растворах.
Изучить устройство сахаромера и
рефрактометра. По полученным результатам
дать оценку методам определения сухих
веществ в растворах.
Теоретические сведения
Определение
концентрации сухих веществ в сырье,
полупродуктах и готовой продукции
бродильных производств имеет большое
практическое значение. По этому показателю
судят о качестве сырья и полноте его
использования в ходе технологического
процесса. Определение сухих веществ
выполняется быстро, поэтому является
удобным методом контроля производства.
Под
концентрацией сухих веществ понимают
количественное содержание этих веществ
в испытуемом материале. В условиях
производства количество растворенных
сухих веществ выражают в массовых (г на
100 г раствора) или массово-объемных (г
на 100 см3
раствора) процентах. Различают истинные
и видимые сухие вещества.
Истинные
сухие вещества наиболее точно определяют
высушиванием продукта до постоянной
массы. Ввиду длительности и трудности
определения истинных сухих веществ, в
бродильной промышленности повсеместное
распространение нашли методы
приблизительного определения растворенных
сухих веществ. Из них наиболее часто
употребляются методы, основанные на
определении плотности или показателя
преломления анализируемого продукта.
Например, по плотности водного раствора
сахарозы находят процентное содержание
сахарозы в этом растворе.
Если
же в растворе, кроме сахарозы, имеются
какие-нибудь несахара, они будут повышать
плотность раствора. В этом случае
полученное количество сахарозы будет
завышенным по сравнению с действительным
ее содержанием в растворе. Так как
несахара и сахароза влияют на плотность
раствора по-разному, то по найденной
плотности нечистого сахарного раствора
находят не истинный процент сухих
веществ в растворе (сумму сахарозы и
несахаров), а величину, близкую к нему
– содержание видимых сухих веществ.
Обычно видимое содержание сухих веществ
бывает больше истинного. Чем чище
раствор, тем меньше разница между
истинными и видимыми сухими веществами.
Для растворов химически чистой сахарозы
эта разница исчезает.
Методы, основанные на определении плотности раствора
Плотностью
вещества (объемной массой) называется
отношение массы m
данного
вещества к его объему V.
Плотность
вещества обозначается символом ρ
и измеряется в кг/м3:
p
= m
/ V.
Плотность
– величина постоянная, характеризующая
данное вещество. Для удобства работы
определяют не абсолютную, а относительную
плотность вещества, представляющую
собой отношение плотности исследуемого
вещества к плотности стандартного
вещества. В качестве стандартного
вещества для жидких продуктов принимают
воду при температуре 20 оС
и давлении 1,03 ∙ 105
Па. Относительная плотность вещества
является безразмерной величиной. Для
нахождения относительной плотности
исследуемой жидкости достаточно
определить массы исследуемого вещества
и воды, находящиеся в одном и том же
объеме, и полученные значения разделить.
Относительная
плотность вещества изменяется в
зависимости от температуры исследуемого
и стандартного веществ, поэтому ее
всегда обозначают с соответствующими
индексами.
Если
вещество тяжелее воды (например,
сахароза), плотность его водного раствора
увеличивается с увеличением концентрации
растворенного вещества, и наоборот,
плотность раствора спирта уменьшается
с увеличением концентрации спирта.
Таким образом, по плотности раствора
можно судить о концентрации вещества
в нем. На основании экспериментальных
работ и эмпирических расчетов составлены
таблицы, в которых приведены концентрации
растворов различных веществ в зависимости
от плотностей этих растворов.
Плотность
определяют, пользуясь специальными
приборами: пикнометрами, гидростатическими
весами или ареометрами-денсиметрами.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Большинство реактивов продаётся в сухом виде: это или порошок, или мелкие гранулы. Однако используются реактивы чаще всего в виде растворов. Поэтому один из самых частых вопросов от наших покупателей – как из сухого вещества сделать раствор нужной концентрации.
Напоминаем, что все работы с химическими веществами следует проводить с соблюдением необходимых мер безопасности! Используйте средства индивидуальной защиты органов дыхания, глаз и кожных покровов!
В зависимости от способа и методики приготовления растворы можно разделить на приблизительные и точные. Вторые можно приготовить только в лабораторных условиях с использованием дорогостоящего оборудования и посуды.
С другой стороны, “точности” приблизительных растворов вполне достаточно для проведения домашних опытов, удаления ржавчины или загрязнения, очистки или обеззараживания воды в аквариуме или в бассейне, для таких хобби, как химическая металлизация, печать фотографий, выращивание кристаллов, изготовления мыла и свечей и многих других целей.
Растворение химических веществ может производится в разных средах – воде, спирте, кислотах и т.д. В этой статье мы будем говорить только о растворении в воде.
Что такое концентрация раствора?
Концентрацию раствора выражают в процентах, например 10% раствор или 0,5% раствор. Эта цифра показывает, сколько частей вещества приходится на 100 частей раствора.
Так, в 100 граммах 10%-го раствора поваренной соли находится 10 грамм соли и 90 грамм воды. А в 500 граммах 30%-го раствора гидроксида натрия содержится 150 грамм NaOH и 350 грамм воды. Один килограмм 0,2%-го раствора нитрата серебра состоит из 2 грамм нитрата серебра и 998 грамм воды.
Отметим, что существует разница между массовой концентрацией и объемной концентрацией растворов, и эта разница тем больше, чем больше концентрация растворенного вещества и плотность раствора.
Например, чтобы приготовить 1 килограмм 15%-го раствора NaCl нужно смешать 150 грамм соли и 850 грамм воды. Для приготовления же 1 литра 15%-го раствора NaCl понадобится уже 166,2 грамм NaCl и 941,8 грамм воды (при растворении соли в воде объём раствора несколько увеличится), и плотность увеличится с 1,000 (на самом деле 0,998) до 1,108.
Объясняется такая разница тем, что плотность солевого раствора выше, чем плотность чистой воды.
В этой статье, для упрощения, речь всегда будет идти о массовой концентрации раствора, то есть вес раствора будем измерять в граммах, а не в миллилитрах.
Приготовление водного раствора из сухого безводного реактива
Прежде всего, определитесь – какой вес раствора вам понадобится. Если раствор этого вещества нестабилен или он вам нужен для какой-то разовой работы – готовьте столько раствора, сколько нужно сейчас. Если же раствор хорошо хранится и используется время от времени, можно приготовить его с запасом.
Теперь рассчитаем количество вещества, которое нужно взять для приготовления определенной массы раствора определённой концентрации:
Масса вещества в граммах = (концентрация раствора в процентах) * (масса раствора в граммах/100)
Соответственно, масса воды вычисляется как разница между общей массой раствора и массой сухого вещества.
Пример 1: приготовим 5%-й раствор гидроксида натрия (NaOH) массой 500 грамм.
Масса NaOH = (5) * (500 гр/100) = 25 грамм.
Масса воды = 475 грамм.
Пример 2: приготовим 37%-й раствор аммония фосфорнокислого (NH4H2PO4) массой 750 грамм.
Масса (NH4H2PO4) = (37) * (750 гр/100) = 277,5 грмм.
Масса воды = 472,5 грамм.
Остаётся растворить навеску сухого реактива в рассчитанном объёме воды.
Приготовление раствора из водных солей (кристаллогидратов)
Откуда взялась вода в сухом реактиве и что такое “водность” вещества – можно прочитать здесь…
Если вам нужно приготовить раствор из вещества, содержащего кристаллизационную воду (например, медный купорос CuSO4*5H2O, хромокалиевые квасцы KCr(SO4)2*12H2O и тому подобные вещества), то методика расчетов меняется, чтобы учесть уже имеющуюся в веществе воду.
Опять же, начинаем с определения массы раствора, который мы хотим приготовить. Затем вычисляем, сколько вещества должно содержаться в растворе такой массы нужной нам концентрации – формула та же, что и при использовании безводных реактивов.
Масса вещества в граммах = (концентрация раствора в процентах) * (масса раствора в граммах/100)
Далее, пересчитываем массу вещества на кристаллогидрат. Для этого в справочниках (Яндекс или Google – наше всё) находим молярные массы безводной формы этого вещества и кристаллогидрата и вычисляем соотношение – сколько вещества в безводной форме содержится в кристаллогидрате. Так, если молярная масса кристаллогидрата 150 грамм/моль, а безводная форма этого вещества имеет молярную массу 70 грамм/моль, это значит, что в 150 грамм кристаллогидрата содержатся 70 грамм безводной формы вещества.
Определив, какое количество кристаллогидрата вещества нам нужно растворить, вычисляем необходимую массу воды.
Пример 1. Приготовим 500 грамм 15%-го раствора карбоната натрия 10-водного Na2CO3∙ 10H2O
Определяем массу карбоната натрия в 500 граммах 15%-го раствора:
Na2CO3 = (15) * (500 гр/100) = 75 грамм
Делаем пересчет массы на кристаллогидрат. Молярная масса Na2CO3 = 106 грамм/моль, молярная масса Na2CO3∙ 10H2O = 286 грамм/моль. Таким образом, 286 грамм карбоната натрия 10-водного содержат 106 грамм карбоната натрия безводного.
Нам нужно, чтобы в растворе оказалось 75 грамм карбоната натрия безводного. Составляем пропорцию и получаем, что нужно взять 202 грамма карбоната натрия 10-водного.
Последний шаг – посчитать нужное количество воды. 500 грамм минус 202 грамма = 298 грамм воды.
Пример 2. Приготовим 1000 грамм 3%-го раствора сульфата магния 7-водного MgSO4∙ 7H2O
Определяем массу сульфата магния в 1000 граммах 3%-го раствора:
MgSO4 = (3) * (1000 гр/100) = 30 грамм
Делаем пересчет массы на кристаллогидрат. Молярная масса (MgSO4) = 120 грамм/моль, молярная масса (MgSO4∙ 7H2O) = 246 грамм/моль.
Вычисляем, что для того, чтобы получить в растворе 30 грамм сульфата магния нужно взять 62 грамма сульфата магния 7-водного.
Смешиваем 938 грамм воды и 62 грамма сульфата магния 7-водного, получаем нужный результат.
тип задач. Раствор из сухого вещества и воды
| Количество сухого вещества = количество рабочего раствора (ml) % (г) раствора : 100 ml |
Эта формула является следствием такого рассуждения:
Пусть необходимо приготовить 1л (т.е. 1000 ml) пятипроцентного раствора.
Вспоминаем, что 5% означает, что в 100 ml такого раствора содержится 5 грамм сухого вещества.
Составляем пропорцию 100 ml — 5 г
1000 ml — Х г
Отсюда количество сухого вещества в 1л 5% раствора составит
Не забыть!!! При приготовлении раствора обязательно указать к о л и ч е с т в о в о д ы.
2 тип задач. Рабочий раствор из раствора более высокой концентрации и воды
Задача. Приготовить 2 литра 1,5 % раствора гипохлорита кальция из 5 % раствора.
Рассчитаем, сколько в этом случае потребуется 5% раствора и сколько необходимо добавить воды.
1 способ. Решаем поставленную задачу с использованием пропорций
ПОМНИМ !: 2л = 2000мл
В 100 мл 1,5% раствора содержится 1,5 г гипохлорита кальция.
В 100 мл 5% раствора содержится 5 г гипохлорита кальция.
| А) Сколько грамм гипохлорита кальция
должно быть в 2 литрах 1,5 % раствора? |
Б) Сколько мл 5%раствора
гипохлорита кальция надо взять, чтобы в этом объеме было 30 г вещества? |
В) Рассчитаем количество воды: |
| пропорция имеет вид:
100 мл (1,5%) – 1,5 г 2 Отсюда х=30 г |
пропорция имеет вид:
100 мл (5%) – 5 г
Отсюда х = 600 мл |
2000 мл – 600 мл (это 5% раствор) = 1400 мл |
Ответ: Для приготовления 2 литров 1,5% раствора гипохлорита кальция необходимо взять 600 мл 5%раствора
( в нем будет содержаться 30 г вещества) и добавить 1,4 литра воды.
2 способ. Решаем задачу с использованием уравнения.
| Кол-во концентрированного раствора (в литрах) % раствора = кол-во рабочего раствора (в литрах)% раствора |
V к.р. % к.р.= Vр.р. % р.р.
Задача. Приготовить 2литра 1,5 % раствора гипохлорита кальция из 5 % раствора.

Y

Рассчитаем количество воды
2000 мл – 600 мл (это 5% раствор) = 1400 мл
Ответ:
Для приготовления 2 литров 1,5% раствора гипохлорита кальция необходимо взять 600 мл 5%раствора
( в нем будет содержаться 30 г вещества)
и добавить 1,4 литра воды.
Вопросы для самоконтроля:
— уметь приготовить раствор из вещества в сухом виде (порошок, таблетки)
— уметь приготовить рабочий раствор из раствора более высокой концентрации
— уметь рассчитать концентрацию полученного рабочего раствора
Задачи для самопроверки:
- Приготовить 3л 3% раствора соды.
- Приготовить 4л 4% раствора соды.
- Приготовить 5л 5% раствора соды.
ОТВЕТ: 90 г соды и 2910мл воды; 160 г соды и 3840 мл воды; 250 г соды и 4750 мл воды.
- Приготовить 3л 3% раствора из 5% раствора
- Приготовить 4л 4% раствора из 5% раствора
- Приготовить 5л 5% раствора из 10% раствора
- Приготовить 2л 4% раствора из 5% раствора
ОТВЕТ: 1,8 л мат. р-ра 1,2 л воды; 3,2 л мат. р-ра и 800 мл воды; 2,5 л р-ра и 2,5 л воды; 1,6 л р-ра и 0,4 л воды.
- Рассчитать концентрацию рабочего раствора, если для его приготовления использовали 3,2 л воды и 800 мл 5% раствора гипохлорита кальция.
ОТВЕТ: 1%
- Рассчитать концентрацию рабочего раствора, если для его приготовления использовали 3,2 л 5% раствора гипохлорита кальция и 800мл воды.
ОТВЕТ: 4%
- Для приготовления 1,5% раствора взяли 5% маточный раствор и добавили 3,5л воды. Сколько получилось рабочего раствора?
ОТВЕТ: 5л
- Для приготовления 0.25% раствора взяли 5% маточный раствор и добавили 9,5л воды. Сколько получилось рабочего раствора?
ОТВЕТ: 10л
- Дано: перекись водорода в таблетках 33%
Приготовить 1 стакан (200 мл) 3% раствора перекиси водорода. Сколько таблеток надо положить в стакан?
- Задача Перельмана Я.И.
Дано: 30-процентный и 3-процентный растворы перекиси водорода.
Приготовить 1 литр 12-процентного раствора.
РАЗДЕЛ 3. ВОДНЫЙ БАЛАНС. ЗАДАЧИ
Вспоминаем!!! Цель: научиться рассчитывать водный баланс пациента и оценивать полученный результат (см. приложение1, 4)
Вопросы для самоконтроля:
Критерии оценки водного баланса
Отрицательный — _____ % от поступившей в течение суток в организм пациента воды.
Нормальный — ______ % от поступившей в течение суток в организм пациента воды.
Положительный — ______% от поступившей в течение суток в организм пациента воды.
Задача для самопроверки:
В течение суток в организм пациента поступило 2 л жидкости.
Рассчитать, сколько жидкости выделит пациент при
- отрицательном водном балансе ОТВЕТ: до 1,4 л;
- нормальном водном балансе ОТВЕТ: от 1,4 л до 1,6 л;
- положительном водном балансе ОТВЕТ: более 1,6 л
ПРОБА ПО ЗИМНИЦКОМУ
Вспоминаем!!! Цель пробы: оценка выделительной и концентрационной функций почек.
| Критерии оценки выделительной функции почек | |
| Дневной диурез (600-900) ; (900-1200) ; (1200-1500) ; (1500-1800) | Ночной диурез (1800-2100) ; (2100-2400) ; (000-300) ; (300-600) |
Сейчас мы должны рассчитать водный баланс, а также дневной и ночной диурезы:
1. В течение суток в организм пациента поступило 2,5 л жидкости. Он выделил 1,6 л мочи. ОТВЕТ: Водный баланс отрицательный;
Ночной диурез ≈ 530 мл; Дневной ≈1070 мл
2. В течение суток в организм пациента поступило 2,5 л жидкости. Он выделил 1,8 л мочи. ОТВЕТ: Водный баланс нормальный;
Ночной диурез 600мл; Дневной 1200мл
3. В течение суток в организм пациента поступило 2,5 л жидкости. Он выделил 2,1 л мочи. ОТВЕТ: Водный баланс положительный;
Ночной диурез 700мл; Дневной 1400мл
ОБРАТИТЕ ВНИМАНИЕ:
Некоторые препараты дозируются не в единицах метрической системы (например, граммах), а в ЕД или МЕ.
В ЕД (единицах действия) измеряются, например, антибиотики, инсулин, панкреатин, нистатин, ботокс.
В разделе №4 этого пособия нам придется разбираться с антибиотиками.
Причем, на флаконе антибиотика могут быть указаны граммы или миллиграммы, или ЕД.
В разделе №5 пособия научимся набирать в обычный шприц инсулин.
МЕ (международная единица) — в фармакологии это
единица измерения количества вещества, основанная на биологической активности. Используется для витаминов, гормонов, некоторых лекарств, вакцин, составляющих крови и подобных биологически активных веществ. В разделе № 5 мы рассмотрим расчет и набор в шприц гепарина.
РАЗДЕЛ 4. РАЗВЕДЕНИЕ АНТИБИОТИКОВ. ЗАДАЧИ
Цель: уметь рассчитывать количество препарата (антибиотика) для пациента в соответствии с назначением врача.
(см. приложение 1, 5)
Вопросы для самоконтроля:
- Какие растворы используются для разведения антибиотиков? Какой концентрации?
- При классическом разведении:
Во флаконе 1 000 000 ЕД – необходимо добавить _____ мл раствора
Во флаконе 500 000 ЕД – необходимо добавить _____ мл раствора
Во флаконе 0,5г – необходимо добавить _____ мл раствора
Во флаконе 0,25г – необходимо добавить _____ мл раствора
ОТВЕТЫ: 10 мл; 5 мл; 5 мл; 2.5 мл
- При произвольном (практическом, рабочем) разведении использовать
______ мл раствора антибиотика на одного пациента на 1 инъекцию
Решим задачи
Задача1. Во флаконе 1 000 000ЕД пенициллина. Для разведения использовали 10 мл раствора новокаина.
Назначение врача: необходимо сделать инъекцию 90 000 ЕД
Вычислить: Сколько мл раствора вы набираете в шприц для инъекции?
Сколько остается во флаконе ЕД антибиотика?
Сколько остается во флаконе мл раствора антибиотика?
ОТВЕТ: 0,9мл ; 9.1 мл ; 910 000 ЕД.
Задача 2. Во флаконе 1 000 000ЕД пенициллина. Для разведения использовали 10 мл раствора новокаина.
Назначение врача: Необходимо сделать инъекции трем пациентам по 300 000 ЕД
Вычислить: Сколько вы набираете в шприц для каждой инъекции?
Сколько остается во флаконе ЕД антибиотика?
Сколько остается во флаконе мл раствора антибиотика?
ОТВЕТ: 3 мл ; 3 мл; 3 мл; 1 мл; 100 000 ЕД
Задача 3. Во флаконе 1 000 000ЕД пенициллина. Для разведения использовали 8 мл раствора новокаина.
Назначение врача: Необходимо сделать инъекции двум пациентам: одному 300 000 ЕД,
другому – 500 000 ЕД.
Вычислить: Сколько вы набираете в шприц для каждой инъекции?
Сколько остается во флаконе ЕД антибиотика?
Сколько остается во флаконе мл раствора антибиотика?
ОТВЕТ: 2,4 мл; 4 мл; 200 000 ЕД; 1,6 мл
Задача 4. Во флаконе 1 000 000 ЕД пенициллина. Для разведения использовали 7 мл раствора новокаина.
Назначение врача: Необходимо сделать инъекции двум пациентам: одному – 400 000 ЕД,
другому- 500 000 ЕД
Вычислить: сколько вы набираете в шприц для каждой инъекции?
Сколько остается во флаконе ЕД антибиотика?
Сколько остается во флаконе мл раствора антибиотика?
ОТВЕТ: 2,8 мл; 3,5 мл; 100 000 ЕД; 0,7 мл
Задача 5. Во флаконе 0,5 г антибиотика. Для разведения использовали 4 мл раствора новокаина.
Назначение врача: Необходимо сделать инъекции двум пациентам: одному – 0,2 г, другому 0,15 г
Вычислить: Сколько вы набираете в шприц для каждой инъекции?
Сколько остается во флаконе грамм антибиотика?
Сколько остается во флаконе мл раствора антибиотика?
ОТВЕТ: 1,6 мл; 1,2 мл; 0,15 г; 1,2 мл
Задача 6. Во флаконе 1 000 000 ЕД пенициллина. Для разведения использовали 8 мл раствора новокаина.
Сколько ЕД пенициллина содержится в 1 мл раствора
2 мл раствора
2.4 мл раствора
4 мл раствора
6 мл раствора
ОТВЕТ: 125 000 ЕД; 250 000 ЕД; 300 000 ЕД; 500 000ЕД; 750 000 ЕД
Задача 7. Дано: 10 ампул 4% раствора гентамицина по 2ml.
Назначение врача – 160 000 ЕД 2 раза в сутки.
Сколько мл вы набираете в шприц для инъекции?
Решение: 1 способ
-
Помнить: соответствие 1г = 1 000 000 ЕД
- Сколько грамм гентамицина содержится в 1 мл 4% раствора гентамицина?
100 мл (4%) — 4 г см. раздел 3
1 мл — Х г Х = 0,04 г
- Сколько ЕД составляют 0,08 г?
1 000 000 ЕД — 1 г
Х ЕД — 0,04 г Х = 40 000 ЕД, т.е. в одной ампуле 80 000 ЕД
- Сколько мл гентамицина необходимо набрать в шприц?
160 000 : 40 000 = 4 мл
Ответ: Для инъекции необходимо набрать в шприц 4 мл гентамицина, что соответствует 2 ампулам.
ЗАДАЧА № 7. Это та же задача, что решена выше, но теперь способ другой. Может, понятнее.
Решение : 2 способ Помнить: соответствие 1г = 1 000 000 ЕД

| 15.03 | Иванов И.И. | Гентамицин 160 000 ЕД | — |
Сколько грамм гентамицина в одной ампуле? Сколько грамм гентамицина назначил врач?
100 мл — 4г 1 000 000 ЕД — 1 г
2 мл — х г 160 000 ЕД — х г
Х= 0,08 г х = 0,16 г
А теперь анализируем полученные результаты:
так как в одной ампуле 0,08 г, а нам нужно 0,16 г, то мы делим 0,16 на 0,08 и получаем количество ампул, которое нам нужно взять для инъекции (0,16:0,08= 2 ампулы ).
Ответ: Для инъекции необходимо набрать в шприц 4 мл гентамицина, что соответствует 2 ампулам.
| Т В О Р Ч Е С К А Я З А Д А Ч А | ЗАДАЧА № 8
— (Сколько флаконов купить в аптеке?) ПРОДОЛЖЕНИЕ ЗАДАЧИ — А сколько ампул будет использовано? |
АНТИБИОТИКИ
Задачи для самостоятельной работы
| № | Название антибиотика | Назначение врача | Вопросы: | РЕШЕНИЕ |
|
1 |
АМПИОКС. Доза во флаконе 0,5 г. Классическое разведение. |
Ввести 250 000 ЕД |
— в миллилитрах; — в ЕД (или граммах) |
|
|
2 |
ЦЕФАЗОЛИН. Доза во флаконе 1,0 г. Классическое разведение. |
Ввести 300 000 ЕД |
||
|
3 |
БЕНЗИЛПЕНИЦИЛЛИНА НАТРИЕВАЯ СОЛЬ. Доза во флаконе 1 000 000 ЕД. Разведен 4,0 ml |
Ввести 0,5 г |
||
|
4 |
БИЦИЛЛИН –5. Доза во флаконе 1 200 000 ЕД. Разведен 6,0 ml |
Ввести 600 000 ЕД |
||
|
5 |
ГЕНТАМИЦИН. Раствор в ампуле 4% -2,0 ml |
Ввести 40 000 ЕД |
||
|
6 |
ЛИНКОМИЦИН. Раствор в ампуле 30% — 1,0 ml |
Ввести 300 000 ЕД |
РАЗДЕЛ 5. ЦЕНА ДЕЛЕНИЯ ШПРИЦЕВ. НАБОР ЛС В ШПРИЦ. ЗАДАЧИ
Ценой деления шприца
называется объем самого маленького деления шприца
Цена деления шприца =
Или
-
Цена деления шприца =
Пример
1.Определите цену деления шприца.
2. Сколько мл ЛС в шприце?
- Определите цену деления шприцев:

Найдите соответствие:
Номер шприца – цена деления
- – а) 0,1мл
- – б) 0,2мл
- – в) 0,5мл
- – г) 1мл
- – д) 2мл
- – е) 5мл
- –
- –
- –
- —
РАЗДЕЛ 6. МАТЕМАТИКА В ПЕДИАТРИИ. ЗДОРОВЫЙ РЕБЕНОК. ЗАДАЧИ
Приложение 6
1.антропометрия
Антропометрия изучает физические показатели развития ребенка: масса
рост
пропорциональность
Масса. средняя прибавка за первое полугодие – 800 грамм в месяц
-
m I полугодия = m рожд. + 800 n, где n – количество месяцев жизни (от 1 до 6)
Среднемесячная прибавка массы тела во
втором полугодии – 400 грамм
m II полугодия = m рожд. + 4800 + 400 n, где n – количество месяцев жизни (от 1 до 6)
7 месяцев —— n=1
8 месяцев —— n=2
9 месяцев —— n=3
10 месяцев —— n=4
11 месяцев —— n=5
12 месяцев —— n=6
Массу тела ребенка
после года и до 10 лет можно рассчитать по формуле
-
m тела после 1 года = 10 + 2 n, где n – число лет после года (n = 1 — 10)
Рост ребенка.
Рост ребенка после года определяется по формуле
-
l после 1 года = 75 + 5 n, где n – возраст до 5 лет
-
l старше 5 лет = 100 + 6( n – 4), где n – количество лет после 5
Зубы появляются к 6-7 месяцам. При расчете количества зубов используется формула
-
N — 4, где N – количество месяцев до 2 лет
2. Особенности функционирования сердечно-сосудистой и дыхательной систем.
РАЗДЕЛ 7. ПРИГОТОВЛЕНИЕ РАСТВОРОВ ДЛЯ ПАРЕНТЕРАЛЬНОГО ВВЕДЕНИЯ. ЗАДАЧИ
| Особенности расчетов: | Помните! |
| — объем приготовленных растворов может быть от 2 мл (объем шприца) до 500 мл ( объем флакона); | |
| — исходной строкой пропорции чаще всего будет соответствие:
|
|
| Пример: в 100 мл 1,5% раствора – 1,5 г вещества
3 % — 3 г 20 % — 20 г |
ЗАДАЧА № 1
Дано: назначение врача 250 мл стерильного 5% раствора Glucosum для введения внутривенно капельно.
Сколько грамм глюкозы в растворе?
Решение: 100 мл (5%) – 5 г
250 мл – х г х = = 12,5 г
ЗАДАЧА № 2
Дано: 30.0 мази, содержашей 1% димедрола (Dimedrolum), 10% стрептоцида (Streptocidum), 5% окиси цинка (Zinci oxydum). Наружное.
Сколько грамм димедрола, стрептоцида, окиси цинка содержится в мази?
ЗАДАЧА № 3
А) Для оказания желчегонного эффекта надо принимать магнезию (Mg SO4) 20% по 1 столовой ложке 3 раза в день.
Для слабительного эффекта достаточно 10-15 г.
Будет ли слабительный эффект? !!!* вспомните, сколько мл в 1 столовой ложке? (Забыли? Смотрите таблицу на стр. 6)
Решение: 100 ml (20%) — 20 г
15 ml – х г х = = 3 г
Ответ: нет, слабительного эффекта не будет.
Б) Для тюбажа используют 200мл 10 % или 100 мл 20 % магнезии.
Будет ли слабительный эффект?
ЗАДАЧА № 4
Дано: 6 ампул 1% раствора Furosemidum по 2 ml.
Сколько ml надо ввести внутривенно,
если при остром отёке лёгких врач назначил 40 мг?
Решение:
| 1. Сколько г фуросемида в 1 ампуле? 100ml(1%) — 1 г 2ml — х г х = |
2. Сколько это мг? (см. метрическую шкалу) 0,02 г = 20 мг т.е. в одной ампуле 20 мг фуросемида. |
3. Сколько ампул содержат 40 мг вещества?
40 : 20 = 2 ампулы. |
ЗАДАЧА № 5
Сколько мл клофелина нужно ввести под кожу, если врач назначил 50 мкг.
Rp: Sol. Clophelini 0,01 % 1 ml
D.t.d. N 10 in amp
S. по ???? под кожу.
Решение:
| 1. Сколько грамм клофелина содержится в 1 ампуле?
100 ml (0,01%) – 0,01 г 1 ml – х г; х = |
2. Сколько это мл? (см. метрическую шкалу) 0,0001 г = 100 мкг |
3. Сколько ампул необходимо взять?
50 мкг = 0,5 ml 0,01 %, т. е пол-ампулы (0,5 мл) под кожу |
ЗАДАЧА № 6
Ампулы 40% глюкозы по 10 ml.
Приготовить 5% раствор глюкозы, используя 200 ml физраствора и ампулы.
Решение:
| 1. Сколько грамм глюкозы содержится в 1ампуле?
100 ml (40%) – 40 г 10 ml – х г; х = |
2. Сколько грамм глюкозы необходимо для приготовления 200 мл 5% раствора?
Если в 100 ml (5%) – 5 г, то в 200 ml, соответственно, в 2 раза больше – 10 г |
Ответ: 2,5 ампулы |
Теперь нам надо научиться разбираться с растворами, концентрация которых задана отношением, например, 1:5.
Переведем в %.
Сначала рассмотрим простые и ясные примеры:
Пример 1. Дано: раствор 1:1. Т.е., например, одна часть спирта и одна часть воды.
Часть, как вы понимаете, это может быть капля или чайная ложка, или стакан и т.д. Теперь решаем. Вместе получилось 2 части.
Составим пропорцию 2 ч – 100%
1 ч — х % х=50%, раствор имеет концентрацию 50%
П
1 ч — х % х=25%, раствор имеет концентрацию 25%
Пример 3.Дано: раствор 1:5. Решите сами.
А теперь сложнее
ЗАДАЧА № 7
Д
настойка полыни (Tinctura Absinthii), в соотношении 3:3:4.
настойка валерианы (Tinctura Valerianae)
Принимать по 20 капель 3 раза в день во время еды 2 недели.
Сколько мл каждой настойки входит в состав капель? Сколько мл желудочных капель принял пациент за 2 недели?
Сколько мл каждой настойки пациент принял за 2 недели? Сколько капель осталось во флаконе?
ЗАДАЧА № 8
Дано: 10 ампул 0,1% адреналина по 1 ml. Флакон раствора новокаина, 200 мл.
Сколько надо добавить адреналина к 200 ml новокаина
для получения концентрации 1: 200 000.
Решение: Избавимся от концентрации 1:200 000 и перейдем к привычным процентам: должны получить почти 0,0005%, так?
100 мл – 0,1 1 мл — х х = 0,001 г |
1) Сколько грамм вещества должно содержаться в 200 мл приготавливаемого раствора?
100 мл – 0,0005 г 200 мл – х г ; х = А сколько же ампул надо использовать, чтобы получить во флаконе это количество адреналина? 100 ml (0,1%) — 0,1 г Х ml – 0,001 г; Х = |
ЗАДАЧА № 9
Ампулы адреналина 0,1% по 1 ml; флакон физраствора, 500 ml.
Задача: приготовить раствор концентрации 1: 200 000
Решение: Указанная концентрация означает, что в 200 000 мл содержится 1 г вещества.
1) Концентрация рабочего раствора (см. задачу №6 данного раздела)
1 г — 200 000 ml
х г – 100 ml х = 0,0005 %
2) Сколько грамм адреналина должно быть в 500 ml?
100 ml (0,0005 %) – 0,0005 г
500 ml – Х г Х = 0,0025 г
3) Сколько грамм адреналина в 1 ампуле?
100 ml (0,1%) – 0,1 г
1 ml – Х г Х = 0,001 г
4) Сколько ампул необходимо использовать для получения раствора?= 2,5 ампулы
| Т В О Р Ч Е С К А Я З А Д А Ч А | З АДАЧА № 10 АДАЧА № 10
Медсестра процедурного кабинета только что получила из аптеки анальгин (раствор для инъекций в/м и в/в введения: 10 ампул по 2 мл в дозе 500 мг/мл). П заглянула в лист назначений одного из пациентов. И ее настроение вмиг ухудшилось: в назначении
раствор для инъекций 50% по 2 мл. Боясь ошибиться в устных расчетах, медсестра взяла листок бумаги и карандаш. ВОПРОС: как вы думаете, какие математические вычисления проведет медсестра? |
Задачи для самостоятельной работы:
| 1) | Дано: 30,0 мази, содержащей 5% анестезина (Anaesthesinum) и 1% левомицетина (Laevomycetinum). Наружное.
Сколько грамм анестезина и левомицитина входит в состав мази? |
| 2) | Дано: 50,0 мази, содержащей 2% тетрациклина (Tetracyclinum) и 4% нистатина (Nystatinum). Наружное.
Сколько грамм тетрациклина и нистатина входит в состав мази? |
| 3) | Дано: 50.0 мази на вазелине (Vaselinum) и ланолине (Lanolinum) поровну, содержащей 10% танина (Tanninum).
Для смазывания пораженных участков кожи. Сколько грамм вазелина, ланолина и танина входит в состав мази? |
| 4) | Дано: мазь содержит анестезин — 2,5 грамма и вазелин до 50 грамм, рассчитать процентное содержание анестезина в мази. |
| 5) | Дано: Лидокаин вводят из расчета 3,5 мг на кг тела.
Сколько 10% раствора лидокаина необходимо ввести пациенту массой тела 70 кг |
| 6) | Дано: 5 ампул 10% раствора новокаинамида (Novocainamidum) по 5 мл для внутримышечного введения.
Рассчитать объем вводимого раствора для больного весом 50 кг, если разовая доза равна 10мг/кг. |
| 7) | Дано: 10 ампул 0,2% раствора платифиллина гидротартрата по 1 мл. Рассчитать дозу платифиллина в 1 мл, назвать в миллиграммах |
 |
Дано: Ампулы 40% глюкозы по 10 ml.
Приготовить 5% раствор глюкозы, используя 500 ml физраствора. |
| 9) | Дано: для обработки слизистой используется раствор перманганата калия KMnO4 1:1000.Укажите концентрацию в процентах %.
Приготовить 100 мл раствора. |
| 10) | Молодая мама имеет на руках назначение врача: для ингаляции ребенку использовать 0,01% раствор нафтизина.
В аптеке она купила раствор нафтизина — 10 мл 0,05% и физраствор (0,9%) для разведения. Домой все принесла, а как приготовить раствор – не знает. Научите маму: как приготовить 10 мл раствора в соответствии с назначением врача. |
| 11) | В вашем распоряжении дозатор емкостью 50 мл, имеющий регулятор переключения скорости подачи раствора в вену,
заполненный 0,5 % раствором дофамина. Какую скорость(мл/час) надо установить на дозаторе, чтобы пациент весом 50 кг. получил дофамин в дозе 5 мкг/кг в минуту. |
РАЗДЕЛ 8.НАБОР В ШПРИЦ ИНСУЛИНА. ЗАДАЧИ
Инсулин выпускается во флаконах по 40 ЕД/мл или по 100 ЕД/мл. Они содержат 40 ЕД инсулина в 1 мл или 100 ЕД инсулина в 1 мл. (см.приложение1, 7)
В настоящее время для введения инсулина выпускаются специальные шприцы, откалиброванные в ЕД.
Т.о., если врач назначает 25 ЕД инсулина, то вы должны набрать препарат в шприц до отметки 25 ЕД из соответствующего вашему шприцу флакона.
Иногда, при отсутствии инсулинового шприца, необходимо уметь рассчитать нужное количество инсулина в мл и ввести его обычным шприцом.
| В 1 мл 40 ЕД |

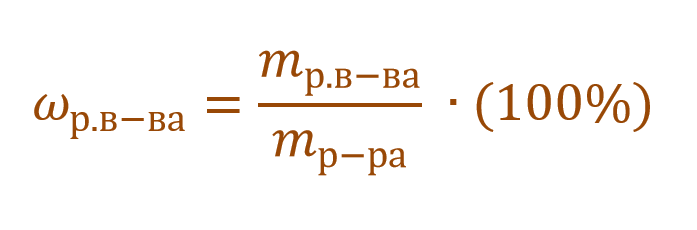
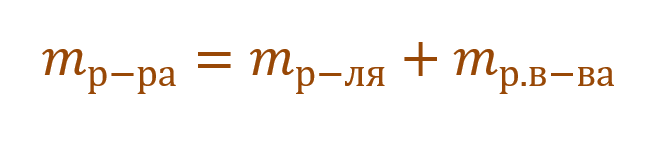
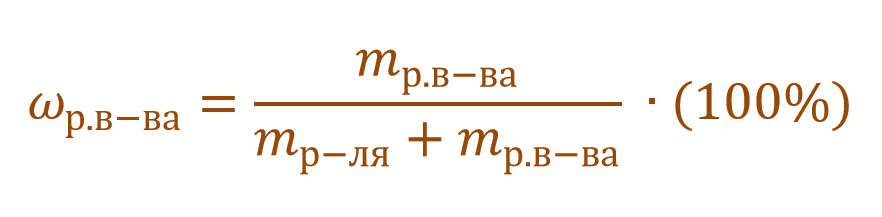
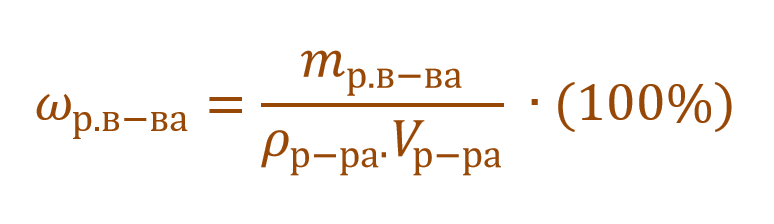
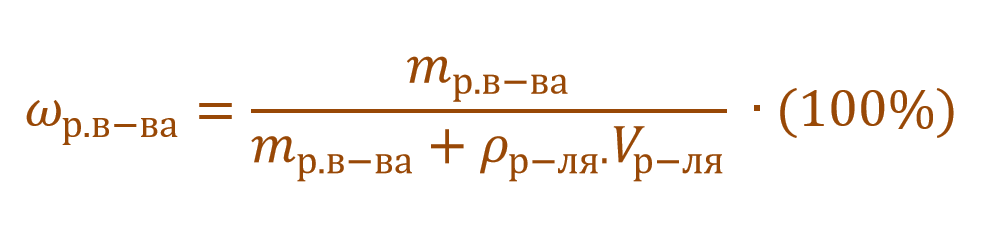
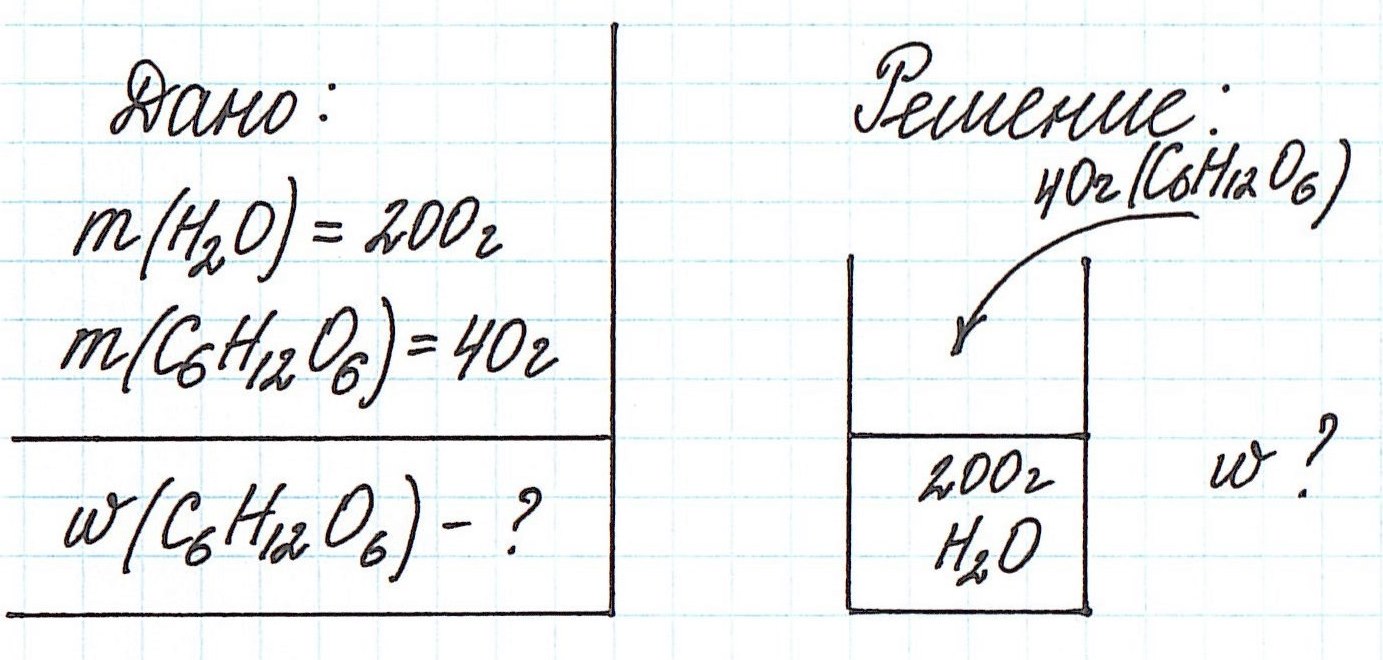
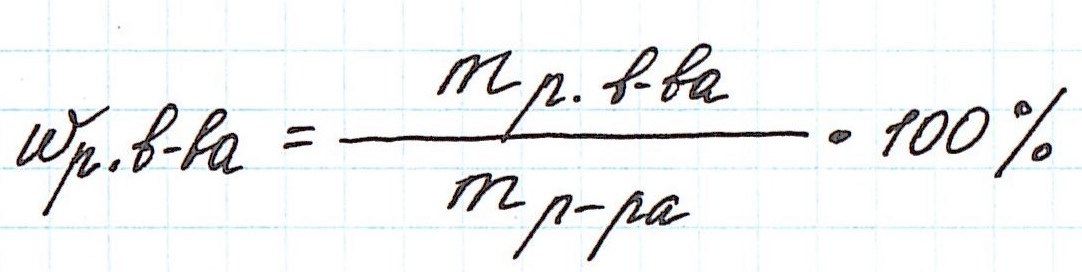
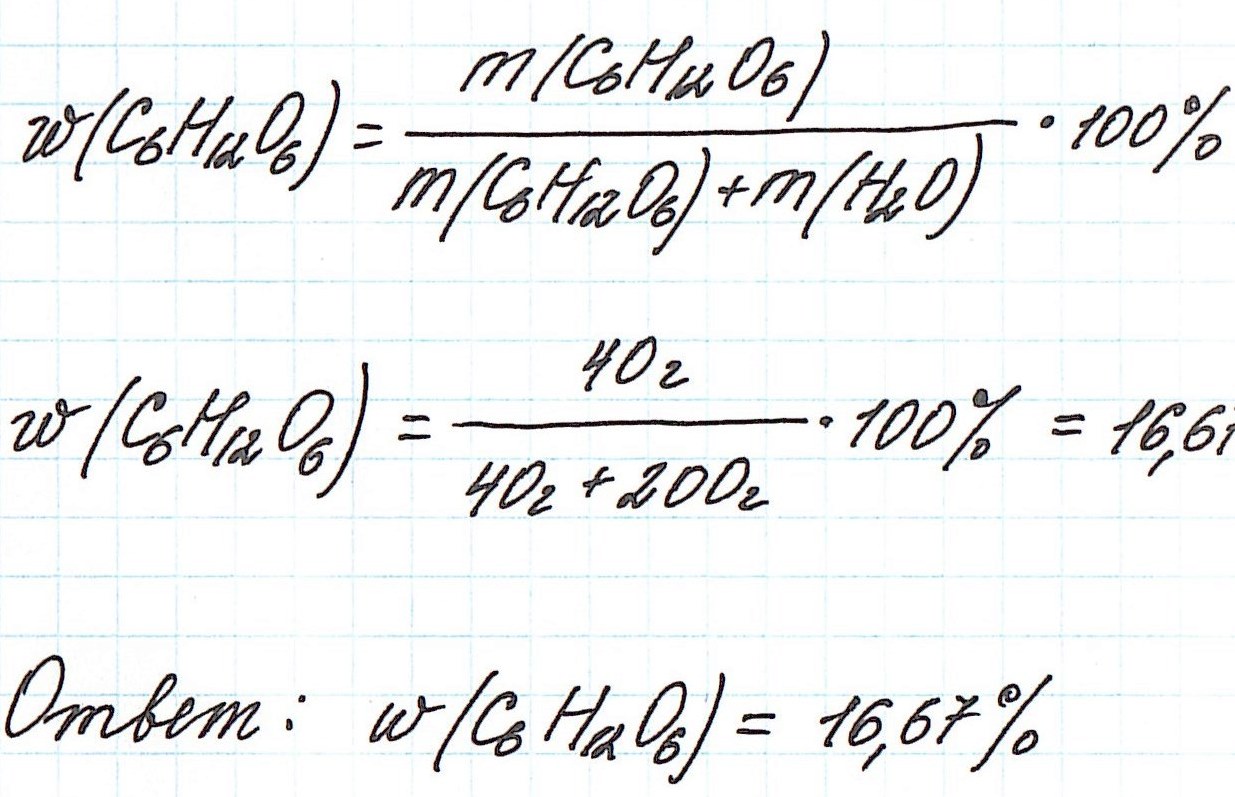
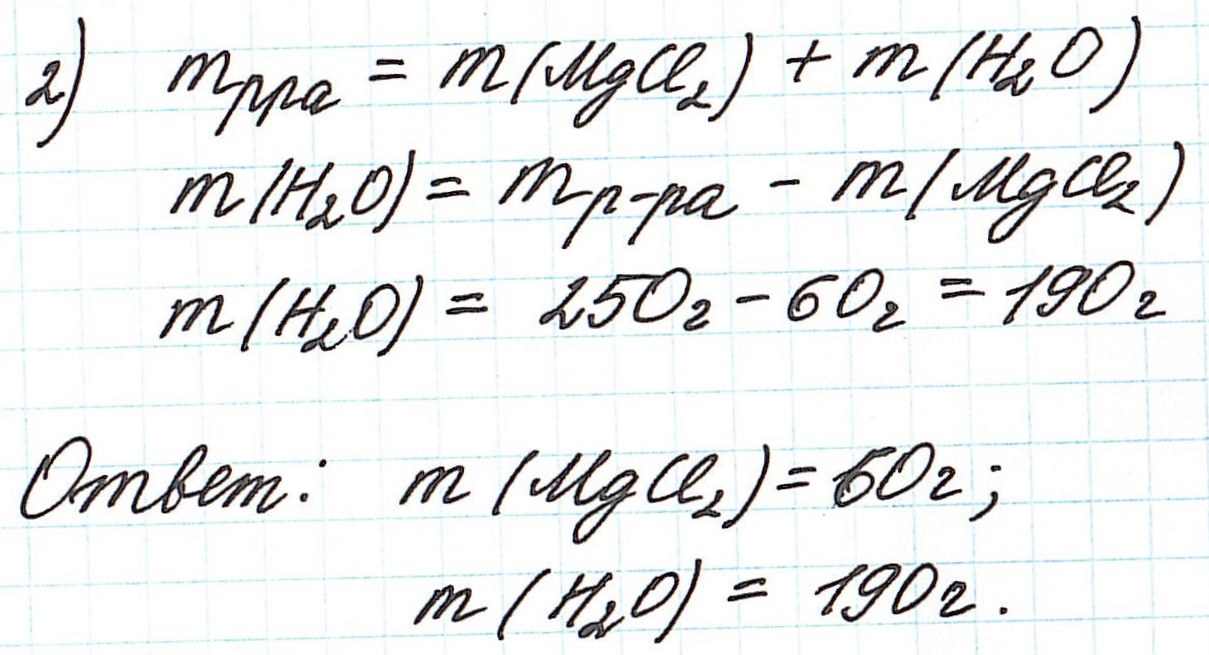
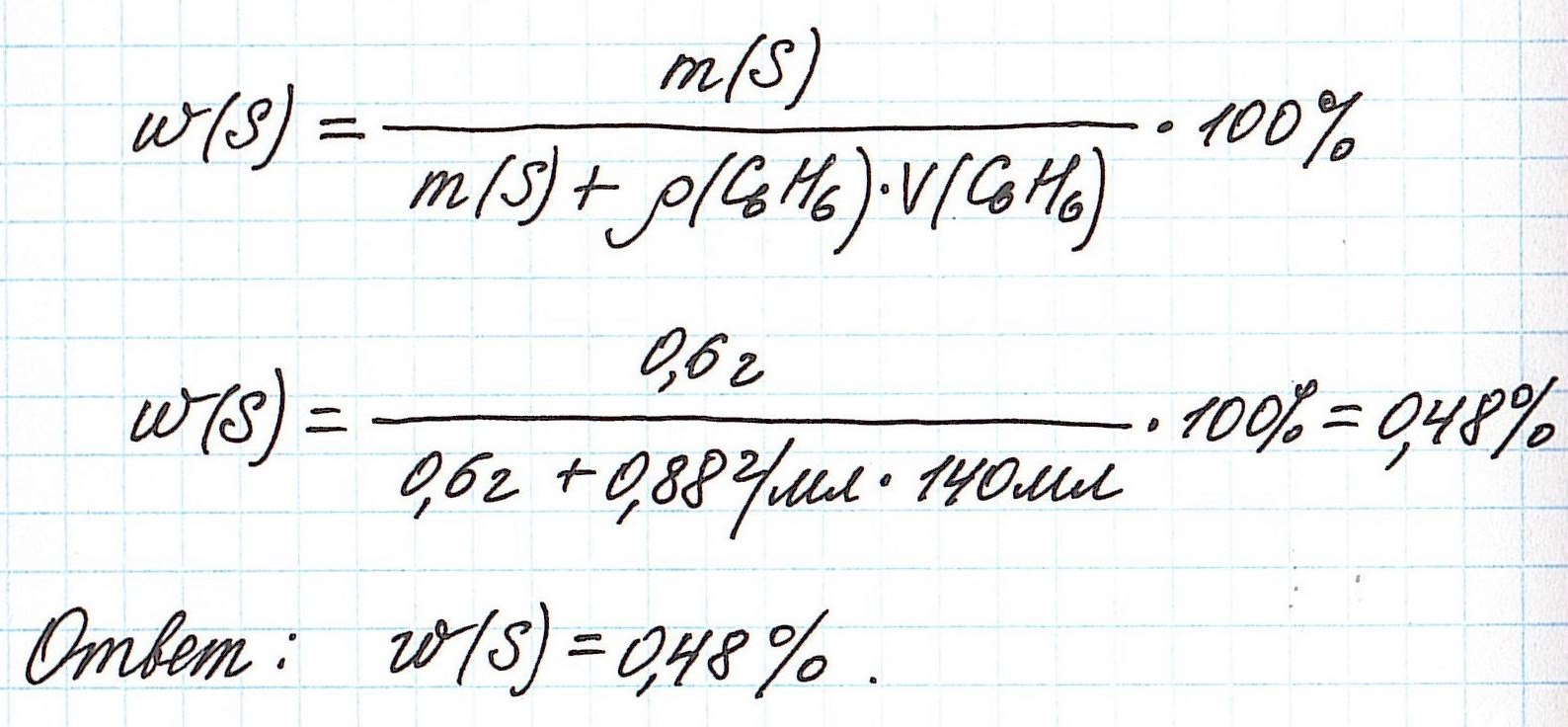
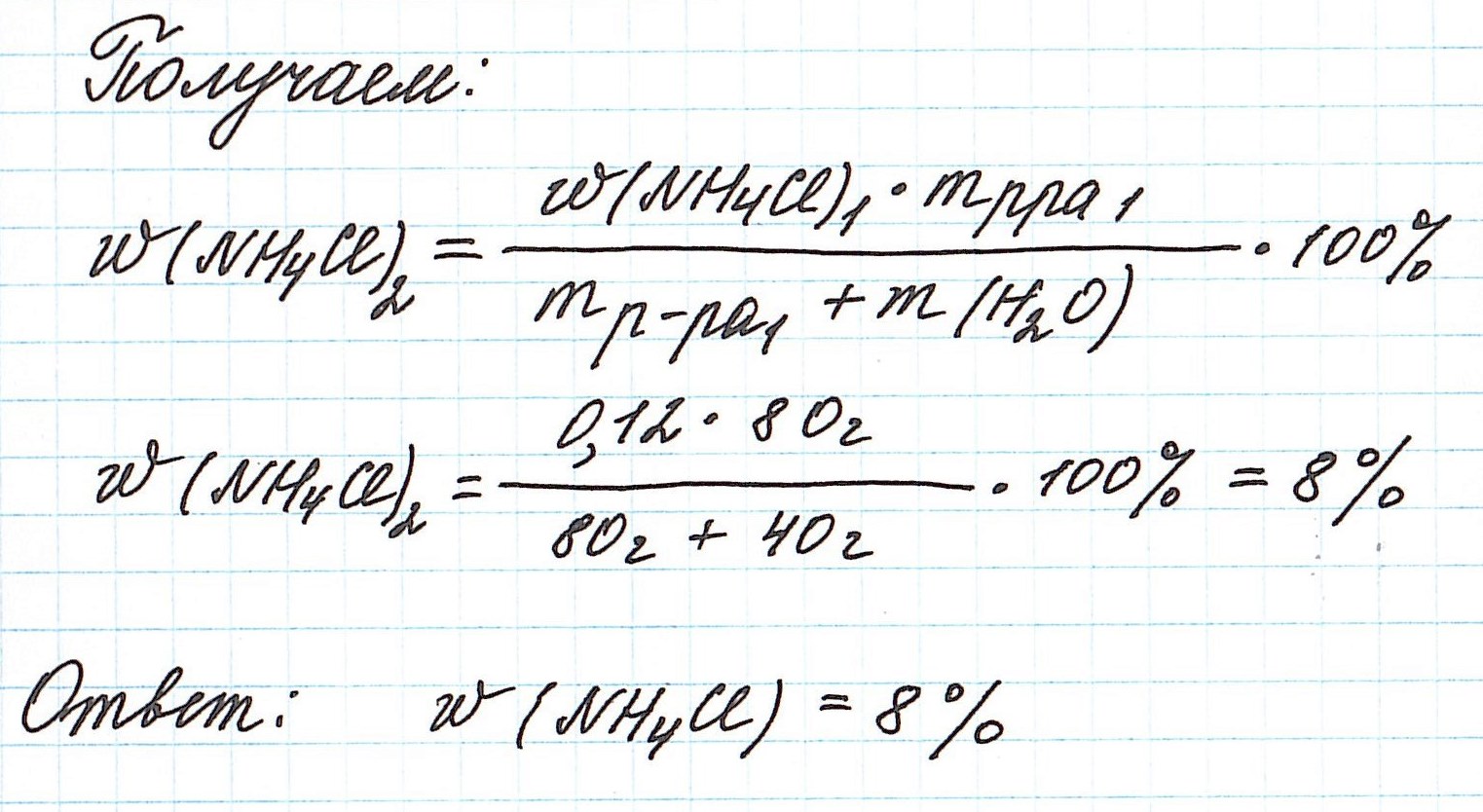



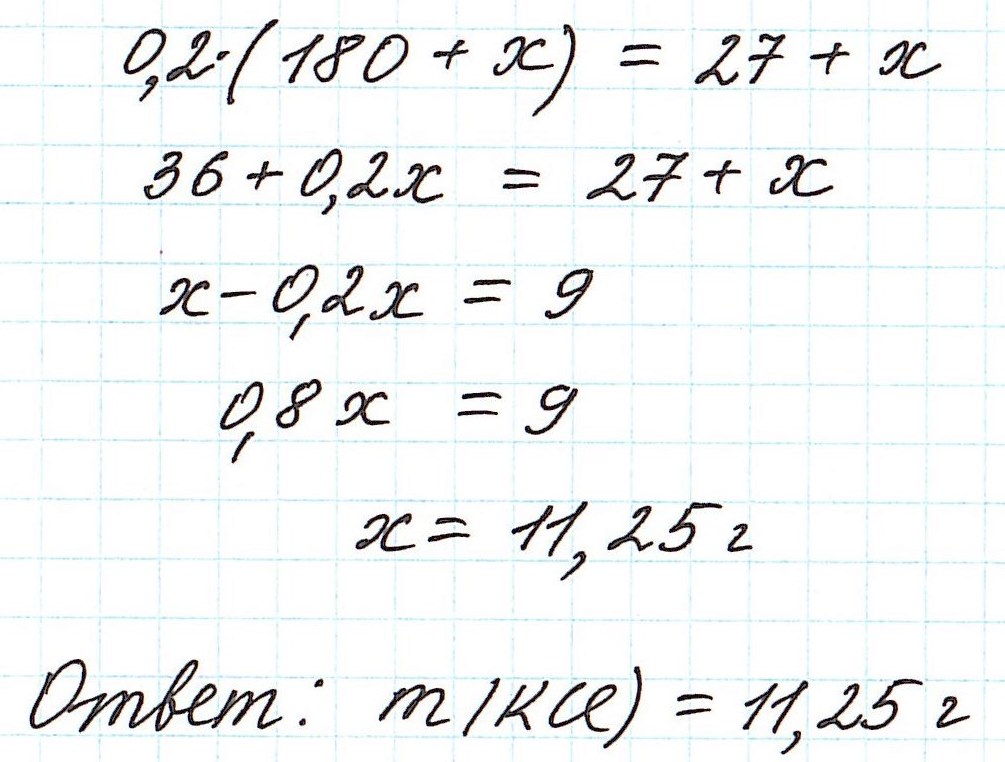

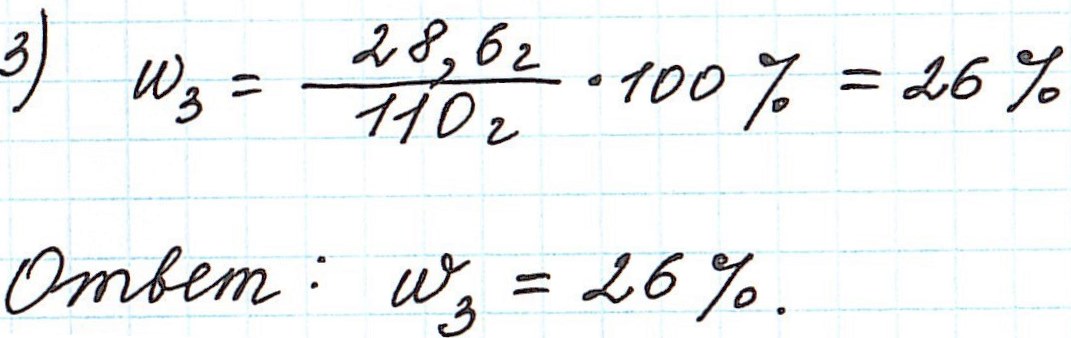

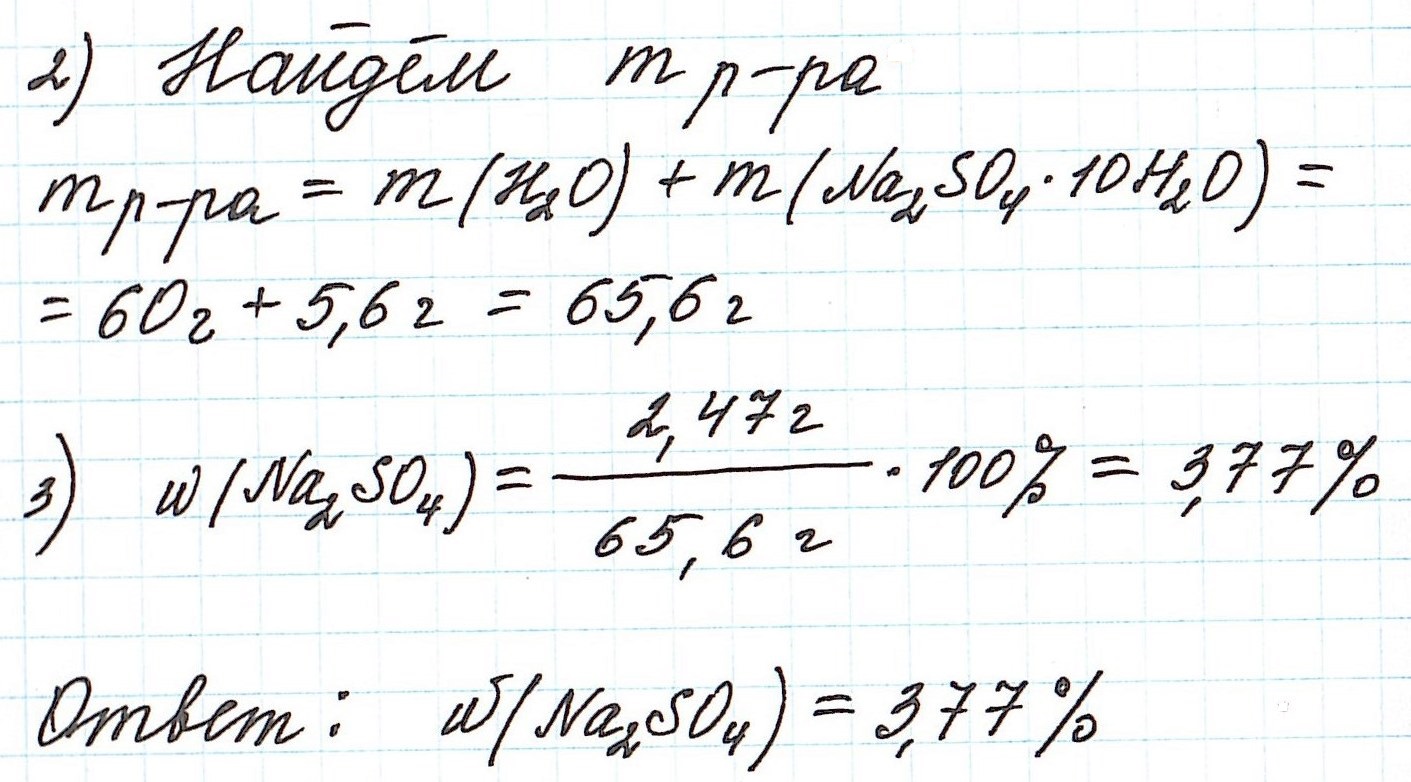
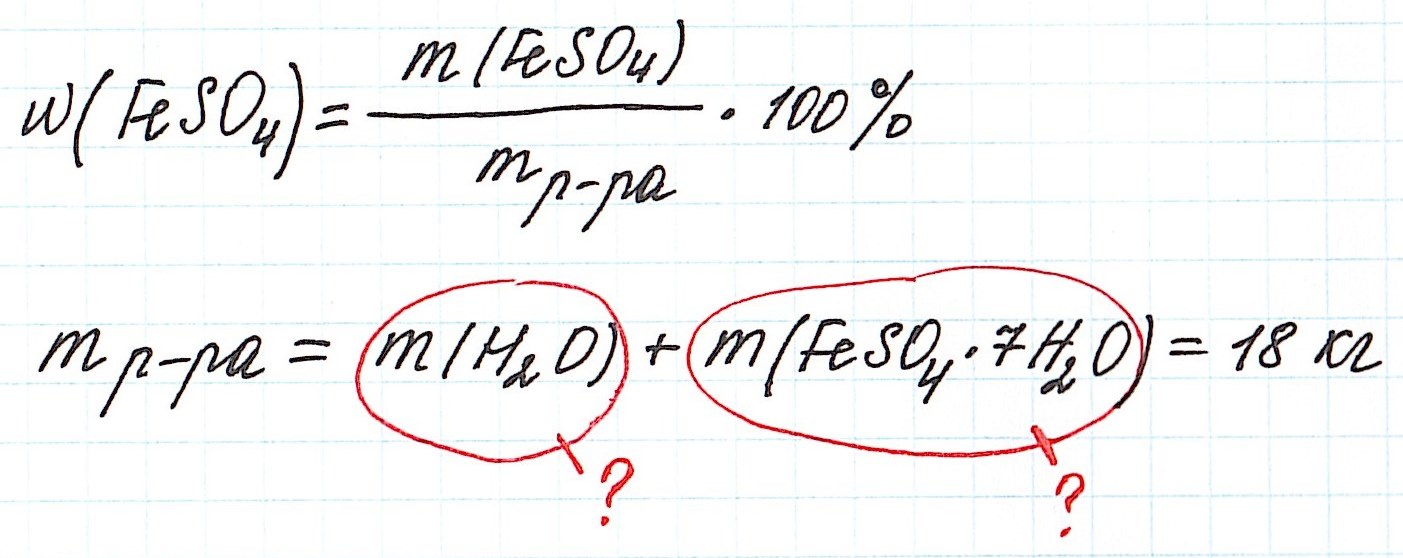

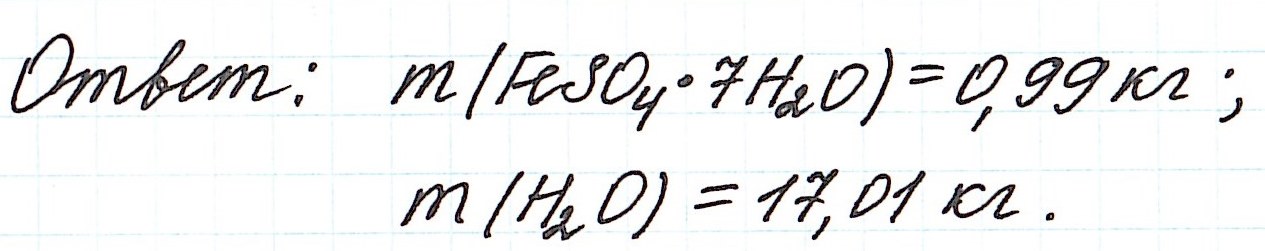







 000 мл (1,5%) – х г
000 мл (1,5%) – х г х мл (5%) – 30 г
х мл (5%) – 30 г




 Больному назначен антибиотик для парентерального (в/м введения) в дозе 400 000 ЕД 2 раза в день. Курс антибиотикотерапии — 7дней. В аптеке имеется данный антибиотик в такой форме выпуска:250 000 ЕД во флаконе (порошок).
Больному назначен антибиотик для парентерального (в/м введения) в дозе 400 000 ЕД 2 раза в день. Курс антибиотикотерапии — 7дней. В аптеке имеется данный антибиотик в такой форме выпуска:250 000 ЕД во флаконе (порошок).

 Для разведения антибиотика используется раствор новокаина 0.5% по 5.0 мл в ампуле.
Для разведения антибиотика используется раствор новокаина 0.5% по 5.0 мл в ампуле. ОПРОС: сколько ампул новокаина надо приобрести в аптеке на весь курс лечения для разведения антибиотика A1(при условии классического разведения). Выполнить расчет для форм выпуска №1 и №2.
ОПРОС: сколько ампул новокаина надо приобрести в аптеке на весь курс лечения для разведения антибиотика A1(при условии классического разведения). Выполнить расчет для форм выпуска №1 и №2. 



 ребывая в приподнятом настроении, она
ребывая в приподнятом настроении, она  указывалась другая форма выпуска (!):
указывалась другая форма выпуска (!):