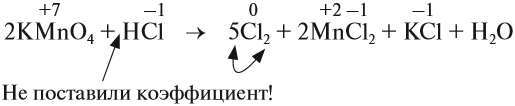
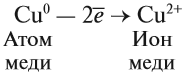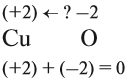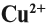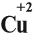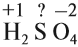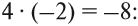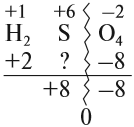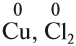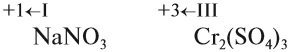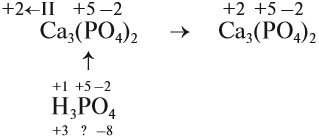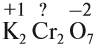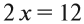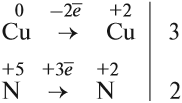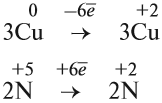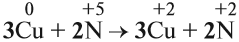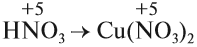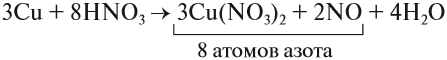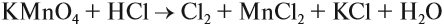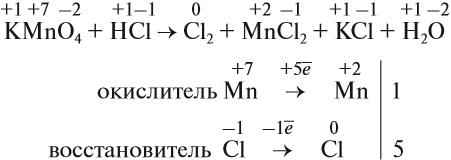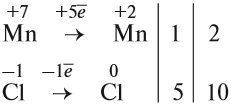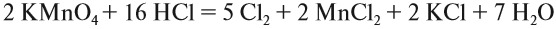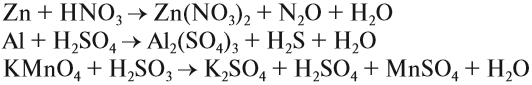Метод электронного баланса и ионно-электронный метод (метод полуреакций)
Спецификой многих ОВР является то, что при составлении их уравнений подбор коэффициентов вызывает затруднение.
Для облегчения подбора коэффициентов чаще всего используют метод электронного баланса и ионно-электронный метод (метод полуреакций). Рассмотрим применение каждого из этих методов на примерах.
Метод электронного баланса
В его основе метода электронного баланса лежит следующее правило: общее число электронов, отдаваемое атомами-восстановителями, должно совпадать с общим числом электронов, которые принимают атомы-окислители .
В качестве примера составления ОВР рассмотрим процесс взаимодействия сульфита натрия с перманганатом калия в кислой среде.
1) Составить схему реакции:
Записать исходные вещества и продукты реакции, учитывая, что в кислой среде MnO4 — восстанавливается до Mn 2+ (см. схему):
Найдем степень окисления элементов:
Из приведенной схемы понятно, что в процессе реакции происходит увеличение степени окисления серы с +4 до +6. S +4 отдает 2 электрона и является восстановителем. Степень окисления марганца уменьшилась от +7 до +2, т.е. Mn +7 принимает 5 электронов и является окислителем.
3) Составить электронные уравнения и найти коэффициенты при окислителе и восстановителе.
S +4 – 2e — = S +6 | 5 восстановитель, процесс окисления
Mn +7 +5e — = Mn +2 | 2 окислитель, процесс восстановления
Чтобы число электронов, отданных восстановителем, было равно числу электронов, принятых восстановителем, необходимо:
- Число электронов, отданных восстановителем, поставить коэффициентом перед окислителем.
- Число электронов, принятых окислителем, поставить коэффициентом перед восстановителем.
Таким образом, 5 электронов, принимаемых окислителем Mn +7 , ставим коэффициентом перед восстановителем, а 2 электрона, отдаваемых восстановителем S +4 коэффициентом перед окислителем:
4) Уравнять количества атомов элементов, не изменяющих степень окисления
Соблюдаем последовательность: число атомов металлов, кислотных остатков, количество молекул среды (кислоты или щелочи). В последнюю очередь подсчитывают количество молекул образовавшейся воды.
Итак, в нашем случае число атомов металлов в правой и левой частях совпадают.
По числу кислотных остатков в правой части уравнения найдем коэффициент для кислоты.
В результате реакции образуется 8 кислотных остатков SO4 2- , из которых 5 – за счет превращения 5SO3 2- → 5SO4 2- , а 3 – за счет молекул серной кислоты 8SO4 2- — 5SO4 2- = 3SO4 2- .
Таким образом, серной кислоты надо взять 3 молекулы:
Аналогично, находим коэффициент для воды по числу ионов водорода, во взятом количестве кислоты
6H + + 3O -2 = 3H2O
Окончательный вид уравнения следующий:
Признаком того, что коэффициенты расставлены правильно является равное количество атомов каждого из элементов в обеих частях уравнения.
Ионно-электронный метод (метод полуреакций)
Реакции окисления-восстановления, также как и реакции обмена, в растворах электролитов происходят с участием ионов. Именно поэтому ионно-молекулярные уравнения ОВР более наглядно отражают сущность реакций окисления-восстановления.
При написании ионно-молекулярных уравнений, сильные электролиты записывают в виде ионов, а слабые электролиты, осадки и газы записывают в виде молекул (в недиссоциированном виде).
При написании полуреакций в ионной схеме указывают частицы, подвергающиеся изменению их степеней окисления, а также характеризующие среду, частицы:
H + — кислая среда, OH — — щелочная среда и H2O – нейтральная среда.
Пример 1.
Рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в кислой среде.
1) Составить схему реакции:
Записать исходные вещества и продукты реакции:
2) Записать уравнение в ионном виде
В уравнении сократим те ионы, которые не принимают участие в процессе окисления-восстановления:
SO3 2- + MnO4 — + 2H + = Mn 2+ + SO4 2- + H2O
3) Определить окислитель и восстановитель и составить полуреакции процессов восстановления и окисления.
В приведенной реакции окислитель — MnO4 — принимает 5 электронов восстанавливаясь в кислой среде до Mn 2+ . При этом освобождается кислород, входящий в состав MnO4 — , который, соединяясь с H + образует воду:
MnO4 — + 8H + + 5e — = Mn 2+ + 4H2O
Восстановитель SO3 2- — окисляется до SO4 2- , отдав 2 электрона. Как видно образовавшийся ион SO4 2- содержит больше кислорода, чем исходный SO3 2- . Недостаток кислорода восполняется за счет молекул воды и в результате этого происходит выделение 2H + :
SO3 2- + H2O — 2e — = SO4 2- + 2H +
4) Найти коэффициенты для окислителя и восстановителя
Необходимо учесть, что окислитель присоединяет столько электронов, сколько отдает восстановитель в процессе окисления-восстановления:
MnO4 — + 8H + + 5e — = Mn 2+ + 4H2O |2 окислитель, процесс восстановления
SO3 2- + H2O — 2e — = SO4 2- + 2H + |5 восстановитель, процесс окисления
5) Просуммировать обе полуреакции
Предварительно умножая на найденные коэффициенты, получаем:
2MnO4 — + 16H + + 5SO3 2- + 5H2O = 2Mn 2+ + 8H2O + 5SO4 2- + 10H +
Сократив подобные члены, находим ионное уравнение:
2MnO4 — + 5SO3 2- + 6H + = 2Mn 2+ + 5SO4 2- + 3H2O
6) Записать молекулярное уравнение
Молекулярное уравнение имеет следующий вид:
Пример 2.
Далее рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в нейтральной среде.
В ионном виде уравнение принимает вид:
Также, как и предыдущем примере, окислителем является MnO4 — , а восстановителем SO3 2- .
В нейтральной и слабощелочной среде MnO4 — принимает 3 электрона и восстанавливается до MnО2. SO3 2- — окисляется до SO4 2- , отдав 2 электрона.
Полуреакции имеют следующий вид:
MnO4 — + 2H2O + 3e — = MnО2 + 4OH — |2 окислитель, процесс восстановления
SO3 2- + 2OH — — 2e — = SO4 2- + H2O |3 восстановитель, процесс окисления
Запишем ионное и молекулярное уравнения, учитывая коэффициенты при окислителе и восстановителе:
Пример 3.
Составление уравнения реакции между сульфитом натрия и перманганатом калия в щелочной среде.
В ионном виде уравнение принимает вид:
В щелочной среде окислитель MnO4 — принимает 1 электрон и восстанавливается до MnО4 2- . Восстановитель SO3 2- — окисляется до SO4 2- , отдав 2 электрона.
Полуреакции имеют следующий вид:
MnO4 — + e — = MnО2 |2 окислитель, процесс восстановления
SO3 2- + 2OH — — 2e — = SO4 2- + H2O |1 восстановитель, процесс окисления
Запишем ионное и молекулярное уравнения, учитывая коэффициенты при окислителе и восстановителе:
Необходимо отметить, что не всегда при наличии окислителя и восстановителя, возможно самопроизвольное протекание ОВР. Поэтому для количественной характеристики силы окислителя и восстановителя и для определения направления реакции пользуются значениями окислительно-восстановительных потенциалов.
Еще больше примеров составления окислительно-восстановительных реакций приведены в разделе Задачи к разделу Окислительно-восстановительные реакции. Также в разделе тест Окислительно-восстановительные реакции
Метод электронного баланса в доступном изложении
Задача.
Методом электронного баланса подберите коэффициенты в схемах следующих окислительно-восстановительных реакций с участием металлов:
Применение метода электронного баланса по шагам. Пример «а»
(в сумме, опять же, получим ноль, как и должно быть)
Теперь перейдем ко второй части уравнения.
Для AgNO3 степень окисления серебра +1 кислорода -2, следовательно степень окисления азота равна:
Для NO степень окисления кислорода -2, следовательно азота +2
Для H2O степень окисления водорода +1, кислорода -2
Шаг 2. Запишем уравнение в новом виде, с указанием степени окисления каждого из элементов, участвующих в химической реакции.
Ag 0 + H +1 N +5 O -2 3 → Ag +1 N +5 O -2 3 + N +2 O -2 + H +1 2O -2
- В первоначальном уравнении перед Ag ставим тройку, что потребует такого же коэффициента перед AgNO3
- Теперь у нас возник дисбаланс по количеству атомов азота. В правой части их четыре, в левой — один. Поэтому ставим перед HNO3 коэффициент 4
- Теперь остается уравнять 4 атома водорода слева и два — справа. Решаем это путем применения коэффииента 2 перед H2O
Пример «б»
Для H2SO4 степень окисления водорода +1 кислорода -2 откуда степень окисления серы 0 — (+1)*2 — (-2)*4 = +6
Для CaSO4 степень окисления кальция равна +2 кислорода -2 откуда степень окисления серы 0 — (+2) — (-2)*4 = +6
Для H2S степень окисления водорода +1, соответственно серы -2
Ca 0 +H +1 2S +6 O -2 4 → Ca +2 S +6 O -2 4 + H +1 2S -2 + H +1 2O -2
Ca 0 — 2e = Ca +2 (коэффициент 4)
S +6 + 8e = S -2
Пример «в»
Для Be(NO3)2 степень окисления бериллия +2, кислорода -2, откуда степень окисления азота ( 0 — (+2) — (-2)*3*2 ) / 2 = +5
Be 0 + H +1 N +5 O -2 3 → Be +2 (N +5 O -2 3)2 + N +2 O -2 + H +1 2O -2
Be 0 — 2e = Be +2 (коэффициент 3)
N +5 +3e = N +2 (коэффициент 2)
Применение метода электронного баланса для расстановки коэффициентов в неорганических реакциях. Случаи, когда индекс при химическом элементе вносится в электронный баланс. Расстановка коэффициентов методом электронного баланса, если в уравнении более 2 элементов меняют степени окисления
Применение метода электронного баланса для расстановки коэффициентов в неорганических реакциях. Случаи, когда индекс при химическом элементе вносится в электронный баланс. Расстановка коэффициентов методом электронного баланса, если в уравнении более 2 элементов меняют степени окисления.
Решение заданий части С ЕГЭ требует от учащихся комплекса знаний и умений.
Давайте разберемся, что нужно знать и уметь ученику, чтобы успешно выполнить задание С1.
1. Уметь расставлять степени окисления элементов в молекулярных формулах веществ.
2. Уметь составлять электронный баланс, то есть определять количество и направление перехода электронов.
3. Уметь расставлять коэффициенты.
Именно этим трем пунктам будет посвящено наше первое занятие.
Однако, помимо этого, есть еще более сложные умения: прогнозировать продукты окислительно-восстановительных процессов, исходя из данных реагентов, или реагенты, исходя из продуктов. Этому будут посвящены наши дальнейшие занятия.
Умение 1: расставлять степени окисления элементов в молекулярных формулах веществ.
Это умение не является простым. Для того, чтобы определить степени окисления элементов, нужны определенные знания и способы их применения.
Какие это знания?
1. Электроотрицательность – способность атомов притягивать к себе общие электронные пары. Притягивая к себе электроны, атомы приобретают частичный отрицательный заряд. Наиболее электроотрицательными являются неметаллы: фтор, кислород и азот. Металлы, как правило, смещают электроны от себя, приобретая положительный заряд. Сравнить электроотрицательность разных элементов можно с помощью ряда электроотрицательности, или по положению в периодической системе.
2. Степень окисления. Понятие степени окисления весьма формально: это заряд, который приобрел бы атом, если бы все связи в молекуле стали ионными. Можно объяснить степень окисления несколько иначе: как число электронов, смещенных к атому ( – ) или от атома (+). Для того, чтобы воспользоваться этим определением степени окисления, потребуются графические (структурные) формулы, которые ученики не всегда могут построить правильно. Этот метод хорош в органической химии, и мы к нему обязательно обратимся на следующем занятии.
При определении степени окисления в неорганических веществах чаще всего пользуются алгебраическим методом и находят усредненное значение степени окисления. Именно поэтому иногда степень окисления выражается нецелыми числами. Степень окисления каждого отдельного атома должна быть целым числом (потому что смещается целое количество электронов).
3. Значение степени окисления некоторых элементов.
Ученики должны знать, что:
· Степень окисления элементов в простых веществах равна 0.
· Фтор в соединениях имеет степень окисления – 1.
· Металлы 1-2 группы главной подгруппы в соединениях имеют степень окисления +№ группы. (В принципе, можно сказать, что бор и алюминий тоже имеют степень окисления +№ группы, так как в школьном курсе с другими степенями окисления этих элементов мы не сталкиваемся. Но строго говоря, у алюминия, галлия, индия и таллия есть соединения, в которых они проявляют степень окисления +1)
· Водород в большинстве соединений проявляет степень окисления +1, и только в гидридах (соединениях с металлами) может быть – 1.
· Кислород чаще всего проявляет степень окисления – 2. Однако, в соединениях с фтором может быть +1 или +2, в соединениях с активными металлами и водородом может проявлять степень окисления – 1 (пероксиды), и дробные степени окисления (надпероксиды и озониды).
Как ученику понять, что в этом соединении у кислорода(или другого элемента) нетипичная степень окисления? Для этого достаточно расставлять степени окисления именно в том порядке, в котором я здесь их привожу, то есть сначала у атомов фтора, потом у атомов металлов 1, 2, 3 групп главных подгрупп, потом у водорода, потом у кислорода. Например, КО3. Расставлять степени окисления нужно с калия, так как у него возможна единственная степень окисления +1, тогда у кислорода – 1/3. N2H4 – расставлять степени окисления следует с водорода, так как он соединен с неметаллом, то проявляет степень окисления +1, значит, у азота степень окисления – 2. HOF – сначала определим степень окисления фтора – 1, потом водорода +1, степень окисления кислорода оказывается 0.
· Все остальные неметаллы могут проявлять переменные степени окисления от (№ группы – 
· Металлы побочных подгрупп и главных подгрупп 4 – 6 групп могут иметь только положительные степени окисления в соединениях, причем у элементов побочных подгрупп номер группы не всегда соответствует высшей степени окисления (например, медь +2, золото +3, железо +6, никель +2, кобальт +3 и т. д.). Степень окисления этих элементов можно определить только по формуле.
Алгебраический метод определения степени окисления исходит из того, что молекула в целом электронейтральна, то есть сумма степеней окисления всех элементов равна нулю.
Например, определим степени окисления элементов в молекуле серной кислоты H2SO4. Так как водород в этой молекуле не связан с металлом, то его степень окисления +1(на 2 атома водорода приходится +2), кислород не связан с фтором, перед нами явно не пероксид и не озонид, поэтому его степень окисления – 2 (на 4 атома кислорода приходится –8). Обозначим степень окисления серы за х. Тогда +2–8+х = 0; х = +6.
Этот метод хорош и для определения степени окисления элементов в ионах. Например, ортофосфат-анион PO43–.
У кислорода степень окисления – 2, на 4 атома кислорода приходится –8, пусть степень окисления фосфора х, тогда сумма степеней окисления равна заряду иона, то есть: х–8 = –3, откуда х = +5
Вот несколько другой подход:
Определим, какой элемент в молекуле наиболее электроотрицательный и отделим его. Это кислород, у него будет низшая степень окисления (№ группы – 

Если в формуле используются скобки, это может вызвать затруднения у учащихся. Здесь можно предложить несколько вариантов определения степени окисления.
Например, ортофосфат кальция. Первый вариант заключается в том, что нужно раскрыть скобки: Ca3(PO4)2 или Ca3P2O8, дальше можно действовать любым из указанных выше способов. Степени окисления кальция и кислорода очевидны, следует найти только степень окисления фосфора. Второй вариант заключается в том, что нужно определить степень окисления фосфора в соответствующей кислоте.
Третий вариант – найти степени окисления в ионе PO4 3 –
В формулах, где степень окисления не является постоянной у 2 элементов, нужно ориентироваться с помощью зарядов ионов.
Например, Fe2(SO4)3. Индекс у сульфат — иона показывает заряд железа. Дальше – любым из выше перечисленных способов.
FeSO4 – заряд сульфат — иона – 2, значит, у железа +2. И т. д.
Умение 2: составлять электронный баланс, то есть определять количество и направление перехода электронов.
Вы наверняка сталкивались с тем, что иногда путаете, отдает элемент электроны или принимает, окислитель он или восстановитель. Каждый учитель ищет рациональные способы запоминания понятий «окислитель», «восстановитель», «окисление», «восстановление», пытается добиться усвоения и безошибочного применения учащимися этих понятий.
Опять же начнем с обязательных знаний:
1. Окисление – процесс отдачи электронов. (Небольшой мнемонический приём: Окисление – Отдача, начинаются с одной буквы)
Восстановление – процесс принятия электронов.
2. Окисление происходит с восстановителем. Значит, восстановитель отдает электроны, окисляется, его степень окисления повышается.
Восстановление происходит с окислителем. Значит, окислитель принимает электроны, восстанавливается, его степень окисления понижается.
(Здесь я хочу вам предложить юмористический приём запоминания, связанный с одушевлением атомов. Восстановитель – созидатель, меценат, он отдает свои электроны, в результате приобретает «положительную репутацию» в обществе, то есть повышает степень окисления. А окислитель – вор, отбирает электроны у других элементов, в результате его «репутация» падает (степень окисления понижается). А рассуждать можно так: степень окисления понизилась, значит, репутация упала, это «плохой» герой нашей истории, окислитель, он отбирает электроны у других. И, наоборот: степень окисления повысилась, репутация возросла, значит, это положительный герой, он жертвует свои электроны, это восстановитель)
Кому не нравится такой подход, предлагаю графический метод:
Сколько электронов принимает или отдает атом элемента, можно посчитать по координатной прямой.
А теперь логический метод. Положительная степень окисления атома – это нехватка отрицательных частиц – электронов, отрицательная – избыток электронов. Например, S+4 ®S – 2 . Рассуждаем так: до реакции атому серы не хватало 4 электронов, после реакции появилось 2 лишних. Это значит, что он приобрел 6 электронов (4 – для того, чтобы стать нейтральной частицей, и ещё 2 – чтобы приобрести отрицательную степень окисления).
После того, как учащиеся научатся определять количество и направление перехода электронов, и записывать это в виде электронного баланса, можно переходить к расстановке коэффициентов.
Умение 3: расставлять коэффициенты методом электронного баланса.
Здесь мне хотелось бы рассмотреть два достаточно распространенных примера:
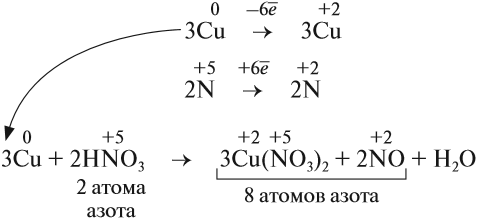
Cu + HNO3 ® Cu(NO3)2 + NO + H2O
1) Определяем степени окисления всех элементов;
2) Выбираем те элементы, у которых изменилась степень окисления;
3) Составляем электронный баланс

N +5 +3e ® N+2 2 окислитель
Число принятых и отданных электронов переносим крест-накрест и сокращаем. Это множители, которые позволяют осуществить закон сохранения: число принятых электронов должно быть равно числу отданных электронов.
Теперь эти множители нужно внести в схему реакции, они должны стать коэффициентами. Перед атомами меди в левой и правой части уравнения нужно поставить коэффициент 3. В этом действии можно не сомневаться, так как медь в левой и правой части встречается только по одному разу.
3 Cu + HNO3 ® 3Cu(NO3)2 + NO + H2O
А вот с азотом возникает вопрос: к какому из атомов азота относится коэффициент 2? Ответ: к тому, степень окисления которого в уравнении встречается единожды, то есть +2. Ставим коэффициент 2 перед NO.
3 Cu + HNO3 ® 3Cu(NO3)2 + 2NO + H2O
Дальше сравниваем левую и правую часть схемы и достраиваем коэффициенты в таком порядке: в правой части после выставления коэффициентов из баланса перед всеми атомами азота есть коэффициенты, пересчитаем азот в правой части – 8, ставим этот коэффициент перед азотной кислотой.
Теперь в левой части поставлен коэффициент перед водородом, число его атомов 8. Ставим в правую часть перед водой 4.
Осталось сравнить число атомов кислорода в левой и правой части уравнения. Если равно – коэффициенты расставлены правильно, если нет – ищем ошибку.
KMnO4 + K2SO3 + H2SO4 ® MnSO4 + K2SO4 + H2O
1) Определяем степени окисления всех элементов;
2) Выбираем те элементы, у которых изменилась степень окисления;
3) Составляем электронный баланс

Mn+7 +5e ® Mn+2 2 окислитель
Перед атомами марганца в левой и правой части уравнения нужно поставить коэффициент 2. В этом действии можно не сомневаться, так как марганец в левой и правой части встречается только по одному разу.
2KMnO4 + K2SO3 + H2SO4 ® 2MnSO4 + K2SO4 + H2O
С серой возникает вопрос: к какому из атомов серы относится коэффициент 5? К тому, степень окисления которого в уравнении встречается единожды, то есть +4. Ставим коэффициент 5 перед K2SO3.
2KMnO4 + 5K2SO3 + H2SO4 ® 2MnSO4 + K2SO4 + H2O
Дальше сравниваем левую и правую часть схемы и достраиваем коэффициенты в таком порядке: калий ( в левой части 10+2=12, перед K2SO4 поставим 6)
2KMnO4 + 5K2SO3 + H2SO4 ® 2MnSO4 + 6K2SO4 + H2O
Теперь в правой части поставлены коэффициенты перед серой, число её атомов 8. В левой части уже есть коэффициент перед серой 5, не хватает еще 3.
2KMnO4 + 5K2SO3 + 3H2SO4 ® 2MnSO4 + 6K2SO4 + H2O
Сравниваем число атомов водорода. Ставим перед водой 3.
2KMnO4 + 5K2SO3 + 3H2SO4 ® 2MnSO4 + 6K2SO4 + 3H2O
Осталось сравнить число атомов кислорода в левой и правой части уравнения. 35 и 35.
Случаи, когда индекс при химическом элементе вносится в электронный баланс.
1) Если формула простого вещества записывается с индексом:
NH3 +O2 ® NO + H2O

5 ставим перед простым веществом – кислородом, 4 – перед азотом в левой и правой части уравнения, уравниваем водород, проверяем кислород.
2) Если в молекуле атомы одного элемента соединены между собой (то есть присутствует ковалентная неполярная связь): пероксиды, дисульфиды, тиосульфат, веселящий газ, органические вещества:
Cr(OH)3 + H2O2 + KOH ® K2CrO4 + H2O

3 ставим перед пероксидом водорода, 2 – перед хромом в левой и правой части уравнения, уравниваем калий, потом — водород, проверяем кислород.
2Cr(OH)3 + 3H2O2 + 4KOH = 2 K2CrO4 + 8H2O
3) Если у элемента усредненная степень окисления получается нецелым числом
(железная окалина, надпероксиды, озониды, органические вещества):
Fe3O4 + H2SO4 (конц)®Fe2(SO4)3 + SO2 + H2O

S+6 +2e ® S+4 1 окислитель
2 ставим перед железной окалиной, тогда перед сульфатом железа – 3, перед сернистым газом коэффициента не будет, тогда справа 10 атомов серы, 10 ставим перед серной кислотой, уравниваем водород (перед водой – 10), сравниваем кислород
2Fe3O4 + 10H2SO4 (конц)=3Fe2(SO4)3 + SO2 + 10 H2O
4) Если у одного элемента в левой и правой части уравнения есть одинаковый индекс:
K2Cr2O7 + K2SO3 + H2SO4 ® Cr2(SO4)3 + K2SO4 + H2O

Перед сульфитом ставим 3, перед хромом в левой и правой части коэффициент не нужен, уравниваем калий (в правой части перед сульфатом калия ставим 4), затем – серу (в левой части перед серной кислотой – 4), водород – перед водой 4, проверяем кислород.
K2Cr2O7 + 3K2SO3 + 4H2SO4 = Cr2(SO4)3 + 4K2SO4 + 4H2O
5) Если без удвоения не уравнивается, хотя индекс у элемента есть только в одной из частей уравнения.
NO2 + P2O3 + KOH → NO + K2HPO4+ H2O

Перед азотом и фосфором коэффициенты не нужны, но чтобы уравнять фосфор перед гидрофосфатом калия поставим 2, тогда перед гидроксидом калия – 4, водорода в левой и правой части уравнения становится по 4, а кислород при этом не уравнивается (в левой части 9, в правой – 10):
NO2 + P2O3 + 4KOH → NO + 2K2HPO4+ H2O
Удвоим фосфор в электронном балансе:
Тогда перед азотом в левой и правой части уравнения ставим 2, чтобы уравнять фосфор перед гидрофосфатом калия поставим 2, тогда перед гидроксидом калия – 4, водорода в левой и правой части уравнения становится по 4, а кислород при этом уравнивается (в левой и правой части по 11):
2NO2 + P2O3 + 4KOH = 2NO + 2K2HPO4+ H2O
Расстановка коэффициентов методом электронного баланса, если в уравнении более 2 элементов меняют степени окисления.
As2S3 + HNO3 ® H3AsO4 + SO2 + NO2 + H2O
В этом уравнении 2 восстановителя (мышьяк и сера) в составе одного вещества, поэтому в электронном балансе обязательно учитываются индексы из формулы исходного вещества, отданные восстановителями электроны суммируются:

3S–2 – 18e ® 3S+4 22 e 1 восстановители
N+5 +1e ® N+4 22 окислитель
Перед азотом в левой и правой части уравнения ставим 22, перед мышьяковой кислотой – 2, перед сернистым газом – 3, уравниваем водород и проверяем правильность расстановки коэффициентов по кислороду.
As2S3 + 22HNO3 = 2H3AsO4 + 3SO2 + 22NO2 + 8H2O
Можно использовать и такую запись поведения восстановителя:
Слева записано электронейтральное вещество, справа считаем сумму зарядов.
В рассмотренном примере степени окисления серы и мышьяка очевидны. Однако, встречаются вещества нестехиометрического состава, в которых определить степень окисления элементов затруднительно. Например, цементит Fe3C.
Fe3C + HNO3 ® Fe(NO3)3 + CO2 + NO2 + H2O
Чтобы не выяснять, какие в этом веществе степени окисления у элементов, воспользуемся выше приведенным приёмом:

Коэффициент 13 ставим перед оксидом азота, перед нитратом железа – 3, перед цементитом и углекислым газом коэффициенты не нужны. Пересчитываем азот в правой части (22), ставим 22 перед формулой азотной кислоты, уравниваем водород, проводим проверку по кислороду:
Fe3C + 22HNO3 ® 3Fe(NO3)3 + CO2 + 13NO2 + 11H2O
В случаях, когда 2 восстановителя находятся в составе одного вещества, элементам можно присваивать даже нереальные степени окисления, при этом будут получаться те же коэффициенты. Например, предположим, что углерод в цементите имеет степень окисления – 4, тогда степень окисления железа +4/3. Составим баланс с этими значениями:

Можно присвоить элементам такие степени окисления, чтобы степень окисления изменялась только у одного элемента. Пусть степень окисления железа +3 в исходном веществе и продукте, тогда степень окисления углерода в цементите – 9 (такого не бывает, но в данном случае мы весьма формально используем степень окисления).
Опять восстановитель отдал 13 электронов.
ЗАДАНИЕ 2. Расставьте коэффициенты методом электронного баланса в следующих схемах реакций:
1) Na + HNO3 ® NaNO3 + N2O + H2O
2) K2FeO4 + H2SO4 ® Fe2(SO4)3 + K2SO4 + H2O + O2
3) H2O2 + KMnO4 + HNO3 ® Mn(NO3)2 + KNO3 + H2O + O2
4) Ti2(SO4)3 + KClO3 + H2O ® TiOSO4 + KCl + H2SO4
5) Mn3O4 + KClO3 + K2CO3 ® K2MnO4 + KCl + CO2
6) Na2S4O6 + KMnO4 + HNO3 ®Na2SO4 + H2SO4 + Mn(NO3)2 + KNO3 + H2O
7) Cu2S + O2 + CaCO3 ® CuO + CaSO3 + CO2

9) CuFeS2 + HNO3 ®Cu(NO3)2 + Fe(NO3)3 + H2SO4 + NO + H2O
10)KSCN + K2Cr2O7 + H2SO4 → Cr2(SO4)3 + K2SO4 + CO2+ NO2 + SO2 + H2O
Ответы (с указанием фамилии) оформляются в файле WORD, имя файла Familija—Z-1. (Familija— фамилия участника – англ.) Работы, выполненные в WORDe, отправляются электронной почтой на адрес *****@***ru, с обязательным указанием в Теме письма слов «дистанционное обучение» с указанием номера задания ( Z1 ) и фамилии (Например: Дистанционное обучение, Z1, ).
В самом письме можно ничего не писать, а файл с заданием нужно прикрепить к этому письму.
Можно присылать отсканированные варианты решения
Контрольный срок выполнения задания №1 до 21-00 мск вр, 04.06.11.
http://profmeter.com.ua/communication/learning/course/course6/lesson326/
http://pandia.ru/text/78/023/681.php
При изучении строения атома, описании свойств некоторых элементов, химической связи неоднократно упоминалось о том, что атомы принимают или отдают электроны. Очевидно, существуют химические реакции, в ходе которых одни атомы отдают электроны другим атомам, которые их принимают.
Процесс отдачи электронов называется окислением, а процесс приёма электронов — восстановлением. Оба процесса происходят одновременно, так как не могут отданные электроны исчезнуть в «никуда» — должна существовать частица, которая их присоединит, и наоборот. Поэтому процессы окисления и восстановления, протекающие одновременно, называются окислительно-восстановительными реакциями. При этом атом*, отдающий электроны, называется восстановителем, а атом, принимающий электроны, — окислителем.
* В окислительно-восстановительной реакции участвует реальная частица, входящая в понятие химического элемента, — атом, ион, радикал.
Что же происходит с такими атомами? Пусть атом меди в каком-то процессе отдаст два электрона:
Если эта реакция происходит в растворе, то можно увидеть, как жёлто-красный металл медь уменьшится в размерах, а раствор приобретает голубую окраску, характерную для ионов меди. Очевидно, что свойства исходного простого вещества, состоящего из атомов, и полученных ионов — различно.
Этот же процесс может происходить и при окислении меди кислородом:
Но ионов здесь не образуется, хотя признак реакции (изменение цвета) налицо. В таких случаях изменение состояния окисленности обозначают при помощи степени окисления. Так, атому кислорода, который для завершения внешнего энергетического (электронного) уровня должен присоединить 2 электрона, почти во всех соединениях приписывают степень окисления –2. Поскольку молекула СuО электронейтральна — атом меди приобретает степень окисления +2.
Заметьте: заряд иона записывается так:
сбоку, сначала число, потом заряд (причём цифра 1 не пишется). Степень окисления записывают по-другому:
над символом элемента, сначала заряд, потом число (причём не только пишется цифра 1, но может быть даже дробное число).
Этой формой записи подчеркивают различие этих понятий:
- заряд иона — реальный заряд реальной, устойчивой частицы, которая входит в состав твёрдых веществ, определяет свойства некоторых растворов и т. д.;
- степень окисления — условный заряд воображаемого иона; этот заряд рассчитывается, исходя из предположения, что вещество состоит только из ионов (а это чаще всего не так). Степень окисления можно определить, исходя из строения атома данного химического элемента.
Величины этих зарядов могут совпадать, но очень часто они различаются. Рассчитаем, например, степени окисления элементов в химической формуле, соответствующей серной кислоте. При этом степень окисления кислорода равна –2, а водорода +1 (так как он может отдать только один электрон):
Суммарный заряд двух атомов водорода равен +2, а четырёх атомов кислорода:
суммарный заряд:
Видно, что для того, чтобы молекула была электронейтральна, не хватает положительных зарядов, следовательно, степень окисления серы в серной кислоте равна +6. (Такого иона серы вообще не существует!)
При расчёте степеней окисления следует руководствоваться следующими правилами:
1. Степень окисления атомов химических элементов в простом веществе равна нулю:
2. Степени окисления атомов металлов в соединениях всегда положительны и равны их валентности:
3. Степени окисления постоянны у F: –1; у Н: +1 (кроме гидридов — Li+1H-1); у О: –2 (кроме Н2+1 О2–1 , F2–1О+2 ).
4. Степень окисления химических элементов в кислотном остатке соли такие же, как в соответствующей кислоте:
5. Алгебраическая сумма степеней окисления в любом соединении равна нулю.
Задание 7.1. Расставьте степени окисления химических элементов в соединениях:
Если вы испытываете затруднения при расстановке степеней окисления, рекомендуется составлять простейшие математические уравнения.
Известные степени окисления
Суммарные степени окисления: +2 + 2х –14 = 0 (математическое уравнение, которое решается относительно «х»)
х = 6, т. е. степень окисления атома хрома в этом соединении равна +6.
Определив степени окисления элементов в уравнении реакции, можно определить, какой атом является окислителем, какой — восстановителем:
Задание 7.2. Определите окислитель и восстановитель в уравнениях реакций:
Из этих примеров видно, что число электронов, принятых окислителем, может отличаться от числа электронов, отданных восстановителем. Но этого быть не должно(!), так как при этом нарушается закон сохранения материи. Значит, число отданных электронов должно равняться числу принятых электронов. А для этого следует изменить число атомов окислителя и восстановителя, поставив соответствующие коэффициенты. Например, в данном случае:
Эти коэффициенты (3 и 2) означают, что три атома меди отдают шесть электронов, а два атома азота принимают шесть электронов:
Или в краткой форме:
Теперь осуществлён баланс (равенство) электронов, поэтому именно эти коэффициенты из электронного баланса (3 и 2) должны быть в уравнении реакции
Но теперь не осуществляется баланс по азоту! Где же допущена ошибка? Дело в том, что в электронном балансе учитываются только электронные процессы окисления и восстановления, т. е. учитываются только те атомы, которые меняют степени окисления, а часть атомов не изменила ее:
Отсюда правило: коэффициенты электронного баланса ставят только к тем атомам, которые с данной степенью окисления встречаются в химическом уравнении один раз.
Исправим ошибку и уравняем атомы остальных элементов:
Проверим по кислороду:
- до реакции: 8 · 3 = 24 атома;
- после реакции: 3 · 3 · 2 + 2 + 4 = 24 атома.
Правила расстановки коэффициентов методом электронного баланса
1. Расставить степени окисления.
2. Выписать элементы, изменившие степени окисления, указав число отданных и принятых электронов. Определить окислитель и восстановитель.
3. Поставить дополнительные коэффициенты, уравняв число отданных и принятых электронов.
4. Проверить эти коэффициенты: они должны соответствовать числу атомов данного элемента в молекуле. Например, если дополнительный коэффициент нечётный, а в молекуле чётное число атомов (например, Сl2), то оба дополнительных коэффициента удваиваются.
5. Проверенные коэффициенты переносят в уравнение, считая атомы, к тем элементам, которые с данной степенью окисления встречаются в уравнении ОДИН раз.
6. Затем уравнивают атомы:
- металлов;
- неметаллов;
- водорода.
7. Проверяют по кислороду.
Рассмотрим эти правила на примере. Требуется уравнять (т. е. расставить коэффициенты в уравнении реакции):
1, 2, 3.
4. Поскольку число атомов хлора в молекуле чётное (2), а коэффициент к хлору нечётный (5), удвоим оба дополнительных коэффициента:
5. Переносим коэффициенты к атомам марганца и хлора, кроме Сl–1 , которые встречаются в уравнении реакции три раза:
Обратите внимание, что перед молекулой хлора поставлен коэффициент 5, а не 10, так как нужно считать атомы хлора: 5 · 2 = 10 атомов.
6. Уравняем остальные атомы:
7. Атомы кислорода до и после реакции пересчитайте сами.
Задание 7.3. Уравнять методом электронного баланса:
Вы можете проверить степень усвоения материала этой главы, выполнив упражнения ЕГЭ из разделов 4, 28 и частично 36.
Выводы
Окислительно-восстановительные реакции (ОВР) — это процессы, в которых изменяются степени окисления атомов. Степени окисления атомов изменяются потому, что один атом (окислитель) принимает электрон от атома восстановителя. При этом число принятых и отданных электронов должно быть одинаковым. На этом основан метод электронного баланса, при помощи которого расставляют коэффициенты в уравнениях ОВР.
Привет)
Сегодня я хочу разобрать одну из самых интересных тем в неорганической химии, которая навевает на некоторых страх и непонимание, -это окислительно-восстановительные реакции.
Процесс окисления и восстановления заключается в том, что любое сложное вещество образуется тогда, когда один элемент отдает электроны, а другой забирает.
Рассмотрим этот процесс на известной всем реакции образования гремучего газа — Н2О (это та же реакция, что и образование воды, но, в отличие от последней, она осуществима при обычных условиях).

Итак, вначале мы пишем химическую реакцию (смотри пункт А), и расставляем степени окисления всех элементов.
Для удобства можно подчеркнуть те элементы, которые изменили свои степени окисления. В этой реакции это произошло с водородом и кислородом.
Разбираем детально этот процесс: у водорода до стрелки стоит степень окисления 0, почему?
Любое простое вещество, которое не входит в состав сложного вещества, всегда пишется со знаком 0, потому что это атом, а атом электронейтрален, соответственно, заряд должен быть равен 0.
Это же самое мы пишем у кислорода, так как до стрелки он представлен в виде свободного атома.
Теперь смотрим молекулу гремучего газа, Н2О: у водорода степень окисления равна +1, так как он отдал один электрон, а кислород имеет степень окисления -2, так как он принял два электрона, но это не логично.
Если элемент отдал электрон, то у него по сути должен быть знак -, а если принял, то +.
- Однако, стоит запомнить, что если у элемента в процессе ОВР степень окисления увеличилась, значит он отдал электроны, и теперь называется восстановителем.
- А если элемент принял электроны, то его степень окисления уменьшилась, и он теперь окислитель. В данной реакции восстановитель это водород, а окислитель-это кислород.
Теперь наступает самый сложный момент, как показать переход электронов. Смотрим пункт Б: рассматриваем первый процесс с водородом.
Слева пишем водород который стоит до стрелки, справа- после стрелки, между ними- количество электронов.
В первую очередь необходимо посмотреть как меняется степень окисления водорода: сначала Н2 имеет степень окисления 0, а после стрелки +1, и было бы естественно написать что водород отдал один электрон, но в итоге получается -2, почему? Когда элемент отдает электроны, он теряет их, и соответственно, ставим-2, а не +2; теперь рассматриваем другой аспект- почему -2, а не -1.
- Водород, как и любой элемент необходимо уравнивать в соответствии с химической реакцией, это в основном касается тех случаев, когда в реакции присутствуют газы, которые пишутся с индексом 2 (например, О2, Н2, N2).
- Мы видим, что у водорода до стрелки 2 атома, после стрелки тоже 2, но мы не имеем права писать второй водород также с индексом, так как он уже не свободное вещество, и представляет собой ион, поэтому ставим эту двойку в качестве коэффициента.
Если вышеперечисленный процесс понятен, переходим к аналогичному с кислородом:
- Также как в случае с водородом, уравниваем кислород, чтобы до и после стрелки их было одинаковое количество, теперь у тебя может возникнуть вопрос, почему в пункте Б в процессе с кислородом перешло не 2, а 4 электрона, опять-таки объясняется удвоением количества электронов в связи исходя из реакции.
Почему +4? В процессе присоединения электронов элемент, в нашем случае кислород забирает два электрона, умноженное на два, то есть 4, у него становится больше, поэтому ставим «+».
Теперь пришло время немного расслабиться, потому что осталось совсем чуть-чуть).
В пункте Д, напротив процесса водорода за чертой стоит цифра 4, а напротив кислорода-2, может возникнуть непонимание, зачем это нужно и откуда взялись эти цифры. Цифры, стоящие за чертой, это количество электронов, отданные водородом и принятые кислородом, в сумме.
Важный аспект в том, что эти цифры нужно переместить крест-накрест, и поставить за черту,- они и выполняют роль коэффициентов при уравнивании. Если эти цифры имеют общее кратное, необходимо их сократить, и начать уравнивать- перед водородом нужно поставить 2, перед кислородом 1, но как ты знаешь, коэффициент 1 мы не ставим; смотри пункт Г.
В последнюю очередь нужно записать, какой элемент является окислителем, а какой восстановителем (это нужно для решения задач), пункт В.
Ну вот и все, реакция уравнена, мучения закончились).
Подведем итог, чтобы быстро и правильно решать реакции ОВР, нужно:
— верно указать степени окисления всех элементов в реакции;
— запомнить, что если у элемента увеличилась степень окисления, что он восстановитель, и над стрелкой ставим «-е», а если степень окисления уменьшилась, то этот элемент-окислитель, и над стрелкой при указании перехода ставим «+е»;
— внимательно расставлять коэффициенты, кислород уравнивать в самую последнюю очередь.
На этой прекрасной ноте я заканчиваю урок.
Внизу представлены задания по этой теме для самостоятельного решения.
При возникновении вопросов, пиши)




Окислительно-восстановительной реакцией (редокс) называют взаимодействие двух атомов, при котором они обмениваются электронами.
Естественно, атомы не перекидывают между собой электроны, как футбольные мячи, иначе это было бы слишком просто.
Исходя из названия понятно, что во время реакции одновременно происходят окисление и восстановление.
Окислители и восстановители
Окисление или повышение степени — это процесс отдачи электронов одного атома другому. При этом элемент, отдающий электроны, называют восстановителем.
Восстановление или понижение степени — это процесс принятия электронов, отданных атомом. Элемент, принимающий их , называют окислителем.
Звучит запутанно, поэтому очень легко ошибиться в названии. Однако существует мнемоника, которая помогает запомнить неразбериху.
Окислитель — похититель, забирает электроны, восстанавливает зоны.
Восстановитель – это донор, электроны отдает, окисление грядет.
Отдать — окислиться.
Взять — восстановиться.
«Вещества-оборотни»
Увы, нельзя сказать, что всю периодическую таблицу можно разделить на две колонки и никогда не ошибаться. На самом деле выделяют типичные вещества, понижающие и повышающие степень окисления. Но есть и «оборотни», которые могут выступать как окислителями, так и восстановителями.
Вещества, принимающие электроны
- Неметаллические, простые. Самым сильным будет F2F_2, за ним кислород O2O_2, потом Cl2Cl_2 и азот N2N_2. Это можно определить по шкале электронегативности элементов Полинга.
- Сложные вещества, содержащие ионы металлов или неметаллов, – элементы в высшей положительной степени окисления. Это может быть калий перманганат, хлорная, нитратная кислота, нитрат калия, высший оксид серы.
- Химические соединения, содержащие катионы некоторых металлов в высокой степени окисления Au3+Au^{3+} или Fe3+Fe^{3+}.
Вещества, отдающие электроны
- Простые металлы. Их способности к восстановлению демонстрирует ряд стандартных электродных потенциалов.
- Соединения, содержащие атомы или ионы неметаллов, – элементы в отрицательной низшей степени окисления. К ним относятся соединения с водородом HBrHBr, H2SH_2S и соли с бескислородными кислотными остатками, такие как K2SK_2S, NaBrNaBr, LiILiI.
- Катионы, которые имеют минимальную положительную степень окисления. Во время реакции эта степень повышается.
- Сложные соединения, в составе которых содержатся катионы неметаллов в положительной промежуточной степени окисления. Этот показатель во время реакции может повыситься.
Остальные вещества, которых нет в списке – это «оборотни». Они ведут себя в реакциях непредсказуемо.
Электронный баланс
В основе любой окислительно-восстановительной реакции лежит электронный баланс.
Его суть заключается в следующем: сколько электронов отдал восстановитель, столько же и должен принять окислитель.
Именно на этом золотом правиле и базируются методы уравнения реакций, которые используют, когда расставить коэффициенты методом подбора долго и сложно.
Как работает метод электронного баланса?
- Сначала мы записываем саму реакцию, оставляем немного места для коэффициентов и несколько строчек внизу для уравнений.
- Расставляем степени окисления над каждым элементом.
- Ищем пары, меняющие свою степень окисления.
- Определяем, на сколько единиц произошло изменение. Изменения идут +8 — 0 — -8.
- Под уравнением записываем первый элемент, над ним – его изначальную степень окисления, потом количество электронов, которое он отдал или присоединил, и элемент еще раз – с окончательной степенью окисления.
- Со вторым элементом делаем аналогично.
- Находим наименьшее общее значение отданных и присоединенных электронов.
- Делим его на количество электронов каждой реакции.
- Полученные цифры и будут коэффициентами, которые следует выставлять.
SiH4+O2→SiO2+H2OSiH_4+O_2→SiO_2+H_2O – неуравненное взаимодействие.
Подпишем степень окисления каждого элемента и определим, кто поменял степень окисления:
Si−4H+1+O20=Si+4O2−2+H2+1O−2Si^{-4}H^{+1} + O_2^0 = Si^{+4}O_2^{-2} + H_2^{+1}O^{-2};
Кремний и кислород поменяли свою степень.
Si−4−8e=Si+4Si^{-4}-8e = Si^{+4} – процесс окисления;
4O20+8e=4O−24O_2^0 + 8e = 4O^{-2} – процесс восстановления.
Общее кратное для чисел 4 и 8: — 8;
88=1 – коэффициент перед кремнием;
84 =2 – коэффициент перед кислородом;
SiH4+2O2→SiO2+2H2OSiH_4+2O_2→SiO_2+2H_2O.
Тест по теме “Окислительно-восстановительные реакции”
Определите количество электронов, которое нужно отдать или присоединить для получения завершённого внешнего энергетического уровня атомам следующих химических элементов: кислород, натрий, хлор, магний.
reshalka.com
ГДЗ Химия 8 класс класс Габриелян. §32. Примените свои знания. Номер №4
Решение
Кислороду для получения завершённого внешнего энергетического уровня следует присоединить 2 электрона.
Натрию для получения завершённого внешнего энергетического уровня следует отдать 1 электрон.
Хлору для получения завершённого внешнего энергетического уровня следует присоединить 1 электрон.
Магнию для получения завершённого внешнего энергетического уровня следует отдать 2 электрона.