Как расставить коэффициенты в химических уравнениях?
Добавлено: 12 мая 2022 в 9:59

В химии уравнение – это запись реакции с помощью формул веществ и математических знаков.
Знак «=» подразумевает, что реакция уравнена, поэтому принято сперва ставить «→» и только в самом конце заменять его на «=».
Вам встретятся следующие понятия:
- Коэффициент – множитель, означающий количество частиц прореагировавшего или образовавшегося вещества. Если перед формулой не стоит коэффициент, он равен 1.
- Индекс – это количественное значение атомов элемента в формуле. Если индекс не стоит, он равен 1.
Например, формуле 8H2O 8 – коэффициент (взято 8 молекул воды), а 2 – индекс (в молекуле воды содержится 2 атома водорода).
Правила расстановки коэффициентов
Коэффициенты в уравнениях химических реакций
Есть несколько принципов, по которым расставляются коэффициенты:
1) Количество элемента в левой части должно совпадать с его количеством в правой;
2) Коэффициент умножается на индекс каждого химического элемента в формуле;
3) Если в одной части уравнения есть несколько веществ, содержащих один и тот же химический элемент, то числовые значения этого элемента из всех формул складываются.
Несмотря на кажущуюся легкость этой темы, иногда именно с нее начинаются пробелы в знаниях по химии. Чтобы не допустить этого мы рекомендуем не затягивать с отставанием по предмету, а сразу записаться на курсы по химии для школьников. Особенно, если химия понадобится для выпускного экзамена.
Уравнивание простых реакций
Коэффициенты в уравнениях химических реакций
Разберемся, как правила работают на практике примере простой реакции соединения:
P + О2 →P2O5
Считаем сколько атомов фосфора в левой части и сколько в правой. Слева фосфор содержит простое вещество P. Индекс не стоит, значит он равен 1. Значит слева 1 атом P. Справа фосфор содержит P2O5, причем стоит индекс 2, значит справа 2 фосфора.
Считаем кислород. Слева 2 атома кислорода, а справа их 5.
Уравниваем кислород. Нужно домножить с каждой стороны его количество на такое число, чтобы в правой стороне кислорода стало столько же, сколько и в левой. Найдем наименьшее общее кратное 2 и 5. Это 10. Слева у кислорода ставим коэффициент 5, чтобы его количество стало равно 10, а справа перед P2O5 пишем 2.
Получаем такую запись:
P + 5O2 → 2P2O5
Уравниваем фосфор. В левой стороне 1 атом фосфора, в правой стороне его стало 4, так как мы поставили 2 перед P2O5, и теперь эту двойку нужно умножать на индекс в формуле. Чтобы количество фосфора в обеих частях сравнялось, ставим 4 в левой части у P.
Реакция уравнена. Пишем знак «=».
4P + 5O2 = 2P2O5
Коэффициенты в уравнениях химических реакций
Уравнивание сложных реакций
Единственное, на что стоит обратить внимание: кислород и водород удобнее уравнивать последними. В остальном процесс идентичен.
Рассмотрим реакцию гидроксида кальция с соляной кислотой.
Ca(OH)2 + HCl → CaCl2 + H2O
Число кальция в каждой части равно 1, кальций уравнен. Сравним количество хлора. Слева 1, справа 2. Ставим перед HCl 2.
Ca(OH)2 + 2HCl → CaCl2 + H2O
Считаем кислород. Слева 2, справа 1. Пишем 2 у воды. Проверяем водород. В левой части его содержат оба вещества. Суммируем количество атомов H, получаем 4. Справа водорода тоже 4. Ставим «=».
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
Коэффициенты в уравнениях химических реакций
Расстановка коэффициентов с помощью электронного баланса
Метод электронного баланса применим для окислительно-восстановительных реакций. Изучение этого метода начинается с определения степеней окисления.
Степень окисления – это заряд атома элемента в соединениях.
Cu + HNO3 → Cu(NO3)2 + NO2 + H2O
Определяем, степень окисления каких элементов поменялась. Это медь и азот. Степень окисления меди была 0, стала +2. Степень окисления азота была +5, стала +4.
Чтобы медь из нуля перешла в +2, она должна отдать 2 электрона. Чтобы азот из +5 перешел в +4, он должен принять 1 электрон.
Пишем:
Cu0 – 2e → Cu+2
N+5 + 1e → N+4
Коэффициенты в уравнениях химических реакций
Далее нужно найти наименьшее общее кратное 2 и 1. Это 2. Делим его на количество отданных медью электронов, затем снова делим его на количество принятых электронов азотом. Найденные значения как раз и являются искомыми коэффициентами.
Cu0 – 2e → Cu+2 2 2 1
N+5 + 1e → N+4 1 2 2
Пишем 2 перед NO2. В правой стороне азота стало 4. Ставим 4 перед HNO3. Перед Cu коэффициенты не нужны, так как по балансу получилась единица. В левой части 4 водорода, пишем 2 перед водой. Проверяем кислород. И там, и там его по 12. Ставим «=».
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
Сперва процесс занимает много времени, но после многочисленных уравниваний он доводится до автоматизма.
Занимайтесь на курсах ЕГЭ и ОГЭ в паре TwoStu и получите максимум баллов на экзамене:

Эксперт по подготовке к ЕГЭ, ОГЭ и ВПР
Задать вопрос
Закончил Московский физико-технический институт (Физтех) по специальности прикладная физика и математика. Магистр физико-математических наук. Преподавательский стаж более 13 лет. Соучредитель курсов ЕГЭ и ОГЭ в паре TwoStu.
Читайте также:
Найдите соотношение чисел положительных и отрицательных ионов в соединениях: а) хлорид натрия NaCl; б) хлорид кальция
C
a
C
l
2
; в) фторид алюминия
A
l
F
3
.
reshalka.com
ГДЗ Химия 8 класс класс Габриелян. §34. Примените свои знания. Номер №5
Решение а
Хлорид натрия: NaCl =
N
a
+
+
C
l
−
Таким образом, соотношение чисел положительных и отрицательных ионов 1 : 1.
Решение б
Хлорид кальция:
C
a
C
l
2
=
C
a
2
+
+ 2
C
l
−
Таким образом, соотношение чисел положительных и отрицательных ионов 1 : 2.
Решение в
Фторид алюминия:
A
l
F
3
=
A
l
3
+
+ 3
F
−
Таким образом, соотношение чисел положительных и отрицательных ионов 1 : 3.
Как расставлять коэффициенты в химических уравнениях
Уравнением реакции в химии называется запись химического процесса с помощью химических формул и математических знаков.
Такая запись является схемой химической реакции. Когда возникает знак «=», то это называется «уравнение». Попробуем его решить.
Пример разбора простых реакций
В кальции один атом, так как коэффициент не стоит. Индекс здесь тоже не написан, значит, единица. С правой стороны уравнения Са тоже один. По кальцию нам не надо работать.
Видео: Коэффициенты в уравнениях химических реакций.
Смотрим следующий элемент — кислород. Индекс 2 говорит о том, что здесь 2 иона кислорода. С правой стороны нет индексов, то есть одна частица кислорода, а с левой — 2 частицы. Что мы делаем? Никаких дополнительных индексов или исправлений в химическую формулу вносить нельзя, так как она написана правильно.
Коэффициенты — это то, что написано перед наименьшей частью. Они имеют право меняться. Для удобства саму формулу не переписываем. С правой части один умножаем на 2, чтобы получить и там 2 иона кислорода.
После того как мы поставили коэффициент, получилось 2 атома кальция. С левой стороны только один. Значит, теперь перед кальцием мы должны поставить 2.
Теперь проверяем итог. Если количество атомов элементов равно с обеих сторон, то можем поставить знак «равно».
Другой наглядный пример: два водорода слева, и после стрелочки у нас тоже два водорода.
Смотрим дальше:
- Два кислорода до стрелочки, а после стрелочки индексов нет, значит, один.
- Слева больше, а справа меньше.
- Ставим коэффициент 2 перед водой.
Умножили всю формулу на 2, и теперь у нас изменилось количество водорода. Умножаем индекс на коэффициент, и получается 4. А с левой стороны осталось два атома водорода. И чтобы получить 4, мы должны водород умножить на два.
Видео: Расстановка коэффициентов в химическом уравнении
Вот тот случай, когда элемент в одной и в другой формуле с одной стороны, до стрелочки.
Один ион серы слева, и один ион — справа. Две частицы кислорода, плюс еще две частицы кислорода. Значит, что с левой стороны 4 кислорода. Справа же находится 3 кислорода. То есть с одной стороны получается четное число атомов, а с другой — нечетное. Если же мы умножим нечетное в два раза, то получим четное число. Доводим сначала до четного значения. Для этого умножаем на два всю формулу после стрелочки. После умножения получаем шесть ионов кислорода, да еще и 2 атома серы. Слева же имеем одну микрочастицу серы. Теперь уравняем ее. Ставим слева уравнения перед серой 2.
Уравняли.
Сложные реакции
Этот пример более сложный, так как здесь больше элементов вещества.
Это называется реакцией нейтрализации. Что здесь нужно уравнивать в первую очередь:
- С левой стороны один атом натрия.
- С правой стороны индекс говорит о том, что здесь 2 натрия.
Напрашивается вывод, что надо умножить всю формулу на два.
Видео: Составление уравнений химических реакций
Теперь смотрим, сколько серы. С левой и правой стороны по одной. Обращаем внимание на кислород. С левой стороны мы имеем 6 атомов кислорода. С другой стороны – 5. Меньше справа, больше слева. Нечетное количество надо довести до четного значения. Для этого формулу воды умножаем на 2, то есть из одного атома кислорода делаем 2.
Теперь с правой стороны уже 6 атомов кислорода. С левой стороны также 6 атомов. Проверяем водород. Два атома водорода и еще 2 атома водорода. То есть будет четыре атома водорода с левой стороны. И с другой стороны также четыре атома водорода. Все элементы уравнены. Ставим знак «равно».
Видео: Химические уравнения. Как составлять химические уравнения.
Здесь пример интересен тем, что появились скобки. Они говорят о том, что если множитель стоит за скобкой, то каждый элемент, стоящий в скобках, умножается на него. Начать необходимо с азота, так как его меньше, чем кислорода и водорода. Слева азот один, а справа, с учетом скобок, его два.
Справа два атома водорода, а нужно четыре. Мы выходим из положения, просто умножая воду на два, в результате чего получили четыре водорода. Отлично, водород уравняли. Остался кислород. До реакции присутствует 8 атомов, после — тоже 8.
Отлично, все элементы уравнены, можем ставить «равно».
Последний пример.
На очереди у нас барий. Он уравнен, его трогать не нужно. До реакции присутствует два хлора, после нее — всего один. Что же нужно сделать? Поставить 2 перед хлором после реакции.
Видео: Балансирование химических уравнений.
Теперь за счет коэффициента, который только что поставлен, после реакции получилось два натрия, и до реакции тоже два. Отлично, все остальное уравнено.
Также уравнивать реакции можно методом электронного баланса. Этот метод имеет ряд правил, по которым его можно осуществлять. Следующим действием мы должны расставить степени окисления всех элементов в каждом веществе для того, чтобы понять где произошло окисление, а где восстановление.
Как определять, находить коэффициент в химических уравнениях
Уравнение реакции в химии — символическая запись протекания химического взаимодействия с помощью математических знаков, химических обозначений и коэффициентов. Расставить в химических уравнениях коэффициенты можно несколькими способами, каждый из которых имеет свои преимущества и уровень сложности.
Распространненые способы уравнивания
Существует не один способ правильной расстановки коэффициентов в химических уравнениях. Чтобы найти нужную схему реакций, можно ознакомиться с самыми распространёнными методами:
- Подбор коэффициентов. В этом способе расставляются акценты на нахождение наименьшего общего кратного и приравнивания к нему обеих частей уравнения.
- Запись онлайн. Безусловно, наипростейший из всех представленных, для которого нужно лишь уметь находить подходящий сайт.
- Вычисления столбиком. Способ представляет собой математическую запись с подбором.
- Метод полуреакций. Иногда встречается под названием «Электронно-ионный баланс», используется при окислительно-восстановительных реакциях.
Чтобы научиться уравнивать химические записи, необходимо разобраться в перечисленных способах. Безусловно, необязательно запоминать каждый, но ознакомившись с методами, легче подобрать тот, с которым расставить коэффициенты в уравнениях химических реакций станет упрощённой задачей.
Подбор коэффициентов
Чтобы решить, как расставить индексы и коэффициенты в записи, можно использовать метод подбора, который считается самым лёгким и понятным, среди прочих:
- Изначально в левой части реакции записываются исходные вещества, ставится стрелка к правой, ещё не заполненной части.
- В правой части записываются полученные продукты.
- В этом пункте происходит выравнивание коэффициентов за счет закона сохранения массы, который гласит о том, что с обеих сторон уравнения должно быть одинаковое количество атомов.
- Число атомов проверяется на соответствие в правой и левой частях уравнения и под стрелкой рисуется диагональная черта.
Метод подбора активно применяется при записи реакций, у которых продуктом является одно вещество. Он наиболее лёгок для понимания и запоминания, с него начинается путь уравнивания записей для школьников 8 класса.
Вычисления с помощью столбика
Такой способ заключается в том, чтобы определять нужные числа с помощью валентностей, составляя небольшие уравнения. Всё, что нужно, — уметь правильно определить, показывать и посчитать исходные реагенты и продукты реакции.
Шаг первый — записать реакцию и в двух столбиках перечислить реагенты и продукты.
Ag + O2 -> AgO. Вещества из этого примера распределяем в 2 колонки, соответственно Ag, O2 — в одной, AgO — в другой.
Следующее действие — расставление валентностей и поиск наименьшего общего кратного.
Валентность серебра — постоянная, в соединении с кислородом также III. Поэтому нужно показать в столбцах эти валентности (II и III). Наименьшим общим кратным является число 6, значит, количество молекул серебра нужно домножить на 2.
Предпоследний шаг — сравнение коэффициентов и индексов.
Сравнивая обе части записи, можно заметить, что они неравны, поэтому необходимо найти сумму и в продуктах поставить индекс 2, а перед серебром в части реагентов — 4. Так получается уравнение: 4Ag + O2 = 2 Ag2O.
Этот вариант похож на метод уравнивания, но отличается тем, что в нём нужно учитывать не закон сохранения массы, а больше внимания уделять валентности элемента. Он используется при вычислении как простых и коротких записей, так и громоздких, достаточно сложных.
Решение методом полуреакций
Способ полуреакций создан для упрощения составления ионных реакций. В нём учитывается число зарядов и их направленность. Для уравнивания по числу зарядов нужно от той части схемы, в которой прописаны реагенты отнять количество электронов, равное коэффициенту перед продуктом из правой части схемы. После этого стрелку можно заменить на знак равенства.
Несколько советов для уравнивания реакций
Прежде всего, стоит изучить все способы выравнивания коэффициентов и понять, с помощью какого метода записывать будет проще, быстрее и удобнее. Для этого нужно рассмотреть плюсы и минусы способов и согласовать их со слабыми и сильными сторонами в понимании химии.
Если же подробное изучение темы не понадобится в дальнейшем, а уравнять реакцию нужно только единожды, можно воспользоваться множеством сайтов, которые предлагают решить проблему онлайн. Нужно просто ввести уравнение в нужное поле.
Как расставлять коэффициенты в химических уравнениях
Содержание:
Все химические реакции, проходящие в окружающем мире можно описать при помощи специальных уравнений, представляющих собой химические формулы и математические знаки с коэффициентами. И от правильно расставленных коэффициентов в химических уравнениях порой зависит не много не мало, а то какой собственно и будет химическая реакция и будет ли она вообще. В нашей статье мы расскажем о том, как правильно расставлять коэффициенты в химии, чтобы химические уравнения были записаны верно.
Пример разбора простых реакций
Главное правило, которым следует руководствоваться при составлении химических уравнений – принцип сохранения энергии вещества, то есть, сколько есть атомов каждого химического элемента в левой части уравнения, столько должно быть и в правой части того же уравнения.
Для примера возьмем химическую реакцию взаимодействия кальция (Ca) с кислородом (O2). Но для начала объясним, почему вообще кислород (как и некоторые другие химических элементы) в химических уравнениях записывается с индексом «2». Дело в том, что одна молекула кислорода имеет 2 атома, поэтому его записывают как O2. В свою очередь, к примеру, одна молекула воды, состоящая из кислорода и водорода, имеет всем известную формулу H2O. Это означает, что каждая молекула воды состоит из двух атомов водорода и одного атома кислорода. Заметьте, что по своему усмотрению индексы в химических уравнениях и формулах менять нельзя, так как они изначально должны быть написаны правильно.
Теперь вернемся к нашему простому примеру реакции взаимодействия кальция и кислорода. Ее можно записать следующим образом:
О чем говорит эта запись? О том, что в результате химической реакции взаимодействия кальция с кислородом образуется оксид кальция, который записан формулой CaO. Но также обратите внимание, что в правой части оксид кальция мы записали с коэффициентом 2 – 2CaO. Это значит, что каждый из двух атомов кислорода сцепился со своим атомом кальция, но тогда происходит несоответствие – в правой стороне у нас два атома кальция, в то время как в левой только лишь один. А значит, чтобы запись была правильной в левой части мы должны перед кальцием поставить коэффициент 2:
Теперь мы можем проверить наше уравнение – с левой стороны у нас два атома кальция и с правой тоже два, а значит между обеими частями можно вполне справедливо поставить знак равенства:
Разберем еще один простой пример, из взаимодействия кислорода и водорода как мы знаем, рождается одно из самых ценным и необычных веществ во Вселенной (и это без преувеличения) – вода, основа жизни на нашей планете. Образование воды можно записать следующим уравнением:
Но где же здесь закралась ошибка? Давайте разберем: в левой части у нас два атома кислорода, а в правой только один. Значит перед формулой воды необходимо поставить коэффициент 2:
Умножение 2 молекул воды на 2 атома водорода даст нам 4 атома водорода с правой стороны, но ведь с левой стороны атомов водорода лишь два! Значить перед водородом в уравнении мы также должны поставить коэффициент 2 и теперь получим правильное химическое уравнение, где вместо стрелочки → можно уже смело поставить знак равенства.
Пример разбора сложной реакции
Теперь давайте разберем то, как проставлять коэффициенты в более сложных химических уравнениях:
Перед вами запись так званой реакции нейтрализации – взаимодействие кислоты и основания, в результате которого образуются соли и вода.
Что же мы имеем тут: с левой стороны у нас один атом натрия (Na), а с правой индекс говорит, что атомов натрия уже стало два. Значит логично, что химическую формулу основания гидроксида натрия NaOH надо умножить на 2. Или другими словами поставить перед ней коэффициент 2:
Количество серы в серной кислоте (H2SO4) и соли сульфате натрия (Na2SO4) у нас одинаковое, тут все хорошо, а вот с количеством кислорода и водорода опять несоответствие, с левой стороны кислорода 6, а с правой 5. Водорода с правой стороны 4, а с левой только 2, непорядок. Чтобы правильно записать это химическое уравнение надо сравнять количество кислорода и водорода в левой и правой части уравнения, к счастью тут сделать это просто, надо перед H2O поставить коэффициент 2.
Таким образом, количество всех химических элементов в правой и левой части уравнения у нас сравнялись, а значит, мы неспроста поставили знак равенства.
Для закрепления материала разберем еще один пример сложного уравнения.
Это уравнение отображает химическую реакцию гидроксида бария (Ba(OH)2) с азотной кислотой (HNO3) в результате которой образуется нитрат бария (Ba(NO3)2) и вода.
Пример этот нам интересен тем, что тут используются скобки. Они означают, что если множитель стоит за скобками, то каждый элемент умножается на него. Начнем же разбирать это уравнение, первое, что бросается в глаза, несоответствие азота N, слева он один, а вот справа, если принимать во внимание скобки, его уже два. Получим следующее:
Теперь у нас слева стало 4 атома водорода, а справа только 2. Значит, перед формулой воды также ставим коэффициент 2.
Теперь все элементы уравнены, и мы справедливо поставили знак равенства.
Видео
И чтобы окончательно закрепить материал, рекомендуем посмотреть это образовательное видео.
http://na5.club/himiya/kak-opredelyat-nahodit-koefficzient-v-himicheskih-uravneniyah.html
http://www.poznavayka.org/himiya/kak-rasstavlyat-koefficzienty-v-himicheskih-uravneniyah/
Как расставлять коэффициенты
Для многих школьников написать уравнения химических реакций и правильно расставить коэффициенты нелегкая задача. Причем, главную трудность у них почему-то вызывает именно вторая ее часть. Казалось бы, ничего сложного в том нет, однако порой ученики пасуют, впадая в полную растерянность. А ведь надо всего лишь запомнить несколько простых правил, и задача перестанет вызывать затруднения.
Инструкция
Коэффициент, то есть число, стоящее перед формулой молекулы химического вещества, относится ко всем символам, и умножается на каждый индекс каждого символа! Именно умножается, а не складывается! Это может показаться невероятным, но некоторые школьники складывают два числа вместо того, чтобы их перемножить.
Иными словами, если в левой части реакции записано:
2Na3PO4 + 3CaCl2 = … Это значит, что в реакцию вступило 6 атомов натрия, 2 атома фосфора, 8 атомов кислорода, 3 атома кальция и 6 атомов хлора.
Количество атомов каждого элемента исходных веществ (то есть находящихся в левой части уравнения) должно совпадать с количеством атомов каждого элемента продуктов реакции (соответственно, находящихся в его правой части).
Рассмотрим это правило, записав до конца уравнение реакции фосфата натрия с хлористым кальцием. Для большей наглядности, уберите из левой части уравнения коэффициенты. Na3PO4 + CaCl2 = Ca3(PO4)2 + NaCl
В ходе реакции образуется практически нерастворимая соль – фосфат кальция – и хлористый натрий. Как же расставить коэффициенты? Сразу обратите внимание, что у фосфат-иона (РО4) в правой части уравнения индекс равен двум. Поэтому, чтобы уравнять количества атомов фосфора и кислорода в левой и правой части, перед формулой молекулы фосфата натрия надо поставить коэффициент 2. Получится: 2Na3PO4 + СaCl2 = Ca3(PO4)2 + NaCl
Вы видите, что количество атомов фосфора и кислорода уравнено, но пока еще различно количество атомов натрия, кальция и хлора. В левой части: натрия – 6 атомов, кальция – 1 атом, хлора – 2 атома. В правой части, соответственно: натрия – 1 атом, кальция – 3 атома, хлора – 1 атом.
Уравнивайте количество атомов натрия, приписав коэффициент 6 к молекуле хлористого натрия. Получается: 2Na3(PO4)2 + CaCl2 = Ca3(PO4)2 + 6NaCl
Осталось уравнять последние два элемента. Вы видите, что в левой части 1 атом кальция и 2 атома хлора, а в правой — 3 атома кальция и 6 атомов хлора. То есть, ровно в три раза больше! Подставляя коэффициент 3 к молекуле хлористого кальция, получите итоговое уравнение: 2Na3(PO4)2 + 3CaCl2 = Ca3(PO4)2 + 6NaCl
Видео по теме
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Содержание
- Химические и физические свойства кальция, его взаимодействие с водой
- Характеристика кальция как простого вещества
- Физические свойства кальция и способы получения металла
- Химические свойства кальция
- Реакция воды с кальцием
- Жесткость воды. Массовая концентрация кальция и магния в воде
- Универсальный индекс насыщения воды карбонатом кальция
Химические и физические свойства кальция, его взаимодействие с водой
Почему металл хранят в герметичной банке
Кальций располагается в четвертом большом периоде, второй группе, главной подгруппе, порядковый номер элемента — 20. Согласно периодической таблице Менделеева, атомный вес кальция — 40,08. Формула высшего оксида — СаО. Кальций имеет латинское название calcium, поэтому символ атома элемента — Са.
Характеристика кальция как простого вещества
При обычных условиях кальций — это металл серебристо-белого цвета. Имея высокую химическую активность, элемент способен образовывать множество соединений разных классов. Элемент представляет ценность для технических и промышленных химических синтезов. Металл широко распространен в земной коре: его доля составляет около 1,5 %. Кальций относится к группе щелочноземельных металлов: при растворении в воде он дает щелочи, но в природе встречается в виде множественных минералов и солей. Морская вода содержит кальций в больших концентрациях (400 мг/л).
Характеристики кальция зависят от строения его кристаллической решетки. У этого элемента она бывает двух типов: кубическая гранецентрическая и объемноцентрическая. Тип связи в молекуле кальция — металлический.
Природные источники кальция:
Физические свойства кальция и способы получения металла
В обычных условиях кальций находится в твердом агрегатном состоянии. Металл плавится при 842 °С. Кальций является хорошим электро- и теплопроводником. При нагревании он переходит сначала в жидкое, а затем в парообразное состояние и теряет металлические свойства. Металл является очень мягким и режется ножом. Кипит при 1484 °С.
Под давлением кальций теряет металлические свойства и способность к электропроводимости. Но затем металлические свойства восстанавливаются и проявляются свойства сверхпроводника, в несколько раз превышающего по своим показателям остальные элементы.
Кальций долго не удавалось получить без примесей: из-за высокой химической активности этот элемент не встречается в природе в чистом виде. Элемент был открыт в начале XIX века. Кальций как металл впервые синтезировал британский химик Гемфри Дэви. Ученый обнаружил особенности взаимодействия расплавов твердых минералов и солей с электрическим током. В наши дни электролиз солей кальция (смеси хлоридов кальция и калия, смеси фторида и хлорида кальция) остается самым актуальным способом получения металла. Кальций также извлекают из его оксида с помощью алюминотермии — распространенного в металлургии метода.
Химические свойства кальция
Кальций — активный металл, вступающий во многие взаимодействия. При нормальных условиях он легко реагирует, образуя соответствующие бинарные соединения: с кислородом, галогенами. Нажмите здесь, чтобы узнать больше о соединениях кальция. При нагревании кальций реагирует с азотом, водородом, углеродом, кремнием, бором, фосфором, серой и другими веществами. На открытом воздухе мгновенно взаимодействует с кислородом и углекислым газом, поэтому покрывается серым налетом.
Бурно реагирует с кислотами, при этом иногда воспламеняется. В солях кальций проявляет интересные свойства. Например, пещерные сталактиты и сталагмиты — это карбонат кальция, постепенно образовавшийся из воды, углекислого газа и гидрокарбоната в итоге процессов внутри подземных вод.
Из-за высокой активности в обычном состоянии кальций хранится в лабораториях в темной герметичной стеклянной посуде под слоем парафина или керосина. Качественная реакция на ион кальция — окрашивание пламени в насыщенный кирпично-красный цвет.
Идентифицировать металл в составе соединений можно по нерастворимым осадкам некоторых солей элемента (фторид, карбонат, сульфат, силикат, фосфат, сульфит).
Реакция воды с кальцием
Кальций хранят в банках под слоем защитной жидкости. Чтобы провести опыт, демонстрирующий, как происходит реакция воды и кальция, нельзя просто достать металл и отрезать от него нужный кусочек. Металлический кальций в лабораторных условиях проще использовать в виде стружки.
Если металлической стружки нет, а в банке есть только большие куски кальция, потребуются пассатижи или молоток. Готовый кусочек кальция нужного размера помещают в колбу или стакан с водой. Кальциевую стружку кладут в посуду в марлевом мешочке.
Кальций опускается на дно, и начинается выделение водорода (сначала в месте, где находится свежий излом металла). Постепенно с поверхности кальция выделяется газ. Процесс напоминает бурное кипение, одновременно образовывается осадок гидроксида кальция (гашёная известь).
Кусок кальция всплывает, подхваченный пузырьками водорода. Примерно через 30 секунд кальций растворяется, а вода из-за образования взвеси гидроксида становится мутно-белой. Если реакцию проводить не в стакане, а в пробирке, можно наблюдать выделение тепла: пробирка быстро становится горячей. Реакция кальция с водой не заканчивается эффектным взрывом, но взаимодействие двух веществ протекает бурно и выглядит зрелищно. Опыт безопасен.
Если мешочек с оставшимся кальцием вынуть из воды и подержать на воздухе, то через некоторое время в результате продолжающейся реакции наступит сильное разогревание и оставшаяся в марле вода закипит. Если часть помутневшего раствора отфильтровать через воронку в стакан, то при пропускании через раствор оксида углерода CO₂ получится осадок. Для этого не нужен углекислый газ — можно продувать выдыхаемый воздух в раствор через стеклянную трубочку.
Источник
Жесткость воды. Массовая концентрация кальция и магния в воде
Федеральное агентство по образованию
Государственное образовательное учреждение
Новгородский государственный университет им. Ярослава Мудрого
Факультет естественных наук и природных ресурсов
Кафедра химии и экологии
Массовая концентрация кальция и магния в воде.
Жесткость воды. Массовая концентрация кальция в водах: Методические указания/ Составитель — НовГУ, Великий Новгород, 2008. – 12 с.
Понятие жесткости, источники кальция в воде, влияние на живые организмы.
Методические указания предназначены для студентов специальности 020801.65 — «Экология» и всех студентов, изучающих «Общую экологию».
1 Жесткость воды
Жесткость — свойство воды, обусловленное присутствием в ней растворенных солей щелочно-земельных металлов (преимущественно кальция и магния). Различают жесткость кальциевую и магниевую, связанную с присутствием в воде соответственно ионов кальция и магния. Суммарное содержание ионов этих металлов в воде называется общей жесткостью.
Общая жёсткость подразделяется на карбонатную, обусловленную присутствием в воде гидрокарбонатов и карбонатов кальция и магния, и некарбонатную, обусловленную наличием кальциевых и магниевых солей сильных кислот.
Карбонатную жесткость также называют временной (устранимой), а некарбонатную — постоянной. Гидрокарбонаты кальция и магния при длительном кипячении воды разлагаются с выделением диоксида углерода и выпадающих в осадок карбонатов кальция и магния (при дальнейшем кипячении карбонат магния гидролизуется с образованием гидроксида); жесткость воды при этом уменьшается:
Са(НСО3)2 = СО2↑ + СаСО3↓ + Н2О;
Mg(HCО3)2 = СО2↑+ MgCО3| + H2О;
MgCО3 + Н2О = Mg(OH)2↓ + СО2↑.
Жесткость, оставшаяся после кипячения воды в течение определенного времени, достаточного для полного разложения гидрокарбонатов и удаления диоксида углерода (обычно 1-1,5 ч), называется постоянной жесткостью. Постоянная жесткость является важной характеристикой качества воды, используемой для технических целей. Она преимущественно зависит от содержания ионов кальция и магния, которые после кипячения уравновешиваются сульфатами и хлоридами. Эту часть постоянной жесткости, называемую также остаточной жесткостью, можно найти по разности между общей жесткостью и концентрацией гидрокарбонатов, выраженной в миллимолях на кубический дециметр. Однако кроме остаточной жесткости в воде после кипячения остается небольшое количество ионов кальция и магния, обусловленное растворимостью карбоната кальция и гидроксида магния. Эта часть постоянной жесткости называется неустранимой жесткостью. Поскольку растворимость карбоната кальция и гидроксида магния в присутствии ионов кальция и магния в растворе весьма незначительна, обычно некарбонатную (остаточную) жесткость отождествляют с постоянной жесткостью.
Жесткость воды в настоящее время выражают в миллимолях количества вещества эквивалентов (КВЭ) Са2+ и Mg2+, содержащихся в 1 дм3 воды — ммоль/дм3 КВЭ (ранее эту единицу обозначали мг·экв/л или мг·экв/дм3). Миллимоль КВЭ Са2+ и Mg2+ равны соответственно 20,04 мг/моль и 12,15 мг/ммоль.
В естественных условиях ионы кальция и магния поступают в воду в результате взаимодействия растворенного диоксида углерода с карбонатными минералами и при других процессах растворения и химического выветривания горных пород. Источником этих ионов являются также микробиальные процессы, протекающие в почвах на площади водосбора, в донных отложениях, а также сточные воды различных предприятий: силикатной, металлургической, стекольной, химической промышленности, стоки с сельскохозяйственных угодий.
Общая жесткость поверхностных вод колеблется в основном от единиц до десятков миллимолей КВЭ в кубическом дециметре, причем карбонатная жесткость часто составляет 70-80 % от общей жесткости. Она подвержена заметным сезонным колебаниям, достигая обычно наибольшего значения в конце зимы и наименьшего в период паводка. Жесткость подземных вод более постоянна.
Вода с жесткостью менее 4 ммоль/дм3 КВЭ характеризуется как мягкая; от 4 до 8 ммоль/дм3 КВЭ — средней жесткости; от 8 до 12 ммоль/дм3 КВЭ — жесткая; более 12 ммоль/дм3 КВЭ — очень жесткая.
Обычно преобладает (иногда в несколько раз) жесткость, обусловленная ионами кальция, однако в отдельных случаях, магниевая жесткость может достигать 50-60 % общей жесткости и более (часто магниевая жесткость превосходит кальциевую в морских и океанических водах, либо в поверхностных водах суши с высоким содержанием сульфат-ионов).
Высокая жесткость оказывает отрицательное влияние на свойства воды используемой в промышленности и для хозяйственно-бытовых целей. Жесткие требования в отношении величины жесткости предъявляются к воде, питающей паросиловые установки, поскольку в присутствии сульфатов и карбонатов кальций и магний образуют прочную накипь, уменьшающую теплопроводность металла и приводящую к перерасходу топлива и перегреву котлов. Для устранения жесткости применяют различные способы — осаждение труднорастворимых солей кальция и магния химическим или термическим путем, умягчение с помощью ионитов.
Высокая жесткость, особенно, обусловленная превышением солей магния, ухудшает органолептические свойства воды, придавая ей горьковатый вкус и оказывая отрицательное воздействие на органы пищеварения. Предельно допустимая величина жесткости в питьевых водах 7 ммоль/дм3 КВЭ, но в некоторых случаях допускается использовать для питьевых целей воду с жесткостью 10 ммоль/дм КВЭ.
1.1 Метод измерения жесткости
Выполнение измерений жесткости основано на способности ионов кальция и магния в среде аммонийно-аммиачного буферного раствора (рН 9-10) образовывать с трилоном Б малодиссоциированные комплексные соединения. При титровании вначале связывается кальций, образующий более прочный комплекс с трилоном Б, а затем магний. Конечная точка титрования определяется по изменению окраски индикатора эриохрома черного Т от вишнёво-красной (окраска соединения магния с индикатором) до голубой (окраска свободного индикатора).
Границы погрешности при вероятности Р=0,95 (±Δ):
от 0,060 до 2,000 ммоль/дм3 – 0,037+0,040Х
св.2,000 до 13,00 включ. – -0,05+0,073Х
Выбор условий титрования
Объём аликвоты пробы воды для выполнения измерений величины жесткости выбирают исходя из предполагаемой величины жёсткости или по результатам оценочного титрования.
Для оценочного титрования отбирают 10 см3 воды, добавляют 0,5 см3 буферного раствора, 7-10 мг индикатора эриохрома черного Т и титруют раствором трилона Б с до перехода окраски из вишнево-красной в голубую. По величине израсходованного на титрование объёма раствора трилона Б выбирают из таблицы 1 соответствующий объем аликвоты пробы воды для выполнения измерений величины жесткости.
Таблица 1 — Объём пробы воды, рекомендуемый для выполнения измерений жесткости
Предполагаемая жесткость воды, моль/дм3
Объем раствора трилона Б, израсходованный при оценочном титровании, см3
Рекомендуемый объем аликвоты пробы воды, см3
Источник
Универсальный индекс насыщения воды карбонатом кальция
В статье представлена методика расчёта значения рН воды, соответствующего состоянию насыщения воды по карбонату кальция. Методика основана на использовании значения произведения растворимости карбоната кальция и константы диссоциации угольной кислоты по второй ступени.
Диоксид углерода содержится в воде в следующих состояниях: адсорбированного диоксида углерода, углекислоты, бикарбоната и карбоната. Все формы диоксида углерода при неизменном состоянии окружающей среды находятся в так называемом «углекислотном равновесии». Изменение углекислотного равновесия воды приводит к тому, что вода становится склонной либо к выпадению карбонатов, либо к углекислотной коррозии.
Если деионизированную воду, содержащую твёрдый карбонат кальция, начать насыщать диоксидом углерода, то будет происходить химическая реакция:
То есть диоксид углерода сначала будет адсорбироваться водой. Затем диоксид углерода диссоциируется в воде с образованием катиона водорода и аниона бикарбоната. Вода приобретает кислую реакцию. В результате начинается растворение твёрдого карбоната кальция с образованием растворённого бикарбоната кальция. Если из воды начать отгон диоксида углерода, то ион водорода при бикарбонате свяжется в воду, и начнёт образовываться обратно твёрдый карбонат кальция. Если вода находится в состоянии углекислотного равновесия, тогда говорят о том, что при определённой концентрации адсорбированного диоксида углерода в воде существует определённая концентрация бикарбоната кальция. При этом состоянии вода не склонна к выделению твёрдой фазы карбоната кальция, и все катионы водорода, образованные в результате диссоциации углекислого газа, участвуют в уравнении реакции (1).
То есть, если возникают условия для протекания коррозии с водородным деполяризатором, это сразу приводит к нарушению углекислотного равновесия. В результате начинает выделяться твёрдая фаза карбоната кальция, что значительно ингибирует скорость протекания коррозии.
справа налево, то должен образовываться твёрдый карбонат кальция. Тем не менее, в воде наблюдаются довольно малые концентрации растворённого карбоната кальция. Концентрации кальция и карбоната в данном случае определяются при помощи произведения растворимости карбоната кальция ПРCaCO3.
Внимание : корректное написание уравнений и формул приводится только в печатной версии журнала СОК и его PDF-версии. Подписаться или скачать журнал можно здесь.
С учётом того, что образуется один катион кальция и один анион карбоната, можно записать:
ПРCaCO3 = CCa fCaCCO3 fCO3,
где ССа и СCO3 — мольные концентрации кальция и карбоната, моль/л; fСа и fCO3 — коэффициенты активности кальция и карбоната.
Так как кальций и карбонат — двухвалентные ионы, с определённым допущением можно записать, что fСа = fCO3.
ПРCaCO3 = CCaCCO3 f 2 CO3. (2)
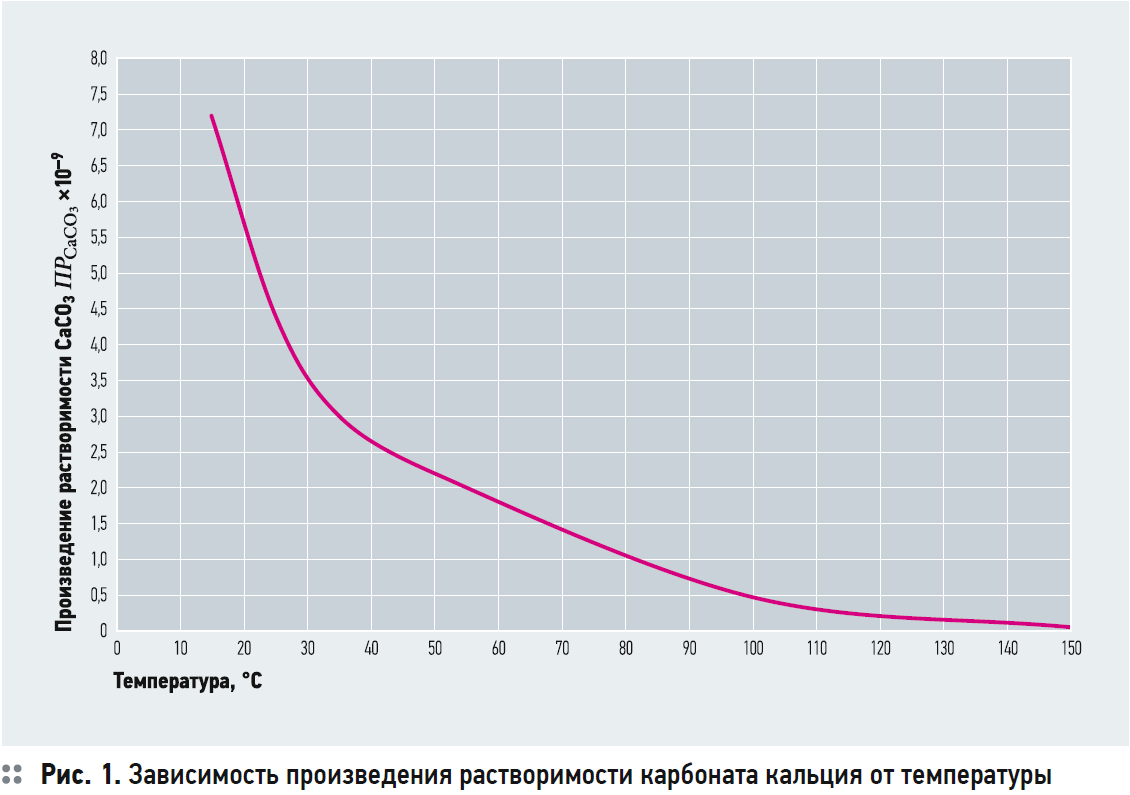
Значения произведения растворимости представлены в литературе для температур воды 25, 50, 100 и 150°C.
На рис. 1 представлена зависимость значения ПР от температуры. Для температур 25, 50, 100 и 150°C данные взяты из [1]. Остальные значения получены автором самостоятельно с использованием индекса Ланжелье.
Об этом будет сказано ниже.
Таким образом, для того, чтобы определить склонность воды к выделению осадка или к коррозии, достаточно знать значения концентраций кальция и карбоната. Но, так как определить карбонатион в воде при рН менее 8,37 невозможно, в соответствии с существующей методикой (ГОСТ 31957–2012. «Вода. Методы определения щёлочности и массовой концентрации карбонатов и гидрокарбонатов») для определения склонности воды к отложению карбоната кальция используют индекс насыщения Ланжелье.
Индекс насыщения Ланжелье — это разность между текущим значением рН воды и значением рНS, соответствующим состоянию насыщения этой воды по карбонату кальция (начало выделения твёрдой фазы карбоната кальция). В этом случае, определив по номограмме значение рНS и измерив текущее значение рН воды, можно определить склонность воды к отложению карбоната кальция или к углекислотной коррозии.
Соответственно, возникает вопрос: «Как определить рНS без использования эмпирического подхода»?
Для расчёта значения рНS воды, соответствующего состоянию насыщения по карбонату кальция, рассмотрим процесс диссоциации углекислоты в воде по второй стадии (диссоциация бикарбоната).
Уравнение диссоциации бикарбоната в воде можно записать в общем виде: HСО3 ?? H+ + СО3 -. (3)
Константу равновесия (диссоциации) данной химической реакции можно записать в виде:
Данное уравнение можно записать следующим образом, вынося ион водорода в левую часть:
Затем записать в виде десятичного логарифма, взятого с обеих сторон:
Очевидно, что При этом Константа диссоциации или константа равновесия реакции растворения углекислоты в воде по второй стадии К2 = 4,69?10–11.
Уравнение (4) есть уравнение Хендерсона-Хассельбальха для диссоциации углекислоты по второй стадии.
Более подробная информация о существовании и взаимодействии различных форм диоксида углерода в воде представлена в статье [2].
При помощи уравнения (4) можно рассчитать значение рНS воды в состоянии насыщения по карбонату кальция. Для этого необходимо определить значение карбонат-иона (СО3), при котором в воде достигается значение произведения растворимости карбоната кальция ПРCaCO3 с учётом существующего ионного состава воды.
Значение карбонат-иона можно определить исходя из произведения растворимости карбоната кальция. То есть мы определим концентрацию карбонат-иона, при котором вода данного химического состава находится в состоянии насыщения. Исходя из (2) получаем:
Таким образом, зная значения концентраций кальция и бикарбоната данной воды из химических анализов и рассчитав по (5) значение концентрации карбоната, мы можем определить при помощи (4) значение рНS.
Для учёта влияния концентрации всех ионов, растворённых в воде, необходимо в уравнении (4) вместо концентраций использовать активности карбоната и бикарбоната. Таким образом, уравнение (4) запишется следующим образом:
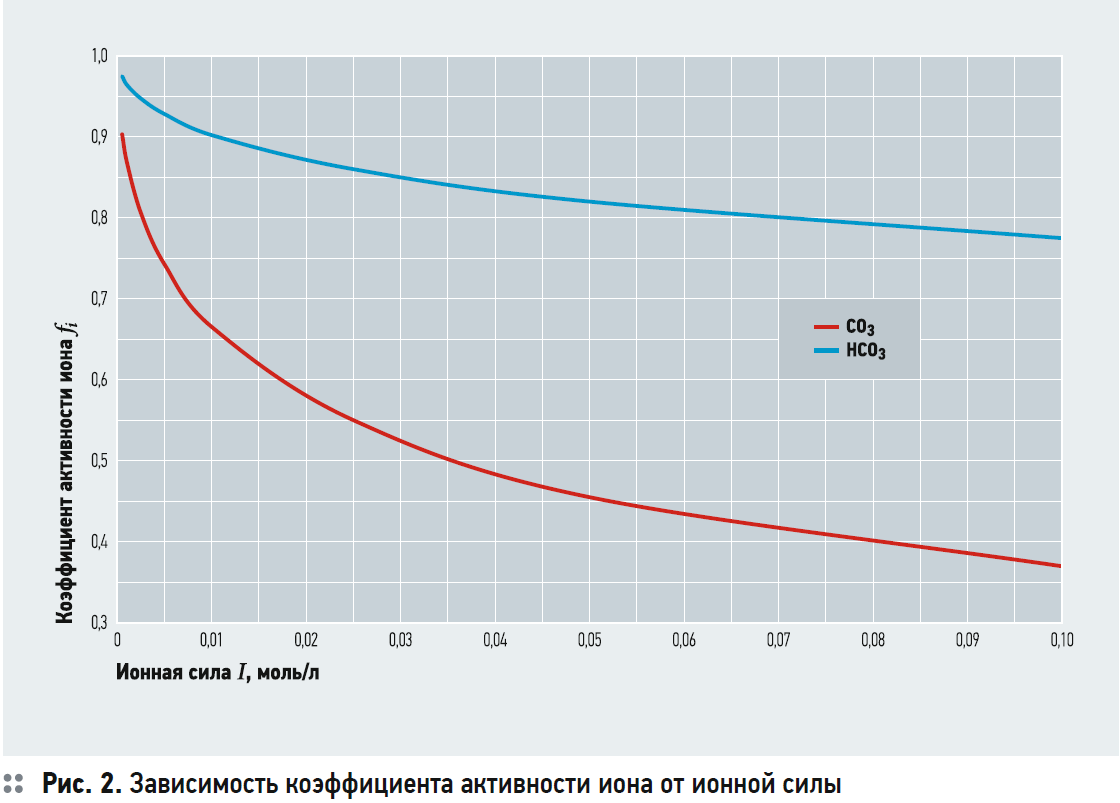
Коэффициенты активности зависят от ионной силы раствора и определяются по уравнению:
где fi — коэффициент активности иона; zi — заряд иона; I — ионная сила раствора, моль/л.
Ионная сила раствора учитывает влияние интенсивности электромагнитного поля, образованного ионами, на физико-химическое взаимодействие ионов, и равна полусумме значений произведения концентрации ионов на квадрат их зарядов:
На рис. 2 представлен график зависимости коэффициента активности иона от ионной силы раствора, построенный с использованием уравнения (7).
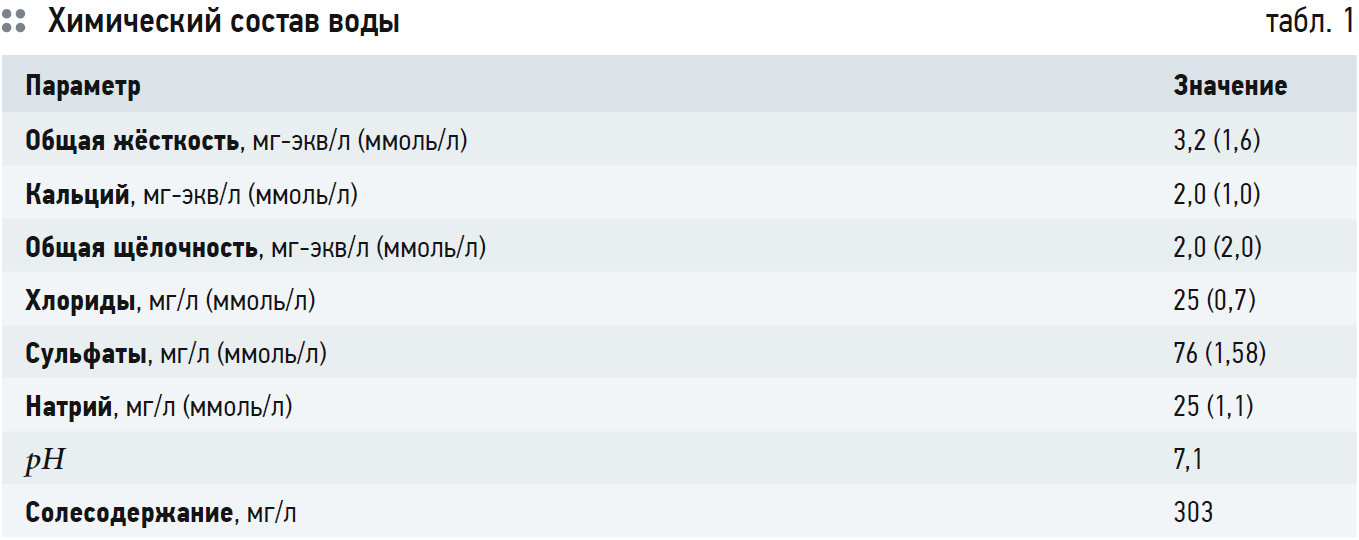
Для примера рассчитаем рНS с использованием ПРCaCO3 для водопроводной воды города Саратова для температуры 25°C. Источником водоснабжения является подготовленная вода из реки Волга.
Состав воды представлен в табл. 1. Ионная сила воды равна: I = 0,5?(Ca · 22 + Mg · 22 + Na · 1 + Cl · 1 + + SO4 · 22) = 1?4 + 0,6?4 + 1,1?1 + + 0,7?1 + 1,58?4 = 0,00726 моль/л. В соответствии с рис. 2: fCa = fCO3 = 0,7; fHCO3 = 0,915; ПРCaCO3 = 4,4?10–9 при t = 25°C. Тогда или СО3 = 0,00898 ммоль/л. В соответствии с уравнением (6) получаем выражение:
Значение рНS получилось на 0,76 больше, чем реально измеренный рН воды. Это значит, что вода склонна к протеканию коррозии с водородным деполяризатором (углекислотная коррозия в данном случае). Что и постоянно наблюдается.
Значение рНS, рассчитанное в процессе определения индекса Ланжелье по программе ROSA 9.0 для данных табл. 1, равно 7,86, то есть полностью совпадает со значением рНS, рассчитанным по предлагаемой методике.
Значение рНS, рассчитанное по номограмме, представленной в [3], равно 7,8.
Можно сказать, что в данном случае значение рНS, рассчитанное по предлагаемой методике, полностью соответствует значению рНS, полученному в результате расчёта индекса Ланжелье.
Для проверки автором был произведён расчёт рНS по данной методике и по расчёту индекса Ланжелье с использованием программы ROSA 9.0, а также с использованием номограммы, представленной в [3].
Результаты расчётов представлены в табл. 2, содержащей следующие данные.
В первой строке представлен расчёт значения рНS по трём методикам для следующего состава воды: Са — 1,25 ммоль/л; НСО3 — — 2,5 ммоль/л. На основании этих значений рассчитаны солесодержание S и ионная сила I и определены коэффициенты активности для ионов по рис. 1. В строке 2 в воду добавляется хлорид натрия (NaCl) — 10 ммоль/л. Соответственно, увеличиваются солесодержание, ионная сила и уменьшаются коэффициенты активности. В строке 3 в воду добавляют 500 ммоль/л (NaCl), и солесодержание воды становится 29,5 г/л. В этом случае значение рНS, рассчитанное по индексу Ланжелье, даёт неверные значения, и ROSA предлагает использовать индекс Стиффа и Девиса. Значение рНS, рассчитанное в соответствии с индексом Стиффа и Девиса, представлено в знаменателе в столбце ROSA 9.0, соответственно, в числителе того же столбца представлены значения рНS, рассчитанные по индексу Ланжелье.
В строках 4, 5 и 6 рассчитывается индекс насыщения для Са — 5 ммоль/л, НСО3 — — 10 ммоль/л, с добавление хлорида натрия в тех же количествах, как в строках 2 и 3.
В строках 7, 8, 9 и 10 рассчитывается индекс насыщения для Са — 10 ммоль/л, НСО3 — — 20 ммоль/л с добавление хлорида натрия. Только в строке 9 производится расчёт с добавлением 100 ммоль/л NaCl.
Для каждой методики произведён расчёт значения рНS для трёх температур воды: 15, 25 и 35°C.
Результаты расчёта, представленные в табл. 1, охватывают довольно большой диапазон концентраций бикарбоната кальция и общего солесодержания.
В расчёте значения рНS по уравнению (6) использовались допущения:
1. Коэффициенты активности для кальция и карбоната принимаются одинаковыми. Также не учитывается влияние температуры на коэффициент активность ионов в связи с её незначительным влиянием.
2. Данные для ПРCaCO3 взяты из [1] для температур 25, 50, 150 и 200°C. Значения ПР для 15°C и 35°C получены автором из расчёта того, что для широкого диапазона температур значения рНS, рассчитанные по предлагаемой методике и по ROSA 9.0, имели хорошую сходимость. В этом случае были определены следующие значения: ПРCaCO3 = 7,2?10–9 при t = 15°C; ПРCaCO3 = 4,4?10–9 при t = 25°C; ПРCaCO3 = 3,0?10–9 при t = 35°C.
3. Расчёт значения рНS при использовании номограммы [3] (третий столбец) ограничен солесодержанием воды в 15 г/л и НСО3 — не более 10 ммоль/л.
При использовании значений произведений растворимости по рис. 1 значения рНS практически совпадают для всех трёх рассматриваемых методик во всём рассматриваемом диапазоне температур и солесодержания. Расхождение составляет менее 0,1 ед. рН.
Также необходимо отметить, что при ионной силе I > 0,04 (солесодержание около 2,2 г/л) значения рНS, посчитанные по предлагаемой методике и в ROSA для индекса Ланжелье и индекса Стиффа и Девиса, имеют небольшое различие (строка 8).
При ионной силе более 0,1 (солесодержание около 7 г/л) значения рНS по индексу Ланжелье, посчитанные в ROSA, начинают давать очевидно неверные значения, но при этом значения рНS по индексу Стиффа и Девиса, посчитанные также в ROSA, практически полностью соответствуют значениям рНS, подсчитанным по предлагаемой методике (строка 9).
Можно сказать, что индекс Ланжелье можно использовать в расчётах при солесодержании воды до 4,0–5,0 г/л. Данное значение солесодержания — это своего рода граница перехода от индекса Ланжелье к индексу Стиффа и Девиса.
Для воды с солесодержанием около 30 г/л (I > 0,5) (строки 3, 6 и 10) значения рНS по предлагаемой методике соотносятся со значением рНS для индекса Стиффа и Девиса с расхождением менее 0,04 ед. рН. Так же, как с индексом Ланжелье при малом солесодержании.
Подводя итог, следует отметить, что использование предлагаемой методики для расчёта значения рНS, которое соответствует состоянию насыщения воды по карбонату кальция, имеет относительно простой и понятный смысл. Расчёт довольно прост и понятен. Для расчёта только необходимо определить значение ПРCaCO3 в зависимости от температуры воды по рис. 1, а также значения коэффициентов активности ионов кальция, карбоната и бикарбоната в зависимости от ионной силы раствора по рис. 1.
Данную методику расчёта значения рН воды, насыщенной по карбонату кальция, можно назвать универсальной, так как полученные результаты представляются достаточно достоверными во всём диапазоне солесодержания (пресных, солоноватых и солёных вод). При этом другие индексы работают только в определённом диапазоне солесодержания воды.
Источник