В уроке 2 «Изотопы элементов» из курса «Химия для чайников» рассмотрим что такое изотопы элементов и как правильно их обозначают; кроме того мы научимся определять массовое число, дефект массы и энергию связи ядра. Данный урок полностью опирается на основы химии, изложенные в первом уроке, в котором мы рассмотрели строение атома и атомного ядра, поэтому настоятельно вам рекомендую его изучить от корки до корки.
Что такое изотоп?
Хотя все атомы одного элемента имеют одинаковое число протонов, эти атомы могут отличаться числом имеющихся у них нейтронов. Такие различные атомы одного и того же элемента называются изотопами. Количество протонов, а также количество электронов у изотопа и исходного элемента совпадает. По этой причине в природе существует гораздо больше химических элементов, чем указано в таблице Менделеева, которая систематизирует элементы по числу протонов (порядковый номер).
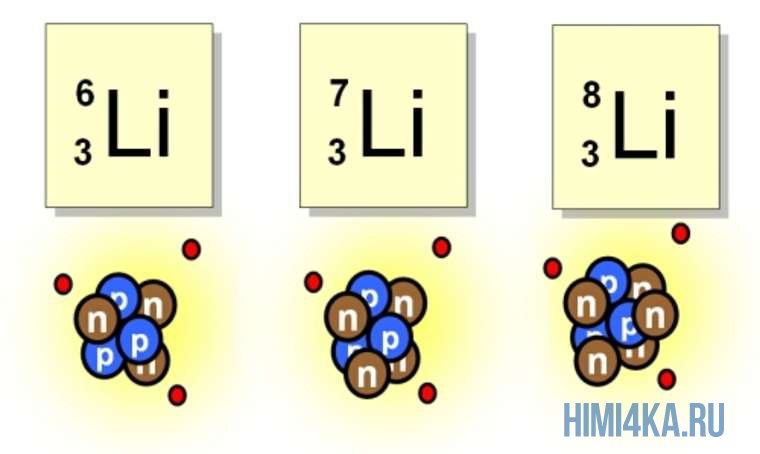
Например, все атомы Li имеют 3 протона, но в природе существуют изотопы, содержащие от 3 до 5 нейтронов. Для обозначения изотопа, слева от символа элемента подписывают нижним индексом его порядковый номер, а верхним — массовое число. Массовое число — это суммарное число нуклонов (протонов и нейтронов) в атомном ядре, численно близкое к атомной массе элемента. Нижний индекс, обозначающий порядковый номер элемента, указывать не обязательно, так как все атомы лития имеют в своем ядре по 3 протона. Также, обсуждая эти изотопы, можно пользоваться записью «литий-6» и «литий-8».
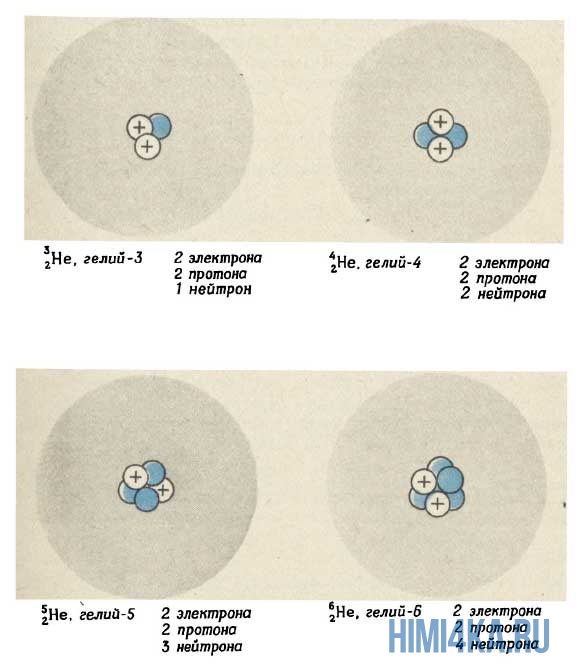
На рисунке выше изображен состав четырех изотопов гелия (Не). Все атомы гелия содержат два протона (и, следовательно, два электрона), но число нейтронов у них может быть разным. В природе большинство атомов гелия имеет два нейтрона (гелий-4) и реже одного раза на миллион встречаются атомы гелия с одним нейтроном (гелий-3). Другие изотопы гелия — гелий-5 , гелий-6 и гелий-8 (не показанный на рисунке) — неустойчивы и обнаруживаются лишь на очень непродолжительное время в ядерных реакциях (подробнее об этом будем говорить еще не скоро). Размеры ядер на рисунке очень сильно увеличены. Если бы они были такими, как это показано на рисунке, диаметр атома должен был достигать примерно 0,5 км.
Пример 1. Сколько протонов, нейтронов и электронов содержится в атоме урана-238? Запишите символ этого изотопа.
Решение: Порядковый номер урана (см. таблицу Менделеева) равен 92, а массовое число изотопа равно 238 (по условию). Следовательно, он содержит 92 протона, 92 электрона и 238 — 92 = 146 нейтронов. Его символ 238U.
Дефект массы и энергия связи ядра
Затронув тему изотопов, нельзя пройти мимо феномена дефект массы ядра. Когда из отдельных нуклонов образуется атомное ядро, часть их массы превращается в энергию. Другими словами, вот взяли вы щепотку протонов и нейтронов, хорошенько их смяли вместе, и получили ядро, но его масса будет меньше массы исходных компонентов. Это и есть дефект масс. Формула для расчета дефекта массы ядра:
- ∆m=(Zmp+Nmn)-Mя
где Mя – масса ядра, Z – число протонов в ядре, N – число нейтронов в ядре, mp – масса протона, mn – масса нейтрона.
Если к атому подвести энергию (которая эквивалентна дефекту масс), то можно разделить его ядро обратно на нуклоны. Эта энергия носит название энергия связи ядра. Формула для расчета энергии связи ядра:
- ∆Eсв=∆mc2
где с — скорость света, ∆m — дефект массы ядра
Проверьте себя, как вы усвоили понятия дефект массы и энергия связи ядра, самостоятельно решив задачу пользуясь формулами выше.
Пример 2. Если образовать атом углерода-12 из субатомных частиц, какое значение будет иметь дефект масс?
Показать
Ответ: 0,0990 а.е.м.
[свернуть]
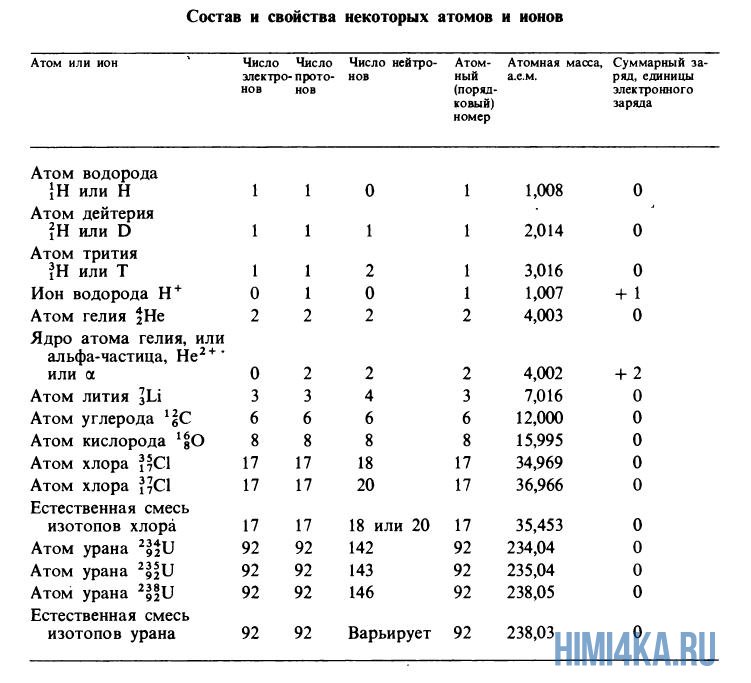
Теперь нам известно, что каждый изотоп элемента характеризуется порядковым номером (суммарным числом протонов), массовым числом (суммарным числом протонов и нейтронов) и атомной массой (массой атома, выраженной в атомных единицах массы). Поскольку дефект массы при образовании атома очень мал, массовое число обычно совпадает с атомной массой изотопа, округленной до ближайшего целого числа. (Например, атомная масса хлора-37 равна 36,966, что после округления дает 37.) Если в природе встречается несколько изотопов одного элемента, то экспериментально наблюдаемая атомная масса (естественная атомная масса) равна средневзвешенному значению атомных масс отдельных изотопов. Это средневзвешенное значение определяется соответственно относительному содержанию изотопов в природе. Хлор существует в природе в виде смеси из 75,53% хлора-35 (атомная масса 34,97 а.е.м.) и 24,47% хлора-37 (36,97 а.е.м.), поэтому средневзвешенное значение масс этих изотопов равно
- (0,7553·34,97 а.е.м.) + (0,2447·36,97 а.е.м.) = 35,46 а.е.м.
Атомные массы, указанные в таблице Менделеева представляют собой во всех случаях средневзвешенные значения атомных масс изотопов, встречающихся в природе, и именно этими значениями мы будем пользоваться в дальнейшем, за исключением тех случаев, когда будет обсуждаться какой-нибудь конкретный изотоп. Все изотопы одного элемента в химическом отношении ведут себя практически одинаково. На рисунке ниже изображены состав и свойства некоторые атомов, ионов и изотопов элементов.
Пример 3. Магний (Mg) в основном состоит из трех естественных изотопов: 78,70% всех атомов магния имеют атомную массу 23,985 а.е.м., 10,13% — 24,986 а.е.м. и 11,17% — 25,983 а.е.м. Сколько протонов и нейтронов содержится в каждом из этих трех изотопов? Чему равно средневзвешенное значение их атомных масс?
Решение: Все изотопы магния содержат по 12 протонов. Изотоп с атомной массой 23,985 а.е.м. имеет массовое число 24 (суммарное число протонов и нейтронов), следовательно, он имеет 24 — 12 = 12 нейтронов. Символ этого изотопа 24Mg. Аналогично находим, что изотоп с атомным весом 24,986 а.е.м. имеет массовое число 25, содержит 13 нейтронов и имеет символ 25Mg. Третий изотоп (25,983 а.е.м.) имеет массовое число 26, содержит 14 нейтронов и имеет символ 26Mg. Средняя атомная масса магния находится следующим образом:
- (0,7870·23,985 а.е.м.) + (0,1013·24,986 а.е.м.) + (0,1117·25,983 а.е.м.) = 24,31 а.е.м.
Надеюсь урок 2 «Изотопы элементов» помог вам понять что из себя представляют изотопы. Если у вас возникли вопросы, пишите их в комментарии.
From Wikipedia, the free encyclopedia
Magnetic sector mass spectrometer used in isotope ratio analysis, through thermal ionization
Isotope analysis is the identification of isotopic signature, abundance of certain stable isotopes of chemical elements within organic and inorganic compounds. Isotopic analysis can be used to understand the flow of energy through a food web, to reconstruct past environmental and climatic conditions, to investigate human and animal diets, for food authentification, and a variety of other physical, geological, palaeontological and chemical processes. Stable isotope ratios are measured using mass spectrometry, which separates the different isotopes of an element on the basis of their mass-to-charge ratio.
Tissues affected[edit]
Isotopic oxygen is incorporated into the body primarily through ingestion at which point it is used in the formation of, for archaeological purposes, bones and teeth. The oxygen is incorporated into the hydroxylcarbonic apatite of bone and tooth enamel.
Bone is continually remodelled throughout the lifetime of an individual. Although the rate of turnover of isotopic oxygen in hydroxyapatite is not fully known, it is assumed to be similar to that of collagen; approximately 10 years. Consequently, should an individual remain in a region for 10 years or longer, the isotopic oxygen ratios in the bone hydroxyapatite would reflect the oxygen ratios present in that region.
Teeth are not subject to continual remodelling and so their isotopic oxygen ratios remain constant from the time of formation. The isotopic oxygen ratios, then, of teeth represent the ratios of the region in which the individual was born and raised. Where deciduous teeth are present, it is also possible to determine the age at which a child was weaned. Breast milk production draws upon the body water of the mother, which has higher levels of 18O due to the preferential loss of 16O through sweat, urine, and expired water vapour.
While teeth are more resistant to chemical and physical changes over time, both are subject to post-depositional diagenesis. As such, isotopic analysis makes use of the more resistant phosphate groups, rather than the less abundant hydroxyl group or the more likely diagenetic carbonate groups present.
Applications[edit]
Isotope analysis has widespread applicability in the natural sciences. These include numerous applications in the biological, earth and environmental sciences.
Archaeology[edit]
Reconstructing ancient diets[edit]
Archaeological materials, such as bone, organic residues, hair, or sea shells, can serve as substrates for isotopic analysis. Carbon, nitrogen and zinc isotope ratios are used to investigate the diets of past people; these isotopic systems can be used with others, such as strontium or oxygen, to answer questions about population movements and cultural interactions, such as trade.[1]
Carbon isotopes are analysed in archaeology to determine the source of carbon at the base of the foodchain. Examining the 12C/13C isotope ratio, it is possible to determine whether animals and humans ate predominantly C3 or C4 plants.[2] Potential C3 food sources include wheat, rice, tubers, fruits, nuts and many vegetables, while C4 food sources include millet and sugar cane.[3] Carbon isotope ratios can also be used to distinguish between marine, freshwater, and terrestrial food sources.[4][5]
Carbon isotope ratios can be measured in bone collagen or bone mineral (hydroxylapatite), and each of these fractions of bone can be analysed to shed light on different components of diet. The carbon in bone collagen is predominantly sourced from dietary protein, while the carbon found in bone mineral is sourced from all consumed dietary carbon, included carbohydrates, lipids, and protein.[6]
Nitrogen isotopes can be used to infer soil conditions, with enriched δ15N used to infer the addition of manure. A complication is that enrichment also occurs as a result of environmental factors, such as wetland denitrification, salinity, aridity, microbes, and clearance.[7]
To obtain an accurate picture of palaeodiets, it is important to understand processes of diagenesis that may affect the original isotopic signal. It is also important for the researcher to know the variations of isotopes within individuals, between individuals, and over time.[1]
Sourcing archaeological materials[edit]
Isotope analysis has been particularly useful in archaeology as a means of characterization. Characterization of artifacts involves determining the isotopic composition of possible source materials such as metal ore bodies and comparing these data to the isotopic composition of analyzed artifacts. A wide range of archaeological materials such as metals, glass and lead-based pigments have been sourced using isotopic characterization.[8] Particularly in the Bronze Age Mediterranean, lead isotope analysis has been a useful tool for determining the sources of metals and an important indicator of trade patterns. Interpretation of lead isotope data is, however, often contentious and faces numerous instrumental and methodological challenges.[9] Problems such as the mixing and re-using of metals from different sources, limited reliable data and contamination of samples can be difficult problems in interpretation.
Ecology[edit]
All biologically active elements exist in a number of different isotopic forms, of which two or more are stable. For example, most carbon is present as 12C, with approximately 1% being 13C. The ratio of the two isotopes may be altered by biological and geophysical processes, and these differences can be utilized in a number of ways by ecologists.
The main elements used in isotope ecology are carbon, nitrogen, oxygen, hydrogen and sulfur, but also include silicon, iron, and strontium.[10]
Stable isotope analysis in aquatic ecosystems[edit]
Stable isotopes have become a popular method for understanding aquatic ecosystems because they can help scientists in understanding source links and process information in marine food webs. These analyses can also be used to a certain degree in terrestrial systems. Certain isotopes can signify distinct primary producers forming the bases of food webs and trophic level positioning. The stable isotope compositions are expressed in terms of delta values (δ) in permil (‰), i.e. parts per thousand differences from a standard. They express the proportion of an isotope that is in a sample. The values are expressed as:
- δX = [(Rsample / Rstandard) – 1] × 103
where X represents the isotope of interest (e.g., 13C) and R represents the ratio of the isotope of interest and its natural form (e.g., 13C/12C).[11] Higher (or less negative) delta values indicate increases in a sample’s isotope of interest, relative to the standard, and lower (or more negative) values indicate decreases. The standard reference materials for carbon, nitrogen, and sulfur are Pee Dee Belamnite limestone, nitrogen gas in the atmosphere, and Cañon Diablo meteorite respectively. Analysis is usually done using a mass spectrometer, detecting small differences between gaseous elements. Analysis of a sample can cost anywhere from $30 to $100.[11] Stable isotopes assist scientists in analyzing animal diets and food webs by examining the animal tissues that bear a fixed isotopic enrichment or depletion vs. the diet. Muscle or protein fractions have become the most common animal tissue used to examine the isotopes because they represent the assimilated nutrients in their diet. The main advantage to using stable isotope analysis as opposed to stomach content observations is that no matter what the status is of the animal’s stomach (empty or not), the isotope tracers in the tissues will give us an understanding of its trophic position and food source.[12] The three major isotopes used in aquatic ecosystem food web analysis are 13C, 15N and 34S. While all three indicate information on trophic dynamics, it is common to perform analysis on at least two of the previously mentioned 3 isotopes for better understanding of marine trophic interactions and for stronger results.
Hydrogen-2[edit]
The ratio of 2H, also known as deuterium, to 1H has been studied in both plant and animal tissue. Hydrogen isotopes in plant tissue are correlated with local water values but vary based on fractionation during photosynthesis, transpiration, and other processes in the formation of cellulose. A study on the isotope ratios of tissues from plants growing within a small area in Texas found tissues from CAM plants were enriched in deuterium relative to C4 plants.[13] Hydrogen isotope ratios in animal tissue reflect diet, including drinking water, and have been used to study bird migration[14] and aquatic food webs.[15][16]
Carbon-13[edit]
Carbon isotopes aid us in determining the primary production source responsible for the energy flow in an ecosystem. The transfer of 13C through trophic levels remains relatively the same, except for a small increase (an enrichment < 1 ‰). Large differences of δ13C between animals indicate that they have different food sources or that their food webs are based on different primary producers (i.e. different species of phytoplankton, marsh grasses.) Because δ13C indicates the original source of primary producers, the isotopes can also help us determine shifts in diets, both short term, long term or permanent. These shifts may even correlate to seasonal changes, reflecting phytoplankton abundance.[12] Scientists have found that there can be wide ranges of δ13C values in phytoplankton populations over a geographic region. While it is not quite certain as to why this may be, there are several hypotheses for this occurrence. These include isotopes within dissolved inorganic carbon pools (DIC) may vary with temperature and location and that growth rates of phytoplankton may affect their uptake of the isotopes. δ13C has been used in determining migration of juvenile animals from sheltered inshore areas to offshore locations by examining the changes in their diets. A study by Fry (1983) studied the isotopic compositions in juvenile shrimp of south Texas grass flats. Fry found that at the beginning of the study the shrimp had isotopic values of δ13C = -11 to -14‰ and 6-8‰ for δ15N and δ34S. As the shrimp matured and migrated offshore, the isotopic values changed to those resembling offshore organisms (δ13C= -15‰ and δ15N = 11.5‰ and δ34S = 16‰).[17]
Sulfur-34[edit]
While there is no enrichment of 34S between trophic levels, the stable isotope can be useful in distinguishing benthic vs. pelagic producers and marsh vs. phytoplankton producers.[12] Similar to 13C, it can also help distinguish between different phytoplankton as the key primary producers in food webs. The differences between seawater sulfates and sulfides (c. 21‰ vs -10‰) aid scientists in the discriminations. Sulfur tends to be more plentiful in less aerobic areas, such as benthic systems and marsh plants, than the pelagic and more aerobic systems. Thus, in the benthic systems, there are smaller δ34S values.[12]
Nitrogen-15[edit]
Nitrogen isotopes indicate the trophic level position of organisms (reflective of the time the tissue samples were taken). There is a larger enrichment component with δ15N because its retention is higher than that of 14N. This can be seen by analyzing the waste of organisms.[12] Cattle urine has shown that there is a depletion of 15N relative to the diet.[18] As organisms eat each other, the 15N isotopes are transferred to the predators. Thus, organisms higher in the trophic pyramid have accumulated higher levels of 15N ( and higher δ15N values) relative to their prey and others before them in the food web. Numerous studies on marine ecosystems have shown that on average there is a 3.2‰ enrichment of 15N vs. diet between different trophic level species in ecosystems.[12] In the Baltic sea, Hansson et al. (1997) found that when analyzing a variety of creatures (such as particulate organic matter (phytoplankton), zooplankton, mysids, sprat, smelt and herring,) there was an apparent fractionation of 2.4‰ between consumers and their apparent prey.[19]
In addition to trophic positioning of organisms, δ15N values have become commonly used in distinguishing between land derived and natural sources of nutrients. As water travels from septic tanks to aquifers, the nitrogen rich water is delivered into coastal areas. Waste-water nitrate has higher concentrations of 15N than the nitrate that is found in natural soils in near shore zones.[20] For bacteria, it is more convenient for them to uptake 14N as opposed to 15N because it is a lighter element and easier to metabolize. Thus, due to bacteria’s preference when performing biogeochemical processes such as denitrification and volatilization of ammonia, 14N is removed from the water at a faster rate than 15N, resulting in more 15N entering the aquifer. 15N is roughly 10-20‰ as opposed to the natural 15N values of 2-8‰.[20] The inorganic nitrogen that is emitted from septic tanks and other human-derived sewage is usually in the form of 
Oxygen-18[edit]
Analysis of the ratio of 18O to 16O in the shells of the Colorado Delta clam was used to assess the historical extent of the estuary in the Colorado River Delta prior to construction of upstream dams.[24]
Forensic science[edit]
A recent development in forensic science is the isotopic analysis of hair strands. Hair has a recognisable growth rate of 9-11mm[25] per month or 15 cm per year.[26] Human hair growth is primarily a function of diet, especially drinking water intake.[citation needed] The stable isotopic ratios of drinking water are a function of location, and the geology that the water percolates through. 87Sr, 88Sr and oxygen isotope variations are different all over the world. These differences in isotopic ratio are then biologically ‘set’ in our hair as it grows and it has therefore become possible to identify recent geographic histories by the analysis of hair strands. For example, it could be possible to identify whether a terrorist suspect had recently been to a particular location from hair analysis. This hair analysis is a non-invasive method which is becoming very popular in cases that DNA or other traditional means are bringing no answers.[citation needed]
Isotope analysis can be used by forensic investigators to determine whether two or more samples of explosives are of a common origin. Most high explosives contain carbon, hydrogen, nitrogen and oxygen atoms and thus comparing their relative abundances of isotopes can reveal the existence of a common origin. Researchers have also shown that analysis of the 12C/13C ratios can locate the country of origin for a given explosive.[citation needed]
Stable isotopic analysis has also been used in the identification of drug trafficking routes. Isotopic abundances are different in morphine grown from poppies in south-east Asia versus poppies grown in south-west Asia. The same is applied to cocaine that is derived from Bolivia and that from Colombia.[27]
Traceability[edit]
Stable isotopic analysis has also been used for tracing the geographical origin of food,[28] timber,[29] and in tracing the sources and fates of nitrates in the environment.[30][31]
Geology[edit]
Hydrology[edit]
In isotope hydrology, stable isotopes of water (2H and 18O) are used to estimate the source, age, and flow paths of water flowing through ecosystems. The main effects that change the stable isotope composition of water are evaporation and condensation.[32] Variability in water isotopes is used to study sources of water to streams and rivers, evaporation rates, groundwater recharge, and other hydrological processes.[33][34][35]
Paleoclimatology[edit]
The ratio of 18O to 16O in ice and deep sea cores is temperature dependent, and can be used as a proxy measure for reconstructing climate change. During colder periods of the Earth’s history (glacials) such as during the ice ages, 16O is preferentially evaporated from the colder oceans, leaving the slightly heavier and more sluggish 18O behind. Organisms such as foraminifera which combine oxygen dissolved in the surrounding water with carbon and calcium to build their shells therefore incorporate the temperature-dependent 18O to 16O ratio. When these organisms die, they settle out on the sea bed, preserving a long and invaluable record of global climate change through much of the Quaternary.[36] Similarly, ice cores on land are enriched in the heavier 18O relative to 16O during warmer climatic phases (interglacials) as more energy is available for the evaporation of the heavier 18O isotope. The oxygen isotope record preserved in the ice cores is therefore a «mirror» of the record contained in ocean sediments.[37]
Oxygen isotopes preserve a record of the effects of the Milankovitch cycles on climate change during the Quaternary, revealing an approximately 100,000-year cyclicity in the Earth’s climate.[38]
References[edit]
- ^ a b Hermes, Taylor R.; Frachetti, Michael D.; Bullion, Elissa A.; Maksudov, Farhod; Mustafokulov, Samariddin; Makarewicz, Cheryl A. (26 March 2018). «Urban and nomadic isotopic niches reveal dietary connectivities along Central Asia’s Silk Roads». Scientific Reports. 8 (1): 596. Bibcode:2018NatSR…8.5177H. doi:10.1038/s41598-018-22995-2. ISSN 2045-2322. PMC 5979964. PMID 29581431.
- ^ van der Merwe, Nikolaas J. (1982). «Carbon Isotopes, Photosynthesis, and Archaeology: Different pathways of photosynthesis cause characteristic changes in carbon isotope ratios that make possible the study of prehistoric human diets». American Scientist. 70 (6): 596–606. Bibcode:1982AmSci..70..596v. JSTOR 27851731.
- ^ O’Leary, Marion H. (1988). «Carbon Isotopes in Photosynthesis». BioScience. 38 (5): 328–336. doi:10.2307/1310735. JSTOR 1310735.
- ^ Schoeninger, Margaret J; DeNiro, Michael J (1984). «Nitrogen and carbon isotopic composition of bone collagen from marine and terrestrial animals». Geochimica et Cosmochimica Acta. 48 (4): 625–639. Bibcode:1984GeCoA..48..625S. doi:10.1016/0016-7037(84)90091-7.
- ^ Fry, B.; Sherr, E. B. (1989). Stable Isotopes in Ecological Research. Ecological Studies. Springer, New York, NY. pp. 196–229. doi:10.1007/978-1-4612-3498-2_12. ISBN 9781461281276.
- ^ Fernandes, Ricardo; Nadeau, Marie-Josée; Grootes, Pieter M. (2012-12-01). «Macronutrient-based model for dietary carbon routing in bone collagen and bioapatite». Archaeological and Anthropological Sciences. 4 (4): 291–301. doi:10.1007/s12520-012-0102-7. ISSN 1866-9557. S2CID 85014346.
- ^ Lodwick, Lisa; Stroud, Elizabeth (2019). «Paleoethnobotany and Stable Isotopes». In López Varela, Sandra L. (ed.). The Encyclopedia of Archaeological Sciences. Malden, MA: Wiley-Blackwell. pp. 1–4. doi:10.1002/9781119188230.saseas0436. ISBN 9780470674611. S2CID 239512474.
- ^ Shortland, A. J (2006). «Application of Lead Isotope Analysis to a Wide Range of Late Bronze Age Egyptian Materials». Archaeometry. 48 (4): 657–69. doi:10.1111/j.1475-4754.2006.00279.x.
- ^ Budd, P; Haggerty, R; Pollard, A. M; Scaife, B; Thomas, R. G (2015). «Rethinking the quest for provenance». Antiquity. 70 (267): 168–74. doi:10.1017/S0003598X00083034. S2CID 162675713.
- ^ Michener, Robert; Lajtha, Kate, eds. (2007-10-08). Stable isotopes in ecology and environmental science (2nd ed.). Blackwell Pub. pp. 4–5. ISBN 978-1-4051-2680-9.
- ^ a b Peterson, B J; Fry, B (1987). «Stable Isotopes in Ecosystem Studies». Annual Review of Ecology and Systematics. 18: 293–320. doi:10.1146/annurev.es.18.110187.001453. S2CID 21559668.
- ^ a b c d e f Michener, Robert H; Kaufman, Les (2007). «Stable Isotope Ratios as Tracers in Marine Food Webs: An Update». Stable Isotopes in Ecology and Environmental Science. pp. 238–82. doi:10.1002/9780470691854.ch9. ISBN 978-0-470-69185-4.
- ^ Sternberg, Leonel; DeNiro, Michael; Johnson, Hyrum (1984). «Isotope ratios of cellulose from plants having different photosynthetic pathways» (PDF). Plant Physiology. 74 (3): 557–561. doi:10.1104/pp.74.3.557. PMC 1066725. PMID 16663460. Retrieved 15 March 2019.
- ^ Kelly, Jeffrey F.; Atudorei, Viorel; Sharp, Zachary D.; Finch, Deborah M. (1 January 2002). «Insights into Wilson’s Warbler migration from analyses of hydrogen stable-isotope ratios». Oecologia. 130 (2): 216–221. Bibcode:2002Oecol.130..216K. doi:10.1007/s004420100789. PMID 28547144. S2CID 23355570.
- ^ Doucett, Richard R.; Marks, Jane C.; Blinn, Dean W.; Caron, Melanie; Hungate, Bruce A. (June 2007). «Measuring Terrestrial Subsidies to Aquatic Food Webs Using Stable Isotopes of Hydrogen». Ecology. 88 (6): 1587–1592. doi:10.1890/06-1184. PMID 17601150.
- ^ Cole, Jonathan J.; Carpenter, Stephen R.; Kitchell, Jim; Pace, Michael L.; Solomon, Christopher T.; Weidel, Brian (1 February 2011). «Strong evidence for terrestrial support of zooplankton in small lakes based on stable isotopes of carbon, nitrogen, and hydrogen». Proceedings of the National Academy of Sciences. 108 (5): 1975–1980. Bibcode:2011PNAS..108.1975C. doi:10.1073/pnas.1012807108. PMC 3033307. PMID 21245299.
- ^ Fry, B. (1983). «Fish and shrimp migrations in the northern Gulf of Mexico analyzed using stable C, N, and S isotope ratios». Fishery Bulletin. 81: 789–801. hdl:1969.3/19268.
- ^ Steele, K. W; Daniel, R. M (2009). «Fractionation of nitrogen isotopes by animals: A further complication to the use of variations in the natural abundance of 15N for tracer studies» (PDF). The Journal of Agricultural Science. 90: 7–9. doi:10.1017/S002185960004853X. hdl:10289/4600. S2CID 96956741.
- ^ a b
- ^ a b Kreitler, Charles W; Ragone, Stephen E; Katz, Brian G (1978). «N15/N14 Ratios of Ground-Water Nitrate, Long Island, New Yorka». Ground Water. 16 (6): 404. doi:10.1111/j.1745-6584.1978.tb03254.x.
- ^ McClelland, James W; Valiela, Ivan (1998). «Linking nitrogen in estuarine producers to land-derived sources». Limnology and Oceanography. 43 (4): 577. Bibcode:1998LimOc..43..577M. doi:10.4319/lo.1998.43.4.0577.
- ^ Carmichael, RH; Hattenrath, T; Valiela, I; Michener, RH (2008). «Nitrogen stable isotopes in the shell of Mercenaria mercenaria trace wastewater inputs from watersheds to estuarine ecosystems» (PDF). Aquatic Biology. 4: 99–111. doi:10.3354/ab00106.
- ^ McClelland, James W; Valiela, Ivan; Michener, Robert H (1997). «Nitrogen-stable isotope signatures in estuarine food webs: A record of increasing urbanization in coastal watersheds». Limnology and Oceanography. 42 (5): 930. Bibcode:1997LimOc..42..930M. doi:10.4319/lo.1997.42.5.0930.
- ^ Rodriguez, Carlie A; Flessa, Karl W; Téllez-Duarte, Miguel A; Dettman, David L; Ávila-Serrano, Guillermo A (2001). «Macrofaunal and isotopic estimates of the former extent of the Colorado River estuary, upper Gulf of California, México». Journal of Arid Environments. 49 (1): 183–93. Bibcode:2001JArEn..49..183R. doi:10.1006/jare.2001.0845.
- ^ Black, S. (2008). Crime Scene Analysis. Reading University.[page needed]
- ^ White, P. (2004). Crime Scene to Court: The Essentials of Forensic Science (2nd ed.). Royal Society of Chemistry.[page needed]
- ^ Ehleringer, J.R.; Casale, J.; Cooper, D.A.; Lott, M.J. (2001). Sourcing Drugs With Stable Isotopes (Thesis). Office of National Drug Control Policy.
- ^ Kelly, Simon; Heaton, Karl; Hoogewerff, Jurian (2005). «Tracing the geographical origin of food: The application of multi-element and multi-isotope analysis». Trends in Food Science & Technology. 16 (12): 555–67. doi:10.1016/j.tifs.2005.08.008.
- ^ Gori, Yuri; Stradiotti, Ana; Camin, Federica (2018). «Timber isoscapes. A case study in a mountain area in the Italian Alps». PLOS ONE. 13 (2): e0192970. Bibcode:2018PLoSO..1392970G. doi:10.1371/journal.pone.0192970. PMC 5815615. PMID 29451907.
- ^ Kendall, Carol; Elliott, Emily M.; Wankel, Scott D. (2007), «Tracing Anthropogenic Inputs of Nitrogen to Ecosystems», Stable Isotopes in Ecology and Environmental Science, John Wiley & Sons, Ltd, pp. 375–449, doi:10.1002/9780470691854.ch12, ISBN 978-0-470-69185-4, retrieved 2021-08-11
- ^ Charteris, Alice Fiona (2019), Charteris, Alice Fiona (ed.), «Introduction», 15N Tracing of Microbial Assimilation, Partitioning and Transport of Fertilisers in Grassland Soils, Springer Theses, Cham: Springer International Publishing, pp. 1–33, doi:10.1007/978-3-030-31057-8_1, ISBN 978-3-030-31057-8, retrieved 2021-08-11
- ^ McGuire, Kevin; McDonnell, Jeff (2007-10-08). «Stable isotope tracers in watershed hydrology». In Michener, Robert; Lajtha, Kate (eds.). Stable isotopes in ecology and environmental science (2nd ed.). Blackwell Pub. ISBN 9781405126809.
- ^ Gabriel Bowen. «WaterIsotopes.org provides information, data, and resources for scientific applications involving spatial variation in the isotopes of hydrogen and oxygen». Waterisotopes.org. Retrieved 2019-03-17.
- ^ Gabriel Bowen. «Welcome». Spatio-temporal Isotope Analytics Lab (Spatial). Retrieved 2019-03-17.
- ^ Cardenas, M. Bayani; Rodolfo, Raymond S.; Lapus, Mark R.; Cabria, Hillel B.; Fullon, Jose; Gojunco, Gordos R.; Breecker, Daniel O.; Cantarero, Danica M.; Evaristo, Jaivime; Siringan, Fernando P.; Zhang, Tongwei (2020). «Submarine Groundwater and Vent Discharge in a Volcanic Area Associated With Coastal Acidification». Geophysical Research Letters. 47 (1): e2019GL085730. doi:10.1029/2019GL085730. ISSN 1944-8007. S2CID 212912472.
- ^ Marwick, Ben; Gagan, Michael K (2011). «Late Pleistocene monsoon variability in northwest Thailand: An oxygen isotope sequence from the bivalve Margaritanopsis laosensis excavated in Mae Hong Son province». Quaternary Science Reviews. 30 (21–22): 3088–98. Bibcode:2011QSRv…30.3088M. doi:10.1016/j.quascirev.2011.07.007. S2CID 15182044.
- ^ Wolff, E. W., Fischer, H., Ommen, T. van, Hodell, D. A. (2022), «Stratigraphic templates for ice core records of the past 1.5 Myr», Nature
- ^ Petit, J. R., Jouzel, J., Raynaud, D., Barkov, N. I., Barnola, J.-M., Basile, I., Bender, M., Chappellaz, J., Davis, M., Delaygue, G., Delmotte, M., Kotlyakov, V. M., Legrand, M., Lipenkov, V. Y., Lorius, C., PÉpin, L., Ritz, C., Saltzman, E., Stievenard, M. (1999), «Climate and atmospheric history of the past 420,000 years from the Vostok ice core, Antarctica», Climate of the Past
External links[edit]
- MixSIAR. MixSIAR is an R package that helps you create and run Bayesian mixing models to analyze biotracer data (i.e. stable isotopes, fatty acids), following the MixSIAR model framework. Both graphical user interface (GUI) and script versions are available. Stock, B.C., Jackson, A.L., Ward, E.J., Parnell, A.C., Phillips, D.L., Semmens, B.X. Associated peer-reviewed research paper.
- IsoSource. Stable isotope mixing model for an excess number of sources (Visual Basic), (Phillips and Gregg, 2003).
- Moore, Jonathan W; Semmens, Brice X (2008). «Incorporating uncertainty and prior information into stable isotope mixing models». Ecology Letters. 11 (5): 470–80. doi:10.1111/j.1461-0248.2008.01163.x. PMID 18294213.
- SIAR — Stable isotope analysis in R.. Bayesian mixing model package for the R environment. Parnell, A., Inger, R., Bearhop, S., Jackson, A.
- SISUS: Stable Isotope Sourcing using Sampling. Stable Isotope Sourcing using Sampling (SISUS) (Erhardt, Wolf, and Bedrick, In Prep.) provides a more efficient algorithm to provide solutions to the same problem as the Phillips and Gregg (2003) IsoSource model and software for source partitioning using stable isotopes.
- Hopkins, John B; Ferguson, Jake M (2012). «Estimating the Diets of Animals Using Stable Isotopes and a Comprehensive Bayesian Mixing Model». PLOS ONE. 7 (1): e28478. Bibcode:2012PLoSO…728478H. doi:10.1371/journal.pone.0028478. PMC 3250396. PMID 22235246.
Что такое изотоп?
Изотопами называют видоизменные элементы периодической таблицы Менделеева, которые имеют один и тот же порядковый номер, но различную атомную массу. Название характеризует нахождение подобных структур в одной клеточке периодической таблицы с нормальными элементами (изо – равное, топ – положение, место – в переводе с английского). Состав изотопов представляет собой совокупность протонов, электронов и нейтронов (количество нейтронов обычно больше, чем в обычных элементах периодической таблицы).
Обозначения изотопов
Видоизмененные элементы периодической таблицы Менделеева обозначаются следующим образом: к символу химического элемента, к которому принадлежит изотоп, подписывается верхний левый индекс с обозначением массового числа. Так, например, изотоп кислорода, обладающий массовым числом равным восемнадцати атомных единиц, будет обозначаться следующим образом: 18O. Имеется также другое обозначение подобных атомов (например, кислород – 18).
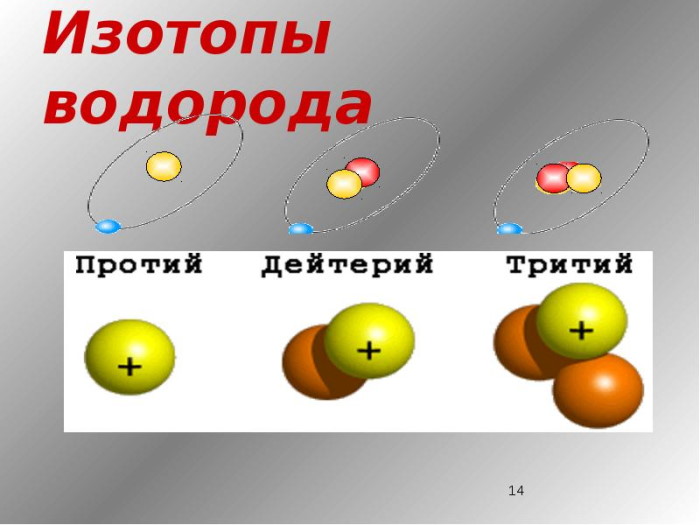
Изотопы водорода
Выделяют три видоизменённых атома водорода, обладающих разными массовыми числами:
-
протий (Н) – одна атомная единица массы;
-
дейтерий (D) – две атомные единицы массы;
-
тритий (Т) – три атомные единицы массы.
В природе чаще всего встречается протий (в 99,98 процентах случаев), именно поэтому среднее массовое число водорода будет равняться приблизительно 1 а.е.м. Стоит, отметить, что бета-распад трития составляет порядка 12 лет, после чего он переходит в форму Гелий — 3.
Отдельно необходимо выделить, видоизменённые атомы водорода, массовое число которого может колебаться в районе 4 – 7 а.е.м.
Изотопы урана
Изотопный ряд урана включает в себя изотопы, имеющие массу от 219 а.е.м. до 243 а.е.м. Элементы, обладающие наибольшей изотопной распространенностью – это уран – 235 и уран – 238.
Изотопные атомные урана с массовыми числами 235 и 238 представляют собой основной компонент для производства плутония – 239 (основного компонента ядерного оружия и ядерного топлива для реакторов нового поколения).
Нуклиды
Нуклиды подразделяются на две больших категории:
-
радиоактивные нуклиды;
-
стабильные нуклиды.
Химический элемент периодической таблицы ртуть (гидраргирум) обладает наибольшей изотопной распространенностью стабильных нуклидов. Так, стабильные нуклиды ртути – это вещества изотопного ряда гидраргиума, обладающие атомной массой от 170 а.е.м. до 219 а.е.м.
Термин нуклид (в понятии радионуклид) был предложен в двадцатом веке американцем Трумэном Команом. Радионуклиды отличаются длительным периодом полураспада, который в большинстве случаев имеет значение порядка 5*108
лет. Таким образом, радионуклиды населяют Землю с момента ее зарождения как планеты. В зависимости от массового числа нуклиды могут подвергать различным видам превращения, обозначим некоторые из них:
-
бета-распад;
-
двойной бета-распад;
-
электронный захват;
-
альфа-распад (для большинства радионуклидов подобный вид распада не наблюдается и из-за большого периода полураспада);
-
позитронный распад;
-
нейтронный и двухнейтронный распады.
Изотопы галлия
Изотопный ряд галлия представлен элементами, обладающими промежутком массовых числен от 49 а.е.м. до 71 а.е.м. Наиболее часто в природе встречаются следующие изотопные атомы: галлий – 69, галлий -71. Природный галлий обычно представлен смесью двух данных видоизмененных атомов, имеющих малый период полураспада (порядка 68 минут). Для представителей изотопного ряда галлия характерные следующие виды ядерных превращений:
-
электронный захват (наблюдается в 13% случаев);
-
позитронный распад (наблюдается в 87% случаев).
Превращения изотопов
Превращения изотопов могут протекать двумя способами:
-
при участии технологий, созданных человеком (используется в промышленности);
-
самопроизвольно (протекает в природе).
Выделяют следующие виды ядерных превращений, связанных со изменением атомной массы химических элементов: распад (альфа, бета, двойной бета, нейтронный, позитронный), электронный захват (происходит присоединение электрона, вследствие чего изменяется заряд и состав нуклида).
Применение радиоактивных изотопов
Изотопы химических элементов представляют собой элементы периодической таблицы Менделеева, обладающие нестабильными ядрами и свойством подвергаться различного ядерному распаду. В научной терминологии подобные атомы называют также радионуклидами. Радиоактивные изотопы применяются в различных сферах человеческой деятельности.
В сельском хозяйстве использования радиоизотопов необходимо для изучения особенностей роста, развития и функционирования корневых систем растений (такой способ изучения получил название – метод меченных атомов).
В авиастроительстве радионуклиды применяют для испытания авиационных конструкций на предмет износостойкости.
В сфере градостроительстве радиоактивные изотопы нашли свое применение как универсальные измерители плотности почвы.
В области коммунального хозяйства видоизмененные химические элементы, обладающие радиоактивной способностью, применяют в целях стерилизации постельного белья.
В текстильной промышленности радионуклиды используются для удаления электрических зарядов с поверхности одежды.
В машиностроительной отрасли радионуклиды используются для определения толщины металлического покрытия.
Особое место в этом списке занимает использование радиоактивных изотопов в химической промышленности и в сфере медицинских услуг. Так, получение различных полимерных соединений, которые составляют основу большинства современных предметов обихода, письменных принадлежностей, резиновых изделий того или иногда вида использования происходит при помощи взаимодействия y-излучения с различными химическими соединениями органической природы. В медицине радиоизотопы применяются в лечебных целях в рамках радиационной терапии (процедура, при которой под воздействием радионуклидов происходит разрушение любого типа живой ткани). Радиотерапия нашла свое применения в области лечения онкологических заболеваний (на данный момент, по эффективности радиотерапия уступает только химиотерапии, но зачастую данные способы лечения составляют две стадии одного процесса).
В заключении, стоит отметить, что научный прогресс в области получения новых видов изотопов тех или иных химических элементов не стоит на месте, поэтому возможно в будущем при помощи грамотного и целесообразного использования видоизмененных атомов можно будет лечить неизлечимые на данный момент заболеваний и строить космические корабли для покорения других планет и галактик.