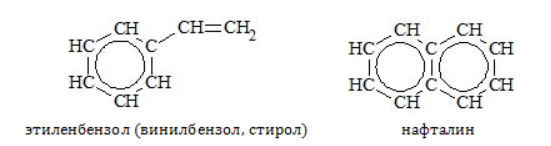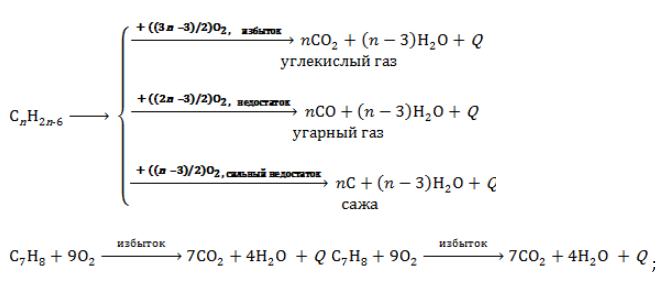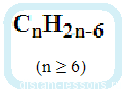Содержание
- 1 Строение ароматической связи
- 2 Гомологический ряд бензола
- 3 Номенклатура и изомерия алкилбензолов
- 3.1 Строение углеродного скелета
- 3.2 Позиции одинаковых заместителей
- 4 Физические свойства некоторых алкилбензолов
- 5 Химические свойства алкилбензолов
- 5.1 Замещение
- 5.2 Присоединение
- 5.3 Окисление
- 6 Взаимодействие радикалов с бензольным ядром
- 7 Заключение
Первым представителем ряда простейших ароматических углеводородов – аренов – является бензол. Все ароматические соединения – как гомологи бензола, так и арены более сложного строения – представляют собой его производные. Отличительный признак аренов – наличие в структуре молекулы бензольного кольца.
Строение ароматической связи
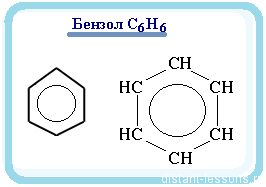
Химическая формула бензола – C6H6. Бензольная молекула – это циклическое образование, построенное из шести -гибридизованных углеродных атомов, каждый из которых соединен с одним атомом водорода.
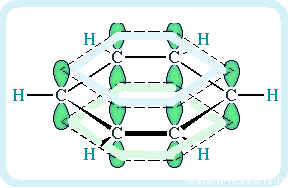
Углеродный скелет бензольного кольца имеет форму шестиугольника, в плоскости которого лежат оси соединяющих атомы -связей. Все эти связи одинаковы, угол между ними равен 120°. Поэтому негибридные p-облака, ориентированные перпендикулярно плоскости цикла, также равнозначны.
Результатом их перекрывания становится обобществление всех p-электронов в единое -электронное облако с делокализованной плотностью. Сочетание прочных
-связей и
-облака – ароматическая связь – образует стабильную структуру, называемую бензольным ядром.
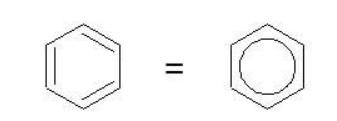
При записи ядро условно обозначается шестиугольным циклом либо с тремя чередующимися двойными связями, либо с вписанной делокализационной окружностью, которая подчеркивает особый характер ароматической связи.
Гомологический ряд бензола
Молекула бензола состоит только из ароматического ядра. Остальные представители гомологического ряда имеют в составе молекулы алкильные радикалы, присоединенные к ядру, и называются алкилбензолами.
Состав гомологов бензола определяется общей формулой . Гомологическая разность выражается через звено
углеводородной цепочки радикала.
Ряд бензола включает только арены с насыщенными радикалами и одним бензольным ядром. К числу ароматических углеводородов относятся соединения с непредельными радикалами, а также с несколькими бензольными кольцами, например:
Эти углеводороды не являются гомологами бензола, они входят в состав других рядов класса аренов.
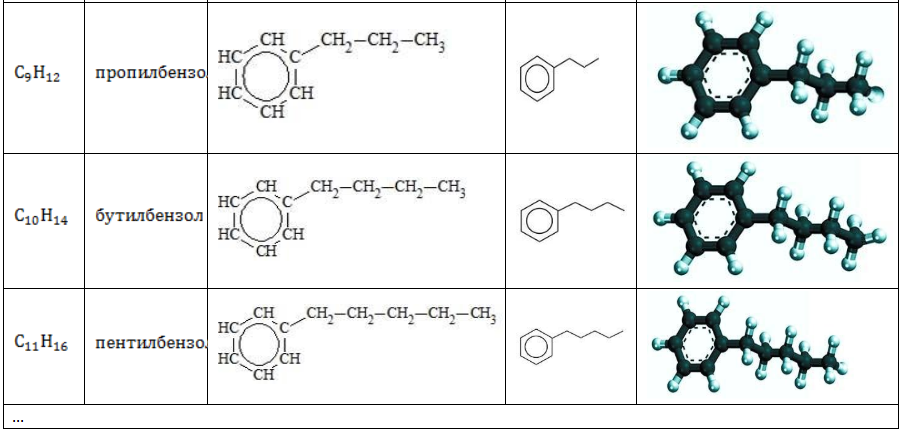
Строение углеводородов бензольного ряда представлено в таблице:
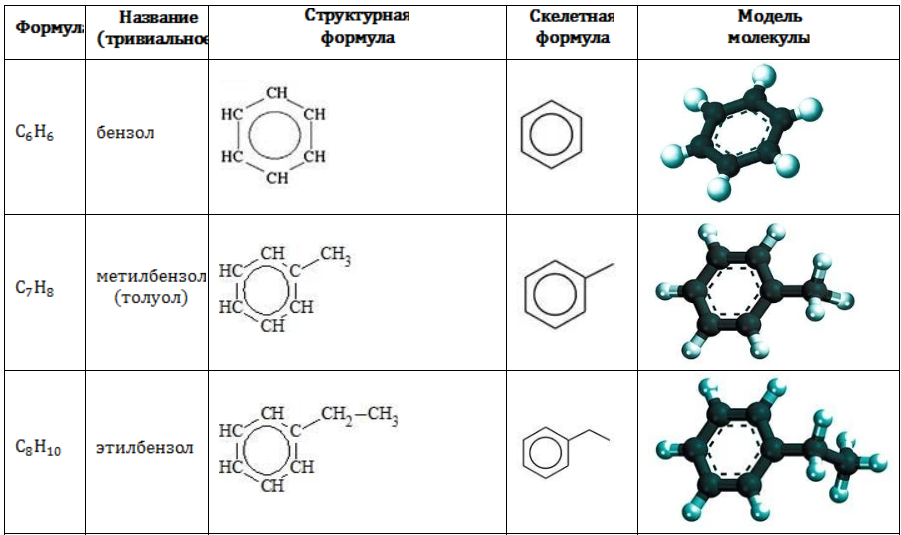
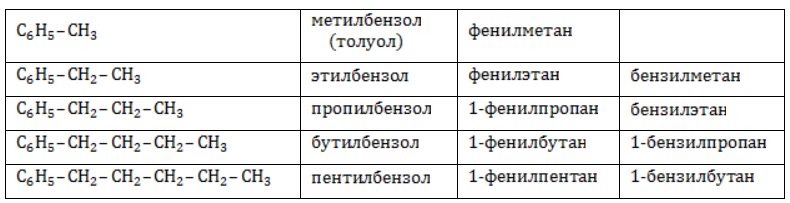
Арильные (содержащие бензольное ядро) радикалы носят следующие названия:
Каждый гомолог бензола может быть представлен как предельный углеводород с ароматическим радикалом:
Номенклатура и изомерия алкилбензолов
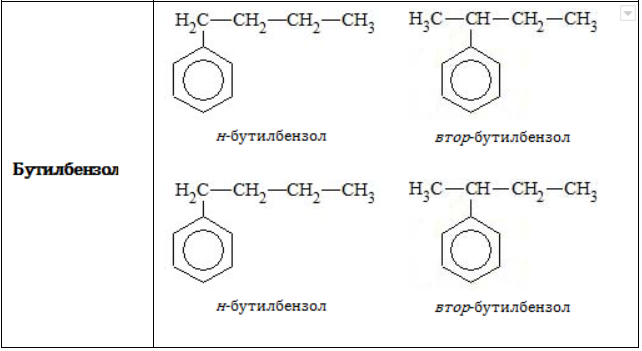
Всем соединениям гомологического ряда свойственна структурная изомерия, обусловленная наличием одной или нескольких боковых цепей. Не имеют изомеров только бензол и его ближайший гомолог – толуол, обладающий единственным простейшим метильным радикалом .
Строение углеродного скелета
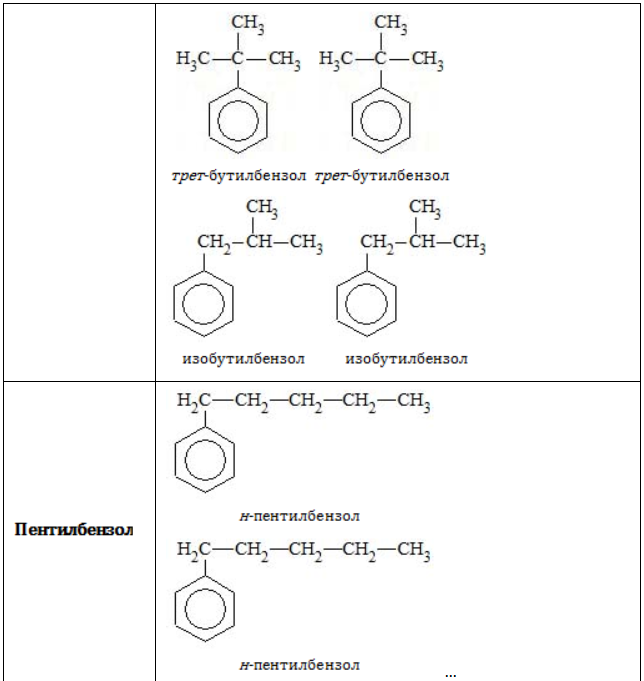
В зависимости от количества, состава и строения алкильных заместителей для соединений состава характерно широкое разнообразие. Число изомерных форм быстро растет с увеличением n.
При наименовании алкилбензолов соблюдаются следующие правила:
- ароматический цикл считается главной цепью и носит название «бензол»;
- алкильный заместитель указывается перед главной цепью: «метилбензол»;
- в случае если радикалов более одного, их позиции нумеруются в направлении кратчайшего промежутка между ними: «1,2», «1,3», «1,4», но не «1,5» или «1,6»;
- количество одинаковых заместителей обозначается после их номеров греческими численными приставками: «1,2-диметилбензол»;
- разные заместители перечисляются по старшинству: «1,2-диметил-4-бутилбензол»;
- посредством приставок «н-», «втор-» или «трет-» указывается, по какому углеродному атому в заместителе (первичному, вторичному или третичному) осуществляется связь с бензольным ядром: «1,2-диметил-4-трет-бутилбензол».
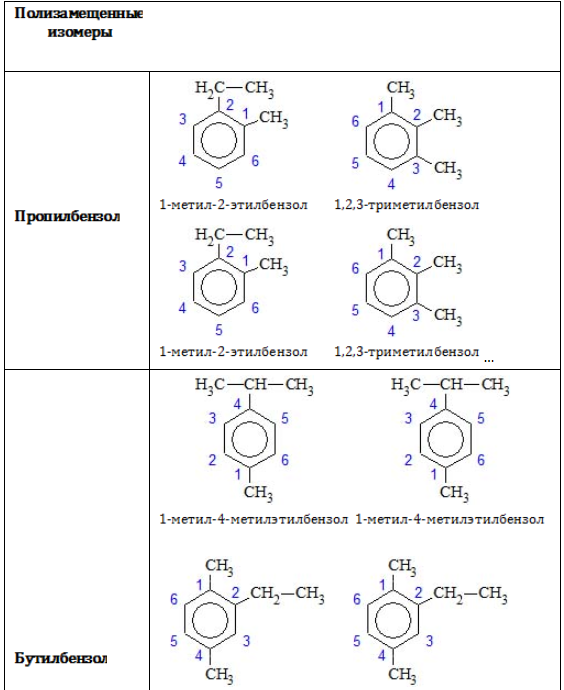
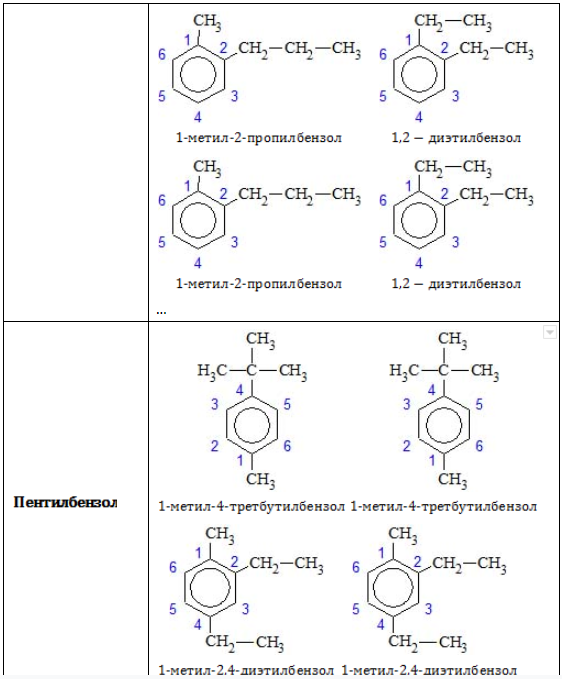
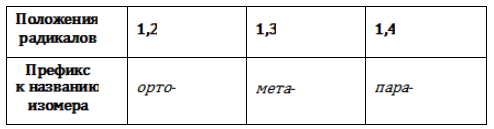
Позиции одинаковых заместителей
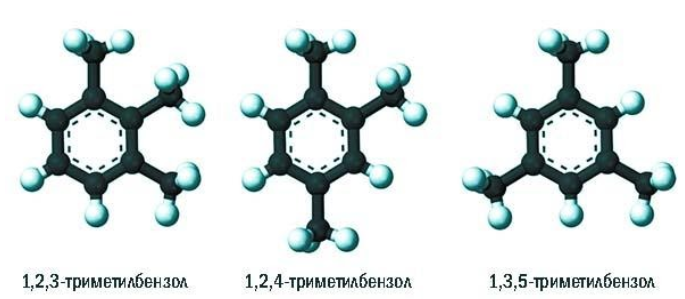
В полизамещенных алкилбензолах с радикалами одного типа возникает изомерия, связанная с их взаимным положением. Для позиционных изомеров в ряду бензола существуют специальные обозначения:
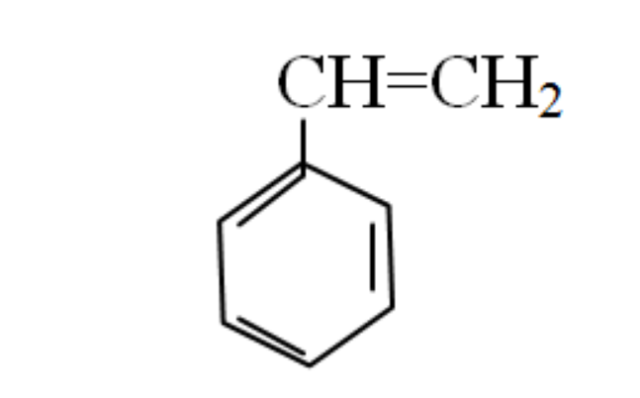
Например, дизамещенные изомеры этилбензола (имеют распространенное тривиальное наименование «ксилолы») образуют следующие изомеры по позициям метильных заместителей:
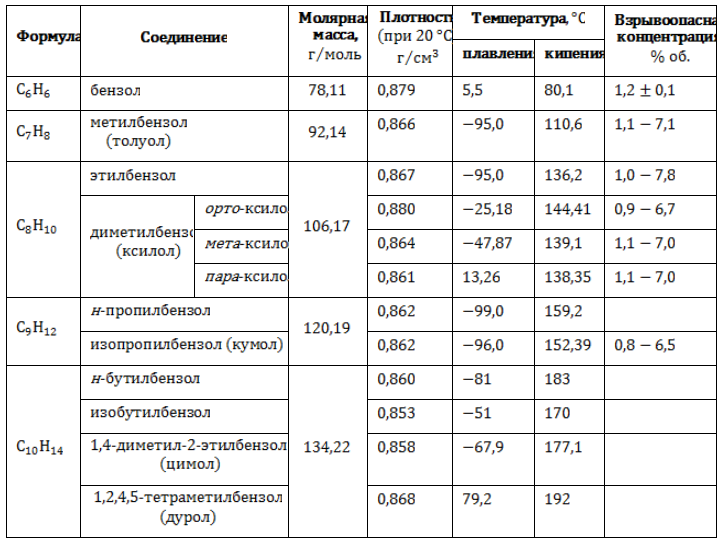
Физические свойства некоторых алкилбензолов
Бензол и углеводороды его ряда – бесцветные жидкости со специфическим запахом, не смешивающиеся с водой и нерастворимые в ней. Высшие гомологи представляют собой твердые вещества. Термические характеристики соединений бензольного ряда зависят от изомерии и длины боковых алкильных цепей.
Основные физические свойства бензола и наиболее близких его гомологов приведены в таблице.
Химические свойства алкилбензолов
Несмотря на то, что по составу бензол и другие представители гомологического ряда являются ненасыщенными соединениями, они склонны к типичным для алканов реакциям замещения, а ароматическое ядро чрезвычайно устойчиво. Тем не менее, алкилбензолы способны и к процессам присоединения, хотя реакции данного типа значительно затруднены по сравнению с непредельными углеводородами.
Различные заместители оказывают влияние на стабильность и реакционную способность бензольного ядра; оно, в свою очередь, воздействует на свойства радикалов. Поэтому изомерия играет важную роль в химических взаимодействиях алкилбензолов.
Замещение
Поскольку ароматическая система насыщена электронной плотностью, бензол и гомологи охотно реагируют с электрофильными соединениями по донорно-акцепторному механизму. Для бензольного кольца типичны процессы ионного замещения.
- Галогенирование
В отсутствие катализатора алкилбензолы не взаимодействуют с галогенами и их растворами (хлорной или бромной водой). На никелевом, железном или алюминиевом катализаторе, способствующем активации галогена, замещение идет по преимуществу в бензольном ядре:
В молекулах гомологов галогены замещают водород главным образом в орто-и пара-позициях к углеводородному радикалу:
Замещение может происходить и в боковой цепи. Для этого требуется воздействие яркого света либо нагревание до 300°C:
При этом галоген атакует ближайший к кольцу углеродный атом.
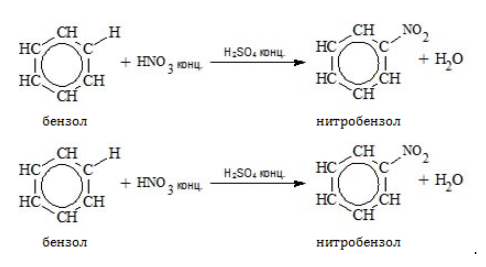
- Нитрование
Для реакции необходима нитрующая смесь концентрированных азотной и серной кислот:
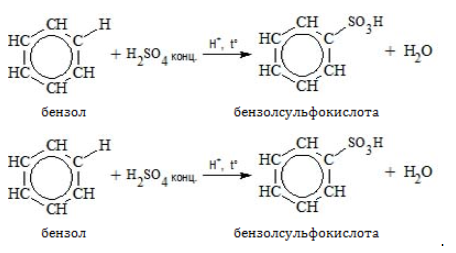
- Сульфирование
Бензол сульфируется концентрированной или «дымящей» кислотой (олеумом):
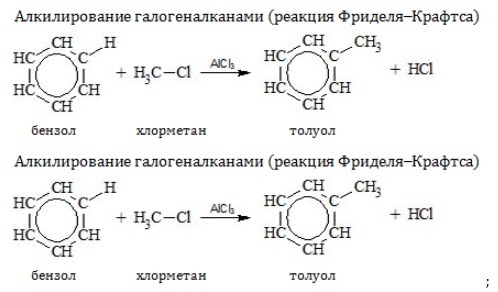
- Алкилирование
Замещение водорода алкильными радикалами является одним из методов получения гомологов бензола. Оно проводится несколькими путями:
Если неразветвленный галогеналкан содержит более двух углеродных атомов, происходит изомеризация продукта алкилирования:
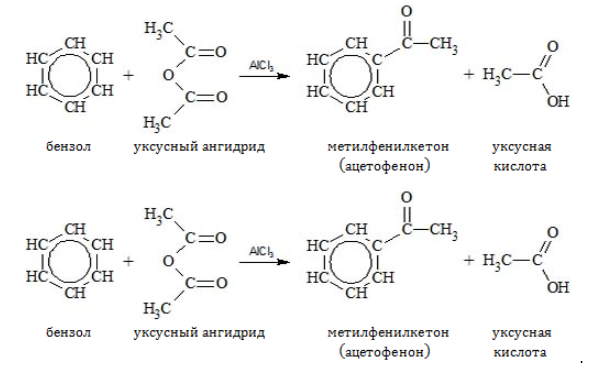
- Ацилирование
Водород может замещаться ацильным остатком галогенангидрида или ангидрида карбоновой кислоты:
Присоединение
В специальных условиях алкилбензолы способны к реакциям присоединения с разрушением ароматической связи.
- Гидрирование
- Хлорирование
Из всех соединений гомологического ряда хлор присоединяется только к бензолу:
При воздействии галогена на любой из гомологов бензола происходит не присоединение, а замещение в алкильном радикале.
Окисление
Бензол стоек к воздействию окислителей, таких как перманганат калия, даже в присутствии кислот и щелочей. Но его гомологи в жестких условиях подвергаются окислению.
- Жесткое окисление
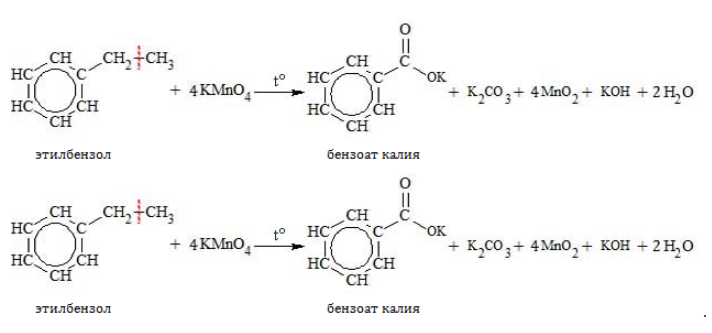
При повышенной температуре в нейтральной среде алкилбензолы окисляются до калиевой соли бензойной кислоты:
В кислой среде происходит образование бензойной кислоты:
Гомологи с длинной боковой цепью образуют две кислоты, так как при отрыве цепи от углеродного атома, соединенного с бензольным циклом, образуется остаток, содержащий более одного атома:
Если в реакции участвует полизамещенный алкилбензол, продуктом его окисления становится многоосновная ароматическая кислота:
- Полное окисление
Углеводороды ряда бензола горят с интенсивным выделением теплоты. Продукты горения зависят от количества вступающего в реакцию кислорода:
Взаимодействие радикалов с бензольным ядром
Заместители в зависимости от своей электрической природы по-разному влияют на распределение электронной плотности в ароматической системе. Соответственно изменяется и реакционная активность бензольного ядра в процессах замещения.
Это интересно:
Изомеры пентена
Общая формула циклоалканов
Окисление алкенов перманганатом калия
Заключение
Особенности электронного строения алкилбензолов не только оказывают влияние на их структуру и обусловливают многообразие изомерных форм. Они также непосредственно воздействуют на реакционную активность, определяя направление химических процессов с участием бензола и его гомологов. Это свойство алкилбензолов делает их ценным химическим продуктом, благодаря чему они находят широкое применение в промышленности и науке.
Арены — ароматические углеводороды, содержащие одно или несколько бензольных колец.
Бензольное кольцо составляют 6 атомов углерода, между которыми чередуются двойные и одинарные связи.
Важно заметить, что двойные связи в молекуле бензола не фиксированы, а постоянно перемещаются по кругу.
Арены также называют ароматическими углеводородами. Первый член гомологического ряда — бензол — C6H6.
Общая формула их гомологического ряда — CnH2n-6.
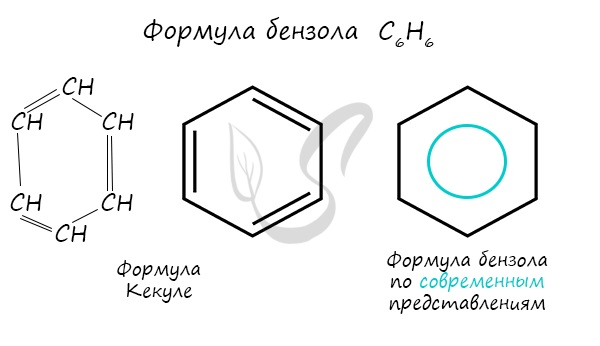
Долгое время структурная формула бензола оставалась тайной. Предложенная Кекуле формула с тремя двойными связями не могла
объяснить то, что бензол не вступает в реакции присоединения. Как уже было сказано выше, по современным представлениям
двойные связи в молекуле бензола постоянно перемещаются, поэтому более верно рисовать их в виде кольца.
За счет чередования двойных связей в молекуле бензола формируется сопряжение. Все атомы углерода находятся в состоянии sp2
гибридизации. Валентный угол — 120°.
Номенклатура и изомерия аренов
Названия аренов формируются путем добавления названий заместителей к главной цепи — бензольному кольцу: бензол, метилбензол (толуол),
этилбензол, пропилбензол и т.д. Заместители, как обычно, перечисляются в алфавитном порядке. Если в бензольном кольце несколько заместителей,
то выбирают кратчайший путь между ними.
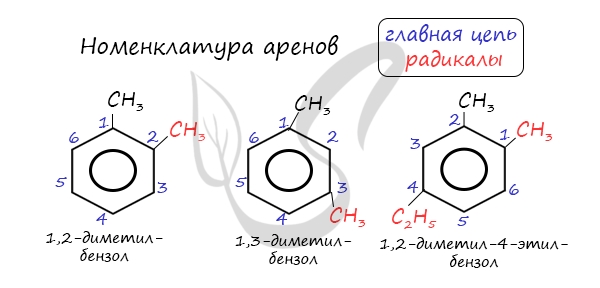
Для аренов характерна структурная изомерия, связанная с положением заместителей. Например, два заместителя в бензольном
кольце могут располагаться в разных положениях.
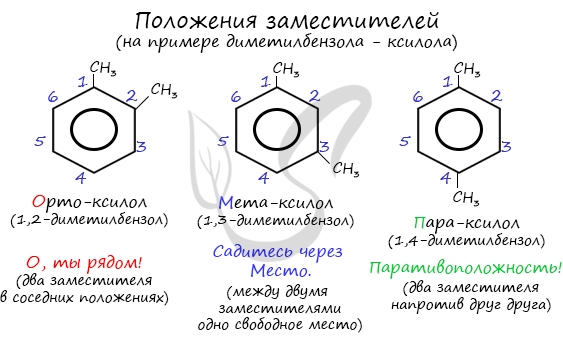
Название положения заместителей в бензольном кольце формируется на основе их расположения относительно друг друга. Оно обозначается
приставками орто-, мета- и пара. Ниже вы найдете мнемонические подсказки для их успешного запоминания 
Получение аренов
Арены получают несколькими способами:
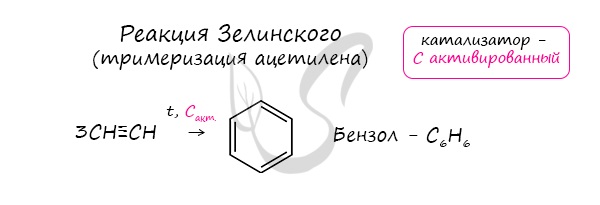
- Реакция Зелинского (тримеризация ацетилена)
- Дегидроциклизация алканов
- Дегидрирование циклоалканов
- Синтез Дюма
Данная реакция протекает при пропускании ацетилена над активированным углем при t = 400°C. В результате образуется ароматический
углеводород — бензол.
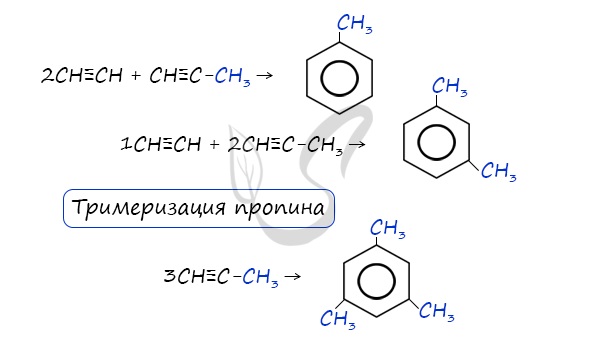
В случае, если к ацетилену добавить пропин, то становится возможным получение толуола. Увеличивая долю пропина, в конечном итоге
можно добиться образования 1,3,5-триметилбензола.
В ходе таких реакций, протекающих при повышенной температуре и в присутствии катализатора — Cr2O3, линейная
структура алкана замыкается в цикл, отщепляется водород.
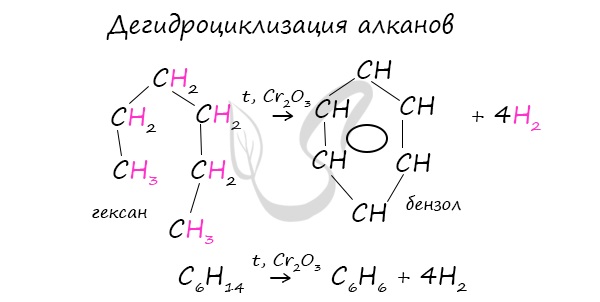
При дегидроциклизации гептана получается толуол.
В результате дегидрирования уже «готовых» циклов — циклоалканов, отщепляются 3 моль водорода, и образуется соответствующий арен,
с теми же заместителями, которые были у циклоалкана.
Синтез Дюма заключается в сплавлении солей карбоновых кислот с щелочами. В результате такой реакции возможно образование различных органических веществ, в том числе аренов.
Химические свойства аренов
Арены — ароматические углеводороды, которые содержат бензольное кольцо с сопряженными двойными связями. Эта особенность
делает реакции присоединения тяжело протекающими (и тем не менее возможными!)
Запомните, что, в отличие от других непредельных соединений, бензол и его гомологи не обесцвечивают бромную воду и
раствор перманганата калия.
- Гидрирование
- Галогенирование
- Нитрование
- Алкилирование
- Окисление
- Полимеризация
При повышенной температуре и наличии катализатора, водород способен разорвать двойные связи в бензольном кольце
и превратить арен в циклоалкан.
Реакция бензола с хлором на свету приводит к образованию гексахлорциклогексана, если же использовать только катализатор,
то образуется хлорбензол.
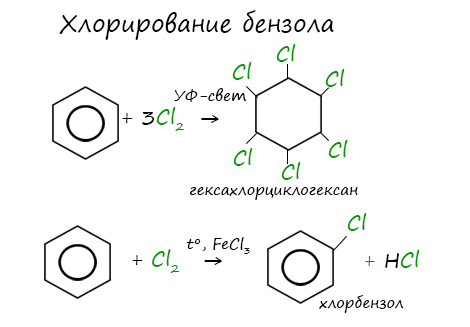
Реакции с толуолом протекают иначе: при УФ-свете хлор направляется в радикал метил и замещает атом водорода в нем, при действии катализатора хлор замещает один атом водорода в бензольном кольце (в орто- или пара-положении).
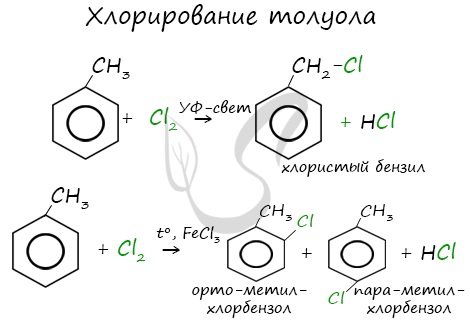
Почему хлор направляется именно в орто- и пара-положения относительно метильной группы? Здесь самое время
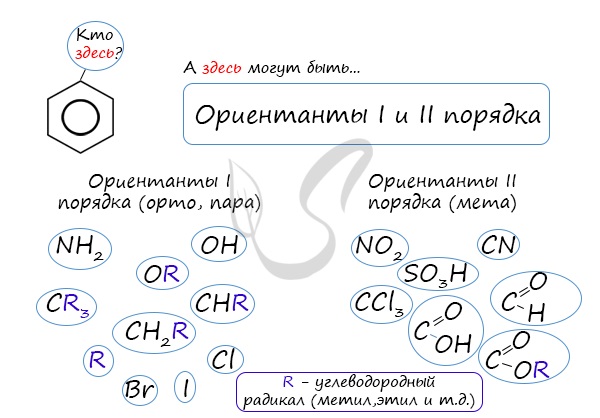
коснуться темы ориентантов I (орто-, пара-ориентантов) и II порядков (мета-ориентанты).
К ориентантам первого порядка относятся группы: NH2, OH, OR, CR3, CHR2,
CH2R, галогены. К ориентантам второго: NO2, CN, SO3H, CCl3,
CHO, COOH, COOR.
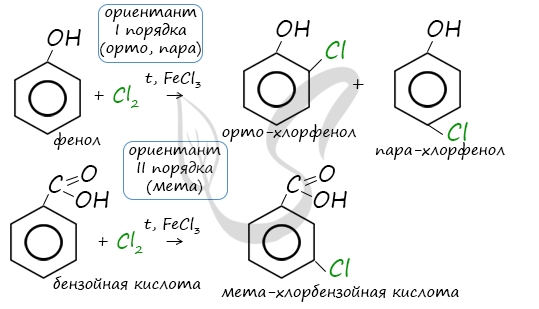
Например, ориентант I порядка, гидроксогруппа OH, обеспечивает протекание хлорирования в орто- и пара-положениях.
А карбоксильная группа COOH, ориентант II порядка, обуславливает хлорирование в мета-положениях.
Арены вступают в реакции нитрования, протекающие при повышенной температуре и в присутствии серной кислоты,
обладающей водоотнимающими свойствами.
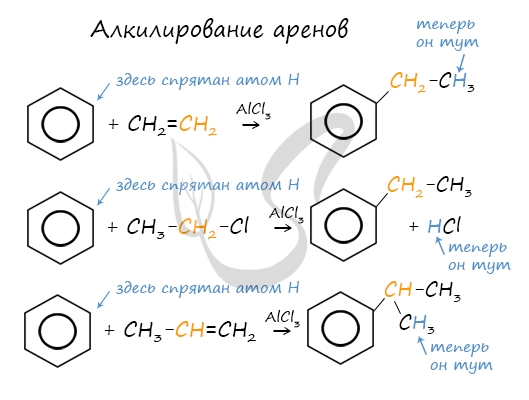
Алкилирование аренов осуществляется путем введения алкильного радикала в молекулу бензола. Алкильным радикалом чаще
всего выступает алкен или галогеналкан. В подобных реакциях используют катализатор AlCl3.
В случае если для алкилирования используется алкен, то с молекулой бензола соединяется наименее гидрированный атом
углерода алкена, прилежащий к двойной связи. Один атом водорода переходит из бензольного кольца к радикалу.
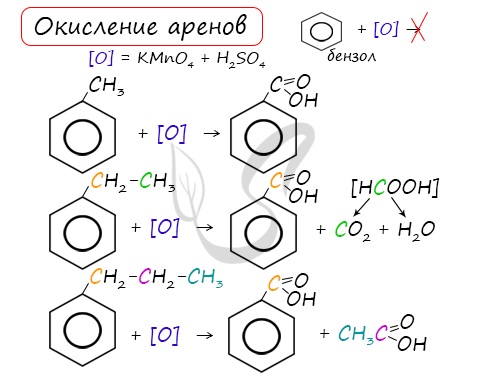
Арены, как и все органические вещества, сгорают с образованием углекислого газа и воды.
2C6H6 + 15O2 → 12CO2 + 6H2O
При неполном окислении гомологи бензола способны окисляться до бензойной кислоты (при подкислении раствора серной
кислотой). Сам бензол не вступает в реакцию окисления с KMnO4, не обесцвечивает его раствор.
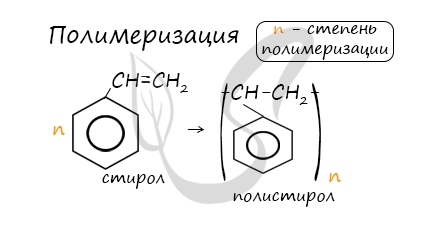
В реакцию полимеризации способен вступать стирол (винилбензол), в радикале которого содержится двойная связь.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Арены (ароматические углеводороды) – это непредельные (ненасыщенные) циклические углеводороды, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с замкнутой системой сопряженных связей.
Общая формула: CnH2n–6 при n ≥ 6.
Строение, номенклатура и изомерия ароматических углеводородов
Способы получения ароматических углеводородов
Химические свойства ароматических углеводородов
Строение аренов
Рассмотрим подробно строение молекулы бензола. В ней присутствуют три двойные связи С=С, три одинарные связи С–C и шесть одинарных связей С–Н.
Структурная формула бензола:
Сокращенная структурная формула бензола:
Каждый из шести атомов углерода в молекуле бензола находится в состоянии sp2-гибридизации.
Каждый атом углерода в молекуле бензола связан с двумя соседними атомами углерода и атомом водорода тремя σ-связями. Валентные углы равны 1200:
Атомы углерода и водорода в молекуле бензола, соединенные σ-связями, образуют правильный шестиугольник, в котором все атомы углерода и все σ-связи С–С и С–Н лежат в одной плоскости.
Негибридные р-орбитали атомов углерода образуют единую циклическую (ароматическую) π-систему – единое электронное облако над и под плоскостью кольца.
Соответственно, на самом деле все связи между атомами углерода в молекуле бензола одинаковой длины (0,140 нм), что соответствует промежуточному значению между одинарной и двойной (полуторная связь).
Соответственно, в молекуле бензола между углеродными атомами нет обычных одинарных и двойных связей, а все они выравнены (делокализованы).
Поэтому структурную формулу бензола изображают в виде правильного шестиугольника и кружка внутри него, который обозначает делокализованные π-связи:
Гомологический ряд аренов
Простейший представитель гомологического ряда аренов — бензол:
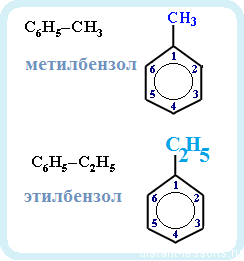
Ближайший гомолог бензола – толуол (метилбензол):
Еще один представитель гомологического ряда бензола – этилбензол:
Изопропилбензол (кумол):
Номенклатура аренов
Первый представитель гомологического ряда аренов — бензол:
Ближайший гомолог бензола – толуол (метилбензол):
При составлении названия ароматического соединения за главную цепь принимают молекулу бензола. Если в ароматическом кольце несколько заместителей, то атомы углерода бензольного кольца нумеруются: в направлении, где больше заместителей, от самого главного заместителя (чем больше атомов углерода в радикале, тем он старше).
Например, 1,2-диметилбензол
Если в молекуле бензола присутствуют два заместителя, то также используют систему специальных приставок:
- орто— (о-) если заместители расположены у соседних атомов углерода в бензольном кольце (1,2-положения);
- мета— (м-) заместители расположены через один атом углерода (1,3-положения);
- пара— (п-) заместители расположены на противоположных сторонах кольца (1,4-положения).
Для названия многих производных бензола используют тривиальные названия:
| Структурная формула | Системное название | Тривиальное название |
 |
Метилбензол | Толуол |
 |
1,2-Диметилбензол | орто-Ксилол |
 |
Изопропилбензол | Кумол |
Названия радикалов, содержащих ароматическое кольцо:
Изомерия аренов
Структурная изомерия
Для гомологов бензола характерна структурная изомерия .
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
- Изомерия углеродного скелета в боковой цепи характерна для ароматических углеводородов, которые содержат три и более атомов углерода в боковой цепи.
Формуле С9Н12 соответствуют изомеры изопропилбензол и пропилбензол
- Изомерия положения заместителей характерна для аренов, которые содержат два и более заместителей в бензольном кольце.
Формуле С8Н10 соответствуют изомеры 1,3-диметилбензол, 1,2-диметилбензол и др.
Химические свойства аренов
Арены – непредельные углеводороды, молекулы которых содержат три двойных связи и цикл. Но из-за эффекта сопряжения свойства аренов отличаются от свойств других непредельных углеводородов.
Для ароматических углеводородов характерны реакции:
- присоединения,
- замещения,
- окисления (для гомологов бензола).
Из-за наличия сопряженной π-электронной системы молекулы ароматических углеводородов вступают в реакции присоединения очень тяжело, только в жестких условиях — на свету или при сильном нагревании, как правило, по радикальному механизму
Бензольное кольцо представляет из себя скопление π-электронов, которое притягивает электрофилы. Поэтому для ароматических углеводородов характерны реакции электрофильного замещения атома водорода у бензольного кольца.
Ароматическая система бензола устойчива к действию окислителей. Однако гомологи бензола окисляются под действием перманганата калия и других окислителей.
1. Реакции присоединения
Бензол присоединяет хлор на свету и водород при нагревании в присутствии катализатора.
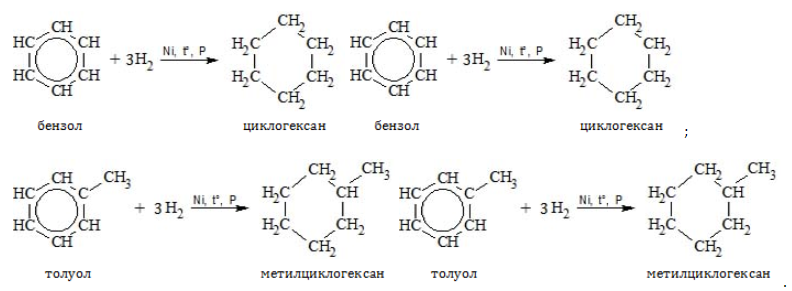
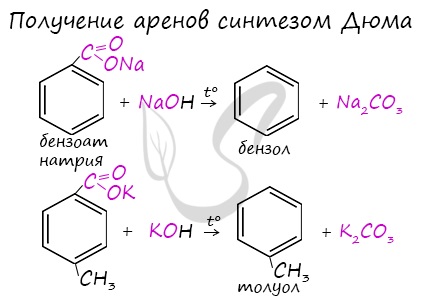
1.1. Гидрирование
Бензол присоединяет водород при нагревании и под давлением в присутствии металлических катализаторов (Ni, Pt и др.).
При гидрировании бензола образуется циклогексан:
При гидрировании гомологов образуются производные циклоалканы. При нагревании толуола с водородом под давлением и в присутствии катализатора образуется метилциклогексан:
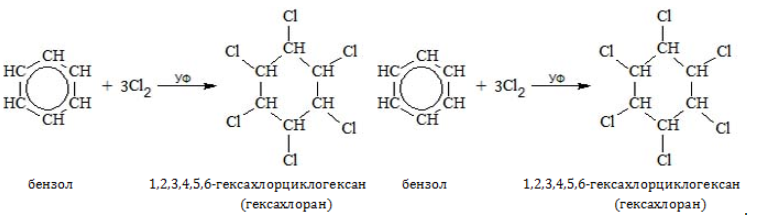
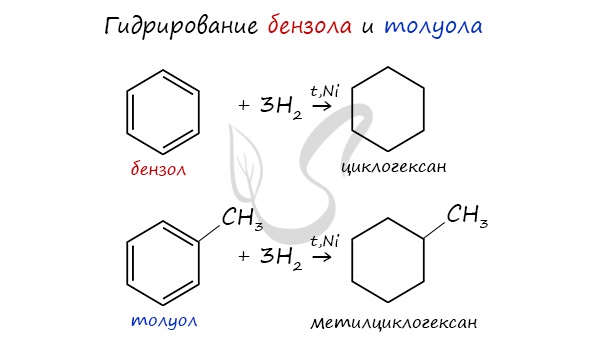
1.2. Хлорирование аренов
Присоединение хлора к бензолу протекает по радикальному механизму при высокой температуре, под действием ультрафиолетового излучения.
При хлорировании бензола на свету образуется 1,2,3,4,5,6-гексахлорциклогексан (гексахлоран).
Гексахлоран – пестицид, использовался для борьбы с вредными насекомыми. В настоящее время использование гексахлорана запрещено.
Гомологи бензола не присоединяют хлор. Если гомолог бензола реагирует с хлором или бромом на свету или при высокой температуре (300°C), то происходит замещение атомов водорода в боковом алкильном заместителе, а не в ароматическом кольце.
Например, при хлорировании толуола на свету образуется бензилхлорид
Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»).
Например, этилбензол реагирует с хлором на свету
2. Реакции замещения
Реакции замещения у ароматических углеводородов протекают по ионному механизму (электрофильное замещение). При этом атом водорода замещается на другую группу (галоген, нитро, алкил и др.).
2.1. Галогенирование
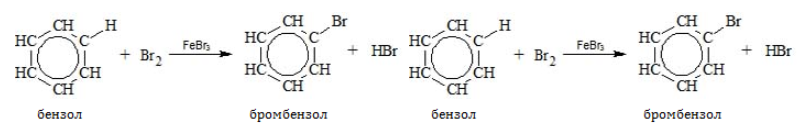
Бензол и его гомологи вступают в реакции замещения с галогенами (хлор, бром) в присутствии катализаторов (AlCl3, FeBr3).
При взаимодействии с хлором на катализаторе AlCl3 образуется хлорбензол:
Ароматические углеводороды взаимодействуют с бромом при нагревании и в присутствии катализатора – FeBr3 . Также в качестве катализатора можно использовать металлическое железо.
Бром реагирует с железом с образованием бромида железа (III), который катализирует процесс бромирования бензола:
На нём возникает избыток электронной плотности, который далее передается на бензольное кольцо.
Поэтому гомологи бензола легче вступают в реакции замещения в бензольном кольце. При этом гомологи бензола вступают в реакции замещения преимущественно в орто— и пара-положения
Например, при взаимодействии толуола с хлором образуется смесь продуктов, которая преимущественно состоит из орто-хлортолуола и пара-хлортолуола
Мета-хлортолуол образуется в незначительном количестве.
При взаимодействии гомологов бензола с галогенами на свету или при высокой температуре (300оС) происходит замещение водорода не в бензольном кольце, а в боковом углеводородном радикале.
Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»).
Например, при хлорировании этилбензола:
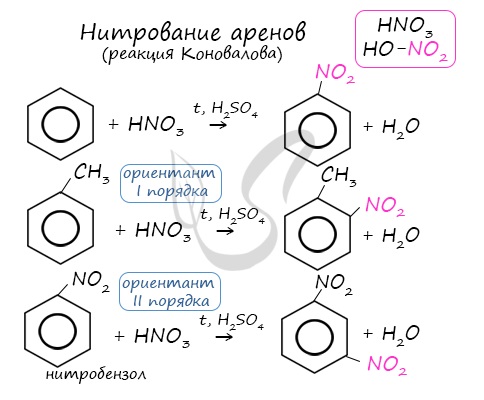
2.2. Нитрование
Бензол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты (нитрующая смесь).
При этом образуется нитробензол:
Серная кислота способствует образованию электрофила NO2+:
Толуол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты.
В продуктах реакции мы указываем либо о-нитротолуол:
либо п-нитротолуол:
Нитрование толуола может протекать и с замещением трех атомов водорода. При этом образуется 2,4,6-тринитротолуол (тротил, тол):
2.3. Алкилирование ароматических углеводородов
- Арены взаимодействуют с галогеналканами в присутствии катализаторов (AlCl3, FeBr3 и др.) с образованием гомологов бензола.
Например, бензол реагирует с хлорэтаном с образованием этилбензола
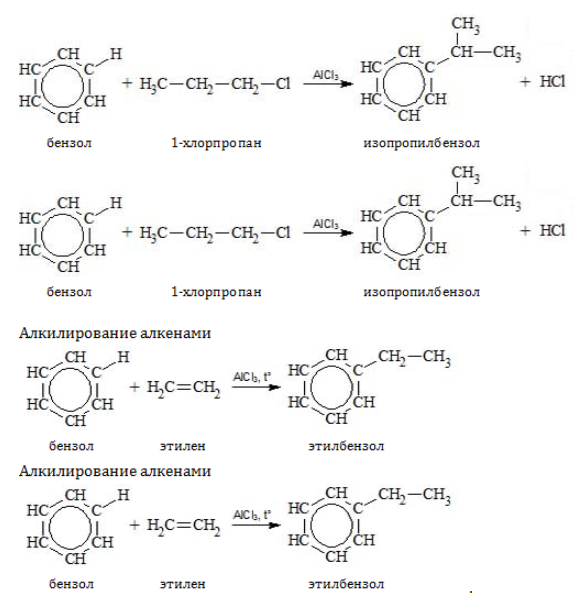
- Ароматические углеводороды взаимодействуют с алкенами в присутствии хлорида алюминия, бромида железа (III), фосфорной кислоты и др.
Например, бензол реагирует с этиленом с образованием этилбензола
Например, бензол реагирует с пропиленом с образованием изопропилбензола (кумола)
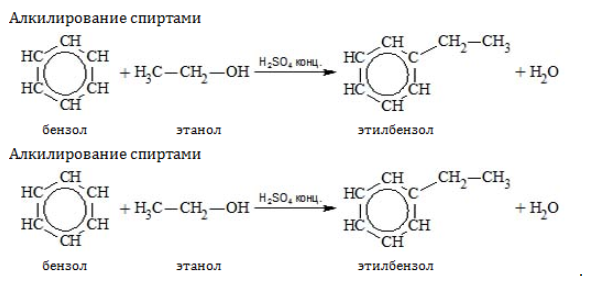
- Алкилирование спиртами протекает в присутствии концентрированной серной кислоты.
Например, бензол реагирует с этанолом с образованием этилбензола и воды
2.4. Сульфирование ароматических углеводородов
Бензол реагирует при нагревании с концентрированной серной кислотой или раствором SO3 в серной кислоте (олеум) с образованием бензолсульфокислоты:
3. Окисление аренов
Бензол устойчив к действию даже сильных окислителей. Но гомологи бензола окисляются под действием сильных окислителей. Бензол и его гомологи горят.
3.1. Полное окисление – горение
При горении бензола и его гомологов образуются углекислый газ и вода. Реакция горения аренов сопровождается выделением большого количества теплоты.
2C6H6 + 15O2 → 12CO2 + 6H2O + Q
Уравнение сгорания аренов в общем виде:
CnH2n–6 + (3n – 3)/2 O2 → nCO2 + (n – 3)H2O + Q
При горении ароматических углеводородов в недостатке кислорода может образоваться угарный газ СО или сажа С.
Бензол и его гомологи горят на воздухе коптящим пламенем. Бензол и его гомологи образуют с воздухом и кислородом взрывоопасные смеси.
3.2. Окисление гомологов бензола
Гомологи бензола легко окисляются перманганатом и дихроматом калия в кислой или нейтральной среде при нагревании.
При этом происходит окисление всех связей у атома углерода, соседнего с бензольным кольцом, кроме связи этого атома углерода с бензольным кольцом.
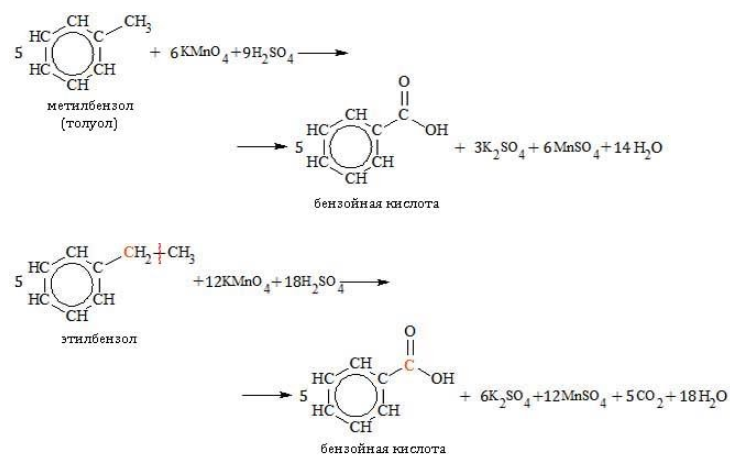
Толуол окисляется перманганатом калия в серной кислоте с образованием бензойной кислоты:
Если окисление толуола идёт в нейтральном растворе при нагревании, то образуется соль бензойной кислоты – бензоат калия:
Таким образом, толуол обесцвечивает подкисленный раствор перманганата калия при нагревании.
При окислении других гомологов бензола всегда остаётся только один атом С в виде карбоксильной группы (одной или нескольких, если заместителей несколько), а все остальные атомы углерода радикала окисляются до углекислого газа или карбоновой кислоты.
Например, при окислении этилбензола перманганатом калия в серной кислоте образуются бензойная кислота и углекислый газ
Например, при окислении этилбензола перманганатом калия в нейтральной кислоте образуются соль бензойной кислоты и карбонат
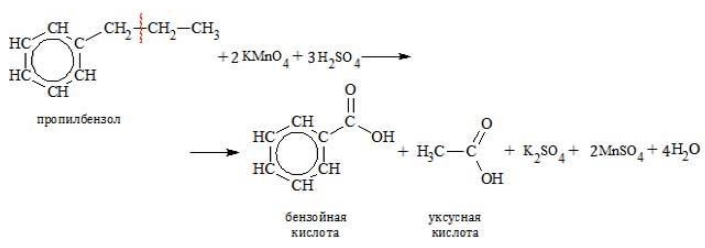
Более длинные радикалы окисляются до бензойной кислоты и карбоновой кислоты:
При окислении пропилбензола образуются бензойная и уксусная кислоты:
Изопропилбензол окисляется перманганатом калия в кислой среде до бензойной кислоты и углекислого газа:
4. Ориентирующее действие заместителей в бензольном кольце
Если в бензольном кольце имеются заместители, не только алкильные, но и содержащие другие атомы (гидроксил, аминогруппа, нитрогруппа и т.п.), то реакции замещения атомов водорода в ароматической системе протекают строго определенным образом, в соответствии с характером влияния заместителя на ароматическую π-систему.
Заместители подразделяют на две группы в зависимости от их влияния на электронную плотность ароматической системы: электронодонорные (первого рода) и электроноакцепторные (второго рода).
Типы заместителей в бензольном кольце
| Заместители первого рода | Заместители второго рода |
| Дальнейшее замещение происходит преимущественно в орто— и пара-положение | Дальнейшее замещение происходит преимущественно в мета-положение |
| Электронодонорные, повышают электронную плотность в бензольном кольце | Электроноакцепторные, снижают электронную плотность в сопряженной системе. |
|
|
Например, толуол реагирует с хлором в присутствии катализатора с образованием смеси продуктов, в которой преимущественно содержатся орто-хлортолуол и пара-хлортолуол. Метильный радикал — заместитель первого рода.
В уравнении реакции в качестве продукта записывается либо орто-хлортолуол, либо пара-хлортолуол.
Например, при бромировании нитробензола в присутствии катализатора преимущественно образуется мета-бромнитробензол. Нитро-группа — заместитель второго рода
5. Особенности свойств стирола
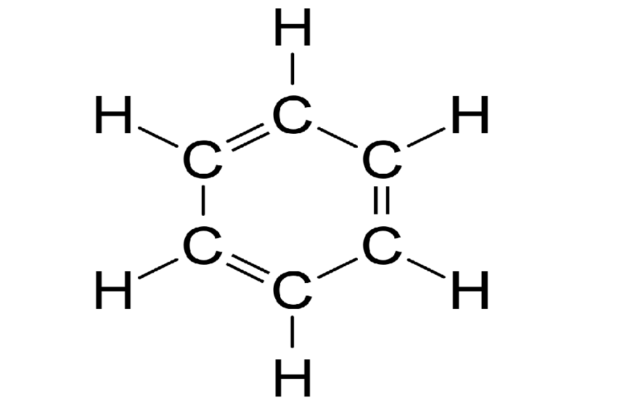
Стирол (винилбензол, фенилэтилен) – это производное бензола, которое имеет в своем составе двойную связь в боковом заместителе.
Общая формула гомологического ряда стирола: CnH2n-8.
Молекула стирола содержит заместитель с кратной связью у бензольного кольца, поэтому стирол проявляет все свойства, характерные для алкенов – вступает в реакции присоединения, окисления, полимеризации.
Стирол присоединяет водород, кислород, галогены, галогеноводороды и воду в соответствии с правилом Марковникова.
Например, при гидратации стирола образуется спирт:
Стирол присоединяет бром при обычных условиях, то есть обесцвечивает бромную воду
При полимеризации стирола образуется полистирол:
Как и алкены, стирол окисляется водным раствором перманганата калия при обычных условиях. Обесцвечивание водного раствора перманганата калия — качественная реакция на стирол:
При жестком окислении стирола перманганатом калия в кислой среде (серная кислота) разрывается двойная связь и образуется бензойная кислота и углекислый газ:
При окислении стирола перманганатом калия в нейтральной среде при нагревании также разрывается двойная связь и образуется соль бензойной кислоты и карбонат:
Получение аренов
1. Реакция Вюрца-Фиттига
Хлорбензол реагирует с хлорметаном и натрием. При этом образуется смесь продуктов, одним из которых является толуол:
2. Дегидроциклизация алканов
Алканы с углеродной цепью, содержащей 6 и более атомов углерода в главной цепи, при дегидрировании образуют устойчивые шестиатомные циклы, т. е. циклогексан и его гомологи, которые далее превращаются в ароматические углеводороды.
Гексан при нагревании в присутствии оксида хрома (III) в зависимости от условий может образовать циклогексан и потом бензол:
Гептан при дегидрировании в присутствии катализатора образует метилциклогексан и далее толуол:
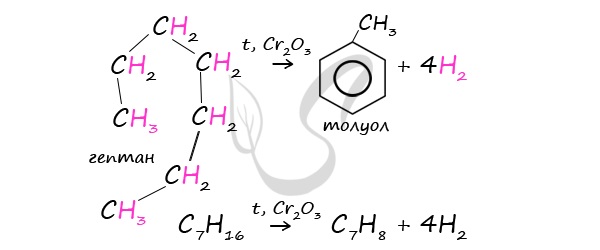
3. Дегидрирование циклоалканов
При дегидрировании циклогексана и его гомологов при нагревании в присутствии катализатора образуется бензол или соответствующие гомологи бензола.
Например, при нагревании циклогексана в присутствии палладия образуется бензол и водород
Например, при нагревании метилциклогексана в присутствии палладия образуется толуол и водород
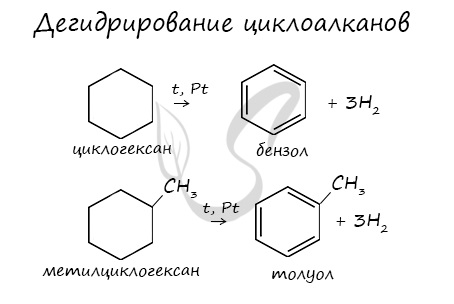
4. Декарбоксилирование солей бензойной кислоты
Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении.
R–COONa + NaOH → R–H + Na2CO3
Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты.
Взаимодействие бензоата натрия с гидроксидом натрия в расплаве протекает аналогично реакции получения алканов по реакции Дюма с образованием бензола и карбоната натрия:
5. Алкилирование бензола и его гомологов
- Арены взаимодействуют с галогеналканами в присутствии катализаторов (AlCl3, FeBr3 и др.) с образованием гомологов бензола.
Например, бензол реагирует с хлорэтаном с образованием этилбензола
- Ароматические углеводороды взаимодействуют с алкенами в присутствии хлорида алюминия, бромида железа (III), фосфорной кислоты и др.
Например, бензол реагирует с этиленом с образованием этилбензола
Например, бензол реагирует с пропиленом с образованием изопропилбензола (кумола)
- Алкилирование спиртами протекает в присутствии концентрированной серной кислоты.
Например, бензол реагирует с этанолом с образованием этилбензола и воды
6. Тримеризация ацетилена
При нагревании ацетилена под давлением над активированным углем молекулы ацетилена соединяются, образуя бензол.
При тримеризации пропина образуется 1,3,5-триметилбензол.
7. Получение стирола
Стирол можно получить дегидрированием этилбензола:
Стирол можно также получить действием спиртового раствора щелочи на продукт галогенирования этилбензола (1-хлор-1-фенилэтан):
Гомологи бензола

3.9
Средняя оценка: 3.9
Всего получено оценок: 415.
3.9
Средняя оценка: 3.9
Всего получено оценок: 415.
Простейший представитель класса аренов или ароматических углеводородов – бензол – состоит из шести атомов углерода и шести атомов водорода. Вещества, отличающиеся от бензола предельными углеводородными радикалами, называются гомологами бензола.
Ряд бензола
Формула бензола – С6Н6. Это бесцветная жидкость со сладковатым запахом. Бензол входит в состав бензина и используется для изготовления лекарств, пластмасс, искусственного каучука, красителей. Является токсичным веществом.
Основа молекулы бензола – бензольное кольцо, которое образуют шесть атомов углерода, соединённых σ-связями. К каждому атому углерода присоединён посредством простой связи водород. Прочную связь между атомами углерода обозначают кругом внутри шестиугольника.
Гомологи отличаются друг от друга одной группой -СН2. Общая молекулярная формула гомологов бензола – CnH2n-6. Наименования гомологов соответствуют наименованиям алканов с суффиксом «-ил» и словом «бензол». Также широко используются тривиальные названия с суффиксом «-ол».
Примеры нескольких представителей ряда бензола описаны в таблице.
|
Гомолог |
Формула |
Физические свойства |
|
Метилбензол (толуол) |
C7H8 |
Бесцветная горючая жидкость, проявляющая слабое наркотическое действие. Смешивает с углеводородами, спиртами, эфирами в неограниченном количестве, но не смешивается с водой |
|
Этилбензол |
C8H10 |
Бесцветная токсичная жидкость с запахом бензина. Растворяется в спирте, бензоле, эфире, CCl4 |
|
Пропилбензол |
C9H12 |
Бесцветная горючая жидкость с резким запахом. Хорошо смешивается с органическими растворителями, не растворим в воде |
|
Бутилбензол (дурол) |
C10H14 |
Бесцветное летучее кристаллическое вещество с запахом камфоры. Плохо растворяется в уксусной кислоте, легко растворяется в бензоле, эфире, спирте |
К бензольному кольцу могут присоединяться не только предельные углеводородные радикалы. Например, стирол или винилбензол состоит из бензольного кольца, к которому присоединён ненасыщенный углеводородный радикал -СН=СН2. Наличие бензольного кольца указывает, что стирол – ароматический углеводород. Однако из-за наличия двойной связи и несоответствия формуле CnH2n-6 стирол нельзя отнести к гомологическому ряду бензола.
Бензол впервые выделил Майкл Фарадей в 1825 году из коксового (светильного) газа, представляющего собой смесь метана, водорода и угарного газа.
Изомерия
Для веществ ряда бензола характерна изомерия углеродного скелета:
- по разветвлению углеводородного радикала – группы -СН2 присоединяются к атомам углерода цепочки;
- по положению радикалов в бензольном кольце – группы -СН2 присоединяются к разным атомам углерода в бензольном кольце.
С увеличением атомов углерода в цепочке радикала увеличивается количество возможных изомеров. Изомер пропилбензола – кумол, бутилбензола – изобутилбензол, втор-бутилбензол, трет-бутилбензол.
Для указания места положения радикалов в бензольном кольце в наименовании вещества используется одна из приставок или первая буква приставки:
- орто- (о-) – у соседних атомов;
- мета- (м-) – через один атом;
- пара- (п-) – через два атома.
Для всех аренов не характерны реакции присоединения. Возможно только замещение водорода в углеводородном радикале.
Что мы узнали?
Бензол – простейший арен, образующий гомологический ряд с общей формулой CnH2n-6. Гомологи бензола – жидкости или кристаллические вещества, плохо растворимые в воде, но хорошо растворимые в жидких органических соединениях (эфирах, спиртах, кислотах). Молекулы бензола и его гомологов состоят из бензольного кольца, образованного шестью атомами углерода. Гомологи отличаются друг от друга углеводородными радикалами, присоединёнными к одному из атомов углерода бензольного кольца. Для них характерна изомерия углеродного скелета.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Давид Магамедов
5/5
-
Рашид Лукманов
5/5
Оценка доклада
3.9
Средняя оценка: 3.9
Всего получено оценок: 415.
А какая ваша оценка?
Бензол и его гомологи
04-Дек-2012 | комментариев 6 | Лолита Окольнова
Бензол и его гомологи
Бензол — первый представитель класса аренов — ароматических углеводородов.
Почему «ароматических«? Потому что большинство гомологов бензола, да и сам бензол, имеют сладковатый запах, при этом довольно ядовиты.
Обычно бензол рисуют вот таким «скворечником» или пишут общую формулу С6H6.
Почему рисуют кружок в шестиугольнике? Это обозначение того, что все связи в молекуле одинаковые.
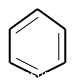
Но! Каждая связь — это не просто черточки на бумаге. Каждая связь имеет определенные физические характеристики. Например, длинна связи.
Двойная связь короче одинарной. При исследовании молекулы бензола оказалось, что:
- все связи одинаковы, т.е. нет разделения на двойные и одинарные;
- эти связи представляют собой промежуточный вариант между двойной и одинарной
Поэтому рисуют кружок — обозначение одинаковых связей по всей молекуле.
Если рассмотреть строение молекулы более детально, с точки зрения электронной плотности, то картина будет примерно следующая — образуется общее ∏-электронное облако и оно распространено (=делокализовано) по всей молекуле:
Общая формула аренов:
Гомологический ряд : С6H6, C7H8, C8H10 и т.д.
Номенклатура гомологов бензола:
Название углеводорода складывается из двух частей:
(количество и указание места прикрепления) и название радикала + «бензол»
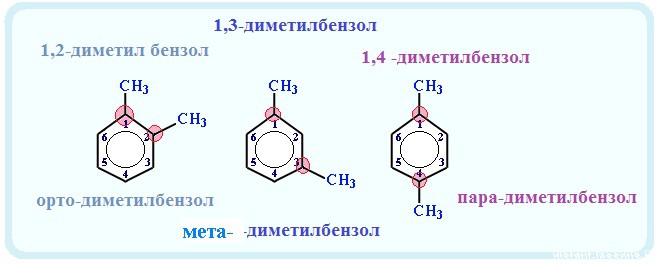
Если в молекуле арена есть несколько одинаковых радикала, то применяются приставки: орто-, мета— и пара-
- орто- (о-) — два радикала находятся рядом — при соседних атомах углерода (1,2-ди «радикал» бензол);
- мета- (м-) — два радикала находятся через один атом углерода (1,3 — ди «радикал» бензол)
- пара- (п-) — два радикала находятся друг против друга — через 2 атома углерода (1,4- ди «радикал» бензол)
Все эти вещества изомерны друг другу. У бензола и его гомологов довольно много изомеров — это обусловлено как количеством атомов, так и геометрией молекулы.
Названия радикалов:
С6H5 — фенил-
С6H5CH2- бензил-
Тривиальные названия:
- толуол = метилбензол (С6H5CH3);
- ксилол = все диметилбензолы ( C6H4(CH3)2 );
- кумол = изопропилбензол (C6H5-CH(CH3)2 )
Дальше мы рассмотрим:
- Химические свойства бензола и его гомологов
- Получение
- в ЕГЭ это вопрос А13 и А14 — Строение и свойства углеводородов
- в ГИА (ОГЭ) это B2 — Первоначальные сведения об органических веществах: предельных и непредельных углеводородах
Категории:
|
Обсуждение: «Бензол и его гомологи»
(Правила комментирования)