Газовая постоянная, справочная таблица
| Азот газовая постоянная азота |
297 (Джоуль / (Килограмм · Кельвин)) |
| Аммиак газовая постоянная аммиака |
488 (Джоуль / (Килограмм · Кельвин)) |
| Аргон газовая постоянная аргона |
208 (Джоуль / (Килограмм · Кельвин)) |
| Ацетилен газовая постоянная ацетилена |
320 (Джоуль / (Килограмм · Кельвин)) |
| Бутан газовая постоянная бутана |
143 (Джоуль / (Килограмм · Кельвин)) |
| Водород газовая постоянная водорода |
4125 (Джоуль / (Килограмм · Кельвин)) |
| Водяной пар (100°C) газовая постоянная водяного пара |
461 (Джоуль / (Килограмм · Кельвин)) |
| Воздух газовая постоянная воздуха |
287 (Джоуль / (Килограмм · Кельвин)) |
| Гелий газовая постоянная гелия |
2078 (Джоуль / (Килограмм · Кельвин)) |
| Двуокись углерода газовая постоянная углекислого газа |
189 (Джоуль / (Килограмм · Кельвин)) |
| Кислород газовая постоянная кислорода |
260 (Джоуль / (Килограмм · Кельвин)) |
| Метан газовая постоянная метана |
519 (Джоуль / (Килограмм · Кельвин)) |
| Неон газовая постоянная неона |
412 (Джоуль / (Килограмм · Кельвин)) |
| Окись углерода газовая постоянная угарного газа |
297 (Джоуль / (Килограмм · Кельвин)) |
| Пропан газовая постоянная пропана |
189 (Джоуль / (Килограмм · Кельвин)) |
| Пропилен газовая постоянная пропилена |
198 (Джоуль / (Килограмм · Кельвин)) |
| Фреон газовая постоянная фреона |
68.7 (Джоуль / (Килограмм · Кельвин)) |
| Этан газовая постоянная этана |
277 (Джоуль / (Килограмм · Кельвин)) |
| Этилен газовая постоянная этилена |
297 (Джоуль / (Килограмм · Кельвин)) |
Газовая постоянная — справочная таблица |
стр. 862 |
|---|

α = 2731 К−1
Закон Гей-Люссака Жоржа
Открыт в 1802 году pi = po (1 +αt)
α = 2731 К−1
Закон Клапейрона Бенуа Поля Эмиля
(1799-1864)
Открыт в 1834 году
|
pV = BT , где |
B = m , |
|
|
μ |
||
|
m − |
масса |
газа; |
μ −молекулярная
масса
Закон Менделеева Дмитрия Ивановича
(1834-1907)
Открыт в 1874 году pv = RT .
Рис.4. Развитие уравнения состояния идеального газа
|
Решение. |
Дж |
Дж |
|||||||||||||||||
|
R |
= 8314 |
= 8314 =189 |
; R |
Н |
= 8314 |
= 8314 |
= 4157 |
; |
|||||||||||
|
CO |
μ |
44 |
кг К |
2 |
μ |
2 |
кг К |
||||||||||||
|
2 |
CO2 |
Н2 |
|||||||||||||||||
|
Дж |
|||||||||||||||||||
|
R |
= |
8314 |
= 8314 |
=520 |
|||||||||||||||
|
кг К |
|||||||||||||||||||
|
CН4 |
μ |
CН4 |
16 |
||||||||||||||||
Задача. Определить газовую постоянную смеси газов, состоящую из 78 % азота и 22 % кислорода.
Решение.
34

На основании уравнения Клапейрона для i-го компонента идеальногазовой смеси, занимающей объём Vсм можно написать:
Записав эти уравнения для всех компонентов смеси и просуммировав их левые и правые части, получим:
|
n |
||||||||||||||||
|
В |
соответствии |
с |
законом |
Дальтона |
∑ pi = рсм |
получаем: |
||||||||||
|
i=1 |
||||||||||||||||
|
pсмVсм = mсмRсс Tсм, где Rсм −газовая постоянная смеси. |
||||||||||||||||
|
Таким |
образом |
можно |
получить |
соотношение: |
||||||||||||
|
n |
||||||||||||||||
|
∑mi Ri |
n |
n |
ci |
=8314 (0.78 |
+ 0.22) = 288.76 |
Дж |
||||||||||
|
R |
= |
i=1 |
= |
∑c R |
=8314 ∑ |
|||||||||||
|
m |
кг К |
|||||||||||||||
|
см |
i i |
i=1 |
μ |
i |
28 |
32 |
||||||||||
|
см |
i=1 |
Уравнение состояния идеального газа написанное выше представляется в интегральной форме. Если продифференцировать уравнение состояния
|
то получим pdv + vdp = RdT , которое |
представляет |
собой процесс, |
|
показанный на рис.5 (на экране). Здесь произведение |
dlv = pdv назвают |
|
|
ДЕФОРМАЦИОННОЙ РАБОТОЙ, а |
произведение dl p = vdp — |
ТЕХНИЧЕСКОЙ РАБОТОЙ.
В первом случае работа связана с изменением объёма (например, в цилиндре поршневого двигателя), а во втором случае – с изменением давления (например, в компрессоре или турбине газотурбинного двигателя).
Уравнение состояния для реального газа было составлено
Ван-дер-Ваальсом Йоханнес Дидериком (1837-1923), нидерландским физиком (Лауреатом Нобелевской премии в 1910 г.) в 1873 году, которое учитывает размеры молекул и межмолекулярные силы притяжения; для одного моля представляется так:
( р + а )(v −b) = RT , . где b −учитывает конечность объёма молекул; v2
a −учитывает межмолекулярное давление.
35
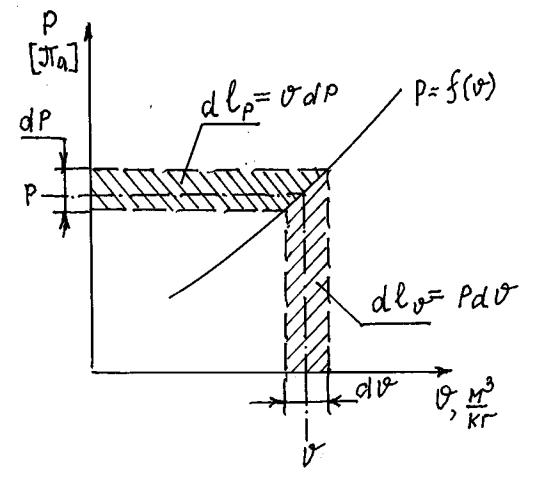
Рис.5. Уравнение состояния идеального газа в дифференциальной форме
Примеры
36

билетов к зачету по дисциплине «Термодинамика и теплопередача» для студентов 3 курса Механического факультета по спец. 160901
Московский государственный технический Университет гражданской авиации
Кафедра «Двигатели летательных аппаратов»
Зав.кафедрой
____________Никонов В.В. «___»_______2007 г.
Учебная дисциплина «Термодинамика и теплопередача»
Билет № 1
1.Поясните содержание понятий «Рабочее тело тепловых машин» и внешняя среда».
Задача. Определить газовую постоянную для следующих газов: СО 2, Н2, СН4.
2.Изобразите и поясните цикл С.Карно в p,v и T , S координатах. Укажите на
графиках площади фигур, соответствующих: работе сжатия и расширения в цикле: количество теплоты, подведенное и отведенное от рабочего тела в цикле. Задача. Определить термический КПД цикла С.Карно, если известны:
Т1 = 288К, Т2 =1500К.
3. Напишите и поясните уравнение неразрывности.
Задача. Как изменитеся расход воздуха через двигатель, если на вход его поступают: — посторонние предметы; — горячие газы от других двигателей.
Московский государственный технический Университет гражданской авиации
Кафедра «Двигатели летательных аппаратов»
Зав.кафедрой
____________Никонов В.В.. «___»_______2007 г.
Учебная дисциплина «Термодинамика и теплопередача»
Билет № 2
1.Поясните содержание понятия «Параметры состояния рабочего тела». Укажите, какие параметры состояния измеряются в эксплуатации авиационных двигателей термометрами сопротивления, термопарами и трубками Пито.
Задача. Определить газовую постоянную смеси газов, состоящую из 78 % азота
и
22% кислорода.
2.Приведите и поясните алгоритм расчета параметров состояния в контрольных точках цикла С.Карно.
Задача. Определить удельную работу сжатия Lv в адиабатном процессе, если известны параметры состояния в начале процесса (T1, p1,v1) и в конце процесса
(T2, p2,v2 ).
3. Напищите и поясните уравнение сохранения энергии в общем виде с учетом трения.
Задача. Определить число Маха воздушного судна в полете со скоростью 2000 км/ч, на высоте 18 км (Тн = 295К ).
МОСКОВСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ
37
УНИВЕРСИТЕТ ГРАЖДАНСКОЙ АВИАЦИИ
Кафедра «Двигатели летательных аппаратов»
В.Т. Шулекин, В.В. Медведев, Н.Д. Тихонов, В.В. Дворниченко
ЛАБОРАТОРНЫЙ ПРАКТИКУМ
по дисциплине
«ТЕРМОДИНАМИКА И ТЕПЛОПЕРЕДАЧА»
для студентов специальности 160901 дневной и заочной форм обучения
Москва – 2007
38
Настоящий лабораторный практикум издается в соответствии с учебным планом для студентов специальности 160901 всех форм обучения. Практикум содержит описание семи лабораторных работ по дисциплине «Термодинамика и теплопередача».
Рассмотрено и одобрено на заседаниях кафедры от 27.03.2007г. , протокол № 6 и методического совета специальности от 27.03.2007 г.
Рецензент, профессор, д.т.н. Коняев Е.А.
39
|
Содержание |
Стр. |
||
|
Введение………… |
…………………………… |
4 |
|
|
1. |
Определение теплоемкости воздуха…………………… |
6 |
|
|
2. |
Исследование газовых процессов в элементах ТРД..… |
14 |
|
|
3. |
Исследование циклов тепловых двигателей………..…. |
20 |
|
|
4. |
Новые циклы авиадвигателей |
. . . . . . . . . . . . . . . . . . . . . |
31 |
|
5. |
Исследование сопла трения и подогрева…………….… |
40 |
|
|
6. |
Определение коэффициента тепловодности |
||
|
латунного стержня…………………………………….… |
48 |
||
|
7. |
Определение коэффициента теплоотдачи в условиях |
||
|
естественной конвекции………………………………… |
55 |
||
|
Список использованных источников . . . . . . . . . . . . . . . . . . . |
63 |
40
4
Введение
Учебная дисциплина «Термодинамика и теплопередача» является общей профессиональной дисциплиной учебного плана подготовки студентов по специальности 160901 «Техническая эксплуатация летательных аппаратов и двигателей».
Настоящий лабораторный практикум имеет целью привить студентам практические навыки и умения по экспериментальному и расчетному исследованию типовых задач термодинамики и теплопередачи.
Авиационный газотурбинный двигатель (ГТД) является тепловой машиной, в которой подводимое за счет химических реакций окисления топлива выделяемое количество теплоты преобразуется в полезную работу либо в виде приращения кинетической энергии струи рабочего тела (воздуха), проходящего через двигатель, либо в виде избыточного крутящего момента, который с помощью вала передается на воздушный винт.
Основными элементами ГТД являются входное устройство,
компрессор, камера сгорания, турбина и выходное устройство. Сумму механической работы, отводимой от двигателя, и кинетической энергии на его выходе называют свободной или полезной работой ГТД.
Предметом технической термодинамики является изучение процессов, происходящих в ГТД как тепловой машине, определение условий, при которых эффективность этой машины является максимальной, исследование основных закономерностей преобразования теплоты в работу.
Предметом теплопередачи является изучение процессов теплообмена, которые играют определяющую роль в теплотехнике при создании конкретных элементов ГТД (турбинных лопаток, корпусов, дисков, теплоизоляционных покрытий и т.д.). К основным видам теплообмена относятся теплопроводность, конвекция и тепловое излучение.
Теплопроводностью называют молекулярный перенос теплоты в сплошной среде. Этот процесс возникает при неравномерном распределении температур в среде. В этом случае теплота передается путем непосредственного соприкосновения частиц, имеющих различную скорость, что приводит к обмену энергией между молекулами, атомами или свободными электронами.
Конвекцией называют движение теплоносителя (жидкости или газа) и перенос теплоты при этом в пространстве. Теплообмен между жидкостью или газом с поверхностью твердого тела называют конвективным теплообменом. Процесс теплообмена между двумя
теплоносителями, разделенными твердой стенкой, называют
теплопередачей.
41
5
Конвективный теплообмен — весьма сложное явление, которое описывается системой дифференциальных уравнений, состоящей в общем случае из уравнений теплообмена, энергии, движения, неразрывности, диффузии и состояния. Дифференциальные уравнения отражают лишь самые общие черты явления, в них отсутствуют индивидуальные признаки конкретного единичного случая. Выделение конкретного случая из общего класса явлений конвективного теплообмена осуществляется дополнением системы уравнений условиями однозначности.
Ввиду чрезвычайной сложности системы дифференциальных уравнений конвективного теплообмена и условий однозначности, содержащих большое количество переменных, аналитическое решение ее не может быть получено в общем случае. Эти уравнения могут быть решены в отдельных случаях при существенных упрощающих предположениях.
Теория подобия устанавливает условия подобия физических явлений и на этой основе дает возможность существенно сократить число переменных. Она также дает правила рационального объединения физических величин в безразмерные комплексы — критерии, число которых существенно меньше числа величин, из которых они состоят. В результате использования этих критериев расчет конвективного теплообмена сводится к решению критериальных уравнений, и определению, в конечном итоге, коэффициента теплоотдачи α.
Тепловое излучение — процесс распространения теплоты электромагнитными волнами. Этот вид теплоты обусловлен превращением внутренней энергии вещества в энергию излучения и его поглощением веществом.
42

6
ЛР-1 ОПРЕДЕЛЕНИЕ ТЕПЛОЕМКОСТИ ВОЗДУХА (4 часа)
Цель работы: 1. Экспериментальное определение средней массовой теплоемкости воздуха при постоянном давлении срт.
2.Ознакомление с методикой измерений и обработки опытных данных.
Задание на работу
1.В рабочей тетради изобразить схему лабораторной установки для определения теплоемкости воздуха и указать ее основные элементы.
2.Ознакомиться с принципом действия установки. Подготовить установку для проведения эксперимента.
3.Ознакомиться с основными сведениями и с методикой обработки опытных данных.
4.Произвести измерения:
— температуры to и давления po наружного воздуха в лаборатории;
—температуры воздуха на выходе из термостата t1;
—напряжения uв и силы тока Iв в цепи нагревателя;
—перепада давлений на мерной диафрагме hв.
5.Выполнить обработку экспериментальных данных.
6.Оформить отчет по лабораторной работе.
Основные сведения
Отношение количества теплоты δQ , полученного рабочим телом при
бесконечно малом изменении его состояния, к связанному с этим измене-
нием температуры dT называют теплоемкостью рабочего тела [1,2,3]:
Обозначение δQ вместо dQ показывает на их различие в зависимости
от процесса подвода теплоты. Индекс «х» используется для обозначения того или иного процесса. Например, обозначая х→ р получаем
выражение для теплоемкости в изобарном процессе ( p = const) :
При x →T получаем выражение для теплоёмкости в изотермическом процессе (T = const) cT →∞; при x → k получаем ck = 0 (теплообмен
43
7
между внешней средой и рабочим телом в адиабатном процессе
pvk = const отсутствует); при x →v получаем cv в изохорном процессе
( v = const ).
Обычно теплоемкость относят к единице количества вещества и в зависимости от выбранной единицы различают:
—удельную массовую теплоемкость ст, кгДжК ;
—удельную объемную теплоемкость cv, мДж3 К ;
—удельную мольную теплоемкость μс, мольДжК .
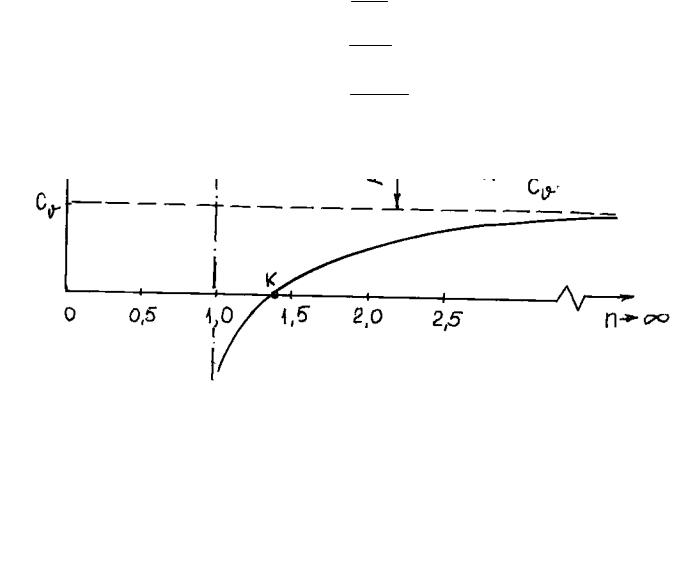
Зависимость теплоемкости от характера процесса может быть представлена графически (рис.1.1). Здесь произвольный процесс представляется политропным
Рис.1.1. Зависимость удельной массовой теплоемкости от показателя политропы п
( pvn = const ), где п – показатель политропы, может принимать значения
|
− ∞ < n < +∞. Теплоёмкость |
политропного процесса |
находится по |
||
|
формуле: |
n−k |
|||
|
c |
x |
= c |
(1.3) |
|
|
v n−1 |
44

8
Для идеального газа, молекулы которого имеют массу, бесконечно малые размеры и не взаимодействуют друг с другом (кроме столкновений), существует связь между теплоёмкостями сp и cv , полученная впервые
Юлиусом Робертом Майером (1814 – 1878) – немецким естествоиспытателем и врачом, в 1847 году:
где R — газовая постоянная идеального газа представляет собой работу совершаемую 1 кг газа в процессе постоянного давления при изменении
температуры на один градус, кгДжК . Численное значение R определяется из соотношения:
Здесь Rμ =8314 мольДжК — универсальная газовая постоянная (для всех газов); μ, молькг — масса одного моля газа. Например, для сухого воздуха
|
μ = 28.966 |
кг |
, |
R = |
8314 |
= 287 |
Дж |
, |
для |
водяного |
пара |
|||
|
моль |
28.966 |
кг К |
|||||||||||
|
Н2О μ =18 |
кг |
, R = 8314 = 462 |
Дж |
. |
|||||||||
|
моль |
|||||||||||||
|
18 |
кг К |
||||||||||||
|
Чем больше |
R , тем больше требуется работы, например, для сжатия |
||||||||||||
|
газа в компрессоре газотурбинного двигателя. |
|||||||||||||
|
В изохорном процессе |
( v = const ) |
теплота, |
сообщаемая газу, |
идёт |
|||||||||
|
только на изменение его внутренней энергии (впервые установлено в |
1843 |
году английским физиком Деймсом Прескотт Джоулем (1818 – 1889)).
Это видно из уравнения первого закона термодинамики:
|
δq |
= cvdT + pdv , |
(1.6) |
|
где pdv = 0, тогда как в |
изобарном процессе |
( p = const ) теплота |
расходуется на изменение внутренней энергии и на совершение работы против внешних сил ( pdv > 0 ). Поэтому c p больше cv на величину этой
работы.
|
В адиабатном |
процессе ( pvk = const ), |
протекающем без теплообмена |
|||
|
между рабочим |
телом и внешней |
средой ( q = 0), |
отношение |
||
|
теплоёмкостей k = |
c p |
называют показателем адиабаты. |
Для воздуха |
||
|
cv |
|||||
как идеального газа (доля кислорода в сухом воздухе составляет 20.9476 % [4], доля азота — 78.064 %), теплоёмкость которого не зависит от температуры к =1.4, для продуктов сгорания авиационного керосина k =1.33.
45

9
Величина теплоёмкостей сp и cv с учётом показателя адиабаты находится из решения системы уравнений:
c p − cv = R
k = ccpv
Отсюда
|
c |
p |
= |
kR |
; c |
= |
R |
. |
(1.7) |
||
|
k −1 |
k −1 |
|||||||||
|
v |
Для реальных газов сp − cv > R , поскольку при их расширении в
изобарном процессе совершается работа не только против внешних сил, но и против сил притяжения, действующих между молекулами, что вызывает дополнительный расход теплоты. При увеличении температуры у многоатомных молекул происходит возбуждение внутренних степеней свободы за счет возникновения колебательного движения атомов молекулы (молекула становится осциллятором). Это приводит к увеличению внутренней энергии, а следовательно, и теплоемкости с ростом температуры.
Поскольку теплоемкость реального газа зависит от температуры, в технической термодинамике различают истинную (найденную по формуле (1.1)) и среднюю теплоемкости.
Средняя теплоемкость процесса находится по формуле:
|
t2 |
t2 |
t1 |
|||||||||||
|
t2 |
q |
ccp ∫ |
−ccp ∫ t1 |
||||||||||
|
t2 |
t1 |
0 |
|||||||||||
|
ccp ∫ |
= |
или ccp ∫ = |
(1.8) |
||||||||||
|
t2 −t1 |
t2 −t1 |
||||||||||||
|
t1 |
t1 |
||||||||||||
|
В теплотехнических |
расчетах |
теплоемкости |
c p или cv находят по |
||||||||||
|
формуле: |
+ a T + a T 2 |
+ a T 3 |
|||||||||||
|
c = a |
o |
+…. |
(1.9) |
||||||||||
|
1 |
2 |
3 |
Например, для расчета теплоемкости сухого воздуха рекомендуется следующая формула:
|
c pm = 0.9952 + 0.9349 10 |
−4 |
t |
кДж |
(1.10) |
|
кг К |
||||
Описание лабораторной установки
Установка (рис.1.2) состоит из электромотора 1, частота вращения которого регулируется реостатом 2; вентилятора 3; мерной диафрагмы 4; электрического нагревателя 5, мощность которого регулируется реостатом 6; термостата 7; амперметра 8; вольтметра 9, с помощью которых
46

10
определяется мощность нагревателя на каждом режиме, термометра 10, с помощью которого измеряется температура нагретого воздуха в термостате; микроманометра 11, с помощью которого измеряется перепад статического давления на мерной диафрагме 4.
Рис.1.2. Принципиальная схема лабораторной установки для определения теплоемкости воздуха:
1 — электромотор; 2,6 — реостаты; 3 — вентилятор; 4 — мерная диафрагма; 5 — нагревательный элемент; 7 — термостат; 8 — амперметр;
9— вольтметр; 10 – термометр; 11 – микроманометр;
α— угол наклона микроманометра к горизонтали
Принцип действия установки состоит в следующем. Воздух из лаборатории с температурой to и давлением po засасывается
вентилятором 3 и подаётся по трубопроводу 10 к электронагревателю 5 открытого типа. Для полного исключения потерь тепла в окружающую среду нагреватель помещён в термостат.
Расход воздуха через трубопровод регулируется частотой вращения вентилятора.
Для определения расхода в трубопроводе 10 установлена мерная диафрагма (рис.1.3), представляющая собой диск с отверстием круглого сечения, центр которого лежит на оси трубопровода. Сужение воздушного потока начинается на некотором расстоянии от диафрагмы и на некотором расстоянии за диафрагмой поток достигает минимального сечения [5]. Далее поток постепенно расширяется до полного мечения трубопровода.
Как видно из рис.1.3, давление за диафрагмой полностью не восстанавливается (перед диафрагмой происходит дросселирование струи
– ускорение потока, а непосредственно за диафрагмой давление не может сразу восстановиться, поэтому появляется разность давлений
47
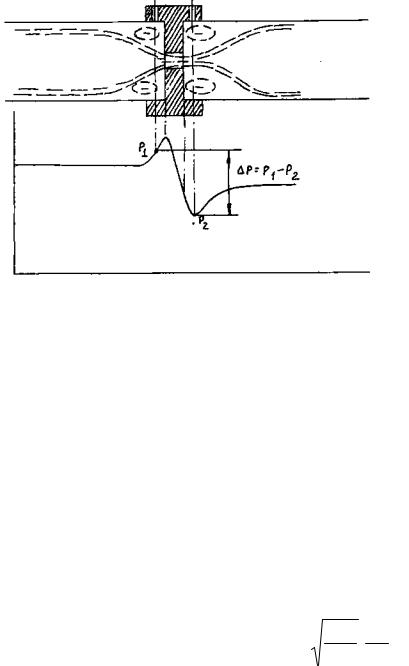
11
р = р2 − р1). Разность давлений на диафрагме зависит от скорости потока
в отверстии, или, что то же самое, от объёмного расхода воздуха V = Fотвсотв, где Fотв — площадь отверстия, сотв — скорость воздуха в отверстии, а также от интенсивности вихрей, образующихся до и после диафрагмы («мертвая» зона на рис.1.3).
Рис.1.3. Характер потока и распределение статического давления при установке в трубопроводе диафрагмы
Таким образом, в лабораторной установке реализуется изобарный подвод теплоты к потоку воздуха. Уравнение теплового баланса для установки представляется так:
|
Gвc pт(T1 −To ) = IвVв, |
(1.11) |
|||
|
где Gв =Vρв — массовый расход воздуха в трубопроводе, кг/с; |
||||
|
ρв |
— плотность воздуха, |
кг |
; Т1 – температура |
воздуха на выходе из |
|
м3 |
термостата; срт — средняя массовая теплоёмкость воздуха при постоянном давлении; Iв,Vв — сила тока и напряжение в цепи нагревателя.
Для определения объёмного расхода воздуха, проходящего через диафрагму, рекомендуют следующую формулу [5]:
|
V =μεk |
F |
2 p , м3 |
, |
||||||||
|
где μ = 0.82 |
t |
отв |
ρв с |
||||||||
|
— коэффициент |
расхода |
мерной диафрагмы; |
ε =1.0 — |
||||||||
|
коэффициент, |
учитывающий |
сужение |
струи; |
kt =1.0 — |
температурный |
||||||
|
поправочный коэффициент; |
F |
= |
πdотв2 |
= 7.85 10−5м2 ; |
d |
отв |
= 0.01 м — |
||||
|
отв |
4 |
||||||||||
диаметр отверстия в диафрагме;
48

|
Н |
; α =30о |
12 |
||
|
р = h sinα — перепад давления в диафрагме, |
— угол наклона |
|||
|
в |
м2 |
|||
микроманометра к горизонту.
Подставляя значения коэффициентов в формулу, с учётом масштаба измерительной части микроманометра и его показаний в мм водяного столба, получаем расчётную формулу:
|
V = 6.45 |
10−3 hв |
, м3 |
(1.12) |
|
ρв |
с |
Порядок проведения экспериментов и методика обработки опытных данных
Перед началом проведения экспериментов необходимо подготовить таблицы 1.1 и 1.2.
Порядок обработки опытных данных следующий:
1. Определяются параметры состояния окружающего воздуха в лаборатории:
|
Т |
о |
=t |
o |
+ 273, K; p |
o |
= B |
133.2 |
Н |
, |
||||||||||||||
|
o |
м2 |
||||||||||||||||||||||
|
где Во — барометрическое давление, мм рт.ст. |
|||||||||||||||||||||||
|
Таблица 1.1 |
|||||||||||||||||||||||
|
Номер |
Перепад |
Температура |
Сила |
тока |
в |
Напряжение на |
|||||||||||||||||
|
Опыта |
давления |
на |
воздуха |
на |
цепи |
клеммах |
|||||||||||||||||
|
мерной |
выходе |
из |
нагревателя, |
спирали |
|||||||||||||||||||
|
диафрагме, |
нагревателя, |
Iв, А |
нагревателя, |
||||||||||||||||||||
|
hв, мм вод. ст. |
t1,o C |
Uв, В |
|||||||||||||||||||||
|
1 |
|||||||||||||||||||||||
|
2 |
|||||||||||||||||||||||
|
3 |
|||||||||||||||||||||||
|
Повышение |
Таблица 1.2 |
||||||||||||||||||||||
|
Номер |
Объёмны |
Массовы |
Количество |
Средняя |
|||||||||||||||||||
|
Опыта |
й |
расход |
й |
расход |
теплоты, |
температур |
массовая |
||||||||||||||||
|
воздуха, |
воздуха, |
подведенно |
ы |
воздуха в |
теплоемкост |
||||||||||||||||||
|
м3 |
кг |
е к воздуху, |
нагревателе, |
ь воздуха, |
|||||||||||||||||||
|
V , |
с |
Gв, с |
Qв,Вт |
Тв,К |
срт, |
Дж |
|||||||||||||||||
|
кг К |
|||||||||||||||||||||||
|
1 |
|||||||||||||||||||||||
|
2 |
|||||||||||||||||||||||
|
3 |
49
13
2. Рассчитывается плотность воздуха из уравнения состояния
(выведено Клапейроном Бенуа Полем Эмилем (1799 – 1864)
французским физиком и инженером в 1834 году и дополнено Дмитрием Ивановичем Менделеевым (1834 – 1907), российским химиком, для одного моля идеального газа в 1874 году):
|
ρв = |
ро |
, |
кг |
, где R = 287 |
Дж |
— газовая постоянная сухого воздуха. |
|
|
RTo |
м3 |
кг К |
|||||
3.Определяется объёмный расход воздуха в трубопроводе по формуле (1.12).
4.Рассчитывается массовый расход воздуха:
Gв =ρвV , кгс
5. Количество теплоты, подведенное к воздуху в нагревателе: Qв = IвUв, Джс или Вт
6.Повышение температуры в нагревателе:
Тв =Т1 −То, где Т1 =t1 + 273, K
7.Удельная средняя массовая теплоемкость воздуха в процессе при
постоянном давлении:
|
c pm = |
Qв |
, |
Дж |
|
|
Gв Tв |
кг К |
|||
Отчетность по лабораторной работе
Включает:
1.Принципиальную схему лабораторной установки с указанием ее основных элементов.
2.Результаты измерений параметров установки при проведении опытов
иих обработки (табл.1.1-1.2).
3.Алгоритм обработки экспериментальных данных.
Ответы на контрольные вопросы:
1.Что называют теплоемкостью рабочего тела?
2.Напишите и поясните уравнение первого закона термодинамики в дифференциальной форме.
3.Напишите и поясните уравнение состояния идеального газа.
4.Напишите и поясните уравнение Ю.Майера.
5.Напишите и поясните уравнение теплового баланса для лабораторной установки.
6. Приведите примеры использования теплоёмкостей ср и cv в авиационной технике.
7.Принцип действия лабораторной установки.
8.Чем объяснить увеличение теплоемкости с ростом температуры?
50

14
ЛР-2 ИССЛЕДОВАНИЕ ГАЗОВЫХ ПРОЦЕССОВ В ЭЛЕМЕНТАХ ТРД (4 часа)
Цель работы: 1. Практическое освоение схемы и принципа действия турбореактивного двигателя.
2.Приобретение навыков по расчету параметров состояния в контрольных сечениях проточной части ТРД.
3.Сделать выводы, ответить на контрольные вопросы и оформить отчет по лабораторной работе.
Задание на работу
1. Для заданного значения степени повышения давления в
компрессоре π*к = 20 и степени подогрева воздуха в двигателе
|
Тг* |
* |
и |
||||
|
= |
= 6.5 (величины πк |
называются параметрами рабочего про- |
||||
|
Тн |
||||||
цесса (цикла) двигателя) определить:
—параметры состояния (действительные и заторможенные) воздуха или газа в контрольных сечениях проточной части (газовоздушного тракта) турбореактивного двигателя;
—энергетические показатели процессов в элементах ТРД:
а) количество теплоты, участвующее в процессе; б) работу сжатия и расширения; в) полезную работу цикла двигателя; Исходные данные:
— рабочее тело — воздух (показатель адиабаты к = 1.4, газовая постоянная Rв = 287 кгДжК , для газа кг=1.33, Rг = 287.5 кгДжК );
—давление и температура в начальной точке «н»:
рн = 760 мм рт.ст., Тн = 288 К;
—скорость полета V=0.
2.Оформить отчет по лабораторной работе.
Основные сведения
Газотурбинным двигателем (ГТД) согласно ГОСТ 23851-79 [1]
называют тепловую машину, в которой энергия сгорания топлива преобразуется в кинетическую энергию струи и в механическую работу на валу; основными элементами ГТД являются компрессор, камера сгорания и газовая турбина.
51
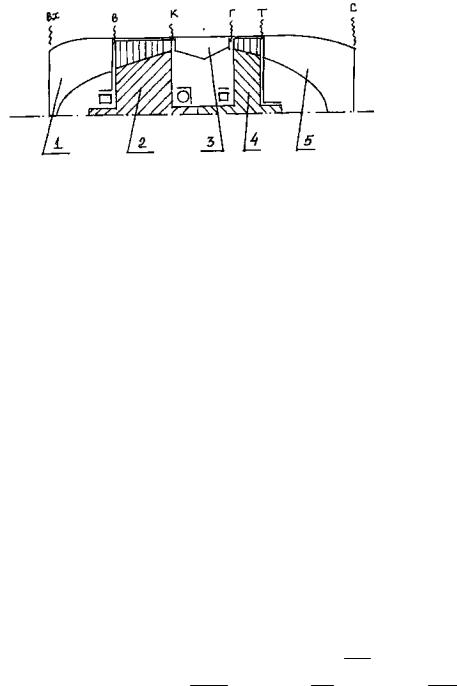
15
Турбореактивным двигателем (ТРД) или двигателем прямой реакции называют ГТД, в котором преобладающая часть энергии топлива преобразуется в кинетическую энергию струи. То есть основой ТРД является ГТД со следующими элементами: входное устройство,
компрессор, камера сгорания, турбина и выходное устройство
(рис.2.1).
Рис.2.1. Принципиальная схема турбореактивного двигателя с осевым компрессором:
1 — входное устройство; 2 — компрессор; 3 — камера сгорания; 4 -турбина; 5 — выходное устройство; вх, в, к, г, т, с -обозначения контрольных сечений проточной части двигателя
Рассмотрим принцип действия ТРД при работе на стенде (Н=0, V =0). 1. Воздух из атмосферы поступает во входное устройство (в воздухозаборник), где происходит его ускорение до скорости cв=180…220 м/с . То есть воздухозаборник на старте воздушного судна
работает в режиме расширения.
Если принять течение воздушного потока в воздухозаборнике энергоизолированным и без трения, то течение воздуха адиабатное. Параметры состояния воздуха на выходе из воздухозаборника (сечение «В-В») находятся по формулам:
а) давление и температура заторможенного потока воздуха
Тв* =Тн* =Тн (при V = 0); рв* = рн* = рн;
б) действительная температура (из выражения для полной энергии потока в сечении) и статическое давление (из уравнения адиабатного
процесса торможения от рв до рв*) в потоке
Тв =Тв* − 2ссв2рв ; рв =
в) плотность и удельный объем
к
рв* Тв* к−1; срв = кк−1 R;Тв
воздуха (из уравнения состояния)
52

16
ρв = RTрвв ; vв = ρ1в .
В этих формулах:
срв — средняя теплоемкость воздуха в изобарном процессе; Rв— газовая
постоянная для воздуха.
2. Из воздухозаборника воздух поступает в компрессор, в котором происходит сжатие (плотность увеличивается). При отсутствии теплообмена рабочего тела — воздушного потока с окружающего средой (лопатками, корпусом и т.п.) и трения процесс сжатия в компрессоре адиабатный (температура и давление в процессе сжатия также возрастают). Параметры состояния воздуха на выходе из компрессора (сечение «К-К») находятся по формулам:
|
к−1 |
ск2 |
|||||||||||||||||
|
* |
* * * |
* * |
к |
* |
||||||||||||||
|
рк |
= рв |
πк; Тк |
=Тв |
πк |
; Тк = |
Тк |
− |
; |
||||||||||
|
2срв |
||||||||||||||||||
|
к |
||||||||||||||||||
|
= р* |
Тк |
к−1 |
рк |
1 |
||||||||||||||
|
р |
к |
; ρ |
к |
= |
; v |
к |
= |
|||||||||||
|
к |
* |
RTк |
ρк |
|||||||||||||||
|
Тк |
Скорость воздушного потока на выходе из компрессора принимается равной ск=100…120 м/с.
3. Из компрессора воздух направляется в камеру сгорания, где к нему подводится теплота при сгорании топлива, впрыскиваемого топливными форсунками в камеру. Принимая процесс подвода теплоты изобарным, определяем параметры состояния газа на выходе из камеры сгорания (сечение «Г-Г»):
|
2 |
кг |
|||||||||||||||||||||||||
|
* |
* * |
* |
к |
г |
−1 |
|||||||||||||||||||||
|
сг |
* |
Тг |
||||||||||||||||||||||||
|
рг |
= |
рк; |
Тг |
=Тн ; Тг =Тг |
− |
; рг = рг |
; |
|||||||||||||||||||
|
2срг |
* |
|||||||||||||||||||||||||
|
Тг |
||||||||||||||||||||||||||
|
ρ |
г |
= |
рг |
;v |
г |
= |
1 |
; с |
рг |
= |
кг |
R . |
||||||||||||||
|
к |
||||||||||||||||||||||||||
|
R T |
ρ |
г |
г |
−1 |
г |
|||||||||||||||||||||
|
г |
г |
Скорость потока газа на выходе из камеры сгорания принимается равной сг =150…160 м/с.
4. Из камеры сгорания поток газа направляется в турбину (сечение «Г-Г»), где происходит расширение газа (плотность уменьшается). Пренебрегая теплообменом между газом и лопатками и корпусом турбины, а также трением, процесс расширения газа принимается адиабатным (при расширении газа температура и давление также уменьшаются). Параметры состояния газа на выходе из турбины (сечение «Т-Т») находятся следующим образом:
53

17
а) из условия баланса мощностей турбины и компрессора в ТРД (или баланса удельных эффективных работ):
срг(Тг* −Тт*) = срв(Тк* −Тв*)
определяется температура заторможенного потока газа за турбиной Тт* .
б) задается приведенная скорость газа на выходе из турбины
λт = 0.5…0.6 .
Действительная температура и статическое давление в потоке газа в данном сечении проточной части двигателя:
|
* |
кг −1 |
2 |
Тт |
кг |
рт |
1 |
||||||||||||||
|
кг −1 |
||||||||||||||||||||
|
Тт =Тт 1 |
− |
λт |
; рт = рг |
; ρт = |
; vт = |
; |
||||||||||||||
|
к |
г |
+1 |
Т |
R Т |
г |
ρ |
т |
|||||||||||||
|
г |
г |
в) давление заторможенного потока газа (полное давление) за турбиной
|
* |
рт |
||||||||||
|
рт |
= |
||||||||||
|
кг −1 |
2 |
кг |
|||||||||
|
к |
г |
−1 |
|||||||||
|
1− |
λ |
т |
|||||||||
|
кг +1 |
|||||||||||
5. Из турбины (сечение «Т-Т») газы направляются в выходное устройство ( в реактивное сопло) двигателя, где происходит ускорение потока (температура, давление и плотность уменьшаются, а скорость увеличивается). Если принять, что течение в реактивном сопле энергоизолированное и трение отсутствует, то процесс расширения газа можно считать адиабатическим. Параметры состояния газа на выходе из сопла (сечение «С-С») при расширении до атмосферного давления рн
находятся по формулам:
|
кг |
−1 |
2 |
||||||||||||||||||||
|
рн |
к |
г |
||||||||||||||||||||
|
р |
с |
= р |
н |
; с = |
2с |
рг |
Т |
* 1 |
− |
; Т |
* =Т |
*; Т |
с |
=Т |
* − сс |
; |
||||||
|
с |
т |
* |
с |
т |
с |
2срг |
||||||||||||||||
|
рт |
||||||||||||||||||||||
ρс = RгрТсс ; vс = ρ1с
2.Энергетические показатели процессов в элементах ТРД:
|
а) входное устройство |
ивх = сvв(Тв −Тн) , |
энтальпии |
||
|
Изменение внутренней |
энергии |
|||
|
(теплосодержания) |
iвх = срв(Тв −Тн) |
и |
энтропии sвх = 0 |
(так как |
|
теплообмен между |
потоком |
воздуха |
и |
внешней средой отсутствует, |
qвх = 0 ). Работа против сил давления lрвх(техническая работа) во
54
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #

Таблицы DPVA.ru — Инженерный Справочник
Адрес этой страницы (вложенность) в справочнике dpva.ru: 
Индивидуальные газовые постоянные и молярные массы некоторых газов Ri. Азот, Аргон, Водяной пар, Водород, Воздух, Гелий, Диоксид серы , Кислород, Метан, Пропан, Углекислый, Угарный газ
|
||||||||||||||||||||||||||||||||||||||||
|
Поиск в инженерном справочнике DPVA. Введите свой запрос: |
Поиск в инженерном справочнике DPVA. Введите свой запрос:
Если Вы не обнаружили себя в списке поставщиков, заметили ошибку, или у Вас есть дополнительные численные данные для коллег по теме, сообщите , пожалуйста.
Вложите в письмо ссылку на страницу с ошибкой, пожалуйста.
Коды баннеров проекта DPVA.ru
Начинка: KJR Publisiers
Консультации и техническая
поддержка сайта: Zavarka Team
Free xml sitemap generator
Пример 4.1
Найти газовую постоянную смеси, состоящей из азота с приведенным объемом 0,4 м3 и кислорода с приведенным объемом 0,2 м3.
Решение
Общий объем смеси:
= 0,4 + 0,2 = 0,6 м3.
Объемные (или молярные) доли компонентов:
= 0,2/0,6 = 0,333;
= 0,4/0,6 = 0,667.
Молярная масса смеси:
= 0,333 · 32·10-3 + 0,667 · 28,01·10-3 = 29,34·10-3 кг/моль
Газовая постоянная смеси:
= 8,314 / 29,34·10-3 = 283 Дж/(кг·К)
Пример 4.2
Найти парциальное давление азота и кислорода газовой смеси, состоящей из азота с приведенным объемом 0,4 м3 и кислорода с приведенным объемом 0,2 м3. Давление смеси равно 0,1 МПа.
Решение
Парциальное давление компонентов равно:
= 0,333·0,1 = 33,3 кПа,
= 0,667·0,1 = 66,7 кПа.
Пример 4.3.
Продукты сгорания топлива массой 1 кг имеют следующий молярный состав: пары воды = 60,3; углекислый газ
= 73,9; азот
= 849,5; кислород
= 132,2. Найти массу и молярную массу смеси.
Решение
Число молей продуктов сгорания:
= 60,3 + 73,9 + 123,3 + 849,5 = 1106,9 моль.
Молярные доли компонентов:
= 60,3 / 1106,9 = 0,0544;
= 73,9 / 1106,9 = 0,0667;
= 123,2 / 1106,9 = 0,1113;
= 849,5 / 1106,9 = 0,7676.
Молярная масса смеси:
;
М = 0,0554 · 18,02·10-3 + 0,0667 · 44,01·10-3 + 0,1113 · 32·10-3 + 0,7676 · 28,04·10-3 =
= 28,04·10-3 кг/моль
Масса смеси:
= 28,04·10-3 · 1106,9 = 31,04 кг
На практике часто встречаются такие изменения состояния газа, когда одновременно изменяются все три параметра – объем VV, давление pp и температура TT. В таких случаях зависимость между параметрами определяется уравнением состояния газа.
Уравнение Клапейрона
Рассмотрим процесс, в результате которого газ перешел из нормального состояния с параметрами V0V_0, p0p_0, T0T_0 в состояние с другими параметрами V1V_1, p1p_1, T1T_1.
Такой переход от начального к конечному состоянию газа можно осуществить с помощью двух известных процессов (например, сначала изобарического, а затем изотермического) по схеме:
I.V0,p0,T0;V′,p0,T;V′=V0TT0I.{{V}_{0}},{{p}_{0}},{{T}_{0}};{V}’,{{p}_{0}},T;{V}’={{V}_{0}}frac{T}{{{T}_{0}}}
II.V′,p0,T;V,p,T;p0V′=pVII.{V}’,{{p}_{0}},T;V,p,T;{{p}_{0}}{V}’=pV
Исключив из двух полученных уравнений объем V′V’ для промежуточного состояния газа, получим
pVT=p0V0T0frac{pV}{T}=frac{{{p}_{0}}{{V}_{0}}}{{{T}_{0}}}
то есть получим уравнение:
pV=ВТpV = ВТ.
Это уравнение вывел французский ученый Б. П. Э. Клапейрон в 1834 году. Постоянная BB в нем – постоянная зависимости от природы газа и его количества. Эту постоянную, рассчитанную для единицы массы газа, называют удельной газовой постоянной B0B_0.
В качестве примера вычислим удельный газовую постоянную для воздуха. Объем 1 кг воздуха – удельный объем воздуха в нормальных условиях (давление 1,013 · 105 Па и температура 273,15 К)
V0=1ρ0=11,293(м3кг){{V}_{0}}=frac{1}{{{rho }_{0}}}=frac{1}{1,293}(frac{{{м}^{3}}}{кг})
Отсюда:
B0=p0V0T0=p0V0273=1,013⋅1051,293⋅273=287,1(Джкг⋅К){{B}_{0}}=frac{{{p}_{0}}{{V}_{0}}}{{{T}_{0}}}=frac{{{p}_{0}}{{V}_{0}}}{273}=frac{1,013cdot {{10}^{5}}}{1,293cdot 273}=287,1(frac{Дж}{кгcdot К})
Аналогично вычислено, что удельная газовая постоянная для водорода равна 4125, для кислорода – 295,7; для азота – 296,7 Дж / (кг · К) и т. д.
Преобразования Менделеева
В 1874 г. русский химик Д. И. Менделеев, воспользовавшись законом Авогадро, предоставил уравнение Клапейрона в более удобном для использования виде. При этом оказалось целесообразным рассчитывать постоянную для газов, взятых в количестве 1 моль или 1 кмоль:
Rm=p0V0mT0=1,013⋅105⋅0,0224273=8,31(Джмоль⋅K){{R}_{m}}=frac{{{p}_{0}}{{V}_{0m}}}{{{T}_{0}}}=frac{1,013cdot {{10}^{5}}cdot 0,0224}{273}=8,31(frac{Дж}{мольcdot K})
Постоянную RmR_m (или просто RR) называют универсальной газовой постоянной. Уравнение состояния в расчете на 1 моль идеального газа имеет вид, аналогичный уравнению Клапейрона:
pV=RmTpV={{R}_{m}}T
В таком виде уравнения состояния идеального газа называют уравнением Клапейрона-Менделеева.
Кроме единицы количества вещества – моль – разрешается применять кратные и дольные от ее величины. В пересчете на кмоль RR составит:
R=1,013⋅105⋅22,4273=8,31⋅103(Джкмоль⋅K)R=frac{1,013cdot {{10}^{5}}cdot 22,4}{273}=8,31cdot {{10}^{3}}(frac{Дж}{кмольcdot K})
В расчете на 1 кмоль идеального газа уравнение записывают так:
pV=RTpV = RT,
а для любой массы mm – так:
pV=mμRTpV=frac{m}{mu }RT
где μμ – масса, которую имеет кмоль газа.
Для удобства расчетов преимущественно пользуются именно этой формой уравнения.
По данному уравнению легко находим зависимость плотности газа от давления и температуры, а именно:
mV=μpRTfrac{m}{V}=frac{mu p}{RT},
ρ=μpRTrho =frac{mu p}{RT}
Таковы в общем виде эмпирические закономерности в свойствах идеального газа.
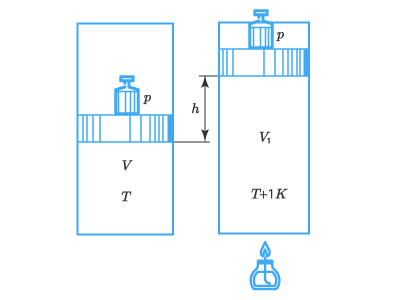
Физическая суть постоянной
Для выяснения физической сути постоянной RR представим 1 кмоль газа под поршнем в некоем цилиндре:
При этом давление в нем составляет рр, температура – ТТ, а площадь поршня SS.
Повысим температуру газа внутри цилиндра от ТТ до (Т+1КТ + 1 К). Газ расширяется и выполняет работу, поднимая поршень на высоту hh. Эта работа составит:
А=pShА = pSh,
но Sh=ΔVSh = ΔV – прирост объема газа при расширении;
поэтому А=pΔVА = pΔV.
Данное выражение определяет работу газа в изобарическом процессе.
Применив уравнение Клапейрона-Менделеева к начальному и конечному состояниям газа, получим:
pV=RT;pV1=R(T+1K)pV=RT;p{{V}_{1}}=R(T+1K)
Отняв от второго уравнения первое, получим:
p(V1−V)=R;R=pΔVp({{V}_{1}}-V)=R;R=pDelta V
Сопоставим данное равенство с уравнением работы по подъему и найдем, что R=АR = А, то есть универсальная газовая постоянная численно равна работе расширения одного кмоль газа при изобарическом нагревании на 1К1 К.
Тест по теме: “Уравнение Клапейрона-Менделеева”