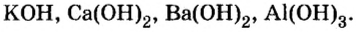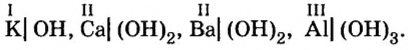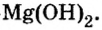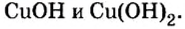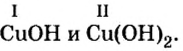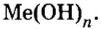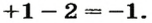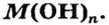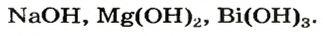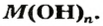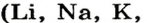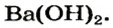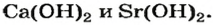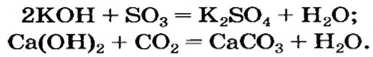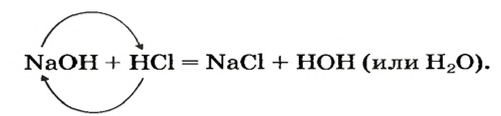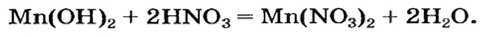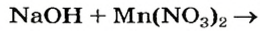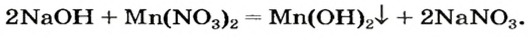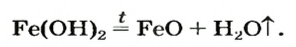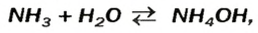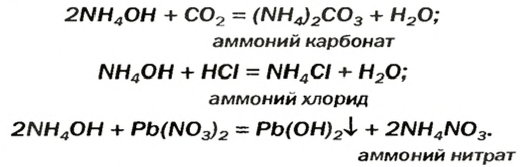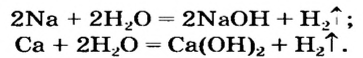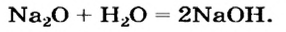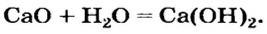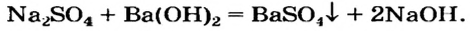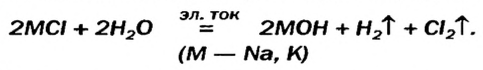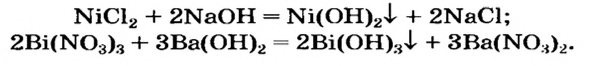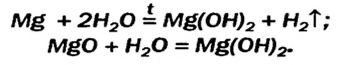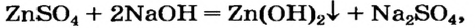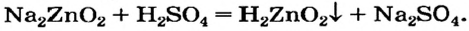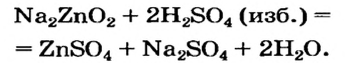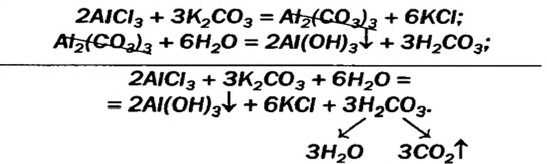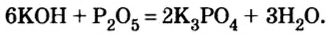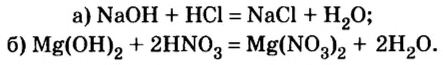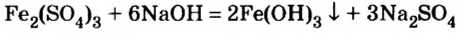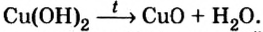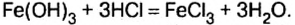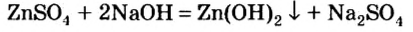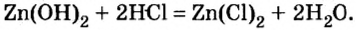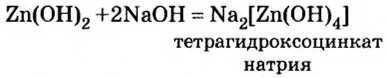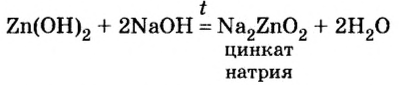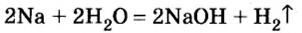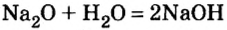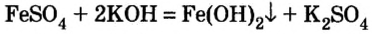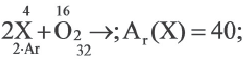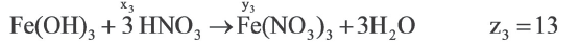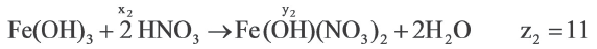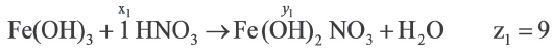План урока:
Оксиды
Кислоты
Основания
Соли
Оксиды
В состав оксидов ВСЕГДА входит ТОЛЬКО два элемента, один из которых будет кислород. В этом классе соединений срабатывает правило, третий элемент лишний, он не запасной, его просто не должно быть. Второе правило, степень окисления кислорода равна -2. Из выше сказанного, определение оксидов будет звучать в следующем виде.
Оксиды в природе нас окружают повсюду, честно говоря, сложно представить нашу планету без двух веществ – это вода Н2О и песок SiO2.
Вы можете задаться вопросом, а что бывают другие бинарные соединения с кислородом, которые не будут относиться к оксидам.
Поранившись, Вы обрабатываете рану перекисью водорода Н2О2. Или для примера соединение с фтором OF2. Данные вещества вписываются в определение, так как состоят из 2 элементов и присутствует кислород. Но давайте определим степени окисления элементов.
Данные соединения не относятся к оксидам, так как степень окисления кислорода не равна -2.
Кислород, реагируя с простыми, а также сложными веществами образует оксиды. При составлении уравнения реакции, важно помнить, что элементу О свойственна валентность II (степень окисления -2), а также не забываем о коэффициентах. Если не помните, какую высшую валентность имеет элемент, советуем Вам воспользоваться периодической системой, где можете найти формулу высшего оксида.
Рассмотрим на примере следующих веществ кальций Са, мышьяк As и алюминий Al.
Подобно простым веществам реагируют с кислородом сложные, только в продукте будет два оксида. Помните детский стишок, а синички взяли спички, море синее зажгли, а «зажечь» можно Чёрное море, в котором содержится большое количество сероводорода H2S. Очевидцы землетрясения, которое произошло в 1927 году, утверждают, что море горело.
Чтобы дать название оксиду вспомним падежи, а именно родительный, который отвечает на вопросы: Кого? Чего? Если элемент имеет переменную валентность в скобках её необходимо указать.
Классификация оксидов строится на основе степени окисления элемента, входящего в его состав.
Реакции оксидов с водой определяют их характер. Но как составить уравнение реакции, а тем более определить состав веществ, строение которых Вам ещё не известно. Здесь приходит очень простое правило, необходимо учитывать, что эта реакция относиться к типу соединения, при которой степень окисления элементов не меняется.
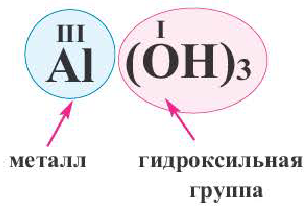
Возьмём основный оксид, степень окисления входящего элемента +1, +2(т.е. элемент одно- или двухвалентен). Этими элементами будут металлы. Если к этим веществам прибавить воду, то образуется новый класс соединений – основания, состава Ме(ОН)n, где n равно 1, 2 или 3, что численно отвечает степени окисления металла, гидроксильная группа ОН- имеет заряд –(минус), что отвечает валентности I.При составлении уравнений не забываем о расстановке коэффициентов.
Аналогично реагируют с водой и кислотные оксиды, только продуктом будет кислота, состава НхЭОу. Как и в предыдущем случае, степень окисления не меняется, тип реакции — соединение. Чтобы составить продукт реакции, ставим водород на первое место, затем элемент и кислород.
Особо следует выделить оксиды неметаллов в степени окисления +1 или +2, их относят к несолеобразующим. Это означает, что они не реагируют с водой, и не образуют кислоты либо основания. К ним относят CO, N2O, NO.
Чтобы определить будет ли оксид реагировать с водой или нет, необходимо обратиться в таблицу растворимости. Если полученное вещество растворимо в воде, то реакция происходит.
Золотую середину занимают амфотерные оксиды. Им могут соответствовать как основания, так и кислоты, но с водой они не реагируют. Они образованные металлами в степени окисления +2 или +3, иногда +4. Формулы этих веществ необходимо запомнить.
Кислоты
Если в состав оксидов обязательно входит кислород, то следующий класс узнаваем будет по наличию атомов водорода, которые будут стоять на первом месте, а за ними следовать, словно нитка за иголкой, кислотные остатки.
В природе существует большое количество неорганических кислот. Но в школьном курсе химии рассматривается только их часть. В таблице 1 приведены названия кислот.
Валентность кислотного остатка определяется количеством атомов водорода. В зависимости от числа атомов Н выделяют одно- и многоосновные кислоты.
Если в состав кислоты входит кислород, то они называются кислородсодержащими, к ним относится серная кислота, угольная и другие. Получают их путём взаимодействия воды с кислотными оксидами. Бескислородные кислоты образуются при взаимодействии неметаллов с водородом.
Только одну кислоту невозможно получить подобным способом – это кремниевую. Отвечающий ей оксид SiO2 не растворим в воде, хотя честно говоря, мы не представляем нашу планету без песка.
Основания
Для этого класса соединений характерно отличительное свойство, их ещё называют вещества гидроксильной группы — ОН.
Чтобы дать название, изначально указываем класс – гидроксиды, потом добавляем чего, какого металла.
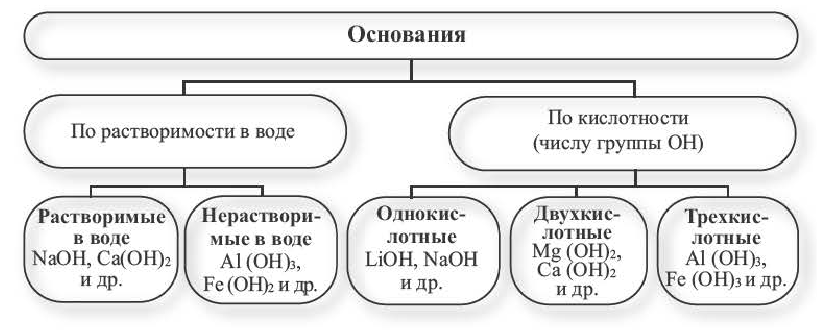
Классификация оснований базируется на их растворимости в воде и по числу ОН-групп.
Следует отметить, что гидроксильная группа, также как и кислотный остаток, это часть целого. Невозможно получить кислоты путём присоединения водорода к кислотному остатку, аналогично, чтобы получить основание нельзя писать уравнение в таком виде.
Na + OH →NaOH или H2 + SO4→ H2SO4
В природе не существуют отдельно руки или ноги, эта часть тела. Варианты получения кислот были описаны выше, рассмотрим, как получаются основания. Если к основному оксиду прибавить воду, то результатом этой реакции должно получиться основание. Однако не все основные оксиды реагируют с водой. Если в продукте образуется щёлочь, значит, реакция происходит, в противном случае реакция не идёт.
Данным способом можно получить только растворимые основания. Подтверждением этому служат реакции, которые вы можете наблюдать. На вашей кухне наверняка есть алюминиевая посуда, это могут быть кастрюли или ложки. Эта кухонная утварь покрыта прочным оксидом алюминия, который не растворяется в воде, даже при нагревании. Также весной можно наблюдать, как массово на субботниках белят деревья и бордюры. Берут белый порошок СаО и высыпают в воду, получая гашеную известь, при этом происходит выделение тепла, а это как вы помните, признак химического процесса.
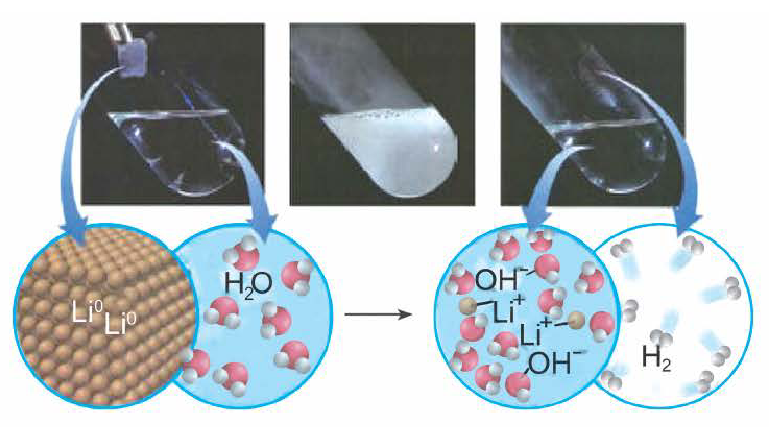
Раствор щёлочи можно получить ещё одним методом, путём взаимодействия воды с активными металлами. Давайте вспомним, где они размещаются в периодической системе – I, II группа. Реакция будет относиться к типу замещения.
Напрашивается вопрос, а каким же образом получаются нерастворимые основания. Здесь на помощь придёт реакция обмена между щёлочью и растворимой солью.
Соли
С представителями веществ этого класса вы встречаетесь ежедневно на кухне, в быту, на улице, в школе, сельском хозяйстве.
Объединяет все эти вещества, что они содержат атомы металла и кислотный остаток. Исходя из этого, дадим определение этому классу.
Средние соли – это продукт полного обмена между веществами, в которых содержатся атомы металла и кислотный остаток (КО) (мы помним, что это часть чего-то, которая не имеет возможности существовать отдельно).
Выше было рассмотрено 3 класса соединений, давайте попробуем подобрать комбинации, чтобы получить соли, типом реакции обмена.
Чтобы составить название солей, необходимо указать название кислотного остатка, и в родительном падеже добавить название металла.
Ca(NO3)2– нитрат (чего) кальция, CuSO4– сульфат (чего) меди (II).
Наверняка многие из вас что-то коллекционировали, машинки, куклы, фантики, чтобы получить недостающую модель, вы менялись с кем-то своей. Применим этот принцип и для получения солей. К примеру, чтобы получить сульфат натрия необходимо 2 моль щёлочи и 1 моль кислоты. Допустим, что в наличии имеется только 1 моль NaOH, как будет происходить реакция? На место одного атома водорода станет натрий, а второму Н не хватило Na. Т.е в результате не полного обмена между кислотой и основанием получаются кислые соли. Название их не отличается от средних, только необходимо прибавить приставку гидро.
Однако бывают случаи, с точностью наоборот, не достаточно атомов водорода, чтобы связать ОН-группы. Результатом этой недостачи являются основные соли. Допустим реакция происходит между Ва(ОН)2 и HCl. Чтобы связать две гидроксильные группы, требуется два водорода, но предположим, что они в недостаче, а именно в количестве 1. Реакция пойдёт по схеме.
Особый интерес и некоторые затруднения вызывают комплексные соли, своим внешним, казалось,громоздким и непонятным видом, а именно квадратными скобками:K3[Fe(CN)6] или [Ag(NH3)2]Cl. Но не страшен волк, как его рисуют, гласит поговорка. Соли состоят из катионов (+) и анионов (-). Аналогично и с комплексными солями.
Образует комплексный ион элемент-комплексообразователь, обычно это атом металла, которого, как свита, окружают лиганды.
Источник
Теперь необходимо справиться с задачей дать название этому типу солей.
Попробуем дать название K3[Fe(CN)6]. Существует главный принцип, чтение происходит справа налево. Смотрим, количество лигандов, а их роль выполняют циано-группы CN−, равно 6 – приставка гекса. В комплексообразователем будут ионы железа. Значит, вещество будет иметь название гексацианоферрат(III) (чего) калия.
Образование комплексных солей происходит путём взаимодействия, к примеру, амфотерных оснований с растворами щелочей. Амфотерность проявляется способностью оснований реагировать как с кислотами, так и щелочами. Так возьмём гидроксид алюминия или цинка и подействуем на них кислотой и щёлочью.
В природе встречаются соли, где на один кислотный остаток приходится два разных металла. Примером таких соединений служат алюминиевые квасцы, формула которых имеет вид KAl(SO4)2. Это пример двойных солей.
Из всего вышесказанного можно составить обобщающую схему, в которой указаны все классы неорганических соединений.
|
Формула кислоты всегда начинается с «H». Например, H2SO4(серная кислота), HCl(соляная кислота). Если видишь первую «H», значит, это кислота. Основания имеют гидроксо группу OH в формуле Например, NaOH(гидроксид натрия), Ca(OH)2 (гидроксид кальция). В формуле солей первая скажем так буква — металл или неметалл ПС. Например, NaCl(хлорид натрия), Na3PO4 Еще раз: если первая «Н», значит, кислота. Если есть «ОН», значит, основание. Если первый металл или неметалл, значит, соль автор вопроса выбрал этот ответ лучшим Krustall 7 месяцев назад Это вопрос из курса школьной химии, достаточно простой, но требующий разъяснения и запоминания. Кислоты — это то, что в растворе диссоциирует только на катионы Н+ и анионы кислотного остатка. Основания — это то, что в растворе диссоциируют на катионы металлов и гидроксид-анионы ОН-. Соли — электролиты, который диссоциируют на катионы металла, анионы кислотного остатка, а еще в некоторых случаях ЕЩЁ на Н+ (кислые соли): NaHCO3 и ОН- (Основные соли) Fe(OH)Cl2. Ну и добавим нужную расшифровку про Оксиды, это такие бинарные (то есть, два элемента) соединения, в которых один из элементов — это всегда кислород. Sagavaha 2 года назад Мне очень нравятся простейшие пояснения из видео на вот этом канале — реально за несколько минут химия становится понятнее, чем после длинных школьных уроков. Если же вам нужно именно текстовое пояснение — то кратко это можно описать вот так: Если же нужно, чтоб было ещё и определение каждой группы — тогда ниже более развёрнуто, но и сложнее для понимания КорнетОболенский 5 месяцев назад Вопрос из школьного курса химии. Но попробуем его соотнести с обыденной жизнью. Сначала рассмотрим химические формулы кислот, оснований и солей на примерах:
Видим, что во всех химических формулах кислот на первом месте стоит первый элемент таблицы Менделеева — водород. При этом всё, что стоит после водорода, является кислотным остатком.
Химические формулы оснований обязательно содержат в себе элемент (ОН) — соединение кислорода и водорода. Вспомним, что многие химические вещества, содержащие в своем составе атомы кислорода, называются оксидами, а водорода — гидридами. Признак основания — элемент (ОН) содержит в себе атомы кислорода и водорода одновременно. Поэтому второе название оснований — гидроксиды.
Несложно увидеть, что соли — ни что иное, как соединения атомов металлов и кислотных остатков. Т.е. Заменив в формуле кислоты водород металлом, получим ту или иную соль. Однако различить эти три разновидности химических веществ можно не только по формулам, но и на простых бытовых примерах. Уже из названия «кислота» следует, что на вкус она кислая (например, лимонная кислота, применяемая в кулинарии или муравьиная (это если запустить руку в лесной муравейник и лизнуть палец после этого) Основания — это всем известные вещества едкий натр (каустическая сода), гашеная известь. Соли — это огромное количество веществ, превышающее количество кислот и гидроксидов вместе взятых. Классическим примером соли является поваренная соль NaCl на кухонном столе или неорганические удобрения для сада и огорода (калийная селитра, сульфат аммония и пр.) G11111 4 месяца назад Химия достаточно простая наука, но это становится понятно не сразу. Когда я учился в школе долго не мог врубиться в смысл, но потом в голове что то щелкнуло и все стало на свои места — формулы и определения стали понятны буквально с одного взгляда. Сейчас это за ненадобностью снова ушло куда то в сторону, но попробую что то вспомнить. В формулах кислот всегда впереди находится водород (Н) Основания определяются по признакам:
Химические формулы соли строятся с учетом валентностей металла и кислотного остатка. Можно сказать, что все соли это ионные соединения, в солях связаны между собой ионы металла и ионы кислотных остатков. Долинн 5 месяцев назад Соль и кислота очень похожи, только у кислоты в составе всегда есть водород, и в формуле водород пишут первым (символ — Н), а у соли на его месте металл. HCl — это соляная кислота. NaCl — это хлорид натрия (поваренная соль). А в основании всегда будет ОН. Так что, если у нас есть соединение, про которое мы точно знаем, что это либо кислота, либо соль, либо основание, смотрим, что идет первым. Водород? Кислота. H2SO4 — серная кислота Далее смотрим, есть ли в завершении формулы ОН (произносится о-аш). Есть? Это основание. NaOH — едкий натр. Если в формуле первым идет металл, то это соль. MgSO4 — соль, сульфат магния. Утренняя роса 2 года назад Основания, кислоты и соли — это сложные вещества, образованные катионами и анионами. Сравним кислоты и соли: И те и другие имеют в своем составе кислотные остатки. В этом их сходство. Различие солей и кислот в том, что в кислотах кислотный остаток соединен с катионами водорода, а в солях кислотный остаток соединен с катионами металла. Например: H2SO4 (серная кислота) и CaSO4 (сульфат кальция — соль), кислотный остаток одинаковый, но в кислоте — водород, а в соли — металл кальций. Сравним соли и основания: Соль состоит из катионов металла и анионов кислотного остатка — CaSO4. Основание состоит из катионов металла и анионов гидроксогрупп (-ОН)- Ca(OH)2 Кислоты и основания, на первый взгляд, сравнить нельзя, но надо учесть, что и кислоты и основания — это гидроксиды (гидр-оксиды, то есть оксид с водой). Кислоты — это гидроксиды неметаллов, а основания — это гидроксиды металлов. Кислота + основание = соль + вода (реакция нейтрализации). SVFE48 4 месяца назад Основания, соли и кислоты можно различать по своим химическим свойствам. Основания — это вещества, которые обладают способностью отдавать протоны (положительно заряженные частицы). Они характеризуются также высокой pH (более 7). Соли — это вещества, образующиеся в результате реакции оснований и кислот. Они содержат ионы, но у них нет способности отдавать или принимать протоны. Кислоты — это вещества, которые обладают способностью принимать протоны. Они характеризуются низким pH (менее 7). Обычно они имеют кислый вкус и могут окислять металлы. В некоторых случаях можно различать основания, соли и кислоты также с помощью цветных индикаторов. Например, розовый цвет индикатора фенолофталеин указывает на присутствие основания, зеленый цвет индикатора метилового зеленого указывает на присутствие кислоты, а желтый цвет индикатора хлорофилла указывает на присутствие соли. Однако стоит помнить, что цветные индикаторы не всегда точно показывают наличие оснований, солей и кислот, поэтому лучше всего использовать их в сочетании с другими методами анализа. Степан БВ 3 месяца назад Основания, соли и кислоты можно различать по своей реакции с водой. Основания растворяются в воде и при добавлении индикатора (например, фенолфталеина) происходит появление розового цвета. Соли не растворяются в воде, но при добавлении индикатора появляется желтый цвет. Кислоты при добавлении индикатора происходит появление зеленого цвета. Также можно использовать тесты на рН, чтобы определить, какое вещество имеется в веществе. РН больше 7 означает, что это основание, РН меньше 7 означает, что это кислота. Rnd 3 месяца назад Химические реакции могут быть легко определены по первой букве в формуле вещества. Начинается ли она с «H»? Тогда это кислота, как в случае с серной кислотой (H2SO4) или соляной кислотой (HCl). Ищешь группу «OH»? Тогда это основание, как гидроксид натрия (NaOH) или гидроксид кальция (Ca(OH)2). Если же первый элемент — металл или неметалл, то это соль, как хлорид натрия (NaCl) или фосфат натрия (Na3PO4). Запомни это правило и определяй химические соединения с уверенностью! Знаете ответ? |
Схема образования гидроксида натрия:
Na+ + H-O-H > NaOH + H+;
Уравнение реакции: 2Na + 2HOH = 2NaOH + H2
OH— — гидроксид-ион является сложным ионом.
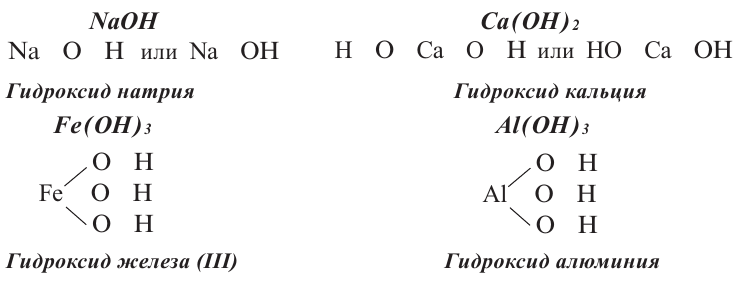
Название основания = Гидроксид + Название металла в родительном падеже + С.О. римскими цифрами
Ca(OH)2 – гидроксид кальция
Fe(OH)2 – гидроксид железа (II)
Fe(OH)3 – гидроксид железа (III)
Дай название веществам: Ba(OH)2, KOH , Al(OH)3, Zn(HO)2. Воспользуйся тренажером. (Оценка за тренажер не входит в итоговую оценку. Нажми на ссылку ответь на вопросы и закрой страницу с тестами.)
Порядок составления формул оснований
При
составлении формулы конкретного основания, необходимо в таблице
растворимости найти ион металла, для которого составляем формулу, и в
соответствии с зарядом этого иона металла составить, формулу основания:
-
Если заряд иона металла «+», то с ионом металла связанна только одна гидроксогруппа OH—, например гидроксид натрия Na+OH;
-
Если «2+», то две Ca2+(OH)2.
Вопрос:
Заряд иона алюминия «3+» (Al3+) сколько гирдроксогупп связанно с алюминием в гидроксиде алюминия?
Запомни:
Оксиду металла соответствует основание: Ca > CaO > Ca(OH)2. Такие оксиды называют основные оксиды. СаО — основный оксид.
Составим основания из оксидов: Na2O , FeO , Fe2O3
|
Na+2O > Na+OH— |
Fe2+O > Fe+2(OH)2 |
Fe23+O3 > Fe3+(OH)3 |
|
|
|
|
Составь:
-
Основания из оксидов: ZnO , Li2O , MgO
-
Оксиды из оснований: CuOH , Cu(OH)2
* * *
.
Содержание:
Основания, как и оксиды, кислоты и соли, относятся к сложным неорганическим веществам. Выясним, из каких частей состоит формула любого основания, воспользовавшись таким рядом формул:
Разделим формулы черточкой на две части, отделив символ металлического элемента от остальных символов, и напишем над металлом его валентность:
Общим для всех формул является наличие группы атомов 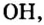
Как вы уже знаете, понятие валентности распространяется на группы атомов, в частности на кислотные остатки. Имеет свою валентность и гидроксильная группа 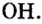
Теперь можем сформулировать определение оснований:
Основания — это сложные вещества, образованные металлическим элементом и гидроксильными группами.
Запишем формулу оснований в общем виде:
Следует отметить, что основания, как и соли,— вещества не молекулярного, а ионного строения, поэтому их формулы отображают соотношения ионов металла 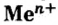
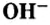
Номенклатура оснований
По современной номенклатуре название оснований состоит из двух слов: слова гидроксид и названия металлического элемента, например: 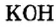
У некоторых оснований сохранились также исторические названия: 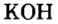
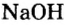
Составление формул оснований и определение валентности металла в формуле основания. Рассмотрим на примерах, как составлять формулы оснований и определять валентность металла по формуле основания.
Пример:
Составить формулу гидроксида магния.
Решение
Исходя из определения оснований, первым записываем символ металла, а после него — гидроксильную группу 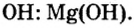
Ответ: формула основания —
Пример 2. Определить валентность меди в формулах оснований
Решение
Известно, что в формуле основания валентность металла совпадает с количеством гидроксильных групп. Первая формула содержит одну гидроксильную группу, вторая — две. Поэтому в первой формуле медь одновалентна, а во второй — двухвалентна.
Ответ:
Физические свойства и классификация оснований
Основания — твердые вещества, преимущественно белого цвета, хотя встречаются и других цветов. Например, гидроксид меди
По способности растворяться в воде основания, как и соли, бывают растворимые, малорастворимые и нерастворимые. Преобладают нерастворимые. Среди хорошо растворимых — гидроксид натрия, гидроксид калия. Их растворы мылкие на ощупь.
Растворимые в воде основания получили название щелочи. По таблице растворимости солей, оснований и кислот можно узнать, к какой группе по способности растворяться в воде принадлежит то или иное основание.
Итак, по физической характеристике — способности растворяться в воде — основания разделяют на растворимые, или щелочи, и нерастворимые.
Существует еще одна классификация оснований — по химическим свойствам. Согласно ей их разделяют на типичные основания и амфотерные гидроксиды. Но об этом речь пойдет позже.
Основания, хорошо растворимые в воде,— тугоплавкие вещества. Основания, нерастворимые в воде, при нагревании разлагаются с выделением воды и образованием оксида.
Итоги:
- Основания — сложные вещества немолекулярного строения, химическая формула которых состоит из одного атома металла и одной или нескольких гидроксильных групп.
- Число одновалентных гидроксильных групп в формуле основания равно валентности металла, поэтому в общем виде формула оснований имеет вид
- Современное название основания состоит из слова гидроксид с добавлением к нему названия металла. Если металл проявляет переменную валентность, то ее указывают после названия металла в скобках.
- При обычных условиях основания находятся в твердом состоянии, часть из них хорошо растворяется в воде. Растворенные в воде основания называются щелочами.
Что такое основания
Известь — соединение, известное человеку давно. Смесь извести с водой нередко используют и в настоящее время в строительстве. Такой смесью белят стволы и ветки деревьев, защищая их от вредителей, а зимой — от солнечных ожогов. Известь (точнее — гашеная известь) 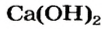
Каждое основание образовано тремя элементами. Из них два элемента «обязательные» — Оксиген и Гидроген, а третьим является металлический элемент.
Основание — соединение, которое состоит из катионов металлического элемента 
Название иона 

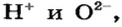
Формулы оснований
Выведем общую химическую формулу соединений этого класса. Вы знаете, что любое вещество электронейтрально. Поэтому в основании на каждый ион металлического элемента с зарядом +n должно приходиться n ионов 
Примеры химических формул оснований:
Основания — ионные соединения. Поэтому для них не составляют графические формулы.
Названия оснований
Химические названия оснований состоят из двух слов. Первым словом является название элемента, а вторым — «гидроксид». Например, соединение с формулой 
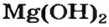
Если элемент имеет переменную валентность, то в названии основания указывают ее значение после названия элемента (римской цифрой в скобках): 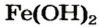
Это интересно. Оснований 
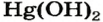
Среди соединений с общей формулой 
Основание 
Заряд иона металлического элемента в основании и оксиде один и тот же.
Оксиды, которые отвечают основаниям, называют основными.
В отличие от оксидов, оснований в природе нет.
Выводы:
Основания — соединения, которые содержат катионы металлических элементов 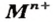

Химическое название основания состоит из названия металлического элемента и слова «гидроксид».
Каждому основанию соответствует оксид; его называют основным оксидом. Заряд иона металлического элемента в этих соединениях один и тот же.
Свойства и применение оснований
Физические свойства оснований:
Вам известно, что каждое основание состоит из положительно заряженных ионов металлического элемента и отрицательно заряженных гидроксид-ионов 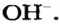
Большинство оснований не растворяются в воде (рис. 20). Малорастворимыми являются гидроксиды 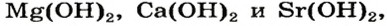
> > >
Водорастворимые основания называют щелочами*.
* — К щелочам часто относят соединения
Сведения о растворимости оснований в воде можно найти в таблице, размещенной на форзаце 2 учебника. Ее называют таблицей растворимости. Приводим соответствующий фрагмент этой таблицы:
Растворимость некоторых оснований в воде при температуре 20—25 °С
Буквой «р» обозначены растворимые основания (щелочи), «м» —малорастворимые, «н>> — нерастворимые. Прочерк «— » означает, что такого основания не существует.
Щелочи и их растворы мылки на ощупь, разъедают многие материалы, вызывают серьезные ожоги кожи, слизистых оболочек, сильно поражают глаза (рис. 21). Поэтому натрий гидроксид в прошлом получил название «едкий натр», а калий гидроксид — «едкое кали ».
Работая со щелочами и их растворами, будьте особенно осторожны. Если раствор щелочи попал на руку, немедленно смойте его большим количеством проточной воды и обратитесь за помощью к учителю или лаборанту. Вы получите у них разбавленный раствор определенного вещества (например, уксусной кислоты), которым нужно обработать кожу для удаления остатков щелочи. После этого руку тщательно промойте водой.
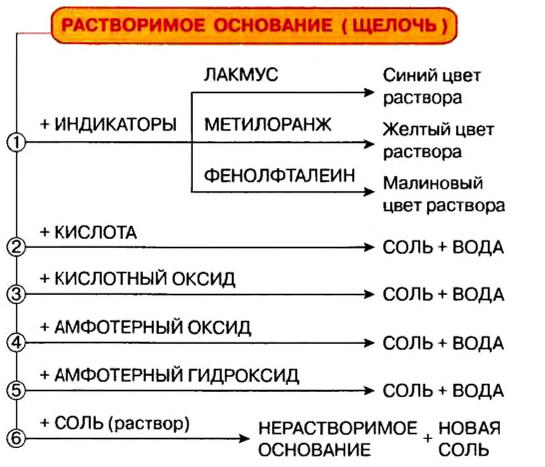
Химические свойства оснований:
Возможность протекания многих реакций с участием оснований зависит от растворимости этих соединений в воде. Щелочи в химических превращениях значительно более активны, чем нерастворимые основания, которые, например, с солями и некоторыми кислотами не реагируют.
Действие на индикаторы:
Растворы щелочей способны изменять окраску особых веществ — индикаторов*. Эти вещества были обнаружены в некоторых плодах и цветах. В настоящее время используют индикаторы, которые производят на химических заводах. Они более эффективны, чем природные, и лучше сохраняются.
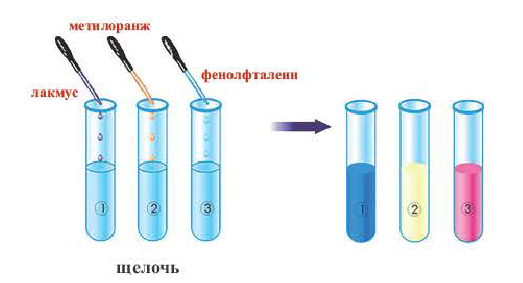
К важнейшим индикаторам относятся лакмус, фенолфталеин, метиловый оранжевый (сокращенное название — метилоранж), а также универсальный индикатор. Последний является смесью нескольких веществ. Эта смесь, в отличие от отдельных веществ-индикаторов, изменяет цвет не только в присутствии щелочи, но и в зависимости от ее количества в растворе.
В химических лабораториях применяют водные растворы метилоранжа и лакмуса, водно-спиртовый раствор фенолфталеина. Очень удобна в использовании так называемая индикаторная бумага. Это — специальная бумага, пропитанная раствором индикатора, а затем высушенная и нарезанная маленькими полосками (рис. 22). Существует также индикаторная бумага, пропитанная раствором лакмуса или фенолфталеина.
Изменение окраски индикатора (рис. 23) является следствием его реакции со щелочью.
* — Термин происходит от латинского слова indico — указываю, определяю.
Уравнения таких реакций не приводим, поскольку формулы индикаторов и продуктов их химических превращений довольно сложные.
Нерастворимые основания на индикаторы не действуют.
Реакции с кислотными оксидами
Растворимые и нерастворимые основания взаимодействуют с соединениями противоположного характера, т. е. имеющими кислотные свойства. Среди этих соединений — кислотные оксиды. Соответствующие реакции были рассмотрены в предыдущем параграфе. Приводим дополнительные примеры:
Реакции с кислотами
При взаимодействии основания с кислотой вещества обмениваются своими составными частями:
Это — реакция обмена.
Выяснить, осталась ли щелочь после добавления определенной порции кислоты, можно, добавив к жидкости 1 — 2 капли раствора фенолфталеина. Если малиновый цвет не появился, то щелочь полностью прореагировала с кислотой.
Пример реакции нерастворимого основания с кислотой:
Реакцию между основанием и кислотой называют реакцией нейтрализации.
Выяснить, осталась ли щелочь после добавления определенной порции кислоты, можно, добавив к жидкости 1 — 2 капли раствора фенолфталеина. Если малиновый цвет не появился, то щелочь полностью прореагировала с кислотой.
Пример реакции нерастворимого основания с кислотой:
Мп(ОН)2 + 2HN03 = Mn(N03)2 + 2Н20.
Реакцию между основанием и кислотой называют реакцией нейтрализации.
Реакции щелочей с солями
Это — реакции обмена. Они происходят в растворе, причем исходная соль должна быть растворимой, а новое основание или новая соль — нерастворимыми.
Выясним возможность реакции между натрий гидроксидом и манган(II) нитратом:
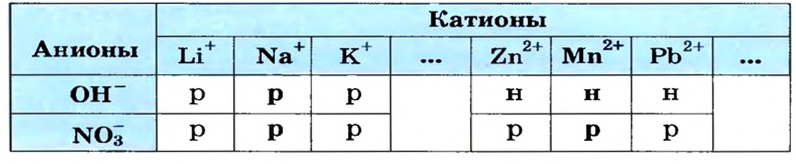
Воспользуемся таблицей растворимости (приводим ее фрагмент):
Как видим, соль 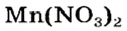
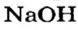
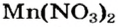
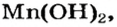
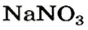
Термическое разложение
Почти все основания (кроме гидроксидов Натрия и Калия) при нагревании разлагаются на соответствующий оксид и воду (водяной пар):
Взрослым известна жидкость под названием «нашатырный спирт». Это — водный раствор газа аммиака 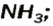
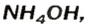
в которую вступает небольшая часть растворенного аммиака, и одновременно разлагается на исходные вещества. На это указывает знак 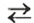
Аммоний гидроксид подобно щелочам (NaOH, КОН и др.) изменяет окраску индикаторов, взаимодействует с кислотными оксидами, кислотами, солями:
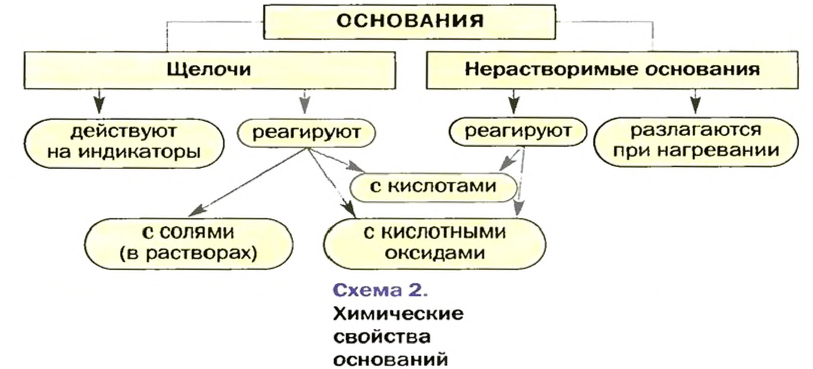
Изложенный материал обобщен в схеме 2.
Применение оснований
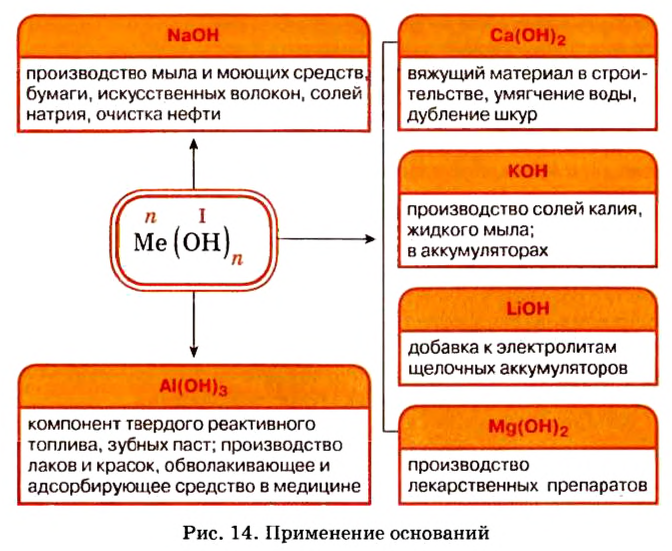
Широкое применение среди оснований получили щелочи, прежде всего гидроксиды Кальция и Натрия.
Вам известно, что вещество, называемое гашеной известью, является кальций гидроксидом 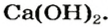
Натрий гидроксид используют при производстве мыла (осуществляют реакции щелочи с жирами), лекарств, в кожевенной промышленности, для очистки нефти и т. д.
Выводы:
Основания — твердые вещества ионного строения. Большинство оснований не растворяется в воде. Водорастворимые основания называют щелочами. Щелочи изменяют окраску особых веществ — индикаторов.
Основания взаимодействуют с кислотными оксидами и кислотами с образованием солей и воды. Щелочи реагируют и с солями; продукты каждой реакции — другие основание и соль. Нерастворимые основания разлагаются при нагревании на соответствующие оксиды и воду.
Реакцию между основанием и кислотой называют реакцией нейтрализации. На практике используют преимущественно гидроксиды Кальция и Натрия.
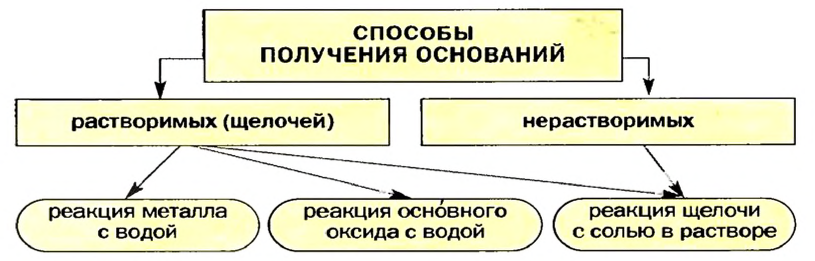
Способы получения оснований и амфотерных гидроксидов
Получение щелочей: один из способов получения щелочей основан на реакции металла с водой (рис. 40). Кроме щелочи, образуется водород:
Второй способ получения щелочей — взаимодействие основного оксида с водой:
Таким способом получают гашеную известь на заводах и непосредственно перед использованием этого вещества для строительных работ, побелки стволов деревьев:
Щелочь можно получить и с помощью реакции обмена между растворимой солью и другой щелочью (в растворе). Исходные соединения подбирают так, чтобы образовалась нерастворимая соль:
Гидроксиды Натрия и Калия производят в промышленности действием постоянного электрического тока на водные растворы хлоридов:
Этот процесс называют электролизом.
Получение нерастворимых оснований
Нерастворимое основание можно получить только с помощью реакции обмена между солью и щелочью в растворе. Поскольку основание будет выпадать в осадок, то образующаяся соль должна быть растворимой в воде (два нерастворимых соединения разделить невозможно):
Малорастворимый магний гидроксид может быть не только продуктом реакции обмена. Это соединение, как и щелочи, образуется при взаимодействии металла или оксида с водой. Правда, эти реакции происходят медленно, а первая — только при нагревании:
Изложенное обобщает схема 7.
Схема 7. Получение оснований
Получение амфотерных гидроксидов
Ввиду того что амфотерный гидроксид проявляет свойства основания и кислоты, его можно получить с помощью реакций обмена и как основание
и как кислоту
Эти превращения происходят потому, что все амфотерные гидроксиды нерастворимы в воде.
Щелочь или кислоту нельзя брать в избытке, поскольку амфотерный гидроксид реагирует с обоими соединениями. Например, при взаимодействии натрий цинка с избытком сульфатной кислоты вместо цинк гидроксида образуется цинк сульфат:
Некоторые амфотерные гидроксиды можно получить реакцией обмена между двумя солями в растворе, если одна из солей — продуктов реакции — разлагается водой (такие сведения имеются в таблице растворимости):
Выводы:
Щелочи получают взаимодействием соответствующих металлов или оксидов с водой.
Общий метод получения растворимых и нерастворимых оснований, а также амфотерных гидроксидов основан на реакции обмена между щелочью и солью в растворе. Амфотерные гидроксиды, кроме того, получают взаимодействием соответствующих солей с кислотами.
Химические свойства оснований
О действии растворов оснований на индикаторы, взаимодействие оснований с кислотными оксидами и кислотами вы узнали ранее. Вспомним соответствующие реакции.
Действие оснований на индикаторы
(Это свойство имеют лишь основания, растворимые в воде, то есть щелочи.) В растворе щелочей лакмус приобретает синий цвет, метиловый оранжевый — желтый, а фенолфталеин — малиновый. Универсальный индикатор в разбавленном растворе щелочи имеет зеленую окраску, в концентрированном — синюю и сине-фиолетовую.
Взаимодействие с кислотными оксидами
Щелочи взаимодействуют с кислотными оксидами, образовывая соль кислоты, которой отвечает взятый для реакции оксид, и воду:
Взаимодействие с кислотами (реакция нейтрализации)
Щелочи (уравнение а) и нерастворимые основания (уравнение б) взаимодействуют с кислотами, образуя соль и воду:
Следующие два свойства оснований вам еще неизвестны, поэтому для их изучения проведем химический эксперимент.
Взаимодействие щелочей с растворами солей
(Реакция происходит в том случае, если по крайней мере один из продуктов реакции выпадает в осадок или выделяется в виде газа.)
Опыт 1. Нальем в сосуд раствор сульфата железа
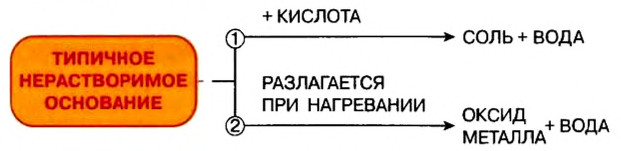
Отношение оснований к нагреванию
Щелочи устойчивы к нагреванию. Нерастворимые основания при нагревании разлагаются на оксид металла и воду.
Опыт 2. Сухую пробирку на 1/4 наполним гидроксидом меди
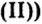
В том, что одним из продуктов этой реакции будет вода, можно удостовериться, подержав холодный предмет (например, стеклянную пластину) около отверстия пробирки.
Чтобы закрепить знания о химических свойствах оснований, выполните лабораторные опыты 3, 4, 5, 6. Прежде чем приступить к их выполнению, ознакомьтесь с мерами предосторожности во время работы со щелочами и неуклонно выполняйте их.
Меры предосторожности во время работы со щелочами:
Твердые щелочи и их растворы разъедают ткань, бумагу, вызывают ожоги кожи, глаз, что очень опасно. Поэтому обращаться с ними нужно осторожно: гранулу щелочи (вспомните, что это твердые вещества) ни в коем случае не брать руками; не разливать растворы; следить, чтобы раствор не попадал на открытые участки кожи, в глаза, на одежду, парту, книги, тетради. Вам понадобятся защитная одежда (халат, передник) и защитные очки. Посуду с раствором щелочи следует держать закрытой, чтобы она не реагировала с углекислым газом воздуха.
Если вы разлили щелочь, сразу нейтрализуйте ее уксусом. Участок кожи, на который попала щелочь, быстро промойте большим количеством воды. Если щелочь попала в глаза, немедленно промойте их медицинским раствором борной кислоты.
Итоги:
- Щелочи в химическом отношении более активны, чем нерастворимые основания, и имеют такие типичные свойства:
- Типичными химическими свойствами нерастворимых оснований является взаимодействие с кислотами и разложение при нагревании:
- Реакция нейтрализации свойственна и щелочам, и нерастворимым основаниям.
- Взаимодействие щелочи с раствором соли происходит, если среди продуктов реакции есть нерастворимые вещества.
«Для того, чтобы спаять две железные части какого-либо предмета, необходимо поверхность металла тщательным образом очистить от ржавчины, в состав которой входит гидроксид железа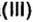
Чтобы во время травления с кислотой взаимодействовала только ржавчина, а не железо, из которого изготовлен предмет, в травильный раствор добавляют ингибиторы — вещества, которые действуют противоположно катализаторам. Они замедляют реакции, а то и совсем их прекращают. Ингибитором реакции между железом и соляной кислотой является органическое вещество уротропин.
Если вы хотя бы раз пользовались горючим под названием «сухой спирт», то имели дело со смесью уротропина с небольшим количеством парафина. Это горючее удобно тем, что быстро зажигается, легко гаснет и почти не оставляет пепла.
Понятие об амфотерных гидроксидах
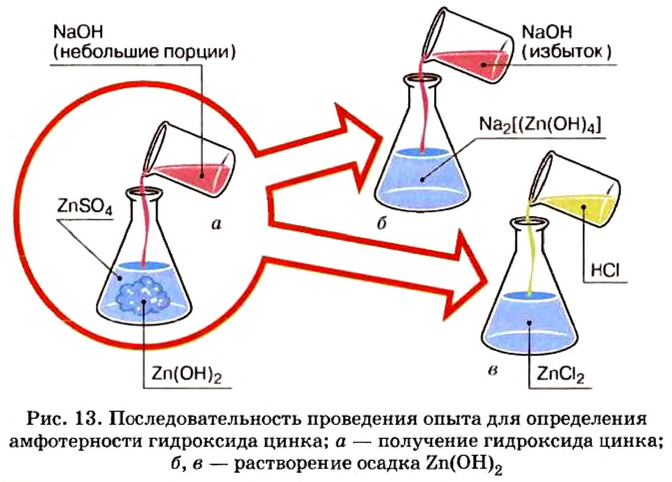
Щелочи и большинство нерастворимых оснований взаимодействуют с кислотами и не взаимодействуют с представителями своего класса. Кислоты взаимодействуют с основаниями и не взаимодействуют с другими кислотами. Проверив экспериментально, с какими веществами данное вещество взаимодействует, а с какими — нет, можно сказать: к классу оснований или к классу кислот оно относится. Это общее правило. Однако оно имеет исключение, понять которое нам помогут опыты с гидроксидом цинка.
По способности растворяться в воде это вещество принадлежит к нерастворимым основаниям. Единственным способом получения нерастворимых оснований является взаимодействие растворимой соли соответствующего металла с раствором щелочи. Одним из продуктов этого взаимодействия будет нерастворимое основание.
Опыт 1. Нальем в колбу раствор сульфата цинка и добавим к нему небольшими порциями раствор гидроксида натрия, пока в колбе не образуется белый осадок (рис. 13):
Образовавшийся осадок разделим, поместим в 2 колбы и проведем следующие опыты.
Опыт 2. В первую колбу с гидроксидом цинка добавим соляной кислоты. Осадок сразу исчезает, что является признаком химического явления:
Обратимся к таблице растворимости и увидим, что образовавшаяся соль хлорид цинка — растворимое в воде соединение.
Произошла реакция нейтрализации, в которой гидроксид цинка проявил свойства основания.
Опыт 3. Во вторую колбу с гидроксидом цинка добавим раствор гидроксида натрия. Наблюдение показывает, что, как и в опыте с соляной кислотой, осадок исчез. Следовательно, осадок прореагировал с избытком щелочи (в опыте 1 мы прекратили доливать раствор щелочи, как только образовался осадок. При избыточном добавлении щелочи мы успели бы лишь визуально зафиксировать появление и исчезновение осадка).
Запишем уравнение проведенной реакции:
Образовалась соль натрия, в которой вместо привычного кислотного остатка есть остаток, содержащий один атом цинка и четыре (тетра — четыре) гидроксильные группы. Остаток такого вида записывают в квадратных скобках.
В этой реакции гидроксид цинка сыграл роль кислоты, потому что металлический элемент цинк после реакции вошел в состав кислотного остатка.
Гидроксиды, которые образуют соль при взаимодействии как с кислотой, так и со щелочью, называют амфотерными гидроксидами.
Повторите материал об амфотерных оксидах (§ 13) и составьте формулы амфотерных гидроксидов, которые им отвечают.
Амфотерные гидроксиды реагируют со щелочами не только в растворе, но и в расплаве:
Образовавшаяся соль имеет двухвалентный кислотный остаток 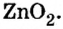
Проведенные опыты свидетельствуют, что разделение сложных неорганических веществ на оксиды, кислоты, основания и
соли не лишено исключений. Бывают вещества со смешанными свойствами, например амфотерные гидроксиды.
Применение оснований:
Представители этого класса неорганических веществ в природе отсутствуют. Но потребность в них существует, поэтому их получают специально. Наибольшее практическое значение имеют щелочи гидроксид натрия и гидроксид калия. Применение этих и некоторых других оснований показано на рисунке 14.
Итоги:
Получение оснований
Растворимые основания (щелочи) получают взаимодействием металла или его оксида с водой.
1. Взаимодействие активных металлов с водой приводит к образованию щелочей и выделению водорода:
(К какому типу относятся эти реакции?)
2. Взаимодействие оксидов активных металлов с водой завершается образованием растворимого в воде гидроксида — щелочи:
(Какой это тип реакции?)
3. В промышленности щелочи получают электролизом водных растворов бескислородных кислот. Этот способ вы будете изучать в следующем классе.
4. Нерастворимые основания получают действием раствора щелочи на растворимую соль соответствующего металла:
Классификация, номенклатура и получение оснований
Поместите в керамический тигель немного карбоната кальция (известняка) и в течение 10 минут раскалите на огне спиртовки.
После того как тигель остынет, влейте поверх него немного дистиллированной воды, Затем помешивайте стеклянной палочкой и проверьте красной лакмусовой бумагой. Что вы наблюдаете? Обсудите свои соображения с товарищами. Запишите уравнения реакций.
Сложные вещества, в составе которых содержатся одна или несколько гидроксильных групп (ОН), соединенных с атомами металлов, называются основаниями. Основания обозначаются общей формулой Me(OH)n
Гидроксильная группа ОН всегда одновалентна. Число гидроксильных групп соответствует валентности металла.
Классификация:
Основания классифицируются по своей растворимости в воде и кислотности.
Растворимые в воде основания называют щелочами. Кроме Li, Na, К, Rb, Cs, Ca, Sr, Ba, гидроксиды других металлов не растворяются или очень мало растворяются в воде. Часть нерастворимых в воде оснований обладает амфотерными (двойственными) свойствами.
Основания, вступающие в реакцию как с кислотами, так и с щелочами, образуя соль и воду, называются амфотерными основаниями: Zn (ОН)2, Be (OH)2, Al (OH)3, Fe (OH)3.
Число гидроксильных групп в составе оснований определяет их кислотность.
Номенклатура:
При наименовании оснований по международной номенклатуре, если металл, образующий основание, имеет постоянную валентность, то вначале указывается слово «гидроксид», а затем название металла. Если же металл обладает переменной валентностью, то после слова «гидроксид» и названия металла валентность отмечают римскими цифрами в скобках.
| Основания металлов с постоянной валентностью | Основания металлов с постоянной валентностью | ||
| Гидроксид металла | Международное название | Гидроксид металла | Международное название |
| Mg(OH)2 | Гидроксид магния | Pb(OH)2 | Гидроксид свинца (II) |
| NaOH | Гидроксид натрия | Cr(OH)3 | Гидроксид хрома (III) |
| Al(OH)3 | Гидроксид алюминия | CuOH | Гидроксид меди (I) |
Графические формулы оснований:
Получение растворимых в воде оснований
Получение в лабораторных условиях.
При взаимодействии активных металлов (щелочных металлов Li, Na, К, Rh, Cs и щелочноземельных металлов Ca, Sr, Ba) с водой. Эти реакции протекают в обычных условиях.
металл + вода → щелочь + H2 ↑
2Li + 2HОH → 2LiOH + H2 ↑
При взаимодействии в обычных условиях гидридов щелочных (NaH3 КН) и щелочноземельных металлов(CaH2, BaH2) с водой.
гидрид металла + вода → щелочь + H2↑
NaH + H2O → NaOH + H2↑
CaH2 + 2H2O → Ca(OH) 2 + 2H2
При взаимодействии оксидов щелочных и щелочноземельных металлов с водой.
оксид металла + вода → щелочь
Na2O + H2O → 2NaOH
CaO + H2O → Ca(OH)2
Получение нерастворимых в воде оснований
При добавлении в раствор растворимой соли среднеактивных и пассивных металлов щелочи. Получение растворимых в воде оснований этим методом возможно в том случае, если в результате реакции получится нерастворимая соль.
FeCh + ЗКОН → Fe(OH)3↓ + 3 KCl
Na2SO4 + Ba(OH)2 → BaSO4↓ + 2NaOH
Получение в промышленности
Путем воздействия постоянного электрического тока на водные растворы хлоридов щелочных и щелочноземельных металлов.
2NaCl + 2H2O
Физические и химические свойства оснований
Определите основания по цвету раствора и осадка в пробирке. Какие физические и химические свойства имеют основания?
Физические свойства: В обычных условиях щелочи это растворимые в воде твердые вещества белого цвета. Некоторые нерастворимые в воде основания имеют другие цвета. Cu(OH)2 голубого, CuOH желтого, Fe(OH)3 бурого, Fe(ОН)2 зеленовато-бурого, Сг(ОН)3 серовато-зеленого цвета.
Все щелочи бывают скользкие как мыло. При растворении в воде они образуют бесцветный раствор.
На рисунке показывается, как меняется цвет индикаторов под действием щелочей. Нерастворимые в воде основания не меняют окраску индикаторов.
Слово «индико» в переводе с латинского означает «показываю», «определяю». Индикаторы это сложные органические соединения. Для определения щелочей (а также кислот) используют такие индикаторы, как лакмус, фенолфталеин и метилоранж.
Химические свойства: Взаимодействие оснований с кислотами (реакция нейтрализации). Для всех оснований характерным химическим свойством является их взаимодействие с кислотами. При взаимодействии кислот с основаниями образуются соль и вода.
Cu(OH)2 + 2HNO3 → Cu(NO3)2 +2H2O
 |
Нальем в химический стакан (или колбу) на 1/4 раствора гидроксида натрия и добавим к нему 1 2 капли лакмуса. Затем к полученному раствору будем прикатывать раствор соляной кислоты. Понаблюдайте, как меняется цвет. Запишите уравнение реакции. |
Взаимодействие щелочей с амфотерными металлами. Из металлов щелочи взаимодействуют только с амфотерными металлами (Be, Zn, Al), при этом образуется соль и выделяется водород.
Zn+ 2NaOH 
2Al + 2NaOH + 2H2O
Взаимодействие щелочей с неметаллами. Щелочи взаимодействуют с целым рядом неметаллов (CL, Br2), образуя соль и воду. Лишь при взаимодействии с кремнием выделяется водород.
Si+ 2NaOH +H2O
Щелочам и нерастворимым в воде основаниям присущи и отличающие их друг от друга химические свойства.
Взаимодействие щелочей с кислотными оксидами. Щелочи вступают в реакцию с кислотными оксидами, а нерастворимые в воде основания не вступают в такую реакцию. 1 моль таких кислотных оксидов, как CO2, S02, SO2, вступает в реакцию соединения с 1 молем однокислотной щелочи.
CO2+NaOH → NaHCO3
Хранить щелочи в открытой посуде нельзя. Потому что при вступлении в реакцию с углекислым газам воздуха образуются соответствующие карбонаты.
В этих реакциях даже в том случае, если кислотного оксида берется в избытке, реакция соединения всё равно происходит. При избытке щелочи, например, в соотношении молей 1:2, получится нормальная соль и вода.
CO2 + 2NaOH → Na2CO3 +H2O
Такие кислотные оксиды, как CO2, SO2, SO2, в зависимости от мольного соотношения, вступают в различные реакции с двухкислотными щелочами, при этом получаются различные продукты.
CO2 + Ca(OH)2 → СаСО3↓ + H2O 2CO2 + Ca(OH)2 → Ca(HCO3)2
Из кислотных оксидов NO2 при взаимодействии с щелочами образует две различные соли.
2NO2 + 2NaOH → NaNO3 + NaNO2 +H2O
Взаимодействие щелочей с амфотерными оксидами и гидроксидами. Щелочи также взаимодействуют с амфотерными оксидами и гидроксидами, образуя соль и воду.
Разложение оснований. В то время как щелочи не разлагаются, нерастворимые в воде основания при нагревании разлагаются. Самыми неустойчивыми основаниями являются гидроксиды серебра и ртути. Они подвергаются разложению при комнатной температуре.
Hg(OH)2 → HgO+ H2O
Задача:
При размешивании растворов, как показано на рисунке, то в I сосуде красный цвет лакмуса превратится в голубой, а во II сосуде голубой цвет превратится в красный. На основе этих данных определите, какое из веществ X, Y, Z является кислотой, а какие основанием?
| Кислота | Основание |
| A) X, Y | Z |
| В) Y, Z | X |
| С) Y | X, Z |
| D) Z | X, Y |
| Е) X | Y, Z |
Решение: Если в I сосуде красный цвет лакмуса превращается в голубой, то Х→кислота, a Y→ щелочь.
А во II сосуде голубой цвет лакмуса превращается в красный, значит, Z→ щелочь, a X→ кислота.
Ответ: E
Задача:
Какие выражения верные, если в результате реакции получается нерастворимая в воде соль?
1) Формула полученной соли: YxAb
2) Получится х+b моль Н2О
3) x
4) Продукты реакции проводят электрический ток
5) Полученный в реакции v (H2O)=x=b
| Вступившие в реакцию вещества | v (моль) |
| HxA кислота | a |
| Y(OH)b основание | a |
Решение: HxA + Y(OH)b→ YxAb+ xH2O (или b H2O).
Ответ: 1:5. Согласно условиям, поскольку соль YxAb нерастворимая в воде соль, то она не проводит электрический ток.
Задача:
Что можно определить на основе таблицы?
1) Массу оксида
2) Ar (X)
3) Степень окисления X в оксиде.
| Вещества, полностью вступившие в реакцию | Продукт реакции | |
| X | O2 | XO |
| 4 г | 1,6 г |
Решение:
m(ХО) = 4+1,6 = 5,6г; 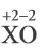
Ответ: 1,2,3
Задача:
| Вещества, вступившие в реакцию, и их мольное количество | Масса полученной соли (в г) | N (атом) в молекуле полученной соли (в целом) | |
| Fe(OH)3 | HNO3 | ||
| 1 | xl | yl | z1 |
| x2 | y2 | z2 | |
| x3 | y3 | z3 |
| 1 | 2 | |
A) х1 х2 х2 х3 х3 |
z1 z2 z2 z3 z3 |
|
В) х3 х2 х2 х1 х1 |
z1 z2 z2 z3 z3 |
|
С) х1 х2 х2 х3 х3 |
z3 z2 z2 z1 z1 |
|
D) x2 x1 x1 x3 x3 |
z2 z1 z1 z3 z3 |
|
Е) х3 х2 х2 х1 х1 |
z3 z2 z2 z1 z1 |
Если y3





Решение:
Ответ: E x3



- Кислоты в химии
- Соли в химии
- Хлор в химии
- Сера в химии
- Вода в химии и её элементный состав, молекулярное строение, формула и молярная масса
- Железо как химический элемент
- Озон как химический элемент
- Оксиды в химии
Таблица и формулы оснований.
Таблица и формулы оснований (1 часть):
| Формула основания | Название основания |
| Al(OH)3 | Гидроксид алюминия |
| NH3·H2O | Гидроксид аммония (Гидрат аммиака) |
| Ba(OH)2 | Гидроксид бария |
| Be(OH)2 | Гидроксид бериллия |
| Bi(NO3)3 | Гидроксид висмута (III) |
| Ga(OH)3 | Гидроксид галлия (III) |
| Ge(OH)4 | Гидроксид германия (IV) |
| Fe(OH)2 | Гидроксид железа (II) |
| Fe(OH)3 | Гидроксид железа (III) |
| In(OH)3 | Гидроксид индия (III) |
| KOH | Гидроксид калия |
| Ca(OH)2 | Гидроксид кальция |
| LiOH | Гидроксид лития |
| Mg(OH)2 | Гидроксид магния |
| Mn(OH)2 | Гидроксид марганца (II) |
| Mn(OH)4 | Гидроксид марганца (IV) |
| Mo(OH)3 | Гидроксид молибдена (III) |
| MoO(OH)3 | Гидроксид молибдена (V) |
| NaOH | Гидроксид натрия |
| Ni(OH)2 | Гидроксид никеля |
Таблица и формулы оснований (2 часть):
| Sn(OH)2 | Гидроксид олова (II) |
| RbOH | Гидроксид рубидия |
| Pb(OH)2 | Гидроксид свинца |
| Sc(OH)3 | Гидроксид скандия (III) |
| Sr(OH)2 | Гидроксид стронция |
| TlOH | Гидроксид таллия (I) |
| Ti(OH)2 | Гидроксид титана (II) |
| Ti(OH)3 | Гидроксид титана с |
| CsOH | Гидроксид цезия |
| Ce(OH)3 | Гидроксид церия (III) |
| Ce(OH)4 | Гидроксид церия (IV) |
| Zn(OH)2 | Гидроксид цинка |
| Сr(OH)2 | Гидроксид хрома (II) |
| Сr(OH)3 | Гидроксид хрома (III) |
| TiO(OH)2 | Дигидроксид-оксид титана |
| AlO(OH) | Метагидроксид алюминия |
| GaO(OH) | Метагидроксид галлия |
| FeO(OH) | Метагидроксид железа |
| ScO(OH) | Метагидроксид скандия |
| CrO(OH) | Метагидроксид хрома |
| MoO(OH)3 | Тригидроксид-оксид молибдена |
Коэффициент востребованности
11 704