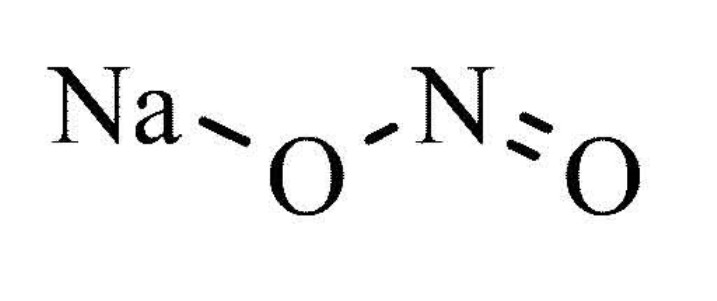From Wikipedia, the free encyclopedia

|
||
|
||
| Names | ||
|---|---|---|
| IUPAC name
Nitrite |
||
| Systematic IUPAC name
dioxidonitrate(1−) |
||
| Other names
nitrite |
||
| Identifiers | ||
|
CAS Number |
|
|
|
3D model (JSmol) |
|
|
| ChEBI |
|
|
| ChemSpider |
|
|
| EC Number |
|
|
|
PubChem CID |
|
|
| UNII |
|
|
|
InChI
|
||
|
SMILES
|
||
| Properties | ||
|
Chemical formula |
NO− 2 |
|
| Molar mass | 46.005 g·mol−1 | |
| Conjugate acid | Nitrous acid | |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa). Infobox references |
The nitrite ion has the chemical formula NO−
2. Nitrite (mostly sodium nitrite) is widely used throughout chemical and pharmaceutical industries.[1] The nitrite anion is a pervasive intermediate in the nitrogen cycle in nature. The name nitrite also refers to organic compounds having the –ONO group, which are esters of nitrous acid.
Production[edit]
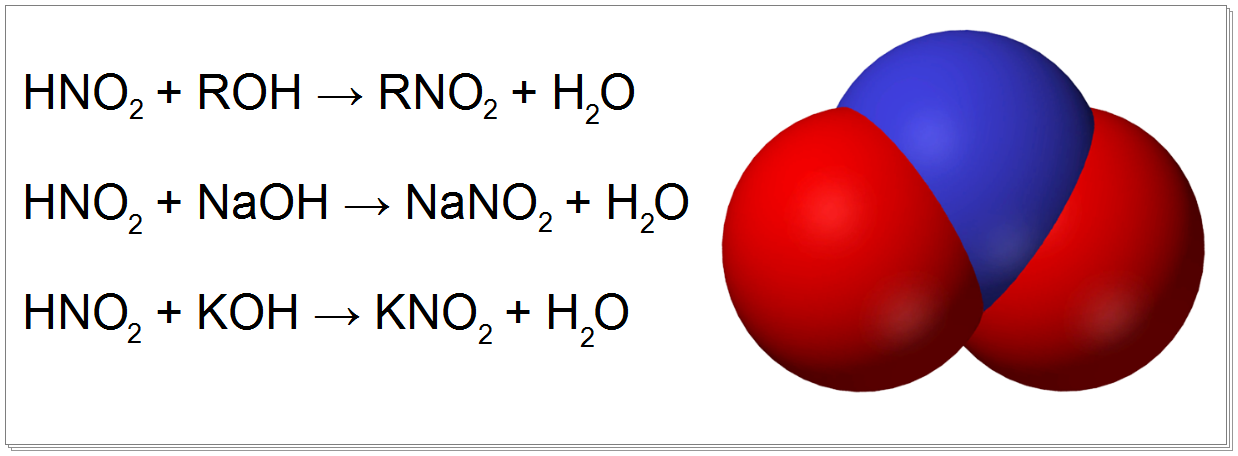
Sodium nitrite is made industrially by passing a mixture of nitrogen oxides into aqueous sodium hydroxide or sodium carbonate solution:[2][1]
- NO + NO2 + 2 NaOH → 2 NaNO2 + H2O
- NO + NO2 + Na2CO3 → 2 NaNO2 + CO2
The product is purified by recrystallization. Alkali metal nitrites are thermally stable up to and beyond their melting point (441 °C for KNO2). Ammonium nitrite can be made from dinitrogen trioxide, N2O3, which is formally the anhydride of nitrous acid:
- 2 NH3 + H2O + N2O3 → 2 NH4NO2
Structure[edit]
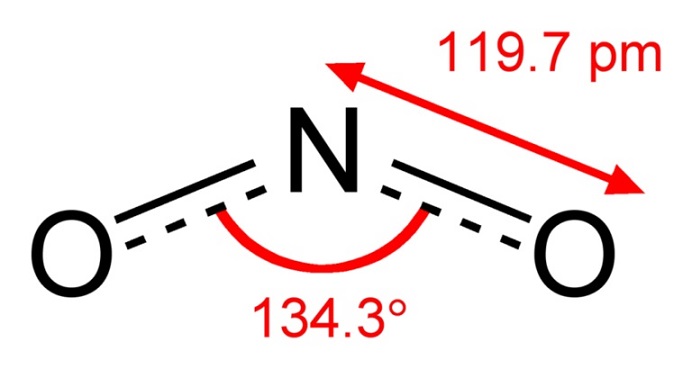
The nitrite ion has a symmetrical structure (C2v symmetry), with both N–O bonds having equal length and a bond angle of about 115°. In valence bond theory, it is described as a resonance hybrid with equal contributions from two canonical forms that are mirror images of each other. In molecular orbital theory, there is a sigma bond between each oxygen atom and the nitrogen atom, and a delocalized pi bond made from the p orbitals on nitrogen and oxygen atoms which is perpendicular to the plane of the molecule. The negative charge of the ion is equally distributed on the two oxygen atoms. Both nitrogen and oxygen atoms carry a lone pair of electrons. Therefore, the nitrite ion is a Lewis base.
Reactions[edit]
Acid-base properties[edit]
Nitrite is the conjugate base of the weak acid nitrous acid:
- HNO2 ⇌ H+ + NO−
2; pKa ≈ 3.3 at 18 °C[3]
Nitrous acid is also highly volatile – in the gas phase it exists predominantly as a trans-planar molecule. In solution, it is unstable with respect to the disproportionation reaction:
- 3 HNO2 (aq) ⇌ H3O+ + NO−
3 + 2 NO
This reaction is slow at 0 °C.[2] Addition of acid to a solution of a nitrite in the presence of a reducing agent, such as iron(II), is a way to make nitric oxide (NO) in the laboratory.
Oxidation and reduction[edit]
The formal oxidation state of the nitrogen atom in nitrite is +3. This means that it can be either oxidized to oxidation states +4 and +5, or reduced to oxidation states as low as −3. Standard reduction potentials for reactions directly involving nitrous acid are shown in the table below:[4]
-
Half-reaction E0 (V) NO−
3 + 3 H+ + 2 e− ⇌ HNO2 + H2O+0.94 2 HNO2 + 4 H+ + 4 e− ⇌ H2N2O2 + 2 H2O +0.86 N2O4 + 2 H+ + 2 e− ⇌ 2 HNO2 +1.065 2 HNO2+ 4 H+ + 4 e− ⇌ N2O + 3 H2O +1.29
The data can be extended to include products in lower oxidation states. For example:
- H2N2O2 + 2 H+ + 2 e− ⇌ N2 + 2 H2O; E0 = +2.65 V
Oxidation reactions usually result in the formation of the nitrate ion, with nitrogen in oxidation state +5. For example, oxidation with permanganate ion can be used for quantitative analysis of nitrite (by titration):
- 5 NO−
2 + 2 MnO−
4 + 6 H+ → 5 NO−
3 + 2 Mn2+ + 3 H2O
The product of reduction reactions with nitrite ion are varied, depending on the reducing agent used and its strength. With sulfur dioxide, the products are NO and N2O; with tin(II) (Sn2+) the product is hyponitrous acid (H2N2O2); reduction all the way to ammonia (NH3) occurs with hydrogen sulfide. With the hydrazinium cation (N
2H+
5) the product of nitrite reduction is hydrazoic acid (HN3), an instable and explosive compound:
- HNO2 + N
2H+
5 → HN3 + H2O + H3O+
which can also further react with nitrite:
- HNO2 + HN3 → N2O + N2 + H2O
This reaction is unusual in that it involves compounds with nitrogen in four different oxidation states.[2]
Analysis of nitrite[edit]
Nitrite is detected and analyzed by the Griess Reaction, involving the formation of a deep red-colored azo dye upon treatment of a NO−
2-containing sample with sulfanilic acid and naphthyl-1-amine in the presence of acid.[5]
Coordination complexes[edit]
Nitrite is an ambidentate ligand and can form a wide variety of coordination complexes by binding to metal ions in several ways.[2] Two examples are the red nitrito complex [Co(NH3)5(ONO)]2+ is metastable, isomerizing to the yellow nitro complex [Co(NH3)5(NO2)]2+. Nitrite is processed by several enzymes, all of which utilize coordination complexes.
Biochemistry[edit]
A schematic representation of the microbial nitrogen cycle.[6][7] ANAMMOX is anaerobic ammonium oxidation, DNRA is dissimilatory nitrate reduction to ammonium, and COMMAMOX is complete ammonium oxidation.
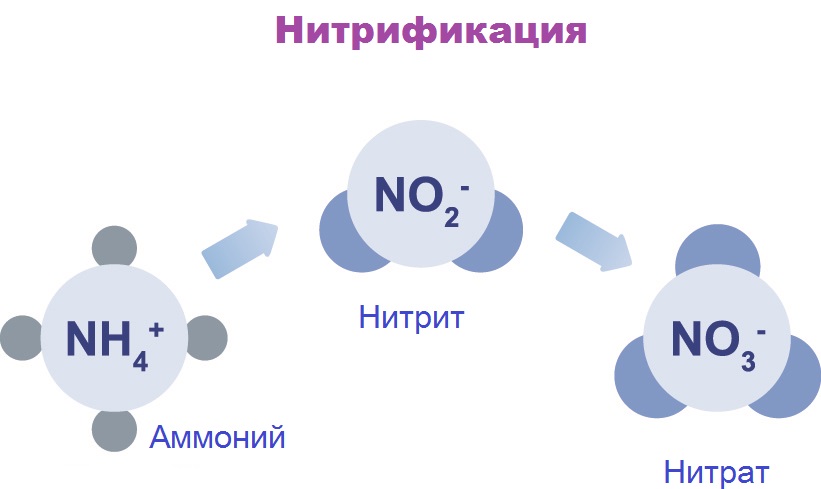
In nitrification, ammonium is converted to nitrite. Important species include Nitrosomonas. Other bacterial species such as Nitrobacter, are responsible for the oxidation of the nitrite into nitrate.
Nitrite can be reduced to nitric oxide or ammonia by many species of bacteria. Under hypoxic conditions, nitrite may release nitric oxide, which causes potent vasodilation. Several mechanisms for nitrite conversion to NO have been described, including enzymatic reduction by xanthine oxidoreductase, nitrite reductase, and NO synthase (NOS), as well as nonenzymatic acidic disproportionation reactions.
Uses[edit]
Chemical precursor[edit]
Azo dyes and other colorants are prepared by the process called diazotization, which requires nitrite.[1]
Nitrite in food preservation and biochemistry[edit]
Sodium nitrite is used to speed up the curing of meat and also impart an attractive colour.[8] A 2018 study by the British Meat Producers Association determined that legally permitted levels of nitrite have no effect on the growth of the Clostridium botulinum bacteria which causes botulism, in line with the UK’s Advisory Committee on the Microbiological Safety of Food opinion that nitrites are not required to prevent Clostridium botulinum growth and extend shelf life.[9] In the U.S., meat cannot be labeled as «cured» without the addition of nitrite.[10][11][12] In some countries, cured-meat products are manufactured without nitrate or nitrite, and without nitrite from vegetable source. Parma ham, produced without nitrite since 1993, was reported in 2018 to have caused no cases of botulism.[8]
In mice, food rich in nitrites together with unsaturated fats can prevent hypertension, which is one explanation for the apparent health effect of the Mediterranean diet.[13] However, adding nitrites to meat has been shown to generate known carcinogens; the World Health Organization (WHO) advises that eating 50 g (1.8 oz) of nitrite processed meat a day would raise the risk of getting bowel cancer by 18% over a lifetime.[8]
The recommended maximum limits by the World Health Organization in drinking water are 3 mg L−1 and 50 mg L−1 for nitrite and nitrate ions, respectively.[14]
Curing of meat[edit]
In a reaction with the meat’s myoglobin, nitrite gives the product a desirable pink-red «fresh» color, such as with corned beef. In the US, nitrite has been formally used since 1925. According to scientists working for the industry group American Meat Institute, this use of nitrite started in the Middle Ages.[15] Historians[16] and epidemiologists[17] argue that the widespread use of nitrite in meat-curing is closely linked to the development of industrial meat-processing. French investigative journalist Guillaume Coudray asserts that the meat industry chooses to cure its meats with nitrite even though it is established that this chemical gives rise to cancer-causing nitroso-compounds.[18]
Antidote for cyanide poisoning[edit]
Nitrites in the form of sodium nitrite and amyl nitrite are components of many cyanide antidote kits.[19] Both of these compounds bind to hemoglobin and oxidize the Fe2+ ions to Fe3+ ions forming methemoglobin. Methemoglobin in turn binds to cyanide (CN) creating cyanmethemoglobin, effectively removing cyanide from the complex IV of the electron transport chain (ETC) in mitochondria, which is the primary site of disruption caused by cyanide. Another mechanism by which nitrites are useful in treating cyanide toxicity is the generation of nitric oxide (NO). NO displaces the CN from the cytochrome c oxidase (ETC complex IV), making it available for methemoglobin to bind.[20]
Organic nitrites[edit]
In organic chemistry, alkyl nitrites are esters of nitrous acid and contain the nitrosoxy functional group. Nitro compounds contain the C–NO2 group. Nitrites have the general formula RONO, where R is an aryl or alkyl group. Amyl nitrite and other alkyl nitrites have a vasodilating action and must be handled in the laboratory with caution. They are sometimes used in medicine for the treatment of heart diseases. A classic named reaction for the synthesis of alkyl nitrites is the Meyer synthesis[21][22] in which alkyl halides react with metallic nitrites to a mixture to nitroalkanes and nitrites.
Safety[edit]
Nitrites salts can react with secondary amines to produce N-nitrosamines, which are suspected to cause stomach cancer. The World Health Organization (WHO) advises that each 50 g (1.8 oz) of processed meat eaten a day would raise the risk of getting bowel cancer by 18% over a lifetime; processed meat refers to meat that has been transformed through fermentation, nitrite curing, salting, smoking, or other processes to enhance flavor or improve preservation. The World Health Organization’s review of more than 400 studies concluded, in 2015, that there was sufficient evidence that processed meats caused cancer, particularly colon cancer; the WHO’s International Agency for Research on Cancer (IARC) classified processed meats as carcinogenic to humans (Group 1).[8][23]
Nitrite (ingested) under conditions that result in endogenous nitrosation, specifically the production of nitrosamine, has been classified as Probably carcinogenic to humans (Group 2A) by the IARC.[24][25]
See also[edit]
- Curing (food preservation)
- Alkyl nitrites
References[edit]
- ^ a b c Laue W, Thiemann M, Scheibler E, Wiegand KW (2006). «Nitrates and Nitrites». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a17_265.
- ^ a b c d Greenwood, pp. 461–464.
- ^ IUPAC SC-Database Archived 19 June 2017 at the Wayback Machine A comprehensive database of published data on equilibrium constants of metal complexes and ligands
- ^ Greenwood, p. 431.
- ^ Ivanov, V. M. (1 October 2004). «The 125th Anniversary of the Griess Reagent». Journal of Analytical Chemistry. 59 (10): 1002–1005. doi:10.1023/B:JANC.0000043920.77446.d7. ISSN 1608-3199. S2CID 98768756.
- ^ Sparacino-Watkins, Courtney; Stolz, John F.; Basu, Partha (16 December 2013). «Nitrate and periplasmic nitrate reductases». Chem. Soc. Rev. 43 (2): 676–706. doi:10.1039/c3cs60249d. ISSN 1460-4744. PMC 4080430. PMID 24141308.
- ^ Simon, Jörg; Klotz, Martin G. (2013). «Diversity and evolution of bioenergetic systems involved in microbial nitrogen compound transformations». Biochimica et Biophysica Acta (BBA) — Bioenergetics. 1827 (2): 114–135. doi:10.1016/j.bbabio.2012.07.005. PMID 22842521.
- ^ a b c d Wilson, Bee (1 March 2018). «Yes, bacon really is killing us». The Guardian. London. ISSN 0261-3077. Archived from the original on 10 February 2021. Retrieved 14 February 2021.
In trade journals of the 1960s, the firms who sold nitrite powders to ham-makers spoke quite openly about how the main advantage was to increase profit margins by speeding up production.
- ^ Doward, Jamie (23 March 2019). «Revealed: no need to add cancer-risk nitrites to ham». The Observer. London. Archived from the original on 26 January 2021. Retrieved 14 February 2021.
The results show that there is no change in levels of inoculated C. botulinum over the curing process, which implies that the action of nitrite during curing is not toxic to C. botulinum spores at levels of 150ppm [parts per million] ingoing nitrite and below.
- ^ De Vries, John (1997). Food Safety and Toxicity. CRC Press. p. 70. ISBN 978-0-8493-9488-1.
- ^ sodium nitrite and nitrate facts Accessed 12 Dec 2014
- ^ Doyle, Michael P.; Sperber, William H. (23 September 2009). Compendium of the Microbiological Spoilage of Foods and Beverages. p. 78. ISBN 9781441908261.
- ^ Charles, R. L.; Rudyk, O.; Prysyazhna, O.; Kamynina, A.; Yang, J.; Morisseau, C.; Hammock, B. D.; Freeman, B. A.; Eaton, P. (2014). «Protection from hypertension in mice by the Mediterranean diet is mediated by nitro fatty acid inhibition of soluble epoxide hydrolase». Proceedings of the National Academy of Sciences. 111 (22): 8167–72. Bibcode:2014PNAS..111.8167C. doi:10.1073/pnas.1402965111. PMC 4050620. PMID 24843165.
- ^ Bagheri, H.; Hajian, A.; Rezaei, M.; Shirzadmehr, A. (2017). «Composite of Cu metal nanoparticles—multiwall carbon nanotubes—reduced graphene oxide as a novel and high performance platform of the electrochemical sensor for simultaneous determination of nitrite and nitrate». Journal of Hazardous Materials. 324 (Pt B): 762–772. doi:10.1016/j.jhazmat.2016.11.055. PMID 27894754.
- ^ Binkerd, E. F.; Kolari, O. E. (1 January 1975). «The history and use of nitrate and nitrite in the curing of meat». Food and Cosmetics Toxicology. 13 (6): 655–661. doi:10.1016/0015-6264(75)90157-1. ISSN 0015-6264. PMID 1107192.
- ^ coudray, guillaume, eric (2017). Cochonneries : comment la charcuterie est devenue un poison. paris: Decouverte. pp. part I, chapter 2 (p. 40–55) and chapter 3 (p. 56–70). ISBN 9782707193582. OCLC 1011036745.
- ^ Lauer, Klaus (1 January 1991). «The history of nitrite in human nutrition: A contribution from German cookery books». Journal of Clinical Epidemiology. 44 (3): 261–264. doi:10.1016/0895-4356(91)90037-A. ISSN 0895-4356. PMID 1999685.
- ^ «Guillaume Coudray on the Nitro Meat Cancer Connection». 14 April 2021.
- ^ Meillier, Andrew; Heller, Cara (2015). «Acute Cyanide Poisoning: Hydroxocobalamin and Sodium Thiosulfate Treatments with Two Outcomes following One Exposure Event». Case Reports in Medicine. 2015: 217951. doi:10.1155/2015/217951. ISSN 1687-9627. PMC 4620268. PMID 26543483.
- ^ Bebarta, Vikhyat S.; Brittain, Matthew; Chan, Adriano; Garrett, Norma; Yoon, David; Burney, Tanya; Mukai, David; Babin, Michael; Pilz, Renate B.; Mahon, Sari B.; Brenner, Matthew (June 2017). «Sodium Nitrite and Sodium Thiosulfate Are Effective Against Acute Cyanide Poisoning when Administered by Intramuscular Injection». Annals of Emergency Medicine. 69 (6): 718–725.e4. doi:10.1016/j.annemergmed.2016.09.034. ISSN 0196-0644. PMC 5446299. PMID 28041825.
- ^ Victor Meyer (1872). «Ueber die Nitroverbindungen der Fettreihe». Justus Liebig’s Annalen der Chemie. 171 (1): 1–56. doi:10.1002/jlac.18741710102.; Victor Meyer, J. Locher (1876). «Ueber die Pseudonitrole, die Isomeren der Nitrolsäuren». Justus Liebig’s Annalen der Chemie. 180 (1–2): 133–55. doi:10.1002/jlac.18761800113.; V. Meyer and Stüber (1872). «Vorläufige Mittheilung». Chemische Berichte. 5: 203–05. doi:10.1002/cber.18720050165.; Victor Meyer, O. Stüber (1872). «Ueber die Nitroverbindungen der Fettreihe». Chemische Berichte. 5: 399–406. doi:10.1002/cber.187200501121. S2CID 95188274.; Victor Meyer, A. Rilliet (1872). «Ueber die Nitroverbindungen der Fettreiche. Dritte Mittheilung». Chemische Berichte. 5 (2): 1029–34. doi:10.1002/cber.187200502133.; Victor Meyer, C. Chojnacki (1872). «Ueber die Nitroverbindungen der Fettreihe. Vierte Mittheilung». Chemische Berichte. 5 (2): 1034–38. doi:10.1002/cber.187200502134.
- ^ Robert B. Reynolds, Homer Adkins (1929). «The Relationship of the Constitution of Certain Alky Halides to the Formation of Nitroparaffins and Alkyl Nitrites». Journal of the American Chemical Society. 51 (1): 279–87. doi:10.1021/ja01376a037.
- ^ «IARC Monographs evaluate consumption of red meat and processed meat» (PDF). International Agency for Research on Cancer. 26 October 2015. Archived from the original (PDF) on 18 January 2021. Retrieved 14 February 2021.
Processed meat was classified as carcinogenic to humans (Group 1), based on sufficient evidence in humans that the consumption of processed meat causes colorectal cancer.
- ^ «List of classifications, Volumes 1–116 – IARC Monographs on the Evaluation of Carcinogenic Risks to Humans». International Agency for Research on Cancer (IARC) – World Health Organization (WHO). 2010. Archived from the original on 10 June 2017. Retrieved 25 September 2016.
- ^ VOLUME 94 – Ingested Nitrate and Nitrite, and Cyanobacterial Peptide Toxins – IARC Monographs on the Evaluation of Carcinogenic Risks to Humans. International Agency for Research on Cancer (IARC) – World Health Organization (WHO). 2010. ISBN 9789283212942. Retrieved 25 September 2016.
Bibliography[edit]
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- Coudray, Guillaume, Who poisoned your bacon. London: Icon Books, 2021. ISBN 9-781-78578612-9
External links[edit]
Wikimedia Commons has media related to Nitrites.
- Material Safety Data Sheet, sodium nitrite (archive)
- ATSDR – Case Studies in Environmental Medicine – Nitrate/Nitrite Toxicity (archive) – US Department of Health and Human Services (public domain)
- Article about Toxicity of Nitrite
Формула нитрита натрия
Определение и формула нитрита натрия
В сухом состоянии устойчив на воздухе, во влажном – окисляется кислородом воздуха. На свету частично разлагается и желтеет. Хорошо растворяется в воде (гидролизуется по аниону). Кристаллогидратов не образует. Окислитель и восстановитель в растворе.
Рис. 1. Нитрит натрия. Внешний вид.
Химическая формула нитрита натрия
Химическая формула нитрита натрия NaNO2. Она показывает, что в состав данной молекулы входят один атом натрия (Ar = 23 а.е.м.), один атом азота (Ar = 14 а.е.м.) и два атома кислорода (Ar = 16 а.е.м.). По химической формуле можно вычислить молекулярную массу нитрита натрия:
Mr(NaNO2) = Ar(Na) + Ar(N) + 2×Ar(O);
Mr(NaNO2) = 23 + 14 + 2×16 = 37 + 32 = 69
Графическая (структурная) формула нитрита натрия
Структурная (графическая) формула нитрита натрия является более наглядной. Она показывает то, как связаны атомы между собой внутри молекулы:
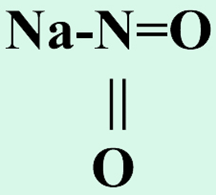
Ионная формула
Нитрит натрия является средней солью азотистой кислоты, которая способно диссоциировать на ионы в водном растворе согласно следующему уравнению:
NaNO2 ↔ Na+ + NO2—
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |
Нитрит ион это неорганическое соединение, состоящее из азота и кислорода. Химическая формула нитрит-иона NO2—.
В пищевой промышленности нитрит натрия обычно используется в качестве отвердителя. Нитрит или нитрат натрия отвечает за цвет и вкус приготовленного вяленого мяса.
В природе нитрит-анион является распространенным посредником в азотном цикле. Нитрит также относится к химическим молекулам, содержащим группу — ОNО, которые представляют собой сложные эфиры азотистой кислоты.
Что такое нитрит
Элементами, которые входят в формулу нитрита, являются азот и кислород. Для написания его формулы требуется четкое представление о валентностях как азота, так и кислорода.
Как известно, символом нитрита является NO2—. Нитрит-ион имеет симметричную структуру (симметрия C2v), с равной длиной связей N–O и углом связи примерно 115 градусов.
Он описывается как резонансный гибрид в теории валентных связей, с равным вкладом двух канонических форм, которые являются зеркальными отражениями друг друга.
В теории молекулярных орбиталей существует сигма-связь между каждым атомом кислорода и атомом азота, а также делокализованная связь, генерируемая из p-орбиталей на атомах азота и кислорода, которая перпендикулярна плоскости молекулы.
Отрицательный заряд иона равномерно распределяется между двумя атомами кислорода. Одинокая пара электронов переносится атомами азота и кислорода. Таким образом, нитрит-ион является основанием Льюиса.
Консервант нитрит натрия защищает ветчину, салями и другое обработанное и вяленое мясо от опасных микроорганизмов, а также придает им розовый оттенок.
Однако нитрит может повредить клетки и превратиться в канцерогенные химические вещества в организме человека в определенных ситуациях.
Свойства нитрита
- Кислотно-основные свойства нитрит-иона
Конъюгатным основанием слабокислой азотистой кислоты является нитрит:
HNO2 ⇌ H+ + NO2—; pKa ≈ 3.3 при 18 °C
- Азотистая кислота также чрезвычайно летуча, в основном существует в виде транс-плоской молекулы в газовой фазе. он нестабилен в растворе с точки зрения реакции диспропорционирования:
3HNO2 (aq) ⇌ H3O+ + NO3— + 2NO
При 0 °C эта реакция протекает вяло. Получение оксида азота (NO) в лаборатории включает добавление кислоты в раствор нитрита в присутствии восстановителя, такого как железо(II).
Окисление и восстановление
Атом азота в нитрите имеет формальную степень окисления +3. Это означает, что он может быть окислен до +4 и +5 уровней окисления или снижен до уровня окисления до 3. В таблице ниже приведены стандартные восстановительные потенциалы для процессов, непосредственно связанных с азотистой кислотой: рассмотрим следующий сценарий:
H2N2O2 + 2 H+ + 2 e— ⇌ N2 + 2 H2O; E0 = +2,65 В
Когда азот находится в состоянии окисления +5, реакции окисления обычно приводят к образованию нитрат-иона.
Для количественного анализа нитритов (титрованием) можно использовать, например, окисление перманганат-ионом:
5 NO2— + 2 MnO4— + 6 H+ → 5 NO3— + 2 Mn2+ + 3 H2O
Реакции восстановления с нитрит-ионом дают различные продукты, в зависимости от восстановителя и его интенсивности.
С диоксидом серы продуктами являются NO и N2O; с оловом(II) (Sn2+)продуктом является гипонитрозная кислота (H2N2O2); а с сероводородом продуктом является аммиак (NH3).
Результатом восстановления нитрита катионом гидразиния (N2H5+) является гидразойная кислота (HN3) (азид водорода или азоимид), нестабильное и взрывчатое соединение, который также может реагировать с нитритом следующим образом:
HNO2 + HN3 → N2O + N2 + H2O
Эта реакция уникальна тем, что включает молекулы азота в четырех различных состояниях окисления.
Часто задаваемые вопросы ответы о нитрите?
Какова формула нитрита? В чем его польза?
Формула нитрит-иона NO2—. Применение нитрита приведено ниже:
Он используется в качестве противоиона в различных реакциях.
Используется в качестве консерванта.
Он используется в качестве противоядия для лечения отравления цианидом.
Является ли химическая формула нитрит-иона и молекулярная формула нитрита одинаковыми?
Да, химическая и молекулярная формула нитрита одинакова. Нитрит может вредить клеткам и превращаться в канцерогенные химические вещества в организме человека при определенных условиях.
Нитрат и нитрит могут вступать в реакцию с аминами и амидами в организме с образованием N-нитрозосоединений (NOC), которые, как было показано, вызывают рак у животных и могут вызывать рак у людей при потреблении через питьевую воду и другие источники пищи.
Нитрит-ион — это ион, состоящий из одного атома азота и двух атомов кислорода. Азот в этом ионе имеет заряд +3, следовательно заряд всего иона -1. Частица одновалентна. Формула нитрит-иона NO2—. Анион имеет нелинейную конфигурацию. Соединения, содержащие эту частицу, называются нитритами, например нитрита натрия — NaNO2, нитрит серебра — AgNO2.
Физические и химические свойства
Нитриты щелочных, щелочноземельных металлов и аммония представляют собой бесцветные или слегка желтоватые кристаллические вещества. Нитриты калия, натрия, бария в воде хорошо растворяются, нитриты серебра, ртути, меди – плохо. С повышением температуры растворимость повышается. Практически все нитриты плохо растворяются в эфирах, спиртах и малополярных растворителях.
Таблица. Физические характеристики некоторых нитритов.
| Характеристика | Нитрит калия | Нитрит серебра | Нитрит кальция | Нитрит бария |
|
Тпл, °С |
440 |
120 (с разлож.) |
220 (с разлож.) |
277 |
|
∆H0обр, кДж/моль |
— 380,0 | — 40,0 | -766,0 | — 785,5 |
| S0298, Дж/(моль*К) | 117,2 | 128,0 | 175,0 | 183,0 |
| Раствор-ть в воде, г в 100 г |
306,7 (200С) |
0,41 (250С) |
84,5 (180С) |
67,5 (200С) |
Нитриты малоустойчивы к нагреванию: без разложения плавятся только нитриты щелочных металлов. В результате разложения выделяются газообразные продукты — O2 , NO, N2, NO2, и твердые вещества — оксид металла или сам металл. Например, разложение нитрита серебра(идет уже при 40 °С) сопровождается выделением элементного серебра и оксида азота (II):
2AgNO2 = AgNO3 + Ag + NO↑
Поскольку разложение идет с выделением большого количества газов, реакция может идти с взрывом, например, в случае нитрита аммония.
Окислительно-восстановительные свойства
Атом азота в нитрит-ионе имеет промежуточный заряд +3, вот почему для нитритов характерны как окислительные, так и восстановительные свойства. К примеру, нитриты будут обесцвечивать раствор калия перманганата в кислой среде, проявляя свойства окислителя:
5KNO2 + 2KMnO4 +3H2SO4 = 3H2O + 5KNO3 + 2MnSO4 + K2SO4
Свойства восстановителя нитрит-ионы проявляют, например, в реакции с крепким раствором пероксида водорода:
NO2— + H2O2 = NO3— + H2O
Восстановителем является нитрит при взаимодействии с броматом серебра (подкисленный раствор). Эта реакция используется в химическом анализе:
2NO2— + Ag+ + BrO2— = 2NO3— + AgBr↓
Еще одним примером восстановительных свойств является качественная реакция на нитрит-ион — взаимодействие бесцветных растворов [Fe(H2O)6]2+ с подкисленным раствором нитрита натрия с появлением бурого окрашивания.
Теоретические основы обнаружения NO2¯
Азотистая кислота при нагревании диспропорционирует с образованием оксида азота (II) и азотной кислоты:
HNO2 + 2HNO2 = NO3— + H2O + 2NO↑ + H+
Поэтому азотистую кислоту невозможно отделить от азотной кипячением. Как видно из уравнения, азотистая кислота, разлагаясь, частично превращается в азотную, что приведет к ошибкам в определении содержания нитратов.
Почти все нитриты растворяются в воде, наименее растворимым из этих соединений является нитрит серебра.
Нитрит-ион сам бесцветен, поэтому его выявляют реакциями образования других окрашенных соединений. Нитриты неокрашенных катионов также бесцветны.
Качественные реакции
Существует несколько качественных способов определения нитрит-ионов.
1. Реакция образования K3[Co(NO2)6].
В пробирку помещают 5 капель исследуемого раствора, содержащего нитрит, 3 капли раствора нитрата кобальта, 2 капли уксусной кислоты (разбавленной), 3 капли раствора хлорида калия. Образуется гексанитрокобальтат (III) K3[Co(NO2)6] — желтый кристаллический осадок. Нитрат-ион в исследуемом растворе не мешает обнаружению нитритов.
2. Реакция окисления иодидов.
Нитрит-ионы окисляют иодид-ионы в кислой среде.
2HNO2 + 2I— + 2H+ = 2NO↑ + I2↓ + 2H2O
В ходе реакции образуется элементарный иод, который легко обнаружить окрашиванием крахмала. Для этого реакцию можно проводить на фильтровальной бумаге, предварительно пропитанной крахмалом. Реакция очень чувствительна. Синий цвет появляется даже при наличии следов нитритов: открываемый минимум – 0,005 мкг.
Фильтровальную бумагу пропитывают крахмальным раствором, добавляют на нее 1 каплю 2н раствора уксусной кислоты, 1 каплю опытного раствора, 1 каплю 0,1н раствора иодида калия. При наличии нитрита появляется синее кольцо или пятно. Обнаружению мешают другие окислители, приводящие к образованию иода.
3. Реакция с перманганатом калия.
В пробирку помещают 3 капли раствора калия перманганата , 2 капли серной кислоты (разбавленной). Смесь нужно нагреть до 50-60 °С. Добавляют осторожно несколько капель нитрита натрия или калия. Раствор перманганата обесцвечивается. Другие восстановители, присутствующие в исследуемом растворе, способные окислить перманганат-ион, будут мешать выявлению NO2—.
4. Реакция с сульфатом железа (II).
Сульфат железа восстанавливает нитрит в нитрат в кислой среде (разбавленная серная кислота):
2KNO2 (тв.) + 2H2SO4 (разб.) + 2FeSO4 (тв.) = 2NO↑ + K2SO4 + Fe2(SO4)3 + 2H2O
Получившийся оксид азота (II) образует с избытком Fe2+ (не успевшими еще вступить в реакцию) комплексные ионы бурого цвета:
NO + Fe2+ = [FeNO]2+
NO + FeSO4 = [FeNO]SO4
Следует учесть, что с разбавленной серной кислотой реагируют нитриты, а с концентрированной будут реагировать нитраты. Поэтому для выявления нитрит-иона необходима именно разбавленная кислота.
5. Реакция с антипирином.
NO2— с антипирином в кислой среде дает раствор зеленого цвета.
6. Реакция с риванолом.
NO2— с риванолом, или этакридином (I) в кислой среде дает раствор красного цвета.
Количественное определение содержания нитритов в воде
По ГОСТу количественное содержание нитрит-ионов в воде определяют двумя фотометрическими методами: с использованием сульфаниловой кислоты и с использованием 4-аминобензолсульфонамида. Первый из них является арбитражным.
Из-за нестойкости нитритов их нужно определять сразу после взятия проб или же консервировать пробы добавлением на 1 л воды 1 мл серной кислоты (концентрированной) или 2-4 мл хлороформа; можно охладить пробу до 4 °С.
Мутную или цветную воду очищают гидроокисью алюминия, добавляя 2-3 мл суспензии на 250-300 мл воды. Смесь встряхивают, для анализа отбирают прозрачный слой после осветления.
Определение содержания нитритов с помощью сульфаниловой кислоты
Сущность метода: нитриты анализируемой пробы взаимодействуют с сульфаниловой кислотой, полученная соль реагирует 1-нафтиламином с выделением красно-фиолетового азокрасителя, его количество определяют фотометрически, затем проводят расчет концентрации нитритов в пробе воды. 1-нафтиламин и сульфаниловая кислота и входят в состав реактива Грисса.
Определение нитрит-ионов: методика
К 50 мл пробы воды приливают 2 мл раствора реактива Грисса в уксусной кислоте. Перемешивают и выдерживают 40 мин при обычной температуре или 10 мин при 50-60 °С на водяной бане. Затем замеряют оптическую плотность смеси. В роли холостой пробы применяют дистиллированную воду, которую готовят аналогично пробе анализируемой воды. Концентрацию нитритов рассчитывают по формуле:
X=K∙A∙50∙f / V,
где: K – коэффициент градуировочной характеристики,
A – установленное значение оптической плотности анализируемой пробы воды за вычетом установленного значения оптической плотности холостой пробы,
50 – объем мерной колбы,
f – коэффициент разбавления (если пробу не разбавляли, f=1),
V – объем аликвоты, взятой для анализа.
Нитриты в воде
Откуда нитрит-ионы в сточных водах? Нитриты в небольшом количестве всегда присутствуют в дождевой воде, поверхностных и подземных водах. Нитриты — промежуточная ступень в превращениях азотосодержащих веществ, осуществляемых бактериями. Эти ионы образуются при окислении катиона аммония до нитратов (в присутствии кислорода) и при противоположных реакциях – восстановления нитратов до аммиака или азота (при недостатке кислорода). Все эти реакции осуществляются бактериями, а источником азотосодержащих веществ является органика. Поэтому количественное содержание нитритов в воде – важный санитарный показатель. Превышение норм содержания нитритов говорит о фекальном загрязнении вод. Попадание стоков животноводческих ферм, заводов, промышленных предприятий, загрязнение водоемов водами с полей, где применялись азотные удобрения – основные причины высокого содержания нитритов в воде.
Получение
В промышленности нитрит натрия получают абсорбцией нитрозного газа (смесь NO и NO2) растворами NaOH или Na2CO3 с последующей кристаллизацией нитрита натрия:
NO + NO2 + 2NaOH (хол.)= 2NaNO2 + H2O
Реакция в присутствии кислорода идет с образованием нитрата натрия, поэтому необходимо обеспечить бескислородные условия.
Таким же методом в промышленности получают и нитрит калия. Кроме того, нитриты натрия и калия можно получить окислением свинца нитратом:
KNO3 (конц) + Pb (губка) + H2O = KNO2 + Pb(OH)2↓
KNO3 + Pb = KNO2 + PbO
Последняя реакция идет при температуре 350-400 °С.
Поиск химических веществ по названиям или формулам.
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Языки:
По умолчанию |
Все возможные |
Из списка
|
Применить к найденному
Нитрит
Брутто-формула:
NO2^-
CAS# 14797-65-0
Категории:
Анион
, Неорганическое вещество
PubChem CID: 946
| ChemSpider ID: 921
| CHEBI:16301
Названия
Русский:
- Нитрит [Wiki]
English:
- Nitrit
- Nitrite [Wiki]
- Nitrite Ion
- Nitrite anion
- Nitrite(1-)
- Nitrous acid, ion(1-)
- dioxidonitrate(1-)
- dioxonitrate(1-)
- dioxonitrate(III)
German:
- Nitrite [Wiki]
Español:
- Nitrito [Wiki]
French:
- Nitrite [Wiki]
Italiano:
- Nitrito [Wiki]
日本語:
- 亜硝酸塩 [Wiki]
中文:
- 亚硝酸盐 [Wiki]
Варианты формулы:
NO2^-
{R}O/N\O
{R}-O-N=O
O\N/O^-
Вещества, имеющие отношение…
Кислота:
Азотистая кислота
Соль:
Нитрит натрия; Нитрит калия; Нитрит аммония; Нитрит рубидия; Нитрит лития; Нитрит бария; Нитрит кальция; Нитрит стронция; нитрит цезия; Нитрит серебра(I); Нитрит никеля(II)
Химический состав
Реакции, в которых участвует Нитрит
-
H{R} <=> H^+ + {R}^-
, где R =
F Cl Br I NO3 NO2 -
N2O4 + 3H2SO4 -> NO^+ + 3HSO4^- + H3O^+ + NO2^-